Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.36 no.100 Medellín Jan./June 2014
ARTÍCULOS DE INVESTIGACIÓN
Efecto de borde sobre la población del cangrejo azul Cardisoma guanhumi (Decapoda: Gecarcinidae) en el manglar de la bahía El Uno, golfo de Urabá (Colombia): una aproximación a su captura artesanal
Edge effect on blue crab population Cardisoma guanhumi (Decapoda: Gecarcinidae) in the mangrove of El Uno Bay, Uraba Gulf (Colombia): an approximation to the folk catchery
Andrea Arroyave–Rincón1,3, Viviana Amortegui–Torres1,4, Juan F. Blanco–Libreros1,2,5, Alexander Taborda–Marín1,6
1 Grupo de Investigación Elice, Instituto de Biología, Universidad de Antioquia. Medellín (Antioquia), Colombia.
2 Docente, Instituto de Biología, Universidad de Antioquia. Medellín (Antioquia), Colombia.
Correos electrónicos: 3 andrea.arroyave@udea.edu.co; 4 viviana.amortegui@udea.edu.co; 5 blanco@exactas.udea.edu.co; 6 alextaborda@gmail.com.
Recibido: abril 2013; aceptado: enero 2014.
Resumen
Los impactos que tiene la eliminación de los manglares sobre las comunidades de macroinvertebrados bénticos son inciertos y poco estudiados en Colombia, particularmente en la región Caribe. Este trabajo estudió el efecto de la conversión del manglar a potrero sobre la población del cangrejo azul Cardisoma guanhumi (Decapoda: Gecarcinidae) en el manglar de la bahía El Uno, golfo de Urabá (Colombia). De marzo a abril de 2012, se llevó a cabo un muestreo diario de especímenes en tres coberturas de vegetación diferentes: en el interior del manglar, en el potrero y en el borde (borde antropogénico ocasionado por la deforestación del manglar). Se comparó la distribución, abundancia, peso y tamaño corporal de especímenes de C. guanhumi y la abundancia, diámetro y bioturbación de las madrigueras. Durante Semana Santa se realizaron visitas y entrevistas a los recolectores de cangrejo azul. Se encontró un número de individuos en el interior del manglar (140) mayor que en el potrero (105) y que en el borde (35), e igualmente fue superior el peso corporal y tamaño del cefalotórax en el manglar que en las otras coberturas, las cuales no presentaron diferencias significativas entre sí. En cuanto a las madrigueras no hubo diferencias en su número y sedimentos expulsados (bioturbación) en las distintas coberturas y tampoco hubo una correlación significativa entre el diámetro de la madriguera y la bioturbación. La presión antrópica sobre la población de cangrejos durante el muestreo fue alta, debido a la temporada de caza. En conclusión, se demostró que hay un efecto borde sobre la población de C. guanhumi inducido por la conversión del bosque de manglar a potrero.
Palabras clave: cangrejo terrestre, manglar, deforestación, efecto de borde antropogénico.
Abstract
The potential impacts of mangrove clearing on communities of benthic macroinvertebrates are uncertain and poorly studied in Colombia, particularly in the Caribbean region. This study investigated the effect of mangrove conversion to pasture on the population of blue crab Cardisoma guanhumi (Decapoda: Gecarcinidae) in the El Uno bay mangrove, Uraba Gulf (Colombia). From March to April 2012, we conducted daily sampling of specimens in three different vegetational covers: mangrove interior, pasture and mangrove–pasture edge (an anthropogenic edge produced by mangrove deforestation). We compared the distribution, abundance, weight and body size of C. guanhumi specimens, and the abundance, diameter, and bioturbation of their burrows. Visits and interviews with folk crab harvesters were conducted during Easter Week. We found a higher number of individuals in the mangrove interior (140), compared with the pasture (105) and the edge (35) sites, with individuals from the mangrove interior exhibiting greater weight and size than those in pasture and edge, with no differences documented between the latter two. We found no differences in the number of burrows or amount of removed sediment (bioturbation) among the different cover types, and there was no significant relationship between burrow diameter and bioturbation. We observed a high pressure on this crab population due to folk harvest during the sampling period. In conclusion, we demonstrated the occurrence of an edge effect on the C. guanhumi population promoted by mangrove conversion to pasture.
Key words: land crab, mangrove forest, deforestation, anthropogenic edge effect.
INTRODUCCIÓN
Los crustáceos decápodos son importantes miembros de las comunidades bénticas de los manglares tropicales y subtropicales (Arruda y Matthews 2007, Oliveira de Almeida et al. 2006). Sin embargo, en el Neotrópico son pocos los estudios sobre su distribución local, patrones de composición, riqueza y abundancia (Arruda et al. 2006), prestando aun menor atención a las especies asociadas a los manglares (Hogarth 2007, Lacerda et al. 1993, Lee 2008).
El cangrejo azul semi–terrestre Cardisoma guanhumi (Latreille, 1828; Decapoda: Gercarcinidae) es ecológicamente importante en los manglares debido a que promueve el flujo de materia orgánica entre el suelo y las redes tróficas, y airean el suelo por su actividad de excavación (Yaldwin y Wodzicki 1979). Los individuos de C. guanhumi habitan en las partes internas de los manglares y los humedales traseros, distribuyéndose desde el sur de la Florida (EE. UU. AA.), hasta Brasil, incluyendo las islas del Caribe y el Oeste de África (Gifford 1962, Govender et al. 2008). Los cangrejos de este género viven en madrigueras que excavan en el suelo lodoso de manglares y se extienden hasta dos metros de profundidad o hasta alcanzar el nivel freático, formando acumulaciones de sedimento relativamente altas en la entrada de las madrigueras que las protegen (Gifford 1962). Se alimentan principalmente de material vegetal y en algunos casos de pequeños macroinvertebrados como caracoles (Arroyave y Amortegui obs. pers.).
Las principales amenazas a las que se enfrenta el cangrejo azul en el Caribe y a nivel global, son en primer lugar, la pérdida de su hábitat natural y en segundo lugar, la captura artesanal indiscriminada (Govender et al. 2008, Rodríguez–Fourquet y Sabat 2009). El manglar está desapareciendo rápidamente a causa de la extensa deforestación, estimándose una tasa de pérdida anual entre el 1 y 2%, con una pérdida neta en el último cuarto de siglo entre 35–86% a nivel mundial (Gilman et al. 2008). Por otro lado, la captura indiscriminada se debe principalmente a que la carne es muy apetecida por los habitantes locales y es ofrecida como un aperitivo exótico para turistas (Govender et al. 2008, Rodríguez–Fourquet y Sabat 2009). Por ejemplo, en Puerto Rico, las poblaciones han tenido un dramático declive (aunque la especie no está en una lista de amenaza oficial), por la pesca artesanal y el cambio de uso de las tierras costeras que modifica la calidad del hábitat tanto en composición como en estructura vegetal (Rodríguez–Fourquet y Sabat 2009). En las islas de Trinidad y Tobago, la captura para consumo humano por medio de trampas ha sido tan eficiente que ha causado una disminución en tamaño, calidad de la carne y en número de individuos, en comparación con los capturados hace dos décadas (Maitland 2002). De igual forma en Brasil, aunque la especie no es considerada amenazada por extinción, se conoce que está disminuyendo rápidamente (Firmo et al. 2012).
Para Colombia, C. guanhumi se encuentra ampliamente distribuida en los departamentos del Caribe colombiano (CORPOURABA 2011). Aunque en el ''Libro rojo de los invertebrados marinos de Colombia'' la especie está registrada como vulnerable (VU) (Ardila et al. 2002), se ignora el estado actual de la población con respecto a los cambios que ha tenido en su ámbito geográfico, abundancia e historia de vida, a pesar de que se conocen las amenazas que afronta la especie. Uno de los estudios más recientes se llevó a cabo en el golfo de Urabá, en donde se indicó el tipo y estado del hábitat, así como su densidad poblacional y con base en ello, se propuso a la especie como amenazada para la zona, demostrando además su importancia socio–económica para las comunidades humanas, lo que ha promovido algunos programas de manejo y conservación (CORPOURABA 2011).
Las principales amenazas que la población de C. guanhumi afronta en el golfo de Urabá, al igual que en otras partes del mundo, es la formación de bordes antropogénicos debido a la pérdida de los manglares por la reclamación de tierras, por la expansión de las fronteras urbana, agrícola y ganadera, y la degradación ecosistémica por la tala selectiva para subsistencia y comercialización ilegal (Blanco 2009, Blanco et al. 2012, CORPOURABA 2003, García–Valencia 2007, Taborda 2008). Estos bordes antropogénicos, que son el efecto más significativo de la reclamación del manglar, generan reducciones significativas de las poblaciones de algunas especies bénticas desde el interior del manglar hacia los potreros (Amortegui et al. 2013, Blanco y Castaño 2012, Blanco et al. 2012). Por lo cual, se llevó a cabo un estudio para analizar el ''efecto borde'' de la deforestación del manglar de la bahía El Uno (golfo de Urabá) sobre la población del cangrejo azul C. guanhumi. Adicionalmente, debido a que el muestreo coincidió con la época de incremento de la recolecta artesanal, se realizaron registros cualitativos sobre dicha práctica.
MATERIALES Y MÉTODOS
Área de estudio. El golfo de Urabá ubicado en el extremo suroccidental del mar Caribe colombiano, presenta 4.900 ha de manglar (Blanco et al. 2012), siendo el ecosistema costero más representativo y abundante (Correa et al. 2010, García– Valencia 2007). Sobre su costa oriental, se encuentra el delta del río Turbo que forma una espiga dispuesta hacia el sur con el nombre de Punta Yarumal, que confina una laguna costera de 1,2 km2 con una profundidad promedio de 2,5 m denominada bahía El Uno (Taborda 2008) (figura 1). El manglar es un bosque mixto, con mayor presencia de Rhizophora mangle (Linneo, 1753) en el borde costero y con rodales de Avicennia germinans (Linneo, 1764) y Laguncularia racemosa (Gaertner, 1807) en la parte trasera (Amortegui et al. 2013, Blanco y Castaño 2012). Este ecosistema presenta una fuerte intervención antropogénica, que se ha caracterizado por la deforestación del bosque para fines ganaderos, agrícolas y para la entresaca de varas de mangle para construcción de viviendas, obtención de carbón y leña para usos domésticos, lo que ha provocado una disminución significativa de la extensión del manglar y una ganancia de área para potreros (Blanco y Castaño 2012, Ortiz y Blanco 2012, Taborda 2008). El presente estudio se realizó en una transición manglarpotrero ubicada en la costa norte de la bahía El Uno, la cual es una frontera agropecuaria que se ha expandido rápidamente durante los últimos 30 años (Taborda 2008).
Diseño del estudio del efecto de borde. El muestreo se realizó durante los meses de marzo y abril de 2012, época en que se observa la mayor actividad del cangrejo azul debido al inicio de su estación reproductiva y un auge en su cacería (CORPOURABA 2011). Para analizar las respuestas de C. guanhumi a la pérdida del manglar (deforestación), se realizó un muestreo en una transición manglar–potrero ubicada a lo largo de la costa norte de la bahía El Uno. El muestreo se llevó a cabo a lo largo de siete transectos (100 m) dispuestos de manera perpendicular a la línea de marea, se hizo un barrido atravesando cada transecto (25 m a cada lado) y abarcando tres coberturas vegetales: a) interior del manglar; b) borde [dominado por el helecho Acrostichum aureum (Linneo, 1753)]; y c) potrero (anteriormente manglar y deforestado durante un periodo no mayor a un año antes de la iniciación del estudio) (figura 1). En cada cobertura se contaron las madrigueras, se midió el diámetro de entrada y se pesó la cantidad de sedimento expulsado (bioturbación). Posteriormente, se procedió a capturar manualmente a los cangrejos azules, los cuales fueron sexados, pesados y se midió el largo y ancho del caparazón. Los cangrejos se marcaron con pintura de rápido secado para evitar que fueran medidos nuevamente y se liberaron.
Se emplearon varios métodos para la captura de los cangrejos, el más utilizado debido a su eficacia fue el tapado, que consistió en introducir en las madrigueras rollos de pasto que redujeran el paso de oxígeno, por lo que al cabo de tres horas aproximadamente, el cangrejo se encontraba más débil siendo más fácil su captura. Además, se emplearon trampas (caja de madera con cebo) ubicadas en la entrada de las madrigueras, que se cerraban al entrar el cangrejo. Este método no fue efectivo, capturándose pocos individuos. Por último, para obtener un registro mayor de la población y debido a que el muestreo coincidió con la temporada de caza del cangrejo, se aprovechó la destreza de los cazadores quienes emplean el método del braceado que consiste en abrir la madriguera con un palín e introducir el brazo hasta hallar el cangrejo y sacarlo.
Análisis estadísticos. La abundancia de individuos capturados en los tres tipos de cobertura (manglar, borde y potrero) se comparó utilizando una prueba de Chi–cuadrado (Zar 2010). Se realizó un análisis de varianza no balanceado de una vía (ANOVA; Zar 2010) para comparar el tamaño del caparazón y el peso corporal [transformados con logaritmo base 10 para obtener la distribución normal (Guisande et al. 2011)] de los individuos capturados en los tres tipos de cobertura, especificando los términos en un modelo lineal general (MLG; Guisande et al. 2011). Se calcularon modelos de regresiones lineales simples y múltiples para establecer la relación alométrica entre el peso corporal y el tamaño de los individuos y la influencia del tipo de cobertura sobre ella.
Por otro lado, para determinar si existían diferencias del peso corporal y del tamaño de caparazón entre machos y hembras, se realizó un MLG con dos factores, ubicación y sexo. Finalmente, se realizó un ANOVA para determinar si había diferencias en el número de madrigueras y su bioturbación de acuerdo al tipo de cobertura, se sometió a prueba si ambas variables estaban correlacionadas, mediante un análisis de regresión (Guisande et al. 2011).
Observaciones sobre la captura artesanal. Durante Semana Santa del año 2012, se realizaron recorridos desde el sitio de estudio hasta el barrio Punta Yarumal, se hicieron entrevistas no estructuradas a las personas que se observaron realizando búsquedas y caza del cangrejo azul. Se indagó sobre si los cangrejos se capturaban asiduamente o solo durante esa época, el tipo de método de captura, el género y edad del cazador, y se registró el número promedio de capturas para el barrio durante 3 días.
RESULTADOS
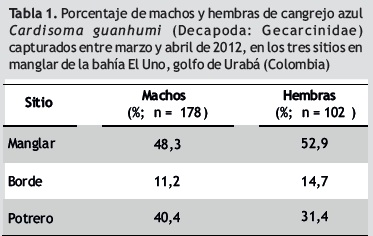
Efecto de borde. Se taparon en total 332 madrigueras de C. guanhumi, capturándose 238 especímenes por este método y 42 por los otros métodos mencionados, obteniéndose una eficiencia de captura con el método de tapado del 71,7%. Del total de especímenes capturados 140 (50%) correspondieron a individuos del manglar, 105 (37,5%) al potrero y 35 (12,5%) al borde (X2 = 61,25; p < 0,001) (tabla 1).
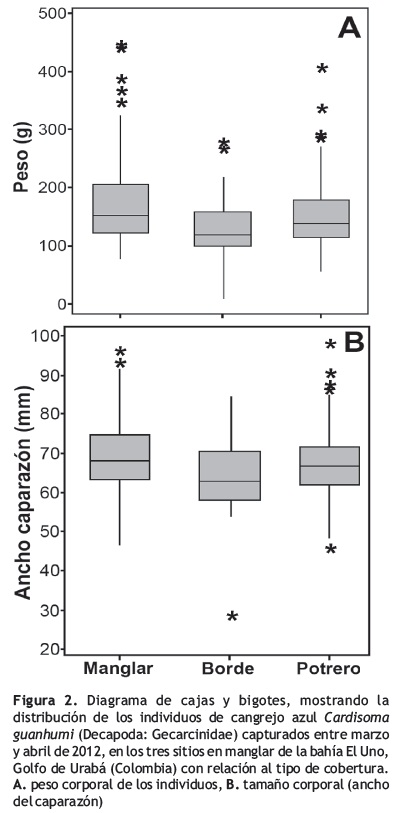
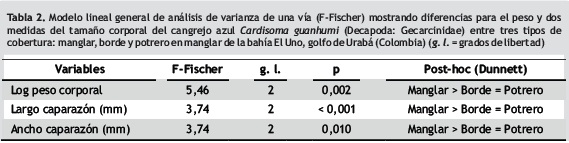
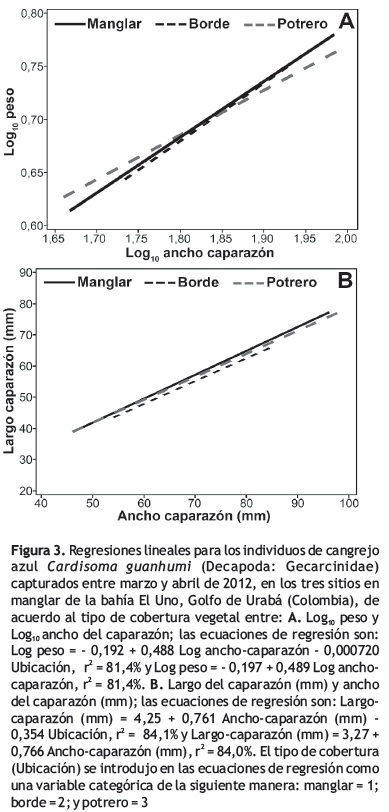
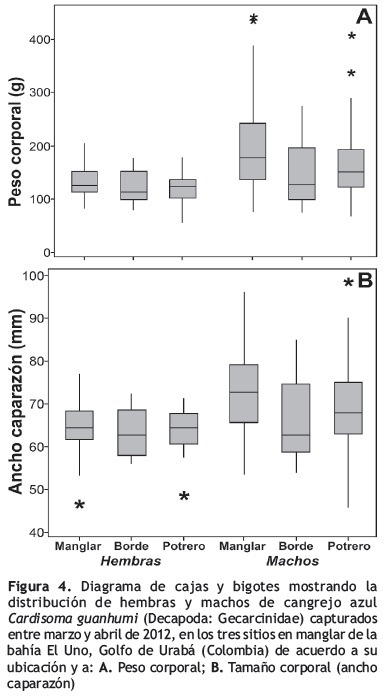
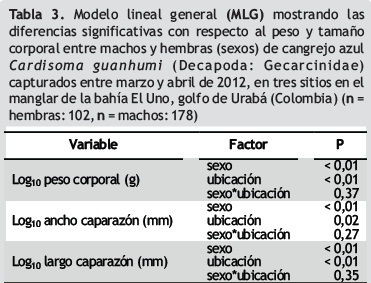
El peso corporal y el tamaño del caparazón de los individuos difirieron con relación al tipo de cobertura, siendo en ambos casos mayor en el manglar y menor en el borde y el potrero (figura 2; tabla 2). Con respecto a las relaciones alométricas entre el peso y ancho del caparazón y entre el largo y ancho, ambas fueron altamente significativas y positivas (regresión lineal simple: p < 0,01; figura 3), debido a que los individuos están aumentando más rápidamente su ancho de caparazón que su largo y su peso corporal. Sin embargo, estas relaciones no presentaron diferencias con el tipo de cobertura (p > 0,05).
Se encontraron diferencias significativas del tamaño del caparazón entre sexos (MLG, p < 0,001), siendo los machos más grandes y pesados (ámbito: 10–441 g; un individuo de 10 g fue el único juvenil capturado) en comparación con las hembras (ámbito: 57–205 g) (figura 4; tabla 3). Finalmente, la proporción de sexos fue 2:1, con un número mayor de machos capturados en los tres tipos de cobertura.
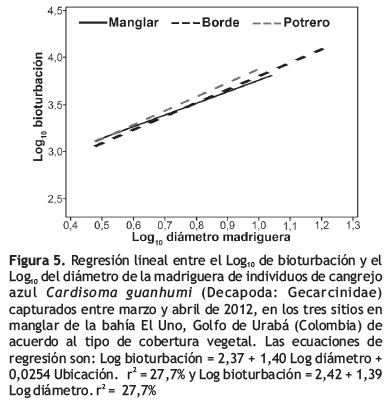
Al comparar el número de madrigueras (Log ) de acuerdo a su 10 ubicación (manglar–potrero) no se obtuvo diferencias significativas (ANOVA: p = 0,915). De igual manera, al comparar la cantidad de sedimento expulsado o bioturbación (Log10) por madriguera en relación al tipo de cobertura (manglar–borde–potrero), tampoco se encontraron diferencias (ANOVA: p = 0,955; ámbito: 0–18,9 kg). La relación diámetro de la madriguera con la bioturbación fue positiva pero no significativa estadísticamente (r2 = 27,7), y no dependió del tipo de cobertura (regresión lineal con predictor: ubicación p > 0,05) (figura 5), indicando que la cantidad de sedimento expulsado por madriguera no depende del diámetro de entrada de la misma, ni del tipo de cobertura.
Observación de la captura artesanal. Las capturas realizadas por los habitantes del barrio Punta Yarumal son llevadas a cabo principalmente con el método de braceado realizado por hombres adultos (padres de familia con sus hijos hombres) (figura 6 B2). Además, es común que niños y adolescentes (hombres) utilicen un ''chuzo'' o vara con punta metálica con la que atraviesan al cangrejo dentro de la adolescentes (hombres) utilicen un ''chuzo'' o vara con punta metálica con la que atraviesan al cangrejo dentro de la madriguera, provocándole la muerte (figura 6 B4). También llevan a cabo capturas manuales durante la marcha del cangrejo, ya que los individuos se vieron caminando o marchando en caminos y potreros, situación que fue aprovechada por los lugareños para capturarlos más fácilmente. Entre los días jueves y sábado Santo se registró para la comunidad de la bahía El Uno, una captura alrededor de 1.000 cangrejos por los integrantes de 20 familias, aproximadamente. Sin embargo, este valor es una subestimación de la producción debido a que no fue posible conocer la cantidad total de cazadores, ya que durante esa época se incrementó el número de personas que llegaron esporádicamente desde la cabecera municipal de Turbo en busca de una ganancia o ingreso ocasional (figura 6 B–C).
DISCUSIÓN
Efecto de borde. Este estudio demostró que la formación de bordes tiene un efecto negativo sobre la abundancia y condición fisiológica (peso y tamaño) de los individuos del cangrejo azul C. guanhumi. El manglar les facilita la formación de madrigueras (Pinder y Smits 1993), debido al sustrato pantanoso y a que los mangles proporcionan sombra, alimento, refugio ante depredadores y el hábitat necesario para sus actividades reproductivas (Gifford 1962, Rodriguez– Fourquet y Sabat 2009). Sin embargo, en el manglar de la bahía El Uno, la recurrente entresaca de mangles y la expansión de los potreros ha generado muchos bordes antropogénicos (figura 1 A–B). Se evidenció que la abundancia de la población, el peso y tamaño de los individuos de C. guanhumi disminuyó desde el manglar hacia el borde y hacia el potrero. Esto puede ser explicado porque al ser reemplazada la cobertura vegetal natural por pastizales para el ganado se produce una disminución de las fuentes de alimento, ya que los individuos se alimentan principalmente de hojas de R. mangle y L. racemosa (Herreid y Gifford 1963). De igual forma se produce un aumento de la compactación del suelo, una acumulación de sedimentos provenientes del río Turbo, una pérdida de la conectividad hidrológica con el mar (e. g., reducción de la entrada de la marea por la construcción de canales y diques para desecación del terreno), y una pérdida de microhábitats (informado por Amortegui et al. 2013, Blanco y Castaño 2012).
Sin embargo, el número de cangrejos capturados en el potrero (105), sugiere que mientras las áreas alteradas proporcionen un sustrato estable para formar sus madrigueras, una conectividad con aguas subterráneas del nivel freático y temperaturas bajas del suelo (las cuales podrían ser proporcionadas por los pastizales altos), los cangrejos pueden sobrevivir al disturbio, tal y como lo demuestran otros estudios en el Trópico (Govender et al. 2008, Rodriguez–Fourquet y Sabat 2009). Se debe tener en cuenta que en la bahía El Uno, los bordes manglar–potrero se encuentran a unos cientos de metros del mar y han sido abiertos durante un término de unos pocos años (situación que aun continua), pero tierra adentro los potreros se establecieron sobre manglares talados desde hace más tiempo (< 10 años). Por ello, las madrigueras de C. guanhumi se presentaron en menor densidad hasta ser inexistentes en el interior del potrero (aproximadamente después de los 30 m), lo cual significa que la conversión de manglar a potreros establecidos no es inocua.
Por otra parte, la menor abundancia de C. guanhumi observada en el borde manglar–potrero podría ser producto de la heterogeneidad del hábitat inducida por la deforestación y por la colonización del helecho de manglar A. aureum. Este helecho tiene una amplia escala de tolerancia a la sal y a la exposición solar encontrándose expuesto totalmente a la radiación en manglares perturbados (Medina et al. 1990) incluso, pueden suprimir la regeneración de árboles de mangle (Tomlinson 1986) (figura 1C), lo cual limita la presencia de las madrigueras. Sin embargo, la sombra que suministra el helecho y el incremento de la altura del sustrato justo debajo del helecho, parece facilitar la excavación de madrigueras, ya que se observaron conjuntos de madrigueras (hasta 7) (figura 6 A4). Por lo tanto, otra manifestación del efecto borde puede ser el incremento del coeficiente de variación de la densidad, como producto de la agregación de las madrigueras.
La diferencia en el peso y tamaño de los individuos capturados en el potrero y en el manglar, puede deberse a la cantidad y calidad de alimento disponible. Los cangrejos C. guanhumi son principalmente herbívoros, se alimentan de hojas tiernas, frutos y flores de los mangles, pero en algunas ocasiones se alimentan de pequeños invertebrados como escarabajos, otros insectos (Gifford 1962) y caracoles (Arroyave y Amortegui obs. pers.). De hecho, en las entradas de las madrigueras ubicadas en el manglar se observó la presencia de conchas vacías del caracol Neritina virginea (Linneo, 1758), el cual es abundante en el lugar, con marcas características de la depredación producida por los cangrejos (figura 6 A1). Estudios anteriores han demostrado que la densidad de N. virginea disminuye en los bordes y potreros (Amortegui et al. 2013, Blanco y Castaño 2012). Por lo cual se sugiere estudiar más a fondo la dieta del cangrejo azul, su condición fisiológica y la interacción depredador–presa en los bordes y potreros en comparación al manglar.
Fue notable observar que el peso y tamaño promedio fueron menores en los bordes del manglar, como producto de una desviación estándar menor y un número reducido de individuos grandes (ancho de caparazón > 70 mm) y pequeños (< 60 mm). Esto podría ser producto del incremento de la densidad de raíces superficiales por la colonización del helecho del manglar y la provisión de un hábitat de tamaño específico debajo de las plantas. Por otra parte, la presencia de individuos pequeños y grandes en los potreros sugiere la plasticidad de la especie y la resiliencia poblacional a tales alteraciones en el hábitat (Rodriguez–Fourquet y Sabat 2009). Aunque el potrero ofrece un hábitat visiblemente diferente, el amplio ámbito de tamaños de los individuos de C. guanhumi, sugiere que ellos encuentran menos obstáculos para la excavación de las madrigueras. Kristensen (2008) mencionó que hay una asociación entre los cangrejos jóvenes y las madrigueras de los adultos, ya que estos modifican el entorno construyendo las madrigueras, abriendo nuevos nichos para otros más jóvenes, con condiciones ambientales estables y alimento permanente, situación que podría estar ocurriendo en el manglar y en el potrero de la bahía El Uno. Es necesario realizar experimentos futuros sobre el papel interactivo de la compactación del sustrato, la densidad de raíces de los helechos, la temperatura y la oferta de hojarasca de manglar y caracoles, sobre la abundancia y condición fisiológica de C. guanhumi.
Análisis demográfico. La distribución de frecuencias de tallas sugiere que la población posiblemente tiene limitaciones de reclutamiento presentando una desviación hacia la derecha, esto es, hacia los adultos. Según Leite (2005), un individuo se considera adulto cuando el ancho del caparazón es igual o mayor a 58,5 mm. Durante el estudio se capturaron 280 individuos, de los cuales 88% (89 hembras y 159 machos) tuvieron un ancho de caparazón por encima de esta medida, sugiriendo que eran adultos, y 12% (13 hembras y 20 machos), posiblemente eran jóvenes. Para facilitar el reconocimiento de su estado de desarrollo, Herreid (1967) señaló los diferentes patrones de coloración que presenta C. guanhumi a lo largo de su vida. Cuando los cangrejos se encuentran en su etapa joven, son de color café, morado o anaranjado, en su etapa adulta suelen ser azul o azul–grisáceo, las hembras adultas en época reproductiva son de color amarillo–blanco (Gifford 1962, Hernández 2013, Leite 2005). Estas diferencias en el tamaño y coloración del caparazón, pueden reflejar el estado de desarrollo de los individuos, indicando que la población de la bahía El Uno es predominantemente adulta, presentándose variaciones en estos parámetros entre machos y hembras (figura 6D).
Se observó que la mayoría de individuos capturados de coloración morado–anaranjado fueron hembras, mientras que la mayoría de los machos fueron de color azul. Sin embargo, se capturaron dos hembras ovadas, siendo una de ellas de color morado–anaranjado con una talla de 50 mm de largo y 59 mm de ancho de caparazón, lo que puede indicar que las variaciones en color pueden no siempre ir ligadas a las del tamaño corporal, por lo cual, para determinar el grado de madurez de los individuos, es necesario, para estudios posteriores, tener en cuenta tanto el tamaño como el patrón de coloración. Es importante mencionar que encontrar pocos cangrejos inmaduros, puede ser evidencia de un declive en la densidad poblacional a través de los años, tal y como lo mencionaron Hartnoll et al. (2009) para el cangrejo terrestre Johngarthia lagostoma (Milne Edwarda, 1837). Esta escasez de jóvenes, además puede deberse a una deficiencia en el muestreo o que posiblemente sean escasos en el ecosistema, revelando problemas con el reclutamiento de la especie (figura 6D). Por lo anterior, se sugiere realizar muestreos durante todo un año para poder confirmar que la limitación del reclutamiento sea una condición permanente y no un patrón estacional.
Proporción de sexos y dimorfismo sexual. Obtener una proporción de sexos desviada de la proporción 1:1 hacia los machos puede deberse principalmente a rasgos biológicos tales como crecimiento diferencial y mortalidad, diferencias en las tallas máximas y posiblemente longevidad (Diele et al. 2005). Como se observó, los machos alcanzan mayores tallas y pesos que las hembras en la bahía El Uno y es posible que tengan una mayor esperanza de vida, lo cual estaría en concordancia con Wenner (1972), quien estableció que en crustáceos marinos maduros una desviación de la proporción esperada 1:1 parece ser más la regla que la excepción. Por lo tanto, hay que analizar la proporción de sexos como una función del tamaño corporal, así que es probable que la población estudiada presente un tipo de dimorfismo entre sexos (no necesariamente seleccionado sexualmente) muy cercanamente asociado al tamaño corporal de los individuos, donde los machos crecen más rápido que las hembras, debido a que estas con su crecimiento lento invierten mayor energía en reproducción.
Papel ecosistémico. Otro aspecto relevante de esta especie es el papel que cumplen en el manglar como ingenieros ecosistémicos, debido principalmente a su actividad excavadora (Hernández 2013). Al remover el sedimento, incrementan el contenido de humedad, materia orgánica y penetrabilidad del suelo, teniendo un efecto en la comunidad bentónica del ecosistema tal y como lo indica Botto (2001) para el cangrejo terrestre Chasmagnatus granulate (Dana, 1851). En este estudio, la distribución de las madrigueras y la cantidad de sedimento removido, fue similar a ambos lados del borde. Sin embargo, de acuerdo a la ubicación, los efectos sobre el sustrato pueden ser diferentes debido a las acciones antrópicas como la tala del bosque, que modifica la dinámica del agua, de los nutrientes y de la materia orgánica (Carol et al. 2011), alterando la compactación y la humedad del suelo, generando suelos más duros, más secos y de mayor altura por la acumulación de sedimentos en el potrero. Estos cambios posiblemente provocan que los cangrejos del potrero tengan que excavar más profundo para alcanzar el nivel freático requerido (Herreid y Gifford 1963), generando mayor remoción de sedimento y similar a la cantidad removida por los cangrejos del manglar quienes son más numerosos y donde los suelos son más blandos y húmedos (figura 6A).
Captura artesanal. Históricamente el cangrejo azul ha sido utilizado por la comunidad del municipio de Turbo como fuente de alimento, especialmente durante la Semana Santa que coincide con la actividad reproductiva del cangrejo (CORPOURABA 2011). Durante este periodo, los individuos adultos salen de sus madrigueras a ''marchar'' situación que es aprovechada por los lugareños para capturarlos, lo que aparentemente, ha diezmado la población disminuyendo la cantidad de individuos ''marchantes'' en cada temporada, tal y como lo mencionan los pobladores, quienes comparan la cantidad de cangrejos de hace dos o tres décadas con la actual: ''ellos (los cangrejos) se nos metían a las ollas, no había que salir a buscarlos... ahora es de buenas si se consiguen con buena carne... por eso hay que coger más''. Esto sugiere un declive de la población, poniendo en grave riesgo la existencia de la especie en la región.
Este escenario, también ha sido documentado en otros estudios en diferentes países del Caribe (Govender et al. 2008) y con otras especies de cangrejos de manglar (Diele et al. 2005, Dumas et al. 2012), mostrando que los individuos más grandes son los más apetecidos, por lo que es probable, que al ser intensiva su captura se afecten todas las clases de tamaño desde los adultos hasta los jóvenes, generando conflictos con los pescadores por su sobreexplotación (Dumas et al. 2012).
Al igual que en Turbo con el cangrejo azul, en Nueva Caledonia tampoco existe la veda de las capturas del cangrejo Scylla serrata (Portunidae; Forskal, 1775) durante la época reproductiva, y se comercializan individuos por debajo de la talla permitida y el número de capturas por persona excede lo legalmente establecido. Sin embargo, estas acciones se ven disminuidas por el sistema de tenencia de la tierra que evita que la mayoría de los recolectores puedan entrar libremente a las zonas de captura (Dumas et al. 2012). Caso contrario ocurre en el estuario Caeté (Brasil) donde los individuos de Ucides cordatus (Ocypodidae; Linneo, 1763) habitan un manglar prácticamente intacto, los cangrejos capturados están por encima del tamaño mínimo legal y hay una selectividad de los recolectores por los machos porque temen que al capturar hembras la población se extinga, por lo cual, no hay evidencia de sobreexplotación, a pesar de que esta actividad se lleva a cabo hace más de 30 años (Diele et al. 2005).
CONCLUSIONES
Debido a lo expuesto anteriormente, se concluye que la deforestación del manglar está afectando negativamente a las poblaciones de C. guanhumi mediante el efecto de borde, lo cual podría estar facilitando indirectamente la captura de individuos con fines de subsistencia o de comercialización. Se hace necesario tomar medidas urgentes para frenar tanto la deforestación del manglar que destruye el hábitat del cangrejo, y de otras especies, así como la captura directa de individuos. Con el fin de conservar la especie, se sugiere implementar: a) campañas y programas de educación ambiental para sensibilizar a los habitantes de zonas urbanas y rurales, y de diferentes edades; b) un plan de seguimiento permanente de C. guanhumi; c) establecer zonas y periodos de vedas de su captura; y d) establecer tallas mínimas de captura, prohibición de caza sobre las hembras ovadas y selección de sexos.
AGRADECIMIENTOS
Se agradece a toda la comunidad del Barrio El Uno, especialmente a don José y sus hijos por su apoyo durante el trabajo de campo. El Banco Santander financió la investigación a través del Premio en Ciencia e Innovación 2011. Esta investigación fue realizada con el apoyo de la Corporación para el Desarrollo Sostenible de Urabá (CORPOURABA), pero los resultados y discusiones mostrados no corresponden a una postura institucional. Publicación ELICE N.° 13. Se agradecen las evaluaciones anónimas.
REFERENCIAS
Amortegui V, Taborda A, Blanco JF. 2013. Edge effect on a Neritina virginea (Neritimorpha, Neritinidae) population in a black mangrove stand (Magnoliopsida, Avicenniaceae: Avicennia germinans) in the southern Caribbean. Pan American Journal of Aquatic Science (PANAMJAS), 8 (2): 68–78. [ Links ]
Ardila N, Navas GR, Reyes J, editores. 2002. Libro rojo de los invertebrados marinos de Colombia. INVEMAR. La serie Libros rojos de especies amenazadas de Colombia. Bogotá (Colombia): Ministerio de Medio Ambiente. p. 177. [ Links ]
Arruda L, Braga C, Ximenes G, Matthews–Cascon H. 2006. Spatial distribution of fiddler crabs (genus Uca) in a tropical mangrove of northeast Brazil. Scientia Marina, 70 (4): 759–766. [ Links ]
Arruda L, Matthews–Cascon H. 2007. Population and reproductive biology of the fiddler crab Uca thayeri Rathbun, 1900 (Crustacea: Ocypodidae) in a tropical mangrove from Northeast Brazil. Acta Oecologica, 31: 251–258. [ Links ]
Blanco JF. 2009. Banana crop expansion and increased river–borne sediment exports to the Gulf of Urabá, Caribbean coast of Colombia. Ambio, 38 (3): 181–183. [ Links ]
Blanco JF, Castaño MC. 2012. Efecto de la conversión del manglar a potrero sobre la densidad y tallas de dos gasterópodos en el delta del río Turbo (golfo de Urabá, Caribe colombiano). Revista de Biología Tropical, 60 (4): 1707–1719. [ Links ]
Blanco JF, Estrada EA, Ortiz LF, Urrego LE. 2012. Ecosystem–wide impacts of deforestation in mangroves: The Urabá Gulf (Colombian Caribbean) case study. International Scholarly Research Network [Internet], 2012 (2012): 1–14. Fecha de acceso: 20 de septiembre de 2013. Disponible en: http://dx.doi.org/10.5402/2012/958709. [ Links ]
Botto F. 2001. Efectos directos e indirectos de la bioturbación producida por el cangrejo cavador Chasmagnatus granulate en ambientes estuariales. [Tesis de doctorado]. [Mar del Plata (Argentina)]: Facultad de Ciencias Exactas y Naturales, Departamento de Biología, Universidad Nacional de Mar del Plata. p. 115. [ Links ]
Carol ES, Kruse EE, Pousa JL. 2011. Influence of the geologic and geomorphologic characteristics and of crab burrows on the interrelation between surface water and groundwater in an estuarine coastal wetland. Journal of Hydrology, 403 (3–4): 234–241. [ Links ]
Corporación para el desarrollo sostenible del Urabá –CORPOURABA–. 2003. Caracterización y zonificación de los manglares del golfo de Urabá. Departamento de Antioquia. Convenio 201671. Apartadó (Colombia): CORPOURABA. [ Links ]
Corporación para el desarrollo sostenible del Urabá –CORPOURABA–. 2011, Caracterización y zonificación de las poblaciones de Cardisoma guanhumi, en la línea costera del municipio de Turbo e identificación de los pobladores que utilizan el recurso y los lugares de mayor extracción. Informe final. Apartadó (Colombia): CORPOURABA. [ Links ]
Correa ID, Prussman J, Garrido AE. 2010. Geomorfología del contorno litoral Urabá–Darién, Departamento de Antioquia y Chocó, Caribe colombiano. Medellín (Colombia): Gobernación de Antioquia, Universidad de Antioquia, Universidad Nacional Sede Medellín, Universidad EAFIT. Proyecto Expedición Estuarina, golfo de Urabá, fase 1. Informe final. [ Links ]
Diele K, Koch V, Saint–Paul U. 2005. Population structure, catch composition and CPUE of the artisanally harvested mangrove crab Ucides cordatus (Ocypodidae) in the Caeté estuary, North Brazil: Indications for overfishing? Aquatic Living Resources. 18: 169–178. [ Links ]
Dumas P, Léopold M, Frotté L, Peignon C. 2012. Mud crab ecology encourages site–specific approaches to fishery management. Journal of Sea Research 67: 1–9. [ Links ]
Firmo AMS, Tognenlla MMP, Silva SR, Barboza RRD, Alves RRN. 2012. Capture and commercialization of blue land crabs (''guaiamum'') Cardisoma guanhumi (Lattreille, 1825) along the coast of Bahia State, Brazil: an ethnoecological approach. Journal of Ethnobiology and Ethnomedicine [Internet]. 8: 12. Fecha de acceso: 14 de agosto de 2013. Disponible en: http://www.ethnobiomed.com/content/8/1/12. [ Links ]
García–Valencia C, editor. 2007. Atlas del golfo de Urabá: una mirada al Caribe de Antioquia y Chocó. Santa Marta (Colombia): Instituto de Investigaciones Marinas y Costeras –INVEMAR– y de Antioquia. Serie de Publicaciones Especiales de Invemar N.° 12. p. 180. [ Links ]
Gifford CA. 1962. Some observations on the general biology of the land crab, Cardisoma guanhumi (Latreille), in South Florida. Biological Bulletin, 123 (1): 207–223. [ Links ]
Gilman EL, Ellison J, Duke NC, Field C. 2008. Threats to mangroves from climate change and adaptation options: A review. Aquatic Botany, 89: 237–250. [ Links ]
Govender Y, Sabat AM, Cuevas E. 2008. Effects of land–use/land–cover changes on land crab, Cardisoma guanhumi, abundance in Puerto Rico. Journal of Tropical Ecology, 24: 417–423. [ Links ]
Guisande C, Vaamonde A, Barreiro, editores. 2011. Tratamiento de datos con R, Statistica y SPSS. Madrid (España): Ediciones Díaz de Santos. p. 978. [ Links ]
Hartnoll RG, Broderick AC, Godley BJ, Saunders KE. 2009. Population structure of the land crab Johngarthia lagostoma on Ascension Island. Journal of Crustacean Biology, 29 (1): 57–61. [ Links ]
Hernández A. 2013. Aspectos biológicos y poblacionales de Cardisoma guanhumi (Latreille, 1825), en la Laguna de Tampamachoco y Majahual en Tuxpan, Veracruz. [Tesis de maestría]. [Veracruz (México)]: Facultad de Ciencias Biológicas y Agropecuarias, Universidad Veracruzana. p. 87. [ Links ]
Herreid II CF. 1967. Skeletal measurements and growth of the land crab, Cardisoma guanhumi Latreille. Crustaceana, 13 (1): 39–44. [ Links ]
Herreid F, Gifford A. 1963. The burrow habitat of the land crab, Cardisoma guanhumi (Latreille). Ecology, 44 (4): 773–775. [ Links ]
Hogarth PJ, editor. 2007. The biology of mangroves and seagrasses. 2nd ed. New York (U. S. A.): Oxford University Press Inc. p. 272. [ Links ]
Kristensen E. 2008. Mangrove crabs as ecosystem engineers; with emphasis on sediment processes. Journal of Sea Research, 59: 30–43. [ Links ]
Lacerda LD, Polania J, Vannucci M, Echevarria J, Sarabia J, Bodero A, Álvarez–León R, D'Croz L, Mainardi V, Padrón CM, Llorente S, Menéndez L, Bacon, PR, Conde JE, Alarcón C, Kjerfve B. 1993. Conservación y aprovechamiento sostenible de bosques de manglar en las regiones de América Latina y África. ISME International Society for Mangrove Ecosystems. Proyecto ITTO/ ISME PD114/90 (F). Informe Final, volumen 2, p. 256. [ Links ]
Lee SY. 2008. Mangrove macrobenthos: Assemblages, services, and linkages. Journal of Sea Research, 59: 16–29. [ Links ]
Leite LMAB. 2005. Estudo etnocarcinológico do Cardisoma guanhumi Latreille, 1825 (Crustácea, Brachyura, Gecarcinidae) no estuário do rio Gioana, Pernambuco, Brasil [Tesis de doctorado]. [Paraíba (Brasil)]: Programa de Pós–Graduação em Ciências Biológicas (Zoologia), Departamento de Sistemática e Ecologia. Universidade Federal da Paraíba. p. 120. [ Links ]
Maitland DP. 2002. Convergent design of Caribbean and Philippine Bamboo land–crab. Journal of Crustacean Biology, 22 (2): 497–501. [ Links ]
Medina E, Cuevas E, Popp M, Lugo A. 1990. Soil salinity, sun exposure, and growth of Acrostichum aureum, the mangrove fern. Botanical Gazette, 151 (1): 41–49. [ Links ]
Oliveira de Almeida A, Alves Coelho P, Almeida dos Santos J, Ribeiro Ferraz N. 2006. Crustáceos decápodos estuarinos de Ilhéus, Bahia, Brasil. Biota Neotropica, 6 (2): 1–24. [ Links ] Fecha de acceso: 20 de junio de 2012. Disponible en: http://www.biotaneotropica.org.br/v6n2/pt/abstract?inventory+bn03406022006.
Ortiz LF, Blanco JF. 2012. Distribución de los gasterópodos del manglar Neritina virginea (Neritidae) y Littoraria angulifera (Littorinidae) en la Ecorregión Darién, Caribe colombiano. Revista de Biología Tropical, 60 (1): 219–232. [ Links ]
Pinder AW, Smits AW. 1993. The burrow microhabitat of the land crab Cardisoma guanhumi: respiratory/ionic conditions and physiological responses of crabs to Hypercapnia. Physiological Zoology, 66 (2): 216– 236. [ Links ]
Rodriguez–Fourquet C, Sabat AM. 2009. Effect of harvesting, vegetation structure and composition on the abundance and demography of the land crab Cardisoma guanhumi in Puerto Rico. Wetlands Ecology and Management, 17: 627–640. [ Links ]
Taborda A. 2008. Cambios de la cobertura del suelo en la cuenca baja del rio Turbo entre 1960 y 2007, departamento de Antioquia, golfo de Urabá, Caribe colombiano. Apartadó (Colombia): CORPOURABA. Informe Técnico. p. 64. [ Links ]
Tomlinson PB. 1986. The botany of mangroves. Cambridge (U. S. A.): Cambridge University Press. p. 413. [ Links ]
Wenner AM. 1972. Sex ratio as a function of size in marine Crustacea. American Naturalist, 106: 321–350. [ Links ]
Yaldwyn JC, Wodzicki K. 1979. Systematic and ecology of the land crabs (Decapoda: Coenobitidae, Grapsidae and Gecarcinidae) of the Tokelau Islands, Central Pacific. Washington (U. S. A.) Atoll Research Bulletin, 235: 1–53. [ Links ]
Zar JH. 2010. Biostatistical analysis. 5th edition. New Jersey (U. S. A.): Pearson Prentice Hall. p. 944. [ Links ]