Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.36 no.101 Medellín July/Dec. 2014
ARTÍCULOS DE INVESTIGACIÓN
Parámetros de crecimiento individual de Petrolisthes caribensis (Werding, 1983) y Petrolisthes galathinus (Bosc, 1902) (Decapoda: Porcellanidae) en el golfo de Morrosquillo, Caribe colombiano
Individual growth parameters of Petrolisthes caribensis (Werding, 1983) and Petrolisthes galathinus (Bosc, 1802) (Decapoda: Porcellanidae) at the gulf of Morrosquillo, Colombian Caribbean
Paula A. Quiceno-Cuartas1, Jaime Palacio-Baena2, Jorge L. Escobar-Cardona3, Bernd Werding4
1 Instituto de Biología, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia. autor para correspondencia: paula.quiceno@udea.edu.co
2 Grupo de Investigación en Gestión y Modelación Ambiental (GAIA), Facultad de Ingeniería, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia. japalaciob@gmail.com
3 Grupo de Investigación en Ictiología (GIUA), Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia. jorgeluisesc@gmail.com
4 Tierökologie und Spezielle Zoologie, Justus Liebig Universität- Giessen- Alemania. Bernd.Werding@allzool.bio.uni-giessen.de.
Recibido: junio 2013; aceptado: marzo 2013.
Resumen
Para determinar si existen variaciones en los parámetros de crecimiento entre dos especies con relaciones ecológicas y filogenéticas, se utilizó la herramienta ELEFAN I. Con base en un muestreo de 11 meses, se estimó la longitud asintótica (L∞) y la constante de crecimiento (K) a partir de las distribuciones de tallas de dos especies de crustáceos, Petrolisthes galathinus y P. caribensis. Los muestreos fueron realizados en recolectores artificiales ubicados en un espolón litoral de roca en la punta norte del golfo de Morrosquillo, San Onofre (Sucre), Colombia. Los resultados indicaron que los valores de K en los tres morfotipos de P. galathinus variaron entre 2,2 y 2,9, y L∞ fluctuó entre 10,6 y 12,15 mm. En P. caribensis (Azul), K osciló entre 2,4 y 2,7, y L∞ entre 11,8 y 12,2 mm. El coeficiente de crecimiento de von Bertalanffy y las tallas máximas en todas las hembras de los morfotipos de las dos especies, fueron menores que en los machos, lo que podría estar relacionado con la defensa territorial en machos, y en el caso de las hembras, con la inversión de energía en reproducción. El coeficiente de variación del índice phi prima (Ø') entre especies y sexos fue menor al 4%, lo cual indica que no hay diferencias entre los parámetros de crecimiento entre especies, debido probablemente a una restricción filogenética. En general, la fase bentónica del ciclo de vida de las dos especies de porcelánidos, desde la categoría de megalopa hasta adulto, se extendió entre 39 y 45 días.
Palabras claves: coeficiente de variación, golfo de Morrosuqillo, parámetros de crecimiento, Petrolisthes caribensis, Petrolisthes galathinus.
Abstract
To determine if there was variation in growth parameters between two ecologically and phylogenetically related species, the ELEFAN I application was used (FISAT II FAO-ICLARM). Based on an eleven months of sampling, the asymptotic length (L ∞) and growth constant (K) were estimated from size distributions of two species of crustaceans, Petrolisthes caribensis and Petrolisthes galathinus. The samples were obtained with artificial collectors located on a rocky shore zone in the northern portion fo the Gulf of Morrosquillo, San Onofre (Sucre), Colombia. The results showed that the K value of the three morphotypes of P. galathinus ranged from 2.2 to 2.9, and the L∞ ranged from 10.6 to 12.15 mm. In P. caribensis (Blue), K ranged from 2.4 to 2.7, and the L∞ from 11.8 to 12.2 mm. The von Bertalanffy growth coefficient and the maximum sizes of all females of the morphotypes of the two species were lower than in males, which could be related to territorial defense in males and to reproductive energy investment in the case of females. The coefficient of variation of the phi prime index (Ø') among species and sexes was less than 4%, which indicates that were are no differences between growth parameters within species, probably due to a phylogenetic restriction. In general, the benthic phase of the life cycle of these two species of porcellanids, from megalope stage to adult, lasted from between 39 and 45 days.
Key words: coefficient of variation, growth parameters, Gulf of Morrosquillo, Petrolisthes caribensis, Petrolisthes galathinus.
INTRODUCCIÓN
En la dinámica de las poblaciones naturales, el conocimiento y caracterización del crecimiento individual es de suma importancia, debido a que este proceso, junto con la sobrevivencia, permite lograr estimaciones más precisas sobre el tamaño de las poblaciones (Arreguín et al. 1991). Asimismo, es esencial para el diseño de estrategias de manejo, protección y conservación adecuadas (Rodríguez y Bahamonde 1986, Wright-López et al. 2009) y para establecer el papel reproductivo de cada individuo en la población y su influencia en la dinámica poblacional (Hepper 1967). Durante el ciclo vital de los organismos se combinan una serie de características biológicas sujetas a selección natural como el tamaño inicial, los patrones de crecimiento, la edad o talla de madurez sexual, la energía que se invierte en la reproducción y los patrones de mortalidad y longevidad (Stearns 1992). Algunas de estas características son cruciales para el mantenimiento de las poblaciones naturales de crustáceos, como por ejemplo, la sobrevivencia en la transición de juvenil a adulto (Petriella y Boschi 1997).
Inicialmente, en los estudios sobre crecimiento de crustáceos decápodos, prevaleció el concepto de que el crecimiento era constante durante todo el ciclo luego de cada muda. Sin embargo, evidencias experimentales han mostrado que la tasa de crecimiento decrece con la edad (Dall et al. 1990, Hartnoll 2001, Petriella y Boschi 1997, Ramos-Cruz 2000, Robinson y Tully 2000). Numerosas especies de decápodos presentan importantes cambios morfológicos al alcanzar la madurez sexual, los cuales pueden ser detectados a través del análisis del crecimiento (Petriella y Boschi 1997). El conocimiento de la estructura de tallas y del crecimiento de individuos, proporciona información sobre la dinámica local de la población y permite estimar tallas de reclutamiento, madurez sexual y senectud, dentro de las poblaciones (Biagi y Mantelatto 2006, Hartnoll 1985, Hernández y Arreola 2007). De acuerdo con Martínez et al. (2009), los patrones de crecimiento dependen de factores endógenos (endocrinos, edad, inmunológicos, muda, nutrición, reproductivos, sexo y talla) y exógenos (cantidad de alimento, contaminación, oxígeno disuelto, salinidad y temperatura). Cada uno de estos factores puede variar entre especies de acuerdo con el hábitat (Hartnoll 1982), pero sería importante indagar si hay variaciones entre especies que coexisten y comparten recursos (hábitat y alimento) además de poseer estrechas relaciones filogenéticas, estas cobran un particular interés cuando se sospecha la presencia de especies crípticas o de un complejo de especies, es decir, aquellas especies que no presentan diferencias morfológicas pero sí en sus patrones de coloración, y que a su vez, son aisladas reproductivamente (Knowlton 1993). A pesar de un número significativo de estudios sobre el crecimiento de crustáceos decápodos, aún existe un gran vacío de información sobre el crecimiento en muchas especies, incluso de importancia comercial (Hartnoll 2001, Petriella y Boschi 1997), y más aún, en especies que comparten hábitat, recursos y una historia filogenética.
En la zona intermareal y submareal del Caribe, la familia Porcellanidae es una de las más representativas (Haig 1960). En el Caribe colombiano está conformada por 37 especies (Werding et al. 2003) que asumen un importante rol como filtradores primarios (Gore 1982) y recicladores de materia orgánica (Sanhueza et al. 1975, Viviani 1969), a su vez, constituyen una fuente de alimentación importante para peces carnívoros (Berríos y Vargas 2004), aves y cangrejos grandes (Castilla y Paine 1987, Cerda y Wolff 1993, Lawton 1989). De lo anterior, se evidencia la importancia de los porcelánidos como eslabón trófico y para el mantenimiento de la integridad del ecosistema y su biodiversidad.
En el litoral rocoso de la punta norte del golfo de Morrosquillo del Caribe colombiano, las especies Petrolisthes caribensis (Werding, 1983) con una variante de coloración (Azul) y P. galathinus (Bosc, 1802) con tres variantes de coloración (Puntos, Estrías y Diente blanco) –ambas especies Decapoda: Porcellanidae– coexisten compartiendo hábitat, recursos y formando grandes agrupaciones (Hiller et al. 2006).
En el presente estudio se evaluaron y compararon los parámetros de crecimiento individual en P. caribensis (Azul) y P. galathinus (Puntos, Estrías y Diente blanco), dada su importancia ecológica en la estructura de la comunidad y al hecho de que coexisten compartiendo recursos, además de poseer estrechas relaciones filogenéticas (Hiller et al. 2006). Específicamente, se abordaron las siguientes preguntas: 1) ¿existen diferencias en la tasa de crecimiento individual (estimada como K) entre especies?; 2) ¿existen diferencias en la tasa de crecimiento entre sexos?; 3) ¿existen diferencias en la duración de la fase bentónica del ciclo de vida entre especies? Para este fin se utilizó la herramienta ELEFAN I (FISAT II FAO-ICLARM) en el análisis de la distribución de la frecuencia de tallas, mediante la identificación de modas mensuales y el análisis de su progresión en el tiempo, a lo largo de un muestreo de 11 meses en sustratos artificiales en la punta norte del golfo de Morrosquillo (San Onofre, Sucre), Colombia.
MATERIALES Y MÉTODOS
Área de estudio. El golfo de Morrosquillo se encuentra ubicado en la zona meridional de la costa del Caribe colombiano, entre los departamentos de Córdoba y Sucre a los 09° 22' 00''-09° 45' 00'' N, 75° 33' 00''-75° 55' 00'' O. El espolón litoral de roca se localiza en la punta norte del golfo de Morrosquillo (9° 42' N-75° 39' O) a la profundidad máxima de 2 m. Se distingue una época seca desde diciembre hasta abril y otra húmeda de mayo a noviembre, con reducción de precipitaciones entre junio y julio. La temperatura del agua superficial oscila entre 26 y 32 °C y la salinidad entre 24 y 35 UPS (Delgadillo et al. 2004).
Especies del estudio. El objeto de estudio del presente trabajo comprendió dos especies de la familia Porcellanidae (Decapoda), Petrolisthes caribensis y P. galathinus, pertenecientes al complejo P. galathinu, distinguibles principalmente por su coloración (Werding 1983). Estas formas son genéticamente diferentes y probablemente representan especies crípticas con estrechas relaciones filogéneticas (Hiller et al. 2006). La especie P. galathinus presenta tres variantes de coloración o morfotipos que se denominarán, a lo largo del texto, como Puntos, Estrías y Diente blanco, y P. caribensis presenta una variante de coloración que se denominará Azul. Estas especies tienen la particularidad de coexistir formando agregaciones de las dos especies y todas las categorías de tamaños en un mismo hábitat, el cual está conformado por rocas litorales superpuestas con una distribución entre 50 cm y 3 m de profundidad, allí los individuos comparten espacios habitables y alimento (Hiller et al. 2006).
Métodos de muestreo y análisis de la información. Entre noviembre de 2009 y noviembre de 2010, se realizaron 11 muestreos de individuos de las dos especies y sus morfotipos con intervalos de un mes. El muestreo consistió en la exposición de sustratos artificiales a partir de canastas plásticas que contenían cascajo coralino y trozos de piedras de litoral rocoso, con un volumen de hábitat de 4 dm3. El uso de este tipo de sustratos artificiales, evita el deterioro de los sustratos naturales y permite obtener una muestra representativa de las poblaciones, puesto que el sustrato puede ser colonizado por organismos en diferentes etapas de desarrollo, lo que facilita la representatividad de diferentes clases de talla (Werding, com. pers.). Se dispusieron 36 canastas en el espolón litoral de roca, de las cuales se retiraron tres cada mes. De las canastas se extrajeron todos los individuos y se almacenaron en alcohol al 99%.
Una vez recolectados y almacenados, los individuos fueron separados por morfotipo y por tamaño en tres grupos: a) megalopa; b) juveniles 1 < 2 mm y juveniles 2 entre 2 y 3,99 mm; y c) adultos ≥ de 4 mm (Ahmed y Mustaquim 1974, Miranda y Mantelatto 2010). La determinación del sexo se realizó con base en la presencia de gonóporos, en el tercero de los cinco pereópodos para hembras. El ancho del caparazón se midió con un estereoscopio Olympus y reglilla micrométrica entre los bordes de la parte más ancha del caparazón.
La mayoría de los estudios de crecimiento en crustáceos se han fundamentado en el análisis de distribuciones de frecuencias de tallas, en las que se identifican y separan distribuciones simples de diferentes categorías de talla de la población, y cuyo seguimiento en el tiempo facilita la estimación del crecimiento de estos organismos (Ramos- Cruz 2000).
Para el cálculo de los parámetros de crecimiento de cada especie, morfotipo y sexo, se utilizaron los resultados del ancho del caparazón (mm) mensuales y la ecuación de crecimiento de von Bertalanffy, por ser la que mejor se ajusta a organismos marinos, especialmente a crustáceos de crecimiento rápido y tamaños pequeños (Ehrhardt 2008, Musick y Frazer 1999, Petriella y Boschi 1997, Sparre y Venema 1997, Zetina-Moguel y Ríos-Lara 2000). Para esto se empleó la ecuación modificada (Longhurst y Pauly 1987, Petriella y Boschi 1997, Sparre et al. 1989):
Lt = L∞ (1-e – K (t-to))
Donde:
t = edad del individuo (estimada por el tamaño)
Lt = longitud del individuo a la edad t
K = coeficiente de crecimiento
L∞ = longitud asintótica máxima
to = edad hipotética inicial del individuo cuando su longitud es igual a cero
e = base de los logaritmos naturales
Este modelo propone que el crecimiento es una función que depende de los parámetros L∞ y to que pueden estimarse con los datos de edad y de talla. Los datos de distribución de tallas mensuales se definieron agrupando en clases de 0,5 mm, ya que este rango fue el que mostró mejor ajuste del modelo. El valor de los parámetros L∞ y K se determinaron mediante el modelo de Ford-Walford (Walford 1946):
L (t + Δt) = a + b L(t)
a = L∞ (1 - b)
b = exp (- k Δt)
Los parámetros K y L∞ se obtuvieron de la forma siguiente:
K = -1/Δt lnb
L∞ = a/1- b (Ricker 1975)
Para la obtención del parámetro to, se hizo una regresión del tipo:
y = -ln (1 - ACm/L∞)
Donde:
to = -a/b
ACm = medida lineal
Los valores de los parámetros fueron obtenidos previamente con las herramientas de aproximación para la estimación de L∞ y K (Ford-Walford, Shepherd, Powell-Wetherall) y posteriormente, corroborados con las opciones de búsqueda de progresión modal, a partir de las frecuencias de tallas mensuales, utilizando la herramienta computacional ELEFAN I (Electronic Length Frequency Analysis) (Pauly 1987, Pauly y David 1981) integrada en el programa FISAT II (FAO–ICLARM Stock Assessment Tools) (Gayanilo et al. 1994). Para modelar el crecimiento, ELEFAN I realizó la reestructuración de las frecuencias de talla bajo la rutina''Smoothing data files'' a través de medias móviles de tres clases y la elección de la curva con el mayor o mejor ajuste posible (Rn) (Sparre y Venema 1997). Adicionalmente, se debía cumplir el criterio de que la moda fuera representativa en todos los meses y que no existieran cambios abruptos en las progresiones modales en los meses asignados a la curva.
Los parámetros de crecimiento estimados de P. caribensis (Azul) y P. galathinus (Puntos, Estrías y Diente blanco), fueron comparados mediante el índice phi prima (Ø') de Munro y Pauly (1983):
Ø' = Log10 K + 2 Log10 L∞
y el criterio de Sparre y Venema (1997), quienes establecen que el coeficiente de variación (CV) no debe exceder del 4% para poder asumir que los resultados son estadísticamente similares.
Una vez se definieron los parámetros de crecimiento de cada especie y morfotipos, se estimaron los tiempos transcurridos entre la fase de megalopa a juvenil 1 (< 2 mm) y de esta a juvenil 2 (2-3,99 mm), periodo en el cual se da el proceso de madurez de gónadas y de juvenil 2 a adulto (≥ 4 mm) (Ahmed y Mustaquim 1974, Miranda y Mantelatto 2010). La comparación de los tiempos transcurridos entre la fase de magalopa a adulto se realizó a través de una Chi cuadrado.
RESULTADOS
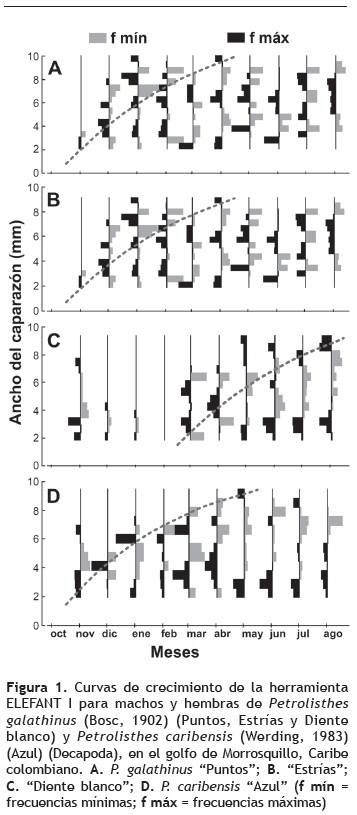
De acuerdo con los parámetros de crecimiento estimados a partir del modelo de Ford-Walford y por las rutinas de ELEFAN I (figura 1, tabla 1), el morfotipo con tamaño asintótico menor fue''Puntos'', tanto en machos como en hembras. No obstante, este morfotipo mostró la mayor constante de crecimiento en machos, mientras que''Estrías'' presentó la longitud asintótica mayor en machos y para las hembras la presentó''Diente blanco'', este último morfotipo alcanzó tamaños máximos de 11,8 mm en machos y 12,5 mm en hembras, con constantes de crecimiento de 2,6 y 2,2, respectivamente. La longitud asintótica de P. caribensis (Azul) fue 12,2 mm en machos y 11,8 en hembras, y las constantes de crecimiento fueron 2,4 y 2,7, respectivamente. En general, los machos presentaron valores mayores en los parámetros de crecimiento que las hembras. La comparación de los parámetros de crecimiento entre especies y morfotipos, a través de los índices phi prima, indican que no hay diferencias entre los parámetros de crecimiento de machos y hembras para cada una de las especies y morfotipos, dado que los coeficientes de variación son menores al 4% (tabla 1).
Las curvas de crecimiento de von Bertalanffy (1938) de machos y hembras de P. caribensis y P. galathinus y sus morfotipos (figura 2), obtuvieron valores de Rn entre 0,14 y 0,16, y aunque estos valores son bajos, cumplen con los criterios de que la moda fue representativa en todos los meses y que no existieron cambios abruptos en las progresiones modales en los meses asignados a la curva.
Existe un patrón similar en las curvas de crecimiento de las diferentes especies y sus morfotipos, mostrando aumento en la talla y disminución de K con el tiempo (figura 2), y presentando diferencias sutiles entre machos y hembras. Sin embargo, hay que considerar que estas leves diferencias puedan ser atribuibles a la precisión en el método de medición del ancho del caparazón de los individuos.
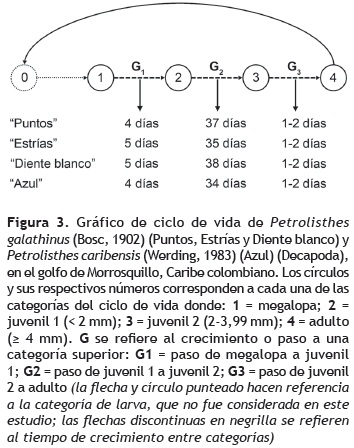
En el esquema del ciclo de vida (figura 3) se evidencia que en las dos especies y sus morfotipos, el tiempo que transcurre entre la categoría de megalopa a juvenil 1 (< 2 mm), en machos y hembras, es entre cuatro y cinco días; el paso de juvenil 1 a juvenil 2 (2-3,99 mm) requiere entre 34 y 37 días; la talla de adulto (≥ 4 mm), como lo propusieron Ahmed y Mustaquim (1974) y Miranda y Mantelatto (2010), se presentó de uno a dos días después. No hay diferencias significativas entre los tiempos estimados de la fase bentónica entre morfotipos (X2 = 0,278; P > 0,05).
DISCUSIÓN
Los resultados de la presente investigación indican que los incrementos mayores en longitud se presentaron en individuos de tallas pequeñas y que la tasa de crecimiento disminuyó con el incremento del tamaño. Estos resultados coinciden con diversos estudios en crustáceos (Company y Sardá 2000, Dall et al. 1990, Franco et al. 2006, Hartnoll 1982, Ramos-Cruz 2000, Robinson y Tully 2000, Zetina- Moguel y Ríos-Lara 2000). Adicionalmente, a partir de observaciones sobre el crecimiento de varias especies de crustáceos de interés comercial –en campo y cautiverio– Petriella y Boschi (1997) encontraron que la tasa de incremento en talla decreció asociada con el aumento de tamaño.
Sobre los parámetros de crecimiento en porcelánidos, solo se conoce el estudio en Pisidia longicornis (Linnaeus, 1767) en Irlanda (Robinson y Tully 2000). Aunque el tamaño máximo de''Estrías'' evidenciado en la presente investigación fue similar al de P. longicornis (L∞ = 12,4 mm), el coeficiente de crecimiento de''Estrías'' fue mayor al de P. longicornis (K = 0,0503), debido probablemente, a que el crecimiento de''Estrías'' es continuo, mientras que en P. longicornis hay una interrupción del crecimiento durante la estación de invierno, debido a la baja en el metabolismo por el descenso en la temperatura y la disminución del alimento.
El coeficiente de crecimiento de von Bertalanffy, y en general las tallas máximas de las hembras de las dos especies y sus morfotipos, fueron menores que en los machos, dado que en numerosas especies de crustáceos el crecimiento depende de factores como el sexo (Dall et al. 1990). Esto podría indicar reducción de la energía invertida en crecimiento en las hembras para ser asignada a la reproducción (Cházaro-Olvera 2009, Hartnoll y Gould 1988). Según Miranda y Mantelatto (2010), las diferencias en los patrones de crecimiento de machos y hembras de P. armatus (Gibbes, 1850) podrían relacionarse también con sus funciones en la población; los tamaños mayores y tasa de crecimiento de los machos estarían relacionados con la defensa territorial y con la competencia intra e interespecífica, y en el caso de las hembras, con la inversión de energía en reproducción.
El valor bajo del coeficiente de variación del índice de crecimiento phi prima (Ø') entre P. caribensis''Azul'' y P. galathinus''Puntos, Estrías y Diente blanco'' no excedió el 4%, por lo cual se asume que los resultados son estadísticamente similares (Pauly 1983, Sparre y Venema 1997). Esta semejanza indica que los morfotipos de las dos especies tienen un patron de crecimiento similar, debido probablemente, a una restricción filogenética, es decir, que el crecimiento para estas especies y morfotipos es específico, y a que coexisten en un hábitat donde la mayoría de las características ambientales son relativamente estables a lo largo del año, excepto la salinidad. De hecho, estas especies poseen una distribución temporal de la densidad relacionada con las épocas climáticas y la salinidad (Quiceno, com. pers.).
En general, la duración de la fase bentónica (i. e., asociada al sustrato) del ciclo de vida de los morfotipos de las dos especies de porcelánidos, desde la megalopa hasta adulto (4 mm), presenta sutiles diferencias: en P. caribensis''Azul'' se extiende entre 39-40 días, en P. galathinus''Puntos'' y ''Estrías'' se extiende entre 41-43 días y en P. galathinus ''Diente blanco'' entre 44-45 días. Estas diferencias podrían estar relacionadas con el hecho de que aún siendo especies filógeneticamente relacionadas, también presentan divergencias en términos de tamaños máximos, impulsado, probablemente, por la adaptación a los diferentes tamaños habitables (Hiller et. al. 2006). En algunos casos se ha demostrado que existen ciertos caracteres que no cambian, dado que hay una restricción filogenética. Es de esperar que estas especies no varían debido a su gran similitud genética (91%), el porcentaje restante corresponde a la variación de caracteres como el color y el tamaño (Hiller et al. 2006). El tamaño máximo para todos los morfotipos se alcanzó entre los 12 y 14 meses, con tiempo estimado de fase adulta de 10,5 a 12,5 meses.
En conclusión, no hay diferencias en la tasa de crecimiento individual entre especies y sexos, así como tampoco existen diferencias estadísticamente significativas en la duración de la fase bentónica del ciclo de vida entre especies y sus morfotipos.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al Comité para el Desarrollo de la Investigación (CODI) de la Universidad de Antioquia, por el apoyo financiero del proyecto: ''Historia de vida de dos especies del complejo Petrolisthes galathinus en la punta norte del golfo de Morrosquillo San Onofre-Sucre'' CODI mediana cuantía 2009. Al Grupo de Investigación en Ictiología (GIUA) y al Grupo de Investigación en Gestión y Modelación Ambiental (GAIA); a Mario Londoño por el apoyo logístico y Sandra Cuartas por la revisión del manuscrito; a la Corporación Académica Ambiental Universidad de Antioquia, por la administración del proyecto; a Fernando Parra por sus aportes en la elaboración de este documento; a la Reserva Natural Sanguaré, Álvaro Roldán y al personal que apoyó el trabajo de campo y laboratorio.
REFERENCIAS
Ahmed M, Mustaquim J. 1974. Population structure of four species of porcellanid crabs (Decapoda: Anomura) occurring on the coast of Karachi. Marine Biology, 26: 173-182. [ Links ]
Arreguín F, Sánchez JA, Defeo O. 1991. Análisis del crecimiento de la almeja amarilla (Mesodesma mactroides) de la costa uruguaya en base a datos de composición por longitudes. Frente Marítimo, 9: 75-81. [ Links ]
Berríos C, Vargas F. 2004. Estructura trófica de la asociación de peces intermareales de la costa rocosa del norte de Chile. Revista de Biología Tropical, 52 (1): 201-212. [ Links ]
Biagi R, Mantelatto FL. 2006. Relative growth and sexual maturity of the hermit crab Paguristes erythrops (Anomura, Diogenidae) from South Atlantic. Hydrobiologia, 559: 247-254. [ Links ]
Castilla JC, Paine RT. 1987. Predation and community organization on eastern Pacific, temperate zone, rocky intertidal shores. Revista Chilena de Historia Natural, 60: 131-151. [ Links ]
Cerda G, Wolff M. 1993. Feeding ecology of the crab Cancer polyodon in La Herradura Bay, northern Chile. II. Food spectrum and prey consumption. Marine Ecology Progress Series, 100: 119-125. [ Links ]
Cházaro-Olvera S. 2009. Growth, mortality, and fecundity of Palaemonetes pugio from a lagoon system inlet in the Southwestern Gulf of Mexico. Journal of Crustacean Biology, 29 (2): 201-207. [ Links ]
Company JB, Sardá F. 2000. Growth parameters of deep-water decapod crustaceans in the Northwestern Mediterranean Sea: a comparative approach. Marine Biology, 136: 79-90. [ Links ]
Dall W, Hill BJ, Rothlisberg PC, Staples DJ. 1990. Biology of the Penaeidae. En: Blaxter JHS, Southward AJ, editores. Advances in marine biology, 27. Londres (Reino Unido): Academic Press. p. 489. [ Links ]
Delgadillo O, García CB, Correa J. 2004. Dinámica temporal de la asociación de peces en dos arrecifes artificiales del golfo de Morrosquillo, Caribe colombiano. Actualidades Biológicas, 26 (81): 219-230. [ Links ]
Ehrhardt NM. 2008. Estimating growth of the Florida spiny lobster, Panulirus argus, from molt frequency and size increment data derived from tag and recapture experiments. Fisheries Research, 93 (3): 332-337. [ Links ]
Franco AR, Ferreira JG, Nobre AM. 2006. Development of a growth model for penaeid shrimp. Aquaculture, 259: 268-277. [ Links ]
Gayanilo FC, Soriano M, Pauly D. 1994. The FAO-ICLARM stock assessment tools (FISAT). User's guide. Roma: Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO). p. 72. [ Links ]
Gore RH. 1982. Porcellanid crabs from the coasts of Mexico and Central America (Crustacea: Decapoda: Anomura). Smithsonian Contributions to Zoology, 363: 1-34. [ Links ]
Haig J. 1960. The Porcellanidae (Crustacea, Anomura) of the Eastern Pacific. Serie Allan Hancock Pacific Expeditions, volumen 24. Los Angeles (E. U. A.): University of Southern California Press. p. 440. [ Links ]
Hartnoll RG. 1982. Growth. En: Bliss D, Abele LG, editores. The biology of Crustacea, embryology, morphology and genetics. Nueva York (E. U. A.): Academic Press. p. 111-196. [ Links ]
Hartnoll RG. 1985. Growth, sexual maturity and reproductive output. En: Wenner AM, editor. Factors in adult growth. Rotterdam: Balkema Publishers. p. 101-128. [ Links ]
Hartnoll RG, Gould P. 1988. Brachyuran life history strategies and the optimisation of the egg production. En: Fincham, Rainbow PS, editores. Aspects of decapod crustacean biology. Volumen 59. Oxford: Clarendon Press. p. 1-9. [ Links ]
Hartnoll RG. 2001. Growth in Crustacea: twenty years on. Hydrobiologia, 449: 111-122. [ Links ]
Hernández L, Arreola JA. 2007. Estructura de tallas y crecimiento de los cangrejos Callinectes arcuatus y C. bellicosus (Decapoda: Portunidae) en la laguna costera Las Guásimas, México. Revista de Biología Tropical, 55 (1): 225-233. [ Links ]
Hepper BT. 1967. On the growth at moulting of lobsters (Homarus vulgaris) in Cornwall and Yorshire. Journal of Marine Biological Association of United Kingdom, 47 (3): 629-643. [ Links ]
Hiller A, Krauss H, Almon M, Werding B. 2006. The Petrolisthes galathinus complex: Species boundaries based on color pattern, morphology and molecules, and evolutionary interrelationships between this complex and other Porcellanidae (Crustacea: Decapoda: Anomura). Molecular Phylogenetics and Evolution, 40 (2): 547-569. [ Links ]
Knowlton, N. 1993. Sibling species in the sea. Annual Review of Ecology and Systematics, 24: 189-216. [ Links ]
Lawton P. 1989. Predatory interaction between the brachyuran crab Cancer pagurus and decapod crustacean prey. Marine Ecology Progress Series, 52: 169-179. [ Links ]
Longhurst AR, Pauly D. 1987. Ecology of tropical oceans. Nueva York (E. U. A.): Academics Press. p. 407. [ Links ]
Martínez P, Martínez L, Ramos R. 2009. Dinámica del crecimiento de peces y crustáceos. Revista Electrónica de Veterinaria, 10 (10): 1-16. [ Links ]
Miranda I, Mantelatto FL. 2010. Sexual maturity and relative growth of the porcellanid crab Petrolisthes armatus (Gibbes, 1850) from a remnant mangrove area, southern Brazil. Nauplius, 18 (1): 87-93. [ Links ]
Munro JL, Pauly D. 1983. A simple method for comparing the growth of fishes and invertebrates. Fishbyte, 1 (1): 5-6. [ Links ]
Musick J, Frazer N. 1999. Planificación del manejo para especies longevas. Contribución N° 2353 del Virginia Institute of Marine Science: 61-67. [ Links ]
Pauly D, David N. 1981. ELEFAN I, a basic program for the objective extraction of growth parameters from the lengh-frecuency data. Meeresforschung-Reports on marine research, 28 (4): 205-211. [ Links ]
Pauly, D. 1983. Algunos métodos simples para la evaluación de recursos pesqueros tropicales. Documento Técnico de Pesca, 234. Roma: Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO). p. 49. [ Links ]
Pauly, D. 1987. A review of the ELEFAN system for the analysis of length-frecuency data in fish and aquatic invertebrates. En: Pauly D, Morgan G, editores. Length-based methods in fisheries research. Manila: International Center for Living Aquatic Resources Management y Kuwait Institute for Scientific Research. 7-34. [ Links ]
Petriella AM, Boschi EE. 1997. Crecimiento en crustáceos decápodos: resultados de investigaciones realizadas en Argentina. Investigaciones Marinas, 25:135-157. [ Links ]
Ramos-Cruz S. 2000. Composición por tallas, edad y crecimiento de Litopenaeus vannamei (Natantia: Penaeidae), en la laguna Mar Muerto, Oaxaca-Chiapas, México. Revista de Biología Tropical, 48 (4): 873-888. [ Links ]
Robinson M, Tully O. 2000. Dynamics of a subtidal population of the porcellanid crab Pisidia longicornis (Decapoda: Crustacea). Journal of Marine Biology Association of the United Kingdom, 80: 75-83. [ Links ]
Rodríguez L, Bahamonde R. 1986. Estimación del crecimiento y mortalidad natural en Munida subrugosa del Estrecho de Magallanes. Investigación Pesquera, 33: 25-32. [ Links ]
Sanhueza E, Bahamonde N, López MT. 1975. Petrolisthes granulosus (Guérin) en biocenosis supramareales de El Tabo (Crustacea, Decapoda, Anomura). Boletín del Museo Nacional de Historia Natural, 34: 121-136. [ Links ]
Sparre P, Ursin E, Venema S. 1989. Introduction to tropical fish stock assessment. Part 1. Manual FAO Fisheries Technical Papers, 1: 1-306. [ Links ]
Sparre P, Venema SC. 1997. Introducción a la evaluación de recursos pesqueros tropicales. Documento Técnico de Pesca, 306 (1). Roma: Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO). p. 420 [ Links ]
Stearns SC. 1992. The evolution of life histories. Oxford (Reino Unido): Oxford University Press. p. 248. [ Links ]
Viviani CA. 1969. Los Porcellanidae (Crustacea, Anomura) chilenos. Beitrage zur Neotrophischen Fauna, 6 (l): l-14. [ Links ]
von Bertalanffy L. 1938. A quantitative theory of organic growth. Human Biology, 10 (2): 181-213. [ Links ]
Walford, L. 1946. A new graphic method of describing the growth of animals. The Biological Bulletin, 90 (2): 141-147. [ Links ]
Werding B. 1983. Der Petrolisthes galathinus-Artencomplex im karibischen Raum mit Beschreibung von P. caribensis und P. columbiensis n. sp. (Crustacea: Anomura: Porcellanidae). Senckenbergiana Biologica, 63 (5-6): 407-418. [ Links ]
Werding B, Hiller A, Lemaitre R. 2003. Geographic and depth distributional patterns of western Atlantic Porcellanidae (Crustacea: Decapoda: Anomura), with an updated list of species. Memoirs of Museum Victoria, 60 (1): 79-85. [ Links ]
Wright-López H, Holguín-Quiñones O, Arreguín-Sánchez F, Roque- Villada I. 2009. Crecimiento y mortalidad de la concha nácar Pteria sterna en bancos silvestres de Baja California Sur, México. Revista de Biología Tropical, 57 (3): 659-670. [ Links ]
Zetina-Moguel CE, Ríos-Lara GV. 2000. Modelos de crecimiento de langosta espinosa (Panulirus argus) y un método para calcular la edad. Ciencia Pesquera, 14: 57-61. [ Links ]