Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.37 no.102 Medellín Jan./June 2015
ARTÍCULOS DE INVESTIGACIÓN
Degradación del clorotalonilo por un consorcio microbiano aislado de humedales construidos en ensayos de laboratorio
Chlorothalonil degradation by a microbial consortium isolated from constructed wetlands in laboratory trials
Karina A. Ríos-Montes1, 2, 3, Gustavo A. Peñuela-Mesa1, 4
1 Grupo de Diagnóstico y Control de la Contaminación (GDCON), Facultad de Ingeniería, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia.
2 Grupo de Investigación en Microbiología y Ambiente (GIMA), Facultad de Ciencias de la Salud, Universidad de San Buenaventura. Calle Real de Ternera, Cartagena (Bolivar), Colombia.
Correos electrónicos: 3 karios2808@gmail.com; 4 gpenuela@udea.edu.co.
Recibido: julio 2013; aceptado: agosto 2014.
Resumen
A escala de laboratorio se evaluó la degradación del clorotalonilo (CLT) por un consorcio microbiano aislado de la biopelícula formada en la grava de humedales construidos de flujo subsuperficial horizontal, usados para el tratamiento de agua residual agrícola, y se estimó el efecto del plaguicida en la dinámica de crecimiento de la comunidad de heterótrofos totales (HT) y la población de Pseudomonas spp. Una concentración de CTL de 0,6 mg l-1 y dos niveles de concentración de carbono orgánico disuelto (COD) de 20 y 100 mg l-1 (empleando glucosa como fuente de carbono), fueron usados en la experimentación llevada a cabo en una solución de agua residual sintética. Las variables respuesta fueron: concentración residual de CLT, concentración residual de COD, y recuento de unidades formadoras de colonias (UFC) de las poblaciones de HT y Pseudomonas spp. Las variables control que se midieron durante el proceso para determinar cambios en las condiciones fisicoquímicas del medio, fueron: conductividad eléctrica, oxígeno disuelto, pH y potencial redox. Se comprobó que el nivel de concentración de carbono orgánico afectó notablemente la degradación del CLT. Con 100 mg l-1 de COD se alcanzó 99,7% de degradación de CLT a las 168 horas del ensayo; en tanto que 45,1%, se alcanzó con 20 mg l-1 de COD. En el análisis cromatográfico no se detectaron productos de degradación.
Palabras clave: carbono orgánico, clorotalonilo, consorcio microbiano, degradación, humedales construidos
Abstract
In the laboratory, we evaluated Chlotothalonil degradation by a microbial consortium isolated from the biofilm formed on the gravel of wetlands constructed with a horizontal subsurface flow for treatment of agricultural wastewater, and we estimated the effect of the pesticide on the growth dynamics of the total heterotrophic community and the population of Pseudomonas spp. A chlorothalonil concentration (CLT) of 0,6 mg l-1 and two levels of dissolved organic carbon concentration (COD) of 20 and 100 mg l-1 (employing glucose as a carbon source) were used in the experiments conducted in a solution of synthetic waste water. The response variables were: residual CLT concentration, residual COD concentration, and counts of colony forming units (CFU) of heterotrophic bacteria and Pseudomonas spp. The control variables measured during the process to determine changes in the physicochemical conditions were: electrical conductivity, dissolved oxygen, pH, and redox potential. It was shown that the level of organic carbon concentration notably affected CLT degradation. With 100 mg l-1 of COD, a 99.7% degradation of CLT was attained after 168 h of trial; while 45.1% was attained with 20 mg l-1 of COD. In the chromatographic analysis no degradation products were detected.
Key words: chlorothalonil, constructed wetlands, degradation, microbial consortium, organic carbon
INTRODUCCIÓN
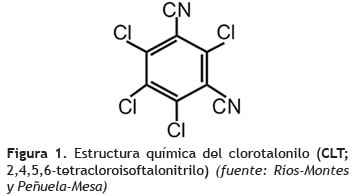
El clorotalonilo (CLT, 2,4,5,6-tetracloroisoftalonitrilo) cuya estructura química es un anillo bencénico compuesto por cuatro cloros y dos grupos cianos en posición meta (figura 1), es un fungicida organoclorado perteneciente al grupo de benzonitrilos halogenados, ampliamente usado para el control de plagas y enfermedades fúngicas en diversos cultivos de frutas y verduras, y también, como preservativo en pinturas y adhesivos desde hace más de 40 años (Regitano et al. 2001, Wang et al. 2011a). Es evidente que la extensiva e indiscriminada aplicación de pesticidas producidos a nivel industrial en la agricultura ha tenido como consecuencia la contaminación de ecosistemas acuáticos y suelos afectando su calidad y sustentabilidad (Arias et al. 2008, Gutiérrez et al. 2007, Imfeld y Vuilleumier 2012), debido a la acción de la escorrentía ocasionada por lluvias y derrames en los sitios donde se llevan a cabo actividades de mezcla, carga y lavado de maquinaria y equipo de aspersión, estimando que estos contienen aproximadamente el 10% de la dosis de pesticida recomendada (Córdova et al. 2011). La interacción con este tipo de agentes químicos puede conducir al desequilibrio ambiental y poner en riesgo la vida de diversos organismos biológicos, e incluso la salud humana si se tiene en cuenta que el CTL ha sido clasificado por la Agencia de Protección Ambiental de los Estados Unidos de América (EPA) dentro del grupo B2 como probable carcinógeno humano, debido al compuesto hexaclorobenceno que es un subproducto de la síntesis del ingrediente activo (Cox 1997, Wang et al. 2011a).
Diversos estudios sobre la degradación del CTL (Chaves et al. 2008, Katayama et al. 1997, Kwon y Armbrust 2006, Motonaga et al. 1996, Wang et al. 2011a, Wu et al. 2012), demuestran su degradación biológica en agua y suelo por consorcios microbianos (Carlo-Rojas et al. 2004, Lu et al. 2006, Regitano et al. 2001) y evalúan el metabolismo aeróbico en una población microbiana en particular (Katayama et al. 1997, Motonaga et al. 1996, Shi et al. 2011, Zhang et al. 2007), llegándose a considerar como la vía más adecuada para la degradación microbiológica del grupo de benzonitrilos halogenados (Katayama et al. 1997). No obstante, vale precisar que las vías metabólicas podrían estar asociadas también con los mecanismos de sulfato reducción y declorinación reductiva que se producen en ambientes anóxicos (Wang et al. 2011b). En adición, estudios recientes han señalado la asociación de dos genes claves que codifican enzimas necesarias para su degradación: la glutatión S-transferasa y la clorotalonil dehalogenasa hidrolítica (Kim et al. 2004, Liang et al. 2010, Wang et al. 2011a).
Desde hace varios años, en diferentes países se están usando los humedales como alternativas de tratamiento para la remoción de diferentes contaminantes, incluyendo los plaguicidas (Budd et al. 2011, Haarstad y Braskerud 2005, Sherrard et al. 2004, Vimazal 2009). Estos sistemas ofrecen condiciones adecuadas para el crecimiento de una gran diversidad de microorganismos capaces de adherirse a las raíces y al lecho del ecosistema como soporte para formar biopelículas, en las cuales la estructura subyacente y la diversidad de las comunidades microbianas junto con su actividad metabólica es crucial en la degradación de tales contaminantes, pues los utilizan como fuente de carbono o energía, o como último aceptor de electrones, modificando los niveles de la concentración del compuesto y disminuyendo, en la gran mayoría de los casos, su toxicidad. Esto subyace en la capacidad de transformación, y por ende, en la tolerancia de los consorcios microbianos frente a diversos contaminantes.
El CTL, plaguicida de interés en el presente estudio no se considera último aceptor de electrones, no obstante sí los productos resultantes de su degradación; sin embargo, estos últimos sufren procesos de degradación muy rápidos, la dosis letal media (DL50) es mayor debido a que en su estructura química presentan menor número de moléculas, lo cual los torna compuestos orgánicos de menor toxicidad (Liang et al. 2011, Wang et al. 2011a). En este estudio se evaluó el tratamiento de un agua residual agrícola sintética contaminada con CTL mediante la degradación aeróbica por acción microbiana, y el efecto del plaguicida sobre la dinámica de crecimiento de los grupos de bacterias heterótrofas y en específico sobre la población de Pseudomonas spp.
MATERIALES Y MÉTODOS
Extracción de la biopelícula microbiana y preparación del inóculo. La biopelícula se extrajo de la grava de los humedales construidos de flujo subsuperficial horizontal a escala piloto ubicados en la Sede de Investigación de la Universidad de Antioquia (SIU), Medellín (Antioquia), Colombia, según el protocolo indicado por Morató (2001) con modificaciones en los volúmenes de lavado. Se emplearon 100 ml de NaCl 0,9% y la suspensión obtenida se sonicó durante 3 minutos con el fin de separar los microorganismos adheridos a la superficie de la grava de diámetro 1/4-1/8''. Este procedimiento garantiza completa extracción y homogenización de la muestra obtenida. El 10% de la biopelícula extraída se inoculó en cada réplica de los bioensayos, excepto en el tratamiento control como es indicado en análisis microbiológico.
Condiciones experimentales. Se prepararon 200 ml de solución de agua residual sintética con los siguientes constituyentes: 0,051 g l-1 de KH2PO4, 0,131 g l-1 de K2HPO4, 0,273 g l-1 de NH4Cl y 0,276 g l-1 de MgCl2. Soluciones independientes fueron enriquecidas con dos niveles de concentración de carbono orgánico disuelto (COD): 20 y 100 mg l-1, usando glucosa como fuente de carbono (0,05 y 0,25 g l-1, respectivamente). Posteriormente, se ajustó a concentración de 0,6 mg l-1 de CTL de uso comercial (Daconil® 720 g l-1 de Syngenta®, 97%); definida con base en la solubilidad de este plaguicida en agua. Las soluciones fueron esterilizadas en autoclave a 121 °C y 15 psi durante 20 minutos previo a la adición del CLT, y posteriormente se les realizó una prueba de esterilidad. El pH final fue de 7,2 ± 0,2. Los bioensayos de degradación con tres réplicas por tratamiento: tratamiento uno (Tr 1) con 20 mg l-1 de COD, tratamiento dos (Tr 2) con 100 mg l-1 de COD y tratamiento tres (Tr 3) como control abiótico, se realizaron bajo agitación constante a 80 rpm en un shaker (New Brunswick Scientific, modelo Excella E2), a 22 °C, y en condiciones aeróbicas en Erlenmeyers de 250 ml. Los tiempos para la recolección de las muestras fueron de 24, 48, 96 y 168 horas (h); estos se seleccionaron de acuerdo con los estudios de vida media del compuesto en condiciones aeróbicas registrados por la EPA (1999).
Concentración residual de clorotalonilo (CLT) y de sus productos de degradación. Se empleó la técnica de extracción líquido-líquido en una mezcla de acetato de etilo-hexano grado cromatográfico (1:1 v/v) para extraer el plaguicida a partir de una muestra inicial de 10 ml. Después de la extracción, 1 μl del extracto fue inyectado en modo splitless en un cromatógrafo de gases Agilent Technologies modelo 6850 equipado con un detector de microcaptura de electrones, un inyector automático serie 7683B y una columna capilar HP-1 Methyl Siloxane (30 m * 320 μm * 0,25 μm) a un flujo de 1,6 ml/min de helio como gas de arrastre. El nitrógeno se empleó como gas make up a un flujo de 30 ml/min. La rampa de temperatura fue de 80 a 180 °C a tasa de 30 °C/min, y luego, de 180 hasta 205 °C a tasa de 3 °C/min, sostenida por 1 min. Finalmente, de 205 hasta 290 °C a tasa de 40 °C/min. La temperatura del inyector fue 290 °C y la del detector fue de 300 °C. Los tiempos de retención y de corrida cromatográfica por réplica, fueron de 7,3 y 14,8 minutos, respectivamente. Se empleó una curva de calibración con R2 = 0,992.
Los productos de degradación se identificaron en un cromatógrafo de gases Agilent Technologies 7890 A, acoplado a un detector de masas 5975 C (CG-EM), con una columna Restek I2723 (30 m * 0,25 mm * 0,2 μm). Se emplearon dos técnicas de extracción: líquido-líquido y en fase sólida en cartuchos C18, utilizando como solvente acetato de etilo-hexano (1:1 v/v). Las muestras extraídas en fase sólida se concentraron por rotaevaporación llevando a volumen final de 1 ml.
Concentración de carbono orgánico disuelto (COD). Las muestras fueron filtradas previamente al vacío, empleando membranas de filtración de 0,45 μm de tamaño de poro y 47 mm de diámetro de filtro de celulosa. Luego se diluyeron a volumen final de 50 ml y fueron analizadas en el equipo COT Tekmar-Dohrmann modelo Phoenix 8000, de acuerdo al método 5310 C del Standard Methods (Rice et al. 2012) cuyo principio de análisis se basa en la oxidación del persulfato con radiación ultravioleta. Los datos se corrieron sobre una curva de 0,1-20 mg l-1, con R2 = 0,9991.
Análisis microbiológicos. El componente microbiológico de la biopelícula aislada de la grava de los humedales e inoculada en el agua residual sintética empleada en los bioensayos, se evaluó mediante la selección de dos grupos de bacterias indicadoras, heterótrofos totales (HT) y Pseudomonas spp. Las bacterias del grupo heterótrofos emplean compuestos orgánicos preformados y reducidos como fuente de carbono, y son indicadoras de amplia diversidad de rutas metabólicas y alta actividad dependiente de la carga orgánica; en tanto que el género Pseudomonas está asociado a la degradación de diferentes compuestos tóxicos (Di-Martino et al. 2012, Wasi et al. 2008, Xuedong et al. 2005), incluyendo el CLT (Wang et al. 2011a, 2012). Se evaluó la dinámica de crecimiento de los dos grupos, realizando diluciones seriadas de las muestras hasta 10-4, de las cuales se sembró 1 ml por duplicado en Agar Plate Count para recuento de HT (Merck®) y Agar GSP selectivo para Pseudomonas-Aeromonas (Merck®). La siembra se realizó en profundidad siguiendo los métodos normalizados para el recuento en placa (Rice et al. 2012). Los datos de unidades formadoras de colonias (UFC) se expresaron como log (UFC ml-1). El inóculo adicionado al agua sintética tenía concentración final en la solución de 2,9 x 106 UFC ml-1 (6,46 log) de HT y 4,3 x 102 UFC ml-1 (2,63 log) de Pseudomonas spp.
Análisis fisicoquímico. Se determinaron algunas variables control como: pH, potencial redox, conductividad y oxígeno disuelto. El comportamiento de estos parámetros se evaluó mediante la comparación con réplicas no inoculadas, bajo la misma concentración de CLT. La intensidad lumínica no fue una variable considerada en la experimentación.
Análisis estadístico. Se aplicó un diseño multifactorial categórico para analizar y comparar las variables experimentales y evaluar el efecto principal de los diferentes factores (concentración de CLT, concentración de COD y tiempo) sobre la remoción del plaguicida y la dinámica de crecimiento de las poblaciones bacterianas estudiadas. Se realizó un análisis de varianza (ANOVA) para determinar diferencias significativas entre cada tratamiento, asumiendo nivel de confianza del 95% y nivel de significancia de 0,05. El modelo de comparación múltiple LSD de Fisher se empleó para determinar diferencias significativas entre los promedios de los recuentos microbiológicos asociados a cada población. Los datos se procesaron y analizaron en el paquete estadístico Statgraphics Plus versión 5.1.
RESULTADOS Y DISCUSIÓN
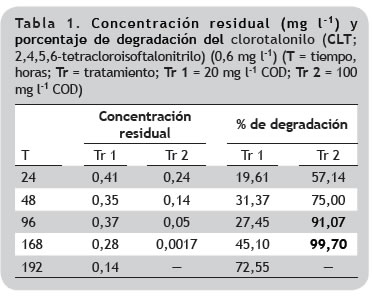
Degradación del CLT y del COD. El porcentaje de degradación del CLT a las 168 h fue del 99,7% cuando la concentración de COD fue de 100 mg l-1 (Tr 2), en tanto que para la concentración de 20 mg l-1 fue del 45,1% (Tr 1), sin embargo, a las 192 h la degradación de CLT alcanzada en Tr 1 fue de 72,55%, indicando que a bajas concentraciones de materia orgánica, los microorganismos requieren de mayor tiempo para metabolizar o transformar el plaguicida (tabla 1). Zhang et al. (2007), estudiaron la degradación simultánea de CTL y nitrato por Bacillus cereus NS1, obteniendo remoción de CLT entre el 87-91% a los 6 días de ensayo en un medio que contenía glucosa y acetato, lo que les permitió concluir que la bacteria utiliza esas fuentes de carbono orgánico para degradar el plaguicida.
Otro estudio realizado por Liang et al. (2010), demostró a las 48 h la degradación completa del CLT (50 mg l-1) por Ochrobactrum sp. CTN-11, a partir de suelos inoculados en solución que contenía glucosa (1 g l-1).
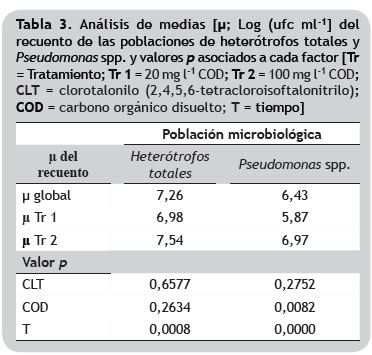
En el presente trabajo, aunque el promedio global de la carga bacteriana de la comunidad de HT no mostró variaciones significativas al compararse los dos tratamientos (p = 0,2634), es preciso resaltar que la actividad metabólica en el Tr 2 fue mayor, debido al porcentaje de degradación del CLT alcanzado. Por el contrario en la población de Pseudomonas, la concentración de carbono orgánico en los tratamientos sí tuvo efecto significativo en la variación promedio de los recuentos (p = 0,0082).
Imfeld y Vuilleumier (2012), concluyeron que las biopelículas resultan tener mayor capacidad y eficiencia en los procesos de degradación con respecto a una cepa en particular, dadas las características estructurales y funcionales, la adaptabilidad y la multiplicidad del quorum sensing de las comunidades microbianas.
Katayama et al. (1991) y Regitano et al. (2001), estudiaron el uso de cepas aisladas de suelos para evaluar la degradación del CLT, y encontraron que la mayoría de estas tienen la capacidad de degradarlo, pero en ausencia de una fuente de carbono este proceso se ve afectado. Asimismo, registraron que la mayor mineralización alcanzada fue posiblemente debido a mayor actividad metabólica en aquellos suelos con más alto contenido de materia orgánica. Resultados similares fueron encontrados por Wang et al. (2011b), quienes estudiaron la degradación del CLT en diferentes tipos de suelo e informaron de porcentajes de degradación anaeróbica desde 0 hasta 89,8% en función del contenido de carbono en la matriz y de la concentración residual del plaguicida, concluyendo que estos dos factores afectan la degradación del CLT.
Mori et al. (1996) y Motonaga et al. (1996), demostraron que la degradación del CLT no depende del uso de este como fuente de carbono para el crecimiento de los microorganismos, puesto que hay evidencias de que la biodegradación ocurre principalmente por cometabolismo, donde la degradación ocurre a expensas de otros sustratos que soportan el crecimiento microbiano; sin embargo, existen estudios que mencionan algunos microorganismos: Flavobacterium sp. (Katayama et al. 1991), Ochrobactrum sp. cepa CTN-11 (Liang et al. 2010), Ochrobactrum lupini cepa TP-D1 y Lysobacter ruishenii (Shi et al. 2010), que tienen la capacidad de degradar el CLT a expensas de ninguna otra fuente de carbono.
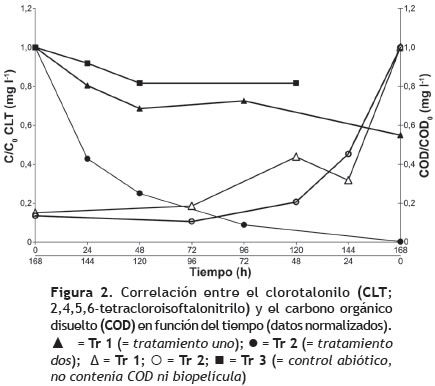
En el presente estudio, la fuente de carbono –glucosa– fue adicionada al agua sintética para evaluar su efecto sobre la capacidad de degradación del consorcio; siendo posible que le proporcionara mayor estabilidad y sobrevivencia a las poblaciones de la biopelícula, garantizando la generación de nueva biomasa y la posterior incorporación del CTL al metabolismo microbiano. Los resultados demostraron que la concentración inicial de COD tuvo efecto significativo sobre la eficiencia en la degradación del plaguicida (p = 0,0001), evidencia de ello es el hecho de que el incremento en la concentración de COD resultó en el incremento del porcentaje de degradación del CLT. La relación entre las concentraciones residuales de CLT y COD fue proporcional con respecto a la concentración inicial de COD en Tr 1 y Tr 2 (figura 2).
Por otra parte, frente a la posibilidad de degradación fotolítica, Peñuela y Barceló (1998) estudiaron la fotodegradación del CLT en agua desionizada y subterránea enriquecidas a concentración de 28 μg l-1, y comprobaron que por fotólisis con luz solar el CLT degrada lentamente en agua destilada (94% a las 348 h), mientras que con luz artificial empleando lámparas de xenón, la degradación fue del 80,2% (84 h) y 99,8% (10 h) en agua desionizada y subterránea, respectivamente. Los autores atribuyeron las diferencias en los porcentajes de degradación a la materia orgánica suspendida y disuelta en el medio acuoso. Porras et al. (2014) evaluaron la fototransformación del CTL en presencia de sustancias húmicas bajo excitación policromática, y concluyeron que la presencia de estas últimas incrementa significativamente la fotodegradación del compuesto; sin embargo, en condiciones de radiación a 406 nm la fotolisis directa del CTL es prácticamente ausente o poco notable. En los bioensayos realizados en este trabajo, es muy poco probable que se haya fotodegradado el compuesto, en tal caso la pérdida sería despreciable, pues las soluciones no estaban expuestas de manera directa a radiación de luz visible en particular que fuera objeto de estudio.
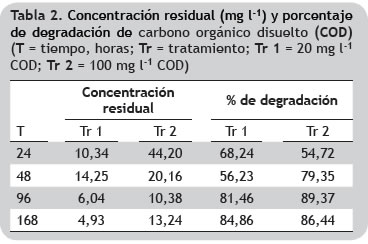
Respecto al porcentaje de degradación de COD, se observaron diferencias significativas entre los niveles de concentración de materia orgánica en relación al tiempo siendo mayor la remoción de carbono orgánico en las réplicas que contenían 100 mg l-1 de COD, no obstante, a las 168 h los porcentajes de remoción fueron relativamente similares para los dos niveles de concentración, 84,9 y 86,4%, respectivamente (tabla 2).
El procedimiento de comparación múltiple entre los tratamientos Tr 1 y Tr 2 con respecto al Tr 3 durante las primeras 48 h, evidenció diferencias significativas en la remoción de CLT al comparar los dos niveles de COD (p = 0,0000). A pesar de que Tr 3 carecía del inóculo de la biopelícula, se observó reducción de la concentración de CLT del 18,3% a las 48 h, la cual permaneció estable hasta las 120 h de evaluación (figura 2).Este hallazgo es consistente con lo comunicado por Carlo-Rojas et al. (2004), quienes registran alto porcentaje de degradación de CTL por microorganismos biológicamente activos (hasta 95%); sin embargo, notables pérdidas abióticas se observaron en blancos estériles, hasta de 37%. Es por ello que la leve reducción en Tr 3 (8-18%) también se puede atribuir a diversos procesos abióticos (físicos o químicos) que ejercen papel importante en la depleción del plaguicida, como la adsorción sobre el material de vidrio, o por radiación con luz visible como lo afirmaron Porras et al. (2014); o en su defecto, por hidrólisis, volatilización y absorción (Wang et al. 2011b). Cabe resaltar que estas pérdidas por procesos abióticos también pueden ocurrir en los tratamientos con inóculo microbiano, luego se podría pensar en ajustar los porcentajes de degradación si las pérdidas observadas en los controles fueran relativamente altas y cuando el objeto de estudio fuera la comparación de la degradación por factores bióticos y abióticos, en cuyo último caso se deberían estudiar todas las variables y fenómenos implicados, en condiciones estándares.
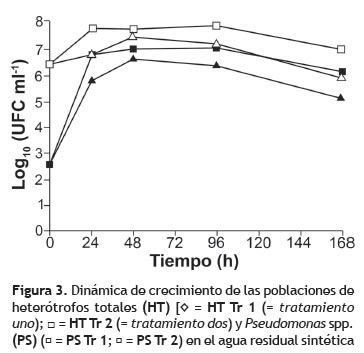
Efecto del CLT sobre las poblaciones microbiológicas. Los resultados de este trabajo demuestran que la variación de las concentraciones de CLT en el tiempo, no tuvieron efecto estadísticamente importante sobre el crecimiento de la comunidad de heterótrofos (HT; p = 0,6577) y la población de Pseudomonas spp. (PS; p = 0,2752); por el contrario, se observó efecto del COD en relación con el recuento bacteriano entre los dos tratamientos, siendo más altos los recuentos en Tr 2. Adicionalmente, diferencias estadísticamente significativas con respecto al tiempo como factor independiente se observaron en ambos grupos estudiados (HT, p = 0,0008; PS, p = 0,0000; figura 3).
El promedio de HT en Tr 1 fue de 6,98 log (UFC ml-1), mientras que en Tr 2, 7,54 log (UFC ml-1). La media del recuento de Pseudomonas spp. fue de 5,87 y 6,97 log (UFC ml-1) para Tr 1 y Tr 2, respectivamente (tabla 3).
Para evaluar las diferencias de medias entre los diferentes tiempos de muestreo, se realizó un procedimiento de comparación múltiple y se encontró que a las 24 y 168 h los recuentos no fueron significativamente diferentes en ninguno de los dos grupos estudiados; posiblemente debido a que en estos tiempos de la cinética de degradación, el crecimiento no es muy significativo (fase de adaptación), o es nulo (fase de muerte) como consecuencia de que la actividad metabólica puede decrecer por el agotamiento de la materia orgánica. Del Tr 3 se realizaron siembras para la determinación de HT y Pseudomonas spp., obteniendo a las 24 h de incubación un recuento < 1 UFC ml-1 en cada tiempo de muestreo.
En este estudio se analizaron estos dos grupos en particular dada su importancia dentro de estos consorcios en los procesos de degradación de xenobióticos (Bhatt et al. 2007), no obstante, las biopelículas están conformadas por un sinnúmero de poblaciones microbiológicas (Bishop 2007) que también podrían estar implicadas en la degradación del CLT (Wang et al. 2011a).
Los efectos de los pesticidas en las comunidades microbianas de diferentes ecosistemas son de gran relevancia porque muchas de las funciones microbianas al igual que la sostenibilidad y calidad ambiental pueden verse afectadas de manera crítica; es por esta razón, que las características funcionales y estructura de las comunidades microbianas se consideran indicadores de elección para evaluar y monitorear el impacto de los plaguicidas sobre el ecosistema, y para valorar su estatus biológico (Imfeld y Vuilleumier 2012).
Los fungicidas pueden estimular la supervivencia bacteriana al ser usados como fuente de nutrientes y energía tras la eliminación de posibles hongos antagonistas, o indirectamente, por el aumento de la cantidad de nutrientes disponibles después de la muerte de hongos sensibles (Chen et al. 2001, Sigler y Turco 2002). Además de las propiedades biocidas, las poblaciones fúngicas no sensibles pueden adquirir nutrientes a partir de aquellos hongos que han muerto como resultado de la exposición al fungicida. En esta línea de investigación, Sigler y Turco (2002) evaluaron el impacto del CLT sobre poblaciones bacterianas y fúngicas de diferentes suelos mediante electroforesis en gel de gradiente denaturante (DGGE), y concluyeron que aun cuando se observaron cambios en la intensidad de las bandas correspondientes a la diversidad de comunidades de hongos y bacterias dominantes, las diferencias no fueron significativamente contundentes; sin embargo, el incremento en las concentraciones del plaguicida, representando 0,2, 1 y 5 veces los niveles recomendados (2,85, 14,25 y 71,25 mg/g), sí afectó la estructura de las comunidades microbianas en casi todas las muestras; conjuntamente, demostraron que las características y composición de la matriz también inciden sobre los cambios en la estructura de las poblaciones, pues en suelos agrícolas y de bosque no fueron detectados cambios visibles respecto a suelos de césped.
Un estudio similar realizado por Yu et al. (2006), en el cual se evaluó el efecto del CLT en microorganismos del suelo, reveló reducción significativa en las poblaciones de bacterias y actinomicetos del 37,4 y 59,4%, respectivamente; sin embargo, se observó recuperación gradual similar a los controles después de los 14 y 21 días de incubación tras la aplicación repetida del plaguicida (1,5 mg/kg), demostrando adaptación con efectos negativos transitorios posterior al tercer y cuarto tratamiento de aplicación. Adicionalmente, los ensayos señalaron que las poblaciones de hongos parecen ser más resistentes al CLT.
Existen otras investigaciones que demostraron como el aumento sucesivo de la concentración inicial del plaguicida y la repetida aplicación interfieren en la vida media y degradación del CLT (Singh et al. 2002, Van der Pas et al. 1999, registrado por Wang et al. 2011b), donde la exposición crónica de los microorganismos a los plaguicidas se incrementa, pero con la adaptación progresiva de estas comunidades (Chen et al. 2001, Imfeld y Vuilleumier 2012, Wu et al. 2012), hecho que con frecuencia se evalúa a través de la tasa de respiración celular (Wu et al. 2012). No obstante, este fenómeno de adaptación y recuperación se debe también al incremento de actividad de pocas especies resistentes y/o a la utilización directa de los plaguicidas como sustrato (Chen et al. 2001, Shi et al. 2010).
Imfeld y Vuilleumier (2012), precisaron sobre los efectos de los plaguicidas en los microorganismos e informaron efectos menores o transitorios cuando se aplican a la dosis recomendada; sin embargo, los procesos y mecanismos correspondientes aún son poco conocidos, luego la evaluación de la toxicidad proveniente de la exposición a plaguicidas en los ecosistemas es compleja debido a que la contaminación es difusa cuando se origina por el uso continuo de plaguicidas poco degradables, o de alto nivel, por la eliminación o liberación accidental de estos a elevadas concentraciones; considerando además que las formulaciones comerciales de plaguicidas pueden provocar efectos tóxicos que difieren de los causados por los compuestos puros.
Chen et al. (2001), demostraron que los efectos del CTL sobre la biomasa y actividad microbiana dependen también de la calidad del material orgánico contenido en la matriz, y al parecer su efecto no es tan significativo en comparación con otros fungicidas. Como se mencionó anteriormente, las biopelículas están conformadas por múltiples consorcios microbianos (Bishop 2007), sin embargo, para efectos de la experimentación sólo se analizaron dos grupos, lo cual da cabida a considerar que otras especies (viables cultivables y no cultivables) también participan en la degradación del plaguicida, como algunas de los géneros: Achromobacter, Acinetobacter, Agrobacterium, Azomonas, Bacillus, Bordetella, Caulobacter, Corynebacterium, Flavobacterium, Lysobacter, Moraxella, Ochrobactrum, Pseudoxanthomonas, Ralstonia, Rhizobium, Rhodococcus, Shinella, Sphingomonas, Xanthomonas, registradas por Wang et al. (2011a).
Recientemente, se ha estudiado el rol ecológico de la transferencia horizontal del gen dehalogenasa hidrolítica que codifica el complejo enzimático 4-clorobenzoato dehalogenasa, y facilita la adaptación bacteriana en sitios contaminados con CLT y su posterior detoxificación a 2,4,5-tricloro-6 hidroxibenceno-1.3-dicarbonitrilo, compuesto que resulta menos tóxico que el CLT (Liang et al. 2011, Wang et al. 2011a). Estos hallazgos se correlacionan con el presente estudio debido a que Pseudomonas es uno de los géneros que presenta el gen, entre otros a saber: Bordetella, Caulobacter, Lysobacter, Ochrobactrum, Pseudoxanthomonas, Rhizobium y Shinella (Liang et al. 2011). Este hecho sugiere posible vía de degradación por dehalogenación hidrolítica en el supuesto de que en los bioensayos realizados en este trabajo, el CLT fuera degradado por la población de Pseudomonas; sin embargo, estudios específicos son necesarios para confirmar esta hipótesis.
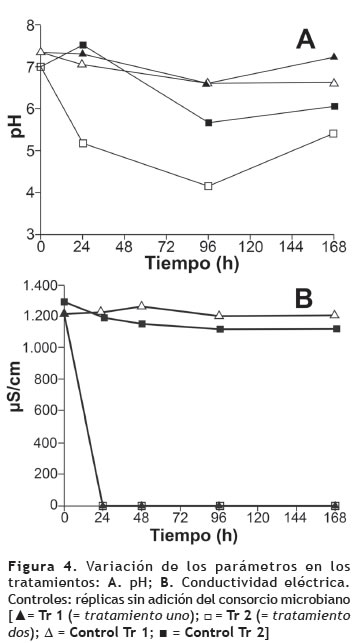
Efecto de la actividad metabólica sobre las variables fisicoquímicas. Es evidente que la actividad metabólica bacteriana influye sobre las variables fisicoquímicas, como es el caso del pH en el que se registraron cambios en ambos tratamientos a partir de un valor inicial de 7,2 en el agua residual sintética (figura 4A). El más significativo se observó en el Tr 2, donde el pH disminuyó considerablemente a las 24 h, señalando que estas variaciones podrían estar intrínsecamente relacionadas con las concentraciones de COD. Para las réplicas con 20 mg l-1 de COD (Tr 1), el pH se mantuvo entre 6,64-7,33. El pH del Tr 3 se mantuvo estable, entre 6,5-7,2.
La disminución del pH en el Tr 2 puede ser correlacionada con la concentración de glucosa en el medio, debido a que la ruta metabólica utilizada por los microorganismos para su degradación, implica la producción de ácidos orgánicos al igual que algunos de los subproductos de degradación del CLT, que son de carácter ácido y se generan por vía oxidativa, como el 3-carbamil-2,4,5-ácido triclorobenzoico; y otros que son el resultado de reacciones que conducen a la sustitución de los átomos de cloro y a la conversión de los grupos funcionales CN a amidas, grupos ácidos y tiazoles (Chaves et al. 2008, Kwon y Armbrust 2006, Regitano et al. 2001).
La conductividad inicial del medio mineral para el Tr 1 y Tr 2 fue de 1.224 y 1.292 μs/cm, respectivamente. A las 24 h, se evidenció un cambio significativo en los Tr 1 y Tr 2 que se inocularon con la biopelícula, reduciéndose a 2,57 y 2,66 μs/cm, respectivamente; mientras que en los controles, la conductividad permaneció constante, sin evidenciar cambios aparentes (figura 4B). El Tr 3 tuvo tendencia similar a los controles, entre 1.507-1.520 μs/cm.
Los datos permiten concluir que los cambios en esta variable están directamente relacionados con la actividad metabólica y que la marcada disminución de la conductividad durante las primeras 24 h para el Tr 1 y Tr 2 se debe posiblemente al consumo de los nutrientes adicionados al medio mineral como fuentes de fósforo, magnesio, nitrógeno y potasio que son requeridos por los microorganismos, no sólo para su crecimiento, sino también, como cofactores empleados en rutas metabólicas importantes para la degradación de compuestos tóxicos.
Davis 2000, señaló que la conductividad es una variable importante que afecta la habilidad de los microorganismos para procesar los desechos o contaminantes que fluyen a través de sistemas de tratamiento. Una matriz con conductividad < 4 μs/cm ofrece las mejores condiciones como medio de crecimiento apto para el desarrollo de la actividad metabólica de los microorganismos.
Lu et al. (2006), estudiando la degradación de diversos plaguicidas concluyeron que la vida media del CTL en el agua es mucho mayor en la medida en que la conductividad eléctrica de esta es más alta, lo cual puede sugerir en el presente trabajo, que la disminución de la conductividad eléctrica fue consistente con el aumento de los niveles de degradación del plaguicida, debidos a la actividad microbiana.
El potencial redox y el oxígeno disuelto permanecieron constantes en el tiempo. El potencial redox se mantuvo entre 108-272 (mV), lo cual concuerda con la presencia de oxígeno disuelto entre 5,0-7,4 (mg/l); ambos eventos favorecidos por la agitación constante de los recipientes donde se llevaron a cabo los ensayos de degradación, manteniendo así las condiciones aerobias.
Subproductos de degradación del CLT. En el análisis por CG-EM no se detectaron productos de degradación por pérdida de uno, dos o tres cloros, lo cual puede deberse a que estos se degradaron rápidamente tan pronto como se formaron, o a que se degradan microbiológicamente por otra ruta metabólica diferente a la declorinación reductiva como ruta inicial (Liang et al. 2010, 2011). En este estudio, al no obtenerse subproductos de degradación, no es posible sugerir otras vías de degradación implicadas.
Han sido sugeridas diferentes rutas metabólicas por procesos de biodegradación. Los cuatro átomos de cloro del CLT pueden ser sustituidos por un grupo metiltio para generar 2,5,6-tricloro-4-metiltio-isoftalonitrilo (Katayama et al. 1997), o por un grupo metoxi y obtener 2,5,6-tricloro- 4-metoxi-isoftalonitrilo, o bien, por un grupo hidroxilo para generar 4-hidroxi-2,5,6-tricloroisoftalonitrilo (Motonaga et al. 1996, Regitano et al. 2001). Otro tipo de sustitución nucleofílica ocurre por la oxidación/hidración del grupo ciano del CLT para formar amidas, tiazoles y ácidos orgánicos (Regitano et al. 2001).
Shi et al. (2011) indicaron dos nuevos metabolitos a partir de la conversión del grupo ciano: metil 2,5,6-tricloro- 3-ciano-4-metoxi-benzoato y metil 3-ciano-2,4,5,6- tetraclorobenzoato.
Katayama et al. (1997) y Regitano et al. (2001), descartaron la mineralización completa del CLT como ruta metabólica en procesos de degradación microbiológica, y demostraron que la mayor tasa de mineralización alcanzada en suelos es de 13,8%, en tanto que la biodegradación ha sido responsable de 50, 54 y 73% en diferentes suelos estudiados, señalando que no ocurre mineralización completa con cultivos puros; mientras que otros resultados (Liang et al. 2010), señalaron la degradación anaeróbica completa con la detección de un subproducto por MS/MS, hidroxitricloroisoftalonitrilo, y confirman que la declorinación hidrolítica es la vía involucrada en la degradación.
Respecto a lo anterior, los metabolitos mencionados por Katayama et al. (1997), Liang et al. (2010), Regitano et al. (2001) y Shi et al. (2011) fueron detectados a partir de cultivos puros de suelo, y en algunos casos, empleando 14C y HPLC-MS; lo cual difiere de este trabajo pues se partió de una matriz diferente, de una biopelícula conformada por diversos consorcios microbianos y la técnica empleada para el análisis fue CG-EM. Tanto la matriz como la diversidad de vías metabólicas de los microorganismos presentes en la biopelícula son determinantes en la biodisponibilidad y degradación del compuesto; la identificación y cuantificación de los metabolitos presentes no sólo es determinada por su concentración, sino también por la técnica de elección.
Peñuela y Barceló (1998), identificaron y cuantificaron por cromatografía de gases acoplada a masas (CG-EM), tres subproductos del CTL (28 μg l-1): tricloro-1,3- dicianobenceno, dicloro-1,3- dicianobenceno y cloro- 1,3-dicianobenceno, siendo el primero de estos el más abundante, y en menor proporción, el último. Por el contrario a los bioensayos del presente estudio, estos análisis fueron realizados mediante experimentos de fotodegradación en periodos cortos de tiempo y a partir del compuesto grado analítico, siendo más factible identificar los subproductos de degradación. En estudios de fotodegradación similares, Sepulveda et al. (2006) y Vásquez et al. (2010) identificaron y cuantificaron por CG-EM los mismos subproductos a partir del uso de un plaguicida comercial a mayores concentraciones (2 y 400 mg l-1) en comparación a la concentración empleada en el presente trabajo, la cual no superó el límite de solubilidad en agua. Por lo tanto, se puede considerar el hecho de que si en el presente estudio no se detectaron los productos de degradación del CTL, fue porque se empleó una concentración muy baja del compuesto comercial, con una probabilidad de generar trazas de estos, que al estar presentes no pudieran ser detectadas a razón del límite de cuantificación de la técnica analítica. Finalmente, otro aspecto a considerar de los registros previos (Peñuela y Barceló 1998, Sepulveda et al. 2006, Vásquez et al 2010), es que los subproductos identificados no procedían de degradación microbiológica, razón que lleva a pensar que los procesos y rutas para la transformación del plaguicida son diferentes, y además, los análisis de estos compuestos se realizaron en términos de tiempo de minutos o pocas horas.
CONCLUSIONES
El mayor porcentaje de degradación del CTL (99,7%) se obtuvo mayor concentración de materia orgánica (100 mg l-1) a las 168 h, indicando que el proceso de degradación es más eficiente cuanto mayor sea la concentración de materia orgánica, y que la biopelícula aislada de los humedales es capaz de degradar eficientemente este plaguicida, no obstante, no se abordió el estudio molecular o de rutas metabólicas para determinar los posibles mecanismos de degradación.
La inferencia estadística lleva a concluir que el decrecimiento en el número de HT y Pseudomonas spp. no estuvo relacionado con la variación de la concentración del CLT en el tiempo, mientras que la variación en la concentración de materia orgánica sí generó efecto en estas poblaciones, las cuales resultaron ser persistentes durante el proceso de degradación y/o transformación de este plaguicida.
La información obtenida sobre la biodegradación del CLT en los ensayos realizados, es útil para valorar el componente microbiológico de los humedales construidos de flujo subsuperficial horizontal, esto es, la capacidad de la biopelícula para la remediación de agua residual agrícola con carga orgánica variada y contaminada con CLT.
Las posibles razones por las cuales no se detectaron productos de degradación pueden atribuirse a la transformación o degradación de estos tan pronto como se formaron, a la presencia de trazas no cuantificables por la técnica analítica, a los tiempos de análisis para la detección y otros fenómenos físicos como la adherencia al material de vidrio, considerada elemento importante para la detección y cuantificación de esta clase de compuestos.
En estudios futuros debería analizarse la biopelícula mediante técnicas de biología molecular para abordar aquellas comunidades que no fueron evaluadas en este trabajo y que participan en la degradación del CLT.
AGRADECIMIENTOS
Al Fondo de Sostenibilidad 2011-2012 de la Vicerrectoría de Investigaciones de la Universidad de Antioquia.
REFERENCIAS
Arias-Estévez M, López-Periago E, Martínez-Carballo E, Simal-Gándara J, Mejuto JC, García-Río L. 2008. The mobility and degradation of pesticides in soils and the pollution of groundwater resources. Agriculture, Ecosystems and Environment, 123: 247-260. [ Links ]
Bhatt P, Kumar MS, Mudliar S, Chakrabarti T. 2007. Biodegradation of chlorinate compounds: A review. Critical Reviews in Environmental Science and Technology, 37: 165-198. [ Links ]
Bishop PL. 2007. The role of biofilms in water reclamation and reuse. Water Science and Technology, 55 (1-2): 19-26. [ Links ]
Budd R, O'geen A, Goh, K, Bondarenko S, Gan J. 2011. Removal mechanisms and fate of insecticides in constructed wetlands. Chemosphere, 83 (11): 1581-1587. [ Links ]
Carlo-Rojas Z, Bello-Mendoza R, Figueroa MS, Sokolov MY. 2004. Chlorothalonil degradation under anaerobic conditions in an agricultural tropical soil. Water Air Soil Pollution, 151: 397-409. [ Links ]
Chaves A, Shea D, Danehower D. 2008. Analysis of chlorothalonil and degradation products in soil and water by GC/MS and LC/MS. Chemosphere, 71: 629-638. [ Links ]
Chen S, Edwards C, Subler S. 2001. Effects of the fungicides benomyl, captan and chlorothalonil on soil microbial activity and nitrogen dynamics in laboratory incubations. Soil Biology & Biochemistry, 33: 1971-1980. [ Links ]
Cox C. Chlorothalonil. 1997. Journal of Pesticide Reform, 17: 14-20. [ Links ]
Córdova RA, Gordillo L, Bello-Mendoza R, Sánchez J. 2011. Use of spent substrate after Pleurotus pulmonarius cultivation for the treatment of chlorothalonil containing waste water. Journal of Environmental Management, 92: 948-952. [ Links ]
Davis L. 2000. Substrates. A handbook of constructed wetlands. Volume 1: General considerations [Internet]. Washington (D. C.): U. S. Environmental Protection Agency (EPA). p. 27-30. Disponible en: http://water.epa.gov/type/wetlands/restore/upload/constructedwetlands-handbook.pdf. [ Links ]
Di-Martino C, López N, Raiger L. 2012. Isolation and characterization of benzene, toluene and xylene degrading Pseudomonas sp. selected as candidates for bioremediation. International Biodeterioration and Biodegradation, 67: 15-20. [ Links ]
Gutierrez RF, Santiesteban A, Cruz-López L, Bello-Mendoza R. 2007. Removal of chlorothalonil, methyl parathion and methamidophos from water by the fenton reaction. Environmental Technology, 28 (3): 267-272. [ Links ]
Haarstad K, Braskerud B. 2005. Pesticide retention in the watershed and in a small constructed wetland treating diffuse pollution. Water Science and Technology, 51 (3-4): 143-150. [ Links ]
Imfeld G, Vuilleumier S. 2012. Measuring the effects of pesticides on bacterial communities in soil: A critical review. European Journal of Soil Biology, 49: 22-30. [ Links ]
Katayama A, Isemura H, Kuwatsuka S. 1991. Population change and characteristics of chlorothalonil degrading bacteria in soil. Journal of Pesticides Science, 16: 239-245. [ Links ]
Katayama A, Itou T, Ukai T. 1997. Ubiquitous capability to substitute chlorine atoms of chlorothalonil in bacteria. Journal of Pesticides Science, 22: 12-16. [ Links ]
Kim YM, Park K, Joo GJ, Jeong EM, Kim JE, Rhee IK. 2004. Glutathionedependent biotransformation of the fungicide chlorothalonil. Journal of Agricultural and Food Chemistry, 52: 4192-4196. [ Links ]
Kwon JW, Armbrust KL. 2006. Degradation of chlorothalonil in irradiated water/sediment systems. Journal of Agricultural and Food Chemistry, 54: 3651-3657. [ Links ]
Liang B, Li R, Jiang D, Sun J, Qiu J, Zhao Y, Li S, Jiang J. 2010. Hydrolytic dechlorination of chlorothalonil by Ochrobactrum sp. CTN-11 Isolated from a Chlorothalonil-Contaminated Soil. Current Microbiology, 61: 226-233. [ Links ]
Liang B, Wang G, Zhao Y, Chen K, Li S, Jiang J. 2011. Facilitation of bacterial adaptation to chlorothalonil-contaminated sites by horizontal transfer of the chlorothalonil hydrolytic dehalogenase gene. Applied and Environmental Microbiology, 77 (12): 4268-4272. [ Links ]
Lu J, Wu L, Newman J, Faber B, Gan J. 2006. Degradation of pesticides in nursey recycling pond waters. Journal of Agricultural and Food Chemistry, 54: 2658-2663. [ Links ]
Morató J. 2001. Formación de biofilms y riesgo sanitario en sistemas de distribución de agua [Tesis doctoral]. [Barcelona (España)]: Universidad Autónoma de Barcelona. p. 271. [ Links ]
Mori T, Fujie K, Kuwatsuka S, Katayama A. 1996. Accelerated microbial degradation of chlorothalonil in soils amended with farmyard manure. Soil Science and Plant Nutrition, 42: 315-322. [ Links ]
Motonaga K, Takagi K, Matumoto S. 1996. Biodegradation of chlorothalonil in soil after suppression of degradation. Biology and Fertility of Soil, 23: 340-345. [ Links ]
Peñuela GA, Barceló D. 1998. Photodegradation and stability of chlorothalonil in water studied by solid-phase disk extraction, followed by gas chromatographic techniques. Journal of Chromatography A, 823: 81-90. [ Links ]
Porras J, Fernández JJ, Torres-Palma RA, Richard C. 2014. Humic substances enhance chlorothalonil phototransformation via photoreduction and energy transfer. Environmental Science and Technology, 48: 2218-2225. [ Links ]
Regitano JB, Tornisielo VL, Lavorenti A, Pacovsky RS. 2001. Transformation pathways of 14C-chlorothalonil in tropical soil. Archives of Environmental Contamination and Toxicology, 40: 295-302. [ Links ]
Rice EW, Baird RB, Eaton AD, Clesceri LS, editores. 2012. Standard methods for the examination of water and wastewater. 22nd ed. Washington (D. C.): American Public Health Association (APHA), American Water Works Association, Water Environment Federation. p. 1368. [ Links ]
Sepulveda C, Peñuela G, Echeverri JD, Agudelo S. 2006. Identificación de los productos de degradación del clorotalonilo por fotodegradación, hidrólisis y fenton. Gestión y Ambiente, 9 (3): 157-166. [ Links ]
Sherrard RM, Bearr JS, Murray-Gulde CL, Rodgers JH Jr, Shah YT. 2004. Feasibility of constructed wetlands for removing chlorothalonil and chlorpyrifos from aqueous mixtures. Environmental Pollution, 127: 385-394. [ Links ]
Shi XZ, Guo RJ, Takagi K, Miao ZQ, Li SD. 2011. Chlorothalonil degradation by Ochrobactrum lupini strain TP-D1 and identification of its metabolites. World Journal of Microbiology and Biotechnology, 27: 1755-1764. [ Links ]
Sigler W, Turco R. 2002. The impact of chlorotalonil application on soil bacterial and fungal populations as assessed by denaturing gradient gel electrophoresis. Applied Soil Ecology, 21: 107-118. [ Links ]
Singh B.K, Walker A, Wright DJ. 2002. Persistence of chlorpyrifos, fenamiphos, chlorothalonil, and pendimethalin in soil and their effects on soil microbial characteristics. Bulletin of Environmental Contamination and Toxicology, 69: 181-188. [ Links ]
Van der Pas L, Master AM, Boesten JT, Leistra M. 1999. Behaviour of metamitron and hydroxychlorthalonil in low humic sandy soils. Pesticide Science, 55: 923-934. [ Links ]
Vásquez E, Peñuela G, Agudelo S. 2010. Estudio de la fotodegradación del clorotalonilo usando las técnicas de fenton y fotocatálisis con dióxido de titanio mediante radiación solar. Revista Facultad de Ingeniería de la Universidad de Antioquia, 51: 105-113. [ Links ]
Vymazal, J. 2009. The use constructed wetlands with horizontal sub-surface flow for various types of wastewater. Ecological Engineering, 35: 1-17. [ Links ]
Wang G, Liang B, Li F, Li S. 2011a. Recent advances in the biodegradation of chlorothalonil. Current Microbiology, 63: 450-457. [ Links ]
Wang G, Chen H, Bi M, Li S. 2012. Bioremediation of chlorothalonil contaminated soil by utilizing Pseudomonas sp. strain CTN-3. Chinese Journal of Applied Ecology, 23(3): 807-811. [ Links ]
Wang H, Wang C, Chen F, Wang X. 2011b. Anaerobic degradation of chlorothalonil in four paddy soils. Ecotoxicology and Environmental Safety, 74: 1000-1005. [ Links ]
Wasi S, Jeelani G, Ahmad M. 2008. Biochemical characterization of a multiple heavy metal, pesticides and phenol resistant Pseudomonas fluorescens strain. Chemosphere, 71: 1348-1355. [ Links ]
Wu X, Cheng L, Cao Z, Yu Y. 2012. Accumulation of chlorothalonil successively applied to soil and its effect on microbial activity in soil. Ecotoxicology and Environmental Safety, 81: 65-69. [ Links ]
Xuedong W, Huili W, Defang F. 2005. Biodegradation of imazapyr by free cells of Pseudomonas fluorescens Biotype II and Bacillus cereus isolated from soil. Bulletin of Environmental Contamination and Toxicology, 74: 350-355. [ Links ]
Yu Y, Shan M, Fang H, Wang X, Qiang Chu X. 2006. Responses of soil microorganisms and enzymes to repeate applications of chlorothalonil. Journal of Agricultural and Food Chemistry, 54: 10070-10075. [ Links ]
Zhang Y, Lu J, Wu L, Chang A, Frankenberger W Jr. 2007. Simultaneous removal of chlorothalonil and nitrate by Bacillus cereus strain NS1. Science of the Total Environment, 382: 383-387. [ Links ]