Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.37 no.102 Medellín Jan./June 2015
ARTÍCULOS DE INVESTIGACIÓN
Frugivoría y dispersión de semillas de la palma Oenocarpus bataua en dos regiones con diferente estado de conservación
Frugivory and seed dispersal of the palm Oenocarpus bataua in two regions with different conservation status
July Franco-Quimbay1, 3, Rosario Rojas-Robles1, 2, 4
1 Maestría en Medio Ambiente y Desarrollo. Universidad Nacional de Colombia, sede Bogotá. Bogotá, D. C., Colombia.
2 Docente e investigadora. Biología, Universidad Nacional de Colombia, sede Bogotá. Bogotá, D. C., Colombia.
Correos electrónicos: 3 jnfrancoq@unal.edu.co; 4 mrrojasr@unal.edu.co.
Recibido: noviembre 2013; aceptado: octubre 2014.
Resumen
Se comparó la frugivoría y dispersión de semillas de Oenocarpus bataua en dos áreas en Colombia, con diferente estado de conservación: Porce (departamento de Antioquia), bosque subandino alterado, fragmentado con baja conectividad y defaunado; y Reserva Las Unamas (departamento del Meta), bosque continuo, menos alterado y con presencia de especies de fauna, principalmente mamíferos desaparecidos en áreas transformadas. Se realizaron observaciones focales, fototrampeo y registro de distancias de dispersión. Cuatro de cinco frugívoros en Porce fueron pequeños mamíferos, mientras que en Las Unamas se registraron cuatro especies de tamaño mediano, y de acuerdo a registros de fauna en el área, hasta 24 especies podrían consumir los frutos. El número de semillas dispersadas, las distancias de dispersión y las distancias de semillas y plántulas al árbol parental más cercano, fueron mayores en Porce. Estos resultados sugieren intensa actividad de roedores pequeños, principalmente las ardillas, que posiblemente han aumentado, como producto de la ausencia de depredadores y competidores desaparecidos por cacería y fragmentación del hábitat. Estos roedores ejercen alta presión sobre los frutos de O. bataua, pero a la vez cumplen una función de dispersión de semillas. A pesar de la limitada dispersión de O. bataua, en ambas áreas estudiadas, esta palma es una especie abundante, fuente casi permanente de alimento para la fauna silvestre y un elemento estructurante del bosque. Este tipo de estudio es significativo debido a que permite reconocer la importancia de la conservación de áreas que sustentan interacciones ecológicas, como la dispersión de semillas y en general la funcionalidad de los ecosistemas que están siendo amenazados por la defaunación y fragmentación del hábitat.
Palabras clave: defaunación, dispersión de semillas, frugivoría, Oenocarpus bataua
Abstract
We compared frugivory and seed dispersal of Oenocarpus bataua in two areas with different conservation status: Porce, an altered sub-Andean forest, fragmented with low connectivity and defaunated and Las Unamas, continuous forest, less altered and with wildlife species present, mainly mammals that disappear in transformed areas. We conducted focal observations, camera trapping and registers of dispersal distances. Four of five frugivors in Porce were small mammals, while in Las Unamas we found recorded four mediumsized species and according to records of wildlife in the area up to 24 species that potentially could consume the fruits. The number of seeds dispersed, their dispersal distances, and the distances of seeds and seedlings to the nearest parent tree were greater in Porce, these results suggest an intense activity of small rodents, especially squirrels, which may have increased due to the absence of predators and competitors eliminated by hunting and fragmentation. These rodents exert a high pressure on the fruits of O. bataua, but also play a role in their dispersal. Despite the limited dispersal of O. bataua in both study areas, is an abundant species and an almost permanent food source for wildlife and a structuring element of the forest. Such studies are important to recognize the importance of protecting areas that support ecological interactions such as seed dispersal and overall functionality of the ecosystems that are threatened by defaunation and habitat fragmentation.
Key words: defaunation, frugivory, Oenocarpus bataua, seed dispersal
INTRODUCCIÓN
La dispersión de semillas es un proceso fundamental en la estructura y supervivencia de las poblaciones vegetales. Cuando los frugívoros alejan las semillas del árbol parental, otros procesos como la depredación (Beckman et al. 2012, Holl y Lulow 1997, Janzen 1971), la germinación (Figueiredo 1993, McAlpine y Jesson 2008), la colonización (Sagnard et al. 2007, Wenny 2001), la competencia (Venable y Brown 1993) y el flujo genético (Choo et al. 2012, Karubian et al. 2010) están siendo influenciados. Así, la dispersión se convierte en un proceso complejo que ayuda a mantener la dinámica de la diversidad florística de los bosques tropicales (Malanson 1996, Terborgh et al. 2002, Wright 2002).
Se ha reconocido que los frugívoros, al manipular los frutos, además de removerlos o alejarlos de los factores de mortalidad denso-dependientes, asociados a la cercanía al parental (Connell 1971, Janzen 1970), pueden brindar otras ventajas. Algunos roedores favorecen la germinación al roer y pelar la semilla (Smythe 1989), otros alejan y entierran las semillas propiciando la germinación y permitiéndole, además, escapar de depredadores vertebrados e invertebrados en la fase de posdispersión, asimismo, evitan la desecación (Asquith et al. 1999). Incluso se ha informado que existen dispersores que además de transportar frutos, llevan consigo esporas de micorrizas esenciales en el ciclo de nutrientes de muchas especies (Smythe 1989).
Se estima que entre el 51 y 98% de los árboles en los bosques neotropicales son dispersados por fauna vertebrada (Stoner y Henry 2008), por lo tanto, una alteración en las comunidades animales afectará la dispersión de semillas y los procesos que esta conlleva. Asimismo, esta interacción mutualista puede estar afectada por eventos como la fragmentación de hábitats (Albrecht et al. 2012, Cramer et al. 2007, Jesus et al. 2012, McConkey et al. 2012), la cacería y defaunación (Holbrook y Loiselle 2009, Vanthomme et al. 2010, Wang et al. 2007) e incluso la introducción de especies exóticas (McConkey et al. 2012, Westcott y Fletcher 2011) y el cambio climático (Aitken et al. 2008, Hampe 2011).
Una de las relaciones más estudiadas es la existente entre la defaunación y la dispersión de semillas (Galetti et al. 2006, Guimarães et al. 2008, Peres y Palacios 2007, Vargas 2008). Por ejemplo, se ha encontrado que para especies con semillas grandes, la probabilidad de remoción y enterramiento varía dependiendo del nivel de defaunación, los frugívoros presentes y el tamaño de los fragmentos (Galetti et al. 2006). Así, la remoción selectiva de frugívoros grandes por cacería y la fragmentación del hábitat, genera disminución en el éxito reproductivo de las plantas con semillas grandes (Forget y Jansen 2007), y en consecuencia, reducción en las tasas de crecimiento de las poblaciones (Brodie et al. 2009).
Las palmas en el Neotrópico son fuente importante de alimento para gran variedad de frugívoros (Galetti y Aleixo 1998, Zona y Henderson 1989). Entre ellas se destaca la palma Oenocarpus bataua (Mart., 1823) ampliamente distribuida en las zonas bajas y algunas veces en las pendientes montañosas de la región tropical suramericana (Henderson et al. 1995); los frutos se caracterizan por la composición lipídica y proteica de alto valor nutritivo (Balick y Gershoff 1981, Blaak 1992), por lo que se convierten en una excelente fuente alimenticia para la fauna silvestre. Se han documentado alrededor de 12 especies de aves y 17 de mamíferos consumiendo sus frutos y otras especies asociadas a la palma que la usan para el forrajeo (Kahn y Granville 1992, Miranda et al. 2008, Zona y Henderson 1989). Sin embargo, son pocos los estudios de dispersión de semillas de esta especie como el realizado por Rojas-Robles et al. (2012) en un bosque subandino alterado.
En Colombia, O. batua puede ser un elemento abundante u ocasional en áreas boscosas relativamente conservadas. Sin embargo, sus poblaciones han sido reducidas por la explotación intensiva, la transformación y disminución de hábitats naturales (Rojas-Robles et al. 2008), y con ello sus dispersores.
El objetivo de esta investigación fue comparar la frugivoría y dispersión de semillas de O. bataua en dos áreas contrastantes por su estado de conservación en Colombia. Para esto se identificó el ensamblaje de frugívoros y posibles dispersores de O. bataua, se registraron distancias y destinos de remoción de semillas en un bosque húmedo tropical continuo, con bajo nivel de intervención y conservada riqueza faunística. Estos resultados se compararon con los obtenidos por Rojas-Robles et al. (2012), en un bosque fragmentado y sometido a fuerte defaunación de vertebrados de mediano y gran tamaño. Los resultados obtenidos en esta investigación contribuyen al conocimiento que se tiene sobre la ecología de la dispersión de esta palma aceitera promisoria. De esta forma, se espera contribuir con la conservación de esta especie y de los ecosistemas naturales amenazados por la fragmentación y la defaunación, donde ella se encuentra.
MATERIALES Y MÉTODOS
En este estudio se comparan los datos recolectados en dos áreas de Colombia: 1) en la Reserva Las Unamas (departamento del Meta), entre junio de 2011 y febrero de 2012; y 2) en Porce (departamento de Antioquia), por Rojas-Robles et al. (2012) entre agosto de 2005 y septiembre 2006. A pesar de que los datos fueron recolectados en tiempos diferentes, las metodologías utilizadas son las mismas. De igual forma, el esfuerzo de muestreo fue equivalente en las dos áreas comparadas.
Área de estudio. 1) Reserva Las Unamas (3° 34' N, 73° 27' O): se ubica en el piedemonte llanero, el cual corresponde a un corredor boscoso que ha permitido el flujo dinámico de fauna entre la Amazonia y la Orinoquia. La reserva se localiza en el municipio de San Martín (departamento de Meta), correspondiente a Bosque Húmedo Tropical y considerada como uno de los sitios mejor conservados del piedemonte (McNish 2007). El área se caracteriza por altitudes entre 260 y 300 m, con temperatura anual entre los 25 y 28 °C, precipitación anual promedio entre los 2.200 y 5.100 mm, y la humedad relativa alcanza valores de 85% en la época húmeda y 50-60% en la estación seca (Reserva Natural Las Unamas 2006). El paisaje está compuesto por un bosque primario de 2.000 ha (Corporación para el Desarrollo Sostenible del Área de Manejo Especial La Macarena 2006), que incluye un área continua de 1.071 ha (Ocampo 2009), conectada con bosques de galería y matas de monte, inmersos en una matriz extensa de sabanas naturales y pastos introducidos, destinados para la ganadería. La reserva colinda y se conecta con otras dos áreas de protección. En total las tres áreas de reserva abarcan 6.887 ha (Peñuela et al. 2011). La especie O. bataua, es un elemento característico del dosel y subdosel en los bosques de la reserva. Se observaron frutos maduros durante todo el año, por lo que es probable que esta palma sea clave para el mantenimiento de las relaciones tróficas de la fauna nativa presente en la reserva. Dentro de la fauna registrada se pueden encontrar: cinco especies de primates (Alouatta seniculus, Aotus brumbackii, Callicebus ornatus, Saimiri sciureus y Sapajus apella); cinco ungulados (Mazama americana, Odocoileus virginians, Pecari tajacu, Tapirus terrestres y Tayassu pecari); cuatro roedores, incluyendo Cuniculus paca y Dasyprocta fuliginosa; cinco felinos (Leopardus pardilis, L. weddy, Pantera onca, Puma concolor y P. yagourondi), entre otros grupos de mamíferos; además son conocidas 136 especies de aves, de las cuales 36 son frugívoras (Pinto, com. pers.), que incluyen cuatro especies de tucanes, seis de psitácidos, entre otras de mediano tamaño, que podrían consumir los frutos de O. bataua (Reserva Natural Las Unamas 2006).
La continuidad y conectividad de las áreas de bosque, el buen estado de conservación de las mismas, sumado a la ausencia de cacería, convierten este lugar en un refugio para gran variedad de especies de fauna y flora nativas, desplazadas o eliminadas de bosques aledaños que han sido sustituidos por cultivos de pasto y palma africana (Reserva Natural Las Unamas 2006). De igual forma, existe alta diversidad y presencia de varias especies de mamíferos que están en alguna categoría de amenaza y que presentan extinciones locales en otras áreas donde antes se distribuían. Todo lo anterior da cuenta del estado de conservación del área de estudio.
2) Porce (6° 46' N, 75° 06' O): en la cuenca media del río Porce, sobre la Cordillera Central andina al nordeste del departamento de Antioquia; correspondiente a Bosque húmedo premontano (bh-PM; Holdridge 2000). En esta área, el estudio se realizó en tres fragmentos de bosque primario intervenido: Normandía, un fragmento de 268 ha; La Piedra con 27,9 ha, separado del anterior por una carretera; y San Ignacio con un área de 71,3 ha, aislado y de difícil acceso, a 10 km de los dos anteriores, rodeado de pastizales y algunos parches de bosque. Se encuentran a alturas entre 925 y 1.100 m, la temperatura promedio anual de 22,7 °C, precipitación media anual de 1.915 mm, y la humedad media mensual varía entre 77,9 y 100% (Rojas-Robles et al. 2008). La matriz en la que se encuentran los fragmentos es de vegetación secundaria, rastrojo alto, rastrojo bajo y pastos para la ganadería. La especie O. bataua, es un elemento característico de la zona, registrando una densidad promedio de 163 individuos adultos/ha y una producción aproximada de 53,211 frutos/ha (Rojas-Robles 2008), disponibles para la fauna silvestre. En el área se han encontrado 237 especies de aves, (Corporación Ambiental 2001, citado por Rojas-Robles et al. 2012), entre las cuales se destacan: Aburria aburri, Ortalis columbiana, Pteroglossus torquatus, Ramphastus citreolaemus, R. swainsonii, Steatornis caripensis y Tinamus major como posibles consumidores de los frutos de O. bataua; los primates: Aotus lemurinus, A. seniculus y Saguinus leucopus; del orden Carnivora: Cerdocyon thous, Leopardus pardalis, Nasua nasua, Potos flavus y Procyon cancrivorus; roedores grandes: paca (Cuniculus paca) y aguti (Dasyprocta punctata), que son intensamente cazados en los fragmentos de bosque en los que aún están presentes (Corporación Ambiental 2001, citado por Rojas-Robles et al. 2012). Ya no se observan en la zona, el tapir (Tapirus bairdii), ni los pecaríes (Pecari tajacu y Tayassu pecari) (Rojas-Robles et al. 2012). Actualmente el área está relativamente protegida por ser de propiedad de Empresas Públicas de Medellín (EPM), sin embargo, por ser accesible, debido a una carretera principal que la divide, facilita las actividades de cacería, extracción de maderas y hojas de O. bataua, prácticas que se convierten en amenazas permanentes para la conservación de este hábitat, que ha sido bastante intervenido, defaunado por cacería, fragmentado altamente y con poca o ninguna conectividad entre pequeños fragmentos de bosque.
Especie en estudio. Oenocarpus bataua (Mart., 1823) se distribuye ampliamente en Colombia en todas las zonas de bosque húmedo de tierras bajas, llegando a ser común y localmente abundante en áreas por debajo de los 1.000 m (Galeano y Bernal 2010), incluyendo el piedemonte llanero, donde es conocida como Unama. Incluso, puede encontrarse en áreas de mayor pendiente en bosques premontanos en la Cordillera Central (Rojas-Robles y Stiles 2009). Es monoica y presenta inflorescencias que alcanzan hasta los 2 m de largo, las cuales producen cada una cientos de frutos elipsoides (1.366 promedio/racimo en Porce) que logran los 35,3 ± 2,8 mm de largo, 21,3 ± 2 mm de diámetro y 10,9 ± 2,1 g de peso (Rojas-Robles et al. 2008), y sirven como alimento a la fauna silvestre frugívora en los bosques donde se encuentra. El valor de la proteína de la pulpa es 40% mayor que la proteína de la soya (Balick y Gerschoff 1981), por lo que se considera una de las palmas más promisorias en Colombia. Además, se ha registrado amplia variedad de usos tradicionales, incluyendo medicinales, cosméticos y en la construcción de viviendas y utensilios (Aguilar-Mena 2006, Bernal et al. 2011, Macía et al. 2011, Sosnowska y Balslev 2008). Se encuentra principalmente en bosques primarios, siendo la extracción y fragmentación del hábitat las principales amenazas para las poblaciones existentes.
Registro de frugivoría con trampas fotográficas. Para registrar los frugívoros diurnos, nocturnos y poco conspicuos se emplearon trampas fotográficas tipo ''Camtrakker'' o ''Camera Trapping'' (marca Cudde Back Digital), con sensor de movimiento y calor. Estas se instalaron aleatoriamente tratando de cubrir la mayor área posible, lejos de los caminos y en lugares donde se observaron eventos previos de frugivoría, cerca de palmas con frutos maduros, dirigidas al suelo con montones de frutos maduros previamente dispuestos y en el dosel hacia racimos maduros (entre 7 y 17 m de altura). Las cámaras se dejaron activas continuamente (día/noche) haciendo esfuerzo de muestreo equivalente en el suelo y dosel. En Las Unamas se totalizaron 135 días/ noches en el suelo y 142 días/noches en el dosel, mientras que en Porce 82 días/noches en suelo y 83 días/noches en el dosel.
Observaciones focales de frugivoría. Con el objetivo de ampliar el muestreo a mayor número de palmas y complementar el ensamblaje de frugívoros, se realizaron observaciones focales, de 6-10 de la mañana, a palmas con racimos maduros y que presentaran evidencia de consumo de frutos en el suelo. Las observaciones se realizaron a una distancia prudencial, con el fin de no interferir con los frugívoros o dentro de una carpa camuflada. Para esto se emplearon binoculares y se registraron los frugívoros visitantes, la hora de llegada, tiempo de permanencia, tiempo consumiendo, número de frutos consumidos, llevados y derribados. En Las Unamas y en Porce se empleó el mismo método alcanzando 40 y 90 horas de observación, respectivamente.
Medidas directas de dispersión de frutos. Con el fin de estimar las distancias y destinos de dispersión de semillas por mamíferos terrestres, se recolectaron, perforaron, marcaron y colocaron 965 y 546 frutos maduros en el suelo del bosque en Las Unamas y Porce, respectivamente. Para el marcaje de los frutos, cada uno fue atravesado con alambre de pesca y se amarró a este un hilo resistente de 50 cm de largo, al final del cual se colocó una cinta reflectiva (móviles). En otros, se amarró al alambre un carretel de hilo que se dejó amarrado a la base de un arbusto, permitiendo que el hilo saliera libremente (fijos) (Forget y Wenny 2005). La ubicación exacta de cada fruto en el suelo se señalizó con banderines. Se dejaron mínimo 5 noches, y finalmente, se revisó si el fruto era removido. El fruto era buscado en un radio de 10 m a partir de la ubicación del banderín, si no era hallado se anotaba como dispersado más de 10 m. Para los frutos hallados, se registraba a qué distancia era removido, a dónde era llevado y en qué estado de consumo se encontraba (pelado, roído, partido) (Silva y Tabarelli 2001).
Medidas indirectas de distancias de dispersión de semillas y establecimientos de plántulas. En un área de una hectárea se hicieron 100 cuadrantes de 10 x 10 m y en el vértice de cada cuadrante se hizo una sub-parcela de 1 m2. En Porce, se hicieron 300 sub-parcelas (100 en cada fragmento) y 270 en Las Unamas. En cada sub-parcela, se contó el número de semillas (tanto intactas como comidas y atacadas por insectos distancia del centro del cuadrante al vecino reproductivo más cercano. Es decir, la distancia a aquella palma que mostrara un evento reproductivo relacionado con las semillas o plántulas halladas (racimos en el tronco, racimos caídos o semillasplántulas en el suelo del vecino reproductivo). El objetivo de esta medida fue determinar distancias de dispersión de semillas y establecimiento de plántulas, dado que por su tamaño y peso las semillas de O. bataua deben ser transportadas por la fauna para poder dispersarse de la palma parental o vecino reproductivo más cercano. Para determinar si existen diferencias entre las distancias de semillas y plántulas al adulto reproductivo entre las áreas comparadas, se aplicó la prueba no paramétrica de Mann-Whitney con un valor p de significancia de 0,05.
RESULTADOS
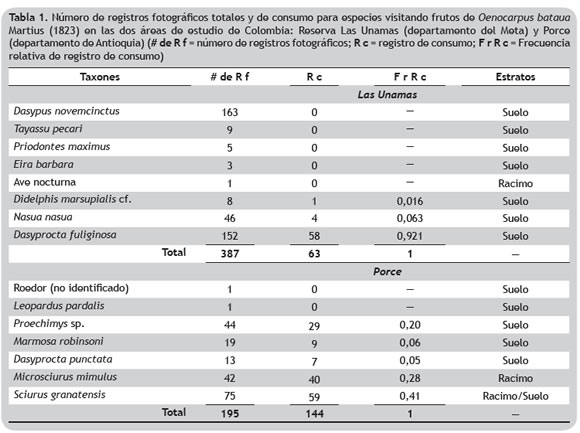
Registro de frugivoría con trampas fotográficas. En Las Unamas se registraron ocho especies de vertebrados, de las cuales Dasypus novemcinctus y D. fuliginosa tuvieron la mayor cantidad de fotografías. La especie D. novemcinctus no puede ser considerado frugívoro de O. bataua debido a la estructura de su aparato bucal, sin embargo, este mamífero puede estar ayudando a controlar las poblaciones de insectos depredadores tales como brúquidos (Coleoptera: Bruchidae) que perforan las semillas y posiblemente también ayuden a reducir la agregación o densidad de las semillas al remover y escarbar en el suelo. Tres especies fueron fotografiadas consumiendo frutos de O. bataua en Las Unamas: D. fuliginosa, Didelphis marsupialis cf. y N. nasua. Aunque P. tajacu no tuvo registros consumiendo, fue fotografiado cerca de los frutos y no se descarta como frugívoro de esta palma en la zona. Por otra parte, en Porce se registraron siete especies, de las cuales D. punctata, Marmosa robinsoni, Microsciurus mimulus, Proechimys sp. y Sciurus granatensis fueron fotografiadas consumiendo frutos (tabla 1).
En Las Unamas, la mayor cantidad de registros y consumo de frutos se obtuvieron en el suelo, mientras que en racimos solo se tuvo un registro de visita de un ave nocturna. Esto contrasta con lo encontrado en Porce (Rojas-Robles et al. 2012), donde la mayor cantidad de registros de consumo se presentaron en frutos en racimos por especies de ardillas M. mimulus y S. granatensis.
Observaciones focales de frugivoría. La única especie observada directamente consumiendo en Las Unamas fue Sapajus apella [denominada antes como Cebus apella (Defler 2012)]. Este primate fue observado solo dos veces consumiendo frutos verdes y maduros de O. bataua, ingiriendo el mesocarpo sin romper la semilla y dejándola caer al suelo bajo la palma. En una de las visitas hizo principalmente actividades de forrajeo en las vainas de las hojas, buscando probablemente insectos, y dedicó menos tiempo al consumo de frutos maduros de la palma. Por otro lado, en Porce se observaron tres especies visitando los racimos maduros: la urraca Cyanocorax affinis (7 visitas), las ardillas M. mimulus (68 visitas) y S. granatensis (22 visitas) (tabla 1). Aunque C. affinis no fue observada consumiendo frutos, esta ave contribuyó a su remoción en menor grado con respecto al papel de las ardillas, quienes además de consumidoras son dispersoras de los frutos desde 4 hasta 63 m de distancia del racimo (Rojas-Robles et al. 2012).
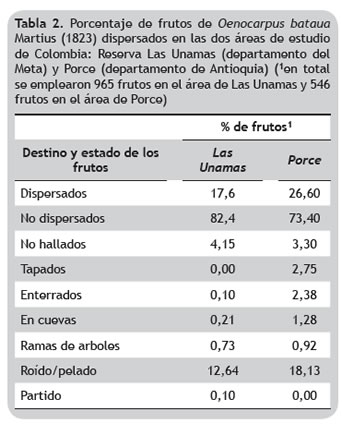
Medidas directas de dispersión de frutos. En Las Unamas, del total de frutos colocados, fueron removidos 17,6%, de los cuales 40 frutos (4,15%) no se encontraron, es decir, fueron dispersados a más de 10 m. 12,4% fueron roídos o pelados, 0,1% se encontraron partidos; y 1,04% fueron enterrados, llevados a cuevas o subidos a ramas de árboles (tabla 2). Los frutos subidos a ramas pudieron ser llevados allí por primates, que se observaron en el suelo, o roedores que no fueron registrados por las cámaras trampa, ya que los frutos fueron roídos e incluso el cable con el que se sujetaron presentaba marcas de haber sido roído. Por otro lado, en Porce se obtuvieron frecuencias mayores donde, de los 546 frutos marcados y colocados en el suelo del bosque, 26,6% fueron dispersados y 18,13% fueron roídos o pelados (Rojas-Robles et al. 2012) (tabla 2). En general, la cantidad de frutos dispersados en las dos áreas estudiadas fue significativamente diferente (Mann- Whitney, p < 0,05).
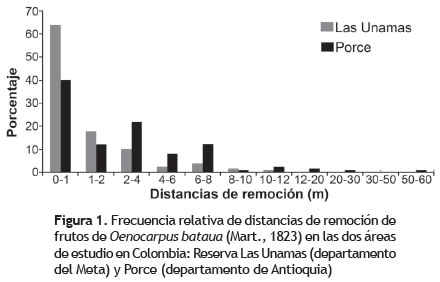
Las distancias de remoción en Las Unamas estuvieron entre los 0,1 y 10 m, obteniendo una distancia promedio de 1,38 m (DE = 1,93; n = 130), siendo las más frecuentes aquellas que están en el rango de 0 a 3 m. En Porce, la distancia media de remoción de frutos fue 3,39 m (DE = 5,71; n = 125), con valores entre los 0,16 y 53 m, la mayoría de las distancias no sobrepasaron los 8 m (figura 1). Se comparó estadísticamente si existían diferencias entre las distancias de dispersión de cada sitio, teniendo en cuenta solo los valores que estaban dentro del rango del radio de búsqueda (10 m), ya que los valores extremos encontrados en Porce sesgarían la comparación. Las distancias entre los dos sitios mostraron diferencias significativas (Mann- Whitney, p < 0,05).
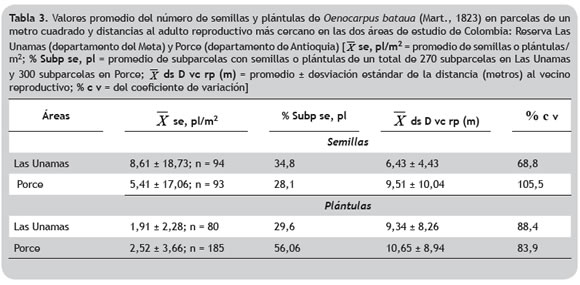
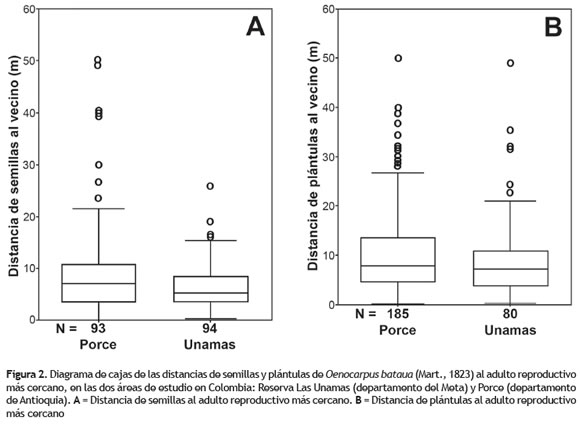
Medidas indirectas de distancias de dispersión de semillas y establecimientos de plántulas. En promedio para Las Unamas se encontró mayor cantidad de semillas/m2 y mayor porcentaje de subparcelas con semillas, con respecto a lo registrado para Porce (Rojas-Robles et al. 2012). Sin embargo, la distancia promedio de las semillas al adulto reproductivo más cercano fue mayor en Porce que en Las Unamas. Por otro lado, en Porce se observó mayor cantidad de subparcelas con plántulas y de plántulas/m2 que lo encontrado en Las Unamas. En general, las distancias halladas en ambas áreas de muestreo son bastante heterogéneas (coeficiente de variación entre 68,8 y 105,5%) (tabla 3).
Las distancias de semillas y plántulas al adulto reproductivo más cercano no mostraron diferencias significativas entre las dos áreas estudiadas (Mann-Whitney, p > 0,05). En Las Unamas, las distancias de las semillas no excedieron los 25,6 m, mientras que en Porce se registraron distancias hasta de 50 m. Para plántulas, en Las Unamas se registraron distancias hasta de 50 m similar a lo encontrado en Porce (figura 2).
DISCUSIÓN
En el trópico los vertebrados de mediano y gran tamaño son los principales agentes dispersores de semillas grandes. Sin embargo, esta relación planta-animal está amenazada por la cacería y la fragmentación de hábitat. La especie O. bataua, es una palma que se encuentra en bosques primarios y es fuente abundante de alimento para la fauna silvestre, por lo que la pérdida o reemplazo de dispersores afectaría la estructura de las comunidades, y, a largo plazo podría ocasionar cambios evolutivos en las características de las semillas, afectando así procesos de germinación y establecimiento, como ha sido encontrado recientemente por Galetti et al. (2013).
Ensamblaje de frugívoros y dispersores. Los registros puntuales de frugivoría para O. bataua abarcan 14 especies de aves y 13 de mamíferos (Bodmer 1991, Kahn y Granville 1992, Peres 1994a, Sist 1989, Stevenson et al. 2000, Zona y Herderson 1989), exhibiendo un variado y abundante ensamblaje de frugívoros. En el estudio realizado en Las Unamas, que presenta bosques continuos conectados y un buen estado de conservación con alta riqueza faunística, se registraron cuatro especies, la mayoría de mediano tamaño, consumiendo y potencialmente dispersando frutos de O. bataua.
En Porce, cuya historia de disturbios indica un menor estado de conservación, tala selectiva, mayor efecto de fragmentación, desconectividad entre fragmentos y defaunación, se registraron cinco especies de frugívoros, siendo principalmente pequeños mamíferos como el marsupial M. robinsoni, M. mimulus, Proechimys sp. y S. granatensis, todos potenciales dispersores.
De las especies frugívoras de O. bataua registradas en Las Unamas, todas pueden ser dispersoras de semillas. El género Dasyprocta, que presentó la mayor cantidad de registros de consumo, come, dispersa y entierra frutos de esta palma (Rojas-Robles et al. 2012, Vargas 2008) y de otras palmas con semillas grandes (Andreazzi et al. 2009). Así, es probable que D. fuliginosa sea responsable de la remoción de los frutos marcados que no fueron hallados en el radio de búsqueda. Estos roedores además olvidan muchas veces los frutos enterrados, favoreciendo el reclutamiento de las plántulas que escapan de la depredación (Galetti et al. 2006, Smythe 1978), evitando la mortalidad denso-dependiente (Schupp 1992) y depositando las semillas en micrositios con microclimas favorables para su germinación (Brewer y Rejmánek 1999, Galetti et al. 2006). Otro roedor de tamaño mediano también presente en Las Unamas que puede consumir frutos de O. bataua es C. paca. Aunque en Porce fue registrada D. punctata, su presencia fue muy baja y su proporción de registros de consumo fue la menor (tabla 1), debido posiblemente a la presión de cacería en el área. De todas maneras, su presencia es importante teniendo en cuenta sus hábitos de forrajeo y manipulación, que incluyen el transporte de frutos a puntos alejados del lugar donde encuentran el alimento (Smythe 1978).
Por otro lado, D. marsupialis cf. es dispersor potencial de esta palma en Las Unamas, como ocurre con el marsupial M. robinsoni en Porce. Se destaca el consumo por N. nasua que no ha sido registrado antes como consumidor ni dispersor de esta palma. Este prociónido omnívoro consume frutos como parte importante de su dieta, contribuyendo a la dispersión a grandes distancias de varias plantas incluyendo la palma Syagrus romanzoffiana (Aguiar et al. 2011, Alves-Costa y Eterovick 2007). Otras especies del género Nasua también consumen y son agentes dispersores de palmas como Attalea butyracea y Oenocarpus mapora (Andreazzi et al. 2009).
Especies como P. tajacu, el cual fue fotografiado cerca de los frutos de O. bataua –aunque no consumiendo– y T. pecari, consumen y dispersan los frutos de O. bataua en la Amazonia (Bodmer 1991, Cabrera y Wallace 2007, Miranda et al. 2008, Painter 1998) y el Chocó biogreográfico (Palacios-Mosquera et al. 2010), y también depredan las semillas. Del mismo modo, T. terrestris que se encuentra en Las Unamas, consume frutos de esta palma (Bodmer 1991, Cabrera y Wallace 2007) y de otras palmas con semillas grandes, defecándolas enteras y dispersándolas largas distancias (Fragoso 1997, Galetti et al. 2001, Tobler et al. 2010). Mazama sp., presente en Las Unamas, también ha sido observado consumiendo frutos de O. bataua en bosques amazónicos (Bodmer 1991, Gayot et al. 2004).
El único primate registrado consumiendo frutos de O. bataua en Las Unamas fue S. apella. Esta especie ha sido vista consumiendo frutos de O. bataua (Defler 2010), comiendo inclusive semillas jóvenes (Peres 1994b), como se observó en Las Unamas. Este primate es generalista, consume principalmente frutos y artrópodos, su dieta varía dependiendo del hábitat y la jerarquía de cada individuo en la tropa (Janson 1985, Janson y Boinski 1992), por lo que el registro de sus hábitos de consumo de O. bataua requiere mayor seguimiento en el área de estudio. Otros primates presentes en el área como A. brumbacki, C. ornatus y S. sciureus (Defler 2010), han sido considerados como frugívoros de O. bataua.
Por otro lado, aves de talla media, presentes en Las Unamas, son también conocidas frugívoras y dispersoras de esta palma, como Amazona ochrocephala, Penelope jacquacu, Pionites melanocephala, Pionus sp. y Ramphastus tucanus (Miranda et al. 2008, Sist y Puig 1987, Zona y Henderson 1989).
El ensamblaje de frugívoros y dispersores de O. bataua en Las Unamas con seguridad puede ser más amplio al registrado durante el tiempo de estudio, si se considera la diversidad de fauna en el área (Reserva Natural Las Unamas 2006), alguna de la cual pudo ser verificada por medio de observaciones directas, registro de huellas y rastros durante el periodo del estudio. Esta diversidad, junto con los registros de frugivoría para esta palma, permite sugerir que el ensamblaje de frugívoros de O. bataua en la región, estaría potencialmente conformado por al menos 10 especies de mamíferos y 14 de aves. En cuanto a Porce, el pobre ensamblaje de frugívoros encontrado también puede haber sido subestimado por efecto del muestreo, sin embargo, no es posible ampliarlo mucho debido al intenso proceso de alteración, fragmentación y cacería que ha llevado paulatinamente a la defaunación de los fragmentos remanentes.
De acuerdo con Rojas-Robles et al. (2012), en Porce pudo ocurrir que al desaparecer los depredadores por cacería o modificaciones del hábitat, haya aumentado el tamaño poblacional de especies de roedores y granívoros pequeños (Jordano et al. 2006). Ardillas, marsupiales, pequeños roedores y pequeñas aves granívoras generalmente no son cazados, lo que ocasionaría el aumento en sus poblaciones considerablemente en áreas defaunadas, como resultado de la falta de competidores y depredadores (Pizo y Vieira 2004). A pesar de no tener datos sobre abundancias de ardillas en Porce, fue común observarlas y escucharlas. Adicionalmente, fueron las especies más frecuentes en los focales y las únicas en los registros fotográficos en los racimos, dando cuenta de su abundancia (Rojas-Robles et al. 2012). La intensa presión sobre los frutos por parte de las poblaciones aumentadas de estos roedores, se vio reflejada en los resultados de mayor consumo y remoción en Porce que en Las Unamas. La fuerte presión sobre los frutos de O. bataua evidenciada por Rojas (2008) y Rojas-Robles et al. (2012), podría estar relacionada con la posible menor oferta en diversidad y cantidad de recursos en Porce, debido a su grado de alteración y tala selectiva.
Algunas de las razones por las cuales no se obtuvo la riqueza de frugívoros esperada para O. bataua en Las Unamas, podrían estar relacionadas con el tiempo de duración del estudio asociado a periodos de producción de frutos, disponibilidad de frutos de otras especies y competencia entre frugívoros. Durante más de un año de trabajo de campo en Las Unamas se observó disponibilidad de frutos maduros de O. bataua en el bosque, lo cual sugiere que durante todo el año esta palma puede ser una fuente permanente de alimento para la fauna silvestre. Sin embargo, se requieren estudios fenológicos para determinar si existen picos de producción anual de frutos o si la palma presenta un patrón fenológico supra-anual como se ha encontrado para esta especie en Porce (Rojas-Robles y Stiles 2009), y si se relaciona la mayor producción de frutos con la actividad de los frugívoros, como fue comprobado para Porce por Rojas-Robles et al. (2012), mostrando que a mayor producción de frutos mayor consumo por parte de los roedores, principalmente ardillas y ratas espinosas.
Distancias de dispersión y consecuencias para la distribución espacial. Contrario de lo esperado, en Las Unamas se presentó menor número de frutos dispersados (con diferencias significativas), menores distancias de dispersión (con diferencias significativas) y menores distancias al adulto reproductivo más cercano de semillas y plántulas (sin diferencias significativas) con relación a Porce.
Aunque O. bataua es una especie común en el bosque continuo de Las Unamas, encontrándose hasta 45 individuos adultos/ha (Moreno-Martínez 2011), en Porce se encontró en promedio 163 individuos adultos/ha (Rojas-Robles et al. 2008), lo cual puede sugerir mayor dependencia de la fauna a esta palma en Porce, y además, mayor probabilidad de registro de eventos de frugivoría o dispersión. Esto se asemeja a lo encontrado por Vargas (2008) en la Amazonia ecuatoriana, donde mientras la mayoría de las especies de palmas disminuye su abundancia relativa en un bosque con cacería, especies como Iriatea deltoidea y O. bataua tienden a aumentar su abundancia. De acuerdo con Rojas- Robles et al. (2008), la robustez de semillas y plántulas, expresada en una relativa baja mortalidad, nos lleva a pensar que O. bataua posee capacidad para sobrevivir en agregaciones densas. A pesar de las limitaciones en la dispersión, la alta supervivencia hace que sea una especie abundante en los bosques estudiados.
La limitada dispersión de semillas de O. bataua en las áreas de estudio, se refleja en la distribución agregada de plántulas y juveniles tanto en Porce (Rojas-Robles et al. 2008) como en Las Unamas (Moreno-Martínez 2011). Así, las cortas distancias de dispersión y de semillas y plántulas al adulto reproductivo más cercano, dadas por la ausencia de animales de talla media y grande como dispersores, y la abundante producción de frutos (Rojas-Robles 2008), pueden ser dos factores que determinan la abundancia y distribución agregada de esta palma. En un estudio reciente realizado en Porce sobre demografía e historia de vida de O. bataua (Guarín 2013), se encontró que su distribución espacial a escala de paisaje correspondía a un patrón agregado. El estudio sugiere que este patrón podría deberse a episodios de tala selectiva de árboles que crean claros en el bosque, favoreciendo el establecimiento de grupos de esta palma. Sin embargo, estas agregaciones de individuos son posibles porque previo a los eventos de apertura del dosel, que permiten la entrada de luz en el suelo del bosque, existe acumulación de semillas y plántulas favorecida por la ausencia de dispersores de mediano y gran tamaño.
Otro factor que puede influir sobre la dispersión de semillas de O. bataua. Se ha encontrado que la cacería, la fragmentación del hábitat y la tala selectiva afectan la dispersión de semillas, sin embargo, cada disturbio por separado no tiene efecto significativo sobre las tasas y distancias de remoción (Markl et al. 2012). Es decir, la dispersión es un proceso que debe ser entendido y analizado como parte de una red de interacciones que definen la estructura y funcionalidad de los ecosistemas. De acuerdo con Markl et al. (2012), la mayoría de los estudios que comparan la dispersión de semillas entre áreas perturbadas y no, tienen en cuenta el grado de defaunación o cacería, la fragmentación del hábitat y la tala selectiva. Sin embargo, no tienen en cuenta las interacciones y características de la comunidad vegetal, como la composición y riqueza florística del hábitat y la competencia que puede existir entre las plantas por dispersores. Esta situación puede ser fundamental al comparar los resultados de Las Unamas con Porce, ya que la riqueza y diversidad vegetal son diferentes en las dos áreas comparadas. Como se mencionó antes, en Porce existe mayor presión por los frutos de O. bataua a diferencia de lo que ocurre en Las Unamas donde su diversidad florística ofrece más recursos a la fauna silvestre, pero en esta investigación no se tienen datos cuantificables comparativos de las dos áreas.
En Las Unamas la composición florística de sus bosques presenta muchos elementos de la Amazonia como Astrocaryum gynacanthum, Capirona decorticans, Couma macrocarpa, Hymenaea oblongifolia, Parkia pendula y Teobroma subicanum (Ocampo 2009), además de otras especies comunes en la Orinoquia como Bactris brongniartii, Byrsonima japurensis, Dialium guianensis, Mabea nitida, O. mapora y Terminalia amazonia (Reserva Natural Las Unamas 2006). En particular, los muestreos se realizaron en el fragmento boscoso continuo más grande que se caracteriza por presentar un dosel cerrado y denso de hasta 35 m, un DAP promedio de 1,5 m y predominan especies como Iryanthera laevis, Pseudolmedia laevis y Virola sebifera (Ocampo 2009). En las zonas boscosas hay 12 especies de palmas y 123 especies de árboles donde predominan las familias Annonaceae, Burseraceae, Euphorbiaceae, Fabaceae y Moraceae, y otras como Bombacaceae, Lauraceae y Sapotaceae que son oferta alimenticia de frutos para la fauna de hábitos arborícolas y terrestres.
La especie O. bataua es sin lugar a dudas un componente importante, pues sus poblaciones representan un recurso para la fauna, además es un componente estructurante de estos bosques, por lo que una variación en sus interacciones ecológicas, en respuesta a los disturbios humanos, se reflejará en la complejidad y funcionalidad de la totalidad del ecosistema. Por tal motivo, la conservación de áreas como la Reserva Las Unamas y Porce, que pueden considerarse como refugio para la fauna, y en general, para la diversidad y funcionalidad de procesos ecológicos como la dispersión de semillas, debe considerarse como una prioridad frente a los acelerados procesos de pérdida de hábitat, fragmentación del hábitat y defaunación.
AGRADECIMIENTOS
A la División de Investigaciones de la Universidad Nacional de Colombia, sede Bogotá (DIB), a Colciencias y el Programa Jóvenes Investigadores e Innovadores ''Virginia Gutiérrez de Pineda'' que financiaron la investigación realizada en la Reserva Las Unamas. A Jordan Karubian por su apoyo en la elaboración del proyecto. A todos los compañeros que nos apoyaron en campo y a Eduardo Encizo y su familia por conservar ese hermoso lugar en el piedemonte llanero.
REFERENCIAS
Aguiar LM, Moro-Rios RF, Silvestre T, Silva-Pereira JE, Bilski DR, Passos FC, Sekiama ML, Rocha VJ. 2011. Diet of brown-nosed coatis and crab-eating raccoons from a mosaic landscape with exotic plantations in southern Brazil. Studies on Neotropical Fauna and Environment, 46 (3): 153-161. [ Links ]
Aguilar-Mena Z. 2006. Influence of the Huaorani on the conservation of Oenocarpus bataua, Arecaceae in Yasuni National Park and Biosphere Reserve, Amazonian Ecuador. Lyonia, 10: 83-90. [ Links ]
Aitken SN, Yeaman S, Holliday JA, Wang T, Curtis-McLane S. 2008. Adaptation, migration or extirpation: Climate change outcomes for tree populations. Evolutionary Applications, 1 (1): 95-111. [ Links ]
Albrecht J, Neuschulz E, Farwig N. 2012. Impact of habitat structure and fruit abundance on avian seed dispersal and fruit predation. Basic and Applied Ecology, 13 (4): 347-354. [ Links ]
Alves-Costa CP, Eterovick PC. 2007. Seed dispersal services by coatis (Nasua nasua, Procyonidae) and their redundancy with other frugivores in southeastern Brazil. Acta Oecologica, 32 (1): 77-92. [ Links ]
Andreazzi C, Pires A, Fernandez F. 2009. Mamíferos e palmeiras neotropicais: Interações em paisagens fragmentadas. Oecologia Brasiliensis, 13 (4): 554-574. [ Links ]
Asquith NM, Terborgh J, Arnold AE, Riveros CM. 1999. The fruits the agouti ate: Hymenaea courbaril seed fate when its disperser is absent. Journal of Tropical Ecology, 15: 229-235. [ Links ]
Balick MJ, Gershoff S. 1981. Nutritional evaluation of the Jessenia bataua palm. Source of high quality protein and oil from tropical America. Economic Botany, 25: 261-271. [ Links ]
Beckman NG, Neuhauser C, Muller-Landau HC. 2012. The interacting effects of clumped seed dispersal and distance and densitydependent mortality on seedling recruitment patterns. Journal of Ecology, 100 (4): 862-873. [ Links ]
Bernal R, Torres C, García N, Isaza C, Navarro J, Vallejo M, Galeano G, Balslev H. 2011. Palm Management in South America. The Botanical Review, 77 (4): 607-646. [ Links ]
Blaak G. 1992. Extracción mecánica y perspectiva para el desarrollo de una industria rural. En: Balick G, editor. Jessenia y Oenocarpus: Palmas aceiteras neotropicales dignas de ser domesticada. Roma (Italia): FAO Producción y protección vegetal. p. 63-64. [ Links ]
Bodmer RE. 1991. Strategies of seed dispersal and seed predation in amazonian ungulates. Biotropica, 23 (3): 255-261. [ Links ]
Brewer SW, Rejmánek M. 1999. Small rodents as significant dispersers of tree seeds in a Neotropical forest. Journal of Vegetation Science, 10 (2): 165-174. [ Links ]
Brodie JF, Helmy OE, Brockelman WY, Maron JL. 2009. Bushmeat poaching reduces the seed dispersal and population growth rate of a mammal-dispersed tree. Ecological Applications, 19 (4): 854-863. [ Links ]
Cabrera W, Wallace R. 2007. Patrones fenológicos de ocho especies de palmeras en un bosque amazónico de Bolivia. Revista Boliviana de Ecología y Conservación Ambiental, 21: 1-18. [ Links ]
Connell JH. 1971. On the role of natural enemies in preventing competitive exclusion in some marine animals in rain forest trees. En: Den Boer PJ, Gradwell GR, editores. Dynamics of populations: Proceedings of the advanced study institute on dynamics of numbers of populations. Wageningen (Paises Bajos): Center for Agricultural Publishing and Documentation. p. 298-310. [ Links ]
Corporación para el Desarrollo Sostenible del Área de Manejo Especial La Macarena. 2006. Resolución 2-6.06.0100 por medio de la cual se autoriza la conformación de un núcleo de reubicación de fauna silvestre. Villavicencio: CORMACARENA. Expediente N.º 5.5.2.4.06.001. [ Links ]
Cramer JM, Mesquita RC, Williamson B. 2007. Forest fragmentation differentially affects seed dispersal of large and small-seeded tropical trees. Biological Conservation, 137: 415-423. [ Links ]
Choo J, Juenger TE, Simpson BB. 2012. Consequences of frugivoremediated seed dispersal for the spatial and genetic structures of a Neotropical palm. Molecular Ecology, 21 (4): 1019-1031. [ Links ]
Defler T. 2010. Historia natural de los primates colombianos. Bogotá (Colombia): Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Biología. p. 609. [ Links ]
Defler T. 2012. Studying primates in eastern Colombia: thirty five years of a primatological life. Revista de la Academia Colombiana de Ciencias, 36 (140): 421-434. [ Links ]
Figueiredo RA. 1993. Ingestion of Ficus enormis seeds by howler monkey (Alouatta fusca) in Brazil: effects on seed germination. Journal of Tropical Ecology, 9 (4): 541-543. [ Links ]
Forget PM, Wenny DG. 2005. How to elucidate seed fate? A review of methods used to study seed removal and secundary seed dispersal. En: Forget PM, Lambert JE, Hulme PE, Vander Wall SB, editores. Seed fate. Predation, dispersal and seedling establishment. Londres (Inglaterra): CABI. p. 379-393. [ Links ]
Forget PM, Jansen PA. 2007. Hunting increases dispersal limitation in the tree Carapa procera, a Nontimber forest product. Conservation Biology, 21 (1): 106-113. [ Links ]
Fragoso JM. 1997. Tapir-generated seed shadows: scale-dependent patchiness in the Amazon rain forest. Journal of Ecology, 85: 519-529. [ Links ]
Peñuela L, Castro F, Ocampo-Peñuela N. 2011. Las reservas naturales del Nodo Orinoquia en su rol de la conservación de la biodiversidad. Bogotá (Colombia): Fundación Horizonte Verde y Resnatur. p. 104. [ Links ]
Galeano G, Bernal R. 2010. Palmas de Colombia, guía de campo. Bogotá (Colombia): Universidad Nacional de Colombia, Facultad de Ciencias, Instituto de Ciencias Naturales. p. 688. [ Links ]
Galetti M, Aleixo A. 1998. Effects of palm heart harvesting on avian frugivores in the Atlantic rain forest of Brazil. Journal of Applied Ecology, 35: 286-293. [ Links ]
Galetti M, Keuroghlian A, Hanada L, Morato MI. 2001. Frugivory and seed dispersal by the lowland tapir (Tapirus terrestris) in Southeast Brazil. Biotropica, 33 (4): 723-726. [ Links ]
Galetti M, Donatti CI, Pires AS, Guimarães Jr PR, Jordan P. 2006. Seed survival and dispersal of an endemic Atlantic forest palm: the combined effects of defaunation and forest fragmentation. Botanical Journal of the Linnean Society, 151: 141-149. [ Links ]
Galetti M, Guevara R. Côrtes MC, Fadini R, Von Matter S, Leite AB, Labecca F, Ribeiro T, Carvalho CS, Collevatti RG, Pires MM, Guimarães Jr PR, Brancalion PH, Ribeiro MC, Jordano P. 2013. Functional extinction of birds drives rapid evolutionary changes in seed size. Science 340 (6136): 1086-1090. [ Links ]
Gayot M, Henry O, Dubost G, Sabatier D. 2004. Comparative diet of the two forest cervids of the genus Mazama in French Guiana. Journal of Tropical Ecology, 20 (1): 31-43. [ Links ]
Guarín-Duque JR. 2013. Life history and demography of Oenocarpus bataua var. bataua in the Central Andean Cordillera, Colombia [Tesis de maestría]. [Medellín, (Colombia)]: Facultad de Ciencias Agrarias, Departamento de Ciencias Forestales, Universidad Nacional de Colombia. p. 74. [ Links ]
Guimarães Jr PR, Galetti M, Jordano P. 2008. Seed dispersal anachronisms: Rethinking the fruits extinct megafauna ate. PLoS ONE [Internet], 3 (3): e1745. Fecha de acceso: 12 de noviembre de 2012. Disponible en: http://www.plosone.org/article/fetchObject.action?uri=info%3Adoi%2F10.1371%2Fjournal.pone.0001745&representation=PDF. [ Links ]
Hampe A. 2011. Plants on the move: The role of seed dispersal and initial population establishment for climate-driven range expansions. Acta Oecologica, 37 (6): 666-673. [ Links ]
Henderson A, Galeano G, Bernal R. 1995. Field guide to the palms of the Americas. Princeton (U. S. A.): Princeton Univesity Press. p. 352. [ Links ]
Holbrook KM, Loiselle BA. 2009. Dispersal in a neotropical tree, Virola flexuosa (Myristicaceae): Does Hunting of large vertebrates limit seed removal? Ecology, 90 (6): 1449-1455. [ Links ]
Holdridge LR. 2000. Ecología basada en zonas de vida. Quinta reimpresión. San José (Costa Rica): Instituto Interamericano de Cooperación para la Agricultura (IICA). p. 216. [ Links ]
Holl KD, Lulow ME. 1997. Effects species, habitat, and distance from edge on post-dispersal seed predation in a tropical rainforest. Biotropica, 29 (4): 459-468. [ Links ]
Janson C. 1985. Aggresive competition and individual food consumption in wild brown capuchin monkeys (Cebus apella). Behavioral Ecology and Sociobiology, 18 (2): 125-138. [ Links ]
Janson CH, Boinski S. 1992. Morphological versus behavioral adaptation for foraging in generalist primates: The case of the cebines. American Journal of Physical Anthropology, 88: 483-498. [ Links ]
Janzen DL. 1970. Herbivores and the number of species in tropical forest. American Naturalist, 107: 501-528. [ Links ]
Janzen DL. 1971. Seed Predation by animals. Annual Review of Ecology and Systematics, 2: 465-492. [ Links ]
Jesus FM, Pivello VR, Meirelles ST, Franco GA, Metzger JP. 2012. The importance of landscape structure for seed dispersal in rain forest fragments. Journal of Vegetation Science [Internet]: 1-12. Fecha de acceso: 5 de julio de 2012. Disponible en: http://dx.doi.org/10.1111/j.1654-1103.2012.01418.x. [ Links ]
Jordano PM, Galetti MA, Pizo MA, Silva WR. 2006. Ligando Frugivoria e Dispersão de Sementes à Biologia da Conservação. En: Duarte CF, Bergallo HG, Dos Santos MA, editores. Biologia da conservação: essências. São Paulo (Brasil): Rima. p. 411-436. [ Links ]
Kahn F, Granville J. 1992. Palm communities in the forest ecosystems of Amazonia. En: Kahn F, Granville J. (editors). Palms in forest ecosystems of Amazonia. Berlin (Alemania): Springer Berlin Heidelberg. p. 41-89. [ Links ]
Karubian J, Sork V, Roorda T, Duraes R, Smith TB. 2010. Destinationbased seed dispersal homogenizes genetic structure of a tropical palm. Molecular Ecology, 19: 1745-1753. [ Links ]
Macía M, Armesilla P, Cámara-Leret R, Paniagua-Zambrana N, Villalba S, Balslev H, Pardo-de-Santayana M. 2011. Palm uses in northwestern South America: A quantitative Review. The Botanical Review, 77 (4): 462-570. [ Links ]
Malanson GP. 1996. Effects of dispersal and mortality on diversity in a forest stand model. Ecological Modelling, 87: 103-110. [ Links ]
Markl JS, Schleuning M, Forget PM, Jordano P, Lambert JE, Traveset A, Wright SJ, Böhning-Gaese K. 2012. Meta-analysis of the effects of human disturbance on seed dispersal by animals. Conservation biology, 26 (6): 1072-1081. [ Links ]
McAlpine K, Jesson L. 2008. Linking seed dispersal, germination and seedling recruitment in the invasive species Berberis darwinii (Darwin's barberry). Plant Ecology, 197 (1): 119-129. [ Links ]
McConkey KR, Prasad S, Corlett RT, Campos-Arceiz A, Brodie JF, Rogers H, Santamaria L. 2012. Seed dispersal in changing landscapes. Biological Conservation, 146 (1): 1-13. [ Links ]
McNish T. 2007. Las aves de los llanos de la Orinoquia. Bogotá (Colombia): M&B Ltda. p. 302. [ Links ]
Miranda J, Montaño F, Zenteno F, Nina H, Mercado J. 2008. El Majo (Oenocarpus bataua): una alternativa de biocomercio en Bolivia. La Paz (Bolivia): TRÓPICO - PNBS - FAN. p. 99. [ Links ]
Moreno-Martínez F. 2011. Distribución espacial de la palma Oenocarpus bataua (Arecaceae) en bosques conservados de piedemonte llanero, Orinoquia Colombiana [Tesis de pregrado]. [Bogotá (Colombia)]: Departamento de Biología, Universidad Nacional de Colombia. p. 25. [ Links ]
Ocampo N. 2009. Contribución de los elementos boscosos del paisaje a la avifauna de un bioma de sabana en San Martín (Meta, Colombia) [Tesis de pregrado]. [Bogotá (Colombia)]: Carrera Ecología, Pontificia Universidad Javeriana. p. 78. [ Links ]
Painter RL. 1998. Gardeners of the forest: Plant-animal interactions in a neotropical forest ungulate community [Tesis de doctorado]. [Liverpool (Inglaterra)]: University of Liverpool. p. 248. [ Links ]
Palacios-Mosquera L, Parra I, Mantilla-Meluk H. 2010. Datos preliminares sobre la abundancia relativa y caracterización del hábitat de Tayassu pecari (Artiodactyla: Tayassuidae) en los municipios del Medio Baudó y Cértegui en el departamento del Chocó, Colombia. Bioetnia, 7 (1): 16-22. [ Links ]
Peres CA, 1994a. Composition, density, and fruiting phenology of arborescent palms in an Amazonian terra firme forest. Biotropica, 26 (3): 285-294. [ Links ]
Peres CA. 1994b. Primate responses to phenological changes in an amazonian terra firme forest. Biotropica, 26 (1): 98-112. [ Links ]
Peres CA, Palacios E. 2007. Basin-wide effects of game harvest on vertebrate population densities in amazonian forest: implications for animal-mediated seed dispersal. Biotropica, 39 (3): 304-315. [ Links ]
Pizo MA, Vieira EM. 2004. Granivorous birds as important post-dispersal seed predators in a Brazilian forest fragment. Biotropica, 36: 417-423. Reserva Natural Las Unamas [Internet]. 2006. Reserva Natural Las Unamas. Fecha de acceso: 30 de marzo de 2013. Disponible en: http://www.lasunamas.com/habitat.html. [ Links ]
Rojas-Robles R. 2008. Fenología, frugivoría, dispersión de semillas y distribución espacial de la palma Oenocarpus bataua en tres fragmentos de bosque subandino de Colombia [Tesis de doctorado]. [Bogotá (Colombia)]: Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia. p. 95. [ Links ]
Rojas-Robles R, Correa A, Serna-Sánchez E. 2008. Sombra de semillas, supervivencia de plántulas y distribución espacial de la palma Oenocarpus bataua, en un bosque de los Andes colombianos. Actualidades Biológicas, 30: 135-150. [ Links ]
Rojas-Robles R, Stiles FG. 2009. Analysis of a supra-annual cycle: reproductive phenology of the palm Oenocarpus bataua in a forest of the Colombian Andes. Journal of Tropical Ecology, 25 (01): 41-51. [ Links ]
Rojas-Robles R, Stiles FG, Muñoz-Saba Y. 2012. Frugivoría y dispersión de semillas de la palma Oenocarpus bataua (Arecaceae) en un bosque de los Andes colombianos. Revista de Biología Tropical, 60: 1445-1461. [ Links ]
Sagnard F, Pichot C, Dreyfus P, Jordano P, Fady B. 2007. Modelling seed dispersal to predict seedling recruitment: Recolonization dynamics in a plantation forest. Ecological Modeling, 203: 464-474. [ Links ]
Schupp EW. 1992. The Janzen-Connell model for tropical tree diversity: population implications and the importance of spatial scale. The American Naturalist, 140: 526-530. [ Links ]
Silva MG, Tabarelli M. 2001. Seed dispersal, plant recruitment and spatial distribution of Bactris acanthocarpa Martius (Arecaceae) in a remnant of Atlantic forest in northeast Brazil. Acta Oecologica, 22: 289-268. [ Links ]
Sist P, Puig H. 1987. Regeneration, dynamique des populations et dissemination d´un palmier de Guyane française: Jessenia bataua (Mart.) Burret subsp. ologocarpa (Griseb. & H.Wendl.). Balick. Bull. Mus.natn. Hist. nat. Paris 4° ser. 9, sectión B. Adansonia, 3: 317-336. [ Links ]
Sist P. 1989. Strategies de regeneration de quelques palmiers en foret Guyanaise [Tesis de doctorado]. [Paris (Francia)]: Universidad de Paris. p. 297. [ Links ]
Smythe N. 1978. The natural history of the Central America agouti (Dasyprocta punctata). Smithsonian Contributions to Zoology, 257: 1-52. [ Links ]
Smythe N. 1989. Seed survival in the palm Astrocaryum standleyanum: Evidencia for dependence upon its seed dispersers. Biotropica, 21 (1): 50-56. [ Links ]
Sosnowska J, Balslev H. 2008. American palms used for medicine, in the ethnobotanical and pharmacological publications. Revista Peruana de Biología, 15 (1): 143-146. [ Links ]
Stevenson PR, Quiñonez MJ, Ahumada JA. 2000. Influence of fruit availability on ecological overlap among four Neotropical primates at Tinigua National Park, Colombia. Biotropica, 32 (3): 533-544. [ Links ]
Stoner K, Henry M. 2008. Seed dispersal and frugivory in tropical ecosystems [Internet]. International Commission on Tropical Biology and Natural Resorces. Fecha de acceso: 28 de marzo de 2012. Disponible en http://www.eolss.net/ebooks/Sample%20Chapters/C20/E6-142-TE-16.pdf. [ Links ]
Terborgh J, Pitman N, Silman M, Schichter H, Nuñez V. 2002. Maintenance of tree diversity in tropical forest. En: Levey DJ, Silva WR, Galetti M, editores. Seed dispersal and frugivory: ecology, evolution and conservation. Wallingford (Inglaterra): CABI Publishing. p. 1-17. [ Links ]
Tobler MW, Janovec JP, Cornejo F. 2010. Frugivory and seed dispersal by the lowland tapir Tapirus terrestris in the peruvian amazon. Biotropica 42 (2): 215-222. [ Links ]
Vanthomme H, Bellé B, Forget PM. 2010. Bushmeat hunting alters recruitment of large-seeded plant species in Central Africa. Biotropica, 42 (6): 672-679. [ Links ]
Vargas JH. 2008. Defaunación de dasipróctidos y sus consecuencias sobre la distribución y abundancia de palmas en el bosque amazónico [Tesis de maestría]. [Santiago (Chile)]: Facultad de Ciencias, Universidad de Chile. p. 34. [ Links ]
Venable DL, Brown JS. 1993. The population-dynamic functions of seed dispersal. En: Fleming TH, Estrada A, editores. Frugivory and seed dispersal: Ecological and evolutionary aspects. Dordrecht (Paises Bajos): Springer Science+Business Media. p. 31-55. [ Links ]
Wang BC, Sork VL, Leong MT, Smith TB. 2007. Hunting of mammals reduces seed removal and dispersal of the Afrotropical tree Antrocaryon klaineanum (Anacaridaceae). Biotropica, 39 (3): 340-347. [ Links ]
Wenny DG. 2001. Advantages of seed dispersal: A re-evaluation of directed dispersal. Evolutionary Ecology Research, 3: 51-74. [ Links ]
Westcott DA, Fletcher CS. 2011. Biological invasions and the study of vertebrate dispersal of plants: Opportunities and integration. Acta Oecologica, 37 (6): 650-656. [ Links ]
Wright J. 2002. Plant diversity in tropical forests: a review of mechanisms of species coexistence. Oecologia, 130 (1): 1-14. [ Links ]
Zona S, Henderson A. 1989. A review of animal-mediated seed dispersal of palms. Selbyana, 11: 6-21. [ Links ]