Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.37 no.102 Medellín Jan./June 2015
ARTÍCULOS DE INVESTIGACIÓN
Diversidad de la micobiota endófita de Cattleya percivaliana y Cattleya trianaei cultivadas en invernadero
Diversity of endophytic mycobiota in Cattleya percivaliana and Cattleya trianaei growing under greenhouse conditions
Pilar X. Lizarazo-Medina1,2,3, Marcelina M. Mendoza-Salazar1,4, Ana I. Gutiérrez-Gallo1,5
1 Instituto de Biología, Grupo de Investigación en Ecología Microbiana y Bioprospección, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia.
2 Docente. Instituto de Biología, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia.
Correos electrónicos: 3 pilarximenalizarazo.udea@gmail.com; 4 marcelina.mendoza@udea.edu.co; 5 anaisaguti@gmail.com.
Recibido: noviembre 2013; aceptado: septiembre 2014.
Resumen
Los microorganismos endófitos se desarrollan asintomáticamente en el interior de los tejidos. En este estudio se aislaron hongos endófitos de hojas y raíces de Cattleya percivaliana y Cattleya trianaei cultivadas bajo condiciones de invernadero. Se obtuvieron 323 hongos endófitos a partir de 4.800 fragmentos de tejido; estos aislados fueron clasificados en 14 géneros caracterizados macroscópica y microscópicamente, y cinco morfotipos no pudieron ser identificados. Se observaron diferencias en el número de plantas colonizadas por especie vegetal y en la diversidad de los endófitos a nivel de tejido, siendo mayores en C. trianaei y en hoja, respectivamente. Se identificaron géneros que colonizaron exclusivamente un tejido, o ambos tejidos. En hoja se registraron: Chromelosporium, Cladosporium, Exophiala, Gonatobotrys, Monilinia y Nodulisporium; mientras que Curvularia, Gloeosporium y cinco morfotipos no identificados colonizaron solamente la raíz. Los géneros Aureobasidium, Botryotrichum, Colletotrichum, Fusarium, Sclerotium y Trichoderma crecieron en ambos tejidos. El género Fusarium fue el género más abundante en raíz y, Colletotrichum y Sclerotium en hoja.
Palabras clave: diversidad, endófito, hongo, orchidaceae
Abstract
Endophytic microorganisms are characterized by asymptomatic development inside tissues. In this study we isolated endophytic fungi of leaves and roots from Cattleya percivaliana and Cattleya trianaei grown under greenhouse conditions. We isolated 323 endophytic fungi from 4,800 tissue fragments: these isolates were classified into 14 genera characterized macroscopically and microscopically, and five morphotypes could not be identified. A higher number of individuals of C. trianaei were colonized by fungi, and a higher diversity of endophytes were found in leaves. Some genera exclusively colonized one tissue, or both tissues. In leaves, we registered Chromelosporium, Cladosporium, Exophiala, Gonatobotrys, Monilinia, and Nodulisporium while Curvularia, Gloeosporium, and five unidentified morphotypes only colonized roots. The genera Aureobasidium, Botryotrichum, Colletotrichum, Fusarium, Sclerotium, and Trichoderma grew on both tissues. Fusarium was the most abundant genus in roots and, Colletotrichum and Sclerotium in leaf tissue.
Key words: diversity, endophyte, fungi, orchidaceae
INTRODUCCIÓN
La familia Orchidaceae es una de las más diversas con aproximadamente 20.000-35.000 especies, de las cuales 10.849 están registradas en el trópico (Pridgeon 1996, Tan et al. 2012). En Colombia, se han registrado más de 3.500 especies y 1.745 de estas se encuentran en la región andina, esta diversidad y la exuberancia de sus flores han hecho que su cultivo y exportación sean de interés comercial y económico para el país (Angel et al. 2001, Sarmiento y Betancur 2006).
Las orquídeas constituyen uno de los grupos más estudiados en la interacción planta-microorganismo debido a la dependencia de hongos micorrícicos para su nutrición (Yagame et al. 2012). Al interior del tejido vegetal de este grupo también se pueden desarrollar hongos endófitos no micorrícicos (Schulz et al. 2006), los cuales se establecen en los espacios intercelulares, sin inducir síntomas o signos visibles y se diferencian de las endomicorrizas porque no forman pelotones al interior de las células vegetales (Hyde y Soitong 2008).
Los hongos endófitos han sido clasificados como clavicipitaceos y no clavicipitaceos, y se diferencian, entre otras características, por el tipo de transmisión, siendo principalmente vertical en el primero y horizontal en el segundo. Estos procesos de transmisión se han relacionado con la diversidad de la comunidad endófita en la planta; en la vertical un genotipo dominante coloniza la planta (Rodríguez et al. 2009), mientras que en la horizontal la incidencia y la riqueza aumentan conforme a la edad, como consecuencia de varios eventos de infección a lo largo del tiempo (Arnold et al. 2003). La riqueza e incidencia de hongos endófitos son mayores en el trópico, presentándose al menos una especie de estos endosimbiontes por planta (Arnold y Lutzoni 2007).
La presencia de hongos endófitos en orquídeas se ha encontrado en plantas desarrollándose en ambientes naturales, en su mayoría en el neotrópico (Bayman y Otero 2006). Entre los géneros que han sido estudiados están: Anacamptis, Ophrys, Orchis, Serapias (Gezgin y Eltem 2009), Bletilla (Tao et al. 2012), Bulbophyllum, Vanda (Sudheep y Sridhar 2012), Dendrobium (Yuan et al. 2009 y Xing et al. 2011), Holcoglossum (Tan et al. 2012), Lepanthes (Bayman et al. 1997) y Pecteilis (Chutima et al. 2011). Las especies endófitas más abundantes fueron: Aspergillus flavus en Bulbophyllum y Vanda, y Guignardia sp. en Bletilla y en Dendrobium nobile, así como los géneros Colletotrichum y Fusarium (Wang et al. 2008).
La estructura de la comunidad de estos hongos depende del tipo de tejido colonizado, de tal manera que algunas de las especies muestran especificidad por cierto tejido como consecuencia de las diversas presiones selectivas que determinan las condiciones fisiológicas de la planta, y consecuentemente el microhábitat de los endófitos (Aly et al. 2011). Al evaluar la diversidad y la tasa de colonización de hongos endófitos en orquídeas, de acuerdo al tejido vegetal, los resultados son contrastantes sin evidenciarse una tendencia. Bayman et al. (1997) observaron que las especies más frecuentes en raíces y hojas de Lepanthes fueron Rhizoctonia spp. y Xylaria spp., por el contrario en D. nobile se registró la colonización exclusiva tanto en raíces (Clonostachys rosea, Fusarium solani y Trichoderma chlorosporum) como en hojas de especies diferentes (Colletotrichum sp. 2. y Hypoxylon sp. 2.) (Yuan et al. 2009).
Respecto a la función de los hongos endófitos en la interacción con su hospedero, Arnold (2007), Sieber (2007) y Slippers y Wingfield (2007) sugirieron que la relación es de tipo mutualista disminuyendo la depredación de las plantas, favoreciendo la resistencia a condiciones de estrés, y como mencionaron Rubini et al. (2005), confiriéndoles protección contra microorganismos fitopatógenos. En orquídeas fue observado el papel de estos hongos como promotores de crecimiento y su efecto mejorando la aclimatación y el vigor de las plántulas micropropagadas (Yuan et al. 2009, Chen et al. 2010). Los hongos endófitos también han sido reconocidos por la producción de metabolitos secundarios con propiedades antimicrobianas, antiparasitarias y anticancerígenas (Aly et al. 2011) o de moléculas de interés industrial como las celulasas (Cabezas et al. 2012).
Considerando la riqueza de especies de orquídeas en nuestro país y la importancia ecológica de los hongos endófitos, en este estudio se determinó la diversidad y composición de la micobiota endófita en dos especies del género Cattleya cultivadas en invernadero y se comparó la estructura de la comunidad de acuerdo al microhábitat colonizado (foliar o radicular) en cada una de las especies.
MATERIALES Y MÉTODOS
Aislamiento de hongos endófitos. Las plantas de C. percivaliana y C. trianaei fueron recolectadas en el invernadero El Cerro, de la Sociedad Colombiana de Orquideología (SCO), ubicado en el municipio de Fredonia (Antioquia), Colombia, a 1.920 m. s. n. m.
Por cada planta se analizaron dos tejidos, una hoja y una raíz, muestreándose en total 50 hojas y 50 raíces sanas de mayor edad (las que mostraron mayor tamaño y espesor) por especie. De cada hoja y raíz sin velamen se tomó un fragmento de tejido que fue desinfectado superficialmente de forma individual en soluciones estériles, de acuerdo con el protocolo establecido por Unterseher y Schnittler (2009) con modificaciones. Los fragmentos se sumergieron en agua destilada estéril durante 30 s tres veces, y posteriormente, en solución de etanol 70% durante 60 s, seguido por lavado en hipoclorito de sodio 1% durante 5 min y etanol 70% por 30 s. Finalmente, los fragmentos se enjuagaron en agua destilada estéril para eliminar el exceso de hipoclorito y etanol y se secaron con papel absorbente estéril. De cada fragmento se retiró la fracción de 3 mm de los bordes para eliminar las regiones que pudieron haber sufrido oxidación. Cada tejido de hoja y de raíz desinfectado se cortó en 34 fragmentos de 5 mm2 y 5 mm, respectivamente, de los cuales 24 fueron colocados en la superficie de agar papa dextrosa (PDA, Merck). Diez fragmentos se emplearon como control para determinar la viabilidad tisular posterior a la desinfección mediante el protocolo de la sal de tetrazolio según Dixon y Gonzales (1994). Los cultivos fueron incubados durante 15 días a temperatura ambiente registrando cada 24 h la presencia o ausencia de colonias en el medio. Como control del proceso de desinfección se sembraron en PDA cinco alícuotas de 1 ml del agua destilada del enjuague final, ya que si la eliminación de la microbiota epífita fue efectiva esta solución debe estar estéril. Los controles también fueron incubados por 15 días. Los fragmentos en los que no se observó desarrollo de micelio fueron sometidos a análisis de viabilidad para garantizar que la ausencia de crecimiento no fue causada por la muerte del tejido (Dixon y Gonzales 1994).
Identificación de los hongos endófitos. Se obtuvieron cultivos axénicos a partir de las colonias que se desarrollaron en los tejidos. La identificación taxonómica de los hongos se realizó considerando los caracteres macroscópicos y microscópicos. Las descripciones morfológicas de las colonias se realizaron a los 10 días de cultivo en PDA. La caracterización microscópica se realizó mediante la técnica de microcultivo en PDA, agar avena y agar V8.
El microcultivo fue coloreado con azul de lactofenol y/o rojo fenol a los 15 días de incubación. La identificación se realizó siguiendo las claves de Barnett y Hunter (1998).
Análisis de los datos. La incidencia de hongos endófitos fue comparada a nivel de especie y tejido, también se realizó un análisis intraespecífico comparando ambos tejidos. Estas comparaciones se hicieron mediante prueba de Chi-cuadrado utilizando el software IBM SPSS 20.
La frecuencia de colonización (% FC) de cada género por tejido fue calculada como la relación entre el número de fragmentos positivos para el género y el número total de fragmentos muestreados, expresado como un porcentaje:
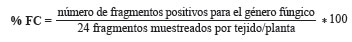
La abundancia relativa se definió como el número de aislados por género dividido el número total de aislados por especie vegetal en cada tejido.
Los índices Jaccard, Shannon y Simpson, la riqueza estimada y las curvas de acumulación de los géneros endófitos se calcularon en EstimateS 9.0 y para el análisis de cada resultado se consideró la especie vegetal hospedera, el tejido y los géneros identificados en cada una de estas.
RESULTADOS
Riqueza y diversidad de la micobiota endófita. Se obtuvieron aislados fúngicos a partir de los tejidos foliares y radiculares de las dos especies de Cattleya cultivadas en condiciones de invernadero. El protocolo de desinfección empleado en este estudio para eliminar la microbiota epífita fue efectivo y no se observó crecimiento de microorganismos en el control de esterilidad. La prueba de tetrazolio indicó que la desinfección no afectó la viabilidad de ningún fragmento vegetal, tanto en los evaluados posterior al proceso, como en los que no se observó crecimiento a los 15 días de incubación.
Se evaluaron 1.200 fragmentos de hoja y la misma cantidad de raíz a partir de 50 plantas de C. trianaei y 50 de C. percivaliana. El crecimiento de hongos endófitos en los fragmentos se evidenció después de ocho días de incubación. La incidencia de la micobiota endófita no varió significativamente a nivel de tejido y especie (tejido: X2 = 0,128; especie: X2 = 0,151; P > 0,05); así como tampoco ocurrió en comparaciones realizadas intraespecíficamente (hoja y raíz en C. trianaei X2 = 0,373; hoja y raíz en C. percivaliana X2 = 0,183 P > 0,05). La totalidad de fragmentos positivos fue 6,7%, a partir de los que se obtuvieron 323 aislados fúngicos clasificados en 14 géneros y 5 morfotipos que a pesar de no ser identificados se determinó que corresponden a géneros diferentes.
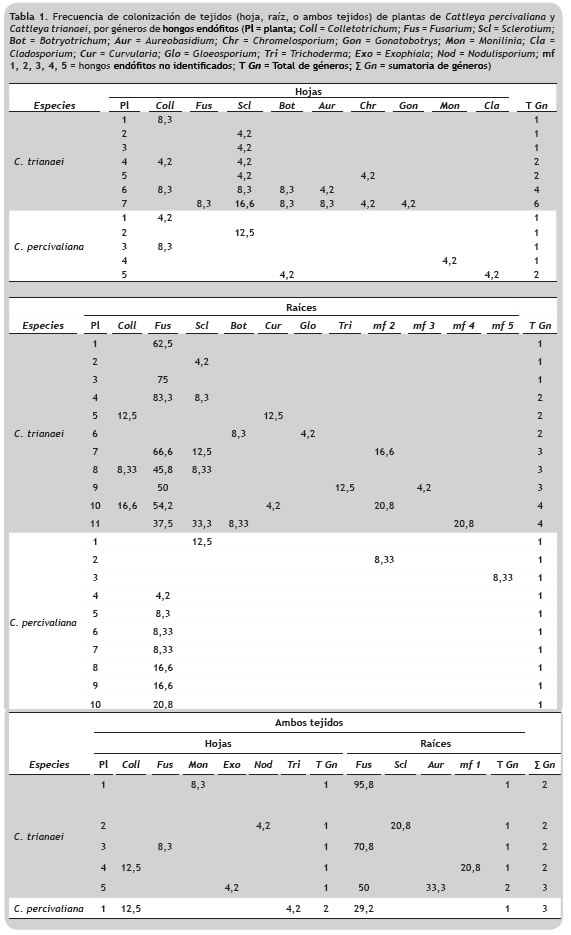
En C. trianaei 23 plantas fueron colonizadas, lo que correspondió al 46% de las muestras, de las cuales 5 fueron positivas en los dos tejidos evaluados. Se obtuvieron 276 fragmentos positivos (36 foliares y 240 radiculares), colonizados por 17 géneros. En las muestras de C. percivaliana el porcentaje de plantas positivas fue inferior, 32% (16 plantas), y solamente en una se observó crecimiento tanto en hoja como en raíz. Se registraron 47 fragmentos positivos (13 foliares y 34 radiculares) colonizados por 9 géneros (tabla 1).
El análisis de colonización de acuerdo al tejido indicó que en las dos especies se presentaron plantas con endófitos únicamente a nivel foliar, radicular o en ambos tejidos; en C. trianaei de las 23 plantas colonizadas se registraron 7 (30,4%), 11 (47,8%) y 5 (21,7%), respectivamente, mientras que de las 16 colonizadas de C. percivaliana estos valores fueron mayores para hoja y raíz, 5 (31,2%) y 10 (62,5%), y solamente en una planta se observó la presencia de endófitos en los dos tejidos (6,3%).
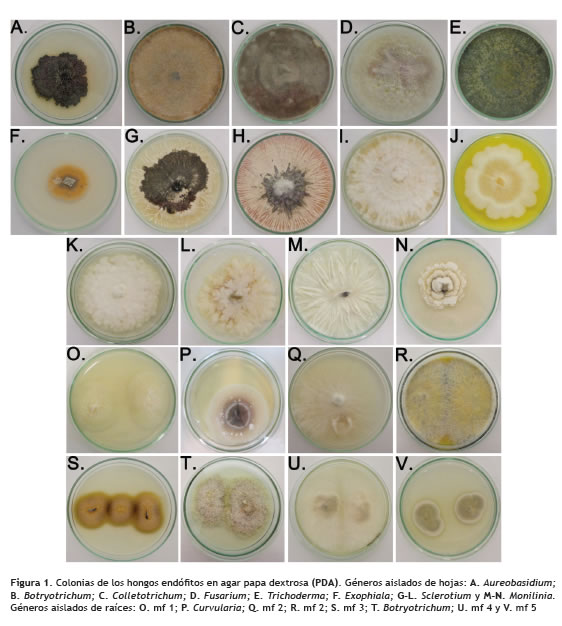
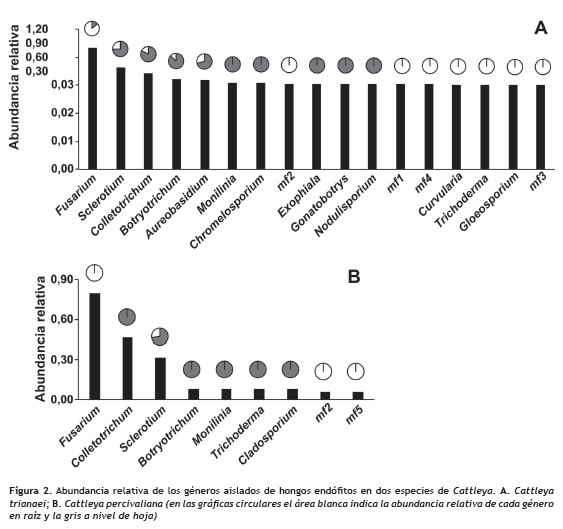
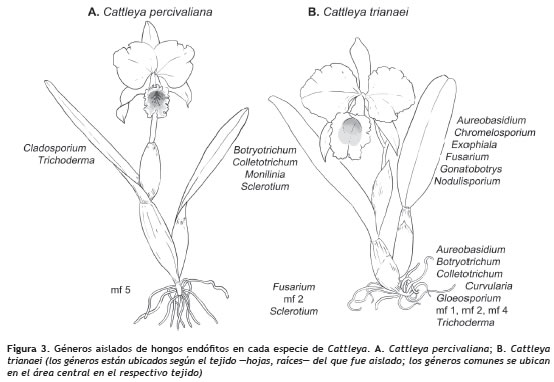
Los endófitos aislados fueron clasificados en 19 géneros y cinco de estos que no presentaron estructuras que permitieran la identificación taxonómica se denominaron como mf 1, mf 2, mf 3, mf 4 y mf 5 (figura 1). De acuerdo con las observaciones microscópicas mf 1 podría corresponder a Epicoccum, en mf 2 se observaron gránulos phaeoides por lo que podría ser clasificado como Botryotrichum, Humicola o Phymatotrichum; mf 3 fue similar a Phialophora o Chloridium, y de mf 5 no se observaron estructuras características que permitieran la aproximación a algún género. El género Fusarium fue el más abundante a nivel de raíz en las dos especies, mientras que en la hoja fueron Colletotrichum y Sclerotium (figura 2).
En las plantas de C. trianaei se identificaron 17 géneros, de los cuales se reportaron 10 en hoja y 12 en raíz. Los géneros aislados exclusivamente de las hojas de C. trianaei fueron Chromelosporium, Exophiala, Gonatobotrys, Monilinia y Nodulisporium, mientras que en raíz fueron Curvularia, Gloeosporium, mf 1, mf 2, mf 3, mf 4, y Trichoderma. Los géneros que se registraron en los dos tejidos correspondieron a Aureobasidum, Botryotrichum, Colletotrichum, Fusarium y Sclerotium (figura 3). En C. percivaliana se aislaron 9 géneros, de los cuales se presentaron 6 en hoja y 4 en raíz. Los géneros aislados exclusivamente en las hojas de C. percivaliana fueron Botryotrichum, Cladosporium, Colletotrichum, Monilinia y Trichoderma, mientras que en raíz se identificaron Fusarium, mf 2 y mf 5, y en los dos tejidos se registró Sclerotium (figura 3).
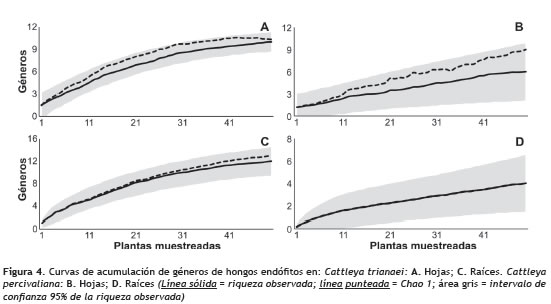
La riqueza observada en las dos especies vegetales en cada tejido fue similar a la estimada (Chao1) excepto en hojas de C. percivaliana, y de acuerdo con los valores de la pendiente (C. trianaei hoja = 0,06 y raíz = 0,084; C. percivaliana hoja = 0,04 y raíz = 0,036) el inventario es confiable (Jiménez y Hortal 2003) (figura 4).
En plantas de C. trianaei colonizadas únicamente en tejido foliar el 42,8% presentó un género por planta, 28,6% 2 géneros, 14,3% 4 géneros y el número máximo fue 6 géneros por planta (14,3%). Sclerotium fue el género dominante aislándose de 6 plantas y con mayor frecuencia de colonización (% FC = 17) (tabla 1). En plantas colonizadas únicamente en la raíz los géneros por planta variaron entre 1 y 4, plantas en las que se observó 1, 2 y 3 géneros correspondieron a 27,3% en cada caso, mientras que las que presentaron 4 géneros representaron 18,2%. Fusarium fue el género dominante (72,7%), colonizando en una de las plantas el 83,3% de los fragmentos analizados. El 60% de las plantas colonizadas en los dos tejidos presentaron dos géneros diferentes, uno en cada tejido, en el 20% se registraron tres géneros, uno en la hoja (Exophiala) y dos en la raíz (Aureobasidium y Fusarium) y en el 20% restante se observó que Fusarium fue el único género aislado en los dos tejidos, además fue el género dominante en la raíz de plantas que presentaron colonización simultánea (tabla 1).
Las plantas de C. percivaliana fueron colonizadas por nueve géneros, seis de estos se identificaron en hoja y cuatro en raíz. Cinco plantas presentaron endófitos únicamente en la hoja, del 80% de estas se aisló solamente un género por planta, mientras que el 20% restante fue colonizado por dos géneros. Colletotrichum fue el género que se asoció a mayor número de plantas, aislándose a partir de dos de las cinco, con % FC de 4,2 y 8,3; y Sclerotium fue el endófito del que se registró mayor frecuencia de colonización. Las plantas colonizadas únicamente en raíz presentaron un género por planta, Fusarium fue el más dominante y también presentó mayor frecuencia de colonización. La única planta positiva en ambos tejidos presentó tres géneros, Colletotrichum (% FC = 13) y Trichoderma (% FC = 4,2) en hoja y Fusarium (% FC = 29) en raíz (tabla 1).
En las dos especies a nivel de hoja los géneros en común fueron Botryotrichum, Colletotrichum, Monilinia y Sclerotium; y en raíz Fusarium, Sclerotium y mf 2. Al comparar en cada especie de Cattleya la comunidad de endófitos de hoja y de raíz, la similitud fue mayor en C. trianaei (Jaccard = 0,29) que en C. percivaliana (Jaccard = 0,11). También se observaron diferencias al contrastar un mismo tejido entre las dos especies, con cuatro géneros compartidos en hoja (Jaccard = 0,3) y tres en raíz (Jaccard = 0,231).
Los índices de Shannon y Simpson mostraron que la diversidad fue mayor en C. trianaei que en C. percivaliana y al comparar los valores de la diversidad a nivel de tejido esta fue mayor en hoja que en raíz (tabla 2).
DISCUSIÓN
Las plantas interactúan con comunidades microbianas establecidas en la superficie y al interior de sus tejidos, constituyendo un sistema complejo denominado microbioma que da lugar a interacciones positivas y negativas (Newton et al. 2010). Entre estas comunidades se encuentran los microorganismos endófitos, los cuales colonizan asintomáticamente el interior de los tejidos estableciéndose como mutualistas, comensalistas o en algunos casos patógenos o saprófitos latentes (Porras- Alfaro y Bayman 2011).
Los métodos para el estudio de microorganismos endófitos requieren estricta garantía de que la comunidad epífita ha sido eliminada, de tal forma que se seleccione y desarrolle únicamente la microbiota que se encuentra al interior del tejido. Convencionalmente, el aislamiento de hongos endófitos se ha efectuado mediante desinfección superficial asegurando que además de eliminar la microbiota acompañante, la viabilidad del tejido no se vea afectada y los microorganismos endófitos puedan desarrollarse (Schulz et al. 1993). La efectividad de un protocolo de desinfección, además de los controles propuestos, puede evaluarse de acuerdo al tiempo de aparición de los microorganismos en el medio, siendo menor el de los epífitos que el de los endófitos (Arnold 2007). En este estudio el desarrollo de la micobiota endófita del tejido foliar y radicular de C. trianaei y C. percivaliana se observó a partir de una semana de incubación, al igual que lo reportado por Sudheep y Sridhar 2012, y no se detectó crecimiento en los cultivos realizados en el agua de enjuague, lo que indicó una desinfección correcta del tejido.
El estudio de la riqueza y diversidad de hongos endófitos ha permitido hipotetizar que una planta puede estar colonizada por al menos un endófito (Arnold y Lutzoni 2007), sin embargo, en este estudio el porcentaje de plantas positivas fue inferior respecto a lo reportado en otras especies de orquídeas. En otro estudio se observó que el 100% de los tejidos analizados de Dendrobium devonianum y Dendrobium thyrsiflorum fueron colonizados (Xing et al. 2011). Todos los tejidos fueron viables después del tiempo de incubación lo que indicó que la ausencia de colonización observada en este trabajo no fue efecto de la pérdida de la integridad del tejido.
En total se identificaron 19 géneros, la mayoría de los aislados se observaron en su estado anamórfico y cinco morfotipos no pudieron ser identificados. Es frecuente que se presente esta dificultad en los estudios de diversidad de hongos endófitos y se debe principalmente a que estos no esporulan en medios de cultivos artificiales y a que en su mayoría no han sido descritos (Bayman y Otero 2006). En la actualidad algunas de las de herramientas moleculares, como el uso de la secuenciación de las regiones ITS (Internal Transcribed Spacer) permiten la identificación de estos aislados (Chen et al. 2011).
Los géneros identificados en este estudio que se han reportado en orquídeas epífitas, fueron Colletotrichum en Encyclia fragrans, Fusarium en Epidendrum porpax, Trichoderma en Lepanthes caritensis, Cladosporium en Pleurothallis periodica, Sclerotium en Dendrobium, y Aureobasidium y Curvularia en plantas no identificadas. Además se identificaron géneros aislados exclusivamente de hoja, de raíz o de ambos tejidos, sin embargo, no se puede indicar que la presencia de un género en un tejido o especie sea un caso de especificidad ecológica considerando la cantidad de factores que influyen en la colonización, la diversidad de hongos endófitos y la detectabilidad del método de estudio, siendo necesaria la validación de este fenómeno. En orquídeas no hay evidencia de hongos endófitos hospedero-específico, los endófitos que se han registrado corresponden a especies aisladas en otras plantas. En las orquidáceas se ha evidenciado que las diferencias en la composición de especies se presentan dependiendo del hábito de crecimiento de cada planta, por ejemplo, en las terrestres Phialocephala es el género más frecuente, mientras que en las epífitas se han reportado Epicoccum, Hadrotrichum, Lasiodiplodia, Pestalotiopsis y Xylaria (Bayman y Otero 2006).
En este estudio las curvas de acumulación de especies indicaron que la riqueza observada fue similar a la estimada, lo que sugiere que los géneros no detectados están representados por microorganismos con algún requerimiento especial o de lento crecimiento (Vartoukian et al. 2010) los cuales no se desarrollan bajo las condiciones experimentales empleadas en este estudio.
A nivel de especie y tejido se observaron diferencias en la composición de las comunidades de endófitos, como lo observado en dos especies de Dendrobium (Chen et al. 2011). En este estudio la riqueza fue mayor en C. trianaei que en C. percivaliana, y a nivel de tejido no se observó una tendencia. En relación a la diversidad, se encontró que los valores de C. trianaei fueron mayores que los de C. percivaliana, y a nivel de tejido fueron menores en la raíz que en la hoja como también se observó en el género Vanda (Sudheep y Sridhar 2012).
Las diferencias en la riqueza y diversidad entre hoja y raíz establecidas en algunos estudios se han atribuido principalmente a la variedad de factores tanto bióticos, incluyendo el genotipo de la planta, como abióticos que afectan los tejidos (Aly et al. 2011, Ghimire et al. 2011). En el filoplano los microorganismos están sometidos a condiciones como la desecación y la radiación UV y el ambiente se caracteriza por ser oligotrófico, mientras que en el rizoplano las condiciones son contrastantes, con alta humedad, baja radiación y alto contenido de materia orgánica (Atlas y Bartha 1997, Gamboa 2006). Estas presiones selectivas influyen en la composición y estructura de las especies asociadas a un hospedero (Arnold 2007). Bayman y Otero (2006) indicaron que hojas y raíces de orquídeas epifitas al estar en el mismo ambiente no presentan diferencias en la comunidad de hongos endófitos, tal como se evidenció en orquídeas del género Lepanthes (Bayman et al. 1997).
La mayoría de los microorganismos endófitos asociados a la hoja se establecen como epífitos y posteriormente penetran el tejido (Porras-Alfaro y Bayman 2011), los géneros Aureobasidium y Cladosporium, identificados en este estudio, se han reportado con esta capacidad (Arnold 2007).
La mayor riqueza observada en hoja por planta respecto a la de raíz podría estar explicada por el potencial del endófito para colonizar, establecerse e inhibir el desarrollo de otros endófitos. Sobre esto se ha observado que en la raíz de orquídeas epífitas los hongos endófitos pueden desencadenar mecanismos de resistencia inducida mediante la producción de fitoalexinas como el orquinol, para evitar la colonización de otros hongos, endófitos o micorrícicos, afectando de esta manera la diversidad en este tejido (Schulz 2006).
Fusarium fue el único género que se desarrolló en el tejido foliar y radicular de la misma planta, colonizando con mayor frecuencia la raíz. Este género se ha registrado como endófito y patógeno de diferentes tejidos y hospederos, y también asociado a las raíces de las orquídeas promoviendo su crecimiento (Ovando et al. 2005, Tan et al. 2012, Tao et al. 2012). La especie Fusarium semitectum induce la formación del protocormo y la germinación de las semillas de Cypripedium reginae, y Fusarium proliferatum, aislado de Dendrobium moschatum, promueve su crecimiento mediante la producción de giberelinas (Tsavkelova et al. 2008). Especies de este género también han sido encontradas como patógenos, en catleyas por ejemplo Fusarium oxysporum causa la pudrición radicular provocando la muerte de la planta (Angel et al. 2001).
Colletotrichum, al igual que Fusarium se ha registrado como un endófito cosmopolita y hemibiótrofo y también como fitopatógeno y endófito dependiendo de la especie vegetal (Freeman et al. 2001). En un estudio en el que Colletotrichum acutatum, aislado de Fragaria sp., se inoculó en plantas de Capsicum annuum, Fragaria sp., Phaseolus vulgaris, Solanum melongena y Solanum lycopersicum, se observó antracnosis solamente en esta última, a pesar de encontrarse asociado a las otra especies como endófito y/o epífito sin causar enfermedad. En orquídeas este género ya ha sido aislado como endófito, y en catleyas como patógeno causando antracnosis (Angel et al. 2001), siendo este el primer reporte como endófito foliar de C. percivaliana y C trianaei. Aunque las bases genéticas de la comunicación simbiótica no han sido esclarecidas, estudios al respecto han mostrado que algunos aislados de especies fúngicas pueden desarrollarse estableciendo interacciones positivas o negativas dependiendo del genotipo del huésped colonizado (Unterseher y Schnittler 2010).
En este estudio se evidenció la presencia de endófitos en orquídeas mantenidas en invernadero, observándose diferencias en el número de plantas colonizadas y diversidad de los endófitos según la especie y tejido colonizado siendo mayor en C. trianaei y en el tejido foliar. Este es el primer reporte de la presencia de hongos endófitos no micorrízicos en especies del género Cattleya, de acuerdo con la revisión realizada por los autores. Los resultados originados de este trabajo son importantes y significativos ya que contribuyen al conocimiento de la diversidad de microorganismos endófitos del país, constituyendo la base para la realización de estudios que determinen el potencial biotecnológico de esta micobiota y su uso en la conservación de estas especies vegetales de importancia social y económica.
AGRADECIMIENTOS
Los autores agradecen al Comité para el Desarrollo de la Investigación (CODI) de la Universidad de Antioquia, en su Convocatoria 2009 de Menor Cuantía, por la financiación del proyecto de investigación: Estudio de la Micobiota Endofítica de Orquídeas Cultivadas en Invernadero. A la Corporación Académica para el Estudio de Patologías Tropicales (CAEPT) de la UDEA por la administración de los recursos económicos. A la Sociedad Colombiana de Orquideología (SCO) por la donación del material vegetal y a los miembros del Grupo Ecología Microbiana y Bioprospección (EM&B).
REFERENCIAS
Aly AH, Debbab A, Proksch P. 2011. Fungal endophytes: unique plant inhabitants with great promises. Applied Microbiology and Biotechnology, 90 (6): 1829-1845. [ Links ]
Angel CA, Tsubota A, Leguizamón J, Cárdenas M, Cháves C, Cadena G, Bustillo A. 2001. Enfermedades y plagas en Cattleyas; antecedentes e investigaciones en Colombia. Chinchiná (Colombia): CENICAFE. p. 322. [ Links ]
Arnold AE. 2007. Understanding the diversity of foliar endophytic fungi: progress, challenges and frontiers. Fungal Biology Reviews, 2: 51-66. [ Links ]
Arnold E, Mejía L, Kyllo D, Rojas E, Maynard Z, Robbins N, Herre E. 2003. Fungal endophytes limit pathogen damage in a tropical tree. Proceedings of the National Academy of Sciences, 100 (26): 15649-15654. [ Links ]
Arnold E, Lutzoni F. 2007. Diversity and host range of foliar fungal endophytes: are tropical leaves biodiversity hotspots? Ecology, 88 (3): 541-549. [ Links ]
Atlas RM, Bartha R. 1998. Microbial ecology: fundamentals and applications. 4th ed. California: Benjamin Cummings. p. 694. [ Links ]
Barnett H, Hunter B. 1998. Ilustrated genera of imperfect fungi. 4th ed. Saint Paul: APS Press. p. 218. [ Links ]
Bayman P, Lebron L, Tremblay R, Lodge L. 1997. Variation in endophytic fungi from roots and leaves of Lepanthes (Orchidaceae). New Phytologist, 135 (1): 143-149. [ Links ]
Bayman P, Otero JT. 2006. Microbial endophytes of orchid roots. En: Schulz B, Boyle C, Sieber T, editores. Microbial root endophytes. New York: Springer. p. 153-173. [ Links ]
Cabezas L, Calderón C, Medina L, Bahamón MI, Cárdenas M, Bernal AJ, González A, Restrepo S. 2012. Characterization of cellulases of fungal endophytes isolated from Espeletia spp. Journal of Microbiology, 50 (6): 1009-1013. [ Links ]
Chen XM, Dong HL, Hu KX, Sun ZR, Chen J, Guo SX. 2010. Diversity and antimicrobial and plant-growth-promoting activities of endophytic fungi in Dendrobium loddigesii Rolfe. Journal of Plant Growth Regulation, 29 (3): 328-337. [ Links ]
Chen J, Hu KX, Hou XQ, Guo SX. 2011. Endophytic fungi assemblages from 10 Dendrobium medicinal plants (Orchidaceae). World Journal of Microbiology and Biotechnology, 27: 1009-1016. [ Links ]
Chutima R, Dell B, Vessabutr S, Bussaban B, Lumyong S. 2011. Endophytic fungi from Pecteilis susannae (L.) Rafin (Orchidaceae), a threatened terrestrial orchid in Thailand. Mycorrhiza, 21 (3): 221-229. [ Links ]
Dixon RA, Gonzales RA. 1994. Plant cell culture: a practical approach. 2nd ed. Oxford: I R L Press. p. 230. [ Links ]
Freeman S, Horowitz S, Sharon A. 2001. Pathogenic and nonpathogenic lifestyles in Colletotrichum acutatum from strawberry and other plants. Phytopathology, 91 (10): 986-992. [ Links ]
Gamboa-Gaitán MA. 2006. Hongos endófitos tropicales: conocimiento actual y perspectivas. Acta Biológica Colombiana, 11 (Suppl. 1): 3-20. [ Links ]
Gezgin Y, Eltem R. 2009. Diversity of endophytic fungi from various Aegean and Mediterranean orchids (saleps). Turkish Journal of Botany, 33 (6): 439-445. [ Links ]
Ghimire SR, Charlton ND, Bell JD, Krishnamurthy YL, Craven KD. 2011. Biodiversity of fungal endophyte communities inhabiting switchgrass (Panicum virgatum L.) growing in the native tallgrass prairie of northern Oklahoma. Fungal Diversity, 47 (1): 19-27. [ Links ]
Hyde K, Soytong K. 2008. The fungal endophyte dilemma. Fungal Diversity, 33: 163-173. [ Links ]
Jiménez-Valverde A, Hortal J. 2003. Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología, 8: 151-161. [ Links ]
Newton A, Fitt B, Atkins S, Walters D, Daniell T. 2010. Pathogenesis, parasitism and mutualism in the trophic space of microbe-plant interactions. Trends in Microbiology, 18 (8): 365-373. [ Links ]
Ovando I, Damon A, Bello R, Ambrosio D, Albores V, Adriano L, Salvador M. 2005. Isolation of endophytic fungi and their mycorrhizal potential for the tropical epiphytic orchids Cattleya skinneri, C. aurantiaca and Brassavola nodosa. Asian Journal of Plant Sciences, 4 (3): 309-315. [ Links ]
Porras-Alfaro A y Bayman P. 2011. Hidden fungi, emergent properties: endophytes and microbiomes. Annual Review of Phytopathology 49: 291-315. [ Links ]
Pridgeon AM. 1996. Orchids: status survey and conservation action plan. Gland y Cambridge: Union Internationale pour la Conservation de la Nature et de ses Ressources. p. 157. [ Links ]
Rodríguez RJ, White JF, Arnold E, Redman RS. 2009. Fungal endophytes: diversity and functional roles. New Phytologist, 182 (2): 314-330. [ Links ]
Rubini M, Silva-Ribeiro R, Pomella A, Maki C, Araújo W, Santos D, Azevedo JL. 2005. Diversity of endophytic fungal community of cacao (Theobroma cacao L.) and biological control of Crinipellis perniciosa, causal agent of Witches' Broom disease. International Journal of Biological Sciences, 1 (1): 24-33. [ Links ]
Sarmiento J, Betancur JC. 2006. Sinopsis sobre la riqueza y la distribución geográfica y altitudinal de las orquídeas de Colombia. Acta Biológica Colombiana, 11 (1): 167. [ Links ]
Schulz B, Wanke U, Draeger S, Aust HJ. 1993. Endophytes from herbaceous plants and shrubs: effectiveness of surface sterilization methods. Mycological Research, 97 (12): 1447-1450. [ Links ]
Schulz B. 2006. Mutualistic interactions with fungal root endophytes. En: Schulz B, Boyle C y Sieber T, editores. Microbial root endophytes. New York: Springer. p. 261-276. [ Links ]
Schulz B, Boyle C, Sieber T. 2006. Microbial Root Endophytes. New York: Springer. p. 367. [ Links ]
Sieber T. 2007. Endophytic fungi in forest trees: are they mutualists? Fungal Biology Reviews, 21 (2): 75-89. [ Links ]
Slippers B, Wingfield M. 2007. Botryosphaeriaceae as endophytes and latent pathogens of woody plants: diversity, ecology and impact. Fungal Biology Reviews, 21 (2): 90-106. [ Links ]
Sudheep NM, Sridhar KR. 2012. Non-mycorrhizal fungal endophytes in two orchids of Kaiga forest (Western Ghats), India. Journal of Forestry Research, 23 (3): 453-460. [ Links ]
Tan XM, Chen XM, Wang CL, Jin XH, Cui JL, Chen J, Guo SX, Zhao LF. 2012. Isolation and identification of endophytic fungi in roots of nine Holcoglossum plants (Orchidaceae) collected from Yunnan, Guangxi, and Hainan provinces of China. Current Microbiology, 64 (2): 140-147. [ Links ]
Tao G, Liu Z, Sun B, Zhu Y, Cai L, Liu X. 2012. Occurrence and diversity of endophytic fungi in Bletilla ochracea (Orchidaceae) in Guizhou, China. African Journal of Microbiology Research, 6 (12): 2859-2868. [ Links ]
Tsavkelova EA, Bömkea C, Netrusov AI, Weiner J, Tudzynski B. 2008. Production of gibberellic acids by an orchid-associated Fusarium proliferatum strain. Fungal Genetics and Biology, 45 (10): 1393-1403. [ Links ]
Unterseher M, Schnittler M. 2009. Dilution to extinction cultivation of leaf inhabiting endophytic fungi in beech (Fagus sylvatica L.) different cultivation techniques influence fungal biodiversity assessment. Mycological Research, 113 (5): 645-654. [ Links ]
Unterseher M, Schnittler M. 2010. Species richness analysis and ITS rDNA phylogeny revealed the majority of cultivable foliar endophytes from beech (Fagus sylvatica). Fungal Ecology, 3 (4): 366-378. [ Links ]
Vartoukian SR, Palmer RM, Wade WG. 2010. Strategies for culture of ''unculturable'' bacteria. FEMS Microbiology Letters, 309 (1): 1-7. [ Links ]
Wang YT, Lo HS, Wang PH. 2008. Endophytic fungi from Taxus mairei in Taiwan: first report of Colletotrichum gloeosporioides as an endophyte of Taxus mairei. Botanical Studies, 49 (1): 39-43. [ Links ]
Xing YM, Chen J, Cui JL, Chen XM, Guo SX. 2011. Antimicrobial activity and biodiversity of endophytic fungi in Dendrobium devonianum and Dendrobium thyrsiflorum from Vietnam. Current Microbiology, 62 (4): 1218-1224. [ Links ]
Yagame T, Orihara T, Selosse MA, Yamato M, Iwase K. 2012. Mixotrophy of Platanthera minor, an orchid associated with ectomycorrhiza forming Ceratobasidiaceae fungi. New Phytologist, 193 (1): 178-187. [ Links ]
Yuan ZL, Chen YC, Yang Y. 2009. Diverse non-mycorrhizal fungal endophytes inhabiting an epiphytic, medicinal orchid (Dendrobium nobile): estimation and characterization. World Journal of Microbiology and Biotechnology, 25 (2): 295-303. [ Links ]