Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.37 no.102 Medellín Jan./June 2015
ARTÍCULOS DE INVESTIGACIÓN
Nuevos registros de macrohongos (Basidiomycota) para Colombia procedentes de un bosque seco tropical
New records of macrofungi (Basidiomycota) for Colombia from a tropical dry forest
Melissa Palacio1, 3, 4, Yossama Gutiérrez1, 5, Ana E. Franco-Molano1, 6, Ricardo Callejas-Posada2, 7
1 Laboratorio de Taxonomía y Ecología de Hongos, Instituto de Biología Universidad de Antioquia AA. 1226 Medellín, Colombia.
2 Laboratorio de Taxonomía de Plantas Vasculares. Instituto de Biología Universidad de Antioquia AA. 1226 Medellín, Colombia.
3 Laboratório de Micologia, Departamento de Botânica, Universidade Federal de Santa Catarina, CEP: 88040-9000 Florianópolis, SC, Brasil.
Correos electrónicos: 4 melissapalacio@gmail.com; 5 yossamagutierrez@hotmail.com; 6 afranco@quimbaya.udea.edu.co; 7 callejas@matematicas.udea.edu.co>.
Recibido: noviembre 2013; aceptado: octubre 2014.
Resumen
Se registraron en un bosque seco tropical en el noreste de Colombia (departamento Cesar), 12 especies de macrohongos previamente no conocidos para el país: Amanita aureofloccosa, A. crebresulcata (Amanitaceae), Daedalea flavida (Fomitopsidaceae), Ganoderma resinaceum (Ganodermataceae), Marasmius cohortalis (Marasmiaceae), Phellinus merrilli, P. aff. umbrinellus (Hymenochaetaceae), Phlebopus beniensis (Boletinellaceae), Podoschypha petalodes (Meruliaceae), Psathyrella murrilli (Coprinaceae), Rigidoporus ulmarius (Meripilaceae) y Trametes socotrana (Polyporaceae). Cada especie es descrita, sus relaciones taxonómicas se discuten y se proveen comentarios sobre su distribución y ecología.
Palabras clave: biodiversidad, bosque seco tropical, macrohongos, taxonomía
Abstract
We recorded in a tropical dry forest in the northeast of Colombia (Cesar Dept.) 12 species of macrofungi previously unknown for the country; Amanita aureofloccosa, A. crebresulcata (Amanitaceae), Daedalea flavida (Fomitopsidaceae), Ganoderma resinaceum (Ganodermataceae), Marasmius cohortalis (Marasmiaceae), Phellinus merrilli, P. aff. umbrinellus (Hymenochaetaceae), Phlebopus beniensis (Boletinellaceae), Podoschypha petalodes (Meruliaceae), Psathyrella murrilli (Coprinaceae), Rigidoporus ulmarius (Meripilaceae) and Trametes socotrana (Polyporaceae). Each species is described, its taxonomic relationships are discussed, and some observations on its distribution and ecology are provided.
Key words: macrofungi, tropical dry forest, taxonomy, biodiversity
INTRODUCCIÓN
El número de especies de hongos a nivel mundial es aún incierto, especialmente cuando se considera que del estimado de 1,5 millones de especies de hongos, solo cerca del 5% han sido adecuadamente descritas (Hawksworth 1991, 2001, Mueller y Schmit 2007), esto debido a obstáculos taxonómicos, falta de estudios a largo plazo y de personal debidamente entrenado. La mayor parte de los estudios sobre la diversidad de macrohongos (esporóforos visibles a simple vista) ha sido realizada en Europa y en general están relacionados con las simbiosis ectomicorrízicas (Lodge et al. 1995, 2004).
Colombia posee una accidentada geografía, una notable riqueza de escosistemas y, en consecuencia, una amplia gama de zonas climáticas; de ahí que se espere tener alta diversidad de hongos. Sin embargo, se está lejos de que haya una idea que se acerque a la diversidad total de este grupo de organismos para el país (Franco-Molano et al. 2000, Vasco-Molano y Franco-Molano 2013). Entre los estudios relacionados con la descripción y caracterización de la micobiota presente en el país y que han contribuido al conocimiento de la diversidad pueden citarse: Betancur et al. (2007), Chardon (1928), Franco-Molano y Uribe-C. (2000), Franco-Molano et al. (2000, 2005), Guzmán y Varela (1978), Guzmán et al. (2004), Halling (1989), Pulido (1983), Rogers y Dumont (1979), Tulloss et al. (1992). De particular importancia son los trabajos sobre la Micota colombiana de Rogers y Dumont (1979), los de Vasco-Palacios y Franco-Molano (2013) y Vasco-Palacios et al. (2005). Al presente, y con base a la literatura de Vasco- Palacios y Franco-Molano (2013), se reconocen 1.239 especies de macrohongos (Ascomycota y Basidiomycota) para Colombia. Tales datos revelan dos ecosistemas en particular que han sido objeto de exploración micótica, el bosque húmedo tropical (bh-T) y los bosques de robles presentes en el bosque muy húmedo montano bajo (bmh- MB), y además que el estudio de la micota colombiana en áreas como el bosque seco tropical (bs-T) es aún muy reducido (Holdridge 2000).
En la región del Caribe colombiano y de los valles interandinos se concentra gran parte de la producción agrícola y ganadera del país, es allí donde se localizan la mayoría de los remanentes de bosque seco tropical (bs-T) de Colombia (IavH 1998), los cuales conforman aproximadamente el 1,5% de su cobertura original (Etter 1993), siendo la llanura del Caribe la región que presenta mayor cobertura de bs-T. El bs-T constituye uno de los ecosistemas más fragmentados y menos conocidos en Colombia, y aunque existen diversos inventarios florísticos y de aves, y algunos pocos de vertebrados e invertebrados (IavH 1998), solo se ha registrado un inventario de macrohongos realizado en el Valle del Cauca por García y Bolaños (2010). Inventarios y seguimientos que permitan identificar y registrar los organismos asociados a este tipo de bosque son necesarios para su conocimiento y su conservación.
Se describen a continuación 12 especies de macrohongos, que constituyen nuevos registros para la micota de Colombia. Para cada especie se provee una descripción completa, se contrasta esta con descripciones publicadas en monografías o revisiones y/o protologos y se indica su distribución y algunas observaciones sobre la ecología de cada especie.
MATERIALES Y METODOS
Área de estudio. El área de estudio y exploración de la micota aquí registrada lo constituye un fragmento del bosque seco tropical (bs-T), situado en el noreste de Colombia, en la denominada llanura del Caribe en el municipio de Valledupar, departamento del Cesar (figura 1).
Este bosque hace parte de una reserva forestal conocida como Los Besotes, que constituye en Colombia el fragmento de bosque seco tropical más extenso bajo protección (ca. 1.000 ha). El Santuario de Vida Silvestre Los Besotes se encuentra localizado en las coordenadas, 10° 32' 20'' N y 72° 23' 60'' O, a 8 km del municipio de Valledupar en la jurisdicción del corregimiento de Los Corazones (figura 1). Su extensión total es de 3.555,8 ha con un límite inferior de 190 m y un límite superior de 1.680 m en su ámbito altitudinal. La zona presenta un régimen de distribución bimodal de la precipitación (abril-junio, septiembre-noviembre altas precipitaciones, y época seca entre diciembre-marzo y julioagosto), humedad relativa varía entre 48 y 80% y temperatura media mensual superior a 24 °C, correspondiéndose a la zona de vida: bosque seco tropical (bs-T) según la clasificación de Holdridge (Barbosa et al. 2008).
El Santuario de Vida Silvestre Los Besotes en su mayoría está cubierto por matorral espinoso tropical y en menor grado por bosques de galería o ribereños que crecen a la orilla de los cuerpos de agua, por pajonales y varillales en las laderas más altas y una pequeña formación de bosque húmedo tropical (bh-T) relictual en la porción más alta, convirtiéndose en un lugar estratégico para el albergue y conservación de múltiples comunidades faunísticas representativas del bs-T (Barbosa et al. 2008).
Los Besotes exhibe gran diversidad de aves, 219 especies (15 órdenes, 41 familias y 127 géneros), 5 especies de distribución endémica y 4 bajo alguna categoría de amenaza (Barbosa et al. 2008), razón por la cual fue declarada por la Bird Life International como ''Área Importante para la Conservación de las Aves (AICA)'' y dado que cumple con las características de un Santuario propuestas por el Sistema Regional de Áreas Protegidas del Caribe Colombiano (SIRAP), la Corporación Autónoma Regional del Cesar (Corpocesar) declara a su interior un área natural protegida de carácter regional, denominada ''Santuario de Vida Silvestre Los Besotes''.
Metodología. Se realizaron muestreos oportunísticos durante los meses de marzo, julio y septiembre de 2012, en 3 salidas de campo, con un esfuerzo de muestreo de 5 días por salida de campo, 5 horas por día, por 3 personas, recorriendo un área total de 4.500 m² del Santuario de Vida Silvestre Los Besotes. Se procuró que las salidas coincidieran con los meses de sequía y los de altas precipitaciones, sin embargo, la temporada de lluvias fue errática y las recolectas no necesariamente reflejan un régimen estricto de lluvias o sequía. Todas las recolecciones fueron realizadas exclusivamente en el paisaje del bs-T, en su interior, mediante el trazado de transectos (2 x 50 m) y no incluye elementos del bosque húmedo o matorrales espinosos. Las recolecciones se realizaron en substratos tanto de suelo como de troncos u hojarasca, en un área comprendida entre las coordenadas 10° 34' 20'' N y 73° 15' 60'' O.
Las descripciones macroscópicas de las colecciones se realizaron teniendo en cuenta la terminología de Largent (1986) y Franco-Molano et al. (2000, 2005), las descripciones microscópicas se realizaron según la metodología de Largent et al. (1977). Se utilizó el portal virtual Index Fungorum (http://www.indexfungorum.org) para el sistema de clasificación, consulta de protólogos y sinonimias de las especies. Todos los ejemplares han sido depositados en la Colección de Hongos del Herbario del Instituto de Biología, Universidad de Antioquia (HUA).
RESULTADOS
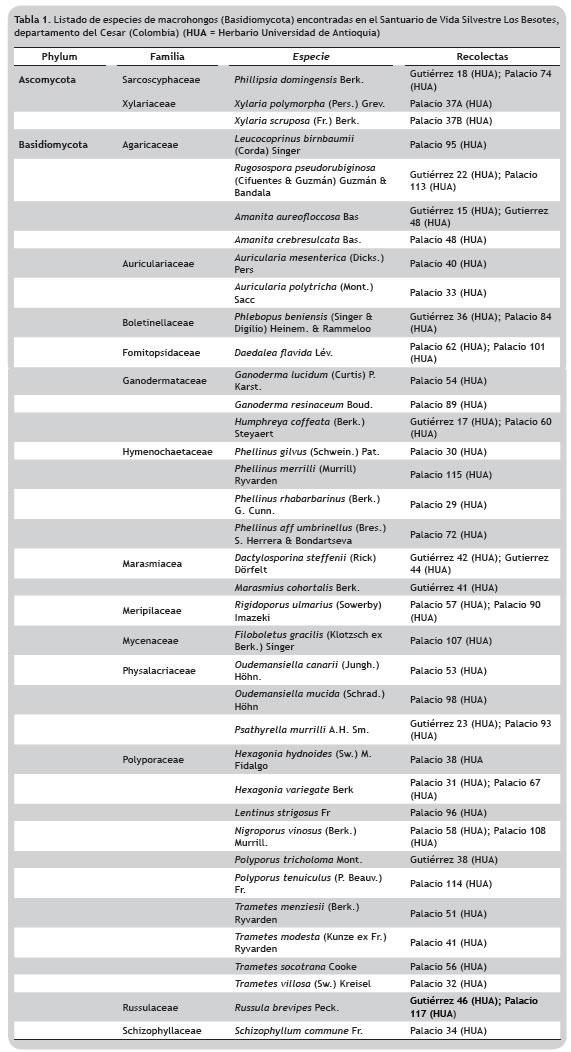
Las colecciones de macrohongos de la reserva Los Besotes revelan la presencia, con base en las salidas de campo realizadas, de 41 especies de macrohongos (tabla 1), de las cuales 40 especies constituyen registros nuevos para el departamento del Cesar, y 12 de ellos para Colombia.
Previo a este estudio, la micota conocida para el departamento del Cesar se reducía a cuatro especies (Vasco-Palacios y Franco-Molano 2013). A partir de este inventario, el número de especies de hongos registrados en el Cesar se incrementa en 40 especies. García y Bolaños (2010), publicaron para el bosque seco tropical (bs-T) en el suroeste del departamento del Valle del Cauca (Colombia) un listado de macrohongos, en el cual Tricholomataceae es la familia más abundante y se indica que 49% de las recolecciones realizadas pertenecen al orden Agaricales. En las recolectas realizadas en el Santuario de Vida Silvestre Los Besotes se presenta el mismo patrón, con 47,6% perteneciente al orden Agaricales, lo cual puede ser el resultado de que este orden conforma el clado más especioso de los hongos formadores de setas (Cepero-de García et al. 2012); sin embargo debido a las diferencias entre los inventarios, especialmente en los esfuerzos de muestreo y resolución taxonómica, resulta difícil para fines comparativos contrastar ambos inventarios.
Amanita aureofloccosa Bas., Persoonia 5(4): 384 (1969). Figura 2
Lepiota aurea Beeli, non L. aurea Massee.
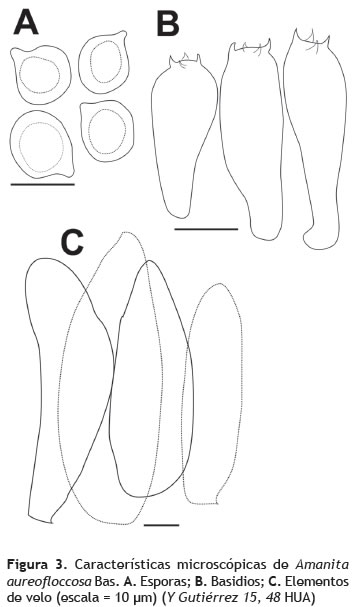
Píleo: hasta 6 cm de diámetro, plano a plano-convexo; superficie pruinosa a escuamulosa, color amarillo fuerte en el centro, más pálido hacia el margen; margen entero, apendiculado, enrollado. Contexto: hasta 0,4 cm de grosor, blanco, inmutable. Olor: fuerte penetrante. Himenóforo: lamelado. Lamelas: hasta 1 cm de ancho, libres, cercanas, ventricosas, blancas; margen entero, algunas veces emarginadas con borde amarillo. Lamelulas: de varias longitudes. Estípite: hasta 8,5 cm de longitud, 1 cm de diámetro, cilíndrico, ligeramente bulboso en la base; superficie flocosa, concolora con la superficie del píleo, blanco en el ápice, anillado; interior blanco, relleno. Anillo: peronado (figura 2). Esporada: blanca. Esporas: 6-9 x 6-7 μm (Q = 1,1), globosas, fuertemente amiloides, hialinas, pared simple, lisa (figura 3A). Basidios: 35-40 x 7-14 μm, clavados, hialinos, inamiloides, 4-esterigmados (figura 3B). Cistidios: no observados. Trama himenoforal: divergente. Subhimenio: pseudoparenquimatoso. Pileipelis: himeniforme, formado por células terminales 80-120 x 21-45 μm, suberectas a erectas, de pared delgada. Estipitipelis: formado por hifas paralelas dispuestas verticalmente, con algunas células terminales (30-72 x 12-19 μm), similares a las del pileipelis, un poco más pequeñas, como remanente de velo universal (figura 3C).
Hábito y hábitat: solitario a gregario, al borde del camino, creciendo sobre suelo, en áreas ligeramente expuestas al sol.
Distribución: bastante común en el oeste de África pero conocida de algunas pocas localidades en el este de África (Pegler 1977) e India (Bhatt et al. 2003).
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes, 10° 34' 20,2'' N, 73° 15' 66,7'' O, elev. 381 m, 7 sep. 2012, Yossama Gutiérrez 15 (HUA); 10° 34' 40,9'' N, 73°, 16' 35,7'' O, elev. 587 m, 16 sep. 2012, Yossama Gutiérrez 48 (HUA).
Observaciones: Debido a la ausencia de volva y la presencia de escuámulas flocosas amarillentas remanentes de velo universal que cubren la superficie del píleo y del estípite A. Aureofloccosa, puede ser confundida en campo con el género Cystolepiota, pero microscópicamente las esporas subglobosas, hialinas y fuertemente amiloides son diagnósticas para esta especie de Amanita. Nuestra descripción es congruente con el concepto de esta especie expresado por Bas (1969), quién indica además que A. aureofloccosa fue descrita originalmente de un bosque seco en el Congo, bajo arbustos y creciendo gregaria.
Píleo: 7 cm de diámetro, deprimido a umbilicado; superficie de color marrón grisáceo en el centro y marrón hacia el margen, glabro; margen erodado. Contexto: 0,3 cm de espesor, blanco, inmutable. Olor: fúngico. Himenóforo: lamelado. Lamelas: 0,3 cm de ancho, libres, cercanas, finamente erodadas en el margen, blancas. Estípite: 6,5 cm de longitud, 1 cm de diámetro, cilíndrico, central; superficie escuamulosa, color blanco, volva; interior fistuloso, blanco (figura 4).
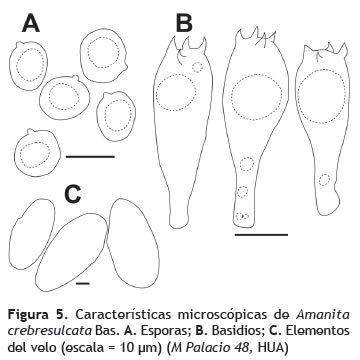
Esporada: blanca. Esporas: 9-12 x 9-12 μm (Q = 1,05), globosas, hialinas, inamiloides, pared simple, con vacuolas grandes, apículo prominente (figura 5A). Basidios: 35-49 x 10-16 μm, clavados, con vacuolas muy grandes, hialinos, paredes delgadas, 4-esterigmados (figura 5B).
Cistidios: no observados. Trama himenoforal: divergente. Subhimenio: celular. Pileipelis: hifas repentes, terminando en una matriz amorfa, color grisáceo a amarillo muy claro en KOH. Estipitipelis: formado por hifas paralelas dispuestas verticalmente. Células de la volva: 80-100 x 34-45 μm, hialinas, inamiloides, células infladas, de pared delgada (figura 3C).
Hábito y hábitat: solitario, creciendo en suelo al interior del bosque.
Distribución: especie neotropical, descrita originalmente de Manaos (Amazonas, Brasil) en áreas con vegetación secundaria, en un bosque húmedo tropical (bh-T) (Bas 1978), también registrada en otros estados Brasileros como Paraná, Pernambuco y San Pablo (Wartchow y Maia 2007).
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes, 10° 34.320' N, 73° 16.336' O, elev. 572 m, 4 jul. 2012, Melissa Palacio 48 (HUA).
Observaciones: la coloración del píleo y el estípite, la ausencia de anillo, el estípite cilíndrico, la presencia de ixocutis, las esporas inamiloides, caracterizan a A. crebresulcata, aunque el ejemplar aquí examinado difiere de la descripción original en el tamaño de las esporas, siendo en promedio las del holotipo 2 μm más estrechas. A pesar de que en la descripción original de A. crebresulcata se estableció claramente una relación ectomicorrízica con Neea (Nyctaginaceae), en el presente estudio no se pudo determinar una asociación ectomicorrízica, aunque en el bs-T y particularmente en Los Besotes existen muchas especies observadas en otras regiones como ectomicorrízicas (e. g., Fabaceae) (Newman y Reddell 1987). Las localidades donde ya ha sido registrada A. crebresulcata corresponden a bosques húmedos tropicales de Brasil, un tipo de bosque muy diferente al bosque seco tropical, el cual presenta condiciones de temperatura más altas y de humedad y precipitación más bajas, además con temporadas de sequía variables que afectan directamente la presencia de los hongos (Dix y Webster 1995), este es el primer registro de A. crebresulcata no solo para el país sino también para el bs-T.
Lenzites acuta Berk.
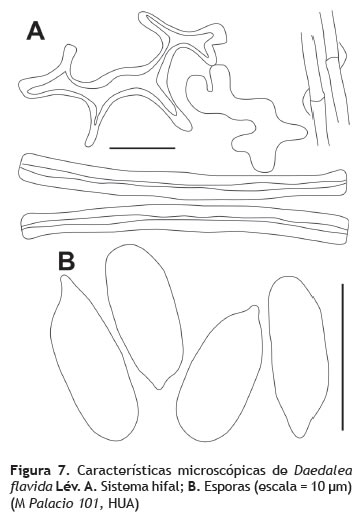
Píleo: 3-5 cm de diámetro, dimidiado a pseudoestipitado, superficie concéntricamente zonada, rugosa en el centro, rugulosa hacia el margen, finamente fibrilosa a glabra, color marrón a crema hacia el margen. Himenóforo: laberintiforme, daedaloide, tubos de 0,4 cm de longitud (figura 6). Sistema hifal: trimítico; hifas generativas 3 μm, fibuladas, hialinas, de paredes muy delgadas, hifas esqueléticas 5 μm de grosor, hialinas, de paredes muy gruesas a sólidas, hifas de unión 4 μm de grosor, paredes muy gruesas a sólidas, ramificadas, ramificaciones muy Cistidios: no observados. Esporada: no obtenida. Esporas: 6-9 x 3 μm (Q = 2,3), cilíndricas, de pared delgada, hialinas en KOH, inamiloides (figura 7B).
Hábito y hábitat: gregario, creciendo sobre tronco en descomposición al margen del camino.
Distribución: pantropical, más común en Asia que en otros continentes, común desde Pakistán hasta China, Japón, este de Rusia, Tailandia a sureste de Asia y Australia (Núñez y Ryvarden 2001), también registrada para Venezuela (Ryvarden e Iturriaga 2001), Brasil (Baltazar y Baptista 2009), Costa Rica, Panamá, Islas Vírgenes, Cuba y Jamaica (González-Ball et al. 2004).
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes, 10° 34' 24,5'' N, 73° 16' 22,3'' O, elev. 586 m, 5 jul. 2012, Melissa Palacio 62 (HUA); 10° 34' 26,9'' N, 73° 16 709' O, elev. 733 m, 15 sep. 2012, Melissa Palacio 101 (HUA).
Observaciones: Daedalea flavida es una especie que se caracteriza por presentar himenóforos fuertemente variables en forma desde poroides, laberintiformes, deadaloides hasta completamente lamelados con lamelas sinuosas (Ryvarden 1976), razón por la cual podría explicarse la extensa sinonimia de esta especie. El color amarillo pálido del contexto y la superficie del píleo generalmente glabra, son también característicos de Daedalea flavida. Esta especie ha sido encontrada sobre madera en descomposición en sitios expuestos y soleados, especialmente en áreas con temporadas de sequía (Núñez y Ryvarden 2001) y sobre mangles [Bruguiera gymnorhiza (L.) Savigny] (Rizophoraceae) (Gilbert et al. 2008).
Ganoderma chaffangeonii Pat.
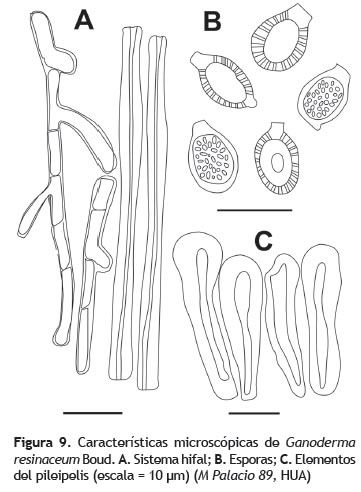
Basidiocarpo: 8,5 cm de diámetro, semicircular; superficie concéntricamente zonada y sulcada, lacada, glabra, color marrón-naranja, con zonaciones más claras. Contexto: crema. Himenóforo: poroide, poros diminutos, 4 poros por mm, regulares, color blanco crema. Estípite: 5 cm de longitud, 1,5 cm de diámetro cerca al ápice, lateral, cilíndrico; superficie lacada, glabra, marrón rojizo (figura 9). Sistema hifal: dimítico; hifas generativas 2-4 μm de grosor, hialinas, pared gruesa, fibuladas, hifas esqueléticas 5-6 μm de grosor, paredes muy gruesas, color marrón claro a oscura, algunas ramificadas (figura 9A). Basidios: no observados. Esporada: no obtenida. Esporas: 10-13 x 7-8 μm (Q = 1,5), elipsoides, ornamentadas, ápice truncado, pared doble, color marrón oscuro en KOH (figura 9B). Pileipelis: una palisada de células embebidas en una matriz amorfa, células del pileipelis 32-35,2 x 6-8 μm, con ápice redondeado terminando en un mismo nivel, fuertemente amiloides (figura 9C).
Hábito y hábitat: gregario, creciendo sobre tronco en descomposición, al interior del bosque.
Distribución: Esta especie ha sido considerada como cosmopolita (Ryvarden 2004) y registrada para las Américas en el estado de Santa Catarina, Brasil (Loguercio- Leite et al. 2009), Argentina (Robledo y Rajchenberg 2007) y en los Estados Unidos (Ryvarden y Gilbertson 1993), en el sur y centro de Europa y en algunas pocas localidades aisladas en el Sur de Dinamarca, también en el Norte de África y en Asia (Ryvarden y Gilbertson 1993).
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes, 10° 34' 30,5'' N, 73° 15' 94,5'' O, elev. 455 m, 14 sep. 2012, Melissa Palacio 89 (HUA).
Observaciones: Ganoderma resinaceum se caracteriza por presentar basidiomas de tonalidades muy oscuras, brillantes, sulcados y glabros, esporas de gran tamaño, células del pileipelis amiloides y regularmente clavadas (Ryvarden 2004, Torres-Torres 2012). A pesar de que Torres-Torres et al. (2012) advierten que este nombre ha sido ampliamente usado en organismos muy disímiles a la especie descrita originalmente por Boud, el ejemplar aquí citado concuerda macroscópica y microscópicamente con la descripción a partir del holotipo realizada por Torres- Torres et al. (2012).
Píleo: 1.5-3 cm de diámetro, umbilicado; estriado de la margen hacia el centro; superficie fibrilosa a velutinosa, higrófana, blanca; margen crispada. Contexto: hasta 1 mm de grosor, blanco, inmutable. Himenóforo: lamelado y fuertemente intervenoso. Lamelas: 1-3 mm de ancho, subdistantes, blancas. Estípite: central; superficie fibrilosa, color blanco tornándose marrón hacia la base; interior hueco. Micelio basal: blanco (figura 10).
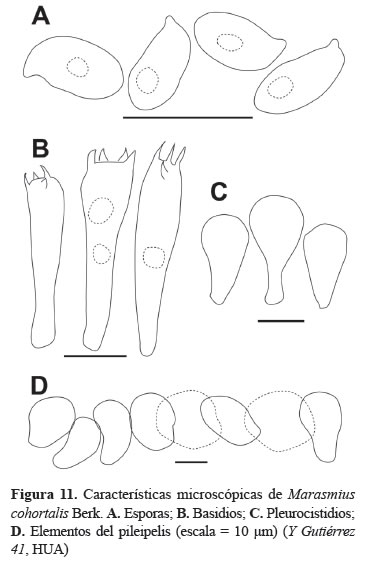
Esporada: no obtenida. Esporas: 6-8 x 3-4 μm, (Q = 2), paredes lisas, hialinas en KOH, inamiloides (figura 11A). Basidios: 32- 36 x 5-6 μm, clavados a cilíndricos, hialinos, inamiloides, 4-esterigmados (figura 11B). Pleurocistidios: no observados. Queilocistidios: 20-29 x 10-11 μm, clavados, de paredes delgadas, hialinos, inamiloides (figura 11C). Pileipelis: himeniforme, células terminales globosas, celulares a obpiriformes, de paredes delgadas, dextrinoides (figura 11D).
Hábito y hábitat: gregario, creciendo en hojarasca al interior del bosque.
Distribución: bosques tropicales, subtropicales y subtropicales montanos, en Argentina y Brazil (Singer 1976).
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes, 10° 34' 17,8'' N, 73° 16' 74,8'' O, elev. 785 m, 15 sep. 2012, Yossama Gutiérrez 41 (HUA).
Observaciones: Marasmius cohortalis pertenece a la sección Globulares; la cual se caracteriza porque las especies poseen un pileipelis himeniforme conformado por células globosas. Marasmius cohortalis se diferencia de otras especies de esta sección por poseer himenóforos fuertemente intervenosos y queilocistidios consistentemente clavados a subglobosos. Este es el primer registro de la especie en el norte de Suramérica y de un bosque seco tropical (bs-T) (Wannathes et al. 2004).
Phellinus merrillii (Murrill) Ryvarden, Norwegian Journal of Botany, 19: 234, 1972 Figura 12
Pyropolyporus merrillii Murrill
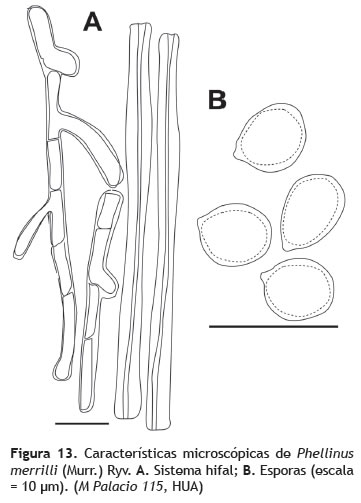
Basidiocarpos: 11 cm de diámetro, dimidiado a ampliamente adherido al sustrato; superficie finamente vellosa, rugosa, húmeda, concéntricamente zonada, color pardo rojizo oscuro más claro hacia el margen, el margen crema. Himenóforo: poroide, pardo-marrón oscuro, poros diminutos, 5-8 poros por mm, tubos de 1 cm de longitud concoloros con las superficie. Contexto: 2 cm de grosor, pardo-dorado (figura 12). Sistema hifal: dimítico; hifas generativas 2-4 μm de grosor, paredes delgadas, color amarillo a pardo rojizo, septadas, ramificadas, hifas esqueléticas 3-6 μm, de paredes gruesas, color marrón oscuro (figura 13A).
Pileipelis: cutis de hifas repentes, similares a las esqueléticas, embebidas en una matriz resinosa de color ámbar en algunos puntos. Basidios: no observados. Cistidios: no observados. Esporada: no obtenida. Esporas: 5-6 x 5 μm (Q = 1,1), globosas, color marrón, inamiloides, pared engrosada lisa (figura 13B). Hábito y hábitat: gregario, creciendo sobre tronco muerto en pie, al interior del bosque.
Distribución: especie probablemente pantropical (Ryvarden y Johansen 1980, Larsen y Cobb-Poulle 1990).
Phellinus merrilli ha sido registrada en Paraná (Brasil) (Baltazar y Baptista 2009), Lajas (Puerto Rico), Costa Rica (Carranza y Ruiz-Boyer 2005), Salta (Argentina) (Robledo y Rajchenberg 2007), Pohnpei (Micronesia) (Baltazar et al. 2009), también ha sido encontrada en el sudeste de Estados Unidos desde Florida hasta Tennessee, y en Filipinas (Larsen y Cobb-Poulle 1990).
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes, 10° 34' 40,9'' N, 73° 16' 35,7'' O, elev. 587 m, 16 sep 2012, Melissa Palacio 115 (HUA).
Observaciones: Phellinus merrilli se caracteriza por presentar basidiocarpos gruesos, la superficie del píleo fuertemente sulcada, el contexto relativamente delgado (Ryvarden y Johansen 1980), esporas globosas y pigmentadas y setas ausentes (Ryvarden 2004). Phellinus merrilli prospera sobre corteza y madera de Rhizophora mangle L., (Rizophoraceae) y sobre Piptadenia macrocarpa Benth. (Fabaceae).
Poria umbrinella Bres.
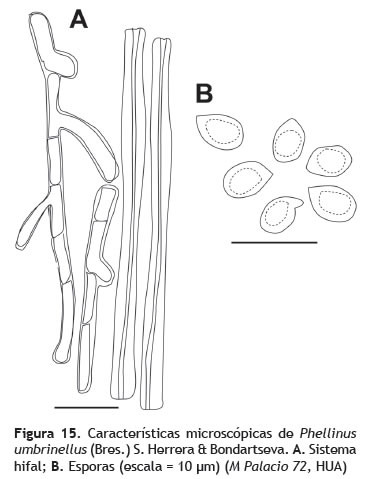
Basidiocarpo: 2-7 cm de diámetro, efuso-reflexo, ampliamente adherido al sustrato, a resupinado, consistencia leñosa; superficie seca, con pliegues como costras color negro y margen color pardo; margen estéril. Contexto: 0,2 cm de grosor, color marrón, tornándose negro con KOH. Himenóforo: poroide, poros diminutos, 6-8 por mm, color marrón verdoso (figura 14). Sistema hifal: dimítico; hifas generativas 2-3 μm de grosor, de paredes gruesas, septadas, ramificadas, hialinas a amarillos claro, hifas esqueléticas 4-5 μm de grosor, de paredes muy gruesas, color marrón rojizo a marrón oscuro (figura 15A). Pileipelis: formado por hifas esqueléticas repentes a suberectas, de paredes gruesas color marrón rojizo, embebidas en una matriz color amarillo brillante en KOH. Basidios: no observados. Cistidios: no observados. Esporada: no obtenida. Esporas: 3-4 x 4-5 μm (Q = 1), globosas, amarillentas, marrón-amarillo en KOH, inamiloides, lisas, pared engrosada (figura 15B).
Hábito y hábitat: imbricado, creciendo sobre tronco muerto en pie, en el borde del camino.
Distribución: Phellinus umbrinellus es una especie pantropical, descrita originalmente del estado de Santa Catarina (Brasil), ha sido comunicada adicionalmente en América tropical y subtropical en las regiones del Caribe (Bahamas, Cuba, Haití, Jamaica), Norte América (Estados Unidos, México), América Central (Costa Rica, Nicaragua) y Sur América (Bolivia, Islas Galápagos); además en Sierra Leona (África) y Nueva Zelanda (Larsen y Cobb-Poulle 1990) y (Núñez y Ryvarden 2000), Japón (Núñez y Ryvarden 2001, Gomes-Silva y Gibertoni 2009).
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes, 10° 34' 17,7'' N, 73° 15' 53,3'' O, elev. 441 m, 6 jul 2012, Melissa Palacio 72 (HUA).
Observaciones: Phellinus umbrinellus se caracteriza principalmente por los basidiocarpos resupinados y microscópicamente por las basidiosporas pequeñas y color marrón, además de la ausencia de setas (Ryvarden 2004). Phellinus umbrinellus es una especie que ha sido encontrada prosperando sobre diferentes hospederos como algunas especies de Ficus, Lonchocarpus parviflorus Benth. (Moraceae) y Luehea candida (DC.) Mart. (Malvaceae). El ejemplar acá estudiado difiere de una colección examinada (Silva y Costa-Rezende 49263, FLOR) colectada en la localidad tipo (Santa Catarina, Brasil) y del protologo, en varios aspectos: el hábito en los ejemplares de Brasil es completamente resupinado, y en el material de Los Besotes parece ir de efuso-reflexo a casi resupinado, además del color del himenóforo, que en los ejemplares de los Besotes es mucho más claro que en los materiales de Brasil. Se hace necesario realizar una revisión exhaustiva del material de Los Besotes para confirmar la identidad del ejemplar aquí citado.
Phlebopus beniensis (Singer & Digilio) Heinem. & Rammeloo, Mycotaxon 15: 390 (1982) Figura 16
Phaeogyroporus beniensis Singer & Digilio.
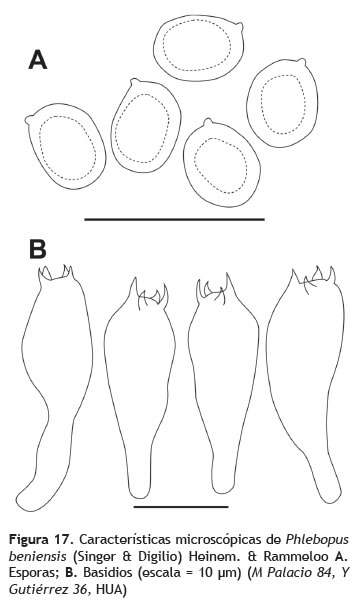
Píleo: 3,5-11 cm de diámetro, irregularmente convexo, convexo a plano; superficie velutinosa, seca, pardo verdosa en el centro, pardo amarillo hacia el margen, con manchas rojizas al tacto, margen enrrollado, proyectado. Contexto: hasta 2,5 cm de grosor, amarillo pálido cambiando a marrón rojizo o más oscuro al cortarlo o exponerlo. Himenóforo: tubulado, tubos 0,4-0,7 cm de longitud, depresos alrededor del estípite; amarillos-verdosos a amarillos. Poros: hexagonales a irregulares en forma, hasta 2 poros por mm, concoloros con los tubos, tornándose azules y luego marrón rojizos al exponerlos. Estípite: 3,5-4,5 cm de longitud, hasta 2 cm de diámetro; superficie finamente estrigosa, amarilla en el ápice, oscureciéndose a pardo amarillento hacia la base cuando joven y pardo oscuro a casi negro cuando maduro, clavado, ligeramente radicado (figura 16). Nota: papel parafinado manchado de rojo al contacto con los especímenes. Esporas: 7-8 x 5-6 μm (Q = 1,17), subglobosas a ampliamente elipsoides, lisas, pared simple a ligeramente engrosada, pardo oliváceo en KOH, inamiloides en reactivo de Melzer (figura 17A). Basidios: 23-39 x 8-12 μm, clavados, hialinos, inamiloides en reactivo de Melzer, de pared delgada (figura 17B).
Cistidios: no observados.
Trama himenoforal: divergente, fíbulas presentes. Pileipelis: tricodermal, formado por hifas mezcladas, suberectas a erectas, hialinas, de paredes delgadas y de ápices redondeados.
Hábito y hábitat: gregario, creciendo en suelo. Estas colecciones proceden de un sendero cruzando un área boscosa con hojarasca.
Distribución: Phlebopus beniensis fue originalmente descrito del departamento de Vaca Diez, en la provincia de Beni, cuenca amazónica de Bolivia. De acuerdo al protologo la especie prospera en bosque húmedo tropical, sobre detritus en un área donde son comunes especies arbóreas de leguminosas. La especie ha sido registrada desde entonces en diferentes coberturas boscosas de Argentina, Brasil, Ecuador, Martinica, Puerto Rico y en Liberia (África) (Sulzbacher et al. 2013), incluyendo bosques subtropicales secos, semideciduos, estacionales montanos y submontanos.
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes, 10° 34' 17,6'' N, 73° 15' 50,1'' O, elev. 355 m, 14 sep. 2012, M. Palacio 84 (HUA); 10° 34' 176'' N, 73° 15' 50,1'' O, elev. 355 m, 14 sep. 2012, Yossama Gutiérrez 36 (HUA). Los ejemplares aquí examinados conforman el primer registro de esta especie para un bosque seco tropical en el neotrópico.
Observaciones: Los ejempares hallados en los Besotes coinciden con el protologo en el color del píleo, pardo, el ápice amarillo, las tramas de hifas gelatinosas, las basidiosporas de paredes delgadas y los basidios claviformes. La especie prospera en áreas expuestas del bosque seco, en sitios con hojarasca y donde especies de los generos Hymanaea, Andira, y Bauhinia (Fabaceae) entre otros, son elementos del bosque, pero sin una aparente dominancia particular, lo que dificulta lanzar una hipótesis sobre la naturaleza ectomicorrízica de la especie, adicionalmente no se detectó una red de Hartig. Registros del sustrato sugieren una especie terrícola en áreas semi boscosas o boscosas donde son frecuentes pero no exclusivas las especies de leguminosas. Sulzbacher et al. (2013) registran la presencia de esta especie en Brasil en vecindades de Laguncularia racemosa (Combretacae) e Hibiscus tiliaceus (Malvaceae) dos especies cultivadas. Aunque existen especies del género posiblemente ectomicorrízicas (Ph. spongiosus) (Hoang- Pham et al. (2012), estas no exhiben desarrollo de red de Hartig y la penetración hifal está restringida a la exodermis. Tedersoo et al. (2011) sugieren, en su estudio de hongos ectomicorrízicos, que especies de Phlebopus, Boletinellus y Phyloboletellus no son ectomicorrízicas sino facultativas o biotrópicas obligadas.
Podoscypha petalodes (Berk.) Boidin, Revue Mycol., Paris 24: 230 (1959) Figura 18
Stereum petalodes Berk.
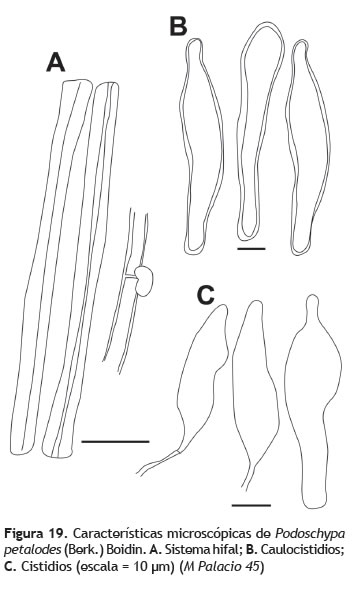
Píleo: 1 a 3 cm de diámetro, en especímenes jóvenes infundibuliforme y en maduros más circulares a planos y umbilicados; superficie lisa, con ligeras zonaciones donde el centro y margen son de color pardo-rojizo claro y en medio blanco crema. Contexto: menos de 1 mm de grosor, blanco crema. Himenóforo: liso a ruguloso, color blanco crema a amarilloso. Estípite: 0,8-2 cm de longitud, 0,1-0,5 cm de diámetro, central, cilíndrico aunque con una pequeña base formándose en el tronco (figura 18). Sistema hifal: dimítico; hifas generativas 3-4 μm de grosor, fibuladas, hialinas, paredes ligeramente engrosadas, hifas esqueléticas 4 μm de grosor, paredes engrosadas a sólidas, hialinas (figura 19A). Estipitipelis: formado por hifas de paredes engrosadas y fibuladas, con elementos terminales erectos a suberectos, con ápices redondeados, caulocistidios de gran tamaño (80 x 12 μm), dispersos y de paredes gruesas (figura 19B). Basidios: no observados. Cistidios: 31-60 x 8-12 μm, hialinos y de paredes engrosadas (figura 19C). Esporada: no obtenida. Esporas: 4 x 3 μm (Q = 1,3), elipsoides, hialinas.
Hábito y hábitat: solitario a gregario, creciendo sobre tronco en descomposición, pequeño, en área húmeda, cercana a fuente de agua.
Distribución: América tropical y en islas del Pacífico (Reid 1965).
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes, 10° 34' 26,5'' N, 73° 16' 21,6'' O, elev. 542 m, 4 jul 2012, Melissa Palacio 45 (HUA).
Observaciones: Podoscypha petalodes se caracteriza por los basidiomas espatulados, flabelados a subinfundibuliforme, con el himenóforo liso a ruguloso, la superficie del píleo de color pardo claro a pardo-rosado, tornándose más claro hacia el centro, y microscópicamente de manera especial por la presencia de caulocistidios y el sistema hifal dimítico, caracterizan esta especie, aunque presenta considerables variaciones tanto en hábito, hábitat como en forma y tamaño en ejemplares de herbario. Esta especie prospera en América tropical, pero también ha sido registrada en islas del pacífico (Reid 1965).
Psathyrella murrilli A.H. Sm., Memories of the New York Botanical Garden 24: 287 (1972). Figura 20
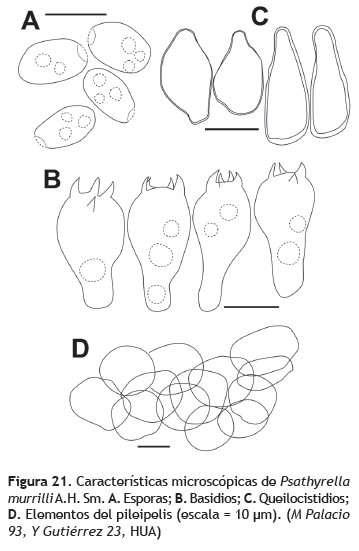
Píleo: 0,5-2,5 cm de diámetro, cónico a umbonado; superficie micácea a velutinosa, amarillenta en el centro, más pálida a crema hacia el margen, centro marrón, aclarándose hacia el margen hasta marrón grisáceo, estriada del margen hacia el centro, margen erodado. Contexto: menos de 1 mm, crema, inmutable. Lamelas: libres, cercanas, delgadas concoloras con la superficie del píleo; margen entero. Estípite: 3,5-7 cm de longitud, hasta 2 mm de diámetro cerca al ápice; superficie fibrilosa, blanca, anillado; interior fistuloso, blanco. Anillo: superior, membranoso, concoloro con la superficie del estípite (figura 20). Esporada: no obtenida. Esporas: 7-9 x 4-5 μm (Q = 1,63), elipsoides, marrón, pared engrosada, truncadas por un poro germinal (figura 21A). Basidios: 16-21 x 7-10 μm, clavados, hialinos de paredes delgadas, 4-esterigmados (figura 21B).
Queilocistidios: 18-26 x 7-11 μm, ventricosos, hialinos, de pared delgada (figura 21C). Pleurocistidios: ausentes. Trama himenoforal: regular, hialina. Pileipelis: un epitelio compuesto por hifas globosas a piriformes, hialinas, dispuestas en diferentes niveles (figura 21D). Estipitipelis: cutis compuesto de hifas 3-4 μm de grosor, repentes, hialinas.
Hábito y hábitat: gregario, creciendo en suelo, sobre el camino, en área altamente expuesta.
Distribución: registrada en Cuba (localidad tipo) y Martinica (Pegler 1983).
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes, 10° 34' 11,4'' N, 73° 15' 44,3'' O, elev. 523 m, 14 sep. 2012, Melissa Palacio 93 (HUA); 10° 34' 11,7'' N, 73° 15' 46,5'' O, elev. 337 m, 11 sep. 2012, Yossama Gutiérrez 23 (HUA).
Observaciones: las esporas pequeñas (7-9 x 4-5 μm), truncadas por un poro germinal, la ausencia de pleurocistidios, el hábito terrestre (Pegler 1987) y la coloración marrón de los basidiomas caracterizan a Psathyrella murrillii. La especie fue descrita originalmente de bosques secos (Smith 1972) y tal como se desprende de la distribución conocida, el registro aquí, de esta especie, es una novedad para Suramérica.
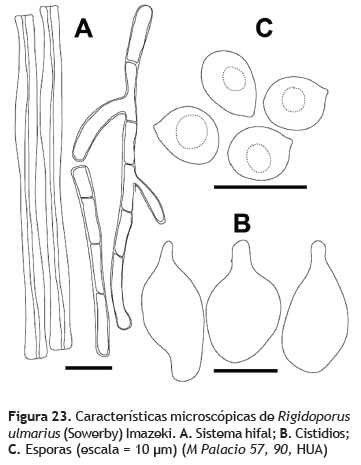
Rigidoporus ulmarius (Sowerby) Imazeki, Bull. Gov. Forest Exp. Stn Tokyo 57: 119 (1952) Figura 22
Polyporus ulmarius Fr.
Fomes geotropus Cooke.
Basidiocarpos: hasta 30 cm de diámetro, flabeliforme, reniforme, dimidiado a ampliamente adherido al sustrato; superficie concéntricamente zonada, rugosa, glabra color naranja con colores más oscuros en el centro, marrón naranja y hacia el margen color mandarina. Contexto: 0,5 cm de grosor, blanco. Himenóforo: poroide, poros diminutos, 5 poros por mm, color naranja pálido. Tubos naranja, hasta 0,5 cm de longitud (figura 22). Sistema hifal: dimítico; hifas generativas 3-4 μm de grosor, paredes engrosadas, hialinas, hifas esqueléticas 5-6 μm de grosor, de paredes gruesas, septadas, septos simples. Basidios: no observados (figura 23A). Cistidios: 19- 21 x 7-10 μm, ventricosos, con ápice agudo, hialinos (figura 23B). Esporada: no obtenida. Esporas: 6-7 x 6- 7 μm (Q = 1,1), subglobosas, pared gruesa, hialinas (figura 23C).
Hábito y hábitat: gregario, sobre tronco de gran tamaño, caído, al interior del bosque.
Distribución: cosmopolita (Ryvarden y Johansen 1980), Rigidoporus ulmarius es una especie ampliamente distribuida en los trópicos, ha sido registrada en varias localidades en África, en Europa, donde generalmente se encuentra sobre árboles del género Ulmus (Ulmaceae) (Ryvarden y Johansen 1980), en América Central en el estado de Chiapas, México (Chanona-Gómez et al. 2007), en Costa Rica (Carranza y Ruiz-Boyer 2005), el estado de Santa Catarina, Brasil (Loguercio-Leite et al. 2009) y Argentina (Robledo y Rajchenberg 2007).
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes. 10° 34' 34,5'' N, 73° 16' 35,4'' O, elev. 640 m, 4 jul. 2012, Melissa Palacio 57 (HUA); 10° 34' 38,6'' N, 73° 16' 10,9'' O, elev. 523 m, 14 sep. 2012, Melissa Palacio 90 (HUA).
Observaciones: Rigidoporus ulmarius se diferencia de otras especies del género Rigidoporus por los basidiomas gruesos (hasta 30 cm de diámetro en este caso) y grandes, además de las esporas de gran tamaño (6-7 x 6-7 μm) (Ryvarden y Johansen 1980).
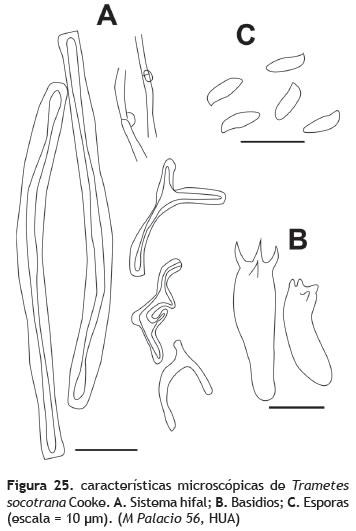
Trametes socotrana Cooke, Grevillea 11 (no. 57): 39 (1882). Figura 24
Basidiocarpo: 2,5-5,5 cm de diámetro, efuso-reflexo a ampliamente adherido al sustrato; superficie tomentosa color amarillo pálido a crema. Himenóforo: poroide a dentado, 4 poros por mm, concoloro con la superficie. Contexto: 0,1 cm de ancho, color blanco (figura 24). Sistema hifal: trimítico; hifas generativas hialinas, fibuladas, 3 μm de grosor, hifas esqueléticas hialinas, de paredes muy gruesas, 5-6 μm de grosor, hifas de unión muy ramificadas, de paredes muy gruesas a sólidas, tipo bovista, 3-4 μm de grosor (figura 25A). Pileipelis: tricodermal, formado por hifas esqueléticas de 5-6 μm de grosor. Basidios: 14-18 x 3-5 μm, hialinos, 4-esterigmados (figura 25B). Cistidios: no observados. Esporada: no obtenida. Esporas: 6 x 3 μm (Q = 2,1), lisas, cilíndricas a ampliamente elípticas, hialinas, inamiloides (figura 25C).
Hábito y hábitat: gregario, creciendo sobre tronco en descomposición, al interior del bosque.
Distribución: pantropical, ha sido observada en Brasil, en el este de África (Etiopia, Kenia, Tanzania, Burundi y Malawi) (Ryvarden y Johansen 1980).
Ejemplares examinados: COLOMBIA: Cesar: Valledupar: Santuario de Vida Silvestre Los Besotes, 10°34.345'N, 73°16.354'W. 640 m. 4 Jul 2012, Melissa Palacio 56 (HUA).
Observaciones: Trametes socotrana, se caracteriza por el color blanco a crema de los basidiocarpos, las esporas aproximadamente 6 x 3 μm, cilíndricas a ampliamente elípticas, hialinas, inamiloides y cistidios ausentes. Trametes socotrana es una especie encontrada en manglares (Baltazar et al. 2009), áreas frecuentemente secas y de sequías estacionales (Ryvarden y Johansen 1980), como lo es el bosque seco tropical.
DISCUSIÓN
El bosque seco tropical (bs-T), es una zona de vida que representa coberturas que ocupan un extremo en condiciones climáticas. Los bosques secos exhiben durante algunos meses del año estrés hídrico, alta luminosidad y elevadas temperaturas, pero además son muy característicos sus suelos ácidos y pobres en nutrientes, por lo tanto, no presentan condiciones muy apropiadas para el desarrollo de muchos macrohongos. Aún así, la constante caída de hojas crea una abundante litera que conforma, junto con los demás componentes del suelo, un rico substrato orgánico y provee condiciones microclimáticas con condiciones apropiadas de humedad (generalmente altas) y temperatura que favorecen la fructificación de los hongos (Dix y Webster 1995). Es interesante notar que estudios de micotas en bosques secos en Asia (Chalermpongse 1987), sugieren que la diversidad de hongos ectomicorrízicos en estos bosques, puede ser tan o más alta que la encontrada en bosques húmedos. Aún así, el estudio de micotas del bosque seco es muy pobre y los datos demasiado fragmentarios como para poder establecer con alguna certeza las causas que subyacen la diversidad de hongos en bosques secos del trópico.
A pesar de que en la reserva de Los Besotes fueron encontrados algunos especímenes de géneros ectomicorrízicos, como Amanita y Phlebopus, debido a la estructura compleja que presentan los bosques de tierras bajas se dificulta evidenciar una correlación entre estos hongos y la vegetación (Dennis 1970), particularmente por la ausencia de especies dominantes. Por otra parte, es posible que especies de estos géneros como Phlebopus sean hongos facultativos, y en este caso particular, siendo hongos saprobios como ya anteriormente ha sido señalado por Singer et al. (1983), por lo cual se dificulta proponer una hipótesis sobre la naturaleza ectomicorrízica de las especies. La ocurrencia de especies ectomicorrízicas en este bosque seco resulta muy relevante, pues es conocido que, en comparación con zonas templadas, las comunidades de hongos ectomicorrízicos en los trópicos son menos diversas (Tedersoo et al. 2011), lo cual puede ser producto de suelos poco estructurados por las altas temperaturas, la erosión y el lavado continuo, además, muchos de estos hongos pueden ser hospederos específicos de ciertas plantas y por ende estar restringidos espacialmente a la distribución de dichas especies. Para establecer con certeza el hábito ectomicorrízico de estas especies, debe realizarse una búsqueda exhaustiva en las raíces de las plantas cercanas, para corroborar la presencia de estructuras como red de Hartig. Estudios recientes en bosques secos deciduos de Dipterocarpaceae en Tailandia, sugieren que la diversidad de hongos ectomicorrizicos es tan alta como la de bosques húmedos, pero que se requiere ampliar las escalas temporales y espaciales de muestreo para poder tener mejor conocimiento de las relaciones de las micotas en bosques secos y sus hospederos comparadas con aquellas de bosques húmedos (Pohsri et al. 2012).
Con respecto a las distribuciones de los taxa aquí registrados puede evidenciarse que aunque algunas especies como Phlebopus beniensis, Phellinus merrillii, P. aff. umbrinellus, Rigidoporus ulmarius, Trametes socotrana y Deaedalea flavida han sido halladas en varias localidades y son consideradas como especies pantropicales, otros macrohongos como Amanita crebresulcata, Marasmius cohortalis y Podoscypha petalodes no muestran un patrón específico, algunas han sido consideradas como especies neotropicales y otras como Amanita aureofloccosa registrada en África y en India, y Psathyrella murrillii conocida solo de Cuba y Martinica, son especies raras y no muestran un patrón biogeográfico particular. Los patrones biogeográficos de algunas especies pueden corresponder con la distribución real de estos taxa, pero en algunos otros casos como Ganoderma resinaceum, considerada anteriormente como una especie pantropical (Ryvarden 2004), realmente se trata de una especie rara, con un nombre mal aplicado a gran número de organismos (Torres-Torres et al. 2012).
Es difícil establecer el significado de los resultados aquí obtenidos en términos de cómo se compara la diversidad de macrohongos en Los Besotes con las micotas de otros bosques secos tropicales. Pohsri et al. (2012) encontraron que en bosques secos de Asia, son mucho más diversos los linajes de Lactarius, Russula, Sebacina, y que si bien la diversidad es comparable con otros bosques secos tropicales, la estructura filogenética de las comunidades exhibe en esos bosques elementos tanto de ecosistemas tropicales como templados. En Los Besotes la diversidad más alta la exhiben los linajes de Phellinus y Trametes pero la composición de la comunidad en estos bosques no es muy distante de la encontrada en bosques del Paleotrópico. Es evidente que el muestreo aquí presentado genera más preguntas que respuestas, que es aún muy limitado para poder tener un efecto comparativo significativo, y que inventarios y seguimientos a largo plazo, complementados con herramientas de tipo molecular, pueden ayudarnos a ampliar el muestreo de forma apreciable y así poder obtener mejor apreciación de la diversidad de macrohongos en bosques secos tropicales (Pohsri et al. 2012).
AGRADECIMIENTOS
La ejecución de este trabajo fue posible gracias al apoyo del Laboratorio de Taxonomía Ecología de Hongos (TEHO), del Instituto de Biología, Universidad de Antioquia, donde se realizaron todas las descripciones de cada especie, a la dirección Regional de la mencionada Universidad que apoyó económicamente para el desplazamiento al área de estudio. Idea Wild concedió equipos de fotografía y GPS al autor principal. La Fundación Eco Besotes facilitó y financió desplazamiento y alojamientos en el área de estudio. Carlos López (Laboratorio de Taxonomía y Ecología de Hongos) y Leif. Ryvarden (Universidad de Oslo), concedieron apoyo para clarificar la taxonomía de varias especies. El Herbario HUA facilitó el secado y depósito de las colecciones.
REFERENCIAS
Baltazar JM, Baptista T. 2009. A checklist of the aphyllophoroid fungi (Basidiomycota) recorded from the Brazilian Atlantic Forest. Mycotaxon, 109: 439-442. [ Links ]
Baltazar JM, Trierveiler-Pereira L, Loguercio-Leite C. 2009. A checklist of xylophilous basidiomycetes (Basidiomycota) in mangroves. Mycotaxon, 107: 221-224. [ Links ]
Barbosa C, Ruiz C, García H, Gutiérrez T. 2008. Ubicación del Santuario de Vida Silvestre Los Besotes. En: Rodríguez-Mahecha JV, Márquez W, editores. Guía ilustrada de plantas destacadas del Santuario de Vida Silvestre Los Besotes Valledupar, Cesar, Colombia. Conservación Internacional. Con descripciones y anotaciones sobre distribución, aspectos ecológicos y usos locales. Serie de Guías Tropicales de Campo. Conservación Internacional. Bogotá: Editorial Panamericana. p. 15-17. [ Links ]
Bas C. 1969. Morphology and subdivision of Amanita and a monograph of its section Lepidella. Persoonia, 5 (3): 285-579. [ Links ]
Bas C. 1978. Studies in Amanita I. Some Amazonian species. Persoonia, 10 (1): 1-22. [ Links ]
Bhatt RP, Tullos RE, Semwal K, Moncalvo J-M, Stephenson SL. 2003. Amanitaceae reported from India. A critically annoted checklist. Mycotaxon, 88: 249-270. [ Links ]
Betancur MA, Calderón MH, Betancourt OG, Sucerquia AG. 2007. Hongos macromycetes en dos relictos de bosque húmedo tropical montano bajo de la vereda la Cuchilla, Marmato, Caldas. Boletín Científico. Centro de Museos. Museo de Historia Natural, 11: 19-31. [ Links ]
Carranza J, Ruiz-Boyer A. 2005. Checklist of polypores of Costa Rica. Revista Mexicana de Micología, 20: 45-52. [ Links ]
Cepero-de García MC, Restrepo S, Franco-Molano AE, Cárdenas M, Vargas N. 2012. Biología de hongos. Bogotá: Uniandes. p. 497. [ Links ]
Chalermpongse, A. 1987. Mycorrhizal survey of dry-deciduous and semi-evergreen dipterocarp forest ecosystems in Thailand. En: Kostermans AJGH, editor. Proceedings third round table conference on dipterocarps. Bogor: UNESCO, Jakarta. p. 81-102. [ Links ]
Chanona-Gómez F, Andrade-Gallegos RH, Castellanos-Albores J, Sánchez JE. 2007. Macrofungi from Parque Educativo Laguna Bélgica, Municipality of Ocozocoautla de Espinosa, Chiapas, Mexico. Revista Mexicana de Biodiversidad, 78: 369-381. [ Links ]
Chardon CE. 1928. Contribución al estudio de la flora micológica de Colombia. Boletín de la Sociedad Española de Historia Natural, 28 (2): 111-124. [ Links ]
Dennis RW. 1970. Fungus flora of Venezuela and adjacent countries. Kew Bulletin Additional Series III. Londres: J. Cramer. Vaduz. p. 531. [ Links ]
Dix JN, Webster J. 1995. Fungal Ecology. Londres: Champman y Hall. p. 549. [ Links ]
Etter A. 1993. Diversidad ecosistémica en Colombia hoy. En Nuestra diversidad biótica. Bogotá: Cerec y Fundación Alejandro Ángel Escobar. p 43-61. [ Links ]
Franco-Molano AE, Uribe-Calle E. 2000. Hongos Agaricales y Boletales de Colombia. Biota Colombiana, 1 (1): 25-43. [ Links ]
Franco-Molano AE, Aldana R, Halling R. 2000. Setas de Colombia (Agaricales, Boletales y otros hongos). Guía de campo. Medellín: Colciencias-Universidad de Antioquia. p. 156. [ Links ]
Franco-Molano AE, Vasco-Palacios AM, López-Quintero CA, Boekhout T. 2005. Macrohongos de la región del medio Caquetá-Colombia, Guía de campo, Grupo Taxonomía y Ecología de Hongos. Medellín: Universidad de Antioquia, Multimpresos. p. 219. [ Links ]
García A, Bolaños AC. 2010. Macrohongos presentes en el bosque seco tropical de la región del Valle del Cauca, Colombia. Revista de Ciencias, Universidad del Valle, 14: 45-54. [ Links ]
Gilbert GS, Gorospe J, Ryvarden L. 2008. Host and habitat preferences of polypore fungi in Micronesian tropical flooded forests. Mycological Research, 112 (6): 674-680. [ Links ]
Gilbertson RL, Ryvarden L. 1993. European Polypores. Oslo: Synopsis fungorum 6, Fungiflora. p 743. [ Links ]
Gomes-Silva AC, Gibertoni BT. 2009. Checklist of the aphyllophoraceous fungi (Agaricomycetes) of the Brazilian Amazonia. Mycotaxon, 108: 319-322. [ Links ]
González-Ball R., Ruiz-Boyer A, Carranza J. 2004. Lenzites acuta Berk. (Polyporaceae, Polyporales), un nuevo registro para Costa Rica y Panamá. Brenesia, 62: 75-76. [ Links ]
Guzmán G, Varela L. 1978. Los hongos de Colombia III. Observaciones sobre los hongos, líquenes y mixomicetos de Colombia. Caldasia, 12 (58): 309-338. [ Links ]
Guzmán G, Torres M, Ramírez-Guillen F, Ríos-Hurtado A. 2004. Introducción al conocimiento de los Macromicetos del Chocó, Colombia. Revista Mexicana de Micología, 19: 33-43. [ Links ]
Halling R. 1989. A Synopsis of Colombian Boletes. Mycotaxon, 34 (1): 93-113. [ Links ]
Hawksworth DL. 1991. The fungal dimension of biodiversity: magnitude, significance and conservation. Mycological Research, 95: 641-655. [ Links ]
Hawksworth DL. 2001. The magnitude of fungal diversity: The 1.5 million species estimate revisited. Mycological Research, 105: 1422-1432. [ Links ]
Hoang-Pham N-D, Yamada A, Shimizu K, Noda K, Tuan-Dang L-A, Suzuki A. 2012. A sheathing mycorrhiza between the tropical bolete Phlebopus spongiosus and Citrus maxima. Mycoscience 53 (5): 347-353. [ Links ]
Holdridge LR. 2000. Ecología basada en zonas de vida. Quinta reimpresión. San José (Costa Rica): Instituto Interamericano de Cooperación para la Agricultura (IICA). p. 216. [ Links ]
IavH (Instituto Alexander von Humboldt). 1998. El Bosque seco tropical (bs-T) en Colombia. Programa de inventario de la biodiversidad grupo de exploraciones y monitoreo ambiental GEMA. p. 24 [ Links ]
Largent DL. 1986. How to identify mushrooms to genus. (I) Macroscopic features; (II; III) Field identification of genera and microscopic features. California: Mad River Press Inc. p. 166. [ Links ]
Largent DL, Johnson D, Watling R. 1977. How to identify mushrooms to genus III: microscopic features. California: Mad River Press Inc., Eureka Printing Co. Inc. p. 148. [ Links ]
Larsen MJ, Cobb-Poulle LA. 1990. Phellinus (Hymenochaetaceae) a survey of the world taxa. Oslo: Synopsis fungorum 3. Fungiflora. p. 206. [ Links ]
Lodge JD, Chapela I, Samuels G, Uecker FA, Desjardin D, Horak E, Milller OK Jr, Hennebert GL, Decock CA, Ammirati J, Burdsall, HH Jr, Krik PM, Minter DW, Hailing R, Laessoe T, Mueller G, Huhndorf S, Oberwinkler F, Pegler DN, Spooner B, Peterson RH, Rogers JD, Ryvarden L, Watling R, Turnbull E, Whalley AJS. 1995. A survey of patterns of diversity in non-lichenized Fungi. Mitteilungen der Eidgenössischen Forschungsanstalt Wald Schnee Landschaft, 70 (1): 157-173. [ Links ]
Lodge JD, Mueller GM, O'Dell TE. 2004 Approaches to sampling macrofungi. En: Mueller GM, Bills GF, Foster MS, editores. Biodiversity of fungi: inventory and monitoring methods. Elsevier. p 127-172. [ Links ]
Loguercio-Leite C, Campos-Santana M, Gerlach A, Guthjar M, Trierveiler-Pereira L, Drechsler-Santos R, Baltazar JM. 2009. Sinopse de Macromicetes em Santa Catarina, Brasil. Revista de Botânica Insula, Florianópolis, 38: 1-14. [ Links ]
Mueller GM, Schmit JP. 2007. Fungal biodiversity: What do we know? What can we predict? Biodiversity and Conservation, 16:1-5. [ Links ]
Newman EI, Reddell P. 1987. The Distribution of Mycorrhizas among families of vascular plants. New Phytologist, 106: 745-751. [ Links ]
Núñez M, Ryvarden L. 2000. East Asian polypores 1. Ganodermataceae and Hymenochaetaceae. Oslo: Synopsis Fungorum 13. Fungiflora. p.168. [ Links ]
Núñez M, Ryvarden L. 2001. East Asian polypores 2. Polyporaceae s. lato. Oslo: Synopsis Fungorum 14. Fungiflora. p. 170-522. [ Links ]
Pegler DN. 1977. A preliminary agaric flora of East Africa. Kew Bulletin Additional series VI. Londres: H.M. Stationery Off. p. 615. [ Links ]
Pegler DN. 1983. Agaric flora of the Lesser Antilles. Kew Bulletin Additional series IX. Londres: Royal Botanic Garden. p. 668. [ Links ]
Pegler DN. 1987. A Revision of the Agaricales of Cuba 2. Species described by Earle and Murrill. Kew Bulletin: 42 (4): 855-888. [ Links ]
Pohsri Ch., Polme S, Taylor AF, Koljalg U, Suwannasai N, Thedersoo L. 2012. Diversity and community composition of ectomycorrhizal fungi in a dry deciduous dipterocarp forest in Thailand. Biodiversity and Conservation, 21 (9): 2287-2298. [ Links ]
Pulido MM. 1983. Estudios en agaricales colombianos: los hongos de Colombia IX. Biblioteca José Jerónimo Triana N.° 7. Bogotá (Colombia): Instituto de Ciencias Naturales, Universidad Nacional de Colombia. p. 143. [ Links ]
Reid DA. 1965. A monograph of the stipitate stereoid fungi. Beihefte zur Nova Hedwigia. Heft 18. p. 483. Junk publ. Berlin [ Links ]
Robledo GL, Rajchenberg M. 2007. South American polypores: first annotated checklist from Argentinean Yungas. Mycotaxon, 100: 5-9. [ Links ]
Rogers JD, Dumont KP. 1979 Los Hongos de Colombia VI. Two New Applanate Species of Hypoxylon. Mycologia, 71 (4): 807-810. [ Links ]
Ryvarden L. 1976. Type studies in the Polyporaceae, 7. Species Described by J. M. Berkeley from 1836 to 1843. Kew Bulletin 31 (1): 81-103. [ Links ]
Ryvarden L, Johansen I. 1980. A preliminary polypore flora of East Africa. Oslo: Fungiflora. p. 636. [ Links ]
Ryvarden L, Gilbertson RL. 1993. Abortiporus-Lindneria. European Polypores. Synopsis fungorum, 6. Oslo: Fungiflora. p. 387 [ Links ]
Ryvarden L, Iturriaga T. 2001. Studies in Neotropical Polypors 9. A critical checklist of poroid fungi from Venezuela. Mycotaxon, 78: 393-405. [ Links ]
Ryvarden L. 2004. Neotropical polypores. Synopsis fungorum 19. Oslo: Fungiflora. p. 229. [ Links ]
Singer R. 1976. Marasmieae (Basidiomycetes–Tricholomataceae). Bronx, New York: Organization for Flora Neotropica by the New York Botanical Garden. p. 347. [ Links ]
Singer R, Araujo I, Ivory MH. 1983. The ectotrophically mycorrhizal Fungi of the Neotropical Lowlands, especially Central Amazonia. Beihefte zur Nova hedwigia. Alemania: Lubrecht & Cramer Limited. p. 352. [ Links ]
Smith AH. 1972. The North American species of Psathyrella. Memories of the New York Botanical Garden, 24: 1-633. [ Links ]
Sulzbacher MA, Grebenc T, Jacques RJS, Antoniolli ZI. 2013. Ectomycorrhizal fungi from southern Brazil – a literature-based review, their origin and potential hosts. Mycosphere, 4 (1): 61-95. [ Links ]
Tedersoo L, Bahram M, Jairus T, Bechem E, Chinoya S, Mpumba R, Leal M, Randrianjohany E, Razafimandimbison S, Sadam A, Naadel T, Kõljalg U. 2011. Spatial structure and the effects of host and soil environments on communities of ectomycorrhizal fungi in wooded savannas and rain forests of continental Africa and Madagascar. Molecular Ecology, 20: 3071-3080. [ Links ]
Torres-Torres MG, Guzmán-Dávalos L, Gugliotta A. 2012. Ganoderma in Brazil: known species and new records. Mycotaxon, 121: 93-132. [ Links ]
Tulloss R, Ovrebo C, Halling R. 1992. Studies on Amanita (Amanitaceae) from Andean Colombia. Memories of the New York Botanical Garden. 66: 27-30 [ Links ]
Vasco-Palacios AM, Franco-Molano AE. 2013. Diversity of Colombian macrofungi (Ascomycota-Basiciomycota). Mycotaxon, 121: p. 48. [ Links ]
Vasco-Palacios AM, Franco-M AE, López-Q CA, Boekhout T. 2005. Macromicetes (Ascomycota, Basidiomycota) de la región del Medio Caquetá, departamentos de Caquetá y Amazonas (Colombia). Biota Colombiana, 6 (1): 127-140. [ Links ]
Wannathes N, Desjardin DE, Retnowati A, Tan YS, Lumyong S. 2004. A redescription of Marasmius pellucidus, a species widespread in South Asia. Fungal Diversity, 17: 203-218. [ Links ]
Wartchow F, Maia LC. 2007. The Neotropical Amanita crebresulcata Bas: new citation from Northeast Brazil. Hoehnea, 34 (2): 131-134. [ Links ]