Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.38 no.104 Medellín Jan./June 2016
https://doi.org/10.17533/udea.acbi.v38n104a04
ARTÍCULOS DE INVESTIGACIÓN
doi: 10.17533/udea.acbi.v38n104a04
Inocuidad citotóxica y mutagénica de los aceites esenciales de Rosmarinus officinalis L. y Ruta graveolens L. promisorios para el tratamiento complementario de la infección por Helicobacter pylori
Cytotoxic and mutagenic innocuousness of essential oils of Rosmarinus officinalis L. and Ruta graveolens L. as a promising complimentary treatment of Helicobacter pylori infection
Sandra J. Mena-Huertas1,4,5; Juan P. García-López1,6; Sindy N. Nicola-Benavides2; María C. Yépez-Chamorro3
1 Docente, Departamento de Biología, Ciudad Universitaria Torobajo, Universidad de Nariño. Pasto (Nariño), Colombia.
2 Estudiante, Departamento de Biología, Ciudad Universitaria Torobajo, Universidad de Nariño. Pasto (Nariño), Colombia. bionatik22@gmail.com.
3 Directora Centro de Estudios en Salud (CESUN), Ciudad Universitaria Torobajo, Universidad de Nariño. Pasto (Nariño), Colombia. mcych@udenar.edu.co.
Correos electrónicos: 4. sajamena@udenar.edu.co; 5. jmenahuertas@ymail.com; 6. jgarcia861@gmail.com.
Recibido: septiembre 2014; aceptado: agosto 2015.
Resumen
La infección por Helicobacter pylori afecta aproximadamente la mitad de la población mundial, se adquiere en la infancia y se ha asociado con desarrollo de gastritis crónica, úlcera péptica y cáncer de estómago en la edad adulta. El tratamiento que incluye dos o tres antibióticos ha generado problemas de resistencia bacteriana, efectividad, costo y seguridad; evidenciando la necesidad del desarrollo de nuevas terapias alternativas. El grupo de investigación Salud Pública de la Universidad de Nariño (Pasto, Colombia), determinó que los aceites esenciales puros de Rosmarinus officinalis L. y Ruta graveolens L. presentan actividad anti-H. pylori in vitro; pero no analizaron su inocuidad para consumo humano. Este estudio evalúa la citotoxicidad de ambos aceites en linfocitos humanos mantenidos en cultivo y su mutagenicidad mediante el prueba de Ames con la cepa TA-100 de Salmonella typhimurium. El aceite esencial de R. officinalis no presentó efecto citotóxico ni mutagénico en ninguna concentración evaluada en comparación con los controles. El aceite esencial puro de R. graveolens fue citotóxico (viabilidad de linfocitos inferior al 40%); sin embargo, en diluciones 10-1 hasta 10-5, este aceite se considera seguro en los dos sistemas de ensayo. Estos resultados demuestran que ambos extractos son promisorios para el consumo humano y a futuro, podrían considerarse como una alternativa para tratamiento complementario de H. pylori.
Palabras clave: aceites esenciales, citotoxicidad, Helicobacter pylori, mutagenicidad, Rosmarinus officinalis, Ruta graveolens.
Abstract
Helicobacter pylori infection affects approximately half of world's population, is acquired in infancy and has been associated with the development of chronic gastritis, peptic ulcers and stomach cancer in adulthood. The usual treatment that includes two or three antibiotics has led to problems of bacterial resistance, decreased effectiveness, price and safety; showing the need to develop alternative therapies. The Public Health Research Group of the University of Nariño (Pasto, Colombia) found that essential oils of Rosmarinus officinalis (L.) and Ruta graveolens (L.) have anti-H. pylori activity in vitro; however, their innocuousness for human consumption was not examined. This study evaluated the cytotoxicity of both oils in human lymphocytes maintained in culture and their mutagenicity by the Ames test with the Salmonella typhimurium strain TA-100. The essential oil of R. officinalis did not present cytotoxic or mutagenic effects in any concentration compared to controls. Pure concentrate of the R. graveolens essential oil was cytotoxic (cell viability 40% lower); however, in dilutions of 10-1 to 10-5, this oil was shown to be safe in both assay systems. These results show that both extracts are promissory for human consumption and in the future, could be considered as an option for complimentary treatment for H. pylori.
Key words: essential oils, cytotoxicity, mutagenicity, Helicobacter pylori, Rosmarinus officinalis, Ruta graveolens.
INTRODUCCIÓN
A nivel mundial se ha generado una gran preocupación asociada a la rápida propagación de clones bacterianos resistentes a las terapias convencionales con antibióticos (Maves et al. 2011). Esto, ha hecho necesaria la búsqueda de alternativas de tratamiento de infecciones bacterianas, y los metabolitos de las plantas son una opción interesante dado que, muchos de ellos tienen una fuerte actividad antimicrobiana (Silva y Fernandes 2010). Su acción sinérgica entre sí y en combinación con antibióticos y quimioterapéuticos hacen un valioso complemento a la terapia anti-infecciosa (Aboaba et al. 2006, Burt 2004).
La infección por Helicobacter pylori presenta altas tasas de incidencia a nivel mundial y causa inflamación crónica del estómago, que aumenta el riesgo de desarrollar úlcera péptica y cáncer gástrico. Generalmente la infección se adquiere en la infancia y suele persistir a largo plazo sin síntomas específicos (Goodman et al. 1997, 2011). El tratamiento de primera línea para la erradicación de H. pylori incluye tres fármacos: un inhibidor de la bomba de protones (PPI) y los antibióticos amoxicilina y claritromicina (CAM), pero la erradicación solo ocurre en el 70-90% de los casos, generando así cepas resistentes, de allí la importancia de buscar terapias alternativas que permitan realizar mejor manejo de esta infección (Deguchi et al. 2012). Estudios previos realizados en nuestro grupo de investigación, teniendo como base los usos etnobotánicos de algunas plantas de la región sur occidental de Colombia, demostraron que existe elevado potencial del aceite esencial de follaje de Ruta graveolens L. (ruda) y Rosmarinus officinalis L. (romero) para controlar in vitro cepas de H. pylori, aisladas de biopsias de pacientes (Mena y Yépez 2007).
La especie R. graveolens conocida popularmente como ruda, es un arbusto pequeño de hoja perenne fuertemente aromática perteneciente a la familia Rutaceae que se distribuye en todo el mundo y ha sido utilizada en tratamientos medicinales desde la época de los griegos y romanos (Kannan y Babu 2012). Posee más de 120 compuestos, principalmente alcaloides, cumarinas, aceites esenciales, flavonoides y las fluoroquinolonas, por ello ha sido ampliamente utilizada en la medicina tradicional de diferentes países para el tratamiento de trastornos que incluyen procesos infecciosos e inflamatorios, patologías digestivas, musculares e incluso control tumoral (Preethi et al. 2006). Por otro lado, R. officinalis, conocido como romero, es un arbusto aromático, perteneciente a la familia de las Lamiaceae, es apreciado por su potencial terapéutico y utilizado para el tratamiento de trastornos respiratorios o gastrointestinales, resfriados, fiebre, tos, asma, sinusitis, reumatismo, tratamientos antimicrobianos, e incluso en desordenes cardiovasculares, nerviosos y terapia antitumoral, así como acelerar el proceso de cicatrización de heridas (Barnes et al. 2007, Bradley 2006, Sienkiewicz et al. 2013).
Los resultados obtenidos en la investigación de Mena y Yépez (2007), en relación a los aceites esenciales de estas plantas, determinan que tienen un potencial in vitro anti-H. pylori, sin embargo, para poder recomendarlos como una posible terapia complementaria contra la infección, es necesario estudiar sus posibles efectos deletéreos en diversos sistemas celulares, determinar dosis efectivas mínimas, establecer su formulación, entre otros, antes de hacer pruebas in vivo y poder recomendarlos para el consumo humano. En este estudio se evaluó el efecto citotóxico de los aceites esenciales de R. graveolens y R. officinalis en linfocitos humanos y su efecto mutagénico con la prueba de mutagenicidad en Salmonella typhimurium, usando la cepa TA-100 his- (Maron y Ames 1983).
MATERIALES Y MÉTODOS
Material biológico. La recolección de las muestras se realizó siguiendo el modelo de muestreo aleatorio simple en 9 cultivos caseros de 3 zonas rurales del municipio de Pasto, departamento de Nariño (Colombia), a partir de los cuales fueron recolectadas al azar plantas o follaje en buen estado, libres de patógenos evidentes, y posteriormente, se verificó su clasificación en el herbario PSO de la Universidad del Nariño con la colaboración del director del Herbario, luego fueron deshidratados mediante secado en el horno a 37 °C durante 24 h antes de la extracción. Para obtener los extractos de aceite esencial (AE) se utilizó el método de hidrodestilación asistida por radiación con microondas (MWHD) según el protocolo estandarizado por Gómez y Moran (2005). Brevemente, se trituró 1.500 g de material seco y se introdujo en un balón de 4 l de capacidad, al que se adicionaron 200 ml de agua destilada y se acopló al sistema de hidrodestilación tipo Clevenger, con reservorio de destilación tipo Dean-Stark y calentamiento por radiación mediante un horno microondas (modelo LG MB-14VG), con una potencia de salida 2.450 MHz (7% de la potencia máxima) durante 90 min, con 1 min intermedio de pausa cada 10 min. El aceite esencial fue recolectado en tubos tipo Ependorff ámbar de 1,5 ml estériles, alicuotados en 100 μl, cubiertos con papel aluminio y conservados a -20 °C hasta su posterior evaluación.
Análisis de citotoxicidad y determinación de concentraciones de trabajo. Para esta prueba se emplearon linfocitos humanos de sangre periférica de un donante, que ha criterio clínico y mediante interrogatorio medico cumplió con los siguientes requisitos: ser joven (20 a 35 años), no fumador, no haber ingerido alcohol un mes antes de la donación de sangre, quien firmó el respectivo consentimiento para participar en este estudio. Los linfocitos se aislaron por el método tradicional en gradiente de Hystopaque® (Boyum 1968). Para esto, se recolectaron 5 ml de sangre en un tubo Vacutainer con heparina y se mezcló por inversión con 5 ml de buffer fosfato de sodio (PBS) en proporción 1:1, posteriormente, 5 ml de esta mezcla se transfirieron, lentamente por las paredes y evitando la formación de turbulencia, a un tubo Falcon de 15 ml de capacidad que contenía 3 ml de Hystopaque®1077 de Sigma (Boyum 1968), se verificó la formación de dos capas y se centrifugó durante 30 min a 2.000 rpm, se extrajo con precaución la capa de linfocitos y se transfirió a otro tubo limpio y seco. Finalmente, se descartó el PBS y se agregó 1 ml de medio RPMI-1640 (sigma) suplementado con suero fetal bovino (SFB) al 10%. Se determinó la viabilidad inicial mediante la técnica de exclusión por azul de tripano y se incubaron en el mismo medio a 37 ºC por 6 h.
Posteriormente, se evaluaron 4 concentraciones de aceite esencial, desde puro hasta 10-3, las diluciones seriadas se hicieron en DMSO al 1%. La prueba se realizó en una solución de 100.000 linfocitos y 10 μl de la solución del extracto a evaluar en cada una de las concentraciones, además del control respectivo con DMSO al 1%, se cultivaron en medio RPMI suplementado con SFB al 10% en un volumen final de 250 μl. Se incubaron a 37 °C y cada hora se evaluó la viabilidad mediante el método de exclusión de azul de tripano, durante 6 h.
En cada caso se realizaron tres experimentos independientes (n = 3), cada uno por duplicado. Se calculó el porcentaje de viabilidad absoluta y los resultados se analizaron mediante una prueba de t múltiple y la significancia se determinó con el método Holm-Sidak en el software Pad Prism v5.0 (GraphPad Software Inc. CA, EE. UU.). Los aceites se consideraron citotóxicos si el porcentaje de viabilidad calculado estaba en un rango entre el 0 a 39%, moderadamente citotóxicos si la viabilidad oscilaba entre 40 a 79% y no citotóxicos cuando presentaban un porcentaje de viabilidad igual o superior al 80% (Mena et al. 2011).
Ensayo de mutagenecidad y premutagenicidad. Para este ensayo se utilizó la cepa TA-100 his-, donada por el Laboratorio de Mutagénesis de la Universidad de Antioquia y diseñada por Bruce Ames, que detecta un amplio rango de sustancias químicas que pueden producir daño genético, específicamente esta cepa detecta mutaciones por sustitución de pares de bases (Maron y Ames 1983). Se verificó que los controles de reversión espontánea de la cepa TA-100 estuviesen dentro del rango establecido a nivel mundial (Mortelmans y Zeiger 2000) y se siguió el protocolo descrito por Maron y Ames (1983). La ejecución del ensayo consistió en el análisis de las dosis de los dos tipos de aceites, previamente determinadas con el análisis de citotoxicidad, incluyendo las diluciones 10-4 y 10-5, con la cepa TA-100 sin y con activación metabólica (en presencia de la fracción microsomal S9). Se realizó una mezcla de 100 μl de inóculo de la cepa TA-100 (1 x 108 bacterias aproximadamente) con 100 μl de la dilución de AE a evaluar y se incubó durante 30 min a 37 °C, posteriormente se mezcló con el top agar, esta mezcla se sirvió en agar mínimo, se llevó a incubación a 37 °C durante 48 h. Al finalizar este tiempo, se hizo el recuento de colonias revertantes y se creó una base de datos con estos resultados para su posterior análisis. Se realizaron tres experimentos independientes, cada uno por duplicado y se incluyeron como controles positivos: 2 aminofluoreno (2AF) (10 μg por placa) en el tratamiento con S9 y azida de sodio (NaN3) (5 μg por placa) en el tratamiento sin S9, el control negativo fue DMSO al 1%.
Para cuantificar la mutagenicidad se utilizó el índice de mutagenicidad (Ím), obtenido de los promedios de tres experimentos independientes, cada uno por duplicado. El Ím se refiere al número de veces que el tratamiento supera la mutagenicidad del control. Teniendo en cuenta los criterios de Watanabe et al. (2003), se establecieron las siguientes categorías:

Los análisis de los resultados del número de colonias revertantes de las diferentes pruebas se realizaron usando el software Pad Prism v5.0 de (GraphPad Software Inc. CA, EE. UU.), se realizó análisis de varianza con un α = 0,05 y un valor de confiabilidad del 99%, y posterior análisis de medias tipo Dunnett.
RESULTADOS
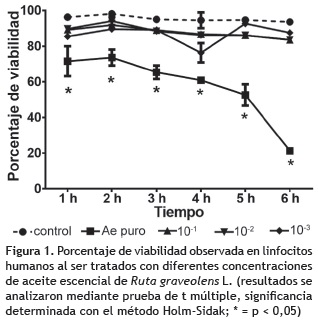
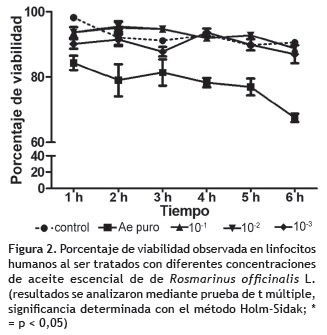
Ensayo de citotoxicidad. El análisis de varianza realizado con el porcentaje de viabilidad de los linfocitos humanos del ensayo de citotoxicidad, señala que para el caso de aceite esencial de R. graveolens existen diferencias estadísticas significativas entre los conteos celulares obtenidos con en el tratamiento con extracto puro y el resto de tratamientos (p < 0,05), demostrando que el extracto puro presenta citotoxicidad con una viabilidad inferior al 40% en 6 h de cultivo (figura 1), por esta razón el extracto puro se descartó para el posterior análisis de mutagenicidad. En el caso de aceite esencial de R. officinalis, no se observaron diferencias estadísticas significativas entre las concentraciones estudiadas y el control (figura 2), por lo tanto se consideraron todas las concentraciones (v/v) para los análisis de premutagenicidad y mutagenicidad.
Con los resultados obtenidos se determinó que el AE puro de R. graveolens induce citotoxicidad, el resto de diluciones evaluadas (10-1 a 10-3), se consideran no citotóxicas para este sistema de ensayo. Para el caso de R. officinalis, el AE puro y las diluciones evaluadas (10-1 a 10-3) no son citotóxicas. Sin embargo, para ambos tipos de aceites es necesario realizar pruebas adicionales en otros sistemas de ensayo para descartar cualquier tipo de daño celular que puedan causar.
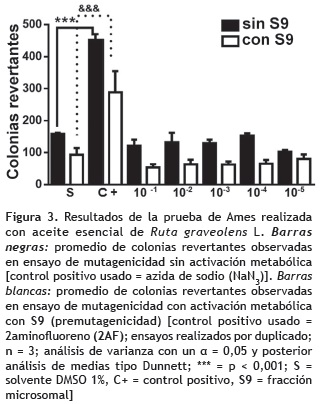
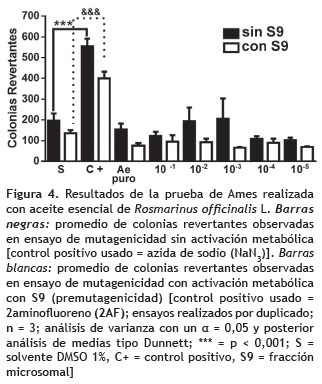
Ensayo de mutagenecidad en Salmonella typhimurium (prueba de Ames). Las pruebas para requerimiento de histidina, mutación rfa, mutación uvrB, y la presencia del factor R del plásmido PKM101 de resistencia a ampicilina de la cepa TA-100 fueron positivas (Maron y Ames, 1983), los valores de reversión espontánea observados se encontraron dentro del rango estandarizado en el laboratorio de Mutagénesis de la Universidad de Antioquia, Medellín (entre 75-90 colonias). Al evaluar el promedio de colonias revertantes observadas en cada caja, solamente los controles positivos en cada uno de los ensayos presentan diferencias estadísticas significativas respecto al control negativo con solvente tanto para el aceite esencial de R. graveolens (figura 3) como para el de R. officinalis (figura 4). Evidenciando así ausencia de efecto mutagénico ó premutagénico en ambos extractos y en las concentraciones evaluadas.
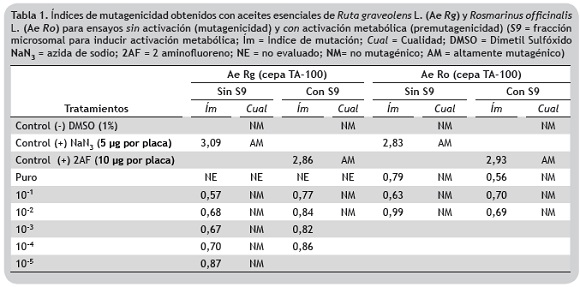
Índice de mutación (Ím). En la tabla 1, se muestran los valores correspondientes al Ím obtenidos para el aceite esencial de R. graveolens y de R. officinalis respectivamente. Estos resultados sugieren que no hubo actividad mutagénica con la cepa TA-100 de S. typhimurium en ninguna de las concentraciones evaluadas, en los dos tipos de aceite esencial el Ím fue menor de 1,5.
DISCUSIÓN
La infección por H. pylori afecta a aproximadamente la mitad de la población mundial, generalmente se adquiere en la infancia y se ha asociada con el desarrollo de gastritis crónica, úlcera péptica y cáncer de estómago en la edad adulta. El tratamiento convencional con dos o tres antibióticos más un inhibidor de la bomba de protones, ha generado problemas asociados con la resistencia desarrollada por las bacterias, la seguridad, efectividad y el costo, evidenciando la necesidad de la búsqueda de nuevas alternativas de tratamiento para la infección (Silva y Fernandes 2010, Ryuzo et al. 2012). Una revisión hecha por Wang (2014), relaciona 34 estudios que incluyeron a más de 80 extractos de plantas con actividad anti-H. pylori. Mena y Yépez (2007), evaluaron la actividad antimicrobiana in vitro de extractos de plantas medicinales promisorias sobre aislamientos de H. pylori, encontrando que, entre otros, los aceites esenciales puros de R. officinalis y R. graveolens presentaron actividad anti-H. pylori con halos de inhibición de 10,55 y 10,30 mm, respectivamente. Continuando con esta línea de trabajo, en este estudio evaluamos la actividad citotóxica y mutagénica como parte del proceso de determinar la inocuidad y seguridad biológica de estos extractos, para poder recomendarlos a futuro como parte de una terapia complementaria para el tratamiento de H. pylori.
Citotoxicidad. Con los resultados obtenidos en la prueba de linfocitos se determinó que el aceite esencial puro de R. graveolens presenta diferencias estadísticas significativas en la viabilidad celular con el control y el resto de tratamientos; esto sugiere la presencia de citotoxicidad dado que a las 6 h de tratamiento se alcanza una viabilidad promedio de 21%. Sin embargo, el resto de diluciones evaluadas (10-1, 10-2 y 10-3), se consideran seguras según este estudio. En relación a este fenómeno, se puede señalar que de manera general ensayos fisicoquímicos in vitro han caracterizado a la mayoría de los aceites esenciales de plantas aromáticas como antioxidantes; pero, algunos estudios demuestran que en las células eucariotas los aceites esenciales de plantas aromáticas pueden actuar como prooxidantes y, que según el tipo y la concentración, estos pueden exhibir efectos citotóxicos en las células (Bakkali et al. 2008). Aunque se desconocen los mecanismos específicos de citotoxicidad asociados a los aceites esenciales, estos bien pudieran involucrar cambios en la permeabilidad de las membranas o en la actividad de enzimas mitocondriales que conducirían a la muerte celular (Bakkali et al. 2008, Di Pascua et al. 2007). El estudio de Varamini et al. (2009) usando ensayo de proliferación celular WST-1, demuestra actividad citotóxica del extracto total puro de R. graveolens sobre líneas celulares tumorales de diferente origen, en cada una de las líneas evaluadas presentaron distintos niveles de toxicidad, destacándose la actividad observada sobre las líneas RAJI y RAMOS. Trovato et al. (1996), señalan que probablemente la citotoxicidad está asociada a la presencia de flavonoides en los extractos de dicha planta. Si este aceite esencial estuviese generando cambios en la permeabilidad de membrana que pueden afectar la viabilidad celular como lo señalaron Bakkali et al. (2008), de alguna manera, la actividad citotóxica observada en el ensayo, podría estar asociada al efecto bactericida determinado en el trabajo de Mena y Yépez (2007) sobre aislamientos de H. pylori.
Coincidiendo con los resultados de este estudio, no se encontró antecedentes bibliográficos de citotoxicidad por extractos de R. officinalis. Estudios realizados por Bai et al. (2010), aseguran que compuestos flavonoides aislados de esta especie han presentado efecto antioxidante y antiinflamatorio desde leve a intenso sobre diversas líneas celulares. Kim et al. (2010), señalan que el diterpeno fenólico ''carnosol'' presente en R. officinalis tiene efecto protector sobre la línea celular glial c6 cuando ha sido sometida a toxicidad inducida. Al revisar estudios relacionados con la actividad biológica del aceite esencial de R. officinalis se encontró que Vijayan et al. (2004), demostraron que el AE puro de esta planta presentó una actividad antiviral moderada sobre HSV-1 (Herpes simplex).
Ensayo de mutagenicidad (prueba de Ames). Se demostró que las dosis evaluadas para cada uno de los extractos de R. graveolens y R. officinalis no indujeron efecto mutagénico ni premutagénico en el ensayo de mutagenecidad con preincubación y activación metabólica en S. typhimurium en la cepa TA-100.
Varios estudios con diferentes aceites esenciales o sus componentes principales han demostrado que, de manera general no inducen mutaciones nucleares. Según Bakkali et al. (2008), la mayor parte de los aceites esenciales se han caracterizado por no presentar efectos mutagénicos y es probable que también estén desprovistos de carcinogenicidad. En la década de los 90 se realizaron varias investigaciones con compuestos aislados de R. graveolens, por ejemplo; el alcaloide puro isogravacridonchlorina aislado de la raíz de la planta fue evaluado por Paulini et al. (1991) y determinaron que actuaba como potente causante de mutaciones frameshift en S. typhimurium. Por otro lado, Schimmer et al. (1991) señalaron el efecto de furocoumarinas (compuestos presentes en el aceite esencial del follaje de R. graveolens) como inhibitorio del efecto premutagénico de dictamnina y rutacridona también aislados de R. graveolens, concluyendo que el efecto inhibitorio probablemente ocurre por la inactivación que produce la furocoumarina del complejo enzimático P450 que está encargado de la activación de premutágenos, en el caso de la reducción de premutagenicidad de dictamnina puede deberse a un sistema competitivo con la furocumarina por el mismo sitio de unión a la molécula de ADN. Por lo tanto, es probable que los compuestos presentes en el aceite esencial de ruda realicen sistemas de autorregulación entre sí que controlen el efecto mutagénico y premutágenico de estos extractos, explicando así los resultados obtenidos en esta investigación.
Recientemente, un estudio realizado en la línea celular en células HepG2 por Zegura et al. (2011), con el extracto comercial AquaROX®15 de R. officinalis, demuestra un claro efecto protector de este extracto ante mutaciones inducidas por 4-nitroquinolina-N-oxido (NQNO) y 2-amino-3-metil-3H-imidazol[4,5-F]quinolina (IQ) en S. typhimurium TA-98, considerándolo así como un producto potencialmente antimutágeno y antioxidante. Esto coincide ampliamente con los resultados de nuestro estudio en el que ninguna de las dosis de AE de esta planta, produjo efecto mutagénico, sería interesante evaluar a futuro su efecto anti-mutagénico.
Los constituyentes más importantes de los extractos de romero son: el ácido rosmarínico, ácido carnósico, carnosol, rosmanol, flavonoides y otros compuestos fenólicos (Hernández et al. 2009). El ácido rosmarínico es un éster de ácido cafeico y ácido 3,4-dihydroxifenilictico del cual se ha demostrado un amplio número de actividades biológicas interesantes tales como anti-depresivo, hepato-protectora, anti-inflamatoria, anti-angiogénico, antitumoral y agente fotoprotector, entre otras (Li et al. 2010, Peng et al. 2007). El ácido carnósico y carnosol, poseen propiedades anti-bacterianas, anti-mutagénicas, anti-inflamatorias antiproliferativas, anti-tumorigénicas y neuroprotectoras (Izumi et al. 2007, Oluwatuyi et al. 2004, Peng et al. 2007, Satoh et al. 2008). El ácido carnósico y el carnosol se considera que representan más del 90% de las propiedades antioxidantes del extracto de romero, son potentes inhibidores de la peroxidación de lípidos y buenos eliminadores de radicales peroxilo (Aruoma et al. 1992). Se ha demostrado que carnosol interfiere con la metástasis de células tumorales, la quimiotaxis, la unión y la inhibición de la invasión por la orientación eventos celulares mediados por mataloproteinasas (Huang y Zheng 2006). Estos componentes interactuando en la mezcla compleja del aceite esencial utilizado en este estudio explican claramente los resultados obtenidos y permiten considerarlo como un extracto potencial para el consumo humano.
Los resultados de mutagenicidad y citotoxicidad de los aceites esenciales de R. graveolens y R. officinalis son similares a los obtenidos con el aceite esencial de Carica candamarcensis que también ha demostrado ser promisorio para el control in vitro de H. pylori (Mena et al. 2011).
En conclusión, el aceite esencial puro de R. graveolens se considera citotóxico; por ello, en esta concentración no se puede recomendar para consumo humano; sin embargo, el resto de concentraciones evaluadas se consideran ''seguras'' de acuerdo a los sistemas de ensayo utilizados. En el caso del aceite esencial de R. officinalis, no se observaron indicios de actividad citotóxica y mutagénica a ninguna concentración, por lo tanto los dos tipos de extractos podrían ser potencialmente usados en una terapia complementaria anti-H. pylori.
AGRADECIMIENTOS
Agradecemos la financiación de este trabajo al sistema de investigaciones de la Universidad de Nariño y al Centro de Estudios en Salud de la Universidad de Nariño. Al laboratorio de Mutagénesis de la Universidad de Antioquia por la donación de la cepa TA-100 de S. typhimurium usada en este estudio. A Jhon Jairo Calderón por sus aportes en el componente estadístico.
REFERENCIAS
Aboaba OO, Smith SI, Olude FO. 2006. Antibacterial effect of edible plant extract on Escherichia coli O157:H7. Pakistan Journal of Nutrition, 5: 325-327. [ Links ]
Aruoma OI, Halliwell B, Aeschbach R, Loligers J. 1992. Antioxidant and pro-oxidant properties of active rosemary constituents: carnosol and carnosic acid. Xenobiotica, 22: 257-268. [ Links ]
Bai N, He K, Roller M, Lai CS, Shao X, Pan MH, Ho CT. 2010. Flavonoids and phenolic compounds from Rosmarinus officinalis. Journal of Agricultural and Food Chemistry, 58: 5363-5367. [ Links ]
Bakkali F, Averbeck S, Averbeck D, Idaomar M. 2008. Biological effects of essential oils. Food and Chemical Toxicology, 46 (2): 446-475. [ Links ]
Barnes J, Anderson LA, Phillipson JD. 2007. Herbal medicines. London: Pharmaceutical Press. p. 710. [ Links ]
Boyum A. 1968. Isolation of mononuclear cells and granulocytes from human blood. Isolation of monuclear cells by one centrifugation, and of granulocytes by combining centrifugation and sedimentation at 1 g. Scandinavian Journal of Clinical and Laboratory Investigation, Supplement, 97: 77-89. [ Links ]
Bradley P. 2006. British herbal compendium: A handbook of scientific information on widely used plant drugs. Volumen 2. Bournemouth (Inglaterra): British Herbal Medicine Association. p. 409. [ Links ]
Burt S. 2004. Essential oils: their antibacterial properties and potential applications in foods - A review. International Journal of Food Microbiology, 94: 223-253. [ Links ]
Deguchi R, Nakaminami H, Rimbara E, Noguchi N, Sasatsu M, Suzuki T, Matsushima M, Koike J, Igarashi M, Ozawa H, Fukuda R, Takagi A. 2012. Effect of pretreatment with Lactobacillus gasseri OLL2716 on first-line Helicobacter pylori eradication therapy. Journal of Gastroenterology and Hepatology, 27 (5): 888-892. [ Links ]
Di Pascua R., Betts G, Hoskins N, Eewars M, Ercolini D, Mauriello G. 2007. Membrane toxicity of antimicrobial compounds from essential oils. Journal of Agricultural and Food Chemistry, 55: 4863-4870. [ Links ]
Gómez D, Morán M. 2005. Extracción e identificación de los metabolitos secundarios presentes en los frutos maduros de Carica candamarcensis Hooker filius [Tesis de Grado]. [Pasto (Colombia)]: Universidad de Nariño. p. 250. [ Links ]
Goodman KJ, Correa P, Tengana-Aux HJ, DeLany JP, Collazos T. 1997. Nutritional factors and Helicobacter pylori infection in Colombian children. Journal of Pediatric Gastroenterology and Nutrition, 25: 507-515. [ Links ]
Goodman KJ, Correa P, Mera R, Yépez M, Cerón C, Campo C, Guerrero N, Sierra M, Bravo L. 2011. Effect of Helicobacter pylori infection on growth velocity of school-age Andean children. Epidemiology, 22 (1): 118-126. [ Links ]
Hernández E, Ponce E, Jaramillo ME, Guerrero I. 2009. Antioxidant effect rosemary (Rosmarinus officinalis L.) and oregano (Origanum vulgare L.) extracts on TBARS and colour of model raw pork batters. Meat Science, 81: 410-417. [ Links ]
Huang S, Zheng R. 2006. Rosmarinic acid inhibits angiogenesis and its mechanism of action in vitro. Cancer Letters, 239: 271-280. [ Links ]
Izumi M, Satoh T, Inukai Y, Tutumi Y, Nakayama N, Kosaka K, Itoh K. 2007. Carnosic acid and carnosol as neuroprotective electrophilic compounds. Neuroscience Research, 58: 208-1208. [ Links ]
Kannan R, Babu UV. 2012. Identity and pharmacognosy of Ruta graveolens Linn. Ancient Science of Life, 32 (1): 16-19. [ Links ]
Kim SY, Park E, Park JA, Choi BS, Kim S, Jeong G, Kim CS, Kim-do K, Kim SJ, Chun HS. 2010. The plant phenolic diterpene carnosol suppresses sodium nitroprusside-induced toxicity in c6 glial cells. Journal of Agricultural and Food Chemistry, 58 (3): 1543-1550. [ Links ]
Li GS, Jiang WL, Tian JW, Qu GW, Zhu HB, Fu FH. 2010. In vitro and in vivo antifibrotic effects of rosmarinic acid on experimental liver fibrosis. Phytomedicine, 17 (3-4): 282-288. [ Links ]
Maron D, Ames B. 1983. Revised methods for the Salmonella mutagenicity test. Mutation Research, 113 (3-4): 173-215. [ Links ]
Maves RC, Castillo R, Guillen A, Espinosa B, Meza R, Espinoza N, Núñez G, Sánchez L, Chacaltana J, Cepeda D, González S, Hall ER. 2011. Antimicrobial susceptibility of Brucella melitensis isolates in Peru. Antimicrobial Agents and Chemotherapy, 55: 1279-1281. [ Links ]
Mena-Huertas J, Yépez-Chamorro MC. 2007. Actividad antibacteriana in vitro de extractos de plantas medicinales regionales promisorias sobre aislamientos de Helicobacter pylori. Revista Universidad y Salud, 1 (8): 7-15. [ Links ]
Mena-Huertas J, Embus-Córdoba C, Rosero-Ruiz VL, Navarro-Yépez J, Ortiz-Trujillo IC, Yépez-Chamorro MC. 2011. Ausencia de efecto citotóxico, mutagénico y genotóxico de extracto acuoso y aceite esencial de Carica candamarcensis Hook. (Plantae: Caricaceae). Actualidades Biológicas, 33 (95): 153-164. [ Links ]
Mortelmans K, Zeiger E. 2000. The Ames Salmonella/microsome mutagenicity assay. Mutation Research, 455 (1-2): 29-60. [ Links ]
Oluwatuyi M, Kaatz GW, Gibbons S. 2004. Antibacterial and resistance modifying activity of Rosmarinus officinalis. Phytochemistry, 65: 3249-3254. [ Links ]
Paulini H, Popp R, Schimmer O, Ratka O, Röder E. 1991. Isogravacridonchlorine: a potent and direct acting frameshift mutagen from the roots of Ruta graveolens. Planta Medica, 57 (1): 59-61. [ Links ]
Peng CH, Su JD, Chyau CC, Sung TY, Ho SS, Peng CC, Peng RY. 2007. Supercritical fluid extracts of rosemary leaves exhibit potent antiinflammation and anti-tumor effects. Bioscience, Biotechnology and Biochemistry, 71: 2223-2232. [ Links ]
Preethi KC, Kuttan G, Kuttan R. 2006. Anti-tumour activity of Ruta graveolens extract. Asian Pacific Journal of Cancer Prevention, 7 (3): 439-443. [ Links ]
Ryuzo D, Hidemasa N, Emiko R, Norihisa N, Masanori S, Takayoshi S, Masashi M, Jun K, Muneki I, Hideki O, Ryuki F, Atsushi T. 2012. Effect of pretreatment with Lactobacillus gasseri OLL2716 on first-line Helicobacter pylori eradication therapy. Journal of Gastroenterology and Hepatology, 27 (5): 888-892. [ Links ]
Satoh T, Izumi M, Inukai Y, Tsutsumi Y, Nakayama N, Kosaka K, Shimojo Y, Kitajima C, Itoh K, Yokoi T, Shirasawa T. 2008. Carnosic acid protects neuronal HT22 cells through activation of the antioxidant-responsive element in free carboxylic acid- and catechol hydroxyl moieties-dependent manners. Neuroscience Letters, 434 (3): 260-265. [ Links ]
Schimmer O, Kiefer J, Paulini H. 1991. Inhibitory effects of furocoumarins in Salmonella typhimurium TA98 on the mutagenicity of dictamnine and rutacridone, promutagens from Ruta graveolens L. Mutagenesis, 6 (6): 501-506. [ Links ]
Sienkiewicz M, Lysakowska M, Pastuszka M, Bienias W, Kowalczyk E. 2013 . The potential of use basil and rosemary essential oils as effective antibacterial agents. Molecules, 5: 18 (8): 9334-9351. [ Links ]
Silva NC, Fernandes A. 2010. Biological properties of medicinal plants: A review of their antimicrobial activity. Journal of Venomous Animals and Toxins including Tropical Diseases, 16: 402-413. [ Links ]
Trovato A, Monforte MT, Rossitto A, Forestieri AM. 1996. In vitro cytotoxic effect of some medicinal plants containing flavonoids. Bollettino Chimico Farmaceutico, 135 (4): 263-266. [ Links ]
Varamini P, Soltani M, Ghaderi A. 2009. Cell cycle analysis and cytotoxic potential of Ruta graveolens against human tumor cell lines. Neoplasma, 56 (6): 490-493. [ Links ]
Vijayan P, Raghu C, Ashok G, Dhanaraj SA, Suresh B. 2004. Antiviral activity of medicinal plants of Nilgiris. Indian Journal of Medical Research, 120: 24-29. [ Links ]
Wang YC. 2014. Medicinal plant activity on Helicobacter pylori related diseases. World Journal of Gastroenterology, 20 (30): 10368-10382. [ Links ]
Watanabe T, Hasei T, Takahashi Y, Otake S, Murahashi T, Takamura T, Hirayama T, Wakabayashi K. 2003.Mutagenic activity and quantification of nitroarenes in surface soil in the Kinki region of Japan. Mutation Research, 538 (1-2): 121-131. [ Links ]
Zegura B, Dobnik D, Niderl MH, Filipic M. 2011. Antioxidant and antigenotoxic effects of rosemary (Rosmarinus officinalis L.) extracts in Salmonella typhimurium TA98 and HepG2 cells. Environmental Toxicology and Pharmacology, 32 (2): 296-305. [ Links ]