Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.38 no.105 Medellín July/Dec. 2016
https://doi.org/10.17533/udea.acbi.v37n105a03
ARTÍCULOS DE INVESTIGACIÓN
doi: 10.17533/udea.acbi.v37n105a03
Efecto de la ivermectina sobre la estructura del ensamble de escarabajos coprófagos (Coleoptera: Scarabaeidae: Aphodiinae-Scarabaeinae) en las sabanas colombianas de la región Caribe
Ivermectin effect on the structure of the ensembles of dung beetles (Coleoptera: Scarabaeidae: Aphodiinae-Scarabaeinae) in the Colombian savannahs of the Caribbean region
Hernando L. Tovar1, Jorge Ari Noriega2, Pedro Caraballo3
1 Maestría en Ciencias Ambientales, Universidad de Sucre. Sincelejo (Sucre), Colombia. hernando.tovar@hotmail.com
2 Laboratorio de Zoología y Ecología Acuática (LAZOEA), Universidad de Los Andes. Bogotá, Colombia. jnorieg@hotmail.com
3 Grupo de Biodiversidad Tropical, Universidad de Sucre. Sincelejo (Sucre), Colombia. pedro.caraballo@unisucre.edu.co.
Recibido: septiembre 2015; aceptado: abril 2016 (Received: September 2015; accepted: April 2016).
Resumen
Sustancias como la ivermectina son utilizadas para el control de parásitos internos y externos del ganado, sin que se haya determinado el efecto sobre la estructura, distribución y comportamiento de otros organismos, entre ellos los escarabajos coprófagos (Coleoptera). En ese sentido, no se sabe cómo influye su uso sobre las pasturas dedicadas a la alimentación, al disminuir las especies de escarabajos en periodos de sequía, cuando el efecto diluyente de la lluvia no existe. Para estimar este efecto se realizaron recolectas durante tres días, en cuatro periodos, entre enero y marzo del 2014, en una finca ganadera en las sabanas de la región Caribe colombiana (Sucre). Se tomaron dos parcelas, una con animales tratados con ivermectina (CIv) y otra con animales sin tratamiento (SIv). Los escarabajos se recolectaron utilizando 20 trampas de caída y se revisaron 144 bostas directamente. Se estimó el efecto de la ivermectina y se analizó la relación entre la precipitación y el número de individuos. Se recolectaron 2.160 individuos pertenecientes a Aphodiinae y Scarabaeinae, con cuatro especies, siendo las más abundantes Ataenius cf. saulensis y Digitonthophagus gazella (99%). Se recolectaron 55,3% de individuos en CIv y 44,7% en SIv; las especies A. cf. saulensis y D. gazella estuvieron presentes en todos los periodos y tratamientos. Se encontró correlación positiva entre precipitación y abundancia para los tratamientos. Se sugiere leve atracción a las bostas y trampas CIv, evidenciando su efecto negativo. Es necesario continuar estudiando el efecto del uso de las ivermectinas sobre los procesos funcionales en agroecosistemas.
Palabras clave: abundancia, bosque seco tropical, bostas, Coleoptera, Colombia, finca ganadera, ivermectina.
Abstract
Anti-parasite drugs as ivermectin are being used for internal and external parasites control in bovine cattle, without a scientific support that determined the effect on the structure, behavior or distribution of dung beetles. In this framework, an important problem emerge that consist of the lack of knowledge about which is the effect of using ivermectin in pastures when the populations of dung beetles decreases in dry periods, when the positive effect of rain disappear. Samplings were realized during three days, in four periods, between January and March of 2014, in a cattle property in the region Sabanas of the Sucre department in north of Colombia. Two pasture plots were monitored, one with animals treated with ivermectin (CIv) and another one with no treatment (SIv). The dung beetles were collected using 20 pitfall traps and 144 dung piles were reviewed directly. We estimated the effect of ivermectin and analyzed the relationship between precipitation and dungs abundance. 2.160 individuals belonging to four species from Aphodiinae and Scarabaeinae were collected, being the most abundant Ataenius cf. saulensis and Digitonthophagus gazella. We collect 55,3% individuals in CIv and 44,7% in SIv. Ataenius cf. saulensis and D. gazella were present in all periods and treatments. We found a positive correlation between precipitation and dungs abundance for the two treatments. Also it was found a slight attraction to piles and traps with ivermectin, demonstrating its negative effect on dung beetles. It is necessary to continue studying the effect of the use of ivermectin on functional processes on different ecosystems.
Key words: abundance, cattle farm, Coleoptera, Colombia, dung piles, ivermectin, tropical dry forest.
INTRODUCCIÓN
A nivel mundial, las explotaciones ganaderas han experimentado una revolución tecnológica, como repuesta al incremento en el consumo de alimentos. Se han introducido mejoras genéticas, implementación de pastos, rotación de potreros, mejoramiento en las dietas alimenticias y nuevos tratamientos veterinarios para los animales (Molinari 2010). Sin embargo, los parásitos han sido uno de los problemas sanitarios de mayor impacto económico, dada la resistencia que adquieren a los fármacos, particularmente en animales de producción. El éxito de estos fármacos en el mercado depende de su eficiencia terapéutica, pero las investigaciones en los últimos años, están dirigidas también a su metabolismo, bioquímica, toxicología y persistencia en los animales tratados; para el caso de los antiparasitarios su importancia es mucho mayor por su uso masivo en animales productores de carne y leche (Pérez et al. 2006).
En la década de los años 80 se introdujo un nuevo antihelmíntico, conocido comercialmente por su ingrediente activo, la ivermectina, derivada de la avermectina B1 el cual es el agente sistémico más utilizado para el control de nemátodos y artrópodos en el mundo (Campbell et al. 1983, Jackson 1989, Molinari 2010). El mecanismo de acción de la ivermectina consiste en que la molécula se une a los canales del ion cloro de las células nerviosas y musculares de la mayoría de los invertebrados, produciendo aumento de la permeabilidad de la membrana e hiperpolarización, lo cual causa parálisis y muerte por inanición (McCavera 2009). Esta droga se puede utilizar tanto como endo o ectoparasitícida y administrar a los animales a través de una solución inyectable subcutánea, solución tópica de aplicación, solución oral, pasta oral, tabletas, comprimidos y bolo rumiar. Su amplio espectro de actividad, potencia y persistencia, promovió el entusiasmo de otras empresas para desarrollar sustancias análogas (Holden-Dye y Walker 2007). La forma de eliminación de la ivermectina es a través de las heces, causando alteraciones a la fauna coprófaga por afectación del comportamiento, desarrollo, tasa de oviposición y fecundidad (Floate 2007), como también su atracción hacia el estiércol (Wardhaugh y Mahon 1991).
En condiciones naturales, la producción de forraje en los agroecosistemas depende del reciclaje de la materia orgánica producida, de la cantidad y disponibilidad de los minerales en el suelo, y del aporte de esta materia orgánica a través de las bostas del ganado vacuno (Anduaga y Huerta 2007, Fincher 1981, Thomas 2001). Un bovino adulto produce en promedio 12 bostas al día, lo que representa aproximadamente 4 kg en seco (HR; 80%) (Lancon 1978). Las condiciones climáticas en el periodo de invierno (lluvias, sol, viento) favorecen el reciclaje de las bostas, liberándose elementos orgánicos y minerales (Krüger y Scholtz 1998). La eficiencia del proceso de reciclaje de la materia orgánica, aportada por las bostas, ocurre cuando estas son desmenuzadas y enterradas en el suelo por los escarabajos coprófagos (Holter 1979). La incorporación de los residuos de las bostas al suelo contribuye al enriquecimiento de los horizontes edáficos subyacentes (Kalisz y Ston 1984), incrementando de esta manera las poblaciones de los micro artrópodos (Bertrand y Lumaret 1984, Yokoyama et al. 1991). De igual manera, se favorece la relación bacteria/hifas (Bertrand y Lumaret 1984) y se incrementa el desarrollo de bacterias amoniacales que aceleran el reciclaje y recirculación del nitrógeno (Loiseau et al. 1984). A nivel general, las bostas son aprovechadas por un sinnúmero de organismos, algunos nocivos para el ganado, como el caso la mosca Haematobia irritans, que produce efectos nocivos al disminuir la producción de leche y carne (Guglielmone et al. 1999). En una bosta pueden desarrollarse de 60 a 80 ejemplares de moscas, pero cuando se produce una competencia con otros insectos, como el caso de los escarabajos, la proliferación de huevos decrece en un 95% (Thomas 2001).
El uso de drogas (como en este caso el uso de ivermectinas) en este tipo de agroecosistemas ganaderos, puede alterar el funcionamiento de los organismos descomponedores (Krüger y Scholtz 1998, Lumaret y Errouissi 2002, Verdu et al. 2015) duplicando el periodo de incorporación de las bostas al suelo y generando consecuencias directas más graves como disminución del área efectiva de pastoreo, menor ciclaje de nutrientes y aireación, acidificación de los suelos, y naturalmente, disminución de poblaciones de insectos que se alimentan del estiércol, con implicaciones directas sobre el control biológico y la diversidad biológica regional (Anduaga y Huerta 2007, Lobo y Veiga 1990).
El principal grupo encargado de la degradación del estiércol, en estos ecosistemas, son los escarabajos coprófagos (Coleoptera: Scarabaeidae), ya que utilizan este recurso como fuente de alimento y reproducción (Anduaga y Huerta 2007), realizando una muy importante labor en los potreros, contribuyendo al reciclaje e incorporación de los nutrientes (Holter 1979), a la dispersión de semillas (Andersen y Feer 2005), al control biológico de parásitos y dípteros (Estrada y Coates-Estrada 1991), incrementando la permeabilidad y retención de agua (Yokoyama et al. 1991), y la aireación (Lobo y Veiga 1990). Para este tipo de agroecosistemas con frecuentes perturbaciones, los escarabajos coprófagos son buenos bioindicadores para analizar el grado de afectación de los procesos ambientales (Escobar y Medina 1996, Kremen et al. 1993, Montes de Oca 2001), por lo que se les ha utilizado con mucha frecuencia para estudios de evaluación y vigilancia de la biodiversidad, ya que responden de manera cualitativa y cuantitativa a la pérdida del hábitat y a los efectos de la fragmentación (Concha-Lozada et al. 2010, Halffter y Favila 1993, Nichols et al. 2008, Otavo et al. 2013).
Cabe anotar que para el departamento colombiano de Sucre, se cuenta con muy pocos trabajos (Amell 2012, Navarro et al. 2011, Noriega et al. 2013, 2015) en tal sentido. En este contexto, un problema que no ha sido considerado y evaluado a nivel regional, es el posible efecto del uso de las ivermectinas sobre el área de pastoreo vacuno, en el escenario de una drástica disminución de algunas especies de escarabajos coprófagos, especialmente en periodos de sequía cuando el efecto diluyente de la lluvia no existe. Por todo lo anterior, el objetivo de esta investigación fue evaluar el efecto del uso de la ivermectina, usada para el control de parásitos en el ganado bovino, sobre la estructura del ensamble de escarabajos coprófagos en el periodo de sequía, en una finca ganadera en la región Caribe de Colombia.
MATERIALES Y MÉTODOS
Área de estudio. Se ubica en la finca San Rafael, vereda Los Muñecos, municipio de Los Palmitos, departamento de Sucre, Colombia (9° 25' 29,06'' N, 75° 13' 52,34'' O, 214 m. s. n. m., figura 1). Las temperaturas en esta región oscilan entre los 24 y 32 °C y la precipitación varía entre 858 y 1.607 mm (Clavijo y Barrera 2001). El periodo de sequía se inicia en diciembre y finaliza en marzo (en ocasiones prolongándose hasta abril) y el periodo de lluvias va de abril a noviembre. La zona presenta relieve ligeramente ondulado sobre materiales arcillosos con arena, cascajo y gravilla, derivados del Cuaternario antiguo (IGAC 1998). Por sus características climáticas el área corresponde a la zona de vida de Bosque seco Tropical (BsT; Holdridge 1978).
Según información suministrada por la Unidad Municipal de Asistencia Técnica (UMATA) de Los Palmitos, esta región ha presentado periodos de ganadería extensiva y siembra de cultivos comerciales (p. ej., yuca, ñame, tabaco, maíz y algodón). Durante las últimas dos décadas ha sido escenario de una profunda intervención de los suelos a través de la mecanización agrícola con arado de disco y uso de agroquímicos. En los últimos cinco años, se ha introducido nuevamente la ganadería extensiva como un sistema adicional de producción de leche y carne.
A nivel específico, la finca San Rafael, es una propiedad ganadera en la cual nunca se ha llegado a utilizar ivermectinas en el ganado, mientras que en algunas fincas cercanas existen algunos pocos ganaderos que utilizan ivermectinas, pero la mayoría no lo usan. Las zonas de pastoreo están dominadas por pasto colosuana [Bothriochloa pertusa (L) A. Camus], delimitado por cercas vivas de mata ratón (Gliricidia sepium) y hobo (Spondias bombin). Las áreas circundantes a la finca, están compuestas por zonas de ganadería extensiva y algunos pequeños cultivos de pan coger. Los potreros de la finca se utilizan de manera rotacional con ocho días de ocupación y 30 días de descanso para la recuperación del pasto. La carga animal es de dos unidades animales (2 UA/ha-1), considerando una unidad como 450 kg de peso vivo.
Diseño experimental y muestreo: trampas y bostas. Se seleccionaron dos parcelas de la finca San Rafael, que se encuentran una al lado de la otra separadas por una cerca de alambre, con 1 ha de área aproximada cada una. Se colocaron seis vacunos en cada una de las parcelas, en la parcela N.° 1 animales sin tratamiento de ivermectinas (SIv), y en la N.° 2, animales con tratamiento con ivermectinas (CIv) los cuales fueron desparasitados en enero del 2014, con 1 ml de Next Platino® de MK®, vía subcutánea por cada 50 kg de peso vivo (cada dosis proporciona 630 μg de ivermectina por kg de peso).
Para determinar la estructura (riqueza, abundancia y composición) del ensamble de escarabajos coprófagos, se seleccionaron diez puntos de muestreo para cada una de las dos parcelas (Decante y Van Helden 2008). Cada punto de muestreo se separó del otro por 20 m y en cada uno se ubicó una trampa de caída (tipo pitfall), compuesta por un recipiente plástico de 1,5 l, con diámetro de 10 cm y altura de 20 cm, los cuales se enterraron a ras de suelo, con aproximadamente 200 ml de solución conservante (Lobo et al. 1988, Noriega y Fagua 2009, Villareal et al. 2004). La separación de 20 m entre trampas no permite la interferencia de olor del desparasitante químico (Ward et al. 2001) y se ha utilizado en trabajos similares (Blackshaw y Vernon 2008, Flota-Bañuelos et al. 2012). Los cebos colocados en cada trampa, consistían en 150 g de excremento fresco de vaca envueltos en gasa. Los muestreos se realizaron cada 15 días (uno en el mes de enero, dos en febrero y uno en marzo de 2014, en total, cuatro muestreos) dejando en cada muestreo las 20 trampas (10 por parcela) activas por 72 horas y renovando el cebo (cambiando el viejo por cebo fresco) y recolectando los individuos encontrados cada 24 horas (120 trampas x 72 horas = 2.880 horas trampa por parcela en total). Los escarabajos capturados en cada muestreo, se colocaron en frascos con alcohol al 70%.
Adicionalmente, para dimensionar la función realizada por los escarabajos en cada parcela se seleccionaron y se muestrearon de forma aleatoria treinta y seis bostas, seis en cada parcela cada 24 horas. Cada noche y cada día se tomaron manualmente tres bostas por parcela y se depositaron en bolsas plásticas rotuladas, para luego diluirlas en agua, haciéndolas pasar por un tamiz de 0,1 mm, para capturar los escarabajos, los cuales se recogieron y guardaron en frascos con alcohol al 70%. Posteriormente, se etiquetaron y se identificaron a especie, comparando con material de referencia de la colección del segundo autor (CJAN).
Análisis estadístico. La representatividad del muestreo se evaluó por medio de curvas de acumulación de especies [por método de muestreo (trampa/bosta) y por tratamiento (SIv y CIv)] con estimadores ACE, Chao1 y MMMean, utilizando el programa EstimateS 6,0 (Colwell 2000). La media total de individuos recolectados por periodos de muestreo se calculó como la sumatoria de todos los individuos a través del programa InfoStat (Balzarini et al. 2008). Se realizó un análisis de varianza y una prueba de Tukey para las especies más abundantes entre los muestreos por tratamiento con un alfa de 0,05. Para estimar la relación entre la precipitación y el número de individuos, se realizó una correlación simple de rangos de Spearman (rs) con un nivel de confianza de 95%. Para evaluar el efecto de la ivermectina sobre la abundancia, se utilizó un modelo lineal mixto para mediciones repetidas en el tiempo, con el que se determinó la existencia de diferencias entre los tratamientos, utilizando el programa Infostat.
RESULTADOS
Las curvas de acumulación de especies (por método de muestreo y tratamiento) y los estimadores utilizados (ACE, Chao1 y MMMean), muestran alta eficiencia en el muestreo que oscila entre 78 y 100%, para trampas SIv: 86-100%, trampas CIv: 96-100%, bosta SIv: 78-81% y bosta CIv: 92-100%. Las curvas de acumulación demostraron que las trampas y bostas estuvieron muestreadas eficientemente.
Estructura del ensamble de escarabajos. Durante los cuatro periodos de muestreo (1-4), se recolectaron 2.160 individuos de la familia Scarabaeidae (Coleoptera) pertenecientes a dos subfamilias y cuatro especies: Aphodiinae (Eupariini: Ataenius cf. saulensis) y Scarabaeinae (Canthonini: Canthon juvencus y Onthophagini: Digitonthophagus gazella y Onthophagus marginicollis) (tabla 1). La subfamilia Scarabaeinae fue la que presentó mayor número de especies (3 spp.), mientras que la subfamilia Aphodinae solo presentó una. Las especies más abundantes fueron A. cf. saulensis (n = 2.086; 96,5%) y D. gazella (n = 67; 3,1%) (tabla 1). La especie A. cf. saulensis registró la mayor dominancia para los dos tipos de tratamientos (CIv y SIv). En términos de los gremios de recolocación del recurso alimenticio, se registraron todas las estrategias comportamentales (paracópridos, telecópridos y endocópridos), al encontrarse por lo menos una especie de cada gremio (tabla 1).
Métodos de captura, tratamientos y periodos. De los dos métodos de captura utilizados (trampas y bostas), el de recolecta directa en las bostas mostró mayor efectividad, recolectándose 1.934 individuos (89,5%) pertenecientes a las cuatro especies, mientras que en las trampas de caída se obtuvieron 226 individuos (10,5%) con solo dos especies (tabla 1). Sumando los escarabajos obtenidos por los dos métodos de captura se encontraron 966 (44,7%) en el tratamiento SIv y 1.194 (55,3%) en el tratamiento de CIv. Se encontraron todas las especies en SIv y la especie más abundante fue A. cf. saulensis (n = 934, 43,2%), seguida de D. gazella (n = 28, 1,3%), mientras que para C. juvencus solo se encontró un individuo (0,05%). En CIv se encontraron tres especies y la más abundante fue A. cf. saulensis (n = 1.152; 53,3%), seguida de D. gazella (n = 39; 1,8%) (tabla 1).
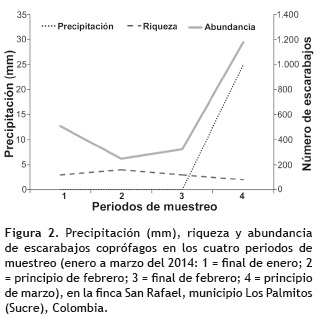
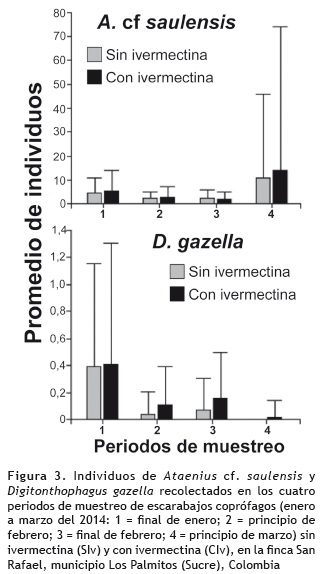
La mayor abundancia de escarabajos se observó en el periodo 4 (mes de marzo), con más de 10 individuos promedio por tratamiento (figura 2). Las menores abundancias se presentaron en los periodos 2 y 3, con menos de cuatro individuos en promedio por tratamiento. Esta abundancia de escarabajos se correlacionó positivamente con la precipitación para ambos tratamientos (rs = 0,95), indicando que en el único periodo donde se presentaron lluvias se obtuvo mayor abundancia en comparación con los otros tres periodos (figura 2). El periodo 2 (mes de febrero), fue el que mayor número de especies registró, encontrándose cuatro especies en SIv y tres especies en CIv (tabla 2), en contraste con el periodo 4 donde se dio la mayor abundancia y la menor riqueza, con dos especies para cada tratamiento. De las cuatro especies presentes en los muestreos A. cf. saulensis y D. gazella estuvieron presentes en los cuatro periodos de muestreo (tabla 2). Las dos especies con mayores abundancias registraron diferencias significativas entre los muestreos según el análisis de varianza (A. cf. saulensis: p = 0,2094 y D. gazella: p = 0,0015) (figura 3).
DISCUSIÓN
En términos generales las curvas de acumulación y sus estimadores demostraron que se obtuvo una muestra representativa del área de investigación. El uso de los dos métodos de captura de escarabajos mostró alta eficiencia, aunque el método de captura en bostas, mostró mayor efectividad (89,5%) que las trampas de caída (pitfall) que solo capturaron el 10,5% de los individuos encontrados y únicamente dos especies.
Estructura del ensamble y periodos. Todas las especies registradas en este trabajo habían sido registradas previamente para la costa Atlántica asociadas a BsT, a sabanas naturales o a zonas abiertas: O. marginicollis (Navarro et al. 2011, Redondo y Herazo 2011, Solis et al. 2011), D. gazella (Navarrro et al. 2011, Noriega et al. 2006, 2013, Solis et al. 2011) y C. juvencus (Navarro et al. 2011). La especie de origen indo-africano D. gazella ha colonizado en Colombia hábitats alterados de uso ganadero y sabanas abiertas con remanentes de bosque (Noriega et al. 2011, 2013). El género Ataenius no había sido registrado para esta región porque la mayoría de los estudios realizados en Colombia han estado enfocados en la subfamilia Scarabaeinae.
El número total de especies registradas en este estudio (n = 4) es muy inferior al registrado en fincas de uso ganadero en época de sequía en esta región, con rangos que oscilan entre 8 y 26 especies (Navarro et al. 2001, Redondo y Herazo 2011). Esta diferencia puede atribuirse a que mientras esta investigación se realizó en una región fuertemente transformada por su uso ganadero y agrícola durante los últimos 50 años, las zonas donde se realizaron las anteriores investigaciones se encuentran en cercanías a fragmentos de BsT menos degradados, lo cual facilita mayor movilidad y conectividad entre las áreas de pastoreo y zonas boscosas, permitiendo mayor disponibilidad de alimento y refugio, lo cual se evidencia en la abundancia y riqueza del ensamble. Igualmente, el uso excesivo y frecuente de ivermectinas en una zona puede ocasionar a mediano plazo un empobrecimiento del ensamble, haciendo que las especies más susceptibles desaparezcan rápidamente de manera local. Por todo lo anterior, este estudio pronostica lo que sería un escenario donde el paisaje ha sido fuertemente transformado y donde las especies que conforman el ensamble son ''supervivientes'' después de un fuerte proceso de empobrecimiento.
La mayor abundancia de escarabajos encontrada durante los cuatro muestreos entre enero y marzo del 2014, coincidió con el periodo de mayor precipitación como se ha registrado en otros estudios (Cambefort y Hanski 1991, Escobar 2000, Hernández et al. 2003, Navarro et al. 2011, Otavo et al. 2013, Solis et al. 2001). Es importante anotar que el mes de marzo es el último mes de verano en esta región y no es frecuente registrar precipitaciones como la que se encontraron. Para BsT es posible encontrar variaciones en la composición de los ensambles de escarabajos entre la época de lluvia y sequía (Escobar 1997), como se registra en otros estudios (Navarro et al. 2011).
El cambio en las abundancias de escarabajos coprófagos para la época de sequía en suelos de uso ganadero, puede estar relacionado con la compactación de los mismos producto de la sobre carga de animales, pisoteo del ganado, erosión, alta insolación y viento, que deshidratan las bostas rápidamente, haciéndolas poco atractivas para los escarabajos coprófagos (Anduaga y Huerta 2007, Arango et al. 2007, Fincher 1981, Holter 1979, Lobo y Veiga 1990). Sumado a lo anterior, el endurecimiento del suelo dificulta la construcción de galerías y la incorporación del excremento (Escobar y Chacón de Ulloa 2000) lo cual puede estar afectando y disminuyendo las poblaciones de escarabajos coprófagos (Cambefort y Hanski 1991). En época de invierno, por lo contrario, existe mayor oferta de recursos alimenticios (bostas más hidratadas), lo que puede estar incrementando su abundancia y generando mayor incorporación de material orgánico al suelo para su fertilización (Anduaga y Huerta 2007, Cambefort y Hanski 1991, Montes de Oca 2001, Navarro et al. 2011, Rougon et al. 1998).
Efecto de la ivermectina en el ensamble y en el ecosistema. Los escarabajos capturados en la parcela de ganado sin ivermectinas (SIv) representan el 44,7% y los encontrados en la parcela de ganado con ivermectinas (CIv) el 55,3% lo cual insinúa una leve tendencia a ser atraídos hacia el estiércol con ivermectina, aunque no se encontraron diferencias significativas. Los resultados de otros trabajos en esta misma línea de investigación, demuestran que el efecto de la ivermectina o de sustancias derivadas de la avermectina B1 en el estiércol vacuno generan mayor atracción hacia los excrementos y trampas cebadas que contenían esta sustancia (Floate 2007, Flota-Bañuelos et al. 2012, Holter et al. 1993, Krüger y Scholtz 1998, Lumaret et al. 1993, Suarez et al. 2003, Verdu et al. 2015, Wardhaugh y Mahon 1991). En otros estudios la presencia de residuos de ivermectina en el estiércol ha reducido la atracción por parte de algunas especies de escarabajos (Holter et al. 1993, Lumaret et al. 1993). Este tipo de atracción se debe a que después de haber sido tratado el animal se liberan aminoácidos asociados a altos contenidos nutricionales asociados al excremento (Lumaret et al. 1993). En un trabajo realizado por Floate (1998), donde la ivermectina fue agregada directamente a las bostas en concentraciones comparables a las que se encuentra normalmente en las deyecciones, se muestra que las bostas son poco degradadas después de 340 días de exposición en campo, mientras que las bostas no tratadas fueron degradadas a los 80 días de exposición. Suarez et al. (2003) encontraron disminución en la colonización de las bostas de animales tratados con ivermectina y residualidad hasta 189 días después de su exposición.
Sin embargo, aunque la presencia de ivermectinas aumente o disminuya la atracción de los escarabajos por el excremento, lo que no se debate es su efecto negativo y en la mayoría de los casos mortal sobre los individuos (Floate 2007, Jackson 1989, Krüger y Scholtz 1998, Lumaret y Errouissi 2002, Lumaret et al. 1993, Martínez y Cruz 2009, Molinari 2010, Suarez et al. 2003, Verdu et al. 2015, Wardhaugh y Mahon 1991). El uso indiscriminado de antiparasitarios como la ivermectina en vacunos es una práctica que debe estudiarse a fondo, y en algunos casos debe regularse, especialmente, en algunas regiones ganaderas como el Caribe colombiano ya que es probable que su excesivo uso esté estrechamente relacionado con la disminución de las poblaciones de escarabajos coprófagos. Adicionalmente, la radical transformación del bosque a áreas de pastoreo y cultivos ha producido fuertes impactos en los ecosistemas interrumpiendo la conectividad entre las áreas perturbadas y las zonas boscosas (Hernández et al. 2003). La zona donde se realizó el estudio lleva más de 15 años cultivando algodón, por lo que se han utilizado diferentes tipos de agroquímicos y métodos de adecuación de los suelos con arado y rastrillo de discos, afectando la estructura de los suelos y destruyendo su fauna. A lo anterior hay que sumar el uso ganadero intensivo que se ha establecido en los últimos años, el cual ha afectado la dinámica y estructura del suelo al incorporar no solo la presencia de ivermectinas que afectan fuertemente la edafofauna (Martínez y Cruz 2009), sino también a malas prácticas agrícolas y ganaderas, que transforman el paisaje y causan en los suelos graves problemas de erosión, contaminación, pérdida de la estructura biótica y compactación de las capas superficiales, afectando negativamente los procesos funcionales de los diferentes grupos de invertebrados en el ecosistema.
En este contexto, es muy importante entender que la incorporación continua de materia orgánica al suelo permite mantener disponibilidad de nutrientes en los pastizales, sin tener que recurrir a planes de fertilización (Loiseau et al. 1984). En los Estados Unidos de América, se ha estimado que el aporte de los escarabajos coprófagos es fundamental a nivel económico, especialmente en la fertilidad de los suelos para uso agrícola y pasturas, como también en la reducción de tratamientos sanitarios como el control biológico de plagas del ganado (Fincher 1981). En el caso de Australia, fue necesario introducir especies exóticas de escarabajos estercoleros para prevenir la acumulación de boñigas no incorporadas al suelo que producían una pérdida anual de aproximadamente un millón de hectáreas (Doube et al. 1991). La no descomposición y persistencia de las boñigas en el suelo, trae como consecuencia la inmovilización de la materia orgánica y la no incorporación de una fracción de minerales al suelo. Este tipo de alteraciones en el ciclo del material orgánico, trae fuertes efectos negativos en la estructura del suelo y en la capacidad de retención de agua, reduciendo la disponibilidad de las sales minerales para ser asimiladas por los pastos (Rougon et al. 1988).
Usar indiscriminadamente sustancias como la ivermectina puede traer consecuencias negativas al ambiente, por lo que es muy importante realizar un manejo mesurado e integrado de los tratamientos de control parasitario (Welch y Malm 1987). Por todo lo anterior, y teniendo en cuenta que este estudio es el primer acercamiento a la problemática regional, recomendamos realizar estudios experimentales en las bostas donde se cuantifiquen las concentraciones de ivermectina presentes en animales tratados, porcentaje de materia orgánica removida y colonización efectiva de la fauna degradadora, tanto para periodos de lluvias como de sequía. Igualmente, es fundamental determinar la ecotoxicidad de la ivermectina en la coprofauna regional, en términos de la cantidad de la dosis y la frecuencia de las mismas, con el fin de reducir a corto plazo y reemplazar a mediano plazo su uso.
AGRADECIMIENTOS
Al municipio de los Palmitos y a los dueños de la finca San Rafael por toda su colaboración y ayuda durante el trabajo de campo. A la Maestria en Ciencias Ambientales de la Universidad de Sucre por su apoyo y asistencia. A Lukasz Minkina por su ayuda en la identificación taxonómica. A David Morris por su ayuda en la revisión del inglés del abstract. A Jorge Lobo por su valiosos comentarios y aportes que mejoraron la calidad del manuscrito. A dos revisores anónimos y al editor de esta revista quienes realizaron importantes correcciones.
REFERENCIAS
Amell YC. 2012. Estructura del ensamblaje de escarabajos coprófagos (Coleoptera: Scarabaeinae) en las cinco subregiones del departamento de Sucre, Colombia [Trabajo de pregrado] [Santa Marta (Colombia)]: Universidad del Magdalena. p. 104. [ Links ]
Andersen E, Feer F. 2005. The role of dung beetles as secondary seed dispersers and their effect on plant regeneration in tropical rainforests. En: Forget PM, Lambert JE, Hulme PE, Vander Wall SB, editores. Seed Fate: predation, dispersal and seedling establishment. CABI Publishing (United Kingdom). p. 331-349. [ Links ]
Anduaga S, Huerta C. 2007. Importance of dung incorporation activity by three species of coprophaneus beetles (Coleoptera: Scarabaeidae: Scarabaeinae) macrofauna in pastureland on ''La Michilía'' Biosphere Reserve in Durango, México. Environmental Entomology, 36 (3): 555-559. [ Links ]
Arango L, Montes J, López D, López J. 2007. Mariposas (Lepidoptera: Papilionoidea, Hesperoidea), escarabajos coprófagos (Coleoptera: Scarabaeinae) y hormigas (Hymenoptera: Formicidae) del Ecoparque Alcázares – Arenillo Manizales, Caldas – Colombia). Boletín Científico Centro de Museos Museo de Historia Natural, 11: 390-409. [ Links ]
Balzarini MG, González L, Tablada M, Casanoves F, Di Rienzo JA, Robledo CW. 2008. InfoStat: Software estadístico. Cordoba (Argentina): Grupo InfoStat, FCA. Universidad Nacional de Córdoba. Disponible en: http://www.infostat.com.ar. [ Links ]
Bertrand M, Lumaret J. 1984. Reactions des populations de microarthopodes a I'enfouissement des feces de mouton par les insects Scarabaeidae en milieu à fortes contraintes. Pedobiologia, 27: 51-66. [ Links ]
Blackshaw R, Vernon R. 2008. Spatial relationships between two agriotis click-beetle species in agricultural fields. Agricultural and Forest Entomology, 10: 1-11. [ Links ]
Cambefort Y, Hanski I. 1991. Dung beetle population biology. En: Hanski I, Cambefort Y, editores. Dung beetles ecology. Princeton University Press, Princeton (New Jersey). p. 36-50. [ Links ]
Campbell W, Fisher M, Stapley E, Albers-Schonberg G, Jacob T. 1983. Ivermectin: a potent new antiparasitic agent. Sciences, 221: 823-828. [ Links ]
Clavijo J, Barrera R. 2001. Geología de las planchas 44 Sincelejo y 52 Sahagún escala 1:100.000. Memoria explicativa. Ministerio de Minas y Energía, Instituto de Investigación e Información Geocientífica, Minero-Ambiental y Nuclear, INGEOMINAS. República de Colombia, Bogotá. p. 63. [ Links ]
Concha-Lozada C, Gallego M, Pardo-Locarno L. 2010. Fragmentación de ecosistemas montanos e impactos estructurales y poblacionales sobre la comunidad de escarabajos coprófagos (Col.: Scarabaeinae) en el Alto Río Cauca, Popayán, Colombia. Boletín Científico Centro de Museos Museo de Historia Natural, 14 (1): 43-55. [ Links ]
Colwell R. [Internet]. 2000. EstimateS: Statistical estimation of species richness and shared species from samples (Software and user's guide), Version 6.0b1. Fecha de acceso: 3 de mayo de 2016. Disponible en: www.viceroy.eed.uconn.edu/estimates/. [ Links ]
Decante D, Van Helden M. 2008. Spatial and temporal distribution of Empoasca vitis within a vineyard. Agricultural and Forest Entomology, 10: 111-118. [ Links ]
Doube B, Macqueen T, Ridsdill S. 1991. Native and introduced dung beetles in Australia. En: Hanski I, Cambefort Y, eds. Dung beetle ecology. Princeton University Press, Princeton, NJ (U. S. A.). p. 255-278. [ Links ]
Escobar F. 1997. Estudio de la comunidad de coleópteros coprófagos (Scarabaeidae) en un remante de bosque seco al norte del Tolima, Colombia. Caldasia, 19 (3): 419-430. [ Links ]
Escobar F. 2000. Diversidad y distribución de los escarabajos del estiércol (Coleoptera: Scarabaeidae: Scarabaeinae) de Colombia. En: Martín-Piera F, Morrone J J, Melic A, editores. Hacia un proyecto CYTED para el Inventario y Estimación de la Diversidad Entomológica en Iberoamérica: PrIBES 2000. Monografías Tercer Milenio, Sociedad Entomológica Aragonesa, Zaragoza. p. 197-210. [ Links ]
Escobar F, Chacón de Ulloa P. 2000. Distribución espacial y temporal de un gradiente de sucesión de la fauna de coleópteros coprófagos (Scarabaeinae, Aphodiinae) en un bosque tropical montano, Nariño – Colombia. Revista Biología Tropical, 48 (4): 961-975. [ Links ]
Escobar F, Medina C. 1996. Coleópteros coprófagos (Scarabaeidae) de Colombia: Estado actual de su conocimiento. En: Insectos de Colombia. Amat G, Andrade G, Fernández F, editores. Academia de Ciencias Exactas Físicas y Naturales – Pontificia Universidad Javeriana. p. 93-116. [ Links ]
Estrada A, Coates-Estrada R. 1991. Howler monkey (Alouatta palliata), dung beetles (Scarabaeidae) and seed dispersal: Ecological interactions in the tropical rain forest of Los Tuxtlas, Mexico. Journal of Tropical Ecology, 7: 475-490. [ Links ]
Fincher G. 1981. The potential value of dung beetles in pasture ecosystems. Journal of Georgia Entomological Society, 16: 316-333. [ Links ]
Floate K. 1998. Does a repellent effect contributed to reduced levels of insect activity in dung from cattle treated with ivermectin. Bulletin of Entomology Research, 88: 291-297. [ Links ]
Floate K. 2007. Endectocide residues affect insect attraction to dung from treated cattle: implications for toxicity test. Medical and Veterinary Entomology, 21: 312-322. [ Links ]
Flota-Bañuelos C, López J, Vargas M, Pernilla F, González H, Martínez I. 2012. Efecto de la ivermectina en la dinámica espacio-temporal de escarabajos estercoleros en Veracruz, Mexico. Tropical and Subtropical Agroecosystems, 15: 227-239. [ Links ]
Guglielmone A, Gimeno E, Idiart J, Fisher W F, Volpogni M, Quaino O, Anziani O, Flores S, Warnke O. 1999. Skin lesions and cattle hide damage from Haematobia irritans infestations. Medical and Veterinary Entomology, 13: 324-329. [ Links ]
Halffter G, Favila M. 1993. The Scarabaeinae an animal group for analyzing, inventorying and monitoring biodiversity in tropical rainforest and modified landscapes. Biology International, 27: 15-21. [ Links ]
Hernández B, Maes J, Harvey C, Vílchez S, Medina A, Sánchez D. 2003. Abundancia y diversidad de escarabajos coprófagos y mariposas diurnas en un paisaje ganadero en el departamento de Rivas, Nicaragua. Agroforestería en las Américas, 10 (39-40): 93-102. [ Links ]
Holden-Dye L, Walker YR. [Internet]. 2007. Anthelmintic drugs, WormBook. C. elegans Research Community. Fecha de acceso: 6 de abril 2015. Disponible en: www.wormbook.org. [ Links ]
Holdridge LR. 1978. Ecología basada en zonas de vida. 1a ed. San José (Costa Rica): Centro Científico Tropical IICA. Traducido por H. Jiménez. p. 216. [ Links ]
Holter P. 1979. Effect of dung-beetles (Aphodius spp.) and earthworms on the disappearance of cattle dung. Oikos, 32: 393-402. [ Links ]
Holter P, Sommer C, Gronvold J. 1993. Attractiveness of dung from ivermectin-treated cattle to Danish and afrotropical scarabaeid dung beetle. Veterinary Parasitology, 48: 159-169. [ Links ]
IGAC. 1998. Estudio general de suelos y zonificación de tierras departamento de Sucre. Bogotá (Colombia): Ministerio de Hacienda y Crédito Publico Colombia. p. 126. [ Links ]
Jackson H. 1989. Ivermectin as a systemic insecticide. Parasitology Today, 5 (5): 146-156. [ Links ]
Kalisz P, Ston E. 1984. Soil mixing by scarab beetles and pocket gophers in North-Central Florida. Soil Science Society American Journal, 48 (1): 169-172. [ Links ]
Kremen C, Colwell R, Erwin T, Murphy D, Noss R, Sanjayan M. 1993. Terrestrial arthropod assemblages: Their use in conservation planning. Conservation Biology, 7: 796-808. [ Links ]
Krüger K, Scholtz C. 1998. Changes in the structure of dung insect communities after ivermectin usage in a grassland ecosystem. II. Impact of ivermectin under high-rainfall conditions. Acta Oecologica, 19 (5): 439-451. [ Links ]
Lancon J. 1978. Les restitutions du betail au pasturage et leurs effets. Fourrages, 75: 55-88. [ Links ]
Lobo J, Veiga C. 1990. Interés ecológico de la fauna coprófaga en pastos de uso ganadero. Ecología, 4: 313. [ Links ]
Lobo J, Martin-Piera F, Veiga C. 1988. Las trampas pitfall con cebo, sus posibilidades en el estudio de las comunidades coprófagas de Scarabaeoidea (Col.). I. Características determinantes de su capacidad de captura. Revue d'écologie et de Biologie du Sol, 25 (1): 77-100. [ Links ]
Loiseau P, Jauneau A, Ricou G. 1984. Etudes sur le recyclage dans l'écosystème prairial. Influence de la conduite du pâturage sur l'activité biologique des pelouses montagnardes. Acta Oecologica, 5 (1): 23-41. [ Links ]
Lumaret J, Errouissi F. 2002. Use of anthemilthicides in herbivores and of risks for the non target fauna of pastures. Veterinary Research, 33: 547-562. [ Links ]
Lumaret J, Galante E, Lumbreras C, Mena C, Bertrand M, Bernal J, Cooper J, Kadiri N, Crowe D. 1993. Field effects of antiparasitic drug ivermectin residues on dung beetle (Insecta: Coleoptera). Journal of Applied Ecology, 30: 428-236. [ Links ]
Martínez M, Cruz M. 2009. El uso de químicos veterinarios y agrícolas en la zona ganadera de Xico, Centro de Veracruz, México y el posible impacto ambiental. Acta Zoológica Mexicana (n.s.), 25 (3): 673-681. [ Links ]
McCavera S, Rogers A, Yates D, Woods D, Wolstenholme A. 2009. An ivermectin-sensitive glutamate-gated chloride channel from the parasitic nematode Haemonchus contortus. Molecular Pharmacology, 75 (6): 1347-55. [ Links ]
Molinari G. 2010. Ivermectinas: evaluación de su efecto deletéreo mediante ensayos de genotoxicidad. Buenos Aires (Argentina): Universidad Nacional de la Plata Facultad de Ciencias Naturales y Museo. p. 110. [ Links ]
Montes de Oca E. 2001. Escarabajos coprófagos de un escenario ganadero típico de la región de Los Tuxtlas, Veracruz, México: Importancia del paisaje en la composición de un gremio funcional. Acta Zoológica Mexicana (n.s.), 82: 111-132. [ Links ]
Navarro I, Roman K, Gomez H, Peréz A. 2011. Variación estacional en escarabajos coprófagos (Coleoptera: Scarabaeidae: Scarabaeinae) de la serranía de Coraza, Sucre (Colombia). Revista Colombiana de Ciencia Animal, 3 (1): 102-110. [ Links ]
Nichols E, Spector S, Louzada J, Larsen T, Amezquita S, Favila M. 2008. Ecological functions and ecosystem services provided by Scarabaeinae dung beetles. Biology of Conservation, 141: 1461-1474. [ Links ]
Noriega JA, Fagua G. 2009. Monitoreo de escarabajos coprófagos (Coleoptera: Scarabaeidae) en la región neotropical. En: Acosta A, Fagua G, Zapata AM, editores. Técnicas de Campo en Ambientes Tropicales, manual para el monitoreo en ecosistemas acuáticos y artrópodos terrestres. Pontificia Universidad Javeriana. p. 165-188. [ Links ]
Noriega JA, Moreno J, Otavo S. 2011. Quince años del arribo del escarabajo Digitonthophagus gazella (Fabricius, 1787) (Coleoptera: Scarabaeidae) a Colombia: proceso de invasión y posibles efectos de su establecimiento. Biota Colombia, 12 (2): 35-44. [ Links ]
Noriega JA, Solis C, Garcia H, Murillo-Ramo L, Renjifo J, Olarte J. 2013. Sinopsis de los escarabajos coprófagos (Coleoptera: Scarabaeinae) del Caribe Colombiano. Caldasia, 35 (2): 465-477. [ Links ]
Noriega JA, Solís C, Quintero I, Pérez LG, García HG, Ospino DA. 2006. Registro continental de Digitonthophagus gazella (Coleoptera: Scarabaeidae) en Colombia. Caldasia, 28 (2): 379-381. [ Links ]
Noriega JA, Camero E, Arias-Buriticá J, Pardo-Locarno LC, Montes JM, Acevedo AA, Esparza A, Murcia B, Garcia H, Solis C. 2015. Grado de cobertura del muestreo de escarabajos coprófagos (Coleoptera: Scarabaeidae: Scarabaeinae) en Colombia. Revista de Biologia Tropical, 63 (1): 97-125. [ Links ]
Otavo SE, Parrado-Rosselli A, Noriega JA. 2013. Superfamilia Scarabaeoidea (Insecta: Coleoptera) como elemento bioindicador de perturbación antropogénica en un Parque Nacional amazónico. Revista de Biología Tropical, 61 (2): 735-752. [ Links ]
Pérez L, Palma C, Villegas R, Vega M, Pérez R. 2006. Metodología analítica y detección de residuos de ivermectina en muestras de leche de rebaños de la provincia de Ñube, Chile. Archivos de Medicina Veterinaria, 38: 143-150. [ Links ]
Redondo F, Herazo C. 2011. Estructura de un ensamblaje de escarabajos coprófagos (Coleoptera: Scarabaeidae), en tres hábitats diferentes, Sucre-Colombia. [Trabajo de grado] [Sincelejo (Colombia)]: Departamento de Biología Universidad de Sucre. p. 93. [ Links ]
Rougon D, Rougon J, Trichet C, Levieux J. 1988. Enrichissement en matière organique d'un sol sahélien au Niger par les Insectes coprophages (Coleoptera, Scarabaeidae) implications agronomiques. Revue Ecologie et de Biologie du Sol, 25 (4): 413-434. [ Links ]
Solis C, Noriega JA, Herrera G. 2011. Escarabajos coprófagos (Coleoptera: Scarabaeinae) en tres bosques seco del departamento del Atlántico-Colombia. Boletín del Museo de Entomología de la Universidad del Valle, 12 (1): 33-41. [ Links ]
Suarez V, Lifschitz A, Sallovitz A, Lanusse C. 2003. Effects of ivermectin and doramectin faecal residues on the invertebrate colonization of cattle dung. Journal of Applied Entomology, 127: 481-488. [ Links ]
Thomas ML [Internet]. 2001. Dung beetle benefits in the pasture ecosystem. Appropriate Technology Transfer for Rural Areas (ATTRA). Fecha de acceso: 9 de marzo 2015. Disponible en: www.attra.org/attra-pub/dungbeetle.html. [ Links ]
Verdu JR, Cortez V, Ortiz AJ, González-Rodríguez E, Martinez-Pinna J, Lumaret JP, Lobo JM, Numa C, Sánchez-Piñero F. 2015. Low doses of ivermectin cause sensory and locomotor disorders in dung beetles. Scientific Reports, 5: 13912. [ Links ]
Villarreal H, Álvarez S, Córdoba A, Escobar F, Fagua G, Gast F, Mendoza H, Ospina M, Umaña AM. 2004. Manual de métodos para el desarrollo de inventarios de biodiversidad. Bogotá (Colombia): Programa de inventarios de biodiversidad. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. p. 236. [ Links ]
Ward D, New T, Yen A. 2001. Effects of pitfall trap spacing on the abundance, richness and composition of invertebrate catches. Journal of Insect Conservation, 5: 47-53. [ Links ]
Wardhaugh K, Mahon R. 1991. Avermectin residues in sheep and cattle dung and their effects on dung beetle (Coleoptera: Scarabaeidae) colonization and dung burial. Bulletin of Entomology Research, 81: 333-339. [ Links ]
Welch L, Malm G. 1987. Uso de ivermectina en ecto y endoparasitosis de caninos y felinos domésticos. Revista Asociación de Veterinarios Españoles especialistas en Pequeños Animales, 5 (25): 6-10. [ Links ]
Yokoyama K, Kai H, Koga T, Aibe T. 1991. Nitrogen mineralization and microbial populations in cow dung, dung balls and underlying soil affected by paracoprid dung beetles. Soil Biology and Biochemistry, 23 (7): 643-647. [ Links ]