Introducción
El golfo de Urabá es la mayor entrada de mar a lo largo de la costa Caribe de Colombia, ocupando aproximadamente 2.000 km² de área. Áreas extensas cubiertas por bosques de manglar rodean el Golfo, el cual posee una considerable influencia fluvial debido a que recibe la entrada de varios ríos, principalmente del Atrato, el Turbo y el León (Urrego et al. 2014). Sin embargo, en la cercanía a centros urbanos, estos bosques han sido muy perturbados en los últimos años, llegando a reducciones de hasta el 29,8% de su área en el periodo 2003-2009 (Blanco et al. 2012). La proximidad a poblaciones humanas pequeñas, implica la transformación de estos bosques en pastizales para el ganado, cultivos agrícolas y la construcción de casas. Además, estos bosques se entresacan con el fin de obtener tallos de R. mangle para leña, reparación de embarcaciones, y demanda de varas y pilotes para diferentes actividades productivas y domésticas (Urrego et al. 2010, Blanco et al. 2012).
Las extensiones más grandes de manglar en el Golfo se encuentran en el delta del río Atrato, ubicados en la costa occidental. Estos bosques se caracterizan por un alto grado de intervención, una alta abundancia de árboles juveniles y baja de adultos de R. mangle, y una muy baja a nula proporción de otras especies (Urrego et al. 2014). Adicionalmente, en los últimos años se han identificado diversos problemas fitosanitarios, que han causado el deterioro del bosque y en consecuencia han afectado a las comunidades humanas que hacen uso de sus productos (Sánchez-Alférez y Álvarez-León 2000, Sánchez-Alférez et al. 2009).
Diagnósticos del estado fitosanitario de los manglares en la desembocadura del río Atrato (Sánchez-Alférez et al. 2009, Urrego et al. 2010), han indicado la presencia de tumoraciones o agallas en las estructuras leñosas de los árboles de R. mangle (fuste, ramas, raíces). Dichas agallas semejan un afloramiento de la corteza externa, de consistencia dura y sin ningún tipo de secreción. Su origen en el golfo de Urabá es aún desconocido (Urrego et al. 2010), y a pesar de que R. mangle forma extensos rodales mono-específicos naturales en el Caribe, los registros sobre las patologías que lo afectan, sus sintomatologías y los efectos sobre las variables estructurales y el crecimiento de los árboles son poco frecuentes (Kohlmeyer 1969, Barnard y Freeman 1982, Teas y McEwan 1982, Tomlinson 1986, Wier et al. 2000, Osorio et al. 2014).
La presencia de agallas se ha identificado en manglares de Panamá y Costa Rica (Jiménez et al. 1985), Estados Unidos (Olexa y Freeman 1978), Puerto Rico (Wier et al. 2000, Tattar y Wier 2002) y Gambia (Teas y McEwan 1982), se le han atribuido diferentes agentes causales. Sánchez-Alférez et al. (2009) atribuyen estas lesiones a Agrobacterium tumefaciens, patógeno que causa esta sintomatología en otras especies forestales. Por otro lado, Barnard y Freeman (1982) y Tomlinson (1986) han señalado al hongo Cylindrocarpon didymum como el causante de las agallas, mientras que Wier et al. (2000) lograron aislar el hongo Cytospora rhizophorae de estas estructuras. Los efectos de estas deformaciones sobre la salud de los manglares son aun contradictorias. Mientras que algunos autores señalan que debilitan los tallos y las raíces y ralentizando el crecimiento de los árboles (Wier et al. 2000), causando incluso muerte descendente en R. mangle (Teas y McEwan 1982). Sin embargo, Olexa y Freeman (1978) documentan que a pesar de la presencia de agallas generalizada en los tallos de R. mangle en el sur de la Florida, los árboles infectados no se vieron afectados seriamente a nivel estructural. De igual forma, Jiménez et al. (1985) y Lugo (1997) reportan que, aunque los árboles adultos tienen una mayor proporción de su área basal afectada por estas agallas, no parecen aumentar las tasas de mortalidad de R. mangle.
Otro aspecto que ha sido subvalorado en el estudio del fenómeno de las agallas es la susceptibilidad de los árboles a la infección y el efecto sobre la anatomía de la madera. Los constantes cambios a los que se ven sometidos los manglares pueden aumentar la vulnerabilidad a las enfermedades (Teas y McEwan 1982). Aunque poco se sabe sobre el ciclo de la enfermedad en R. mangle, algunos autores argumentan que la infección puede llevarse a cabo a través de heridas mecánicas o naturales (Tattar et al. 1994, Tattar y Wier 2002, Sánchez-Alférez et al. 2009) las cuales dejan expuestas la corteza interna y el tejido cambial. Sin embargo, otros autores señalan la posibilidad de infección a través de las lenticelas de la corteza (Barnard y Freeman 1982), dejando entonces una brecha en el conocimiento de las características del árbol que lo hacen susceptible a la infección y los efectos de la enfermedad sobre su desarrollo (Wier et al. 2000, Martínez-Zurimendi et al. 2009).
Hasta ahora se desconoce el impacto real de esta afección sobre los manglares del golfo de Urabá, sin embargo, teniendo en cuenta la alta demanda de su madera en muchas partes del mundo, es irónico que tan solo un número limitado de estudios hayan examinado el impacto de esta enfermedad sobre la estructura de los árboles (Osorio et al. 2014). En esta investigación se propuso evaluar la relación entre la incidencia de agallas y las variables estructurales de poblaciones de R. mangle (mangle rojo) encontradas en los bosques de manglar del golfo de Urabá. Para lograr este objetivo se postularon dos hipótesis: (i) las sintomatologías asociadas a la incidencia de agallas se presentan en todas las categorías de tamaño de R. mangle en el área de estudio, y (ii) existen diferencias significativas en las relaciones alométricas y el desarrollo estructural, entre los árboles sanos y los infectados. Adicionalmente, dada la manera como se expresan las agallas en las estructuras leñosas del árbol, se buscó caracterizar los cambios en la anatomía de la madera derivados de esta patología.
Materiales y métodos
Área de estudio
El estudio se desarrolló en los bosques de manglar que bordean las márgenes del golfo de Urabá, específicamente en el corregimiento Bocas del Atrato, municipio de Turbo y la ensenada de Rionegro, municipio de Necoclí, en Antioquia, Colombia (Figura 1). El área de estudio está localizada entre las coordenadas 08°33’14,61’’ y 07°59’23,45’’ N; y 76°56’44,91’’ y 76°48’40,59’’ W.
El Golfo es un cuerpo de agua semi-cerrado, en forma de bolsillo, con considerable influencia fluvial (Urrego et al. 2014). Sus costas son seriamente afectadas por la acumulación y transporte de sedimentos aluviales, la erosión causada por el aumento en el nivel del mar (Bernal et al. 2005; Urrego et al. 2014) y marcados procesos antrópicos (Blanco et al. 2012). Áreas extensas de las costas del Golfo están cubiertas por bosques de manglar, de las cuales el 78,3% se encuentran ubicados en los canales, bahías deltaicas y pantanos entre las barras de arena en el delta del río Atrato (Urrego et al. 2010, Gómez y Bernal 2013). Por otro lado, los manglares de la ensenada de Rionegro corresponden al 7,2% en extensión y son bosques de sucesión temprana distribuidos alrededor de una laguna costera delimitada por barras de arena (Gómez y Bernal 2013).
El régimen de lluvias en el área de estudio es de tipo bimodal, modulado por los desplazamientos de la Zona de Convergencia Intertropical (ZCIT), con un período seco bien definido entre diciembre y abril, y una época lluviosa que se extiende desde mayo hasta noviembre, con una leve disminución entre junio y julio (Lozano 1998, Hoyos et al. 2013). La temperatura promedio anual es de 27°C y la precipitación promedio anual es aproximadamente 2.500 mm (Urrego et al. 2014). La zona de vida corresponde a Bosque muy Húmedo Tropical (bmh-T) (León 2009).
Las unidades geomorfológicas identificadas en el área están determinadas por la interacción de procesos continentales y fluvio-marinos e incluyen valles aluviales, lagunas, pantanos y playas de arena (costas bajas), colinas bajas y arrecifes de coral formando terrazas (costas altas) (Díaz et al. 2000, Bernal et al. 2005, Urrego et al. 2014). El régimen de mareas se clasifica como micromareal con alturas que oscilan entre 0,5 y 0,9 m (IDEAM 2014, Hoyos et al. 2013); sin embargo, la altura de las olas varía en direccion norte-sur (Molina et al. 1998). La temperatura de la superficie del mar en el interior del Golfo es muy variable (26-31°C), debido a la fuerte influencia de las descargas de los ríos, especialmente de los ríos Atrato y León (Bernal et al. 2005), aunque se registran variaciones estacionales (Urrego et al. 2014). La salinidad del agua refleja las interacciones fluvio-marinas que allí se presentan. Durante la estación seca, la salinidad de la superficie del agua oscila entre 2 y 26 ‰, mientras que, durante la estación lluviosa, oscila entre el 0,8 y 35 ‰. El gradiente de salinidad es controlado en dirección sur-norte por corrientes de circulación oceánica (François et al. 2007, Urrego et al. 2014). Debido a la posición del Golfo, en la zona se presenta un afloramiento local de aguas profundas, las cuales se mezclan en las capas superficiales con las de baja salinidad que proceden de los aportes de los ríos (León 2009).
Trabajo de campo
El número de parcelas a establecer se calculó a partir de un premuestreo exploratorio basado en el coeficiente de variación del área basal (AB) de árboles de R. mangle muestreados por Urrego et al. (2010) y un error de muestreo permisible del 15%. Entre Junio y Septiembre de 2014, se establecieron 27 parcelas circulares de 500 m², distribuidas al azar, 24 parcelas en la desembocadura del río Atrato y tres parcelas en ensenada de Ríonegro donde no se había registrado la infección en 2009-2010 (Urrego et al. 2010). En cada parcela, se midió el diámetro a la altura de pecho (DAP) y la altura total (H) de todos los árboles con DAP superior a 2,5 cm. Cuando se encontraron raíces aéreas arriba de la altura de pecho, el diámetro se midió 30 cm por encima de la última raíz. La altura se midió utilizando un medidor vertex desde una distancia horizontal de 10 m. Todos los árboles fueron identificados y marcados. Para conocer el estado fitosanitario de los árboles de R. mangle se registró el número de agallas en raíces, fustes y ramas, y se calificó el vigor del árbol (V), con base en la clasificación propuesta por Wier et al. (2000) para cuantificar el estado cualitativo de los árboles con base en la gravedad de los síntomas por muerte descendente (Tabla 1). Los individuos con DAP menor que 2,5 cm se muestrearon en cuatro subparcelas de 1 m² ubicadas en el límite de las parcelas grandes, con respecto a los cuatro puntos cardinales. A todas las plántulas se les midió el diámetro en la base y la altura total, y se cuantificó el número de hojas y número de agallas. Se colectaron 12 discos de madera de 3 cm de espesor en dos niveles del tallo donde se encontrara una agalla desarrollada, con el fin de evaluar los efectos de la infección sobre la anatomía del árbol. Estos discos fueron desinfectados y secados al aire para su posterior análisis en el laboratorio.
Trabajo de laboratorio
Se obtuvieron muestras de 1 cm² de los discos de madera para el montaje de placas permanentes. Estas muestras fueron cortadas en el limite del tejido de la agalla y sometidas a ciclos de cocción a presión, y posterior humedecimiento a temperatura ambiente, para reducir la dureza del material y disminuir su resistencia al corte. Las placas fueron montadas en el Laboratorio de Productos Forestales “Héctor Anaya López” de la Universidad Nacional de Colombia, Sede Medellín, utilizando la metodología propuesta por Franklin (1946).
Análisis de datos
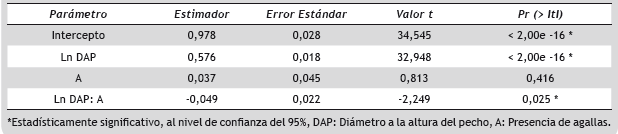
Se construyeron modelos de elección binaria para evaluar la relación entre la presencia de la infección y las variables estructurales, y estimar la probabilidad de infección para los árboles en una categoría de diámetro determinada. La presencia de agallas (A) fue trabajada como una variable indicadora en la cual solo hay dos alternativas mutuamente excluyentes: A = 1 cuando se observaron agallas en el árbol y A = 0 cuando no se observaron. Esto debido a la dificultad en campo para cuantificar el número exacto de agallas presentes en cada árbol. Los modelos se construyeron por el método de Máxima Verosimilitud, asumiendo distribución logística de los errores. Se estimó el “Odds Ratio” para las variables independientes, con el fin de evaluar el riesgo de que la presencia de agallas se presente en la población. Según este índice, si el Odds > 1 significa que, para el individuo i, la opción A = 1 es más probable que la opción A = 0. Si Odds = 1, ambas opciones son igualmente probables. El efecto de la categoría de vigor se evaluó utilizando una prueba Chi-Cuadrado χ2 , al nivel de confianza del 95%. A través de una comparación de rectas por regresión múltiple, se establecieron las diferencias en las relaciones alométricas (H vs. DAP) entre árboles sanos y enfermos, y entre árboles sanos de los dos sitios de muestreo. Como variables indicadoras se usaron la presencia de agallas y el sitio de muestreo, respectivamente. Los modelos a comparar fueron rectas paralelas, rectas independientes por grupo y recta común para ambos grupos, utilizando un análisis de varianza (ANOVA). El supuesto de homocedasticidad fue evaluado a través del Test Estudentizado de Koenker (Koenker y Bassett 1982), bajo la hipótesis nula de homocedasticidad y un nivel de confianza del 95%. La identificación de la categoría de tamaño en la cual comienzan a expresarse las sintomatologías se realizó a través de distribuciones diamétricas a intervalos de 10 cm de DAP, diferenciando entre individuos sanos e infectados. Debido a la gran proporción de árboles con diámetros entre 2,5 y 10 cm de DAP, esta categoría fue descompuesta en intervalos de 1 cm, para obtener mayor detalle en su análisis. La incidencia de la enfermedad fue calculada como el número de árboles infectados sobre el total de árboles evaluados para cada parcela y categoría diamétrica, teniendo en cuenta solo los árboles de R. mangle encontrados, y se clasificó en baja, media y alta, con porcentajes de 0-30 %, 31-60 % y > 60 %, respectivamente. Todos los análisis estadísticos se realizaron usando el software R Studio (Versión 3.1.2).
Resultados
Según el porcentaje de infección encontrado en las parcelas del delta del Río Atrato, sólo cuatro de éstas tuvieron una infección baja (parcelas 2, 7, 10 y 23), y correspondieron a aquellas parcelas con desarrollo estructural menor (Tabla 2). Allí no se encontraron áreas libres de infección. Las parcelas con mayor incidencia de agallas se concentraron alrededor del caserío de Bocas del Atrato y en la bahía Marirío (Figura 1), en donde se presentan altos niveles de intervención.
En los discos de madera analizados se encontró deformación de los tejidos vasculares y de la corteza alrededor de las agallas. La madera presentó porciones de corteza inclusa en el xilema con diferentes grados de descomposición y altos contenidos de resina en las células (Figura 2A y 2B). A nivel microscópico, se evidenció la presencia de alteraciones en el tamaño de las fibras y las células de parénquima radial (Figura 2C y 2D), y cambios importantes en su orientación en comparación con un tejido sano, debido a la formación de tejido calloso en el límite del área afectada (Figura 2E y 2F). A pesar de desconocer los efectos de estas variaciones en el xilema sobre los procesos fisiológicos del árbol, se pudieron identificar alteraciones en las relaciones alométricas que podrían estar determinadas por cambios en la anatomía y la fisiología.
La Tabla 3 muestra los resultados del modelo de regresión lineal para describir la relación entre la altura total (H), el diámetro a la altura de pecho (DAP) y la presencia de agallas (A), la cual fue definida como una variable indicadora que toma el valor 1 si la presencia es verdadera y 0 si es falsa. Esta condición permitió generar dos rectas de regresión separadas (Figura 3), una para cada valor de A.
Tabla 2 Parámetros estructurales descriptivos de R. mangle en 24 parcelas localizadas en el delta del Río Atrato (Turbo) y 3 parcelas en la Ensenada de Rionegro (Necoclí). Las parcelas ubicadas en la Ensenada de Rionegro se identifican como Ei. Los valores promedio se presentan como: promedio (desviación estándar)
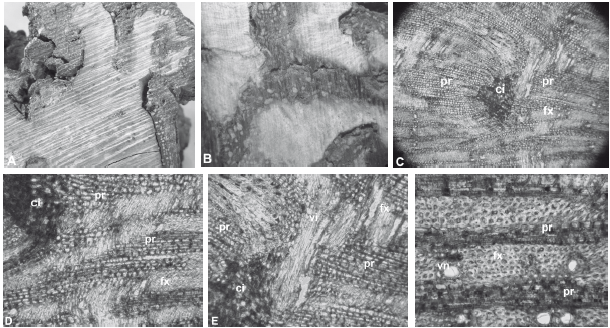
Figura 2 A. Deformación de los tejidos alrededor de la agalla. B. Corte transversal macroscópico (10 X). C y D. Corte transversal microscópico - células de corteza inclusas en el xilema de R. mangle (100 X). E. Alteración de los planos de corte en el límite de la agalla (200 X) F. Corte transversal microscópico de tejido sano (200 X). fx fibras de xilema secundario, pr parénquima radial, ci corteza inclusa, vi vasos invertidos, nv vasos normales.
Al comparar los modelos generados por regresión múltiple, se evidenció que al considerar una recta para cada grupo de árboles (F = 6,46; Pr (<F) = 0,002) mejoró el ajuste con respecto a un modelo de recta única. La tendencia lineal no es la misma entre ambos grupos, sugiriendo que la altura total varía con el diámetro de forma disímil entre árboles sanos e infectados (Figura 3), siendo menor en árboles infectados. Por otro lado, al comparar las relaciones alométricas (H vs. DAP) entre árboles sanos de los dos sitios de muestreo, el modelo de rectas paralelas fue suficiente para explicar los datos observados (F = 31,84; Pr (<F) <0,001). Según esto, no existe un efecto significativo asociado al sitio de muestreo (variable indicadora que toma el valor 1 si el árbol fue muestreado en la ensenada de Rionegro y 0 si fue muestreado en el delta del río Atrato) sobre la relación alométrica H vs. DAP al nivel de confianza del 95% (t = 0,44; Pr (<t) <0,001), y por tanto la altura varía con el diámetro de forma similar en árboles sanos de ambos sitios (Figura 4).
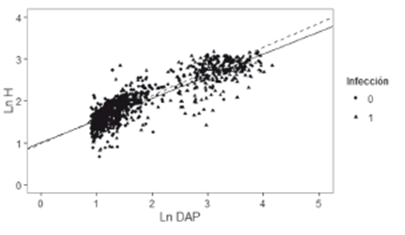
Figura 3 Comparación de líneas de regresión entre árboles sanos e infectados. Las líneas continua y punteada representan la ecuación alométrica para árboles infectados y sanos, respectivamente.
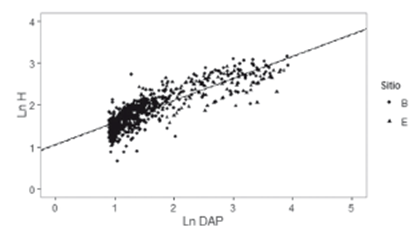
Figura 4 Comparación de líneas de regresión de árboles sanos, diferenciando entre sitios de muestreo. Las líneas continua y punteada representan la ecuación alométrica para árboles muestreados en Bocas del Atrato y la Ensenada de Rionegro, respectivamente.
Adicionalmente, para evaluar la relación entre la presencia de agallas y las variables estructurales, y valorar el efecto del vigor del árbol sobre la probabilidad de infección, se construyó un modelo de regresión logística que describe la relación entre la presencia de agallas (A) como variable dependiente, y las variables independientes: diámetro a la altura de pecho (DAP) y categoría de vigor (V) (Tabla 4).
Todas las variables independientes fueron estadísticamente significativas (Tabla 4) al nivel de confianza del 95%. Los estimadores asociados con el DAP y las categorías de vigor fueron positivos, sugiriendo que la probabilidad condicional Pr (A = 1/DAP; Vi) de encontrar un árbol infectado aumenta cuando los valores del DAP aumentan y el árbol presenta una condición de vigor más desfavorable. Con respecto a los valores de “Odds Ratio” estimados, se encontró que, para cualquier combinación de las variables usadas en el modelo, la presencia de agallas en los árboles es más factible que la ausencia.
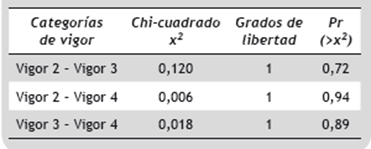
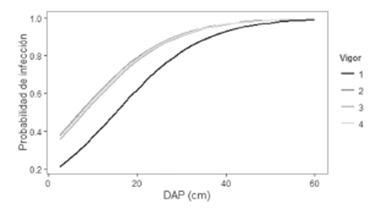
La prueba Chi-Cuadrado (χ2 = 4,7, Pr (>χ2) < 0,001), indicó que el efecto general del vigor fue estadísticamente significativo. Sin embargo, al realizar los contrastes entre las categorías de vigor superiores (2-4) (Tabla 5) se encontró que no existen diferencias entre los coeficientes (Figura 5).
Las Figuras 6 y 7, muestran los histogramas que relacionan la proporción de árboles infectados (incidencia) con respecto al número total de árboles de R. mangle en cada categoría diamétrica. La presencia de agallas se restringió a estados iniciales del desarrollo cuando las plántulas alcanzan diámetros cercanos a 2,5 cm. En el muestreo de campo no se encontraron plántulas con agallas en ninguna de las parcelas de regeneración. La prueba de correlación de Pearson no mostró ningún tipo de dependencia significativa entre la cantidad de regeneración y el porcentaje de infección (t = 0,887; Pr (>t) = 0,384), al nivel de confianza del 95%. En general, la proporción de árboles infectados fue alta (> 75%) para todas las categorías por encima de 10 cm de DAP, evidenciando el grado de extensión de la infección en toda el área del delta del río Atrato. Las distribuciones conservaron la relación positiva encontrada con el modelo de regresión logística entre el diámetro de los árboles y la presencia de agallas (Tabla 3).
Discusión
En el golfo de Urabá, las agallas se presentaron como un crecimiento anormal de la corteza, de tamaño variable, crecimiento esférico, consistencia dura y sin ningún tipo de secreción (Figura 2). Estas estructuras se encontraron en ramas, fustes y raíces, asociadas a heridas mecánicas en fuste y ramas, y a intercepciones de arcos en raíces, y en general son el resultado del incremento anómalo del tamaño y el número de células del tejido infectado (hipertrofia e hiperplasia, respetivamente) (Schumann y D’Arcy 2010). La infección se encontró distribuida en los manglares del costado occidental del Golfo, afectando únicamente árboles de R. mangle y no a las otras especies presentes tales como Avicennia germinans (L.) L., Laguncularia racemosa (L.) C.F. Gaertn y Pelliciera rhizophorae Planch. y Triana, comportamiento que es similar en otros lugares del mundo (Olexa y Freeman 1978, Teas y McEwan 1982, Jiménez et al. 1985, Wier et al. 2000, Tattar y Wier 2002).
Según los resultados obtenidos, la formación de agallas en los árboles de R. mangle genera la deformación de los tejidos vasculares y la corteza externa. Cuando se lesiona cambium vascular, la actividad cambial normal es interrumpida y se generan una serie de procesos de defensa y de cicatrización de la herida, que incluyen la formación de tejido calloso y la compartimentalización del tejido necrosado (Larson 1994, Arbellay et al. 2012). En las muestras analizadas, el tejido calloso estuvo constituido esencialmente de parénquima radial en la proximidad de la lesión, y en menor proporción por parénquima axial y fibras de floema y xilema (Figura 2), además de porciones de corteza inclusa debido posiblemente a la formación de peridermis hacia adentro de la herida, que evita la mezcla del cambium vascular con el tejido calloso (Biggs 1992a). Las anomalías observadas en los radios alrededor del área infectada han sido reportadas como característica de gran valor adaptativo ya que mejoran la compartimentalización del tejido descompuesto y aumentan la resistencia del tallo contra tensiones mecánicas radiales (Mattheck y Kubler 1995, Burgert y Eckstein 2001, Reiterer et al. 2002, Arbellay et al. 2012). Estos resultados son consistentes con estudios en otras especies arbóreas, las cuales han respondido a daños mecánicos a través del aumento en el número y ancho de los radios (Lev-Yadun y Aloni 1992, 1993, Lev-Yadun 1994, Arbellay et al. 2012).
A nivel fisiológico, esta alteración de la actividad cambial y en general este tipo de procesos de cicatrización, han sido relacionados con la obstrucción del flujo de auxinas hacia la base del árbol y con la acumulación de etileno en el área afectada (Lev-Yadun y Aloni 1992, 1993, 1995), lo cual tiene implicaciones sobre el número y tamaño de las células de los tejidos en regeneración (Biggs 1992a, Arbellay et al. 2012). Para infecciones similares a las agallas, las reacciones de defensa involucran compuestos como la lignina, suberina y sus precursores (Biggs 1992b), los cuales actúan como barreras físicas y químicas que evitan la pérdida de agua, restringen la difusión de toxinas y la disponibilidad de nutrientes, y aumentan el potencial antibiótico del árbol (Biggs 1992b, Stangarlin et al. 2011).
Cuando el árbol se somete a estrés por la formación de una agalla, es claro que sus prioridades se concentran en el restablecimiento de la resistencia mecánica del xilema y la continuidad del cambium vascular (Biggs 1992a, Schweirgruber 2007). Esto ocurre a través de la formación de tejido calloso; no obstante, este proceso se genera a expensas del transporte de agua y por consiguiente del crecimiento del árbol (Schweirgruber 2007, Arbellay et al. 2012). Es por esto que como primera aproximación se evaluaron las diferencias en la relación alométrica H vs. DAP entre árboles de R. mangle sanos e infectados (Tabla 3). Los resultados sugieren diferencias significativas que podrían estar relacionadas con una ralentización del crecimiento en diámetro con respecto al crecimiento en altura en árboles infectados, lo cual podría afectar la estructura del ecosistema a largo plazo (Wier et al. 2000, Gilbert 2002a). Sin embargo, en esta investigación no se midió el crecimiento de los árboles.
El modelo de regresión logística confirmó una relación positiva entre el diámetro del fuste y la presencia de la infección (Tabla 4), ya que los árboles más desarrollados presentaron una proporción alta de su área específica con presencia de agallas. El porcentaje de infección por categoría diamétrica (Figura 6) respaldó esta relación, evidenciando una proporción de individuos infectados superior al 70% para todas las categorías por encima de 10 cm de DAP, lo cual es consistente con lo sugerido por Lugo (1997) quien manifiesta que la formación de agallas parece darse de manera preferencial en árboles de mangle rojo más viejos. Por el contrario, Jiménez et al. (1985) encontraron resultados contrastantes en donde las agallas en los manglares de la costa pacífica de Costa Rica y Panamá y en el Caribe de Costa Rica presentaron porcentajes de infección menores al 25%. Sin embargo; el porcentaje del área basal afectada fue alto (58,8 a 72,4 %), porque los árboles con mayor diámetro fueron los más atacados. La altura total no fue una variable significativa en la explicación de la presencia de agallas (z = 1,229; p (z) = 0,219).
Para cualquier combinación de las variables usadas en el modelo logístico, la presencia de agallas en los árboles fue más factible que la ausencia y esta probabilidad fue más alta para árboles con DAP mayores y con una condición de vigor más desfavorable (Figura 5). Esto también se vio reflejado en el comportamiento de las agallas en árboles de la primera categoría de vigor, en la cual la probabilidad de infección fue menor para cualquier valor de DAP con respecto a las categorías superiores (2-4) (Figura 5). Algunos autores, como Kohlmeyer (1980) y Tattar y Wier (2002) respaldan esta afirmación, al encontrar que las agallas generadas por el patógeno C. rhizophorae en suroeste de Puerto Rico no se desarrollaron en árboles de R. mangle saludables. Teas y McEwan (1982) sugieren que la creciente intervención antrópica y la variabilidad en las condiciones ambientales, puede dejar a los árboles susceptibles a contraer la enfermedad, ya que el vigor tiene una relación directa con el crecimiento aéreo de las plantas, con su capacidad de prosperar, reproducirse y soportar la competencia (Martínez-Zurimendi et al. 2009, Delvaux et al. 2010, Arbellay et al. 2012) y este puede verse alterado en respuesta a factores como la deficiencia de nutrientes, el ataque por insectos, la intolerancia a la sombra (Manion 1991, Gilbert 2002a, b), la exposición a altas temperaturas (Krauss et al. 2008), la pérdida de área foliar, defoliación recurrente, y la senescencia del hospedero (Gilbert 2002a, Cooke 2006).
A pesar de que en los bosques tropicales las plantas en estados juveniles son muy susceptibles a ser presa de alguna enfermedad (Gilbert 2002a), especialmente por aquellas que difunden la conductancia de agua por el tallo (Gilbert 2002a, b, Gilbert et al. 1994a, b), en las parcelas de regeneración establecidas, no se encontraron plántulas con presencia de agallas; sin embargo, dada la composición de estas estructuras (Figura 2) y la categoría de tamaño en la que estas comienzan a manifestarse (Figuras 6 y 7), la infección podría permanecer latente en la plántula hasta que esta comienza la actividad cambial. Adicionalmente, la infección en plántulas, a pesar de ser asintomática podría estar reduciendo su crecimiento, lo cual puede disminuir la capacidad de las plántulas de competir por la poca luz que llega al sotobosque y aumentar su susceptibilidad de morir por otros factores (Gilbert 2002a).
Nuestros resultados, permiten ampliar el panorama de los efectos de la infección por agallas sobre la anatomía de la madera de R. mangle y su relación con el desarrollo estructural de los árboles, los cuales han sido poco estudiados alrededor del mundo (Kohlmeyer 1969, Barnard y Freeman 1982, Teas y McEwan 1982, Tomlinson 1986, Wier et al. 2000). Por otro lado, es claro que existen necesidades de investigación orientadas a evaluar la etiología de las enfermedades y el impacto de estas en el reclutamiento, crecimiento y reproducción de los árboles (Cooke 2006). Las enfermedades vegetales que se suscitan en los bosques tropicales han sido menos estudiadas que las enfermedades que afectan a los cultivos agrícolas o a los bosques de la zona templada (Gilbert 2002a) y además, muchas investigaciones han descuidado la dinámica de la población hospedera y se han concentrado en la dinámica del patógeno exclusivamente (Hau y Kranz 1990, Cooke 2006). De la estabilidad y supervivencia de los bosques de manglar en el golfo de Urabá, depende la principal fuente de ingresos para las comunidades locales (Blanco et al. 2012, Urrego et al. 2014) y a pesar de esto se sabe poco sobre las enfermedades que los afectan, especialmente las causadas por microorganismos. Dada la productividad y los servicios ecosistémicos que los manglares prestan (Vo et al. 2012), estos ecosistemas se han ido convirtiendo en un atractivo para los investigadores de muchos campos diferentes, sin embargo, las relaciones simbióticas, especialmente con hongos, son aún un campo relativamente inexplorado (Osorio et al. 2014).
Agradecimientos
Los autores agradecen a la Gobernación de Antioquia y a la Facultad de Ciencias Agrarias, de la Universidad Nacional de Colombia, Sede Medellín, por la financiación y administración del proyecto. A la profesora Ángela María Vásquez Correa, del Laboratorio de Laboratorio de Productos Forestales “Héctor Anaya López” de la Universidad Nacional de Colombia, Sede Medellín por su apoyo en el procesamiento de las muestras de madera. A la Bióloga Karen Robles López por su apoyo en toda la ejecución del proyecto. A los Ingenieros Forestales Marco Antonio Prado y Diana Carolina Sucerquia por su colaboración en el trabajo de campo. A la comunidad de Bocas de Atrato