Introducción
Southwood (1977) planteó la hipótesis del “hábitat templet” en la cual expuso que las múltiples estrategias de los organismos para sobrevivir surgieron desde un proceso de adaptación al hábitat que conlleva una relación costo-beneficio. Además, afirmó que la heterogeneidad del hábitat se puede considerar desde dos escalas: la espacial y la temporal. A partir de ahí, se espera que las especies presentes en un determinado hábitat tengan rasgos funcionales similares, independientemente de sus relaciones filogenéticas (Townsend y Hildrew 1994). Un rasgo funcional es un atributo del organismo, referente a su biología, fisiología y ecología, que repercute en el crecimiento, la reproducción y la supervivencia a nivel individual (Violle et al. 2007). Estos rasgos presentan un marco integrador que explica como los cambios en sus características, asociados con variaciones ambientales, responden tanto en el rendimiento del individuo en niveles de organización superior como en la comunidad (Pla et al. 2012, Schmera et al. 2017).
Los macroinvertebrados habitantes en ecosistemas lóticos de bajo orden se desarrollan en un medio que cambia constantemente debido a la dinámica hidráulica; por esto, exhiben rasgos funcionales variados (Junk et al. 1989, Rodrigues-Capítulo et al. 2009, Tomanova et al. 2008). Así, los rasgos funcionales tienen uso potencial como indicadores de perturbaciones físicas naturales y/o antrópicas en los ríos (v. g., temporalidad en el flujo de agua) y se proyectan como enfoque complementario al taxonómico en el conocimiento del funcionamiento y condición de los ecosistemas, ya que están directamente relacionados con aspectos metabólicos del mismo, por tanto, ofrecen una perspectiva adecuada para conocer el estado de un sistema (Bonada et al. 2006, Ding et al. 2017, Hooper et al. 2002, Luiza-Andrade et al 2017, Statzner et al. 2005).
En ríos temporales (v. g. canales que carecen de flujo superficial durante la temporada de sequía) los macroinvertebrados expresan diferentes tipos de rasgos, tales como: adaptación a la época de sequía mediante el desarrollo de rasgos de resistencia (v. g., características de los organismos que les permiten permanecer en la comunidad después de una perturbación) y rasgos de resiliencia (v. g., características de los organismos que les permiten recuperarse rápidamente de la perturbación o evitarla) (Townsend y Hildrew 1994). Los rasgos que predominan varían dependiendo de si la sequía es estacional predecible o si es un evento impredecible (Bogan et al. 2015, Lake 2003). En general, se ha encontrado en ecosistemas mediterráneos y templados que los rasgos funcionales asociados con mayor adaptación a la temporalidad son: ciclos vitales flexibles (sincronización de los ciclos de vida acuáticos con las temporadas de lluvias), desarrollo ligado con la temperatura del agua, diapausa, huevos protegidos contra la desecación y alto poder de dispersión (Bonada et al. 2007, Boulton 1989, Dézerald et al. 2015, Dole-Olivier et al. 1997, Lake 2003, McDonough et al. 2011, Stubbington et al. 2016, Williams y Hynes 1977), así como alimentación de tipo generalista (Dieterich y Anderson 2000).
En regiones secas, los ríos temporales presentan alta relevancia para los procesos ecosistémicos que ocurren en la interfase agua-tierra, ya que sirven de hábitat para animales y plantas; son zonas de procesamiento de nutrientes y están unidos a otros sistemas perennes, siendo importantes en el lavado de material y en la conectividad de la cuenca (Dieterich y Anderson 2000, Larned et al. 2010, Skoulikidis et al. 2017). Por lo anterior, tienen características únicas que los hacen excelentes sensores del cambio climático (Clifford 1966, Datry et al. 2016). En el caso particular de la isla de Providencia, los ríos y las quebradas presentan una temporalidad marcada por cuatro meses de pluviosidad mínima al año; esto hace que el recurso hídrico superficial se agote transitoriamente y se formen así flujos intermitentes y efímeros.
Por otro lado, los estudios sobre rasgos funcionales de macroinvertebrados en sistemas insulares son escasos en Colombia (Longo et al. 2015); las pocas investigaciones registradas se han centrado en uno o dos tipos de rasgos y se han realizado principalmente en la isla Gorgona, Región Pacífica (Gómez-Aguirre et al. 2009, Longo y Blanco 2009 y 2014a). En el caso particular de la isla de Providencia, se conocen los trabajos de Cortés-Guzmán y Linares (2016), Cortés-Guzmán y Ospina-Torres (2014) y Valencia y Campos (2007). Por esta razón, es importante conocer la respuesta de los macroinvertebrados ante eventos de perturbación natural, asociados con la variación temporal, en las condiciones hidráulicas a partir de sus rasgos funcionales. Lo anterior ofrece una base para el uso de los rasgos como elementos de biomonitoreo de estrés hídrico, con implicaciones para la conservación y estrategias adecuadas de manejo en los ríos de la isla de Providencia.
En el presente trabajo se formuló el interrogante ¿Cómo varían la composición, la diversidad y algunos rasgos funcionales de la comunidad de macroinvertebrados en función de los cambios temporales del hábitat relacionados con las fluctuaciones de caudal en tres ríos intermitentes? Como hipótesis, se planteó que la comunidad en la sequía presentará disminución en la riqueza y la diversidad, con dominancia de taxones, particularmente moluscos; los rasgos sobresalientes serán aquellos que confieren resistencia ante la disminución de oxígeno disuelto y al aumento de la conductividad eléctrica y la temperatura del agua, tales como: estructuras especializadas para acceder al oxígeno y resistir la desecación, hábito trófico colector−recolector y reproducción por medio de nidadas cementadas. En contraste, en la época de lluvias predominarán estructuras que confieren protección y adaptación a corrientes fuertes, hábito trófico colector−filtrador y ciclos de vida cortos y rápidos. Los objetivos fueron: a) determinar cambios en la composición, estructura y en los rasgos funcionales de la comunidad de macroinvertebrados, en función de las diferencias en caudal presentados durante dos períodos hidrológicos, en tres ríos, b) establecer las variables de hábitat que influyen en los cambios de estructura y de los rasgos funcionales de la comunidad.
Materiales y métodos
Métodos de campo
Área de estudio. El estudio se realizó en la isla de Providencia ubicada en el Mar Caribe Occidental de Colombia (Figura 1); tiene un área de 17,2 km2 y una elevación máxima de 350 m s.n.m. La isla hace parte de una cordillera submarina llamada “elevación de Nicaragua” (Nicaragua rise), que se extiende entre Nicaragua y las islas de Jamaica, Haití y República Dominicana. El origen es volcánico debido a fracturas tectónicas de la corteza oceánica ocurridas hace aproximadamente 24 millones de años (Aguilera 2010).
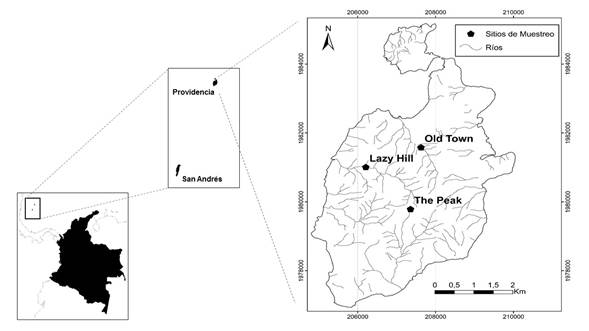
Figura 1 A. Ubicación geográfica del Archipiélago de San Andrés y Providencia en el mar Caribe de Colombia. B. Localización de los ríos Lazy Hill, The Peak y Old Town.
El relieve es quebrado, con una serranía conformada por tres ramales principales en sentido oriente-occidente. Los ríos y las quebradas de la isla tienen un carácter temporal. En general, los que están ubicados en la vertiente occidental presentan mayor longitud, caudales perennes y coberturas ribereñas más extensas, en comparación con los localizados en la vertiente oriental. Esto se debe a que la vertiente occidental tiene menor exposición al flujo de los vientos del oriente. Los suelos son poco profundos, con una capa vegetal delgada y la textura varía desde franco arenoso hasta arcilloso (Aguilera 2010, Gómez-López et al. 2012).
El régimen de lluvias es monomodal. La época de lluvias ocurre desde mayo hasta noviembre con promedios entre 121 y 307 mm/mes, siendo octubre el mes con mayor pluviosidad (promedio: 301 mm). La época seca ocurre entre los meses de diciembre y abril, con oscilaciones entre 23 y 94 mm/mes, con valores mínimos en marzo (promedio: 24 mm/mes) (Gómez-López et al. 2012). La temperatura media anual de la isla es de 27,4 °C, siendo junio, julio y agosto los meses con mayores valores (promedio: 28,1 °C) y febrero es el mes con temperatura más baja (promedio: 26,5 °C).
Se muestrearon tres ríos localizados en la vertiente occidental de la isla: (a) Lazy Hill (13º 21´356´´N 81º 23´292´´W), (b) The peak (13º 20´602´´N 81º 22´121´´W) y (c) Old Town (13º 21´788´´N 81º 22´629´´W) (Figura 1). Estos sistemas se seleccionaron debido a que presentan intervención antrópica mínima y tienen bosques ribereños primarios y secundarios extensos. Se muestreó en tres tramos por cada río, localizados aproximadamente a 45, 33 y 10 m s.n.m. En época seca no se encontró flujo base en los tramos altos, sólo había pozos aislados en los tramos medios y bajos, así que el muestreo se realizó en ellos. Con el fin de hacer una caracterización general de cada tramo, se registraron algunas variables de hábitat sugeridas en Longo y Blanco (2009) (material suplementario: Anexo 1).
Se realizaron dos muestreos en el año 2013, en julio y en octubre. Con base en los registros del Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM), se determinó que el régimen de lluvias para este año fue atípico. Así, el período de sequía se prolongó hasta el mes de julio; por tanto, los muestreos se realizaron en dos épocas hidro-climáticas contrastantes: época seca (julio: 27 mm) y época de lluvia (octubre: 165,8 mm) (Figura 2).
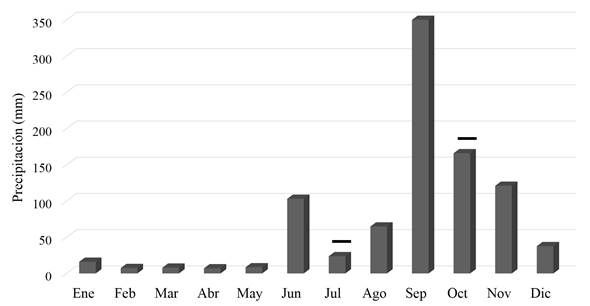
Figura 2 Valores mensuales totales de precipitación (mm) en el año 2013 registrados en la estación San Felipe del IDEAM, isla de Providencia. Meses de muestreo: julio y octubre. Tomado de: Banco de Datos del Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM).
Tratando de abarcar la mayor diversidad de hábitats (rápidos y pozos) y de sustratos (cantos, gravas, arenas, hojarasca, raíces y agua superficial), en cada tramo se recolectaron muestras desde cada uno de los sustratos disponibles. En el momento de la recolecta se integraron tres repeticiones por cada sustrato, con una intensidad de muestreo de un minuto por cada una siguiendo el método propuesto por Rodríguez-Capítulo et al. (2009). La recolecta se llevó a cabo usando una red Surber de 1,44 m2 con 250 µm de ojo de malla. Así, en octubre se muestrearon sobre rápidos (0,19−0,36 m/s) (18 muestras) y pozos (0−0,18 m/s) (24 muestras), los sustratos: roca ≥ 0,3 m (17 muestras), piedras < 0,3 m (9 muestras), hojarasca (2 muestras), raíces ribereñas (7 muestras) superficie del agua (5 muestras) y arenas (2 muestras). En julio se tomaron muestras de pozos (28 muestras) a partir de los siguientes sustratos: roca ≥ 0,3 m (6 muestras), piedras < 0,3 m (4 muestras), hojarasca (9 muestras), macrófitos y algas filamentosas (3 muestras) y en la superficie del agua (6 muestras), para un total de 52 muestras. Debido a la agilidad de los decápodos para escapar de las redes, estos se capturaron empleando trampas−bolsa con sebo (atún enlatado). Las muestras se etiquetaron y preservaron en alcohol al 70%.
Variables físicas y químicas. En cada punto de muestreo se registraron las variables: pH y temperatura hídrica con pH-metro (BOE 5190000), conductividad eléctrica (conductivímetro Hanna), oxígeno disuelto mediante el método Winkler con Kit Aqua-Merck, la alcalinidad y la dureza total mediante método colorimétrico con Kit Aqua-Merck. El caudal se estimó solo en época de lluvias, mediante la relación área de sección y velocidad de flujo (método de flotación) (Gore 2007).
Métodos de laboratorio
Identificación taxonómica. Los macroinvertebrados fueron identificados hasta los niveles de género y morfotipo con base en las claves de: Brinkhurst y Wetzel (1984), Byers y Gelhaus (2008), Chen (2004), Courtney et al. (2008), Epler (1992), Fernández y Dominguéz (2001), Gelthaus (2002), Gaviria (1993), McCafferty y Provonsha (1981) y Pennak (1989). Para la identificación de oligoquetos y quironómidos se realizaron montajes según los métodos sugeridos por Brinkhurst (1971) y Epler (1992), respectivamente. Adicionalmente, se realizaron consultas a taxonómos expertos para confirmar las determinaciones. Los organismos se depositaron en la colección de referencia del Museo de Historia Natural Luis Gonzalo Andrade, Universidad Pedagógica y Tecnológica de Colombia (números de colección 324-451: B 3-13, HP 11-19, N 1-6, CO 1-2, N 1-2, CL 1, D 60-110, E 55-56, T 93-107, C 72-85, H 21-26, L 1-5, I 1-2 y De 1).
Determinación de rasgos. Se utilizaron 55 categorías pertenecientes a 10 rasgos (material suplementario: Anexo 2). Estos rasgos incluyen características tróficas (hábito trófico y tipo de alimentación), fisiológicas (respiración), morfológicas (protección del cuerpo), conductuales (tipos de movilidad y de fijación al sustrato), del ciclo de vida (duración, número de ciclos reproductivos por año, estadios acuáticos, tipo de reproducción, formas de resistencia) y ecológicas (micro-hábitats preferenciales). Los rasgos fueron seleccionados teniendo en cuenta su posible relación con la temporalidad del caudal, con el tipo de flujo y con las variables físicas y químicas; para esto se consideraron los planteamientos de Beche et al. (2006) y Bonada et al. (2007).
Los rasgos medidos directamente fueron: micro-hábitats preferenciales, tipo de alimentación y hábito trófico (material suplementario: Anexo 2 y 3). Los restantes, asociados con el ciclo de vida y el comportamiento, se tomaron de las bases de datos de rasgos de macroinvertebrados para Bolivia (Tomanova 2007), para Estados Unidos (EPA, 2014) y para Europa (Tachet et al. 2000) y de publicaciones sobre Gastropoda de Barroso y Matthews-Cascon (2009), Bichuette y Trajano (2003), Blanco y Scatena (2007), Blanco et al. (2014), Boag y Pearlstone (1979), Dillon (2000) y Nava et al. (2011); las publicaciones sobre Diptera consultadas fueron: Cranston (2010), Deonier y Regensburg (1978), Foote (1990) y Tokeshi (1995); las de Hemíptera fueron: Ditrich y Papácek (2009) y Muraji y Nakasuji (1990); para Malacostraca fueron: Belvédère (2014) y Graziani et al. (1993).
La caracterización de los rasgos de alimentación y hábito trófico se realizó con base en los contenidos estomacales de 250 individuos pertenecientes a 29 taxones. Se tomaron entre 1 y 5 individuos de cada género por sustrato; a cada uno se le practicó una disección para extraer el material del estómago, el cual fue montado con glicerina en portaobjetos. Los montajes resultantes fueron dispuestos en microscopios, en los cuales, bajo observación a 400X, se seleccionaron 15 campos al azar teniendo como área fija la delimitada por los cubreobjetos. Así se determinó la cobertura relativa de cada categoría de ítem alimenticio (Chará-Serna et al. 2012 y Longo y Blanco 2014a). El hábito trófico se determinó de acuerdo con la información de contenidos estomacales y se complementó con datos publicados en Chará-Serna et al. (2012), EPA (2014), Longo y Blanco (2014), Merrit et al. (2008), Tachet et al. (2000) y Tomanova (2007).
Se hace notar que la asignación de grupos funcionales tróficos en su mayoría está adaptada de ecosistemas norteamericanos y europeos; por tanto, las asignaciones locales basadas en contenidos estomacales sirven para complementar o confirmar la información de la literatura de referencia.
Tratamiento de datos. Para identificar tendencias y el grado de variabilidad espacio-temporal en los datos físicos y químicos de los tres ríos, se empleó estadística descriptiva: media aritmética y coeficiente de variación en porcentaje. Al mismo tiempo, para reducir la dimensionalidad y establecer las variables determinantes se realizó un Análisis de Componentes Principales (ACP) con los datos físicos y químicos estandarizados (Guisande et al. 2011) mediante el programa Rstudio (https://www.rstudio.com/). Luego, con el fin de conocer la existencia de diferencias ambientales entre épocas se realizó una prueba de Kolmogorov-Smirnov para dos muestras con cada una de las variables estudiadas (Guisande et al. 2011).
En cuanto a la estructura de la comunidad de macroinvertebrados, se construyó una tabla de abundancias absolutas por taxón. Con base en ella se determinó el grado de similitud entre las épocas mediante la prueba ANOSIM. Para conocer cuáles fueron los taxones que caracterizaron los grupos se aplicó un Simper basado en una matriz de Bray-Curtis con 9999 permutaciones y con esto se identificaron los taxones que explicaron las diferencias (Clarke 1993); para estos análisis se utilizó el programa PRIMER 6. Se estimó el índice de Jaccard cualitativo entre épocas y se estimó la diversidad para cada época de muestreo a través de los índices de riqueza de Margalef y de diversidad de Simpson, mediante el programa PAST versión 3.13.
Con el fin de determinar las relaciones entre todas las variables ambientales con las abundancias se llevó a cabo un ACC (Análisis de Correspondencia Canónico) en el programa CANOCO 5; para la validación del mismo se utilizó la Cadena de Monte Carlo con 499 permutaciones. Se seleccionó este análisis teniendo en cuenta que los datos de abundancia tuvieron un gradiente de 4,7 unidades de desviación estándar; por ende, fue más adecuado usar un modelo unimodal −y no uno lineal− para el análisis (Lepŝ y Ŝmilauer 2003). En el ACC, el conjunto de datos ambientales fue centrado y estandarizado y los datos de abundancia fueron transformados con log10 (x + 1). Además, las especies raras fueron ponderadas y solo los taxones con mayor peso (con abundancias altas y mayor frecuencia) fueron tenidos en cuenta para el análisis.
Para el análisis de los rasgos funcionales, cada taxón se catalogó de acuerdo con su afinidad con cada una de las categorías por rasgo, siguiendo el enfoque de codificación difusa: 0 (el taxón no tiene ningún vínculo con la categoría), 1 (vínculo débil), 2 (relación moderadamente fuerte) y 3 (vínculo fuerte con la categoría). Este enfoque integra la plasticidad de cada taxón teniendo en cuenta que este puede vincularse a más de una categoría por rasgo (Chevenet et al. 1994). Con esta información se construyó una matriz de afinidad a los rasgos por estación y se ponderaron los valores de la matriz con la abundancia relativa de cada taxón por estación. Con esta última matriz se realizaron diagramas de cajas y bigotes mediante el programa Rstudio de acuerdo con la puntuación proporcional de cada categoría, y así se describió el comportamiento general con los datos integrados de los tres ríos.
Para comprobar posibles diferencias en la frecuencia de aparición de los rasgos entre las épocas, considerando los datos integrados de los tres ríos, se realizó un análisis de Chi cuadrado (X2) para cada rasgo (Guisande et al. 2011), para lo cual se utilizó el programa SPSS Versión 12. Luego, con la base de datos estación-rasgo se realizó un ACD (Análisis de Correspondencia Difusa) en el programa Rstudio, con el cual se determinó la relación de dependencia entre los rasgos funcionales y la variación temporal. Por último, para estimar la asociación entre las variables ambientales con las categorías de los rasgos, se realizó un ACC usando la matriz de estación−rasgo. En el ACC, el conjunto de datos ambientales fue centrado y estandarizado y los datos de los rasgos fueron transformados con log10 (x + 1).
Resultados
Variables fisicoquímicas. En general, se observó una marcada estacionalidad en las condiciones físicas y químicas de los tres ríos. Se registró ausencia de flujo base o muy bajo flujo (0,81 L/s en The peak) en la época seca, con un consecuente aumento en la época de lluvia cuando el caudal osciló entre 11,4 y 412,33 L/s (Tabla 1). En el ACP, el primer eje explicó el 57,8% y el segundo el 18,1% de la variabilidad; como se esperaba, a lo largo del primer eje se observa la agrupación de las estaciones según las concentraciones altas y bajas de oxígeno disuelto y de iones, las cuales están directamente relacionadas con los cambios de precipitación pluvial (Figura 3). Las variables correlacionadas con ese primer eje, además del oxígeno disuelto (2,0−5,8 mg/L), son la conductividad eléctrica (122,7−1302,7 µS/cm), la dureza total (17,8−111 mg/L CaCO3) y la alcalinidad (0,4−2,33 mmol/L) (Tabla 1), las cuales presentaron diferencias temporales significativas (Tabla 2).
Tabla 1 Media aritmética y coeficiente de variación (considerando época seca y de lluvias) para cada una de las variables físicas y químicas medidas en los ríos Lazy Hill, The Peak y Old Town, Isla de San Andrés, Colombia. T: temperatura hídrica (°C), Cd: conductividad eléctrica (μs/cm), Dr: dureza total (mg/L CaCO3), Al: alcalinidad (mmol/L), O2: oxígeno disuelto (mg/L), Ca: caudal (L/s).
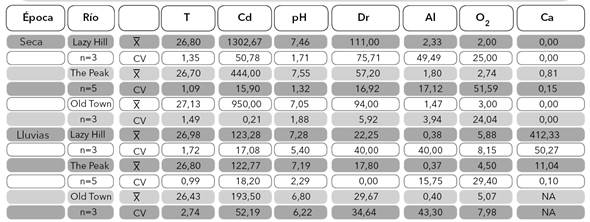
Tabla 2 Resultados de significancia de la prueba de Kolmogorov-Smirnov para dos muestras entre las variables físicas y químicas registradas en dos épocas hídricas en tres ríos en la Isla de Providencia, Colombia. D: Diferencia máxima.

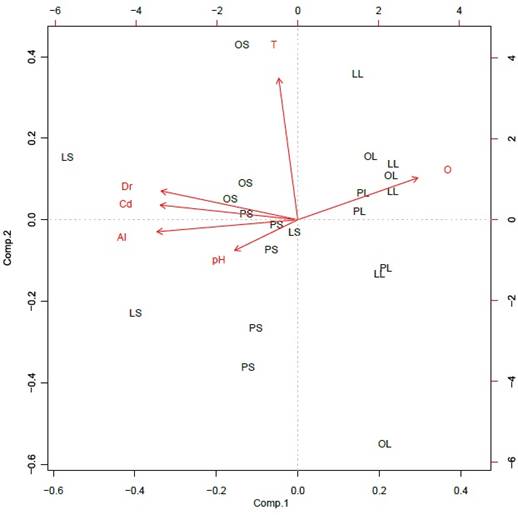
Figura 3 Análisis de componentes principales (ACP) de las variables físicas y químicas en los ríos de estudio. Variables, T: temperatura, Cd: conductividad eléctrica, Dr: dureza, Al: alcalinidad, O: oxígeno disuelto. Ríos, LS: Lazy Hill en epoca seca, LL: Lazy Hill en epoca de lluvia, PS: The Peak en época seca, PL: The Peak en época de lluvia, OS: Old Town en época seca, OL: Old Town en época de lluvias. Varianza explicada Comp. 1 = 57,82% y Comp. 2 = 18,14%.
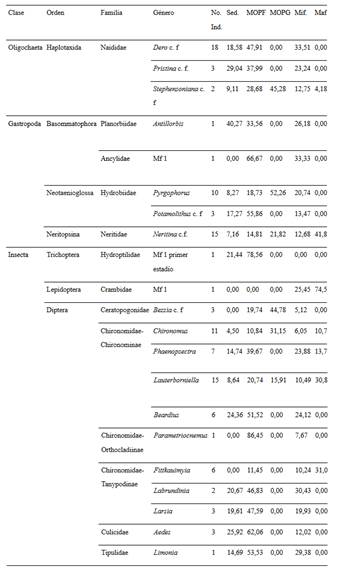
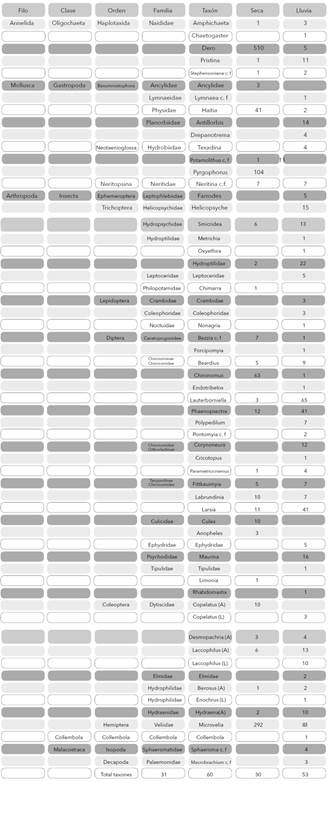
Composición taxonómica. Se recolectaron en total 1.611 individuos distribuidos en 60 géneros/morfotipos. Se resalta la riqueza del orden Diptera que representa al 36,7% del total de taxones y en especial la familia Chironomidae con 13 géneros (Tabla 3). Entre las dos épocas fueron comunes 23 taxones (40% de similitud). En la época seca se encontraron menos taxones exclusivos (7 géneros) y se determinó un aumento en la abundancia total (1123 ind.), en comparación con la época de lluvia (30 géneros exclusivos y 493 ind. en total).
Tabla 3 Listado taxonómico y abundancia absoluta de los macroinvertebrados colectados en tres ríos en la Isla de Providencia, Colombia. Estado: (A) adulto, (L) larva.
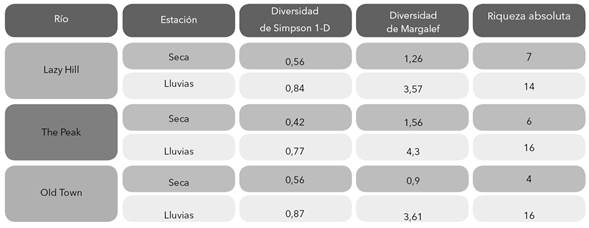
Se registró variación temporal en la diversidad siendo los índices de riqueza de Margalef y de diversidad de Simpson más altos en el periodo de lluvias con respecto a la temporada seca (Tabla 4). La abundancia total de la comunidad (Anosim R= 0,29, p = 0,003) así como la de cada taxón también tuvieron diferencias entre ambas épocas, siendo Microvelia (Simper contribución = 20%), Dero (Simper contribución = 15%), Pyrgophorus (Simper contribución = 8%), Lauterborniella (Simper contribución = 6%) y Larsia (Simper contribución = 5%), los taxones que contribuyeron en mayor grado a estas disimilitudes temporales. Microvelia, Dero y Pyrgophorus fueron más abundantes en la época seca y Lauterborniella y Larsia en la época de lluvia (Tabla 3).
Tabla 4 Resultados de índices de diversidad de macroinvertebrados por río y por por época de muestreo en la Isla de Providencia, Colombia.
En cuanto al ACC, la varianza total (inercia) de la abundancia de los macroinvertebrados fue de 4,01. De ésta, el porcentaje explicado por las 6 variables fisicoquímicas fue del 38,80%. Por otro lado, el primer eje explicó 38,78% de la varianza y el segundo el 17,23%; además, según el test de permutación de Monte Carlo, entre las abundancias con las variables fisicoquímicas existe una relación significativa (p = 0,002). De esta manera, el primer eje se asoció positivamente con altos valores en la dureza total, la alcalinidad y con la conductividad eléctrica y con altos valores de abundancia de Chironomus, Ancylidae Mf., Pyrgophorus, Haitia y Dero (Figura 4).
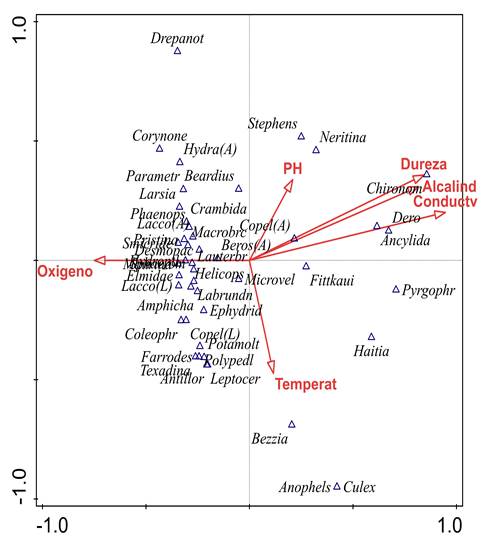
Figura 4 Análisis de correspondencia canónica (ACC) entre las variables ambientales y la abundancia de los taxones. Varianza explicada Comp. 1 = 38,8% y Comp. 2 = 17,23%. Test de permutación Monte Carlo p = 0,002. Para géneros de coleópteros, A. adulto. L. larva.
Rasgos funcionales. De acuerdo con los ponderados de aparición de los rasgos funcionales en los tres sistemas de la isla de Providencia, las categorías dominantes por rasgo fueron: preferencia por el microhábitat de rocas en rápidos, consumo de detritus fino y grueso, hábitos tróficos colector−recolector y fragmentador, respiración por tegumento, ningún tipo de protección del cuerpo y estuches−caparazones, forma de desplazarse: andando, duración del ciclo de vida de más de un año, más de un ciclo de vida por año, reproducción por nidadas cementadas o fijas y ninguna forma de resistencia seguida de diapausa−latencia (Figura 5).
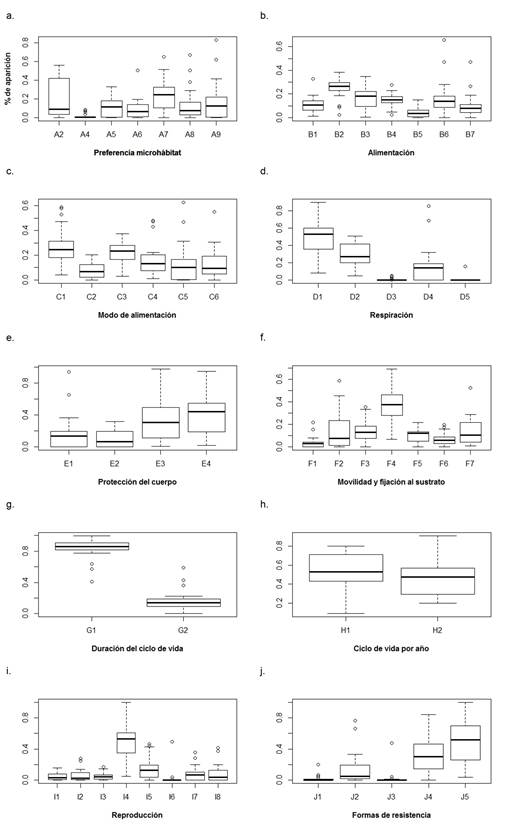
Figura 5 Diagrama de caja y bigotes para los ponderados de aparición de las categorías de cada rasgo funcional en los tres ríos. A. A2: Hojarasca corriente lenta y nula, A4: Macrófitos, algas filamentosas corriente lenta, A5: Piedras < 0,3 m Corriente lenta, A6: Ramas, raíces corriente lenta y nula, A7: Rocas ≥ 0,3 m Corriente lenta y nula, A8: Rocas ≥ 0,3 m Corriente rápida, A9: Superficie del agua en corriente lenta y nula. B. B1: Partículas de sedimento, B2: Detritus fino, B3: Detritus grueso, B4: Microfitas, B5: Macrófitos, B6: Microinvertebrados, B7 Macroinvertebrados. C. C1: Colector-recolector, C2: Colector-filtrador, C3: Fragmentador, C4: Raspador, C5: Perforador, C6: Predador. D. D1: Tegumento, D2: Branquias, D3: Plastron, D4: Estigmata, D5: Tubo de respiración. E. E1: Cuerpo esclerotizado, E2: Moderada esclerotización, E3: Fuerte (estuche, caparazón), E4: Sin adaptación. F. F1: Volador F2: Nadador de superficie F3: Nadador completo F4: Caminador F5: Excavador epibentónicos F6: Excavador endobentónicas F7: Temporalmente fijo al sustrato. G. G1: ≤ 1 año, G2: > 1 año h. H1: ≤ 1, H2: > 1. I. I1: Ovoviviparidad, I2: Huevos aislados y libres, I3: Huevos aislados, cementados, I4: Nidadas, cementadas o fijas, I5: Nidadas, libres, I6: Nidadas, en la vegetación, I7: Nidadas, terrestre, I8: reproducción asexual. J. J1: Estatoblastos, gémulas, J2: Capullos, J3: Células contra deshidratación, J4: Diapausa o de latencia, J5: Ninguna.
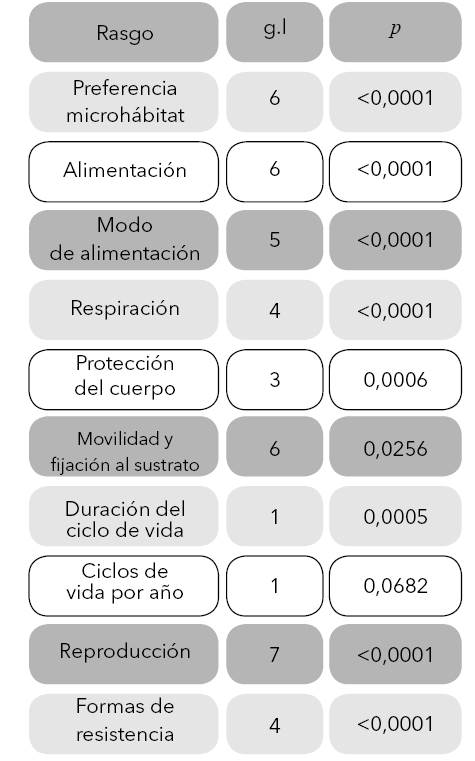
En cuanto a la variación temporal en la frecuencia de aparición de los rasgos se resalta que, todos (p < 0,0001-0,0006), excepto los correspondientes a movilidad y fijación al sustrato (p = 0,0256) y ciclos de vida por año (p = 0,0682), presentaron diferencias significativas entre las dos épocas (Tabla 5).
Tabla 5 Valores de significancia la prueba X2 realizadaa los datos los rasgos funcionales evaluados, entre las temporadas sequía y lluvias altas, para los macroinvertebrados acuáticos habitando ríos de la Isla Providencia, Colombia.
Del análisis de correspondencia difusa (ACD) (Figura 6) se dedujo que en Lazy Hill en la época de sequía (estaciones 1 y 2) sobresalieron los rasgos: ningún tipo de protección del cuerpo (E4), resistencia contra la desecación en forma de capullos (J2) y más de un ciclo de vida por año (H2); al igual que con forma de movilidad volador (F1) (estación 3). Por otro lado, en época de lluvias, en Lazy Hill (estación 5) resaltaron: reproducción por medio de nidadas cementadas o fijas (I4), menos de un ciclo de vida por año (H1) y protección del cuerpo fuerte con caparazón o estuche (E3); al mismo tiempo que (estación 6) duración del ciclo de vida de más de un año (G1) y hábito trófico colector−recolector (C1). En el río The Peak, en época seca (estación 8), los rasgos destacados fueron: reproducción por medio de nidadas cementadas y fijas (I4) y protección contra la desecación por medio de diapausa (J4); al mismo tiempo que (estación 9) duración de ciclo de vida de menos de un año (G2). En Old Town, en época seca (16, 17 y 18), los principales rasgos fueron: hábito trófico raspador (C4) y duración del ciclo de vida de menos de un año (G2).
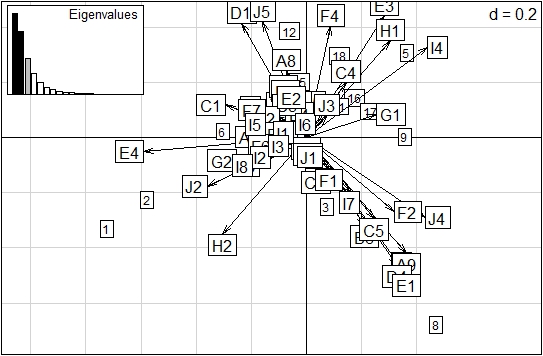
Figura 6 Agrupación de las categorías de rasgos de macroinvertebrados en relación con la variación temporal en los ríos de estudio de la isla de Providencia, basado en el Análisis de Correlación fuzificado. Los cuadrados grandes representan los códigos de las categorías mencionados en la Figura 5 y los cuadrados pequeños señalan las estaciones. 1, 2, 3: Lazy Hill en época seca; 4, 5, 6, 7: Lazy Hill en época de lluvia; 8, 9, 10, 11, 12: The Peak en época seca; 13, 14, 15: The Peak en época de lluvia; 16, 17, 18: Old Town en época seca; 19, 20, 21: Old Town en época de lluvias. Porcentaje de inercia proyectado: eje 1 (37,77%), eje 2 (17,63%). (Para los códigos de los rasgos ver Figura 5).
En cuanto al ACC, la varianza total de los rasgos funcionales fue de 0,48 y el porcentaje de varianza explicado por las 6 variables fisicoquímicas fue de 45,8%. En el primer eje se explica 37,48% de la varianza y en el segundo, el 30,83% (Figura 7). De esta manera, el primer eje se relacionó con valores bajos de oxígeno disuelto y altos de dureza total, alcalinidad y con la conductividad eléctrica, así como con alta frecuencia de las categorías de rasgos: forma de resistencia a la sequía por medio de capullos (J2), formas de reproducción asexual (I8), huevos aislados y libres (I2), huevos aislados, cementados (I3) y preferencia hojarasca en pozos como microhábitat (A2). El segundo eje se relacionó con valores altos de pH y temperatura hídrica y con alta frecuencia del rasgo resistencia a la desecación por medio de células contra la deshidratación (J3).
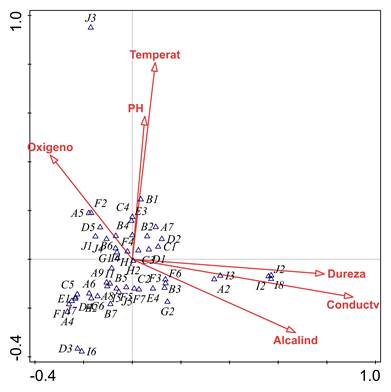
Figura 7 Análisis de Correspondencia Canónica (ACC) entre las variables ambientales y las categorías de los rasgos funcionales de los macroinvertebrados muestreados en tres ríos de la isla de Providencia, Colombia. Varianza explicada Comp. 1 = 37,48% y Comp. 2 = 30,83%. Test de permutación Monte Carlo p= 0,004. (Para los códigos de los rasgos ver Figura 5).
Discusión
Variables físicas y químicas. Se registró temporalidad en las condiciones físicas y químicas, referida a diferencias en la cantidad o presencia de flujo subsuperficial como consecuencia de los cambios en la precipitación pluvial y en la temperatura ambiental, cambios que son típicos en los bosques secos tropicales. En esta dinámica, uno de los procesos que cobra relevancia es la descomposición de hojarasca que, en las temporadas secas, se acumula en cantidades considerables en los pozos aislados que se forman debido a la ausencia de caudal. En dichos pozos, entonces, no sólo sube la temperatura del agua sino que también disminuyen las concentraciones de OD y aumentan las de gas carbónico debido a la descomposición y se incrementa en aproximadamente 11 veces la conductividad eléctrica y siete veces la dureza total y la alcalinidad, producto de la supresión de la dilución de iones provenientes de la roca ígnea insular con un consecuente aumento del pH a unidades entre neutras y alcalinas. A estas y otras modificaciones, tanto del canal -incluyendo conexiones longitudinales y laterales−, como de las condiciones físicas y químicas del agua, deben responder los diferentes organismos de los macroinvertebrados para persistir y garantizar su progenie (Allan y Castillo 2007).
Macroinvertebrados. A pesar del aislamiento de la isla de Providencia (a 271 km de Nicaragua y a 855 km de Colombia), la riqueza de taxones encontrada es alta en comparación con lo registrado para otras islas tropicales tales como Gorgona (48 géneros/morfotipos Longo y Blanco 2014b). También influye en la riqueza y en la abundancia encontrada, la estacionalidad del caudal; por tanto, la distancia al continente y la estacionalidad de las lluvias podrían ser los filtros iniciales para la colonización y el establecimiento de nuevos taxones en la isla.
De acuerdo con Cortés-Guzmán y Ospina-Torres (2014), la fauna acuática de la isla de Providencia es una combinación de elementos de Centroamérica, Suramérica y Las Antillas, en la que Chironomidae, Coleoptera y Trichoptera figuran, al igual que en este trabajo, entre los grupos más representativos por la riqueza de géneros/morfotipos. En este trabajo, los taxones con mayor abundancia fueron el oligoqueto Dero, el insecto Microvelia y el gastrópodo Pyrgophorus. Ellos presentan distribuciones generalizadas a través de las islas del Caribe y también son comunes en ríos intermitentes. En general, en las islas se ha encontrado que la mayor riqueza reside en Insecta, puesto que los organismos alados tienen rasgos funcionales que favorecen la movilidad en largas distancias (Bass 2003, Longo et al. 2009). Sin embargo, en la isla de Providencia se relata también la riqueza de Gastropoda (9 géneros/morfotipos) y de Oligochaeta (5 géneros), organismos que tienen distribución pasiva y rasgos -escasamente estudiados- que les permiten tolerar y sobreponerse a la desecación, aprovechando los cambios en los niveles del agua para reproducirse y redistribuirse aguas abajo (Longo et al. 2010).
En cuanto a la variación estacional, se encontró menor riqueza de taxones en la época seca, lo que podría asociarse, como ha sido sugerido en otras investigaciones (Beche et al. 2006, Bogan y Lytle, 2011, Covich 1988, Longo et al. 2010), con alternancia de presencia-ausencia durante los periodos seco−lluvias, determinada por la sensibilidad a la disminución o ausencia del caudal, momento con limitada capacidad de sobrevivir en los pozos en donde se presentan bajas concentraciones de oxígeno disuelto y altos valores de conductividad eléctrica, de alcalinidad y de dureza total, entre otros. Una de las estrategias de los insectos para sobrellevar la sequía es el proceso de emerger, así pasan la temporada en el medio terrestre−aéreo. En contraste, se ha encontrado en algunos ríos intermitentes del Mediterráneo que la riqueza de taxones aumenta durante la época de sequía en comparación con la temporada de inundación, esto estaría relacionado con la predictibilidad de la época de sequía en estos ecosistemas y el papel de sistemas intermitentes como zonas de refugio de la fauna de quebradas efímeras (Bogan et al. 2015, Bonada et al. 2007, Maasri et al 2008, Skoulikidis et al. 2017).
En cuanto a los rasgos, se encontró que organismos como Ancylidae Mf., Pyrgophorus, Anopheles y Culex (presentes únicamente durante la temporada seca) y Dero, Haitia, Neritina, Labrundinia, Microvelia y Laccophilus (comunes a las épocas seca y de lluvias), poseen rasgos de resistencia frente a las condiciones ambientales extremas de la época seca. Por otro lado, la fauna que se encontró solo en época de lluvia (v. g. Macrobrachium, Polypedilum, Corynoneuria, Helicopsyche y Farrodes) tiene rasgos de resiliencia que le permite evitar estas condiciones. De esta forma, en la época seca, Chironomus, Ancylidae Mf., Pyrgophorus, Haitia, y Dero resistieron disminución en las concentraciones de oxígeno disuelto y aumento en las concentraciones de dureza total y alcalinidad, así como incrementos de la conductividad eléctrica. Esta resistencia se atribuye a la presencia de estructuras tales como branquias (Dero, Ancylidae Mf., Pyrgophorus), conchas para proteger el cuerpo o pigmentos como la hemoglobina (Chironomus), así como de mecanismos especializados que les permiten salvaguardarse de dichas condiciones. Estas formas de especialización de los macroinvertebrados ante las condiciones físicas y químicas adversas encontradas en la isla de Providencia concuerdan con lo hallado para ríos intermitentes de Australia, España y Estados unidos (Beche et al. 2006, Bonada et al. 2007, Dézerald et al. 2015, Huryn et al. 2008, Stubbington et al. 2016).
Así, los rasgos que se asociaron con la época de sequía son: resistencia contra la desecación en forma de capullos o estuches y diapausa, duración de ciclo de vida de menos de un año y más de un ciclo de vida por año y el hábito trófico−raspador. Por otro lado, las categorías que se asocian con la época de lluvia son: duración del ciclo de vida de más de un año, menos de un ciclo de vida por año, protección del cuerpo fuerte con caparazón o estuche y hábito trófico colector−recolector. Lo anterior concuerda con lo encontrado por Dezerald et al. (2015) y Stubbington et al. (2016) para ríos intermitentes y Torrez-Zambrano y Torrez-Zambrano (2016) para ríos perennes.
Teniendo en cuenta que en las dos épocas se presentaron, en proporción similar, organismos que utilizan estuches o capullos, se destaca la importancia de esta adaptación para sobrellevar tanto condiciones de sequía como de corriente en época de lluvias. Así, se registra que algunas larvas de Chironomidae y ciertos oligoquetos Naididae, construyen capullos de barro en el fondo de pozos con el fin de hacer frente a las sequías prolongadas (Pennak 1989, Tokeshi 1995); igualmente, Epler (1992) afirmó que los estuches transportables de Lauterboniella, hechos de pequeños granos de arena, pueden servir como protección contra la corriente. Adicionalmente, se registró en este trabajo la capacidad de Beardius para fabricar casas y adherirlas a la hojarasca y dado que solo se encontraron en la época de lluvias, se presumen que este estuche puede servir como adaptación a la corriente y como una estrategia para captar alimento, ya que Beardius se alimenta de materia orgánica particulada fina.
Otra de las estrategias asociada con la época de sequía es la diapausa; así, por ejemplo, se ha documentado que huevos del hemíptero Microvelia pueden entrar en diapausa en época de lluvias intensas y permanecer así hasta que la velocidad del agua disminuya (Muraji y Nakasuji 1990). A pesar que la diapausa solo se asoció con organismos encontrados en la época de sequía, se registra que Polypedium (encontrado en la isla de Providencia durante las lluvias), también presenta diapausa en forma de larva durante la temporada seca, la cual puede durar incluso años y luego “emerge” inmediatamente cuando vuelven las lluvias (Huryn et al. 2008). En América del Norte, organismos de este género son los primeros en habitar los pozos después de una sequía extrema (Lampert y Sommer 2007).
En cuanto a los ciclos de vida, según Hynes (1970), habría tres tipos: estacional lento, estacional rápido y no estacional. En la isla de Providencia, los ciclos de vida que se asociaron con las condiciones de temporalidad correspondieron a los estacionales, los cuales se presentan de forma característica en organismos que habitan sistemas lóticos intermitentes (Huryn et al. 2008, Jackson y Sweeney 1995, McDonough et al. 2011). De esta forma, en la isla de Providencia, en la época de sequía, se encontraron ciclos rápidos-estacionales, considerando que la mayoría de individuos completan su ciclo en menos de un año y en general tienen más de una generación por año, tal es el caso de Microvelia, Beardius y Chironomus. En cambio, en la época de lluvias, prevalecieron organismos con ciclos de vida de más de un año, con menos de una generación por año; este tipo de ciclo corresponde a lento estacional y es propio de Laccophilus, entre otros. Estos patrones concuerdan con lo registrado por Bogan et al. (2015) y Dézerald et al. (2015) para ríos intermitentes de Europa.
Respecto al hábito trófico, en la época seca abundaron organismos raspadores, lo que coincide con lo reportado por Muñoz (2003) para un río intermitente del Mediterráneo. Dicha condición se asocia con el aumento de la productividad primaria durante esta época. Igualmente, en los tres ríos de la isla de Providencia, se evidenció alta proliferación de perifiton en la superficie de la hojarasca y de las piedras durante esta época. En cambio, en la época de lluvia, dominaron organismos colectores−recolectores que utilizan la MOPF como recurso principal. Estos resultados concuerdan con lo registrado para quebradas continentales de Colombia por Torrez-Zambrano y Torrez-Zambrano (2016). Sin embargo, en estudios realizados en quebradas de la isla Gorgona (Longo y Blanco 2014b, Longo et al. 2015) y la parte central de los Andes colombianos (Chará-Serna et al. 2012), destacan la riqueza y abundancia de los fragmentadores especializados, diferente a lo observado en los arroyos de la isla de Providencia, ya que los taxones tienen roles que combinan la fragmentación de hojarasca y de MOPG con la recolecta y la recolección de MOPF desde los sedimentos. En contraste, en ríos continentales e intermitentes de la zona templada, la variación temporal en el hábito trófico está marcada por organismos macrodepredadores en aguas bajas y por raspadores y filtradores en aguas altas (Amundrud y Srivastava 2016, Bonada et al. 2007, Williams 1996).
Por otro lado, los rasgos que se relacionan con bajas concentraciones de oxígeno disuelto y con altos registros de conductividad eléctrica, dureza total y alcalinidad, registrados para la época seca son: rasgos de historia de vida y hábito trófico. Por ejemplo, Dero puede sobrellevar la disminución en el nivel del agua y los cambios en las condiciones físicas y químicas al utilizar la reproducción asexual para la autoperpetuación (Armendáriz 2008, Christensen 1984); condición evidenciada mediante la recolecta de organismos organizados en cadenas (zooides). Se resalta también la hojarasca acumulada en los pozos durante la época seca ya que jugó un papel relevante como alimento (tanto para fragmentadores como para los raspadores y recolectores) y como sustrato (Blanco et al. 2015, Valencia et al. 2009).
Conclusiones
La condición ambiental de los ríos está determinada por la temporalidad de las lluvias con los consecuentes cambios del flujo superficial en el lecho, sumado a la dinámica en la acumulación de hojarasca en los pozos aislados formados durante la temporada seca, así como con las inundaciones en la época de lluvias. Sin embargo, a pesar que los cambios son aparentemente extremos, cada temporada es aprovechada por un grupo de taxones que a través de sus rasgos aprovechan las circunstancias o sobreviven. De tal manera que los cambios no son catastróficos para el mantenimiento de la diversidad taxonómica de la comunidad.
Se corroboró, en parte, que durante la época seca se presentaría menor diversidad y riqueza de macroinvertebrados y que los rasgos funcionales asociados a esta época confieren a los organismos resistencia ante condiciones extremas, especialmente asociadas a la drástica variación del régimen hidrológico, altas conductividades eléctricas y alcalinidad, y bajas concentraciones de oxígeno disuelto. Mientras que los rasgos sobresalientes en la época de lluvia se relacionan con la resistencia a velocidades de corriente altas (protección con caparazón o estuches, ciclos de vida lentos estacionales, hábito trófico colector recolector y ciclo de vida largo).
Se recomienda para estudios posteriores sobre rasgos funcionales de macroinvertebrados en ríos intermitentes insulares: a) realizar más muestreos tratando de abarcar todo el ciclo de las lluvias durante varios años; b) incluir muestras de la zona hiporreica y de fitotelmas; y c) evaluar el rasgo funcional de movimiento hacia el mar (organismos diádromos y anádromos) y su asociación con la temporalidad.