Introducción
La reproducción es el medio por el que se perpetuán las especies (Vazzoler 1996) y quizá en el que las especies invierten más energía, al punto que han evolucionado diversos mecanismos reproductivos que dependen de factores genéticos, pero también, en gran medida, por factores ambientales en el que interaccionan los factores sociales, neurales, endocrinos y nutricionales (Criscuolo-Urbinati 2005).
Los peces despliegan una alta diversidad de estrategias y tácticas reproductivas que les han permitido ser exitosos en los ambientes acuáticos. La estrategia y táctica reproductiva que desarrolla un pez está dirigida a transferir sus genes a la siguiente generación y persistir en el ambiente; tales rasgos incluyen la edad de su primera reproducción, el tamaño y la edad especifica de fecundidad, el tamaño y la naturaleza de los gametos, el tiempo y el periodo de reproducción y el cambio de sexo en algunas especies (Shapiro 1984), mientras las tácticas consideran cómo la especie utiliza los recursos energéticos y como los canaliza, el desencadenamiento hormonal por estímulos ambientales, el tiempo de incubación o el periodo de eclosión, la época de desove de acuerdo con la distribución de la especie y el número de épocas reproductivas (Vazzoler 1996).
Un aspecto importante en la reproducción es la fecundidad. Es parte del potencial reproductivo de un individuo y se estima como el número de gametos que puede producir. Hay especies que presentan una fecundidad muy alta, con una producción de millones de huevos, mientras otras especies, especialmente aquellas que viven o desovan ligadas a un tipo de substrato y que brindan alguna clase de protección a sus huevos, tienen una fecundidad más baja (Csirke 1993). Sin embargo, la mayoría de los teleósteos tienen desoves con gran número de oocitos pequeños y el cuidado parental de estos es poco común (Wootton 1998). Según Ray y McCormick (2004) los peces presentan diferentes estrategias de vida de acuerdo con sus rasgos reproductivos, y las definen como oportunistas, estacionales y en equilibrio.
El objetivo de este trabajo fue determinar la fecundidad de las especies de peces más abundantes del área de influencia de los embalses Porce II y Porce III, con miras a proveer información sobre uno de los rasgos más importantes en la reproducción de los peces y que sirva de insumo para comparar con poblaciones en ambientes no modificados.
Materiales Y Métodos
Área de estudio
Este trabajo se desarrolló en el río Porce, en el área de influencia de los embalses en cascada Porce II y Porce III. Desde el punto de vista regional, el río Porce se inserta en la zona del macizo oriental antioqueño, cuyos rasgos geomorfológicos más importantes son los procesos erosivos favorecidos por la meteorización química y el régimen de lluvias abundante (Empresas Públicas de Medellín y Universidad de Antioquia, 2010). El río Porce nace en el Alto de San Miguel, al sur de la ciudad de Medellín, a 2660 m s.n.m. y desciende atravesando la parte central del departamento de Antioquia en dirección noreste, hasta desembocar en el río Nechí, afluente del río Cauca, después de un recorrido de 227 km. El cauce del río desde su nacimiento hasta su paso por el municipio de Barbosa (Antioquia) a 680 m s.n.m. recibe el nombre de río Medellín, luego de este sitio toma el nombre de río Porce (Figura 1).
El río Porce es uno de los ríos emblemáticos de Antioquia puesto que nace y “muere” dentro de éste departamento. Este sistema no sólo es importante como referente en Antioquia, sino también por ser un río transandino representante único de la conformación geológica del batolito antioqueño.
Luego de la formación de los embalses Porce II y Porce III, el paisaje del valle del río Porce tuvo un cambio definitivo, originando tres sistemas claramente definidos: cauce del río Porce no embalsado, embalses y quebradas tributarias a los embalses (Figura 1).
Diseño del muestreo
Entre los años 2011 y 2016 se realizaron en total 13 jornadas de campo, correspondiendo siete de estas a los periodos de lluvias y seis a los momentos de estiajes. En cada campaña de campo se obtuvieron muestras de la ictiofauna presente en las 31 estaciones de los tres sistemas principales: embalses en el cauce del río Porce, quebradas tributarias a los embalses, y ríos afluentes o efluentes a estos embalses (Figura 1)
Captura de peces
La captura de los peces en el embalse se realizó mediante redes de espera con diferentes ojos de malla (1, 2, 3, 4, 5, 6, 7, 8, 9, 10 cm), expuestas durante seis horas, mientras que en los sistemas de río y quebradas se emplearon atarrayas (ojo de malla 1 cm), 30 lances y electropesca (Samus 725MP) contra corriente aguas arriba haciendo un barrido por 100 m. Las capturas se realizaron generalmente en horas del día (7:00−14:00 horas). Cada ejemplar capturado fue fotografiado, medido en su longitud estándar y pesado. Posteriormente fue anestesiado con aceite de clavo, el cual es un sedante comúnmente usado en peces (Neiffer et al. 2009); luego de un corto tiempo, cuando la solución hizo efecto, el pez fue fijado en solución de formalina al 10% (Murphy y Willis 1996) y se le asignó un número de campo. Finalmente, el espécimen fue embalado para su procesamiento en el laboratorio de la Universidad de Antioquia. Las consideraciones éticas siguieron los protocolos de Murphy y Willis (1996).
Métodos en Laboratorio
A cada ejemplar traído del campo se le realizó un corte en su región ventral para exponer su cavidad visceral; a continuación, el contenido fue cuidadosamente removido y se identificaron sus partes. Las gónadas se removieron cuidadosamente, se determinó el sexo y el estado de madurez según la escala de Vazzoler (1996) y finalmente se registró el peso de la gónada corregido (Wg) / (Wt-Wg).
Análisis de la información
Para analizar la fecundidad de algunas de las especies más abundantes se extrajeron sus gónadas (n ˃ 7 por especie); las gónadas de las hembras en estadio de madurez C se preservaron en solución de Transeau y se analizaron sus hemisferios por separado (gónada derecha, gónada izquierda). Se siguieron dos métodos según la cantidad de huevos por especie: el gravimétrico, propuesto por Vazzoler (1996), para las especies Coptodon rendalli (Boulenger 1897), Astyanax microlepis Eigenmann 1913, Hoplosternum magdalenae Eigenmann 1913, Brycon henni Eigenmann 1913 y Parodon magdalenensis Londoño-Burbano, Román-Valencia y Taphorn 2011, mientras para Bryconamericus caucanus Eigenmann 1913, Roeboides dayi (Steindachner 1878), Andinoacara latifrons (Steindachner 1878), Chaetostoma thomsoni Regan 1904, Poecilia reticulata Peters 1859, P. caucana (Steindachner 1880) y Oreochromis niloticus (Linnaeus 1758) se realizó conteo total de los huevos de cada gónada. Cada gónada fue seccionada en tres sectores: cefálico, medio y caudal y de cada uno de estos se seleccionaron de manera aleatoria 100 huevos y se midió su diámetro con la ayuda de un estereoscopio con reglilla instalada en el ocular. De cada hemisferio de la gónada se obtuvo el registro del diámetro de 300 huevos, para un total de 600 huevos por gónada.
Para definir la inversión energética (esfuerzo reproductivo) que hizo cada hembra en su reproducción, se analizaron las características de sus huevos y las particularidades de su postura (fecundidades, diámetro medio del huevo). Con base en la muestra del número de huevos totales por hembra (fecundidad total Ft) y tomando en consideración su peso total, se estimó la fecundidad relativa Fr (número de huevos por gramo de hembra). A partir de la información de la muestra se estimaron los valores medios de las variables Ft y Fr, y la amplitud de sus rangos. Por último, se realizó una prueba de asociación de Spearman entre la fecundidad y las variables corporales de las hembras (peso total y longitud estándar).
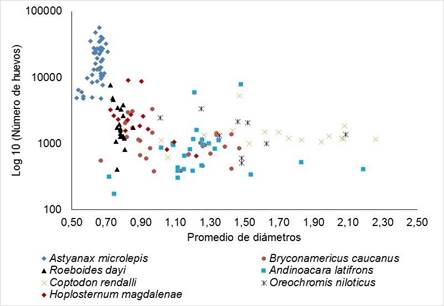
El análisis de diámetros se hizo a partir de la distribución de frecuencias del número de huevos en cada clase de diámetro (amplitud: 1mm). El análisis fue gráfico y se hizo tanto para el conjunto de especies agrupadas por familias, como para cada especie. A partir de la información de la muestra se estimaron los valores medios de los diámetros y la amplitud de sus rangos. Además, se realizó un gráfico de dispersión y una prueba de asociación de Spearman a la fecundidad total de cada individuo analizado y el promedio del diámetro de los huevos para ese individuo.
Resultados
Fecundidad
Se estimó la fecundidad total de 12 especies de las cuales A. microlepis presentó el mayor número de huevos con un valor medio de 20.202 y P. reticulata tuvo el menor número de embriones (15 en promedio). En cuanto a la fecundidad relativa (huevos/ gramos de peso) A. microlepis tenía 1077 h.g-1, mientras O. niloticus 5 h.g-1. El menor diámetro de los huevos se observó en las especies P. magdalenensis y A. microlepis con promedio de diámetro de 0,65 mm, mientras los mayores diámetros de huevos se encontraron en las especies C. rendalli y C. thomsoni (1,63 mm y 2 mm, respectivamente); el rango más amplio de diámetros se encontró en las especies A. latifrons y B. henni (0,10−3,04 mm y 0,10−2,23) (Tabla 1).
Tabla 1 Fecundidad total, fecundidad relativa Fr (huevos por gramo de hembra) y diámetro de los huevos de las especies más abundantes presentes en el área de influencia de los embalses Porce II y Porce III
| Especie | N | Fecundidad total | Fecundidad relativa | Media diámetro oocitos | Diámetro (Min-Max) oocitos mm | ||||
|---|---|---|---|---|---|---|---|---|---|
| Media ± Des est | Rango (Min-Max) | Media ± Des est | Rango (Min-Max) | ||||||
| Astyanax microlepis | 50 | 20202±12314 | 4763-56502 | 1077±474 | 326-2310 | 0,65 mm | 0,26-0,97 | ||
| Bryconamericus caucanus | 29 | 1215±801 | 380-3299 | 199±160 | 49-584 | 1,09 mm | 0,39-1,9 | ||
| Roeboides dayi | 20 | 2403±1774 | 408-7695 | 405±269 | 107-1390 | 0,78 mm | 0,34-1,18 | ||
| Brycon henni | 7 | 5788±2533 | 1621-9887 | 33±26 | 12-88 | 1,56 mm | 0,10-2,23 | ||
| Parododn magdalenesis | 7 | 12541±9730 | 3710-32375 | 628±339 | 126-1014 | 0,65 mm | 0,18-0,94 | ||
| Poecilia caucana | 30 | 41±28,10 | 6-145 | 47±26 | 8-110 | NA | NA | ||
| Poecilia reticulata | 11 | 15±15 | 10-153 | 50±52 | 10-153 | NA | NA | ||
| Andinoacara latifrons | 27 | 1125±1727 | 145-7867 | 38±19 | 7-81 | 1,25 mm | 0,10-3,04 | ||
| Coptodon rendalli | 28 | 1464±995 | 618-5297 | 7±6 | 3-33 | 1,63 mm | 0,36-2,98 | ||
| Oreochromis niloticus | 9 | 1651±945 | 506-3396 | 5±2 | 2-10 | 1,46 mm | 0,46-3,09 | ||
| Chaetostoma thomsoni | 9 | 89±37 | 42-167 | 9±4 | 6-17 | 2 mm | 0,51-3,74 | ||
| Hoplosternum magdalenae | 15 | 3503±3327 | 644-11210 | 200±176 | 40,98-671,90 | 0,87 mm | 0,1-1,8 | ||
La distribución de huevos por rangos de diámetro muestró que la familia Characidae es la que, en promedio, presentó el mayor número de huevos pequeños en rangos de diámetros más estrechos, seguida de Parodontidae; en contraste, los tamaños y diámetros de las familias Loricariidae, Cichlidae y Callichthydae mostraron rangos más amplios que van desde los 0,1 mm a 3,8 mm con abundancias de huevos más bajas en cada rango (Figura 2).
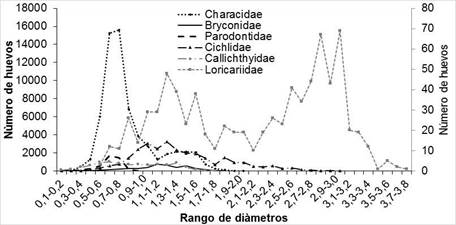
Figura 2 Distribución del número de huevos para cada clase de diámetro de acuerdo con la familia. El eje secundario aplica solo para la familia Loricariidae, debido a su bajo número de huevos.
En cuanto al rango de diámetros a nivel de especies se encontró que A. microlepis, P. magdalenensis y R. dayi presentaron rangos estrechos (entre 0,2−1,2 mm), A. latifrons presentó un rango intermedio (entre 0,4−1,9 mm) y C. thomsoni un mayor rango en el tamaño del diámetro del huevo (0,5−3,7 mm) (Figura 3) (Tabla 1).
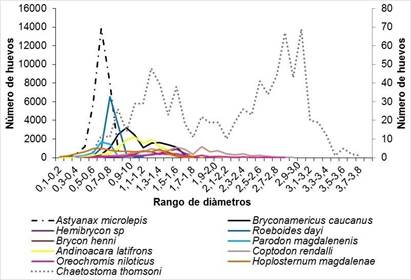
Figura 3 Distribución del número de huevos por clase de diámetros para cada especie. El eje secundario aplica solo para Chaetostoma thomsoni, debido a su bajo número de huevos.
La relación entre el número de huevos y algunas características corporales de los individuos fue particular para cada especie. Astyanax microlepis, O. niloticus, R. dayi, P. caucana y C. thomsoni presentaron relaciones significativas (p<0,05) entre el número de ovocitos con la longitud y el peso, es decir a mayor peso y longitud, mayor fecundidad. En el caso de H. magdalenae se determinó una relación positiva entre la longitud y el número de huevos, mientras que para B. caucanus, C. rendalli, B. henni y Hemibrycon sp, no se encontró relación entre la fecundidad y las variables corporales analizadas. Aunque P. magdalenensis y P. reticulata tuvieron un coeficiente de correlación de 0,61 y 0,59, respectivamente, el valor p no fue significativo. El grado de correlación (R) entre el número de huevos y las variables corporales fue diferente para cada especie (Tabla 2).
Tabla 2 Valor R de correlación (índice de Spearman) entre el número de huevos y las variables longitud estándar (LE) y peso corregido (Pc), para algunas especies presentes en el área de influencia de los embalses Porce II y Porce III. *Relaciones significativas (p<0,05)
| Especies | LE-# huevos | Pc-# huevos |
|---|---|---|
| Astyanax microlepis | 0,72* | 0,70* |
| Andinoacara latifrons | 0,20 | 0,77* |
| Coptodon rendalli | 0,01 | 0,11 |
| Oreochromis niloticus | 0,73* | 0,76* |
| Hoplosternum magdalenae | 0,54* | 0,3 |
| Bryconamericus caucanus | -0,11 | -0,04 |
| Roeboides dayi | 0,62* | 0,57* |
| Poecilia caucana | 0,80* | 0,80* |
| Brycon henni | 0,0 | 0,0 |
| Parodon magdalenensis | 0,61 | 0,46 |
| Chaetostoma thomsoni | 0,68* | 0,67* |
| Hemibrycon sp | 0,33 | 0,14 |
| Poecilia reticulata | 0,59 | 0,41 |
Pc=peso total - peso gónada
La relación entre el número de huevos y el tamaño de los mismos fue negativa y significativa (p<0,05), es decir, a mayor número de huevos menor fue el tamaño de estos y viceversa, cuando la fecundidad fue baja el tamaño de los huevos presentó un diámetro mayor (Figura 4).
Discusión
Se estimó la fecundidad para 12 taxa presentes en el área de influencia de los embalses Porce II y Porce III. Los valores de fecundidad registrados por otros autores para las especies analizadas son, en algunos casos cercanos y en otros difieren de los encontrados en el área del río Porce y sus embalses (Tabla 3). La fecundidad de las especies analizadas muestra que, aunque pueden ser similares en grupos filogenéticamente próximos (especies de una misma familia), las diferencias se dan de acuerdo con las tácticas reproductivas de cada especie.
Murua y Motos (2006) afirman que, dentro de la misma especie, la fecundidad puede variar como resultado de las diferentes adaptaciones a las condiciones y presiones ambientales particulares de cada hábitat, pues el hábitat provee la energía para la reproducción. Además, tanto Murua et al. (2003) como Vazzoler (1996) afirman que la fecundidad es particular a la condición fisiológica del individuo, a su edad y en algunos casos, a su talla. Nuestros resultados sugieren que las nuevas condiciones en los embalses están influyendo en la fecundidad, dirigida al aumento quizá con el fin de compensar una alta mortalidad de larvas y juveniles, debido a condiciones adversas, o bien, a disminuir debido a factores de estrés que no permiten la suficiente inversión de energía en la reproducción. Sin embargo, este trabajo no verificó si la respuesta obedece a presiones ambientales, por lo que lo anterior corresponde a una hipótesis que debe verificarse.
Tabla 3 Información sobre fecundidad registrada en estudios anteriores. * Especies comparadas a nivel de género
| Especies | n.º huevos otros trabajos | Referencia | n.º huevos en este trabajo |
|---|---|---|---|
| *Astyanax microlepis | 10000 | Vazzoler (1996) | 20.202 |
| Bryconamericus caucanus | 3759 | Román-Valencia et al. (2008) | 1.215 |
| Roeboides dayi | 305 | Román et al. (2003) | 2.403 |
| Brycon henni | 13-47 h.g-1 | Martínez-Orozco y Vásquez-Zapata (2001) | 12-88 h.g-1 |
| Poecilia caucana | 10-251 | Wischnath (1993) | 41 |
| Poecilia reticulata | 8-198 | Urriola-Hernández et al. (2004) | 3-59 |
| Oreochromis niloticus | 2408 | Campos-Mendoza et al. (2004). | 1651 |
| Coptodon rendalli | 6.160 | Chandrasoma y De Silva (1981) | 5297 |
| Andinoacara latifrons | 954 | Olaya-Nieto et al. (2010) | 1125 |
| Chatostoma thomsoni | 124 | Zuñiga-Upegui et al. (2014) | 89 |
| *Hoplosternum magdalenae | 1675 | Winemiller (1987) | 3503 |
En este trabajo se encontró que las especies de la familia Characidae que no tienen cuidado parental tenían fecundidades más altas que aquellas especies de la familia Cichlidae que si lo tienen. Según Wooton (1998), la mayoría de las especies sin cuidado parental se especializan en la producción de una mayor cantidad de huevos, mientras las que protegen sus crías tienen una fecundidad más baja.
Vazzoler (1996) propone que las especies con fecundación externa, no migratorias y sin cuidado parental, presentan huevos pequeños a medianos, mientras las especies que tienen fecundación externa con cuidado parental, tienen huevos más grandes. Esto concuerda con lo encontrado en este trabajo, ya que las especies A. microlepis, B. caucanus y R. dayi no tienen cuidado parental y presentan huevos con menor diámetro, comparadas con aquellas especies de fecundación externa y cuidado parental como A. latifrons y C. rendalli que tienen huevos más grandes. Con base en el tamaño corporal, el tamaño de la primera reproducción, la fecundidad y la estacionalidad en la reproducción, los peces pueden ser clasificados en oportunistas, estacionales y en equilibrio (Ray y McCormick 2004). En este trabajo solo se estimó la fecundidad, por lo que no es posible conocer la estrategia reproductiva de las especies analizadas.
Se determinó que hay relaciones entre la fecundidad y la longitud del pez y la fecundidad y el peso corporal, esto es debido a que peces más grandes pueden contener más huevos. Según Murua et al. (2003), la fecundidad es proporcional al tamaño del pez, es decir, peces más grandes producen más huevos, en ambos términos, absolutos y relativos, debido a la masa corporal.
Existe una relación inversa entre el número de huevos y el volumen de los mismos, lo que indica que a mayor diámetro del huevo menor fecundidad; esto es confirmado por el trabajo realizado por Vazzoler (1996), quien afirma que la fecundidad está en función del volumen individual de los huevos. De acuerdo con este rasgo asociado con la fecundidad, podemos agrupar en dos categorías a las especies analizadas en el área del río Porce. La primera conformada por las especies de la familia Characidae, los cuales no tienen cuidado parental, sus huevos son más pequeños y abundantes y la segunda agrupa las especies de la familia Cichlidae, quienes presentan cuidado parental, tienen menor número de huevos, pero de mayor tamaño.