Introducción
Los embalses rompen el flujo unidireccional dentro del cauce de los ríos (Dudgeon et al. 2006, Nilsson et al. 2005) en los que se presentan diferentes flujos de velocidad del agua y de grandes turbulencias y forman un nuevo sistema semi-lacustre con características similares a las de un lago y con algunas influencias del río (Granado-Lorencio 2002). Estas nuevas condiciones modifican la composición y la estructura del ensamblaje de la biota acuática y en particular de la ictiofauna (Petrere 1996).
El desarrollo del sector hidroeléctrico, a nivel global, ha provocado la construcción de embalses en ríos alrededor del mundo, muchos de estos localizados a lo largo de un mismo cauce, conformando sistemas de embalses en cascada. Analizando la respuesta de algunas características del agua (v. g., temperatura, turbidez, oxígeno) así como la diversidad biótica, Ward y Standford (1983), en su planteamiento Discontinuidad Serial, definen que éstos nuevos sistemas acuáticos además de romper con el continuo del río (Vannote et al. 1980), perturban el hábitat, interrumpen el flujo de agua, de sedimentos, de nutrientes (Barbosa et al. 1999, Bunn y Arthington 2002) y de la biota acuática (Chaves-Ulloa et al. 2014); efectos que pueden ser acumulativos en sistemas que presentan múltiples embalses en serie (Stanford y Ward 2001), pues estos alteran la dinámica de nutrientes del sistema, y en consecuencia, la productividad pesquera en embalses aguas abajo (Welcomme 1985). A pesar de estos cambios, las condiciones ecológicas de los ríos tienden a restablecerse a su estado inicial, aguas abajo del sector embalsado, dado que las aguas que ingresan al río desde una cuenca superior ejercen un efecto de “restauración”, puesto que oxigenan las aguas, se incrementan los sedimentos en el agua y la fauna que compone el lecho del cauce (Stanford y Ward 2001).
En Colombia, Maldonado-Ocampo et al. (2008) reportaron 213 especies para la cuenca del río Magdalena-Cauca. En embalses en Colombia, Jiménez-Segura et al. (2011a) reportaron 77 especies de peces. Entre éstas especies se encuentran nativas e introducidas, siendo éstas últimas las especies que sostienen en gran parte las pesquerías de los embalses colombianos. Dentro de la compleja red hídrica de la Cuenca Magdalena-Cauca han sido varios los ríos que suscitan interés para la generación de energía eléctrica. En el río Porce (tributario del río Nechí, afluente del río Cauca) se encuentran en operación la central Guadalupe III y IV, los embalses Miraflores-Troneras, Río Grande, Porce II y III, además de otros planteados como Porce IV y diversas microcentrales.
Desde la década de 1960 la cuenca alta del río Porce (tramo conocido como río Medellín) ha tenido grandes cambios en sus hábitats acuáticos. El mal manejo de las aguas residuales e industriales que caen al río Medellín y la pérdida de bosque para la construcción de viviendas han modificado, no solo la calidad del agua, sino también la tipología del pulso de caudal, ocasionando que su ictiofauna sea pobre en el número de especies (Uran y Torrente 2001). La carga de materia orgánica que lleva el río Porce al ingresar al embalse Porce II hace de éste un sistema hiper-eutrófico con alta productividad primaria y con bajos niveles de oxígeno (EPM 2009). La retención de esta carga orgánica dentro de éste embalse permite que el agua turbinada por la central hidroeléctrica Porce II tenga mejor calidad. El embalse Porce III recibe estas aguas, así como las que vienen de la central Guadalupe IV y ha sido definido como un sistema eutrófico (Silva 2008).
Petrere (1996) planteó que la construcción de embalses en cadena (ó cascada) en ríos altamente contaminados, aumenta la productividad biológica y mejora las condiciones del agua abajo de éstos embalses. Con base en esta hipótesis se plantearon dos preguntas de investigación sobre la respuesta de la ictiofauna a las condiciones de embalses en cascada en el río Porce: a) ¿cómo está estructurado el ensamblaje en dos embalses de cascada en el río Porce y b) ¿ésta estructura se mantiene en dirección cola-presa y en su interacción con el eje vertical dentro de cada embalse? Para responderlas, analizamos la composición de especies y la estructura del ensamblaje de peces en los embalses Porce II y Porce III, ubicados sobre el cauce principal del río Porce, durante diferentes periodos climáticos (lluvias, estiaje), entre los años 2011 y 2013.
Materiales y Métodos
Área de estudio
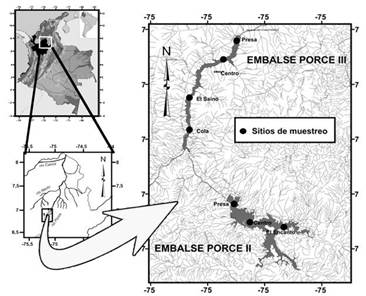
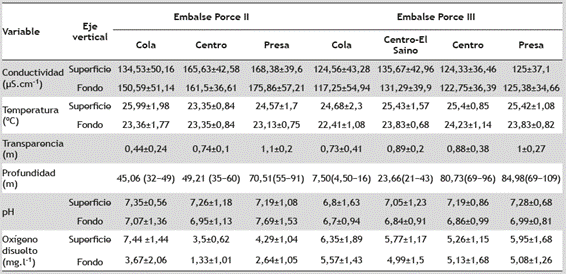
El río Porce, llamado río Medellín en los primeros 101 km, nace en el alto San Miguel a 2660 m s.n.m., al oeste de la cordillera Central de los Andes. En la cuenca se observa un régimen de distribución bi-modal de las lluvias (dos periodos de máximas lluvias: marzo a junio y septiembre a noviembre, y dos de reducción: diciembre a febrero y julio a agosto). La longitud del cauce del río es de 226 km y desemboca en el río Nechí (afluente del río Cauca), a los 100 m s.n.m. Su caudal medio anual es de 113,4 m3.seg-1. En el sector medio de la cuenca, el río Porce corre por un sistema de montaña de gran pendiente y por sus laderas fluyen pequeñas quebradas con caudales entre 0,01 y 3 m3.s-1. En el año 2000 fue construido, sobre el cauce principal del río, el embalse Porce II, a los 924 m s.n.m. En el año 2011 fue construido, aguas abajo del embalse Porce II, el embalse Porce III, a los 680 m s.n.m. Estos embalses están localizados aguas abajo de la ciudad de Medellín, capital del departamento de Antioquia, a 120 y 147 km respectivamente (Figura 1). El embalse Porce II se considera un embalse “hiper-eutrófico” (EPM 2009); mientras que el embalse Porce III se considera un embalse eutrófico (Silva 2008). El volumen de agua almacenado de Porce II depende de los aportes del río Porce y de la operación de la central hidroeléctrica, en tanto que el embalse Porce III depende de la interacción entre los aportes de la descarga de la central Porce II, de la central hidroeléctrica Guadalupe III y IV, del río Guadalupe, y de la operación de la central hidroeléctrica Porce III. En la Tabla 1 se presentan algunas características limnológicas de los diferentes sectores dentro de los dos embalses.
Diseño muestral
Entre los años 2011 y 2013, se realizaron ocho muestreos en periodos pluviométricos contrastantes (lluvias y estiajes). Para verificar la hipótesis asociada con el cambio que imprimen los dos embalses a las características del ensamblaje a lo largo del eje longitudinal, las muestras se tomaron en la zona litoral de los diferentes sectores dentro del embalse. Dentro de cada embalse, los sitios de muestreo se localizaron siguiendo el modelo general de Thornton (1990), donde se separan tres sectores principales sobre el eje longitudinal del embalse: desde la cola del embalse donde ingresa el río Porce (cola o zona ribereña), el centro del embalse (zona de transición) y en dirección hacia el muro de la presa (zona lacustre o lagunar) (Figura 2). Para incorporar el efecto de la profundidad en la estructura del ensamblaje de especies, en cada sector se tomaron muestras a 0.5 m y 3 m de la superficie (superficie) y de 4 m a 7 m de la superficie (fondo).
Las capturas se realizaron entre las 07:00 y 14:00 horas. Se utilizaron redes de espera (100 m longitud, 3 m de alto) con diferentes tamaños de malla (0,01 a 0,15m). Se conservó el esfuerzo de pesca (6 horas.300m-2.Red-1) entre los sitios de muestreo para permitir comparaciones. En cada sitio del embalse se emplearon tres redes, dos superficiales (a 0,5 m de la superficie) y una de fondo (a 4 m de la superficie).
En campo, los ejemplares fueron identificados y su información (especie, longitud estándar, peso) fue registrada bajo un código. Aquellos ejemplares de difícil identificación en campo fueron anestesiados por diez minutos por inmersión en solución de Eugenol (aceite de clavo, sedante usado en peces; Neiffer y Stamper, 2009), se fijaron en solución de formalina al 10% (Murphy et al. 1996) y se almacenaron en bolsas plásticas debidamente etiquetadas con la información de campo (sitio, hora y fecha de captura). A cada ejemplar se le determinó su especie con la ayuda de claves taxonómicas apropiadas a nivel de familia y género. La identidad taxonómica fue verificada en Eschmeyer y Fong (2017).
Tabla 1 Características limnológicas en el gradiente longitudinal del embalse de Porce II y Porce III. Las variables limnológicas se presentan como media ± desviación estándar; la profundidad como la media y el rango mínimo y máximo
Análisis de datos
Se definió el número de especies, así como la abundancia numérica de cada especie dentro de la muestra. Para definir la categoría de cada especie dentro del ensamblaje (dominante, ocasional, común, rara) se utilizó su frecuencia de ocurrencia en las muestras obtenidas, así como su abundancia numérica (Sokal y Rolfh 1995). Para construir las gráficas de dispersión en 2D se empleó el software SimagPlot 12.0.
Para estimar los valores de diversidad alfa (Fisher 1943) por sector y periodo pluviométrico y la dominancia (Whittaker 1972) se usaron las abundancias numéricas de las especies de peces. Para su cálculo se usó el software PAleontological STatistics (PAST) vers. 2.16 (Hammer et al. 2001). Dado que los datos no cumplieron con los supuestos de homogeneidad de varianzas ni normalidad, se usó una prueba de comparación de rangos (ANOVA no paramétrico, Kruskall-Wallis) para verificar si existían diferencias estadísticamente significativas en los valores de diversidad alfa, dominancia y número de especies entre los sectores de cada uno de los embalses (cola, transición, presa) y una prueba de contingencia (chi-cuadrado de Pearson) para determinar si había diferencias significativas en la interacción eje vertical (superficie y fondo) y hábitat de los embalses.
Resultados
Se capturaron 16207 individuos (89,95% en el embalse Porce II y 10,1% en el embalse Porce III) representantes de 15 especies (Tabla 2). En términos de la distribución porcentual de la abundancia numérica el orden Characiformes agrupó el 40%, el Perciformes 33,33%, Siluriformes 13,33% y Cyprinodontiformes 13,33%. En los embalses Porce II y Porce III las especies dominantes dentro del ensamblaje fueron Astyanax microlepis, Andinoacara latifrons, Roeboides dayi y Coptodon rendalli; Brycon henni solo fue dominante en Porce III mientras que Hoplosternum magdalenae lo fue en Porce II (Figura 3). Estas seis especies reunieron el 99,36% de la abundancia de los individuos capturados en los dos embalses (Tabla 2). Las familias con mayor número de especies fueron Cichlidae y Characidae (cinco y cuatro especies, respectivamente). Por su parte, las familias Anostomidae, Bryconidae y Callichthyidae estuvieron representadas solo por una especie.
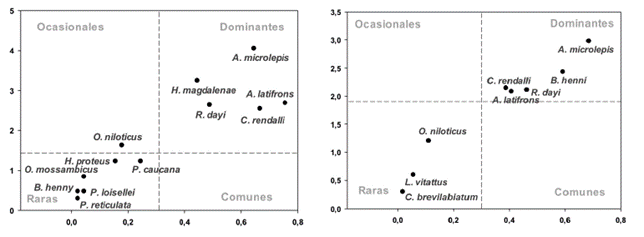
Figura 3 Ensamblaje de especies de peces en los sistemas de embalse de la cuenca media del río Porce. A. Embalse Porce II, B. Embalse Porce III. Eje vertical: Abundancia (Log); Eje Horizontal: Frecuencia de Ocurrencia Relativa. Parámetros en el eje Y: mediana de la abundancia. Parámetros en el eje X: media de la frecuencia.
Tabla 2 Distribución de la abundancia relativa por especie en los embalses Porce II y Porce III. *Especies no nativas
| Taxa | Abundancia relativa (%) | |
|---|---|---|
| Porce II | Porce III | |
| CHARACIFORMES | ||
| Anostomidae | ||
| Leporellus vittatus (Valenciennes1850) | 0,18 | |
| Characidae | ||
| Roeboides dayi (Steindachner1878) | 2,99 | 7,92 |
| Hyphessobrycon proteus Eigenmann1913 | 0,11 | |
| Astyanax microlepis Eigenmann1913 | 78,63 | 58,26 |
| Bryconidae | ||
| Brycon henni Eigenmann1913 | 0,01 | 16,64 |
| SILURIFORMES | ||
| Callichthyidae | ||
| Hoplosternum magdalenae Eigenmann1913 | 12,05 | |
| Loricariidae | ||
| Chaetostoma fischeri Steindachner1879 | 0,06 | |
| CYPRINODONTIFORMES | ||
| Poeciliidae | ||
| Poecilia caucana(Steindachner1880) | 0,11 | 0,06 |
| Poecilia reticulata Peters1859* | 0,01 | |
| PERCIFORMES | ||
| Cichlidae | ||
| Oreochromis mossambicus (Peters1852)* | 0,04 | |
| Oreochromis niloticus (Linnaeus1758)* | 0,29 | 0,92 |
| Coptodon rendalli (Boulenger1897)* | 2,41 | 8,53 |
| Andinoacara latifrons (Steindachner1878) | 3,34 | 7,43 |
| Parachromis loisellei (Bussing1989)* | 0,01 | |
El número, la composición y la dominancia de especies fue diferente entre los embalses y entre los diferentes sitios de los embalses. En el embalse Porce II se capturaron 12 especies de peces, mientras que en el embalse Porce III se capturaron 10. La mayor abundancia numérica se registró en el embalse Porce II en el sector próximo a la influencia del río Porce (cola); A. microlepis, H. magdalenae y R. dayi agruparon el 95% de la abundancia en este embalse, en tanto que en los sitios de transición (centro) y presa del embalse, C. rendalli y A. latifrons fueron las especies más importantes en número (Figura 4). Por su parte, en el embalse Porce III, A. microlepis fue la especie más abundante en todos los sectores del embalse, B. henni y R. dayi lo fueron en el sector de la cola, y C. rendalli y A. latifrons lo fueron en el sector de la presa. En todos los sectores de los embalses Porce II y Porce III se encontraron especies introducidas como C. rendalli, Oreochromis niloticus, Oreochromis mossambicus y Parachromis loisellei (Tabla 2).
En el embalse Porce II, la dominancia de especies fue alta en los sectores cercanos a la entrada del río Porce, donde A. microlepis y H. magdalenae dominaron la estructura del ensamblaje; mientras que en los sitios cercanos al muro del embalse (centro y presa) los valores de dominancia disminuyeron y el ensamblaje estuvo conformado por las especies H. magdalenae, A. latifrons y C. rendalli (Tabla 2, Figura 4). Desde el sector medio (centro) hasta el sector presa del embalse Porce III, la estructura estuvo dominada por las especies A. microlepis, B. henni y C. rendalli. Éstas especies y otras como R. dayi y A. latifrons conformaron el ensamblaje encontrado en el sector cola.
En la interacción sector-profundidad de los embalses Porce II y Porce III, no se observaron diferencias significativas (Porce II p = 0,19; Porce III p = 0,32). A pesar de este resultado es evidente la reducción en la abundancia, en la diversidad y en el número de especies en el eje longitudinal (cola, centro, presa) y vertical (superficie, fondo) dentro del embalse Porce II (Tabla 3). En el embalse Porce III, el sector cola (cerca al río) y presa presentó el mayor número de especies en la superficie y en los otros (saino y centro), en el fondo (Tabla 3, Figura 1). En el sector cola y saino, la dominancia fue mayor en el fondo (dominando A. microlepis, B. henni y R. dayi), en tanto que en el sector de la presa la dominancia fue mayor en la zona superficial (dominando C. rendalli, O. niloticus y B. henni). El mayor número de individuos se obtuvo en los sectores cola, saino y centro del embalse.
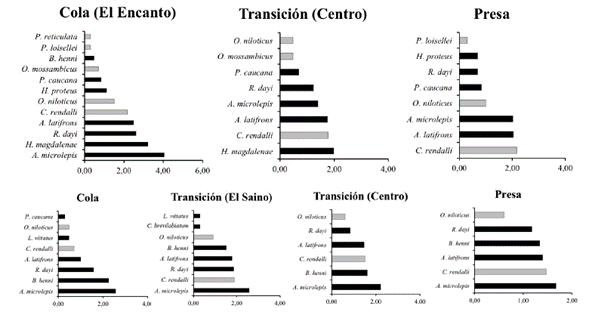
Figura 4 Distribución de la abundancia numérica relativa de las especies de peces dentro de los embalses del río Porce. A. Embalse Porce II, B. Embalse Porce III. Barras en color gris pertenecen a especies introducidas.
El número de especies presentó diferencias significativas entre los sectores solo dentro del embalse Porce II (H2, 24 = 6,15; p<0,05), y la abundancia numérica fue diferente entre los dos embalses y dentro de cada embalse (Porce II, H2, 24 = 8,65, p<0,05; Porce III, H3, 32 = 10,50, p<0,05) (Figura 5).
Aunque la diversidad alfa no presentó diferencias significativas (p<0,05) entre los sectores dentro de cada uno de los embalses (Tabla 3), si se observaron algunas tendencias durante los diferentes momentos de muestreo. En el embalse Porce III, la diversidad fue menor que en Porce II y no tuvo grandes variaciones entre sectores. Dentro del embalse Porce II, la mayor desviación en los valores de la diversidad fue en sector de la cola (ingreso del río Porce), mientras que en Porce III la mayor diversidad se encontró en el centro del embalse y las mayores desviaciones en el sector presa.
Tabla 3 Valores medios y rangos de algunos descriptores del ensamblaje de especies de peces en los embalses del río Porce. Media (Diversidad Alfa, y Dominancia), mediana (número de especies). Diferencias significativas (p<0,05) entre: *los hábitats, § Entre periodos pluviométricos
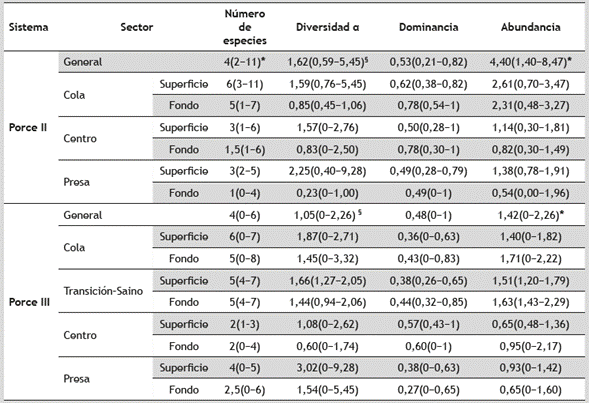
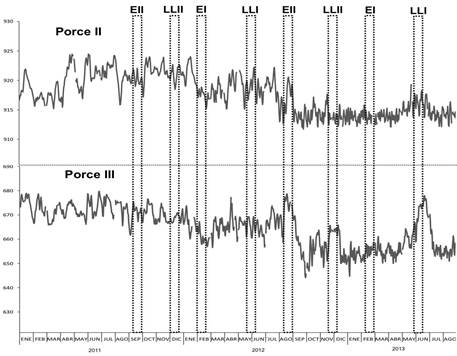
La abundancia numérica fue mayor en el embalse Porce II que en Porce III y no se observaron diferencias entre los periodos de lluvias (Figura 6), así como en el número de especies y la dominancia (p<0,05) (Tabla 3). En la dimensión temporal la diversidad alfa presentó diferencias significativas. En el embalse Porce III, los mayores valores se registraron en las temporadas de lluvias (H 7, 32 = 13,96, p<0,05); mientras que en el embalse Porce II solo se presentaron en el periodo de lluvias de 2012 y 2013 (H7, 24 = 16,73, p<0,05) (Figura 6).
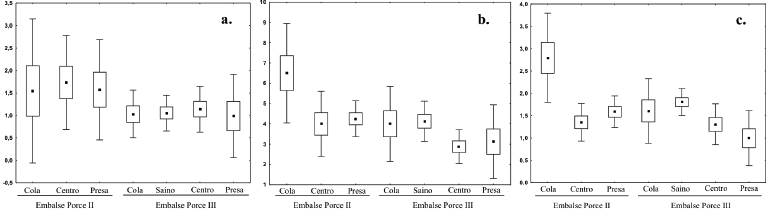
Figura 5 Características emergentes de los ensamblajes de peces a lo largo del eje longitudinal de los embalses de Porce II y Porce III del río Porce. A. Diversidad Alfa. B. Número de especies. C. Abundancia relativa (Log10). Punto: media, Caja: error estándar, barras: desviación estándar.
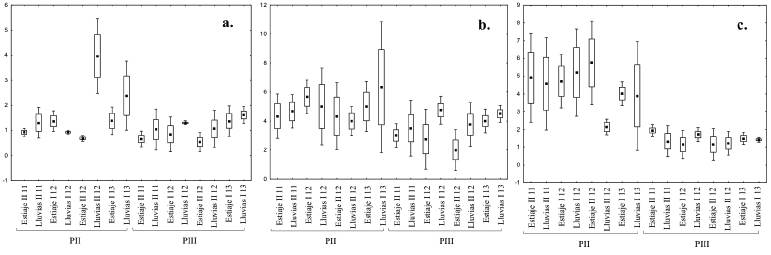
Figura 6 Características emergentes de los ensamblajes de peces en la escala temporal entre los años 2011 y 2013. A. Diversidad alfa. B. Número de especies. C. Abundancia relativa (log10). Punto: media, Caja: error estándar, Barras: Desviación estándar. I: primer semestre del año, II: segundo semestre del año; años: 2011 (11), 2012(12) ,2013(13). PII: embalse Porce II y PIII: embalse Porce III
Discusión
El ensamblaje de especies en el sector del cauce del río Porce que fue embalsado, es pobre en especies. Jiménez-Segura et al. (2013) estimaron que dentro de este rango altitudinal (680 - 924 m s.n.m.) se espera encontrar aproximadamente 81 especies en sistemas de ríos naturales, y entre 2 y 31 especies en embalses de la cuenca Magdalena-Cauca y la vertiente del Pacífico (Jiménez-Segura et al. 2011a). Agostinho (1999) afirma que la comunidad de peces en los embalses resulta de la re-estructuración de la comunidad de peces original del río, y la composición que se observa también dependerá del tiempo de formación del embalse, así como de sus características (forma, profundidad, tiempo de retención, área de espejo de agua).
Dentro de la nueva estructura del ensamblaje, especies como A. microlepis, H. magdalenae, R. dayi y C. rendalli fueron dominantes en el ensamblaje de los embalses Porce II y Porce III. Estas especies son comunes (poco abundantes, muy frecuentes) en lagos del plano inundable del río Magdalena (Granado-Lorencio et al. 2012) y raras o ausentes en sistemas ribereños (Jiménez-Segura et al. 2014). Aunque no se cuenta con información completa sobre las estrategias de vida de estas especies en nuestro país, Gomes y Miranda (2001) afirman que algunas estrategias de vida permiten que ciertas especies nativas sean exitosas en sistemas de flujo de agua lento: a) tamaños de camada y cuidado parental, b) uso de un reducido número de compartimentos dentro de la red trófica (v. g., herbívoros, planctófagos, detritívoros) y ciclos de vida rápidos. Entonces, si estas especies se encontraban dentro del ensamblaje ribereño original, es posible que la alta fecundidad sin cuidado parental, como en el caso de A. microlepis y R. dayi (Loaiza y Jiménez-Segura 2013) o la baja fecundidad con cuidado parental, en el caso de H. magdalenae y C. rendalli (Londoño y Jiménez-Segura 2013), así como su dieta (v. g., herbivoría, omnivoría) (Universidad de Antioquia y EPM 2013), sea la causa de su éxito en los embalses Porce II y Porce III.
El embalse Porce II presentó un mayor número de especies y mayores abundancias comparado con Porce III; el ensamblaje se caracterizó por la ausencia de especies típicas de este sector del río Porce como B. henni, C. brevilabiatum y L. vittatus y la presencia de especies introducidas como C. rendalli, P. loisellei y O. niloticus, en tanto que en el embalse Porce III aún persisten estas especies y las especies introducidas son menos abundantes. Esta estructura de la ictiofauna en los dos embalses es resultado de las características propias a cada embalse y que son determinantes en la persistencia de las poblaciones de estas especies dentro de estos cuerpos de agua. El embalse Porce II tiene 12 años de formado, recibe la descarga de materia orgánica de Medellín (Antioquia), su forma dendrítica con numerosas bahías internas puede favorecer la oferta de hábitats, la temporalidad de ingreso de agua depende de la estacionalidad climática de la cuenca aportante, es un sistema más estable que el embalse Porce III pues su tiempo de retención hidráulico es de 43 días y tienen un área de espejo de agua mucho mayor (13,78 km2, cota mínima de inundación). En tanto que el embalse Porce III es un sistema joven con apenas cuatro años de formación, poco complejo en su estructura (forma alargada, menor desarrollo de borde, menor área de inundación, 4,61 km2), con fuertes oscilaciones en el volumen de agua, pues su condición geomorfológica le permite ser menos estable, sus entradas dependen de la operación de las centrales Guadalupe III y IV y Porce II y su tiempo de retención es de ocho días. La persistencia de las poblaciones nativas en el embalse Porce III en los próximos años dependerá de las condiciones que le sean favorables a su reclutamiento. La respuesta de estas especies a esta nueva dinámica hidrológica dentro de éste sector en el río Porce debe ser objeto de estudio en un futuro cercano.
Son diversos los autores que han encontrado resultados similares en otras regiones de Suramérica. Araujo-Lima et al. (1995) , encontraron que el área del embalse influye en la cantidad de especies; Agostinho (1999, 2007) y Petrere (1996) mencionaron que la riqueza decrece con la edad del embalse, y Gutiérrez-Bonilla y Álvarez-León (2011), Jiménez-Segura et al. (2011a) y Larrahondo (1993), indicaron que los embalses son sistemas acuáticos que favorecen el crecimiento de las poblaciones de especies exóticas, las cuales se convierten en el sustento de la actividad pesquera artesanal. Sin embargo, al considerar embalses en cascada, estas tendencias identificadas no necesariamente mantienen estos patrones. Aunque el tiempo de retención del agua pueden influir en la producción de plancton y carga de nutrientes en los embalses, la proximidad geográfica entre dos presas también es influyente (Barbosa et al. 1999), y en última instancia, puede reducir la abundancia numérica de peces dentro del sistema (Draštíket et al. 2008, Jackson y Marmulla 2001). No obstante, con la edad del embalse la riqueza disminuye (Agostinho et al. 2007) y el rendimiento pesquero tiende a incrementar (Jiménez-Segura et al. 2011a). Así que, es probable que el bajo número de ejemplares capturados en el embalse Porce III corresponda al tiempo de vida de este y a la interacción entre los embalses en cascadas. Esto ya había sido analizado en Petrere (1996) quien afirmó que, en cuencas con problemas de contaminación, la calidad del agua en aquellos embalses localizados aguas abajo de otros embalses tendrá mejores condiciones para la ictiofauna dado que los embalses aguas arriba actuarán como sistemas filtro. El embalse de Porce II, podría actuar como filtro de nutrientes y sedimentos y así cambiarían las condiciones físico-químicas del agua que entra al embalse Porce III (v. g., menor carga de sedimentos y de nutrientes). Estas condiciones podrían ser favorables a la ictiofauna; sin embargo, el embalse Porce III presenta menor número de especies, así como menor abundancia de individuos. Entonces, se debe considerar que si bien, la calidad del agua puede ser diferente a la del embalse Porce II, las condiciones propias al embalse como son su edad, su estructura física similar a la de un río y las grandes oscilaciones en el volumen almacenado debido a la operación de la central y al ingreso del caudal turbinado por las centrales hidroeléctricas presentes aguas arriba (Porce II, Guadalupe III y IV), puedan ser parte de la razón por la que la ictiofauna del embalse Porce III si es comparada con la de Porce II es poco diversa y poco abundante.
La composición y abundancia numérica de la ictiofauna cambió a lo largo del eje longitudinal (cola-presa) de los embalses. De acuerdo con Margalef (1983), los embalses son sistemas híbridos entre un río y un lago, los cuales están biológica, física y químicamente estructurados desde la cola hasta la presa. Los cambios involucran estratificación en la columna del agua y velocidad en el flujo del agua, esto asociado a la forma del hábitat y al aporte de sedimentos al sistema. Agostinho et al. (2007) indican que las especies nativas del ensamblaje original tienen mayor oportunidad de persistir en aquellos sectores del embalse cercanos a la influencia del río; estas especies en su mayoría son de pequeño a mediano porte, omnívoras y menos exigentes a las condiciones físicas y químicas del embalse para su reproducción y reclutamiento. En los embalses analizados especies como A. microlepis, H. magdalenae y R. dayi fueron más abundantes en la cola del embalse Porce II mientras que en la presa son más abundantes especies de Ciclidos (C. rendalli, A. latifrons), en tanto que en la cola de Porce III lo fue A. microlepis, R. dayi y B. henni, y en la presa fue A. microlepis y A. latifrons.
La presencia e importancia de B. henni en el embalse Porce III sugiere que la especie puede estar aprovechando los recursos que circulan en el nuevo sistema acuático. La formación del embalse Porce III permite ahora a los individuos de la especie salir de sus tributarios y utilizar el embalse como ruta de movimiento. Su capacidad de remontar cuencas de alta pendiente y hacer movimientos cortos entre cuencas (Builes y Lara 1980, Builes y Uran 1974) le ha permitido a la especie ocupar los cuerpos de agua del embalse Porce III. Es posible que a medida que el tiempo pase, la abundancia numérica de la especie se reduzca restringiéndose nuevamente a las quebradas. Aunque esta es una hipótesis que debe verificarse a futuro.
La carga de nutrientes y sedimentos que ingresa a los embalses, así como la temperatura del agua son factores que pueden influir en la estructura del ensamblaje en el eje longitudinal (dirección cola-presa) y vertical (superficie-fondo). En el embalse Porce II se detectó estratificación vertical (independientemente del sector) en las características del ensamblaje de especies. De acuerdo con Umaña (2006), la estratificación (epipelágica y batipelágica) de la columna del agua, depende del arrastre que ejerce la entrada del río, la salida de agua y la forma misma del embalse de manera que la estratificación ocurre en los sitios más profundos, cercanos a la presa. Es posible que la diferencia en la carga de sedimentos que reciben los embalses Porce II (río Porce) y Porce III (descarga del Porce II y río Guadalupe), así como la variabilidad en el nivel del agua (debido a los tiempos de retención), son variables que influyen en la estructura de la ictiofauna tanto en el eje longitudinal (cola-presa) como en el vertical (superficie y fondo). El embalse Porce II actúa como trampa de sedimentos, así que la transparencia del agua será mayor en el embalse Porce III. La alta carga de sedimentos que le aporta el río Porce al embalse Porce II genera condiciones bajas en oxígeno en el fondo de este cuerpo de agua, influyendo en que el ensamblaje de especies en la región epipelágica sea más rico en especies y diverso, independientemente del sector del embalse. En tanto que, en el embalse Porce III, la alta variabilidad en el nivel del agua, puede ser un factor causante de la baja abundancia de individuos, especialmente para aquellas especies que anidan y se refugian en la ribera del embalse (v. g., O. niloticus y C. rendalli), los cambios abruptos en el nivel del agua, deja en evidencia sus áreas de anidamiento, impidiendo el éxito desarrollo de sus progenies.
Brycon henni se encontró entre los diferentes hábitats del embalse Porce III, presentando mayor preferencia por las áreas próximas a la influencia del río. Varios autores (Magallanes y Tabares 1999, Montoya-López et al. 2006, Trahl 1973) mencionan que esta especie puede habitar tanto en sistemas lóticos como lénticos; de hecho, forma parte del ensamblaje de especies en ambientes cenagosos del río Magdalena (Jiménez-Segura et al. 2011b). Su hábito trófico omnívoro puede ser parte de la razón que le permite ocupar diferentes ambientes independientemente de la calidad en la oferta de alimento. Agostinho et al. (1999) afirma que las especies con hábitos tróficos generalistas son las más exitosas en los embalses puesto que pueden explorar los diferentes recursos que se ofrecen.
La diversidad en los dos embalses estuvo influenciada por las temporadas de lluvias. No obstante, esto podría estar más asociado con los bajos niveles del agua encontrados en los embalses que por la temporalidad climática (Figura 2), pues la mayor abundancia de individuos y el número de especies se registraron en estos periodos (Figura 6 B y 6 C). Esta misma tendencia se observó en los embalses de Betania y Urra I, donde las mayores capturas se registraron durante los menores niveles del agua (Jiménez-Segura et al. 2011a). De acuerdo con Agostinho (2007) y Pompeu y Godinho (2006), en aquellos embalses construidos en cascada, la temporalidad climática no influye en la estructuración del ensamblaje de especies de peces dentro del embalse, así como sucede en un ambiente ribereño natural. La pérdida de conectividad con sistemas acuáticos localizados aguas abajo, elimina la posibilidad de ingreso de nuevas especies al ensamblaje de especies dentro del embalse (Ward y Stanford 1995). A pesar que el nivel de los dos embalses no está definido por la temporalidad climática local, es posible que, durante las lluvias torrenciales, los peces sin estructuras corporales que les permitan fijarse al sustrato presente en las quebradas tributarias a los dos embalses sean arrastrados hacía el cuerpo principal del embalse. En general, las condiciones en los embalses Porce II y Porce III son favorables a las poblaciones de las especies que como A. microlepis, R. dayi y H. magdalenae, se reproducen independientemente de la estacionalidad climática (Loaiza 2013, Londoño 2013) y dominan en el ensamblaje de especies. La hipótesis que las lluvias torrenciales pueden generar movimientos locales entre las quebradas y los embalses debe ser validada en futuros estudios.
En conclusión, la formación de embalses en cascada genera cambios en la composición, riqueza y abundancia numérica de la fauna íctica; condiciones a las que se ajusta el ensamblaje de especies de peces conformando así ensamblajes propios a cada hábitat del sistema. No necesariamente los embalses ubicados aguas abajo dentro de cadenas de embalses a lo largo del cauce ofrecen mejores condiciones para la biota acuática tal y como se plantea en Petrere (1996). La profundidad y la morfología del embalse en interacción con temporalidad climática pueden ser definitivas en la estructuración del ensamblaje dentro de estos cuerpos de agua. La respuesta de la ictiofauna en la construcción progresiva de embalses en cascada no solo dependerá de la conformación propia de la cuenca aportante, sino de las características y dinámicas del embalse, así como de las condiciones físicas y químicas de los cuerpos de agua.