Introducción
La sucesión ecológica es el proceso temporal de colonización y sustitución de las especies, de patrón continuo y levemente direccional, que resulta de la modificación del ambiente físico por la comunidad y por las interacciones dentro de la población (Begon et al. 2007), siendo un proceso de recambio y mudanza en el desempeño de las especies (Pickett et al. 1987). El proceso de sucesión del perifiton depende de varios factores, principalmente la disponibilidad de nutrientes (Hillebrand y Sommer 2000, Jeppesen et al. 2000, Rier y Stevenson 2006) y de luz (Sekar et al. 2004), así como la temperatura y la concentración de carbono orgánico total (Barragán 2010). Los organismos fotosintéticos, que habitualmente son los primeros colonizadores, generalmente son reemplazados, en el tiempo, por organismos heterotróficos de primer orden, los cuales gradualmente desplazan a las especies pioneras (Guevara et al. 2007). A medida que los componentes fotosintéticos del sistema cambian, la vida animal que los acompaña también lo hace.
El primer evento de la colonización del sustrato es el desarrollo de una cobertura orgánica, generalmente de mucopolisacáridos; este es considerado el evento químico que modifica la carga superficial del sustrato artificial que llega a ser negativa, influenciando la colonización de bacterias, pre-requisito para su unión (Sierra y Ramírez 2000). Un segundo evento de sucesión es desarrollado por la colonización de las algas perifíticas, las cuales, luego del desarrollo de la flora bacteriana sobre el sustrato, inician la colonización con diatomeas pequeñas y postradas que dan paso a las diatomeas coloniales adheridas apicalmente y posteriormente con la colonización de algas verdes (Biggs 1996). Sin embargo, para ambientes tropicales, los estudios describen a Zygnemaphyceae (Felisberto 2007) y Chlorophyceae (Ferragut y Bicudo 2009, Sekar et al. 2004, Vercellino y Bicudo 2006) como los colonizadores iniciales. Finalmente, el último evento de sucesión es dado con la colonización de la fracción heterotrófica sobre el sustrato, protistas como ciliados y flagelados heterotróficos que se alimentan de las bacterias y algas presentes en el biofilm (Azam et al. 1983).
Rodrigues y Bicudo (2004), con base en estudios realizados en la planicie de inundación del rio Paraná, señalan que el pulso de inundación es el mayor factor que influencia el proceso sucesional del ficoperifiton. Siquera (2008) evidencia que los procesos autogénicos, tales como la presión por herbivoría, direccionan la sucesión sobre sustratos artificiales y Varcellino y Bicudo (2006) la disponibilidad de nutrientes. Este trabajo establece el proceso de sucesión de la comunidad perifítica, identificando la participación de las fracciones bacterianas, algales y de protozoos presentes a escala espacial y temporal sobre sustratos artificiales en el sistema de lagos de Yahuarcaca, Amazonia Colombiana.
Materiales y métodos
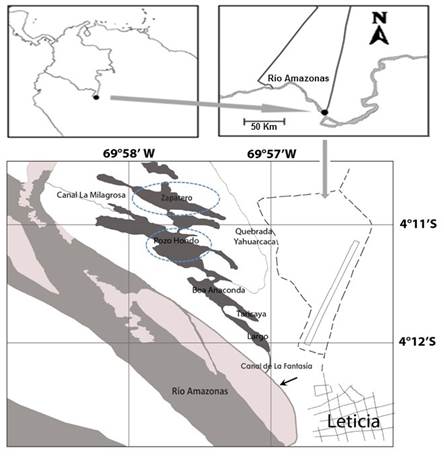
El sistema de lagos de Yahuarcaca se ubica a 2 km al oeste de la ciudad de Leticia (Amazonas, Colombia; 4°11’16’’ S y 69°58’16’ W), a una altitud de 82 m s. n. m., corresponde al tipo de paisaje N1 (llanura aluvial de río andino de aguas con abundante material en suspensión; Otero y Botero 1997) y se encuentra constituido por 17 subsistemas interconectados por canales naturales (Figura 1).
El volumen del sistema de lagos encuentra su punto máximo en el mes de mayo (período de aguas altas) y su mínimo en el mes de agosto (período de aguas bajas). De acuerdo con la clasificación de Lewis (1983) el patrón de estratificación de este sistema es térmica polimíctica continuo cálido, aunque la información existente muestra que usualmente esta estratificación solo dura unas pocas horas en la tarde.
En los períodos de aguas bajas y aguas altas, en las zonas de macrófitos y limnética de los lagos Zapatero y Pozo Hondo del sistema de lagos, fueron instalados soportes de ganchos o colgadores a nivel sub-superficial en los que se ubicaron los sustratos artificiales (láminas de acetato para impresión de 11,5 x 14,5 cm) para la obtención de muestras de la comunidad perifítica. Cada 12 h y durante tres días consecutivos estos sustratos fueron recolectados directamente en una bolsa Ziploc® que fue abierta justo debajo de la lámina, a fin de recolectar el material adherido en totalidad y aquel que estaba ligado al sustrato. Los sustratos recolectados (tres láminas de acetato cada 12 h por ambiente y sistema) se guardaron en nevera con hielo y trasladaron al laboratorio para su limpieza. En el período de aguas bajas, para el lago Pozo Hondo no había macrófitos, razón por la cual no se registraron valores para esta zona.
Paralelamente, en campo se midieron las condiciones físicas y químicas del agua de cada uno de los ambientes muestreados a nivel sub-superficial en cada período de muestreo: profundidad (equipo ecosonda HUMMINBEIRD WIDE), transparencia (disco Secchi), temperatura, OD y % saturación OD, pH, conductividad y TDS (sólidos totales disueltos) con equipos digitales de campo modelos WTW 3210.
Para el análisis microscópico, cada lámina fue lavada con agua destilada directamente en la bolsa Ziploc® que la contenía disminuyendo de esta forma la pérdida del perifiton. Posteriormente, cada muestra se dividió en dos partes: una conservada con Transeau en proporción 1:1 (para identificación y fotografía) y otra con Lugol-acético al 1% (para conteo de organismos). En total se recolectaron 144 muestras.
Para el análisis de la fracción bacteriana el equipo de laboratorio de vidrio usado fue lavado previamente con sulfocrónica y enjuagado con agua libre de bacterias (prefiltrada con filtros de 0,2 µm de poro) con formol al 2% de concentración final (Di Siervi 2002). La tinción de las muestras se realizó con 0,1 mg/l de DAPI (4,6-diamidino-2 denilindol) adicionado y conservado en oscuridad durante 30 minutos (Di Siervi 2002). Para la filtración de las muestras de agua fueron utilizados filtros Nucleopore, siguiendo la metodología presentada por Hobbie et al. (1977). Los filtros coloreados fueron refrigerados y guardados dentro del colorante hasta el momento de uso, en donde fueron enjuagados con agua destilada filtrada por 0,2 µm y usados aún húmedos. Los filtros se analizaron con un microscopio de epifluorescencia con cámara fotográfica, con el que se tomaron 20 fotomicrografías de cada preparado para su posterior conteo manual con la ayuda del programa Image Pro Plus 4.5. Por campo o foto de captura se contaron en promedio 30 a 40 bacterias, con un total mínimo de 300 para que la muestra fuera representativa. Los resultados se expresaron en número de individuos por mililitro.
Los componentes algal y de protozoos se analizaron por microscopia ocular empleando un equipo invertido Olympus CX 31. El conteo se realizó mediante la técnica Uthermöhl (1958) hasta obtener una estabilización en la curva. Para el cálculo de la superficie de colonización se empleó la fórmula propuesta por Ross (1979), adaptada según el área del sustrato. Los valores tanto para la fracción algal como de protozoos se expresaron en Ind.cm-2.
Para el tratamiento estadístico de los datos físicos y químicos se utilizó la estadística descriptiva en los períodos de muestreo (aguas altas y bajas), sometiéndolos a un análisis exploratorio que incluyó la media, mínimo, máximo y desviación estándar. De igual forma se realizó un Análisis de Componentes Principales (ACP) para analizar la existencia de diferencias entre los ambientes y sistemas muestreados por medio del programa SPSS 6.0 y de esta manera observar el comportamiento de las variables físicas y químicas (Guisande et al. 2006). También se realizaron pruebas para comprobar los supuestos de distribución normal y homogeneidad de varianzas de los datos a partir del test de Shapiro-Wilk con el programa STATISTIC 7.0 y el test de ANOVA para establecer diferencias significativas entre los sistemas.
Para el análisis del proceso de sucesión de la comunidad perifítica, se realizaron curvas de acumulación para la fracción algal, lo cual permitió establecer la observación de 10 alícuotas máximo para observación por microscopía óptica convencional y un volumen de sedimentación de 10 ml necesario para obtener datos representativos para el análisis del proceso de sucesión. Los datos de las tres fracciones analizadas se estandarizaron para realizar los análisis comparativos durante el proceso de sucesión.
Para el análisis inferencial se aplicó un análisis de varianza (ANOVA de 1 y 2 factores) para la comparación de las variables ambientales a escala temporal (período limnológico y horas) y espacial (lago y zona). Las pruebas de similitud entre los puntos de muestreo se realizaron a través del análisis de Jaccard, análisis realizado usando los programas STATISTICA 7.0 y SPSS 6.0.5. Los efectos de las variables ambientales sobre las abundancias de las fracciones y de la comunidad en general, se analizaron con el método de ordenación de Análisis de Correspondencia Canónica Distendido (ACCD) usando el programa CANOCO (Braak y Smilaurer 1998). La disminución de las especies raras para al análisis se logró eliminando aquellas que tuvieron menos del 3% del total de las abundancias de la muestra. Finalmente, la significancia estadística de los dos primeros ejes se estimó por el test de Monte Carlo.
Resultados
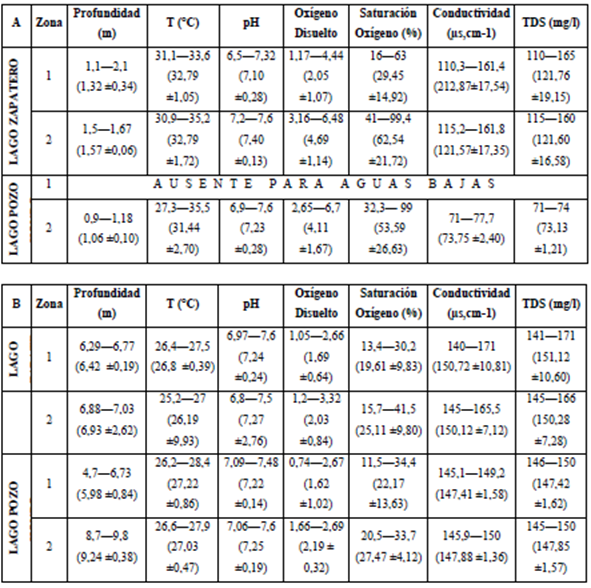
Las variables limnológicas se registran en la Tabla 1. Por cada período limnológico se comprobó que las condiciones son significativamente diferentes, con excepción del pH (p=0,8217) y por lago solo significativamente diferentes para las variables de conductividad y sólidos totales disueltos. Por zona de muestreo fueron significativamente diferentes las variables del oxígeno disuelto y el porcentaje de saturación; la conductividad y los sólidos totales disueltos no presentaron diferencias significativas por hora muestreada.
Tabla 1 Amplitud de valor, valor medio y desviación estándar de las variables físicas y químicas, A: Período de aguas bajas, B: Período de aguas altas, La zona 1 corresponde a macrófitos y la zona 2 a limnética
El ACP de las características físicas y químicas del sistema de lagos resumen el 82,72% de la variabilidad conjunta (Figura 2a). El primer componente está asociado con la profundidad y los TDS y el segundo tiene asociación principalmente con el OD. A nivel espacial (lago y zona de muestreo) y temporal (período limnológico y tiempo de sucesión) solo el período limnológico presentó una clara separación de las variables ambientales (Figura 2b).
Fracción bacteriana
Según el análisis de variaciones, las abundancias del componente bacteriano evidenciaron diferencias significativas a escala temporal, tanto para el tiempo de colonización (p=0,047) como para el período limnológico (p=0,008) siendo así el factor más importante para explicar la distribución de la densidad bacteriana en los sistemas estudiados.
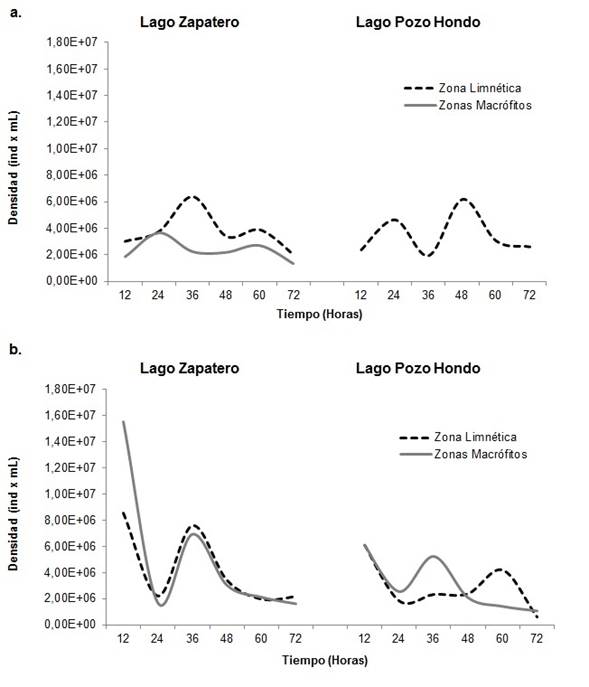
El comportamiento de la abundancia bacteriana, para el período de aguas bajas, fue de aumento de la proporción de individuos a través del tiempo de colonización, presentando las mayores densidades hacia la mitad de tiempo de muestreo entre las 36 y 48 h, con disminución del número de individuos al final del estudio (Figura 3). Para el período de aguas altas el comportamiento fue inverso ya que la mayor densidad se registró en las horas iniciales con descenso hacia el final del tiempo de colonización.
Por lago, la fracción bacteriana tuvo mayores valores de abundancia para el sistema de Zapatero, con un pico máximo en las horas iniciales del período de aguas altas (8,54E+06 y 1,55E+07 Ind.ml-1), aunque en general, los lagos presentaron un comportamiento constante y sin variaciones significativas. La mayor abundancia por zona para el período de aguas bajas la presentó la zona limnética para ambos sistemas, mientras que para el período de aguas altas fue en la zona de macrófitos.
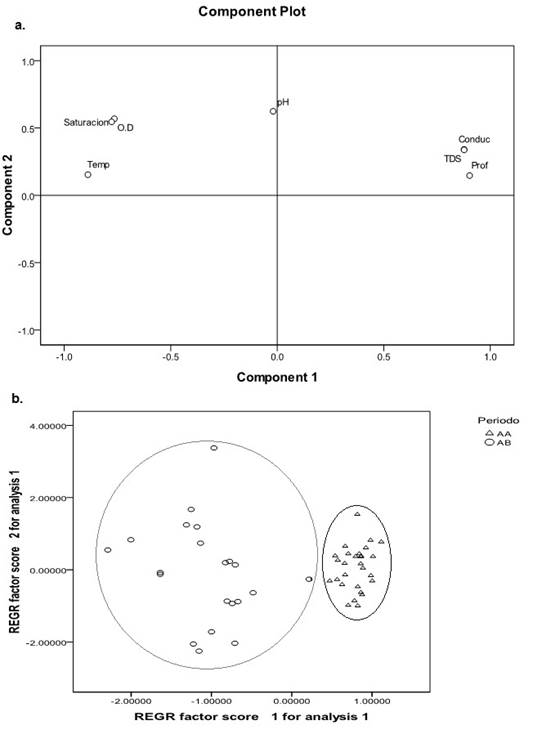
Figura 2 Análisis de Componentes Principales para el sistema de lagos de Yahuarcaca. A. Diferenciación por componente; B. Análisis por período limnológico. AA=aguas altas, AB=aguas bajas.
Fracción algal (se incluyen las Cyanobacterias)
Las curvas de acumulación para cada zona de muestreo presentaron una forma asintótica hacia el final del tiempo de colonización, indicando que el muestreo fue representativo y logró evidenciar el proceso de sucesión de la comunidad para la fracción algal.
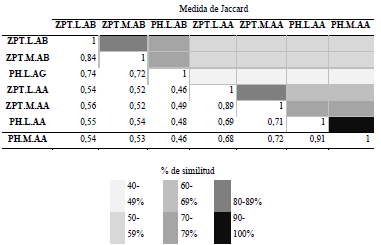
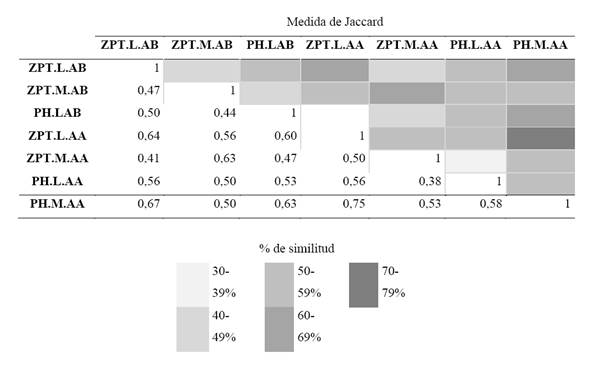
A nivel temporal, la aplicación del ANOVA demostró diferencias significativas para la abundancia de la fracción algal solo por período limnológico (p=0,003), en contraste con la variable zona que fue el único factor no significativo, como lo demuestra el valor de eta cuadrado parcial (n.2p= 0,0) al momento de explicar la distribución de la densidad algal. A nivel espacial para las zonas de muestreo, por medio del análisis de Jaccard, se encontró que el mayor porcentaje de similitud lo presentaron las zonas limnética y macrófitos del lago Pozo Hondo, seguido por las mismas zonas para el lago Zapatero, ambos para el período de aguas altas (Tabla 2).
Tabla 2 Matriz de similitud de Jaccard de los sitios muestreados (Zpt: lago Zapatero, PH: lago Pozo Hondo, M: macrófitos, L: Limnética, AB: aguas bajas y AA: aguas altas)
En el período de estudio fueron identificados 194 taxones, distribuidos en 11 clases taxonómicas algales. Durante el período de aguas bajas la clase Bacillariophyceae fue dominante con valores de 48% para la zona limnética del Lago Zapatero (ZPT-L), 37,2% para la zona de macrófitos (ZPT-M) y 51,7% para la zona limnética del Lago Pozo Hondo (PH-L). Las clases Euglenophyceae y Coscinodiscophyceae también fueron dominantes con más de 5% de densidad total. En el período de aguas altas, nuevamente la clase Bacillariophyceae fue la dominante con valores de 58,2% en ZPT-L, 50,2% en ZPT-M, 60,2% en PH-L y 58,4% en la zona de macrófitos del lago Pozo Hondo (PH-M). También fue dominante la clase Cyanophyceae para este período limnológico (Figura 4).
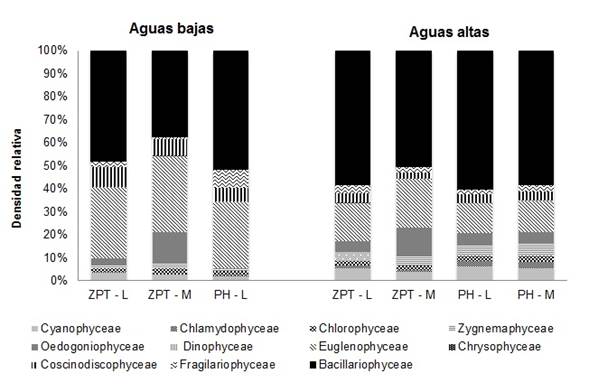
Figura 4 Abundancia relativa (%) de las clases algales durante el proceso de sucesión en los lagos Zapatero (ZPT) y Pozo Hondo (PH), en la zona limnética (L) y de macrófitos (M) por período limnológico.
Para la dinámica de sucesión algal, el desarrollo de la fracción presentó una tendencia de incremento a lo largo del período de colonización durante los dos períodos hidrológicos para cada zona de muestreo. Las mayores densidades se presentaron entre las 36 y 60 h de colonización, con valores de 2924 y 11535 ind.cm-2 para la zona de macrófitos y entre 2524 y 5814 ind.cm-2 para la zona limnética. El período limnológico de aguas bajas presentó la mayor densidad para el estudio en ambas zonas de muestreo (Figura 5). A nivel taxonómico para el período de aguas bajas en el lago Zapatero las especies Eunotia pectinalis, Eunotia sp.1, Trachelomonas volvocinopsis y Oedogonium sp.1 fueron las que presentaron mayor participación en la estructura de la comunidad. Para el Lago Pozo Hondo nuevamente las especies Trachelomonas volvocinopsis y Eunotia sp.1 junto con Pinnularia aff. caudata y Pinnularia divergens son las que presentaron la mayor densidad.
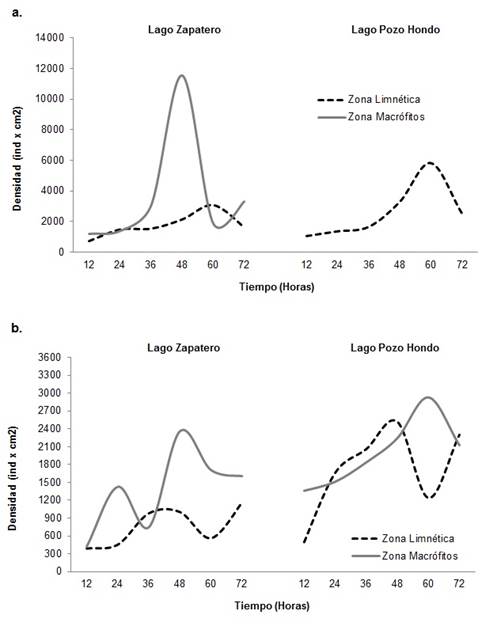
Figura 5 Densidad de la fracción algal de la comunidad perifítica durante el curso del proceso de sucesión por período y zona de muestreo. A. Aguas bajas; B. Aguas altas.
Para el período de aguas altas en el lago Zapatero las mayores densidades durante el proceso de sucesión estuvieron representadas por las especies Trachelomonas volvocinopsis, Encyonema aff. vulgare, Encyonema sp.1 y Oedogonium sp.2. El lago Pozo Hondo para este período limnológico compartió las mismas especies abundantes con el lago Zapatero junto con la dominancia de Gomphonema aff. augur y Pinnularia sp.3.
Durante el período de aguas bajas en la zona de macrófitos del lago Zapatero, las algas dominantes fueron las diatomeas con ocho especies de Pinnularia seguidas por cuatro de Gomphonema y tres de Fragillaria, Eunotia y Navicula, todas de forma de vida propiamente epífita; para la zona limnética, las Trachelomonas son las dominantes con nueve especies, todas de forma de vida ticoepífita y Pinnularia con ocho de forma de vida propiamente epífita. Para el caso del lago Pozo Hondo, el género con mayor diversidad fue Pinnularia con diez especies de forma de vida epífita seguido por Trachelomonas y Lepocinclis con seis y cuatro especies respectivamente y de forma de vida accidental o ticoepífita.
El mayor número de especies en general para el período limnológico de aguas bajas, estuvo registrado para el lago Zapatero en la zona de macrófitos, seguido por la zona limnética del lago Pozo Hondo. La división Bacillariophyta (clases Coscinodiscophyceae, Fragilariophyceae y Bacillariophyceae) presentó el mayor número de taxones con 80 para el lago Zapatero en la zona de macrófitos, 54 en la zona limnética y 36 para el lago Pozo Hondo en la zona limnética.
Para el período de aguas altas, el género Pinnularia fue el más dominante para las dos zonas de muestreo de los lagos estudiados con valores entre trece y catorce especies, todas de forma de vida propiamente epífita. Trachelomonas y Gomphonema fueron los segundos géneros dominantes con ocho a doce especies y finalmente los géneros Eunotia, Closterium y Cosmarium con valores entre siete a nueve especies (Anexo 1).
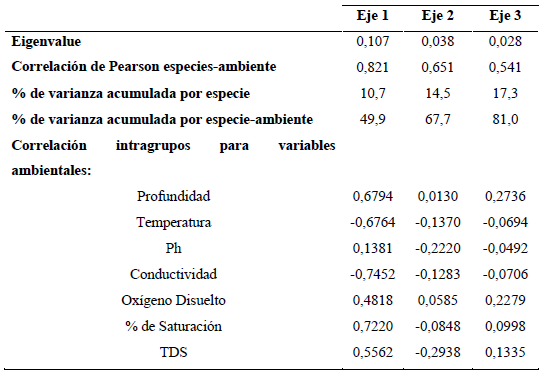
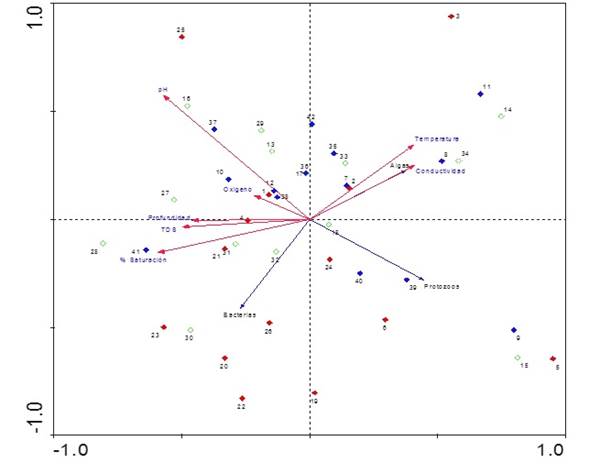
Finalmente, los resultados del Análisis de Correspondencia Canónica Distendido (DCCA) evidencian que los ejes 1, 2 y 3 evaluados con el test de Monte Carlo con 499 permutaciones fueron significativos (p=0,002) para el análisis. Puesto que la longitud del gradiente arrojó un valor <2,7 se realizó un Análisis de Redundancia (RDA; Tabla 3). Según el RDA, la varianza total explicada por la frecuencia especie-ambiente en los tres ejes fue de 81%. En el primer eje se encontró una fuerte correlación con el oxígeno, la profundidad y una relación inversa con la temperatura y la conductividad; mientras que el segundo eje estuvo relacionado negativamente con el pH (Figura 6).
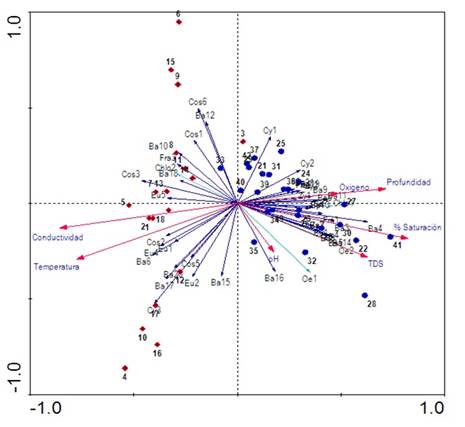
Figura 6 Triplot basado en el RDA de las variables físicas y químicas y las especies algales más representativas del perifiton (<5% etiquetas referenciadas en la tabla de anexo).
Se observa una clara separación temporal para los períodos limnológicos; la época seca fue ubicada en lado negativo del eje 1 y se asocia con la conductividad y la temperatura; en contraste, la época de lluvias ubicada en el eje positivo del eje 1 estuvo asociada con el oxígeno y la conductividad. En el eje 2 se observa el efecto de la escala sucesional en la estructura de la fracción algal. Las especies que más se asocian con el inicio del proceso (entre 12 y 24 h) para el período de aguas bajas fueron Aulacoseira aff. alpigena, Phacus ephippion, Trachemononas hispida aff. minor y Eunotia aff. pectinallis. Mientras que Aulacoseira sp.1, Trachelomonas superva var. espinosa, Fragillaria sp.2, Gomphonema aff. neonasutum, Melosira italica y Sellaphora sp. se asociaron con la fase intermedia (36 a 48 h) y Pseudoanabaena sp. y Pinnularia abaujensis con la fase final del proceso sucesional (60 a 72 h).
Para el período de aguas altas, para las especies Oedogonium sp.3, Eunotia aff. fleuxuosa, Euastrum aff. divaricatum y Fragillaria aff. ulna se observa una asociación con las primeras horas de sucesión, seguidas por Oedogonium sp.2, Oscillatoria sp., Asterionella sp.1, Cymbella aff. affinis y Gomphonema sp.1 para la fase intermedia, finalizando con Encyonema aff. vulgare y Pinnularia aff. major para la fase final del proceso sucesional.
Fracción de protozoos
Según la matriz de similitud de Jaccard, el análisis de relación para la fracción de protozoos evidenció que el mayor porcentaje de similitud fue encontrado entre la zona limnética del lago Zapatero y la zona de macrófitos del lago Pozo Hondo para el período de aguas altas, seguido por la zona limnética del lago Zapatero para aguas bajas con la zona de macrófitos del lago Pozo Hondo para aguas altas (Tabla 4).
Tabla 4 Matriz de similitud de Jaccard de los sitios muestreados (Zpt: lago Zapatero, PH: lago Pozo Hondo, M: macrófitos, L: Limnética, AB: aguas bajas y AA: aguas altas)
Para este componente se encontraron 17 familias, 13 dentro del zooplancton ciliado y cuatro dentro de los flagelados. En términos de abundancia, el período de aguas bajas presentó los mayores registros para el estudio, en ambos lagos, con valores máximos de 541,72 ind.cm-2 para la zona de macrófitos y de 601,49 ind.cm-2para la zona limnética del Lago Pozo Hondo (Figura 7a). Para el período de aguas altas, las mayores densidades se encontraron en la zona de macrófitos para ambos lagos, con valores máximos de 287,50 ind.cm-2 para el lago Zapatero y de 272, 37 ind.cm-2 para el lago Pozo Hondo (Figura 7b).
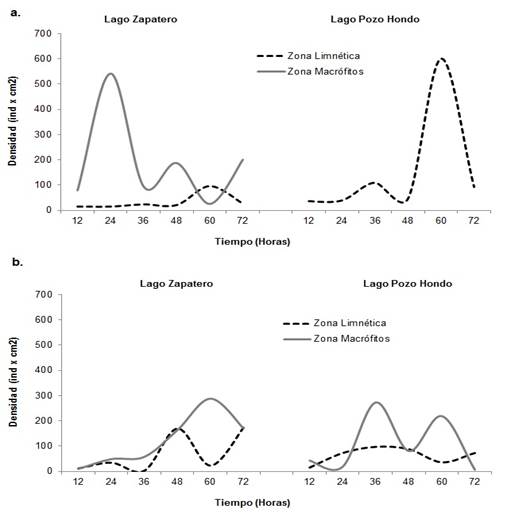
Figura 7 Densidad del componente de protozoos expresado en ind.cm-2 para cada lago y zona de estudio. A. Período de aguas bajas; B. Período de aguas altas.
Para el período de aguas bajas, los géneros Vorticella, Arcella y Centropyxis fueron los más abundantes. A nivel espacial y temporal los organismos ciliados tienden a colonizar el sustrato con mayor diversidad a partir del tiempo medio del muestreo (36 h) en comparación con los flagelados que predominan en las etapas iniciales de colonización (Tabla 5). Se registraron seis nuevas especies para el período de aguas altas, entre los ciliados Tintinnopsis sp., Dexiotricha sp., Stentor sp., Dileptus sp., Urotricha sp. y Centropyxis sp.1 dentro de los flagelados (Tabla 6).
Tabla 5 Presencia de los géneros reportados para el componente de protozoos a escala temporal y espacial para el período de aguas bajas. ZPT -L (*); ZPT - M (+) y PH - L (°)
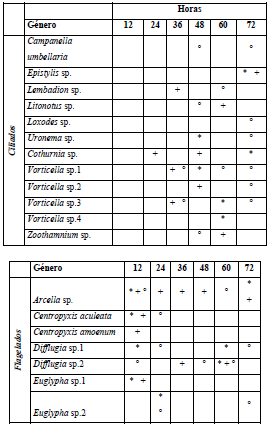
Tabla 6 Presencia de los géneros reportados para el componente de protozoos a escala temporal y espacial para el período de aguas altas. ZPT - L (*); ZPT - M (+); PH - L (°) y PH - M (/)
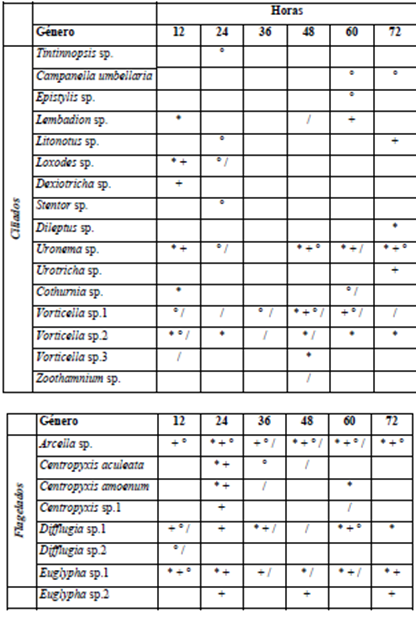
Pese a las diferencias presentes en términos de riqueza y abundancia de esta fracción para la comunidad del perifiton en los diferentes períodos y sistemas, los resultados del ANOVA mostraron que estas no son significativas para explicar el comportamiento de estos organismos durante el proceso de sucesión, siendo de esta forma importante la relación alimenticia de estos organismos con las demás fracciones tanto algales como bacteriana.
Comunidad Perifítica
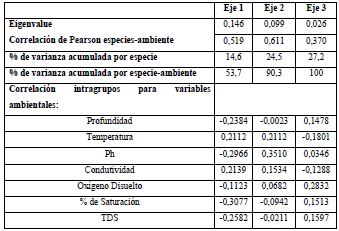
Los datos de abundancia de cada fracción estudiada (algas, bacterias y protozoos) fueron transformados a porcentajes totales por hora para cada zona, lago y período muestreado, previamente estandarizados para la elaboración del Análisis de Correspondencia Canónica Distendido (DCCA). El test de Monte Carlo con 499 permutaciones fue significativo para los ejes 1 y 2 con un valor de p=0,02. El Análisis de Redundancia (RDA) evidenció una varianza total explicada por la frecuencia especie-ambiente de 90,3% en los dos ejes (Tabla 7). Las variables ambientales correlacionadas positivamente con el eje 1 fueron la temperatura (r=0,40), la conductividad (r=0,41) y negativamente con la profundidad (r=-0,45), TDS (r=-0,49) y el % de saturación (r=-0,59; Figura 8).
La ordenación de las muestras basada en las horas de sucesión de las especies evidencia la agrupación de las primeras horas de colonización para el período de aguas altas con un dominio bacteriano (muestras 19, 20, 22, 23 y 25), un dominio algal para algunas muestras de horas intermedias (muestras 2, 7, 8, 14, 33, 34 y35) y un dominio de la fracción de protozoos para horas finales del proceso de sucesión (39 y 40 h). También se observa una relación directa entre la fracción algal con las variables conductividad y temperatura, dinámica totalmente opuesta a lo encontrado para la fracción bacteriana.
Discusión
Las condiciones limnológicas de los sistemas que hacen parte de la várzea del río Amazonas sufren grandes modificaciones, principalmente como consecuencia del pulso de inundación (Junk et al. 1989). Los resultados obtenidos en la presente investigación para el análisis de varianza, corroboran este planteamiento siendo así el parámetro más importante para entender la dinámica abiótica del sistema de lagos de Yahuarcaca.
Para el caso del oxígeno disuelto, en el período de aguas bajas en el lago Pozo Hondo, los bajos valores se asocian con los aportes de materia orgánica en descomposición provenientes de la planicie de inundación que llegan al sistema incrementando así la tasa de consumo de oxígeno. Cuando el agua del río Amazonas irrumpe en la planicie de inundación, una gran cantidad de material orgánico en descomposición es arrastrado hasta los lagos, razón por la cual, y como fue observado, es de esperar un aumento de variables como la conductividad durante el período de aguas altas, ya que los altos valores registrados en el estudio pueden estar relacionados con altas velocidades de descomposición (Caraballo et al. 2014). Durante la época de aguas bajas la conductividad se ve reducida por la desconexión de los lagos con el río y al aporte de aguas negras de la quebrada de Yahuarcaca (Duque et al. 1997).
La sucesión es un proceso que se puede dividir en tres fases: adhesión, crecimiento y separación (Nazar 2007). En la etapa de adhesión bacteriana pueden influir también variaciones en la velocidad de flujo, temperatura del agua y concentración de nutrientes (Shiah y Ducklow 1994, White et al. 1991), como fue evidenciado por medio del Análisis de Redundancia en donde se observa que la temperatura es uno de los factores que limitó la abundancia de esta fracción perifítica para los sistemas estudiados. Luego de la adhesión, durante la etapa de crecimiento, la fracción bacteriana inicia el proceso de división y las células hijas se extienden colonizando el sustrato y elaborando un exo-polisacárido que constituye la matriz del biofilm, desplegándose hacia una formación tridimensional (Ramadah 2006). Esta etapa se presenta entre las 36 y 48 h para el estudio, en donde la densidad máxima para el período de aguas bajas fue de 6,36E+06 y de 7,58E+06 Ind.ml-1 para aguas altas.
Finalmente, en la tercera etapa, luego que el biofilm ha alcanzado la madurez, algunas células, ya sea aisladamente o en conglomerados bacterianos, se liberan de la matriz para colonizar nuevas superficies, cerrando el proceso de formación y desarrollo del biofilm; este desprendimiento puede ser resultado de fuerzas externas al biofilm o de procesos activos inducidos por éste (Post et al. 2004). Durante esta fase, la densidad bacteriana tuvo un gran descenso con valores máximos de 2,57E+06 y 5,73E+05 Ind.ml-1 para los períodos de aguas bajas y altas, respectivamente. Para el estudio, el crecimiento de la fracción bacteriana del perifiton desciende en gran parte debido a la presencia de protozoarios tanto ciliados como flagelados bacteriófagos. Hacia las 72 h, la mayoría de ciliados presentes en las muestras son bacteriófagos exclusivos (Campanella sp., Loxodes sp., Uronema sp. y Vorticella sp.), lo que se considera una de las principales razones por la cual se reduce la abundancia de la fracción bacteriana al final del período de estudio.
Luego de analizar la dinámica de colonización, en términos de abundancia de la fracción bacteriana, se observa que los promedios de densidad para el sistema de Yahuarcaca se encuentran entre los rangos registrados por Edwards y Meyer (1986) e Iriberri et al. (1990) con valores entre los 106 y 107 individuos por cm2. Otros estudios como el de Wissmar et al. (1997) registraron abundancias bacterianas en diferentes ecosistemas amazónicos, con rangos entre 9,108 y 11,1010 cél/l y para sistemas acuáticos no amazónicos y de diferente condición trófica promedios alrededor de 6,108 a 1,1010 cél/l (Castillo et al. 2004, Cole y Pace 1995, Mariazzi et al. 1998).
Se ha observado que un aumento en la concentración de nutrientes está correlacionado con un aumento en el número de células bacterianas adheridas al biofilm (Nazar 2007), y para el sistema estudiado, esta incorporación de nutrientes se hace a través del proceso de inundación de las aguas del río Amazonas y la quebrada Yahuarcaca que arrastran a su paso biomasa de la planicie y bosque circundante.
Una dinámica opuesta a la fracción bacteriana del perifiton es la presentada por la fracción algal, en donde la composición fue caracterizada principalmente por el período limnológico, seguida por el sitio de muestreo. La riqueza total para esta fracción fue mayor durante el período de aguas altas, lo que puede estar relacionado con el efecto homogenizador del río Amazonas sobre los ambientes acuáticos en que presenta influencia (Algarte et al. 2006). De igual forma, la presencia de grandes bancos de macrófitos durante el período de aguas altas, como se observa para ambos lagos de estudio, constituye excelentes hábitats para el desarrollo algal, especialmente verdes filamentosas y desmidias, una vez que liberan nutrientes disueltos y disminuyen la turbulencia de la columna de agua (Marinho 1994).
En el caso del componente algal, segundos organismos a colonizar el sustrato, su proceso de adhesión inicial implica el asentamiento de algas planctónicas y otros microorganismos sobre la fina capa de material orgánico (capa de aire) que ha sido adherido a la superficie sólida (Bellinger y Sigee 2010). Para la fracción algal perifítica, el grupo que presenta mayor capacidad y diversidad de adaptación son las diatomeas, las cuales son comunes y dominantes en la estructura del biofilm debido a sus estructuras especiales de fijación como: 1) largos pedúnculos mucilaginosos, 2) producción de matrices gelatinosas y 3) estructuras coloniales en forma de estrella o ramas fijas por la base (Rodrigues et al. 2003).
La participación de las diatomeas aumentó con el avance del tiempo de sucesión, encontrando dentro de los primeros colonizadores para el período de aguas bajas especies como Encyonema aff. vulgare que presenta una forma de vida solitaria o formando colonias, Pinnularia acrosphaeria, Eunotia pectinallis, E. arcus, E. aff. transfuga, E. aff. tropico arcus y Navicula sp., considerado un género bidimensional debido a que la secreción inmoviliza el rafe y mantiene el alga adherida al sustrato; todos estos son considerados géneros pioneros de bajo perfil correspondientes a las primeras etapas de sucesión de la comunidad perifítica puesto que son capaces de colonizar rápidamente las superficies expuestas desarrollándose en condiciones de alta radiación (Bellinger y Sigee 2010, Bicudo y Menezes 2006). Para el período de aguas altas esta primera etapa sucesional estuvo conformada por las diatomeas Encyonema sp.1, E. aff. vulgare, Cymbella sp., Amphora ovalis, Pinnularia sp.3, Gomphonema aff. gracile, G. aff. grunowii y G. aff. augur todas especies con forma de vida propiamente epífitas. Es importante mencionar que la alta abundancia del género Trachelomonas durante toda la investigación, con mayor presencia en el período de aguas altas, fue debido al alto contenido de materia orgánica disponible.
En la segunda fase de sucesión, tanto para el período de aguas bajas como altas, se encuentran las diatomeas tolerantes a una amplia gama de radiación, representadas por Gomphonema aff., G. grunowii y G. gracile con forma de crecimiento colonial adheridas al sustrato por un filamento de mucilago, Melosira varians, diatomea colonial que forma cadenas largas de células, Pinnularia aff. caudata, P. aff. abaujensis y Pinnularia sp.3 que son células solitarias que raramente se encuentran formando colonias (Andramunio-Acero et al. 2008, Bicudo y Menezes 2006) y Eunotia aff. Pectinalis, también diatomea que forma largas colonias en forma de cintas, considerada una especie característica de aguas con presencia de plantas acuáticas, muchas veces viviendo de forma asociada con estos macrófitos de forma perifítica.
En la última fase de sucesión, las especies presentes son las capaces de mantener una alta tasa de crecimiento en presencia de baja luminosidad; para el caso de las diatomeas, los géneros presentes en esta etapa son aquellos considerados de forma de vida tridimensional, que poseen estructuras de fijación especiales que les permiten levantarse sobre el sustrato colonizado para aprovechar mejor los recursos. Las especies representantes de esta fase para aguas bajas fueron Fragilaria aff. intermedia, F. aff. ulna y Aulacoseira varians que forman cadenas lineales como forma de crecimiento (Bicudo y Menezes 2006) y, para aguas altas, la dominancia de las diatomeas fue con Pinnularia sp., Gomphonema aff. augur, G. aff. grunowii que presentan pedúnculos gelatinosos simples que les permiten adherirse y levantarse sobre el sustrato y Amphora ovalis que son algas poco móviles que se postran sobre el sustrato, indicando el inicio de un nuevo proceso sucesional tras la llegada de nuevos organismos bidimensionales.
Oedogonium sp. fue otro de los géneros más abundantes durante las dos últimas fases en ambos períodos limnológicos. Estos organismos son buenos competidores por la luz y el espacio y están adaptados a elevadas concentraciones de nutrientes y conductividad (Fernandes 1997). Se consideran organismos con forma de vida típicamente epifítica y con grandes células de fijación que les permiten levantarse sobre el sustrato, por lo que son de las especies más abundantes de forma tridimensional en las etapas finales de sucesión de la comunidad.
Otras especies dominantes para el proceso sucesional fueron Ulothix sp. y Nostoc sp., algas con formas de vida filamentosas que tienden a dominar la comunidad perifítica de forma densa por los tapetes que forman sobre el sustrato e importantes por su capacidad como organismos fijadores de nitrógeno (Pereira et al. 2000). Y diferentes géneros de Trachelomonas, especialmente T. volvocina y T. volcocinopsis, considerados euglenófitos oportunistas, con altas tasas de reproducción, tolerantes a condiciones ambientales extremas y relacionados principalmente con ecosistemas que presentan una elevada carga de materia orgánica, razón principal de su dominancia durante el período de aguas altas donde los lagos reciben la descarga proveniente del río Amazonas y las planicies de inundación circundantes.
Teniendo en cuenta los trabajos de Castillo (2006) y Ordoñez (2002) para el mismo sistema lagunar, los resultados demuestran que no solo se desarrolló un proceso de colonización sino un proceso de sucesión de este componente algal debido a la ausencia de especies iniciales y llegada de nuevas especies hacia las horas finales, evidenciando así un cambio en la estructura de esta comunidad. Las nuevas especies estuvieron representadas por Aulacoseiraaff.ambigua, Cymbella aff. tumida, C. aff. affinis, Encyonema aff. silesiacum, Diatoma sp., Nupela sp., Peronia sp., Calothrix fusca, Spirulina sp., Oocystis elliptica, Desmodesmus sp.,Cyclotella sp. y Euastrum brasiliense.
La disminución de las especies de algas sobre el sustrato es analizada con base en dos condiciones que se logran inferir durante el proceso de sucesión; la primera debido a la competencia por el sustrato y la capacidad de adaptación a la luz y la segunda por la presencia de predadores de zooplancton. Estudios previos han demostrado que el componente algal es muy importante en el régimen alimentario de los tecamebianos (Gilbert et al. 2000 y 2003), aunque también pueden ingerir otros organismos inmóviles, senescentes o muertos (Gilbert et al. 2003). Por ejemplo, Modenutti y Vucetich (1987) detectaron individuos de Arcella discoides, con diatomeas y clorófitas en el protoplasma y a Difflugia biconcava depredando sobre larvas nauplio.
Para el componente de protozoos del perifíton, los primeros colonizadores fueron los organismos flagelados consumidores de bacterias, algas y detritos, organismos que se encontraron con mayor disponibilidad hasta mediados del tiempo del muestreo entre las 36 y 60 h. Posteriormente, los zooflagelados fueron desplazados por los ciliados quienes son registrados como comedores más eficientes de bacterias; por ello, tan pronto las poblaciones bacterianas alcanzan altos valores, los ciliados de vida libre predominan. Cuando disminuyen las poblaciones de bacterias, los ciliados de vida libre no tienen fuentes de alimento y dan paso a los ciliados fijos (tipo vorticélidos) que consumen material particulado (Sierra y Ramírez 2000).
En la zona litoral la mayor abundancia de algas de mayor tamaño, en particular de diatomeas, constituye una importante fuente de alimento que favorece la presencia de tecamebianos, razón por la cual se presenta la colonización de estos protozoos hacia las etapas intermedias y finales del proceso de sucesión donde se encuentran los mayores tamaños y desarrollos del componente algal.
Dentro de los ciliados propiamente perifíticos encontramos a Epistylis sp., considerado un protozoo colonial que se fija al sustrato mediante un pedúnculo no contráctil, Vorticella sp. protozoo solitario fijado por medio de un pedúnculo contráctil y que habita característicamente en ambientes ricos en materia orgánica y Zoothamnium sp. protozoo colonial fijo mediante un pedúnculo contráctil. Para los ciliados libres, registrados comedores más eficientes gracias a los cilios que rodean su célula y que los hace más eficaces en la captura de alimento, se encontraron con mayor abundancia los géneros Litonotus sp., Loxodes sp., Uronema sp. y Urothricha sp (Figura 9).
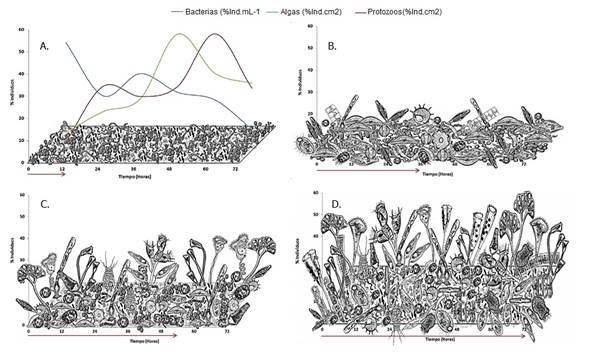
Figura 9 Fisionomía de la comunidad perifítica durante el proceso de sucesión representada por los organismos con mayor abundancia para cada fase. A. Colonización de la fracción bacteriana y curvas de porcentaje de individuos a lo largo de toda la sucesión; B. Segunda fase de sucesión, aumento de la fracción algal y disminución de la fracción bacteriana por presencia de protozoos bacteriófagos; C. Tercera fase sucesión con predominio de la fracción algal con forma de vida tridimensional. D. Fase final del proceso con predominio de protozoos de diversos hábitos alimenticios.
La relación de los componentes bacteriano, algal y de protozoos durante el proceso de sucesión perifítica evidenció una clara separación y dominancia de cada fracción dependiendo del período limnológico y el tiempo de sucesión. Como se observa en el RDA, las primeras horas (entre 12 y 36 h) tuvieron una dominancia del componente bacteriano, con mayores abundancias para el período de aguas posiblemente dado por un mayor porcentaje de materia orgánica disponible en el sistema. Para el caso del componente algal estas estuvieron directamente relacionadas con la temperatura, conductividad y presentaron una dinámica opuesta al componente bacteriano debido al recambio de estas durante el proceso sucesional. Por último, el pH fue el factor limitante para el establecimiento de la fracción de protozoos, disminuyendo su presencia hacia valores básicos del agua debido a que la mayoría de los protozoos encontrados se desarrollan entre 6 y 7,5 y a temperaturas entre 21 y 30 °C.
Finalmente, la ausencia de especies iniciales y posterior colonización de nuevas especies en las etapas finales del proceso sucesional, genera cambios en la estructura de la comunidad del perifíton, como se pudo evidenciar en la presente investigación. Razón por la cual se concluye, que para estos sistemas de la Amazonia colombiana se presenta un proceso sucesional perifítico durante un lapso mínimo de 72 h, siendo este un aporte importante para el conocimiento del funcionamiento y productividad de estos sistemas acuáticos.