INTRODUCCIÓN
Varios fenómenos externos como la contaminación ambiental, la radiación UV, la luz azul, la concentración elevada de oxígeno y la acción de sustancias químicas provocan daños en el organismo humano debido a su elevada producción de radicales libres (RLs) como especies reactivas de oxígeno (ROS), siendo la piel el órgano más afectado (Sakthivel y Devi, 2019). Para disminuir los efectos dañinos de los RLs como el cáncer de piel, el envejecimiento prematuro de la piel, la disminución de la respuesta inmune, la pérdida de elasticidad o la perdida de pigmentación, las industrias cosméticas han incorporado antioxidantes y filtros solares, como coadyuvantes en sus productos (Mendes-Silva et al., 2020).
De acuerdo con Bianchet et al. (2020), la mayoría de los cosméticos son elaborados con sustancias químicas sintéticas y derivados del petróleo, recursos que producen residuos difíciles de degradar, por lo que constituyen un gran problema medioambiental. Además, muchas de las sustancias químicas utilizadas provocan problemas en la piel a corto y largo plazo, como irritación, daños en los fibroblastos y envejecimiento prematuro de la piel (Cottrez et al., 2020). Las tecnologías verdes se han incluido también en el desarrollo de cosméticos, por ello, las sustancias antioxidantes han ganado alto interés para la producción de cremas, geles, aceites, polvos compactos y protectores solares, entre otros (Hamidi et al., 2020).
Cosméticos con ingredientes constituyentes de plantas, animales permitidos y microorganismos, han ganado mayor demanda en el mercado mundial por lo que se busca incluir ingredientes de origen natural en categoría de antioxidantes, antimicrobianos, espesantes, agentes anti-edad y agentes para el blanqueamiento de la piel (Sugibayashi et al., 2019). Los antioxidantes juegan un rol importante dentro de los cosméticos, ya que son los encargados de evitar la peroxidación lipídica, la oxidación de proteínas y el daño en el ADN provocados por el incremento en la producción de ROS en la piel (Unsal et al., 2020).
Dada la capacidad de retrasar o prevenir significativamente la oxidación de biomoléculas orgánicas e inorgánicas, los antioxidantes obtenidos de varias sustancias naturales son muy utilizados en el campo de la medicina dentro de la formulación de antiinflamatorios, antidiabéticos, defensa ante enfermedades cardiovasculares o de neuro y hepatoprotectores; en la farmacéutica, nutraceútica y cosmética (Neha et al., 2019). Actualmente, la fuente principal de extracción de recursos antioxidantes son las plantas, ya que contienen gran cantidad de compuestos bioactivos como flavonoides, terpenos, ácidos grasos, polisacáridos, esteroles carotenoides y enzimas que presentan actividad antioxidante (Hęś et al., 2019).
Sin embargo, la recolección de células vegetales es mucho más complicada, dado que presentan ciertas restricciones, sobre todo las especies protegidas y las condiciones de crecimiento y mantenimiento son más estrictas (Atanasov et al., 2015), por lo que optar por microorganismos se ha convertido en una gran alternativa para obtener compuestos bioactivos. Los microorganismos, además, son extremadamente diversos, incluyendo bacterias, arqueas, protistas, hongos y algas, por lo que, en las últimas décadas, ha habido grandes progresos en la extracción de la inmensa diversidad biológica disponible en el mundo microbiano (Peyrat et al., 2019).
El objetivo de la presente revisión es detallar compuestos antioxidantes no tóxicos producidos por microorganismos acuáticos y terrestres para proporcionar información relevante sobre alternativas a antioxidantes sintetizados artificialmente y obtenidos de fuentes vegetales. Además, teniendo en cuenta que las investigaciones de antioxidantes producidos por microorganismos marinos o aislados de ambientes extremos están apenas emergiendo, y que su metabolismo está mejor adaptado para producir metabolitos antioxidantes, este artículo recopila información relevante que permite comparar con aquellos antioxidantes originarios de microorganismos terrestres.
METODOLOGÍA
Se revisaron 130 artículos en inglés, de los cuales se seleccionaron los más relevantes, considerando los siguientes criterios de inclusión:
Artículos publicados durante y después de 2015
Artículos publicados en las siguientes bases de datos: Pro-Quest, Web of Science, Scopus, Science Direct y Springer
Artículos que presentaban resultados de ensayos de toxicidad
Se utilizaron palabras claves como: antioxidants, natural antioxidants, antioxidants producing microorganisms, application of natural antioxidants, activity of antioxidants, antioxidants acuatic microorganisms, synthetic antioxidants, antioxidants in cosmetics, advantages/disadvantages of microorganisms/plans, toxicity of antioxidants, phototoxicity/cytotoxicity.
La información fue esquematizada a través de tablas, una que permite comparar ventajas y desventajas entre antioxidantes de origen vegetal y de origen microbiológico; y otras tres que posibilitan evidenciar las propiedades de diferentes compuestos antioxidantes, donde se incluyó su clasificación, su actividad biológica y su utilidad en diversas ramas de la ciencia.
Generalidades de antioxidantes naturales
La actividad antioxidante que presentan los organismos vivos se desarrolló en conjunto con la atmosfera oxigénica (Kaboré et al., 2017). Esta actividad se originó como un mecanismo de defensa dentro de los organismos primitivos, ya que al empezar a captar el oxígeno por procesos de óxido-reducción se generaban especies reactivas (ROS) que al acumularse en las células eran letales y causaban daños en el ADN, lípidos y proteínas (Ndongo et al., 2020).
El oxígeno se ha mantenido como un elemento esencial para el crecimiento y desarrollo de gran parte de formas de vida, por lo que no está presente solo en el aire, si no también disuelto en el agua; lo que ha provocado que tanto organismos terrestres como acuáticos desarrollen un sistema antioxidante (Ślesak et al., 2019).
Los antioxidantes pueden ser compuestos naturales o sintéticos capaces de prevenir o generalmente retardar el daño oxidativo, ya que contrarrestan los RLs, en biomoléculas expuestas a este tipo de estrés (Bazinet y Doyen, 2015). Químicamente, los antioxidantes incluyen eliminadores o cazadores de RLs, agentes reductores, inactivadores de peróxidos o de otras especies reactivas de oxígeno, y quelantes de metales (Yang et al., 2018).
En los sistemas biológicos los antioxidantes se encargan de la protección frente a la oxidación inhibiendo la producción de RLs, capturando los RLs para evadir la cadena de reacción o restaurando el deterioro provocado por RLs (Neha et al., 2019). Los antioxidantes naturales pueden ayudar a fortalecer la inmunidad innata del cuerpo humano contra enfermedades crónicas o relacionadas con la edad, protegiendo el cuerpo humano de los efectos nocivos de los RLs, y disminuyendo así el impacto del fotoenvejecimiento de las células cutáneas (Khan y Ahmad, 2020).
Además, los antioxidantes naturales presentan ventajas frente a los antioxidantes sintéticos, ya que no influyen en la señalización y regulación de muchas vías biológicas (Ambati et al., 2019), no son tóxicos ni obstaculizan la función normal de las células humanas (Valentová, 2020). Según Shah et al., (2016), los antioxidantes sintéticos pueden causar genotoxicidad y carcinogenicidad en altas concentraciones, por lo que presentan menos propiedades que promueven la salud, incluso presentan un potencial antioxidante más bajo que los compuestos naturales; todo esto los hace menos valiosos y deseables como coadyuvantes o aditivos (Novoveská et al., 2019).
Fuentes para la obtención de antioxidantes naturales
Los antioxidantes naturales pueden ser de origen vegetal o compuestos derivados de otros organismos vivos con potencial de inhibir el estrés oxidativo. Estos antioxidantes naturales pueden balancear el estrés oxidativo irregular y restablecer la homeostasis celular (Ramana et al., 2018). Los más utilizados en la industria de alimentos, farmacéutica y cosmética generalmente son de origen vegetal. En los organismos vegetales los compuestos fenólicos como ácidos fenólicos, flavonoides, lignanos, estilbenos y taninos son los responsables de la actividad antioxidante; y se los pueden encontrar en semillas oleaginosas, cereales, legumbres, plantas de la familia Lamiaceae, té y café, frutos secos, frutas y bayas (Amarowicz y Pegg, 2019).
Los compuestos fenólicos de las plantas están asociados con el mecanismo de defensa contra patógenos invasores y la radiación y son responsables del sabor, color, olor y acidez de los alimentos. En varios estudios se ha revelado que pueden ser protectores contra la incidencia y el progreso de la diabetes, cáncer, osteoporosis, enfermedades cardiovasculares y neurodegenerativas (Pengkumsri et al., 2019), por ello son de especial interés para la industria de alimentos, fármacos, cosméticos e incluso para la producción de plásticos (Khan y Ahmad, 2020).
Los antioxidantes obtenidos de plantas han sido aplicados en varios productos de interés humano desde hace algunos años; sin embargo, existen otros organismos vivos capaces de producir sustancias con capacidades antioxidantes similares, los microorganismos (Ceylan et al., 2019). Las sustancias antioxidantes de estos pequeños organismos presentan incluso más ventajas frente a las sustancias producidas por las plantas (Penchaszadeh, 2017), por lo que los microorganismos son una fuente de compuestos antioxidantes de gran interés. La Tabla 1 presenta las ventajas y desventajas de los antioxidantes de origen vegetal y de origen microbiológico.
Tabla 1 Ventajas y desventajas de los antioxidantes de origen vegetal y de origen microbiológico
| Origen de los antioxidantes | Ventajas | Desventajas |
|---|---|---|
| Antioxidantes de Origen vegetal | · Las células se pueden cultivar individualmente, como si fueran microorganismos (Hidalgo et al., 2018) | · Las células de origen vegetal son delicadas, por lo que demandan condiciones más costosas de mantenimiento (Zhang et al., 2020) |
| · Pueden cultivarse en biorreactores a gran escala para la producción de compuestos valiosos para la industria químico-farmacéutica (Hidalgo et al., 2018) | · La recolección del material vegetal, es más compleja, ya que el hábitat de las plantas, en particular de las especies protegidas, debe respetarse de acuerdo con la normatividad vigente relacionada (Atanasov et al., 2015) | |
| · La biosíntesis de componentes activos en la planta se limita a un órgano específico o a la formación de estructuras, por lo que su producción se basa en cultivos de órganos para su localización (Hidalgo et al., 2018) | ||
| · La síntesis de ciertos compuestos depende de interacciones con microorganismos (Lutzu y Dunford, 2018) | ||
| · La generación de mezclas de componentes activos requiere de más pasos para producir el producto final, tiene bajo rendimiento y alto costo (Soares et al., 2017) | ||
| Antioxidantes de origen microbiológico | · Los metabolitos y enzimas que se obtienen de los microorganismos son mucho más variados y adaptados a ambientes extremos (Satoh y Oono, 2019) | · Las tecnologías de procesamiento son costosas debido a que varios compuestos no muestran estudios previos (Mussagy et al., 2019) |
| · Permiten mayor eficiencia y rapidez para obtener compuestos a escala industrial (Bianchet et al., 2020) | · El porcentaje de microorganismos cultivables en laboratorio es menor al 2% (Lutzu y Dunford, 2018) | |
| · El bioprocesamiento de los compuestos activos puede controlarse, aumentando los rendimientos de producción y reduciendo los costos (Mussagy et al., 2019) | · Las nuevas cepas requieren ser caracterizadas y almacenadas manteniendo sus características particulares, lo cual resulta costoso (Lutzu y Dunford, 2018) | |
| · No generan micromoléculas difíciles de degradar (Bianchet et al., 2020) |
Los microorganismos son una amplia fuente de nuevas sustancias químicas que representan un valioso recurso para innovar en biotecnología (Mendes-Silva et al., 2020). Aunque por la accesibilidad se han investigado y utilizado con mayor frecuencia los microorganismos terrestres y de ecosistemas de agua dulce, los organismos que presentan mayor ventaja en la producción de metabolitos son los que habitan en ecosistemas marinos (Hamidi et al., 2020), debido a la enorme diversidad biológica y capacidad para sintetizar metabolitos secundarios bioactivos (Pedroso et al., 2019).
El ecosistema marino cubre alrededor de tres cuartos de la superficie terrestre y todo el volumen de agua, así como el suelo marino es ocupado por organismos vivos (Peyrat et al., 2019), por lo que hay una amplia gama de microrganismos marinos que han desarrollado estrategias inteligentes para adaptarse y crecer (Hamidi et al., 2020).
Las diferencias en la presión, temperatura, variaciones en las propiedades espectrales en la luz y la movilidad del medio en el que se encuentran los organismos, han provocado que las rutas metabólicas de los microorganismos marinos sean más variadas (Baker et al., 2020). Además, la contaminación afecta de manera directa a los ecosistemas terrestres, por lo que se pueden presentar modificaciones tóxicas en los metabolitos producidos por microorganismos (Ribera, 2019) y el crecimiento de los microorganismos útiles que habitan en los mismos se limita a una capa de un metro de espesor, debido a las limitaciones de carbono y nitrógeno (Soong et al., 2020). Por ello, las propiedades de los microorganismos marinos hacen que sus moléculas sean de gran interés para incluir en varios productos y procesos industriales.
Microorganismos generadores de antioxidantes con potencial cosmético
Actualmente, la industria cosmética, al igual que otros sectores industriales, ha optado por tecnologías verdes. Por lo anterior, los cosméticos ahora producidos presentan una composición natural y orgánica (Bianchet et al., 2020). Los productos cosméticos son de uso externo para la piel, rostro, uñas, cavidad bucal y cabello; y su toxicidad debe ser evaluada a través de ensayos con dosis repetidas de toxicidad o ensayos de biocinética y carcinogenicidad, en células animales o células de tejidos humanos, ya que se incluyen conservantes, agentes antimicrobianos, biosurfactantes, fragancias, etc., que pueden dañar las células del cuerpo (Rogiers et al., 2020).
El efecto tóxico de los cosméticos es reducido al incorporar en los procesos de producción moléculas de origen natural como antioxidantes naturales, tales como alcaloides, quinonas, furanones, piraones, benzopiroides, xantonas, terpenos, esteroides, péptidos y compuestos fenólicos (Agrawal et al., 2020). Los compuestos bioactivos con actividad antioxidante son producidos por la mayoría de los organismos sean procariontes o eucariontes. Los microorganismos como bacterias, arqueas o eucariontes (hongos), son fuentes valiosas de compuestos antioxidantes y pueden ser utilizados en beneficio de la humanidad, siendo útiles en aplicaciones biotecnológicas, industrias farmacéuticas, de alimentos y cosméticas (Chandra et al., 2020).
Tanto microorganismos terrestres, como de ecosistemas de agua dulce y marinos son una fuente rica de compuestos antioxidantes, ya que presentan una diversidad biológica enorme y una gran capacidad para sintetizar metabolitos secundarios bioactivos (Pedroso et al., 2019). Las Tablas 2, 3 y 4 presentadas a continuación incluyen diferentes tipos de antioxidantes producidos por estos microorganismos.
Tabla 2 Antioxidantes producidos por microorganismos terrestres con uso potencial en cosméticos
| Compuesto antioxidante | Tipo de compuesto/Clasificación | Clasificación del microorganismo (Reino; división/filo especie) | Actividad biológica del compuesto | Utilidad | Fuente |
|---|---|---|---|---|---|
| Hexahidropirrolizin-3-ona | Alcaloide | Hongo; Ascomycota; Botryosphaeria dothidea | Acción fisiológica pronunciada y biológicamente activos en señalizaciones antimicrobianas y antiinflamatorias | Usado como antimicrobiano y antiinflamatorio | (Pedroso et al., 2019; Prakash et al., 2019) |
| Ácido terreico | Epóxido | Hongo; Ascomycota; Aspergillus Terreus LS01 | Inhibidor covalente de la enzima biosintética MurA de la pared celular bacteriana | Usado en la industria farmacéutica por sus propiedades antibióticas | (Yin et al., 2016) |
| Hongo; Ascomycota; Pseudocercospora sp. ESL 02 | (Prihantini y Tachibana, 2017) | ||||
| Ácido 6-metilsalicílico | Compuesto orgánico | Hongo; Ascomycota; Pseudocercospora sp. ESL 02 | Mejora la acumulación de proteínas relacionadas con la patogénesis | Utilizado para mejorar la acumulación de proteínas relacionadas con la patogénesis y en estudios de resistencia al virus del mosaico del tabaco | (Prihantini y Tachibana, 2017) |
| Xilo y arabinoxil ooligosacáridos | Carbohidrato polimérico | Mónera; Firmicutes; Bacillus safensis CBLMA18 | Antioxidante. Sintetizadas a partir de un metabolismo alterno para protección contra radicales libres | Industria de alimentos. | (Bouiche et al., 2020) |
| Resveratrol | Flavonoide polifenólico | Hongo; Ascomycota; Arcopilus aureus | Antioxidante con fuerte actividad antifúngica, así como actividad anti-estafilocócica. Neutraliza e inhibe la formación de especies reactivas de oxígeno. Contrarresta la peroxidación de lípidos y la oxidación de proteínas. Inhibe la actividad inducible de óxido nítrico sintasa (iNOS) y la síntesis de tromboxano A2 en leucocitos | Mercado cosmético y farmacéutico (reduciendo la progresión de enfermedades neurológicas). Producción de ácidos orgánicos, antibióticos, aminoácidos y vitaminas comercialmente | (Dwibedi y Saxena, 2018; Dwibedi y Saxena, 2020) |
| Ácido gálico | Ácido fenólico | Hongo; Ascomycota; Achaetomium sp. | Potencial antioxidante con un papel vital como agente reductor, silenciador de singletes de oxígeno y donante de hidrógeno | Industria farmacéutica | (Uma Anitha y Mythili, 2017) |
| β-caroteno | Carotenoides | Hongo; Basidiomycota; Rhodotorula mucilaginosa | Capturan radicales de peroxilo, inhiben la degradación por singlete de oxígeno, e inhiben la peroxidación de los lípidos | Usados en la industria farmacéutica por su actividad anticancerígena, en suplementos dietéticos, agentes colorantes alimentarios y aditivos cosméticos y farmacéuticos | (Cheng y Yang, 2016; Kot et al., 2018) |
| Toruleno | |||||
| Torularhodin | |||||
| Ácido p-coumárico | Ácidos orgánicos | Hongo; Basidiomycota; Aspergillus austroafricanus CGJ- B3 | Antioxidantes, acción antibacteriana y producción de lignina en la pared de los microorganismos | Analgésico, antiinflamatorio, anticancerígeno, antioxidante, antimicrobiano, anticoagulante, antimicrobiano, acondicionador y blanqueamiento de la piel | (Danagoudar et al., 2017) |
| Ácido ferúlico | |||||
| Ácido cinámico | |||||
| α-(1 → 3)-(1 →2)-unión de ramnan, α-(1 → 6)- unión de mannan, y α, β (1→3)-unión de glucan | Exopolisacárido | Protista; Chlorophyta; | Actividad antioxidante y antimutagénica | Bioadhesivos, bioflocculantes, biosorbentes, agentes gelificantes, estabilizantes, y espesantes | (Singh et al., 2017) |
| Chlamydomonadales incertae sedis; Graesiella sp. | |||||
| Hongo; Ascomycota; Lipomyces starkeyi VIT-MN03 | |||||
| Probiótico y polifenol contra la neurodegeneración | |||||
| NP7 | Péptidos | Mónera; Actinobacteria; Streptomyces sp. | Antioxidante. reduce la acumulación de radicales libres e inhibir la neurotoxicidad inducida por H2O2 | Utilizados en la industria alimentaria, farmacéutica y nutracéutica. Precursores de la vitamina A | (Trabelsi et al., 2016) |
| Astaxantina | Mónera; Actinobacteria; Streptomyces sp. | Fuerte actividad de captura de radicales libres y otras moléculas prooxidantes, protege a la bicapa lipídica de la peroxidación | Utilizados en las industrias alimentaria, farmacéutica y nutracéutica | (Huang et al., 2019) | |
| Neurosporano | Carotenoides | Mónera; Actinobacteria; Microbacterium sp. LEMMJ01 | Cromóforo. Precursor de licopeno y de β-caroteno | Probiótico y polifenol contra la neurodegeneración | (Ragavan y Das, 2019) |
| α,β-caroteno | Mónera; Actinobacteria; Microbacterium sp. LEMMJ01 | Participa en la prevención de daños oxidativos de los radicales libres, actúan como extintores químicos sometidos a oxigenación irreversible. Estimula la comunicación celular y mejora el sistema inmunológico. Actividad pro-vitamina A | Utilizados en la industria alimentaria, farmacéutica y nutracéutica. Precursores de la vitamina A | (Reis-Mansur et al., 2019) |
Tabla 3 Antioxidantes producidos por microorganismos de ecosistemas de agua dulce con uso potencial en cosméticos
| Compuesto antioxidante | Tipo de compuesto/Clasificación | Clasificación del microorganismo (Reino; división/filo especie) | Actividad biológica del compuesto | Utilidad | Fuente |
|---|---|---|---|---|---|
| Ácido clorogénico | Ácidos orgánicos | Mónera; Cyanobacteria; Fortieaceae; Aulosira fertilissima | Antioxidante, protección contra desoxirribosa. Efecto inhibidor sobre bacterias, actividad multi-antivirales y efecto antifúngico | Utilizado en comida, cosméticos y medicinas, especialmente en medicinas chinas | (Wang et al., 2020) |
| Ácido cafeico | Aplicaciones farmacéuticas | (Trabelsi et al., 2016) | |||
| Extracto metanólico | Mónera; Proteobacteria; Novosphingobium sp. PP1Y | Participa en el sistema de eliminación reactiva de oxígeno para preservar la homeostasis redox celular | Industria biotecnológica | (Petruk et al., 2019) | |
| Escualeno | Hidrocarburo | Mónera; Cyanobacteria; Phormidium autumnale | Actividad antioxidante. Precursor de colesterol y de esteroles | Agroindustria y en la industria alimentaria | (Fagundes et al., 2019) |
| Ácido ferúlico | Compuesto fenólico | Mónera; Cyanobacteria; Cronbergia siamensis, Sphaerospermopsis aphanizomenoides (KU212886.1) | Exhibe una fuerte actividad antioxidante a través de la donación de un átomo de hidrógeno de su grupo hidroxilo fenólico | Aplicaciones en los sectores farmacéutico y cosmético | (Badr et al., 2019) |
Tabla 4 Antioxidantes producidos por microorganismos marinos con uso potencial en cosméticos
| Compuesto antioxidante | Tipo de compuesto/Clasificación | Clasificación del microorganismo (Reino; filo; especie) | Actividad biológica del compuesto | Utilidad | Fuente |
|---|---|---|---|---|---|
| Ácido docosahexaenoico (DHA) | Ácido graso | Protista; Heterokonta; Schizochytrium sp. (Microalga) | Actividad antioxidante que evita la acumulación de altos niveles de ROS causados por la peroxidación lipídica y previene la pérdida de los lípidos producidos | Aditivo alimentario y uso farmacéutico (como antioxidante en el cerebro) | (Sun et al., 2018) |
| Protista; Aurantiochytrium sp. T66 (Microalga) | Actividad antiinflamatoria y antioxidante | Nutracéutico | (Patel et al., 2019) | ||
| Escualeno | Hidrocarburo | Protista; Aurantiochytrium sp. T66 (Microalga) | Actividad antioxidante, precursor de miles de compuestos bioactivos, incluyendo esteroles y hopanoides | Industria cosmética, farmacéutica (efecto positivo sobre la respuesta inmune), y adyuvante para aumentar la capacidad de respuesta inmune a las vacunas | (Patel et al., 2019) |
| Extracto de pigmentos carotenoides | Carotenoides | Hongo; Rhodotorula sp. RY1801 | Precursores de la vitamina A, capturan especies activas de oxígeno | Protección contra H2O2 en eritrocitos | (Zhao et al., 2019) |
| Bacterioruberin (BR) | Euryarchaeota; Euryarchaeota; Halorubrum sp. | Proporcionar una eficaz potencia de barrido de radical libre y una actividad de eliminación de oxígeno singlete, y protegerlos de lesiones mortales causadas por altas intensidades lumínicas, irradiación UV y exposición a especies oxidantes | Aplicaciones en varios campos de la biotecnología: enzimas tolerantes a la sal, exopolysacáridos, poliésteres biodegradables, halocinas antimicrobianas, y también alimentos fermentados | (De la Vega et al., 2016; Hou y Cui, 2018) | |
| Monohidrobacterioruberina (MABR) | Euryarchaeotes; Halogeometricum rufum RO1-4, Halogeometricum limi RO1-6, Haladaptatus litoreus RO1-28, Halogeometricum rufum RO1-4, Halogeometricum limi RO1-6, Haladaptatus litoreus RO1-28 | Ayuda a las células haloarcoas a adaptarse a entornos hipersalinos, ya actúa como un "remache" en la membrana celular, estabilizando así la membrana celular bajo el estrés osmótico | (De la Vega et al., 2016; Hou y Cui, 2018) | ||
| Euryarchaeotes; Halogeometricum rufum RO1-4, Halogeometricum limi RO1-6, Haladaptatus litoreus RO1-28, Halogeometricum rufum RO1-4, Halogeometricum limi RO1-6, Haladaptatus litoreus RO1-28 | Capacidades antioxidantes significativamente más altas que el caroteno | Utilizado como antioxidante, antihemolítico y anticancerígeno | (Hou y Cui, 2018) | ||
| β-caroteno | Protista; Dunaliella salina (Microalga) | Actividad antioxidante, pigmento fotosintético | Colorante alimentario natural, provitamina aditivos, antioxidantes para industrias farmacéuticas, cosméticas y nutracéuticas Pigmentos naturales para la industria acuícola | (Hamed, 2016) | |
| Mónera; Cyanobacteria; Spirulina platensis, Mónera; Cyanobacteria; Spirulina maxima | Inhibición de la translocación nuclear NF-B, protección contra la peroxidación lipídica mediada con oxígeno único y acumulación intracelular de ROS | Precursor de la vitamina A, prevenir la degeneración macular, ayuda en quemaduras de la piel por rayos UV, depresión, asma, infertilidad, psoriasis, presión arterial alta, alimentos para mascotas | (Singh et al., 2019) | ||
| Cantaxantina | Mónera; Cyanobacteria; Spirulina platensis | Limita los eventos de peroxidación lipídica mediante la eliminación de la ROS formada durante los procesos fotooxidos | Acuicultura como aditivo y en la nutrición humana como suplemento dietético | (Singh et al., 2019) | |
| Astaxantina | Protista; Chlorophyta Asterarcys quadricellulare | Elevada actividad antioxidante, protege contra el daño oxidativo por diversos mecanismos: eliminación del oxígeno singlete; capta radicales para prevenir reacciones en cadena; preservación de la estructura de la membrana mediante la inhibición de la peroxidación lipídica; mejora de la función del sistema inmunitario y la regulación de la expresión génica | Antioxidantes, proteger de los rayos UV, biodisponibilidad, colorante alimentario, alimentación animal, mejorar las funciones inmunes, mejorar la salud de los ojos / piel, propiedad antienvejecimiento, farmacéutico, nutracéutico, cosmecéutico, acuacultura | (Liu et al., 2016; Singh et al., 2019) | |
| Protista; Chlorophyta; Haematococcus pluvialis | Mecanismo de respuesta al estrés oxidativo | (Shah et al., 2016) | |||
| Luteina | Protista; Chlorophyta; Asterarcys quadricellulare | Antioxidante, actúa como un filtro de luz que protege las células contra el daño de los radicales libres. Mejora las respuestas inmunitarias mediadas por células y, en consecuencia, la resistencia a la formación de tumores | Colorante de comida, alimentación de peces, productos farmacéuticos para enfermedades oculares, degeneración relacionada con la edad, cataratas; nutracéuticos, cosméticos | (Singh et al., 2019) | |
| 13-O-(β-galactosyl)- porphyra-334 | Aminoácido micosporina glicosilada | Mónera; Cyanobacteria; Nostoc sphaericum | Eliminación de radicales libres y actividad de protección UV | Sustancia nueva (se evaluó resistencia a radiación UV, toxicidad y actividad antioxidante) | (Ishihara et al., 2017) |
| Ácido gálico | Compuestos fenólicos | Protista; Euglenozoa: Euglena cantábrica | Mecanismos de defensa contra altos niveles de ROS | Usado para tratar enfermedades cardiovasculares, quimioprevención de cánceres y daños mitocondriales de varios tejidos | (Jerez-Martel et al., 2017) |
| Protista; Chlorophyta; Ankistrodesmus sp | |||||
| Ácido protocatecuico | Protista; Euglenozoa; Euglena cantábrica y Protista; Chlorophyta; Ankistrodesmus sp. | Participa en mecanismos de defensa de microalgas contra altos niveles de ROS | Utilizados en la industria farmacéutica | (Jerez-Martel et al., 2017) | |
| Catequina | Participa en mecanismos de defensa de microalgas contra altos niveles de ROS | Utilizados en la industria farmacéutica | (Jerez-Martel et al., 2017) | ||
| Ácido clorogénico | |||||
| Epicatequina | |||||
| Resveratrol | Saccharomyces cerevisiae | Antioxidante (inhibición de la formación de 8-OH-dG en el ADN) Efecto preventivo sobre la peroxidación lipídica | Industrias farmacéuticas, alimentarias y cosméticas, suplemento nutricional; se incluye en algunos productos cosméticos, bebidas energéticas y otros productos | (Li et al., 2015) | |
| Ficocianina | Pigmento proteínico | Mónera; Cyanobacteria; Spirulina platensis, y Mónera; Cyanobacteria; Spirulina maxima | Disminución de los radicales de peroxilo, peroxidación lipídica, colesterol total, lipoproteínas de baja densidad (LDL), COX-2, iNOS, ROS, MDA, TNF-o, IL-6 e IL-1 | Industria farmacéutica (antioxidantes, antiinflamatorios, anticancerígenos, antivirales y antibacterianos, efectos positivos contra la hiperlipidemia, desnutrición, obesidad, diabetes, toxicidad inducida por productos químicos de metales pesados y anemia) | (Wu et al., 2016) |
| Polisacáridos sulfatados | Polisacáridos | Repara daños del ADN, protección contra lesiones hipoxias, disminución del estrés oxidativo, captura superóxidos e hidroxilos, inhibición de la peroxidación lipídica | (Wu et al., 2016) | ||
| ácido γ- linolénico | Ácido graso | Disminuye el contenido antioxidante de las células, induce de la apoptosis de células tumorales | |||
| Sulfolípidos | Lípido | Inhibición de la actividad de la polimerasa del ADN, disminución de la demanda de fósforo, inhibición de la producción de aniones de superóxido |
Todos los compuestos antioxidantes recopilados en las (Tablas 2, 3 y 4) fueron seleccionados después comprobar la existencia de evidencia bibliográfica sobre su toxicidad en animales o en células humanas. Además, el 80% de los compuestos presentan resistencia o capacidad de absorber la radiación UV. La radiación UV causa daños en la piel, como eritema fotoinducido, envejecimiento de la piel y cáncer de piel (radiación UB-B) o daños en la estructura del colágeno (radiación UV-A), por lo que incluir moléculas capaces de absorber esta radiación mejora la eficiencia en la protección de la piel humana (Hüglin, 2016).
Mecanismo de acción de antioxidantes en la piel y cabello
Las ROS son capaces de causar graves daños en los organismos vivos. Pueden originarse debido a procesos de óxido-reducción internos, metabolismo aerobio y daño oxidativo o por factores externos, como la radiación UV y la contaminación ambiental (humo de tabaco, pesticidas, etc.) (Berthon et al., 2017). De acuerdo con Nowruzi et al. (2020), la piel y el cabello son las partes del cuerpo más expuestas a estos factores generadores de ROS, por lo que el uso de antioxidantes naturales en la industria cosmética representa la mejor solución para contrarrestar el daño oxidativo ocasionado por factores externos o endógenos.
La piel tiene su propio sistema para combatir los RLs y reducir su impacto en las células. El sistema antioxidante de la piel está integrado principalmente por antioxidantes enzimáticos como: sintasa de O2, superóxido dismutasa citosólica y mitocondrial, glutatión peroxidasa, catalasa y ciertas vitaminas, entre otros (Hüglin, 2016). Además, tanto la piel como el cabello producen un tipo de melanina para protegerse del daño oxidativo, la eumelanina, que reduce la acumulación de fotoproductos inducidos por la luz UV (Palareti et al., 2016).
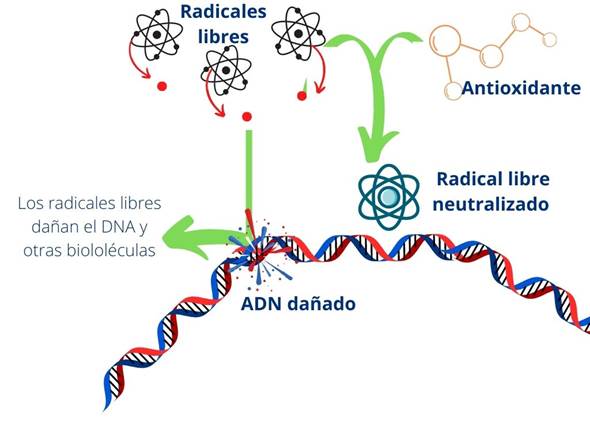
En las últimas décadas el desarrollo de las industrias de siderúrgica, minera, textil y agropecuaria ha provocado un gran impacto ambiental (Li et al., 2020), lo que ha incrementado la contaminación y la radiación UV por disminución de la capa de ozono (Malanca y Arguello, 2017). Por ello, el desarrollo de productos con compuestos antioxidantes y absorbentes de luz UV para la protección de la piel es altamente demandado gracias a la capacidad de estos compuestos de neutralizar radicales de oxígeno y peróxidos para ayudar a reducir los daños causados por estrés oxidativo y por la radiación en el ADN celular (Figura 1) (Hüglin, 2016).
Ensayos de verificación de la actividad antioxidante de compuestos naturales
La capacidad antioxidante se puede medir mediante ensayos in vitro. Estos ensayos se clasifican en aquellos basados en la transferencia de átomos de hidrógeno (HAT) para medir la habilidad de captar radicales de hidrógeno o los basados en la transferencia de electrones (ET) (Camarena-Tello et al., 2018). A continuación, se describe el fundamento de los ensayos más comúnmente utilizados:
Ensayo DPPH (2,20-difenil-1-picrylhydrazyl radical)
Este ensayo es el más utilizado para la determinación de la actividad antioxidante de extractos obtenidos de microorganismos (Badr et al., 2019). El radical DPPH tiene coloración violeta y cuando se coloca delante de una molécula capaz de reducirla a hidrazina hay un cambio en su coloración a amarillo pálido (Pedroso et al., 2019). La reducción ocurre debido a la transferencia de un átomo de hidrógeno, por lo que es un ensayo tipo HAT. Las moléculas capaces de reducir el DPPH son los agentes antioxidantes probados. El radical violeta DPPH remanente se mide con un espectrofotómetro UV-Vis a aproximadamente 515-520 nm y así se determina la actividad antioxidante del compuesto (Sirivibulkovit et al., 2018).
Ensayo ORAC (capacidad de absorción de radicales de oxígeno)
La capacidad de absorción de radicales de oxígeno (ORAC) se clasifica como ensayo de tipo HAT (Camarena-Tello et al., 2018). En el ensayo ORAC se utiliza una sonda sintética no proteínica, la fluoresceína (FL) como sustrato oxidable y da la generación de radicales peroxilo (RO2) mediada por dihidrocloruro de 2,2'-azobis (2-amidinopropano) (AAPH) (Amarowicz y Pegg, 2019). Los antioxidantes protegen o evitan que la fluoresceína pierda fluorescencia, ya que los ROO2 captan preferiblemente un átomo de hidrógeno del antioxidante y esta capacidad de protección se mide con un fluorómetro (Agrawal et al., 2020). En este ensayo, como agentes generadores de radicales peroxilo se puede utilizar otras sustancias como el AIBN lipófilo (α, α-azobisisobutironitrilo) que es un compuesto orgánico natural, o el ABAP (2,2-azobis (2-amidinopropano) diclorhidrato) y AMVN (2,2′-azobis (2, 4-dimetilvaleronitrilo)), que son compuestos químicos sintéticos (Dorta et al., 2016).
Ensayo de quimioluminiscencia por fotosensibilización (PCL)
El ensayo PCL se clasifica como ensayo de tipo HAT, y se realiza en presencia de un superóxido anión-radical (Camarena-Tello et al., 2018). Se generan radicales aniones de superóxido bajo la influencia de la luz UV y un fotosensibilizador; durante la reacción se da la detección, con un compuesto quimioluminógeno (luminol). La medida de la cantidad de radicales en el sistema será la intensidad de la luz emitida y los compuestos de captura de radicales atenuarán esta intensidad de fotoquimioluminiscencia en función de la cantidad y actividad del antioxidante probado (Gramza-Michalowska et al., 2015).
Ensayo FRAP (reducción férrica poder antioxidante)
El método FRAP determina la capacidad antioxidante del compuesto basado en la reducción del complejo Fe3+-TPTZ al complejo azul Fe2+-TPTZ mediante una sustancia donadora de electrones en condición ácida (Ceylan et al., 2019), por lo que es un ensayo ET. El cambio de color se puede correlacionar con la capacidad antioxidante al medir la absorbancia a 450 nm (Oniga et al., 2018).
Los ensayos de evaluación de la actividad antioxidante in vitro detallados previamente son ampliamente utilizados y presentan ventajas como la sencillez, precisión, asequibilidad y relativa rapidez de desarrollo. Además, ensayos como el DPPH permiten controlar la evolución temporal de la reacción, por lo que proporcionan datos valiosos. Sin embargo, son utilizados para detecciones preliminares, dado que no proporcionan información de la actividad biológica de los antioxidantes que brindan solamente las pruebas in vivo, pero estas implican altos costos y pueden plantear problemas éticos; por esto se pueden usar como sustitutos los ensayos en líneas celulares representativas, para lo cual se somete el cultivo celular a alguna fuente de estrés oxidativo en presencia o ausencia del antioxidante y se evalúa el daño en células tratadas versus células no tratadas (Amorati y Valgimigli, 2015).
Procesos de evaluación de compuestos antioxidantes para usar cosméticos
De acuerdo con Millington y Marsh, (2020), el uso de aditivos naturales, no tóxicos en productos cosméticos, es un proceso mucho más atractivo que el utilizar aditivos sintéticos. Para utilizar productos naturales de interés en cosméticos se debe evaluar su toxicidad, citotoxicidad, fototoxicidad, carcinogenicidad y efectos mutagénicos (Nowruzi et al., 2020), para lo cual se pueden utilizar células o tejidos humanos, al igual que animales de laboratorio como los ratones (Tuttle et al., 2018).
Ensayos de toxicidad en animales
Una vez pasadas las pruebas de fototoxicidad se utilizan ratones outbred, ya que al igual que los humanos, cada ratón de este tipo es diferente a otro, por lo que cada uno reaccionará de manera distinta al producto (Suh et al., 2018).
Se puede tratar a los animales primero con el producto químico con una dosis de 2000 mg/kg y se determina la morbilidad y mortalidad relacionadas con el compuesto. Si ninguno de los animales muere, se suspenden las siguientes pruebas de toxicidad. Si algunos mueren, se realizan pruebas de toxicidad a dosis menores entre 200 y 20 mg/kg. Se puede considerar un índice de toxicidad aguda de aproximadamente 4000 mg/kg o más cuando no hay mortalidad a la dosis de 2000 mg/kg (Mishra et al., 2018).
Ensayos de toxicidad en líneas celulares mamíferas
Los animales de laboratorio representan un costo elevado y no brindan resultados de alto rendimiento, por lo que las células mamíferas obtenidas de diferentes tejidos son una mejor alternativa (Huang et al., 2016). Para ensayos toxicológicos se utilizan, por lo general, células del tejido epitelial como los fibroblastos, ya que brindan resultados más exactos de toxicidad para humanos y no exigen condiciones complejas de crecimiento; se las puede mantener en medio DMEM (Dulbeco’s Modified Eagle’s Medium) a 37 °C en una atmósfera húmeda con 5% de CO2 (Huang et al., 2016). Además, para evaluar cosméticos destinados a la cavidad bucal u otros que presenten el riesgo de ingresar a la misma, se pueden utilizar fibroblastos gingivales, los cuales pueden cultivarse también en el medio DMEM a 37 °C en una atmósfera húmeda con 5% de CO2 (Costa et al., 2019).
Ensayos de fototoxicidad y citotoxicidad
Los ensayos de fototoxicidad evalúan la respuesta fotoinducida cuando una sustancia fotoreactiva es activada por la luz solar produciendo químicos excitados que pueden transferir la energía adsorbida y generar especies reactivas que podrían causar irritación sobre la piel (Reis-Mansur et al., 2019). Se pueden realizar disolviendo la sustancia evaluada en un buffer de fosfato de sodio, analizando el espectro de absorción UV/VIS con un espectrofotómetro y evaluando las especies reactivas de oxígeno formadas (Lee et al., 2017).
Los ensayos de citotoxicidad evalúan la capacidad de un compuesto de ocasionar daño celular. Los efectos citotóxicos se pueden determinar tratando todas las líneas celulares con las mismas dosis durante 48 h, para poder investigar los efectos sinérgicos o antagonistas de los compuestos ensayados (Sevimli-Gur y Yesil-Celiktas, 2019).
Incorporación de antioxidantes en cosméticos
Para incorporar compuestos antioxidantes producidos por microorganismos en cosméticos se inicia con la extracción de estos para luego adicionarlos en la fase oleaginosa de la formulación cosmética (Bianchet et al., 2020). Primero se liberan las sustancias intracelulares mediante métodos físicos, químicos o biológicos y posteriormente, se separan de los desechos celulares (Mussagy et al., 2019). Después se realiza la extracción, que puede utilizar el método Soxhlet, extracción con solventes orgánicos, extracción con maceración, extracción de fluidos supercríticos y subcríticos, extracción asistida por ultrasonido, extracción de líquido presurizado y extracción asistida por enzimas, entre otros, dependiendo de la sustancia que se va a obtener (Saini y Keum, 2018).
Los cosméticos pueden ser una emulsión de aceite en agua o agua en aceite. Por lo general, consisten en emolientes y lubricantes dispersos en una fase de aceite y una fase de agua que contiene agentes emulsionantes y espesantes, perfume, color y conservantes (Sugibayashi et al., 2019). Los compuestos antioxidantes se solubilizan, disuelven o dispersan en la fase de lípidos, o pueden ser incluidos en microcápsulas o liposomas, en dependencia del producto en desarrollo. Posteriormente, se puede optar por la aplicación de diferentes técnicas para homogenizar la emulsión (Yukuyama et al., 2016).
Para homogeneizar la emulsión se puede utilizar el método de alta presión para nanoemulsiones usado en cosméticos, donde la mezcla se dispersa en una solución de surfactante caliente por encima del punto de fusión por agitación a alta velocidad para obtener una pre-emulsión. Luego, la pre-emulsión pasa a través de un homogeneizador de alta presión a altas temperaturas o a temperatura ambiente, dependiendo del método, para obtener la emulsión final (Yukuyama et al., 2016).
CONCLUSIONES
Los microorganismos son fuentes de recursos naturales con gran potencial industrial. Estos recursos han atraído la atención de la industria cosmética para ser utilizados como coadyuvantes con propiedades antioxidantes, es decir, como sustancias capaces de absorber y minimizar los efectos de ROS. La fuente principal de obtención de antioxidantes son las plantas, sin embargo, sus células vegetales pueden presentar desventajas respecto al costo de mantenimiento, biosíntesis limitada de antioxidantes a ciertas zonas o dependencia de interacciones con microorganismos, entre otras.
Por lo anterior, se ha detallado una lista de diferentes tipos de microorganismos que pueden ser fuente de estos compuestos para aplicarlos, no solo en la industria cosmética, sino también en fármacos, suplementos alimenticios, nutraceúticos y en terapias médicas. Existen varias metodologías para evaluar la actividad antioxidante de diferentes tipos de sustancias como el ensayo DPPH, ORAIC o PCL; pero estas pruebas son solo el inicio para poder emplearlas en cosméticos, ya que estos, al ser aplicados directamente sobre células humanas deben pasar por ensayos toxicológicos en líneas celulares de mamíferos o directamente en animales de laboratorio, y así formar parte de la fase lipídica de los cosméticos.
Con esta evidencia sobre la actividad antioxidante de varios compuestos obtenidos de microorganismos acuáticos y terrestres, a futuro, es necesaria la elaboración de estudios sobre la actividad antioxidante de compuestos obtenidos de especies de microorganismos endémicos de diferentes zonas para aprovechar su accesibilidad y potencial en diversas aplicaciones de interés humano; así como de investigaciones sobre la estabilización de estos compuestos, formulación viable para su mantenimiento y la concentración necesaria para desencadenar la actividad biológica esperada.