Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.28 no.1 Bogotá June 2006
CALIDAD BACTERIOLÓGICA DEL AGUA DEL HUMEDAL DE JABOQUE, BOGOTÁ, COLOMBIA
Bacteriological quality of the water of the humedal of Jaboque, Bogotá, Colombia
SARA LILIA ÁVILA DE NAVIA
SANDRA MÓNICA ESTUPIÑÁN-TORRES
Universidad Colegio Mayor de Cundinamarca, Facultad de Ciencias de la Salud, Programa Bacteriología y Laboratorio Clínico. savila@unicolmayor.edu.co; estupinantorres@gmail.com
RESUMEN
Como parte del proyecto “Restauración Ecológica del Humedal de Jaboque, Bogotá, Colombia”, se evaluaron en trece estaciones de muestreo de las zonas no canalizada y canalizada del humedal de Jaboque, las variaciones temporales de la calidad bacteriológica del agua mediante muestreos que correspondieron a los meses de octubre de 2004, enero, marzo y junio de 2005. La técnica utilizada para el recuento bacteriológico del agua fue filtración por membrana, y la identificación de los microorganismos se realizó con pruebas bioquímicas rápidas Crystal BBL y API-20. Los recuentos de los grupos de bacterias aisladas (Aeromonas, Pseudomonas, Clostridium, Coliformes totales y Enterococcus) no mostraron diferencias estadísticamente significativas entre las estaciones que se encuentran en la zona canalizada y las de la zona no canalizada (ANOSIM, test global, R= -0.027, P >0.05). A escala temporal, las muestras recolectadas arrojaron diferencias estadísticamente significativas entre los meses de muestreo (ANOSIM, test global, R=0.511, P<0.05). Para los cinco grupos de bacterias analizados los menores recuentos obtenidos se dieron en el mes de octubre de 2004. Los grupos de mayor abundancia en las aguas del humedal son los coliformes totales, Aeromonas y Pseudomonas, este comportamiento se observa en la zona canalizada como en la no canalizada, y durante los cuatro meses del muestreo. Las aguas del Humedal de Jaboque contienen un alto número de Coliformes totales, por lo tanto, no deben ser usadas para fines de consumo humano y doméstico, agrícola o recreativo.
Palabras clave. Bioindicadores, calidad sanitaria de aguas, bacterias coliformes, humedales.
ABSTRACT
The water sanitary quality was evaluated of Humedal de Jaboque, like part of the project ecological restauration of the Humedal de Jaboque. There were chosen thirteen stations of sampling of the not canalized and canalized zone of the wetland, to evaluate possible temporary changes of the bacteriological quality there were realized four samplings that corresponded to the months of Octubre/2004, January, March and June / 2005. The method used for the microbial counts of the water was membrane filtration; the identification of the microorganisms was realized with rapid biochemical tests API-20 and Crystal BBL. The enumeration of the groups of bacteria (Aeromonas, Pseudomonas, Clostridium, total Coliformes and Enterococcus) did not show statistically significant differences between the stations that are in the canalized zone and those of the zone not canalized (ANOSIM, global test, R =-0.027, P> 0.05). To temporary scale the samples threw statistically significant differences between the months of sampling (ANOSIM, global test, R=0.511, P <0.05). For five groups of bacteria analyzed the minor obtained enumeration they happened in October, 2004. The groups of major abundance in the waters of the wetland are the total coliformes, Aeromonas and Pseudomonas, this behavior is observed both in the canalized zone and in the not canalized one, and in 4 months of the sampling, therefore, these three bacterial groups might be considered to be indicators of the sanitary quality of the water. The waters of Humedal de Jaboque contain a hight number of total Coliformes therefore they must not be used for human and domestic use, agricultural or recreative consumption.
Key words. Bioindicators, water sanitary quality, coliform bacteria, wetlands.
INTRODUCCIÓN
La reducción y la fragmentación de los sistemas hidrológicos, por la construcción de canales perimetrales de recolección de aguas lluvias y negras, han aumentado la velocidad de evacuación en el humedal de Jaboque. A esto se suma la colmatación de su lecho por la carga orgánica, las basuras y los desechos de construcción y ocasionalmente recibe las crecientes producidas por las lluvias, convirtiéndose en un elemento amortiguador importante. Los agentes patógenos transmitidos por el agua constituyen un problema mundial que demanda un urgente control implementando medidas de protección ambiental a fin de evitar el aumento de las enfermedades relacionadas con la calidad del agua (Vargas 1996). Cuando se utiliza como medio de eliminación de excretas y otros desechos orgánicos, el agua se convierte en un vehículo de transmisión de numerosos microorganismos, principalmente bacterias de origen intestinal. Es por esta razón que el control sanitario se realiza en función de la presencia de este tipo de bacterias.
Desde el punto de vista bacteriológico, el examen de la calidad sanitaria del agua tiene por objetivo determinar la presencia de ciertos grupos de bacterias, que revelen una contaminación por materia fecal o por materia orgánica. Derivado de las consideraciones anteriores, se planteó como objetivo evaluar la calidad sanitaria de las aguas del Humedal de Jaboque a partir de los indicadores de aguas residuales (Coliformes totales y Enterococcus) y otros grupos bacterianos como Pseudomonas, Aeromonas y Clostridium.
MATERIALES Y MÉTODOS
Toma de muestras y recuento de microorganismos
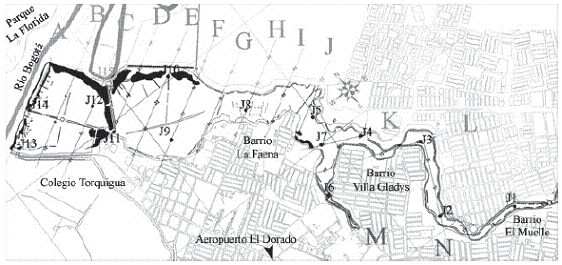
Se eligieron trece estaciones para la toma de muestras de agua superficial, que corresponden a los siguientes puntos de la grilla de trabajo del Humedal de Jaboque (Figura 1): A3, B10, C13, D19, E23, G30, H36, J42, J44, L47, L51, L52, 59. Las estaciones A3, B10, C13, D19, E23, G30, H36 y J42 corresponden a la zona no canalizada del Humedal y las restantes a la zona de adecuación de canales perimetrales para recolección de aguas lluvias. La obtención de las muestras se realizó teniendo en cuenta la guía para la toma de muestras de agua del Ministerio de Salud de Colombia (Decreto 475 de 1998) y las recomendaciones de Andreu & Camacho (2002). Para evaluar posibles variaciones temporales de la calidad microbiológica se realizaron cuatro muestreos que correspondieron a los meses de octubre/2004, enero, marzo y junio/ 2005.
Figura 1. Grilla de trabajo. Estaciones para la toma de muestras de agua superficial. (J1: 59, J3: L52, J4: L51, J5: J42, J6: L47, J7: K44, J8: H36, J9: G30, J10: E23, J11: D19, J12: C13, J13: B10, J14: A3)
Se realizó el recuento de UFC/100 ml por el método de filtración por membrana (Sartorius 1997), para coliformes, Aeromonas, Enterococcus, Pseudomonas y Clostridium, en los siguientes medios de cultivo: bacterias coliformes y E. coli medio Endo-NPS (Millipore), incubación a 37ºC durante 24 horas en atmósfera aerobia (US-EPA 2001), para Aeromonas se utilizó el Agar dextrina-ampicilina con vancomicina (Merck), incubación a 37ºC durante 24 horas en atmósfera aerobia (US-EPA 2001), para el recuento de Enterococcus se utilizó medio Azida-NSP (Millipore) incubación a 37ºC durante 48 horas en atmósfera aerobia (Slanetz y Bartley 1957), para Pseudomonas medio Cetrimide-NPS (Millipore) incubación a 37ºC durante 48 horas en atmósfera aerobia (United States Pharmacopeia XXIII 1995) y para Clostridium se usó el agar Sulfadiacina polimixina sulfito – SPS (Merck), incubación a 37ºC durante 48 horas en anaerobiosis (Angeloti et al. 1962).
La identificación de los microorganismos aislados se realizó por medio de pruebas bioquímicas rápidas Crystal BBL y API-20, para Enterobacterias, bacterias Gram positivas y Anaerobios, que en 24 horas permiten obtener la ubicación taxonómica de los microorganismos aislados, sin determinar características fisiológicas (Koneman et al. 1999).
Pruebas estadísticas
La prueba utilizada para determinar la existencia de diferencias estadísticamente significativas entre los valores de similitud entre los grupos de muestras (Factores espacio-temporales: zona-estaciones de la zona canalizada y no canalizada- y Mes de muestreo) fue un Análisis de Similitud (análisis of similarities-ANOSIM- PRIMER 5.0), esta técnica es análoga a ANOVA, la cual es utilizada para estadística univariada (análisis de varianza) (Clarke & Warwick 2001). Para observar posibles diferencias entre las diversidades obtenidas se aplicó una prueba ANOVA (análisis de varianza-1 vía) con los índices de Shannon (1949 en Ramírez & Viña, 1998; Donato et al. 1996) obtenidos en cada una de las estaciones y meses de muestreo.
Se determinó el porcentaje de grupos (bacterias) que contribuyen al promedio de similitud dentro de los factores (meses y zonas) y el promedio de disimilitud entre estos (SIMilarity PERcentages –SIMPER-, PRIMER 5.0). Se realizaron dendogramas (aglomeración por ligamiento promedio) para combinar la información proporcionada por la técnica de escalamiento multidimensional no métrico (NMDS), a partir de las matrices de similitud mediante el Índice de Bray-Curtis entre muestras (estaciones y meses-matrices tipo Q-) y recuentos bacterianos (variables-matrices tipo R-).
RESULTADOS
Recuentos de los grupos de bacterias aisladas:
Los recuentos de los grupos de bacterias aisladas (Aeromonas, Pseudomonas, Clostridium, Coliformes totales y Enterococcus) no mostraron diferencias estadísticamente significativas entre las estaciones que se encuentran en la zona canalizada y las de la zona no canalizada (ANOSIM, test global, R= -0.027, P >0.05) (Tabla 1). El valor de R sin embargo, menor a 0, denota que existen diferencias entre las estaciones dentro de cada una de las zonas (Clarke & Warwick 2001) y entre las estaciones.
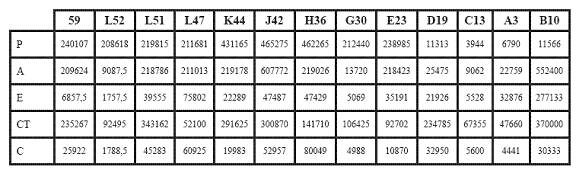
Tabla 1. Promedios de los recuentos de los grupos de bacterias aislados en cada estación en el muestreo (P: Pseudomonas; A: Aeromonas, E: Enterococcus, CT: Coliformes totales, C: Clostridium)
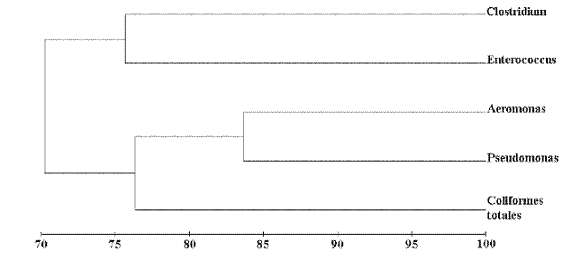
De acuerdo con el dendograma de asociación entre grupos, se observa que los recuentos obtenidos para Pseudomonas y Aeromonas con un 84% de similitud. Aproximadamente con un 24% de disimilitud se formaron dos grupos, uno por los recuentos obtenidos de Clostridium y Enterococcus que presentaron las menores abundancias a lo largo de todo el estudio y otro por Aeromonas, Pseudomonas y Coliformes totales que mostraron las mayores abundancias. De todas formas el porcentaje de similitud entre los cinco grupos de bacterias aislados muestra un valor alto (70%) (Figura 2).
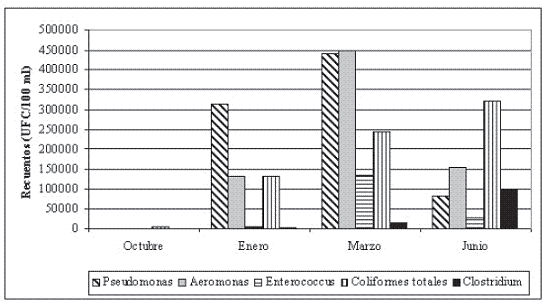
Figura 2. Variación temporal de los recuentos promedio para cada uno de los meses de muestreo.
A escala temporal las muestras recolectadas arrojaron diferencias estadísticamente significativas entre los meses de muestreo (ANOSIM, test global, R=0.511, P<0.05); las menores abundancias corresponden a octubre y se van incrementando durante enero, marzo y junio (Figura 3). El valor de stress obtenido (0.08, 976 reiteraciones) <0.1 indica una buena ordenación de las muestras permitiendo una acertada interpretación del análisis (Clarke & Warwick 2001).
Figura 3. Dendograma de asociación de los grupos de bacterias aislados en el Humedal de Jaboque.
En la prueba pareada entre los meses de muestreo, los recuentos fueron significativamente diferentes entre casi todos los meses (ANOSIM, P<0.008), excepto para marzo con los meses de junio y de enero (ANOSIM, P>0.008). La mayor disimilitud entre meses, de acuerdo con los valores de R para las pruebas pareadas (Clarke & Warwick 2001), se encuentra ente octubre-marzo (R=0.928) y octubre-junio (R=0.914) (Figura 3).
DISCUSIÓN
En general, se aprecia un alto número de Coliformes totales en todo el cuerpo de agua estudiado, a manera de referencia, se presentan algunos datos tomados de la Norma Colombiana que reglamenta el uso del agua y los criterios de calidad para la destinación de este recurso (Decreto 1594/1984). Los criterios de calidad admisibles para la destinación del agua para consumo humano y doméstico que requieren para su potabilización tratamiento convencional, indican que este recurso no debe tener más de 20.000 microorganismos/100 ml de coliformes totales. Si el agua va a ser utilizada para uso agrícola (situación que ocurre en el humedal), el número de Coliformes totales no debe ser mayor a 5000 microorganismos/100 ml; para fines recreativos mediante contacto primario se aceptan hasta 1000 microorganismos/100ml y hasta 5000/100 ml si el contacto es secundario. Por tanto, según lo expuesto, el agua del humedal de Jaboque no debería ser utilizada para ninguno de los fines anteriormente mencionados.
Dentro de las patologías que pueden ser causadas por este grupo de bacterias coliformes se encuentran entre otras síndrome urémico hemolítico, gastroenteritis, bacteremia, infecciones (urinaria, del tracto respiratorio bajo, de piel y tejidos blandos, intraabdominales y oftálmicas), intoxicación alimentaria, meningitis neonatal y septicemia. (Brooks et al. 2005).
Otro de los indicadores utilizados en este estudio corresponde al grupo de los Enterococcus, el hecho de encontrar estos microorganismos en todos los muestreos, coincide con lo reportado por Godfree et al. (1997), quienes aseguran que presentan una mayor resistencia frente a los factores de estrés ambiental como la temperatura y el pH, a diferencia de las bacterias coliformes. Su presencia se ha asociado a contaminación fecal de origen humano y animal (Prescott et al. 1999). En este cuerpo de agua, la presencia de este grupo de bacterias podría relacionarse con la población de aves (patos), mamíferos (vacas, perros, gatos, caballos, roedores) y otras especies animales que se encuentran en varios sitios del Humedal. Se ha demostrado en algunos estudios que la presencia de animales puede afectar la calidad bacteriológica de las aguas (Namihira-Santillán et al. 2002), así como la entrada de aguas servidas por las conexiones erradas.
El estudio también incluyó al grupo de las Aeromonas ya que su número aumenta por la contaminación con aguas residuales, aun cuando estas bacterias no pueden considerarse de origen fecal (Monteil & Harf-Monteil 1997). En algunos casos, el recuento de Aeromonas fue mayor que el de Coliformes totales, resultado que indicaría la utilidad de las Aeromonas en la valoración de los fenómenos de contaminación, como lo señalaron Araujo et al. (1989), quienes encontraron correlaciones significativas entre las Aeromonas, los Coliformes totales y la concentración de materia orgánica, medida como demanda biológica de oxígeno. Así mismo, otros investigadores han propuesto utilizar la Aeromonas hydrophila como indicador del estado trófico (Rippey & Cabelli 1989). En Colombia, se evaluó la presencia de A. hydrophila en ambientes acuáticos y se determinó que su uso como indicador del estado trófico es prometedor (Canosa & Pinilla 1998). Estos microorganismos son habitantes normales de fuentes de agua y pueden estar presentes en alto número en agua dulce en presencia o ausencia de contaminación fecal (Rippey & Cabelli 1989), como efectivamente se encontró en las aguas de Jaboque. Es frecuente encontrar un alto número en aguas de desecho, pero se encuentran especies diferentes a las que están presentes en agua dulce (Rippey & Cabelli 1989).
Se ha propuesto (Rippey & Cabelli 1989, Canosa & Pinilla 1999) una evaluación del grado de eutrofización basado en el que la densidad de Aeromonas ml-1, Canosa & Pinilla (1999) señalan los siguientes datos del estado trófico para cuerpos de agua en Colombia: Oligotrófico <1500 UFC/100 ml-1, oligo-mesotrófico 1510-6500 UFC/100 ml-1, mesotrófico 6510-32500 UFC/100 ml-1, meso-eutrófico 32600-57500 UFC/100 ml-1, eutrófico 57600-340000 UFC/100 ml-1 e hipereutrófico >340000 UFC/100 ml-1. Si comparamos los resultados del presente estudio con los valores anteriores, podemos observar que en el humedal existen estaciones con diferentes grados de eutrofización así: Las estaciones A3, C13 y D19 pueden ser consideradas como mesotróficas, con un recuento promedio de 19098 UFC/100 ml, las estaciones 59, G30, L52 y L47 con un recuento promedio de 110861 UFC de Aeromonas /100 ml, serán consideradas eutróficas y estaciones L51, E23, K44, H36, J42 y B10 con un recuento promedio de 339264 UFC de Aeromonas /100 ml podrán ser catalogadas como muy cercanas a la hipereutrofia.
El comportamiento similar al de las Aeromonas, se observa en el grupo de las Pseudomonas como indicadoras del estado trófico, ya que muestran un aumento en las estaciones con altos niveles de nutrientes y carga orgánica (L51, E23, K44, H36, J42) y los recuentos disminuyen en la zona no canalizada del humedal (estaciones A3, C13, D19 y B10), situación similar se mencionó en el estudio de Canosa & Pinilla (1995).
Estas bacterias normalmente aisladas de los pacientes con gastroenteritis (Montiel & Harf-Montiel 1997), también se asocian con infecciones de ojos, heridas, tracto respiratorio, e infecciones sistémicas (Janda & Duffey 1988); la mayoría de las cuales se producen por el contacto con aguas ricas en Aeromonas. No se deben ignorar los riesgos potenciales que para la salud pública implican los resultados encontrados. P. aeruginosa es una bacteria que no se considera autóctona del agua, puede derivar de heces humanas y animales, su detección en agua se asocia con contaminación por descarga de aguas residuales, por lo tanto hay una estrecha correlación de su presencia en ambientes acuáticos con fenómenos de contaminación (De Vicente et al. 1991). Este microorganismo crece en muy baja concentración de nutrientes en medio ambiente acuoso y puede sobrevivir durante muchos meses en aguas a temperatura ambiente, es un importante patógeno oportunista y es causa de una amplia variedad de infecciones, especialmente de oídos, ojos y piel y su control en aguas destinadas a la recreación es una obligación en varios países del mundo (Moore et al. 2002).
Otro de los géneros estudiados abarcó el grupo de los Clostridium, los cuales se encuentran en suelos y aguas tropicales en concentraciones bajas, pero pueden incrementarse a niveles significativos cuando existe contaminación fecal. Estos microorganismos están asociados a coliformes totales y fecales en aguas contaminadas (Fernández et al. 2001). Las características de resistencia del Clostridium permiten establecer que la contaminación de las aguas es anterior (Edberg et al. 1997 en Fernández et al. 2001). De acuerdo con lo mencionado por Byamukama et al. (2005), en ambientes con baja variación física el uso simultáneo de E. coli y Clostridium permite diferenciar si la contaminación fecal es reciente o antigua. En el presente estudio los recuentos de Clostridium fueron bajos en relación con los Coliformes totales, lo cual indica que en el humedal existe contaminación fecal antigua que se ha hecho constante en el tiempo.
Estos microorganismos causan una amplia gama de enfermedades, entre las que se encuentran endocarditis, abscesos, enterocolitis necrotizante en niños, infección de picaduras y otitis media, diarrea, gangrena gaseosa, tétano, síndrome urémico hemolítico, infección de tejidos blandos y edema maligno (Brooks 2005). En animales el Clostridium sordellii produce enterotoxemias en bovinos, ovinos y caprinos (http://santaelena.com.uy/imgnoticias/2101.pdf).
Para los cinco grupos de bacterias analizados los menores recuentos obtenidos se dieron en octubre de 2004, época de lluvias con una precipitación de 170 mm, desafortunadamente no se tienen los datos de precipitación correspondientes al año 2005, por lo que no se pueden correlacionar los recuentos obtenidos durante este periodo con esta variable.
En general, los recuentos promedio de todos los microorganismos estudiados durante el período de muestreo, para cada una de las estaciones se agrupan en zonas de menor abundancia de microorganismos (A3, C13 y D19), de abundancia media (59, G30, L52 y L47) y de mayor abundancia (L51, E23, K44, H36, J42 y B10). Llama la atención que el punto B10 localizado en la zona conservada del humedal y que recibe las aguas del canal Marantá, presenta un alto recuento bacteriano en todos los microorganismos estudiados, mientras que este comportamiento no se observa en los puntos adyacentes.
Otras bacterias aisladas:
Durante este estudio se identificaron además de las bacterias mencionadas anteriormente, otros microorganismos que pertenecen a los grupos indicadores de contaminación. No se encontró ninguna asociación entre las especies aisladas en cada una de las estaciones, éstas difieren durante todo el estudio:
• Acinetobacter iwoffi produce infecciones del tracto respiratorio, urinario y de heridas, sepsis, abscesos y meningitis. (Brooks et al. 2005).
• Actinomyces meyeri es causante de infecciones respiratorias e infecciones de heridas (Brooks et al. 2005).
• Bacillus licheniformis contribuye al ciclaje de nutrientes y tiene actividad antifúngica (http://www.epa.gov/pesticides/biopesticides/ingredients/factsheets/factsheet_006492.htm).
• Bacillus sphaericus usado para el control de vectores de enfermedades tropicales (anopheles) (Blanco et al. 2002).
• Bacillus subtilis causa endoftalmitis (Romero et al. 2003) y es usado para la producción de bacitracina (Azevedo et al. 1993).
• Burkholderia cepacia produce enfermedades en plantas y humanos. (Brooks et al. 2005).
• Corynebacterium genitalium causa uretritis no especifica (Coppola & Turnes 1985).
• Corynebacterium renale es productor de prostatitis ulcerativa en ovejas (Loste et al. 2005).
• Eubacterium lentum es causa de sinusitis (Moon & Lin 1986), colitis ulcerativa, infecciones en cabeza, cuello y odontológicas (Kamma et al. 2001).
• Eubacterium limosum, es un microorganismo acetogénico (Hur & Raffi 2000).
• Flavimonas oryzihabitans produce rash papular hemorrágico (Kansouzidou et al. 2000) bacteremia, sinusitis, meningitis, endoftalmitis, empiema pleural (Oian & Wang 2001).
• Flavobacterium odoratum causa celulitis (Bachman et al. 1996) y bacteremia (Spanik et al. 1998).
• Hafnia Alvei ocasiona diarrea (Seral et al. 2001).
• Helcococcus kunzii produce abscesos (Riegel & Lepargneur 2003).
• Lactococcus garvieae es un patógeno de peces (Park et al. 1997) y produce mastitis en vacas y búfalos (Vela et al. 2000).
• Lactococcus lactis es usado en la fabricación de quesos (Ryan et al. 1996).
• Morganella morganii causa infecciones del tracto urinario e infecciones extra intestinales en humanos (Brooks et al. 2005).
• Pantoea agglomerans es patógeno de plantas (Amellal et al. 1998).
• Peptostreptococcus anaerobius causa enfermedades en perros y gatos (Dow et al. 1988), y enfermedad periodontal en humanos (Lopez et al. 2004).
• Peptostreptococcus magnus produce meningitis y endocarditis (Bassetti et al. 2003).
• Staphylococcus cohnii ssp cohnii causa endocarditis y septicemia (Gauduchon et al. 2003).
• Serratia fonticola produce abscesos (Bollet et al. 1991).
• Serratia liquefaciens ocasiona infecciones oculares (Brooks et al. 2005).
• Serratia marcescens produce olor a orina (trimetilamina) (Unemoto et al. 1996) produce fascitis necrotizante (Curtis et al. 2005).
• Serratia odorifera. Produce un fuerte olor a papa húmeda (2-methoxy-3-isopropyl-pyrazine) (http://www.pureaircontrols.com/glossary.html#BS).
• Staphylococcus felis es patógeno en gatos, produce otitis, abscesos, dermatitis, infección de heridas, conjuntivitis y cistitis (http://www.bacterio.cict.fr/bacdico/ss/staphfelis.html).
• Yersinia enterocolitica causa gastroenteritis aguda, enterocolitis, linfadenitis mesentérica e ileítis terminal (Brooks et al. 2005).
En las aguas del humedal de Jaboque se identificó una gran variedad de microorganismos, que muestran la diversidad bacteriana y brindan información para su posible utilización en el campo de la biotecnología y la indicación biológica (Eubacterium limosum, es un microorganismo acetogénico, Lactococcus lactis es usado en la fabricación de quesos), y de interés sanitario pues afectan la salud humana y la de otros organismos que utilizan el recurso hídrico. Acinetobacter iwoffi produce infecciones del tracto respiratorio, urinario y de heridas, sepsis, abscesos y meningitis, Burkholderia cepacia produce enfermedades en plantas y humanos, Pantoea agglomerans es patógeno de plantas, Lactococcus garvieae es un patógeno de peces y produce mastitis en vacas y búfalos.
Se sugiere realizar estudios epidemiológicos en la zona de influencia del Humedal donde con la aplicación de metodologías adecuadas, se pueda establecer la relación causa / efecto, de la enfermedad diarreica aguda (EDA) y la infección respiratoria aguda (IRA) entre otras, señaladas con mayor frecuencia en el informe de morbi-mortalidad del Hospital de Engativá (Bogotá).
Es importante que sea considerada la inclusión de las Aeromonas y Pseudomonas aeruginosa en la norma de calidad sanitaria del agua para los diferentes usos, especialmente las destinadas a consumo humano y recreación (humedales, ríos, lagos, embalses, aguas costeras).
Es indispensable identificar las conexiones erradas de los barrios que colindan con el sistema y que conducen las aguas servidas hacia la zona canalizada del Humedal, ya que éstas están ingresando sin previo tratamiento y son perjudiciales en términos ecológicos y sanitarios. Se requiere realizar un mantenimiento exhaustivo y permanente a los canales perimetrales para facilitar el flujo normal de las aguas que alimentan el sistema, y evitar que se conviertan en un foco de contaminación abierto. Los niveles de indicadores bacteriológicos encontrados en el humedal, son señales de alerta que deben movilizarnos a todos, pues seguir por las vías de nuestras indolencias y explotaciones imprudentes, sólo nos llevará a previsibles daños ecológicos y sociales.
AGRADECIMIENTOS
Las autoras expresan sus agradecimientos a la Universidad Colegio Mayor de Cundinamarca y a J. Orlando Rangel Ch., del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, por su apoyo en el desarrollo de este trabajo. Agradecemos a Mireya Arcos Pulido por el análisis estadístico de los datos obtenidos en el presente estudio.
LITERATURA CITADA
1. Amellal, N., G. Burtin, F. Bartoli & T. Heulin. 1998. Colonization of wheat roots by an exopolysaccharide-producing pantoea agglomerans strain and its effect on rhizosphere soil aggregation. Appl. Environ Microbiol. 64: 3740-3747. [ Links ]
2. Andreu, E. & A. Camacho. 2002. Recomendaciones para la toma de muestras de agua, biota y sedimentos en humedales Ramsar. Ministerio del Medio Ambiente, Dirección General de Conservación de la Naturaleza, Secretaría General del Medio Ambiente, Madrid. [ Links ]
3. Araújo R. M., R. Arribas, F. Lucena & R. Pares. 1989. Relation between Aeromonas and fecal coliforms in fresh waters. J. Appl. Bacterial. 67: 213-217. [ Links ]
4. Azevedo E. C., E. M. Rios, K. Fukushima & G. M. Campos-Takaki. 1993. Bacitracin production by a new strain of Bacillus subtilis. Extraction, purification, and characterization. Appl. Biochem. Biotechnol. 42: 1-7. [ Links ]
5. Bachman K. H., D. L. Sewell & I. J. Strausbaugh. 1996. Recurrent cellulitis and bacteremia caused by Flavobacterium odoratum. Clin. Infect. Dis. 22: 112-113. [ Links ]
6. Bassettti S., G. Laifer, G. Goy, U. Fluckiger & R. Frei. 2003. Endocarditis caused by Finegoldia magna (formerly Peptostreptococcus magnus): diagnosis depends on the blood culture system used. Diagn. Microbiol. Infect. Dis. 47: 359-360. [ Links ]
7. Blanco S., E. Colombi, L. Florez & D. Canales. 2002. Aplicación del biolarvicida Bacillus sphaericus-2362 (GRISELESF) para el control de la Malaria en un área de salud de la República de Honduras. Rev Cubana Med Trop. 54: 134-141. [ Links ]
8. Bollet, C., M. Gainnier, J. Sainty, P. Orhesser & P. De Micco. 1991. Serratia fonticola isolated from a leg abscess. J Clin Microbiol. 29: 834-835. [ Links ]
9. Brooks G. F., J. S. Butel & S. A. Morse. 2005. Microbiologia médica de Jawetz, Melnick y Adelberg. Manual Moderno, México. [ Links ]
10. Byamukama D., R. Mach, F. Kansiime, M. Manafi, A. Farnleitner. 2005. Discrimination efficacy of fecal pollution detection in different aquatic habitats of a high-altitude tropical country, using presumptive coliforms, Escherichia coli, and Clostridium perfringens spores. Appl. Environ. Microbiol. 71:65-71. [ Links ]
11. Canosa, A. 1995. Indicadores bacteriológicos de eutrofización en los embalses de Chuza, Neusa y Tominé, y en la laguna de Chingaza. Fundación Universidad de Bogotá Jorge Tadeo Lozano, Centro de Investigaciones Científicas. Santafé de Bogotá. Colombia. 196 pp. [ Links ]
12. Canosa, A, & G. Pinilla. 1998. Adaptación de un método para el aislamiento de bacterias del grupo Aeromonas hydrophila en aguas dulces. Boletín Ecotrópica, Bogotá. Ecosistemas tropicales. 32: 1-9. [ Links ]
13. Canosa, A. 1999. Aeromonas hidrophila, Plesiomonas shigelloides, Pseudomonas spp and Vibrio spp as bacteriological indicators of eutrophication in Colombian freshwater. Rev. Geotrópica 4: 14-27. [ Links ]
14. Clarke, K. & M. Warwick. 2001. Change in marine communities: An approach to statistical analysis and interpretation. Second Edition. Primer-E Ltd., Reino Unido. [ Links ]
15. Coppola K. M. & G. Furness. 1985. Evaluation of differential media for the identification of Corynebacterium genitalium and Corynebacterium pseudogenitalium (group J K corynebacteria).Can. J. Microbiol.31: 4-32. [ Links ]
16. Curtis C. E., S. Chock, T. Henderson & M. J. Holman. 2005. A fatal case of necrotizing fascitis caused by Serratia marcescens. Am. Surg. 71: 228-230. [ Links ]
17. De Vicente A., J. C. Codina, J. Borrego & P. Romero. 1991. Relationship between Pseudomonas aeruginosa and bacteria indicators in polluted natural waters. Wat. Sc. Tech. 24: 121-124. [ Links ]
18. Donato-Rondon, Ch. 2001. Fitoplancton de los Lagos Andinos del norte de Sudamérica (Colombia), composición y factores de distribución. Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Colección Jorge Álvarez Lleras Nro. 19. Bogotá, Colombia. [ Links ]
19. Dow S. W., R. A Le Couteur., R. A. Henik, R. L. Jones & M. I. Poss. 1998. Central nervous system infection associated with anaerobic bacteria in two dogs and two cats. J. Vet. Intern. Med. 2: 171-176. [ Links ]
20. Edberg S.C., H. Le Clero & J. Robertson. 1997. Natural protection of spring and well drinking water against surface microbial contamination. II. Indicators and monitoring parameters for parasites. Crit. Rev. Microbiol. 23: 179-206. [ Links ]
21. Fernández-Molina M.C., A. Álvarez-Alcántara & M.A. Espigares-García. 2001. Transmisión fecohídrica y virus de la hepatitis A. Higiene y Sanidad Ambiental 1: 8-18. [ Links ]
22. Gauduchon V., L. Chalabreysse, J. Etienne, M. Celard, Y. Benito, H. Lepidi, F. Thivolet-Bejui & F. Vandenesch. 2003. Molecular diagnosis of infecti ve endocarditis by PCR amplification and direct sequencing of DNA from valve tissue. J. Clin. Microbiol. 41: 763-766. [ Links ]
23. Godfree A. F., D. Kay & M. D. Wyer. 1997. Faecal streptococci as indicator of fecal contamination in water. Journal of Applied Microbiology (Symposium Supplement). 83: 110s-119s. [ Links ]
24. Hur H. & F. Raffi. 2000. Biotransformation of the isoflavonoids biochanin A, formononetin, and glycitein by Eubacterium limosum. FEMS Microbiol. Lett. 192: 21-25. [ Links ]
25. Janda J. M. & P. S. Duffey. 1988. Mesophilic aeromonads in human disease: current taxonomy, laboratory identification and infectious disease spectrum. Reviews in Infectious Diseases. 10: 980-987. [ Links ]
26. Kamma J. J., M. Nakou & R. G. Persson. 2001. Association of early onset periodontitis microbiota with aspartate aminotransferase activity in gingival crevicular fluid. J. Clin. Periodontol. 28: 1096-1105. [ Links ]
27. Koneman E., S. Allen, W. Janda, P. Schreckenberger & W. Winn. 1999. Diagnóstico microbiológico. Editorial Médica Panamericana. Bogotá, Colombia 1432 pp. [ Links ]
28. López N. J., S. S. Socransky, I. Da Silva, M. R. Japlit & A. D. Haffaiee. 2004. Subgingival microbiota of chilean patients with chronic periodontitis. J. Periodontol. 75: 717-725. [ Links ]
29. Loste A., J. J. Ramos, L. Garcia, L. M. Ferrer & M. T. Verde. 2005. High Prevalence of Ulcerative Posthitis in Rasa Aragonesa Rams Associated with a Legume-rich Diet. J. Vet. Med. Physiol. Pathol. Clin. Med. 52: 176-179. [ Links ]
30. Ministerio de Salud de Colombia. 1998. Guía para la toma de muestras. Decreto 475 de 1998.
31. Monteil H. & C. Harf-Monteil. 1997. Les infections à Aeromonas. Le Presse Médicale. 37: 1790–1798.
32. Moon T., R. Y. Lin & A. F. Jahn. 1986. Fatal frontal sinusitis due to Neisseria sicca and Eubacterium lentum. J. Otolaryngol. 15: 193-195. [ Links ]
33. Moore J. E., N. Heaney, B. C. Millar, M. Crowe & J. S. Elborn. 2002. Incidence of Pseudomonas aeruginosa in recreational and hydrotherapy pools. Commun. Dis. Public. Health. 5: 23-26. [ Links ]
34. Namihira-Santillán, P., G. Barrera-Escorcia & A. Márquez-García. 2002. Contaminación por bacterias fecales en el Lago Huayamilpas, México D.F. Hidrobiológica 12(2): 129- 136. [ Links ]
35. Oian K. & S. Wang. 2001. Infections caused by Flavimonas oryzihabitans. Chin. Med. J. (Engl). 114: 394-398. [ Links ]
36. Park K.H., S. Matsuoka, T. Nakai & K. Muroga. 1997. A virulent bacteriophage of Lactococcus garvieae (formerly Enterococcus seriolicida) isolated from yellowtail Seriola quinqueradiata. Diseases of Aquatic Organisms. 29: 145-149. [ Links ]
37. Prescott L., J. Harley & D. Klein. 1999. Microbiología. Editorial McGraw-Hill. Madrid, España 1005 pp. [ Links ]
38. Ramírez, A. & G. Viña. 1998. Limnología Colombiana, aportes a su conocimiento. Fundación Universidad Jorge Tadeo Lozano, Bogotá, Colombia. [ Links ]
39. Riegel P. & J. P. Lepargneur. 2003. Isolation of Helcococcus kunzii from a post-surgical foot abscess. Int. J. Med. Microbiol. 293: 437-439.
40. Rippey S. R. & V. J. Cabelli. 1989. Use of thermotolerant Aeromonas group for the trophic classification of freshwaters. Water Research. 23:1107-1114. [ Links ]
41. Romero A. P., I. Méndez, M. Salvat, I. Pujol & F. Ballester. 2003. Chronic Endophthalmitis in Pseudophakic Patients Caused By Bacillus Subtilis. Archivos de la Sociedad Española de Oftalmología N. 2. [ Links ]
42. Ryan M. P., M. C. Rea, C. Hill & R. P. Ross. 1996. An application in cheddar cheese manufacture for a strain of Lactococcus lactis producing a novel broad-spectrum bacteriocin, lacticin 3147. Appl. Environ. Microbiol. 62: 612-661. [ Links ]
43. Sartorius. 1997. Microbiological testing of solid foods by membrane filtration. Publicación. SM-4017-e02067. 20 pp. [ Links ]
44. Seral C., F. J. Castillo, M. T. Llorente, M. Varea, A. Clavel, M. Rubio & R. Gómez-Lus. 2001. The eaeA gene is not found in Hafnia alvei from patients with diarrhea in Aragon, Spain. Int. Microbiol. 4: 81-82.
45. Slanetz, L. C., Bartley. 1957. Numbers of Enterococci in Water, Sewage, and Faeces Determined by the Membrane Filter Technique with an Improved Medium. J. Bact. 74: 591-595. [ Links ]
46. Spanik S., J. Trupl & V. Krecmery. 1998. Nosocomial catheter-associated Flavobacterium odoratum bacteraemia in cancer patients. J. Med. Microbiol. 47: 183. [ Links ]
47. Unemoto T., M. Hayashi & K. Miyaki. 1996. Formation of trimethylamine from DL-carnitine by Serratia marcescens. Biochim Biophys Acta. 121: 220-222. [ Links ]
48. United States Pharmacopeia XXIII, Chapter “Microbial Limit Tests”, 1995. ISBN 0-913595-81-0. United States Pharmacopeial Convention, Inc.
49. U.S. Environmental Protection Agency. 2001. Method 1640: Total Coliforms and Escherichia coli in Water Membrane Filtration Using a Simultaneous Detection Technique. EPA 821-R-02-024.Office of Water, U.S. Environmental Protection Agency, Washington D.C.
50. U.S. Environmental Protection Agency. 2001. Method 1605: Aeromonas in Finished Water by Membrane Filtration Using Ampicillin-Dextrin Agar with Vancomycin (ADA-V). EPA 821-R-01-034. Office of Water, U.S. Environmental Protection Agency, Washington D.C.
51. Vargas C., R. Rojas, & J. Joseli. 1996. Control y vigilancia de la calidad del agua de consumo humano. Textos Completos. CEPIS. Lima, Perú. 27 pp. [ Links ]
Recibido: 13/12/2005
Aceptado: 21/04/2006