Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.28 no.2 Bogotá Dec. 2006
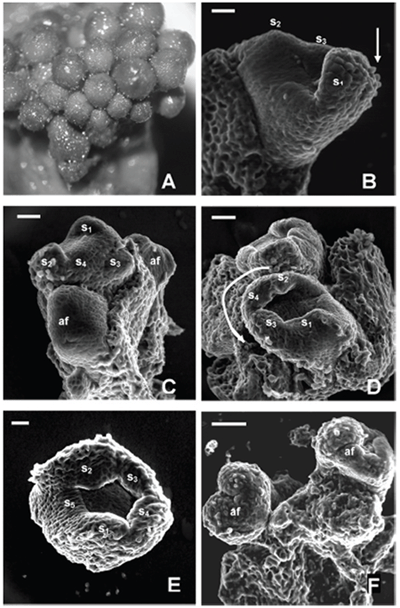
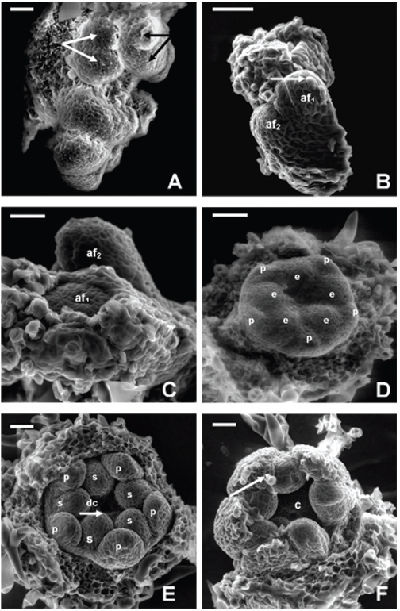
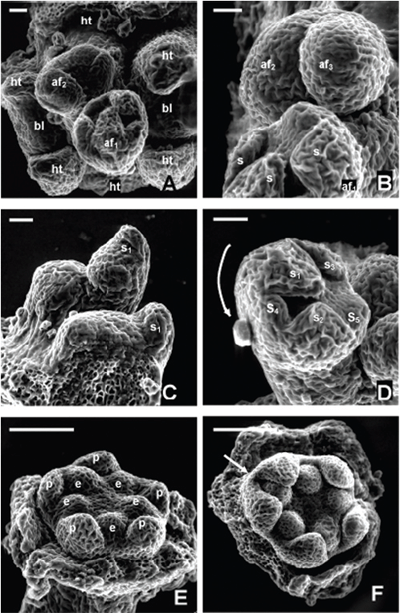
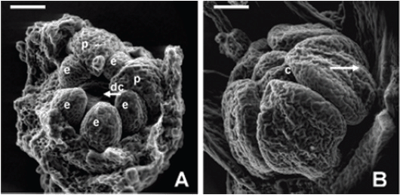
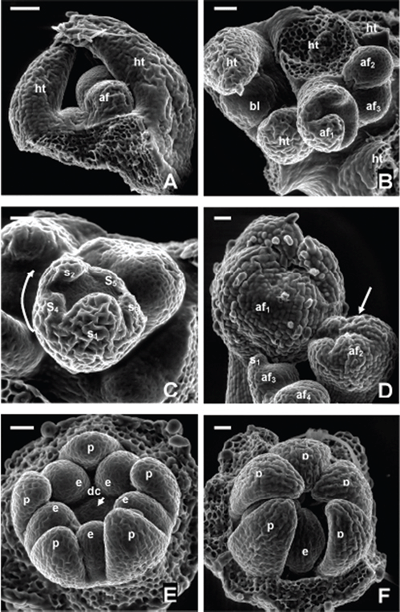
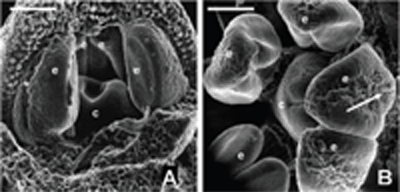
ORGANOGÉNESIS FLORAL EN ACNISTUS ARBORESCENS, DUNALIA SOLANACEA, DEPREA BITTERIANA, LARNAX GLABRA Y LARNAX HAWKESII - TRIBU PHYSALEAE (SOLANACEAE) JAVIER GARZÓN-VENEGAS Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Apartado 7495, Bogotá, D. C., Colombia. njgarzonv@unal.edu.co; ciorozcop@unal.edu.co RESUMEN Se estudió la organogénesis floral en las especies Acnistus arborescens, Dunalia solanacea, Deprea bitteriana, Larnax glabra y Larnax hawkesii de la tribu Physaleae (Solanaceae), empleando microscopía electrónica de barrido en modo ambiental. Para fines de comparación de la organogénesis de las cinco especies, se tuvieron en cuenta tres estados de desarrollo. Las especies estudiadas comparten la secuencia acrópeta en la que surgen sépalos, pétalos, estambres y carpelos, así como el arreglo simultáneo de corola y androceo. Comparten también la simpetalia tardía, siendo aún más tardía en las especies de Larnax. El tiempo de fusión de los pétalos puede considerarse un carácter importante para la diferenciación entre Deprea y Larnax. Se encontraron diferencias intergenéricas en cuanto al arreglo del cáliz, que es simultáneo en Dunalia solanacea, mientras que en Deprea bitteriana y en las dos especies de Larnax es espiralado, en A. arborescens el patrón de desarrollo de los sépalos es intermedio. Los carpelos se desarrollan fusionados basalmente en un estadio temprano, todas las especies son bicarpelares, sin embargo, el gineceo de A. arborescens da la apariencia de ser tricarpelar por la formación de un “falso septo”. Palabras clave. Organogénesis floral, Acnistus, Deprea, Dunalia, Larnax, Physaleae, Solanaceae. ABSTRACT The floral organogenesis of Acnistus arborescens, Dunalia solanacea, Deprea bitteriana, Larnax glabra, and Larnax hawkesii, of tribe Physaleae (Solanaceae) was studied using scanning electron microscopy in environmental mode. Three ontogenetic states were examined to compare the five studied species. These species share the acropetal sequence of sepals, petals, stamens, and carpels development, these also share the simultaneous development of petals, stamens, and the simultaneous arrangement of corolla and androecium. The late sympetaly is another common characteristic share among species but in Larnax species is later. This characteristic is important to consider in the differentiation between Deprea and Larnax. The most notorious intergeneric differences are related to sepals emergence sequence, it is simultaneous in D. solanacea; while is helicoid in D. bitteriana and in the two species of Larnax, and is intermedium between whorled and helicoid in A. arborescens. Carpel primordia are fused in an early development state, all species are bicarpelar but the “false septa” presence in A. arborescens gives the appearance of a tricarpelar gyneceum. Key words. Floral organogenesis, Acnistus, Deprea, Dunalia, Larnax, Physaleae, Solanaceae INTRODUCCIÓN En la propuesta filogenética de Olmstead et al. (1999), la familia Solanaceae incluye siete subfamilias de las cuales Solanoideae es la más grande, comprende once tribus, 64 géneros y 1762 especies. Dentro de Solanoideae se encuentra la tribu Physaleae, con la mayor diversidad genérica dentro de la familia (25 géneros) y en la que se encuentran los cuatro géneros que son objeto del presente estudio: Acnistus (subtribu Iochrominae), Dunalia (subtribu Iochrominae), Deprea (subtribu Withaninae) y Larnax (subtribu Withaninae). Las especies de los géneros estudiados son pequeños árboles, arbustos o hierbas que crecen en Suramérica, especialmente en los bosques húmedos montanos del norte de los Andes con excepción de Acnistus, cuya única especie A. arborescens y Larnax sylvarum se encuentran también en Centroamérica. Estudiando la taxonomía de las especies presentes en Colombia, Garzón & Orozco (en prep.), reportan que de las siete especies de Dunalia sólo una se encuentra en Colombia, D. solanacea Kunth, en Deprea de las cinco especies solamente se encuentran dos, D. orinocencis (Kunth) Ralf. y D. bitteriana (Werderm.) Sawyer & Benítez, mas una posiblemente nueva y, en Larnax de las 25 especies reconocidas, cinco especies están presentes en Colombia, L. darcyana Sawyer, L. glabra (Standl.) Sawyer, L. hawkesii Hunz., L. sachapapa Hunz. y L. sylvarum (Standl. & C. V. Morton) Sawyer. Las especies comparten entre si varias características, como son la acrescencia en mayor o menor grado del cáliz, la presencia de un disco nectarífero en el ovario y la ocurrencia de withanólidos (D´Arcy 1991, Cardona et al. 2005 a, b). He & Saedler (2004), consideran que el rasgo morfológico de la acrescencia presente en varios géneros de Solanaceae (e.g. Physalis), es el resultado de la expresión heterotípica de genes asociados a la organogénesis floral. En la historia taxonómica de estos géneros la delimitación ha sido controversial y actualmente existen aún inconsistencias en algunos de los caracteres usados para la diferenciación entre Deprea y Larnax, como la heterandría que Sawyer (1999), empleó como carácter diagnóstico propio de Larnax, un carácter no observado en todo el rango de distribución de las especies presentes en Colombia. Por otro lado, Garzón & Orozco (en prep.) en el estudio de las especies presentes en Colombia, corroboran la diferenciación de estos géneros en cuanto al grado de fusión de la corola, un carácter diagnóstico previamente propuesto por Sawyer (1999). En el caso de Acnistus y Dunalia, las especies fueron confundidas entre si y con Iochroma de la misma subtribu (Hunziker 1960, 1982). Además del interés taxonómico las especies de estos géneros son importantes por su potencial farmacológico (Echeverri et al. 1991, 1995, Luis et al. 1994). La dificultad en la diferenciación morfológica principalmente entre Deprea y Larnax insta a explorar otras fuentes de caracteres morfológicos como la organogénesis floral. El desarrollo de la tecnología de microscopía electrónica de barrido (MEB), ha facilitado el estudio de la organogénesis, y ha sido foco de atención de botánicos sistemáticos, genetistas y ecólogos de la reproducción. Sin embargo, los estudios de organogénesis son aún limitados especialmente en países en desarrollo, los que a pesar de ser diversos en flora carecen de una disponibilidad ventajosa del microscopio de barrido en relación con países desarrollados. Entre los estudios morfológicos de iniciación y desarrollo floral en solanáceas, la contribución de Huber en 1980 comentada por Endress (1981), es la más completa y considera varios aspectos, entre otros: (1) la posible transposición de unidades monopodiales a simpodiales; (2) los órganos florales en la familia, surgen generalmente en forma verticilada o simultánea, pero también pueden surgir en secuencia espiralada, además indica que la posición de un primordio puede ser influenciada más por el tamaño y ubicación de los órganos inmediatamente contiguos, que por el primordio secuencialmente precedente; y (3) la fusión de los carpelos ocurre en diferentes etapas del desarrollo floral, variando entre especies y ocasionalmente dentro de la especie. Además del trabajo de Huber, vale la pena mencionar otras contribuciones sobre ontogenia floral en Solanaceae como las de Sawhney & Greyson (1972), Chandra & Sawhney (1984) Georgiady & Lord (2002) en Solanum lycopersicum, Hicks & Sussex (1970) en Nicotiana, Gersterberger & Leins (1978) en Physalis y Yang et al. (2002) en Przewalskia y Hyoscyamus. En estos trabajos se describe para la familia un desarrollo en secuencia acrópeta, los sépalos surgen espiraladamente (simultáneamente sólo en Hyoscyamus), mientras que pétalos y estambres se desarrollan siempre en forma simultánea. En el caso de los géneros asiáticos, Przewalskia y Hyoscyamus (Yang et al. 2002), se encuentra variación intergenérica en el tiempo de fusión de los sépalos durante el desarrollo floral. Es importante mencionar el aporte de Ampornpan & Armstrong ( 2002) sobre la disposición oblicua del gineceo en Solanaceae, carácter no observado en su estudio de la ontogenia floral de Salpiglossis. El presente trabajo busca contribuir al conocimiento de la ontogenia floral en la familia Solanaceae, suministrando por primera vez una descripción de la organogénesis floral en algunas especies distribuidas en Colombia, de los géneros Acnistus, Dunalia, Deprea y Larnax. También busca aportar información diagnóstica para la diferenciación intergenérica. MATERIALES Y MÉTODOS Se estudiaron cinco especies pertenecientes a Acnistus, Dunalia, Deprea y Larnax de la tribu Physaleae (Tabla 1). El material utilizado en este estudio fue coleccionado de poblaciones silvestres encontradas en los departamentos de Cauca y Cundinamarca, los ejemplares testigo se depositaron en el Herbario Nacional Colombiano (COL) y en el Herbario de la Universidad de Antioquia (HUA). Para el caso de Dunalia solanacea, especie reconocida como dioica (Sawyer & Anderson 2000), se estudió material proveniente de individuos masculinos cuyos estambres son exertos del tubo de la corola. Tabla 1. Especies de la tribu Physaleae estudiadas Inflorescencias en distintos estadios de desarrollo con botones de menos de 5 mm de longitud, se fijaron en alcohol al 70%, posteriormente se disectaron y se almacenaron en alcohol al 90 %. Los botones florales fueron embebidos en glicerina 12 horas previas al montaje para las observaciones en el microscopio electrónico de barrido, modo ambiental (MEB), posteriormente las muestras se colocaron en porta muestras sobre cintas de carbono adhesivas por ambas caras, los botones fueron cuidadosamente liberados de excedentes de glicerina antes y durante el montaje con hisopos de papel absorbente. El estudio se realizó en el Laboratorio de Microscopía Electrónica del Centro de Equipos Interfacultades de la Universidad Nacional de Colombia (CEIF), en un microscopio electrónico Quanta 200 FEI, en modo ambiental (~18 mbar), a voltajes entre 25 y 30 kV. Las fotografías que acompañan este trabajo se obtuvieron del mismo equipo en formato digital. Se observaron entre cinco y diez botones por cada estado de desarrollo, con excepción del estadio presepalino en D. solanacea, en el que se observaron tres botones. Con el propósito de poder comparar el desarrollo floral entre las especies, se consideraron tres estados de desarrollo, emergencia de los primordios sepalinos, aparición y diferenciación de los primordios petalinos y estaminales y la emergencia y diferenciación de los carpelos. En la discusión se contrastan cada uno de los estadios de acuerdo con los resultados obtenidos. Se hicieron medidas a partir de las fotos obtenidas de MEB teniendo como referencia la escala de las imágenes para encontrar una posible correspondencia entre los diámetros de los botones y los diferentes estadios de desarrollo. RESULTADOS En la literatura no se encontraron investigaciones previas en organogénesis en las que se haya hecho uso del modo ambiental del microscopio electrónico, por tal motivo la metodología aquí usada es una modificación de las convencionales (e.g. Yang et al. 2002). Al usar el microscopio en modo ambiental no es necesario el secado por punto crítico, tampoco la metalización. Sin embargo, se hace necesario mantener las muestras húmedas después de su fijación. El uso de glicerina resultó una buena alternativa para tal propósito. Donald (2003) señala la desventaja de usar el secado por punto crítico cuando se usa alto vacío, por cuanto se afecta notoriamente el tamaño original de las muestras. Otra desventaja del secado por punto crítico es la fragilidad de las muestras después del proceso, mientras que con glicerina se mantuvo la integridad de las mismas. Organogénesis floral en Acnistus arborescens Las inflorescencias se originan a partir de un meristema cupuliforme, posteriormente se organizan en glomérulos muy densos de más de 30 flores en la axila de hojas maduras o directamente sobre ramas lignificadas. Dentro de cada inflorescencia se inician varias flores simultáneamente, sin embargo, las flores jóvenes se encuentran más concentradas en la parte distal de la inflorescencia, lo que indica que su crecimiento es acrópeto (Fig. 1A). Cada botón se desarrolla sin bractéolas acompañantes. Fig. 1. Organogénesis floral en Acnistus arborescens. A. Inflorescencia joven con botones en distintos estadios de desarrollo (foto tomada en estereomicroscopio 30X). B. Ápice floral con el primordio del primer sépalo (s1) formado y con los primordios s2 y s3 emergiendo, la flecha indica la iniciación de tricomas sobre s1. C. Ápice floral con los primordios s1-s3 formados y s4 emergiendo. D. Ápice floral con los primordios s1-s4 fusionados y formando un semianillo. E. Los cinco primordios sepalinos han emergido y forman un anillo. F. El cáliz de dos botones se cierra sobre el centro del receptáculo. Abreviaciones: af, ápice floral; s, primordios sepalinos. Escala de barra: 50 μm (Fig. 1A-E); 100 μm (Fig. 1F). Los distintos órganos florales se desarrollan en secuencia acrópeta, sépalos, pétalos, estambres y carpelos. En un flanco del meristemo se desarrolla el primer primordio sepalino (S1), sobre el cual se inician los primeros tricomas (Fig. 1B). El segundo sépalo (S2) se origina en el extremo opuesto y los sépalos S3 y S4 aparecen entre los dos primeros, en sentido de las agujas del reloj (Fig. 1C). Posteriormente las bases de los cuatro sépalos se conectan basalmente formando un semianillo (Fig. 1D). Finalmente surge el ultimo sépalo (S5), cerrando el anillo (Fig. 1E), cada uno de los cinco sépalos continúan su desarrollo y ocluyen en el centro del ápice floral (Fig. 1F), cubriendo los verticilos internos que apenas empiezan a formarse. La emergencia de los primordios de los cinco pétalos y cinco estambres es simultánea. Los primordios petalinos surgen alternos a los sépalos, mientras que los estaminales opuestos a los sépalos y a alternos con los pétalos (Fig. 2A). Al igual que en todas las especies estudiadas, los primordios petalinos se tornan angulosos diferenciándose de los estaminales que se mantienen redondeados (Fig. 2B), y luego se curvan hacia el centro del receptáculo cubriendo los espacios entre los primordios estaminales (Fig. 2C). En este estadio de A. arborescens se conectan las bases de los pétalos formando una corola simpétala y empieza a observarse la depresión del primordio del gineceo (Fig. 2C). Fig. 2. Organogénesis floral en Acnistus arborescens. A. Primordios petalinos y estaminales emergen simultáneamente. B. Inicio de la diferenciación de pétalos y estambres. C. Los primordios de los pétalos se curvan hacia el centro del ápice floral cubriendo los espacios interestaminales, las bases de los pétalos se conectan y se forma la depresión del primordio de los carpelos. D. Emerge el primordio carpelar de forma anular. E. Se diferencian los dos carpelos y surge un falso septo sobre uno de los carpelos dando la apariencia de un tercer carpelo formado (3), inicio de la diferenciación de los filamentos estaminales. F. Estivación valvar, lóbulos apicales del primordio del gineceo. af, ápice floral; c, primordio carpelar; dc, depresión del primordio carpelar; e, primordios estaminales; fs, falso septo; p, primordios petalinos. A-F sin sépalos, E sin sépalos ni pétalos. Escala de barra: 100 μm. En la fase final de la organogénesis, los dos carpelos se desarrollan simultáneamente a partir de un primordio anular (Fig. 2D), y continúan su crecimiento unidos basalmente manteniendo un surco apical que posteriormente se abre perpendicularmente, formando un “falso septo” sobre uno de los carpelos y dando la apariencia de la formación de un tercer carpelo (Fig. 2E). En el mismo estadio se diferencian los filamentos haciéndose notorios los lóbulos de las anteras. Finalmente, los cinco pétalos se cierran presentando una estivación valvar cubriendo los órganos que internamente continúan su desarrollo. El gineceo se cierra y se hacen evidentes dos lóbulos apicales (Fig 2F). Organogénesis floral en Dunalia solanacea Al igual que en A. arborescens, las inflorescencias de D. solanacea se desarrollan sobre la axila de hojas maduras o sobre el tallo y se organizan en glomérulos densos (Fig. 3A). A diferencia de A. arborescens, en D. solanacea, los botones se organizan en pares (Fig. 3A-C). Fig. 3. Organogénesis floral en Dunalia solanacea. A. Ápices florales en pares. B. Ápices florales (af1-af2), se indican los primeros tricomas. C. Ápice floral con los cinco sépalos formando un anillo. D. Primordios petalinos y estaminales emergen simultáneamente. E. Depresión del primordio de los carpelos, la base de los primordios petalinos aún se mantienen separadas por los primordios estaminales. F. Diferenciación simultánea de los dos carpelos, tricomas sobre la superficie de los pétalos. af, ápice floral; c, primordio carpelar; dc, depresión del primordio carpelar; e, primordios estaminales; p, primordios petalinos. D-F sin sépalos. Escala de barra: 50 μm. Los órganos florales también se desarrollan en secuencia acrópeta. Los primeros tricomas se diferencian antes de la emergencia de los sépalos (Fig. 3B). Los sépalos emergen simultáneamente y forman un anillo cubierto de tricomas en el contorno del ápice floral (Fig. 3C). Posteriormente el cáliz continúa su desarrollo creciendo y cerrándose sobre el centro del receptáculo. El surgimiento de los primordios de los cinco pétalos y cinco estambres es simultáneo como en A. arborescens (Fig. 3D). La formación de la depresión del primordio del gineceo en D. solanacea, ocurre más temprano que en Acnistus, cuando los primordios estaminales igualan en longitud a los primordios petalinos y cuando aún no se conectan sus bases (Fig. 3E). La emergencia de los dos carpelos se presenta cuando los primordios petalinos se curvan y cubren los espacios interestaminales, pero a diferencia de A. arborescens, la fusión basal de los pétalos ocurre más tarde. Como en A. arborescens los dos carpelos se desarrollan unidos basalmente (Fig. 3F), sin embargo, ni en D. solanacea ni en las especies de Deprea y Larnax estudiadas se forma el falso septo. La fusión de los pétalos ocurre cuando se encuentran en contacto los ápices petalinos. La etapa final de la organogénesis ocurre de la misma manera que en A. arborescens, con la excepción que el ápice de los pétalos se encuentran totalmente cubiertos por tricomas. Organogénesis floral en Deprea bitteriana Las inflorescencias se forman en la axila de hojas tectrices a partir de un meristemo apical cupuliforme, del cual emergen acropetamente tres primordios florales (Fig. 4A, 4B). En un flanco del meristemo se forma el primer primordio sepalino (S1) (Fig. 4C). El segundo primordio (S2) aparece en sentido contrario a las agujas del reloj a 135° de la circunferencia del ápice floral, los primordios sepalinos (S3-S5) emergen siguiendo el patrón 2/5 espiral o quincuncial (Fig. 4D). Al igual que en Acnistus arborescens y Dunalia solanacea, los primordios petalinos y estaminales emergen simultáneamente (Fig. 4E). En D. bitteriana y A. arborescens cuando los pétalos se curvan hacia dentro abarcando los espacios interestaminales, se observa el inicio de la fusión de los pétalos y ocurre la depresión del primordio del gineceo (Fig. 4F, Fig. 5A). Fig. 4. Organogénesis floral en Deprea bitteriana. A. Ápices florales (af1 y af2) originados en la axila de hojas tectrices (suprimidas), brotes laterales y sus hojas tectrices. B. Tres ápices florales en distintos estados de desarrollo (af1-af3), los más jóvenes de forma globosa. C. Ápices florales con el primer primordio sepalino (s1). D. Formación de los sépalos en secuencia espiralada y en sentido contrario de las agujas del reloj. E. Primordios petalinos y estaminales emergen simultáneamente. F. Inicio de la fusión de los pétalos. af, ápice floral; bt, brote lateral; e, primordios estaminales; ht, hoja tectriz; p, primordios petalinos; s, primordios sepalinos. F sin sépalos. Escala de barra: 50 μm. Al final de la organogénesis floral los dos carpelos emergen de manera simultánea al igual que en las demás especies y se desarrollan unidos basalmente manteniendo un surco apical. Posteriormente el primordio del gineceo se cierra, se hacen visibles los dos lóbulos del estigma y se observa igualdad en la longitud del gineceo y los primordios estaminales (Fig. 5B). En este estadio también se diferencian los filamentos y los lóbulos estaminales. Fig. 5. Organogénesis floral en Deprea bitteriana. A. Depresión del primordio de los carpelos. B. Gineceo con los dos lóbulos apicales igualando la longitud de los primordios estaminales, los filamentos comienzan a diferenciarse. c, primordio carpelar; dc, depresión del primordio carpelar. A-B sin sépalos ni pétalos. Escala de barra: 100 μm. Organogénesis floral en Larnax glabra y Larnax hawkesii No se observaron diferencias entre la organogénesis floral de L. glabra y L. hawkesii. Se encontraron similitudes en la organogenesis entre las especies de Larnax y D. bitteriana. Las inflorescencias de L. glabra y L. hawkesii se originan en la axila de hojas tectrices, de donde surgen tres a cuatro primordios florales en orden acrópeto (Fig. 6A, B). Fig. 6. Organogénesis floral en Larnax glabra (A, B, D, F) y Larnax hawkesii (C). A. Hojas tectrices protegiendo los ápices florales. B. Ápices florales en distintos estados de desarrollo (af1-af3). C. Formación de los sépalos en secuencia espiralada y en sentido de las agujas del reloj. D. Ápices florales diferentes estados de desarrollo, estivación valvar en af2. E. Primordio carpelar, primordios petalinos de igual longitud a los estaminales F. Bases de los pétalos aún separadas. af, ápice floral; bt, brote lateral; dc, depresión del primordio carpelar; e, primordios estaminales; ht, hoja tectriz; p, primordios petalinos. E-F sin sépalos. Escala de barra: 50 μm. Los sépalos se diferencian en secuencia espiralada, siguiendo el mismo patrón quincuncial, presentado en D. bitteriana, pero en sentido de las agujas del reloj (Fig. 6C). En la figura 6D se observan los sépalos ya diferenciados protegiendo los primordios internos en desarrollo y se inician los primeros tricomas. El surgimiento de los primordios de los cinco pétalos y de los cinco estambres es simultáneo (Fig. 6E). En L. glabra y L. hawkesii la formación de la corola simpetala es más tardía con respecto a las especies de A. arborescens, Deprea bitteriana y Dunalia solanacea. La depresión del primordio del gineceo en las dos especies de Larnax es más temprana que en D. bitteriana y ocurre cuando los primordios petalinos superan ligeramente la longitud de los primordios estaminales (Fig. 6E). Los primordios petalinos se mantienen separados, aún cuando se han curvado y sobrepasan la longitud de los primordios estaminales (Fig. 6F). El desarrollo del gineceo y la finalización de la organogénesis floral en D. bitteriana, L. glabra y L. hawkesii ocurren de manera semejante, sin embargo, los filamentos y los lóbulos estaminales en L. glabra y L. hawkewsii empiezan a diferenciarse antes que el gineceo iguale la longitud de las anteras (Fig. 7A, B). Fig 7. Organogénesis floral en Larnax hawkesii (A) y Larnax glabra (B). A. Sincarpía basal. B. Carpelos sincárpicos, lóbulos apicales visibles, diferenciación de los filamentos y lóbulos estaminales. c, primordio carpelar; e, primordio estaminal; p, primordio petalino. A y B sin sépalos y B sin sépalos ni pétalos. Escala de barra: 100 μm. No se observó un patrón de correspondencia entre los diámetros de los ápices florales y los diferentes estadios de desarrollo, sin embargo, hay que resaltar que a pesar de ser D. solanacea, la especie con la flor más grande entre las especies estudiadas resulta ser la que presenta menor tasa de crecimiento y en la que al finalizar la organogénesis se mantiene más pequeña. DISCUSIÓN Los estudios de organogénesis son importantes desde el punto de vista sistemático, como lo indica Yang et al. (2002) en sus trabajos sobre la posición y las relaciones de parentesco de algunos géneros de Solanaceae, Anisodus, Atropa, Hyoscyamus y Pzelwalzkia. El presente trabajo no tiene implicaciones directas sobre la posición o relaciones de parentesco, sin embargo, los resultados que se presentan aquí, por primera vez en las especies estudiadas, Acnistus arborescens, Deprea bitteriana, Dunalia solanacea, Larnax glabra, y Larnax hawkesii, contribuirán a futuras investigaciones sobre la filogenia en Solanaceae, en donde se consideren géneros o especies diferentes a las estudiadas en la presente investigación. La importancia filogenética de los caracteres de la organogénesis floral se desconoce en taxones relacionados con los aquí estudiados, bien sea en la tribu Physaleae o en las subtribus Iochrominae o Withaninae, por lo tanto cualquier discusión sobre las relaciones de los géneros estudiados estarían por fuera de los alcances de esta contribución. Las características de la organogénesis floral de los géneros estudiados corresponden a un patrón general presente en la mayoría de las angiospermas, no obstante también se encontraron caracteres presentes con mayor frecuencia en Solanaceae y familias relacionadas. El patrón de desarrollo acrópeto de flores e inflorescencias es el más generalizado en angiospermas. Los verticilos emergen siguiendo la regla de Hofmeister, es decir que los nuevos órganos se originan hacia el centro del receptáculo en el primer espacio disponible (Endress 1981, Leins & Erbar 1997). La regla de Hofmeister es más notoria en especies cuyo cáliz presenta arreglo quincuncial, como ocurre en Deprea bitteriana y en las dos especies de Larnax. Otra característica común en la organogénesis de las cinco especies estudiadas, es el arreglo simultáneo de la corola y el androceo, como se ha indicado en otros estudios en Solanaceae (Hicks & Sussex 1970, Sawhney & Greyson 1972, Gersterberger & Leins 1978, Chandra & Sawhney 1984, Georgiady & Lord 2002 y Yang et al. 2002). Las diferencias en la organogénesis floral entre las especies estudiadas, corresponden al orden de emergencia de los sépalos, y a los tiempos de fusión de la corola, gineceo y la diferenciación del androceo. En la mayoría de las angiospermas todos los órganos florales se desarrollan de forma simultánea o en verticilo como se observó en la organogénesis de D. solanacea. De acuerdo con Weberling (1989), en flores pentámeras el desarrollo del cáliz con frecuencia tiene una disposición 2/5-espiral o quincuncial, que corresponde a lo observado en Deprea bitteriana y en las dos especies de Larnax. En Acnistus arborescens se observó un patrón de desarrollo del cáliz que podría parecer intermedio entre el espiralado y el verticilado. De manera similar ocurre en Przewalskia tangulica y en Hyoscyamus niger de la tribu Hyoscyameae (Yang et al. 2002). Es importante mencionar la diferencia en el sentido de orientación de la secuencia de iniciación de los sépalos, encontrada entre Deprea bitteriana y las dos especies de Larnax. En Deprea bitteriana los meristemos sepalinos emergieron en sentido contrario a las agujas del reloj, mientras que en Larnax con frecuencia surgen en sentido opuesto. Organogénesis de la corola y el androceo. La iniciación y el desarrollo de los primordios petalinos y sepalinos se presenta de manera similar en todas las especies, no obstante, se observaron diferencias en el tiempo de fusión de las bases de los primordios petalinos y en los tiempos de diferenciación de los filamentos estaminales. En las especies de Acnistus, Dunalia y Deprea las bases de los meristemos petalinos se conectan en el momento en que estos se han curvado y han cubierto los espacios interestaminales, mientras que en Larnax la corola simpétala se forma, en un estado mas avanzado de desarrollo, cuando los meristemos petalinos se han cerrado totalmente sobre el receptáculo. Esta condición corresponde a los grados de fusión de la corola que caracterizan los estados más avanzados de desarrollo de los géneros, es el caso de las corolas campanulado-infundibuliformes o infundibuliformes de Acnistus, Dunalia y Deprea (lóbulos más cortos o iguales que el tubo) y de las corolas campanuladas en Larnax (lóbulos más largos que el tubo). Características como la simpetalia tardía, la orientación del surgimiento de los primordios sepalinos y el tiempo de diferenciación de los filamentos pueden ser importantes en la delimitación genérica entre Larnax y Deprea. Aunque solamente se estudiaron tres especies, una de Deprea y dos de Larnax, los resultados instan al estudio de la organogénesis en otras especies. Estos caracteres, en especial el tiempo de fusión los pétalos, podrían ser considerados en la definición del concepto de los dos géneros. Organogénesis del gineceo. La familia Solanaceae se caracteriza por la presencia de un gineceo bicarpelar, sin embargo, Acnistus arborescens se diferencia por la formación de un “falso septo” sobre uno de los carpelos, dando la apariencia de un tercer carpelo. Divisiones secundarias se han observado en algunos taxones de las tribus Datureae y Nicandreae (Watson & Dallwitz 1992), también en Trianaea de la tribu Juanulloeae, en donde se registran más de cinco carpelos (Knapp et al. 1997). Algunos estados de desarrollo de la corola y los estambres fueron tomados como puntos de referencia para la comparación del desarrollo del gineceo. Con base en lo anterior se observa que la formación de la depresión del primordio del gineceo en Larnax y Dunalia es más temprana que en Deprea y Acnistus. Iniciación de tricomas. La emergencia tardía o temprana de tricomas sobre los distintos órganos florales en formación es tenida en cuenta en algunos trabajos de organogénesis como el de Chandra & Sawhney (1984) en tomate, quienes tomaron en cuenta la presencia o ausencia de tricomas para caracterizar los estadios de desarrollo. En A. arborescens y D. solanacea la diferenciación de los tricomas ocurre en estadios más tempranos de desarrollo con respecto a las especies de Larnax y Deprea. En el caso de D. solanacea la aparición de los primeros tricomas ocurre antes de la emergencia simultánea de los sépalos. En las dos especies de Larnax la emergencia de tricomas es más tardía, y ocurre cuando los sépalos se han cerrado sobre el receptáculo. AGRADECIMIENTOS Los autores expresan un especial agradecimiento a Fernando Echeverri del grupo de Química Orgánica de Productos Naturales de la Universidad de Antioquia por la financiación del proyecto a través de Colciencias, a Gloria de Pérez del Departamento de Biología y a Marta Guerra del Laboratorio de Microscopía Electrónica por su colaboración en la obtención de las fotografías (ESEM), a Alexandra Hernández, Juan Carlos Granados y Dubán Canal por su colaboración en campo. Queremos expresar un sincero agradecimiento al Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, al Herbario Nacional Colombiano y en especial al profesor Favio González por su asesoría y por proporcionar literatura especializada. También queremos agradecer a las revisoras del artículo Carmen Benítez y Sandra Knapp por sus acertadas recomendaciones y a Diego Giraldo del comité editorial de la revista Caldasia. 1. Álvarez, E.R. 2002. La diversidad de las formas vegetales variaciones sobre un mismo tema. Versión: 7 de enero de 2005, http:// www.ejournal.unam.mx/ciencias/no65/CNS06503.pdf. [ Links ] 2. Ampornpan, L. & J. Armstrong. 2002. Floral Ontogeny of Salpiglosis (Solanaceae) and the oblique gynoecium. Journal of the Torrey Botanical Society 129: 85-95. [ Links ] 3. Brukhin, V., H. Michel, N. González, C. Chevalier & A. Mouras. 2003. Flower development schedule in tomato Lycopersicon esculentum cv. sweet cherry. Sex Plant Reprod. 15: 311–320. 4. Cardona, D., W. Quiñones, F. Torres, I. Vélez, S. Robledo, R. Fonnegra, O. Triana, L. C. Upegui-Gonzalez, C. I. Orozco, R. Torrenegra-G & F. Echeverri. 2005 a. Búsqueda de sustancias antiparasitarias de la flora colombiana. Actualidades Biológicas 27 (Supl. 1): 65-69. [ Links ] 5. Cardona, D., F. Torres, W. Quiñones, S. Robledo, I. Vélez, C. Orozco-P, J. Garzón & F. Echeverri. 2005 b. Estructura y actividad Leishmanicida de Larnaxolida A y B, nuevos withanólidos de Larnax glabra (Standl.) Sawyer. Actualidades Biológicas 27 (Supl. 1): 81-86. [ Links ] 6. Chandra, K.N. & V.K. Sawhney. 1984. A scanning electron microscope study of the development and surface features of floral organs of tomato (Lycopersicon esculentum). Can. J. Bot. 62: 2403-2413. [ Links ] 7. D’Arcy, W.G. 1991. The Solanaceae since 1976, with a review of its biogeography. En J.G. Hawkes, R.N. Lester, M. Nee, & N. Estrada-R. (eds.). Solanaceae III. Taxonomy, Chemistry, Evolution. pp. 35-137. Royal Botanic Gardens, Kew. 8. Donald, A.M. 2003. The use of environmental scanning electron microscopy for imaging wet and insulating materials. Nature materials 2: 511-116. [ Links ] 9. Echeverri, F., F. Torres, G. Cardona, J. López, W. Quiñones, C. Peláez, M. Rojas, F. García & L. Restrepo. 1991. Withajardines: estructura y actividad. Rev. Boliviana Quim. 10 (1): 21-23. [ Links ] 10. Echeverri, F., W. Quiñones, F. Torres, G. Cardona, R. Archbold, J. G. Luis & G. González. 1995. Withajardin E, a withanolide from Deprea orinocensis. Phytochemistry, 40 (3): 923-925. [ Links ] 11. Endress, P.K. 1981. Reproductive structures of flowering plants. En: H. Ellenberg, K. Esser, K. Kubitzki, E. Schnepf, & H. Ziegler (eds). Progress in Botany, fortschritte der Botanik. Vol. 43. pp. 39-48. Springer-Verlag, Berlin. [ Links ] 12. Endress, P.K. 1997. Evolutionary biology of flowers: prospects for the next century. En: K. Iwatsuki & P.H. Raven (eds). Evolution and Diversification of land plants. pp 99-119. Springer-Verlag, Tokio. [ Links ] 13. Erbar, C., & P. Leins. 1997. Different patterns of floral development in whorled flowers, exemplified by Apiaceae and Brassicaceae. Int. J. Plant Sci. 158 (6 Suppl.): 49-64. [ Links ] 14. Georgiady M.S. & E.M. Lord. 2002. Evolution of the inbred flower form in the currant tomato, Lycopersicon pimpinellifolium. Int. J. Plant Sci. 163(4):531–541. 15. Gersterberger, P. & P. Leins. 1978. Rasterelektronemikroskopische untersuchungen an blutenknospen von Physalis philadelphica (Solanaceae). Ber. Dtsch. Bot. Ges. 91: 381-387. [ Links ] 16. He, C. & H. Saedler. 2004. Heterotopic expression of MPF2 is the key to the evolution of Chinese lantern of Physalis, a morphological novelty in Solanaceae. PNAS 102 (16): 5779-5784. [ Links ] 17. Hicks, G.S. & I.M. Sussex. 1970. Development in vitro of excised flower primordia of Nicotiana tabacum. Can. J. Bot. 48: 133-139. [ Links ] 18. Hufford, L., & P.K. Diggle. 1997. The morphology and evolution of flowers: a tribute to the work of Shirley Tucker: an introduction. Int. J. Plant Sci. 158 (6 Suppl.): 1-2. [ Links ] 19. Hunziker A.T. 1960. Estudios sobre Solanaceae II. Sinopsis taxonómica del género Dunalia H.B.K. Boletín de la Academia Nacional de Ciencias Argentina, 41 (2): 211-244. [ Links ] 20. Hunziker A.T. 1982. Estudios sobre Solanaceae. XVII. Revisión sinóptica de Acnistus. Kurtziana 15: 81-102. [ Links ] 21. Knapp, S., V. Persson & A. S. Blackmore. 1997. A phylogenetic conspectus of the tribe Juanulloeae. Ann. Missouri Bot. Gard. 84: 67-89. [ Links ] 22. Luis, J., F. Echeverri & A. G. González. 1994. Acnistins F-H, withanolides from Dunalia solanacea. Phytochemistry, 36 (3): 769-772. [ Links ] 23. Leins, P., & C. Erbar. 1997. Floral developmental studies: some old and new questions. Int. J. Plant Sci. 158 (6 Suppl.): 3-12. [ Links ] 24. Olmstead, R.G., J.A. Sweere, R.E. Spangler, L. Bohs & J.D. Palmer. 1999. Phylogeny and provisional classification of Solanaceae based on chloroplast DNA. En: M. Nee, D.E. Symon, R.N. Lester & J.P. Jessop (eds.). Solanaceae IV. Advances in biology and utilization. pp. 111-137. Royal Botanic Gardens, Kew. [ Links ] 25. Sawhney, V.K. & R.I. Greyson. 1972. On the initiation of the inflorescence and floral organs in tomato (Lycopersicon esculentum). Can. J. Bot. 50: 1493-1495. [ Links ] 26. Sawyer, N.W. 1999. The systematics of Deprea Raf. and Larnax (Miers) Hunz. (Solanaceae). Unpublished Ph.D. dissertation. University of Connecticut, Storrs, Connecticut. [ Links ] 27. Sawyer, N.W. & G. J. Anderson. 2000. Dioecy in South American Deprea (Solanaceae). Biotropica 32 (2): 291-298. [ Links ] 28. Tucker, S.C. 2003. Floral development in legumes. Plant Physiol. 131: 911-926 [ Links ] 29. Watson, L. & M.J. Dallwitz. 1992. The Families of Flowering Plants: Descriptions, Illustrations, Identification, Information Retrieval. Versión: 13 de enero de 2005, http://delta-intkey.com. [ Links ] 30. Weberling, F. 1989. Morphology of flowers and inflorescences. Cambridge University Press, Cambridge. [ Links ] 31. Yang, D-Z., Zhang, Z-Y., Lu, A-M., Sun, K., Liu, J-Q. 2002. Floral organogenesis and development of two taxa in the tribe Hyoscyameae (Solanaceae)-Przewalskia tangutica and Hyoscyamus niger. Acta Botanica Sinica 44 (8): 889-894. [ Links ] Recibido: 08/10/2005
Floral organogenesis in Acnistus arborescens, Dunalia solanacea, Deprea bitteriana, Larnax glabra and Larnax hawkesii- tribe Physaleae (Solanaceae)
CLARA INÉS OROZCO
Los patrones ontogenéticos, especialmente la secuencia de iniciación y posición de los distintos órganos florales en formación, resultan informativos para establecer relaciones filogenéticas a nivel genérico y aún en categorías jerárquicas más inclusivas. (Endress 1997, Erbar & Leins 1997, Leins & Erbar 1997, Yang et al. 2002). Además Hufford & Diggle (1997) y Brukhin et al. (2003), consideran que estos estudios son importantes en la investigación relacionada con los controles moleculares de la morfogénesis floral (modelo ABC). Álvarez (2002) y Tucker (2003) consideran que los estudios en grupos con amplia variación morfológica son aún limitados. 
Endress (1997), Leins y Erbar (1997), señalan que la simpetalia temprana es más frecuente en Eusteride I y la tardía en Eusteride II. En los resultados de previas investigaciones en solanáceas, como los trabajos de Chandra & Sawhnew (1984) en Solanum lycopersicum, Yang et al. (2002) en Hyoscyamus y Pzelwalzkia, entre otros, y en los resultados aquí mostrados, se registra simpetalia tardía. Diferentes grados de simpetalia tardía pueden ocurrir durante la organogénesis como en el caso de las especies de Larnax en donde la simpetalia ocurre más tardíamente que en A. arborescens, D. solanacea y D. bitteriana. Aún se desconoce la ocurrencia de simpetalia temprana en otros taxones de Solanaceae.
LITERATURA CITADA
Aceptado: 24/03/2006