Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.28 no.2 Bogotá Dec. 2006
DIVERSIDAD DE LÍQUENES Y BRIOFITOS EN LA REGION SUBXEROFITICA DE LA HERRERA, MOSQUERA (CUNDINAMARCA-COLOMBIA). I. RIQUEZA Y ESTRUCTURA
Diversity of lichens and bryophytes in the subxerofitic region of La Herrera, Mosquera (Cundinamarca-Colombia). I. Richness and structure
MARIBEL PINZÓN
EDGAR L. LINARES
Departamento de Biología, Universidad Nacional de Colombia, Apartado 7495, Bogotá, D.C., Colombia. bmpinzonb@unal.edu.co
Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Apartado 7495, Bogotá, D.C., Colombia. ellinaresc@unal.edu.co
RESUMEN
Se evaluó la diversidad de líquenes y briófitos de la región subxerofítica de La Herrera, en términos de riqueza y estructura. Los prados fueron el ambiente menos diverso y a su vez menos uniforme para el desarrollo de este tipo de comunidades, mientras que las cañadas y los matorrales fueron los más propicios para el desarrollo de los briófitos. Los líquenes a pesar de ser característicos de los suelos desnudos y las rocas, tuvieron la mejor representatividad en los matorrales, al igual que los mayores valores de uniformidad. Las especies Anomobryum conicum, Calymperes erosum, C. rubiginosum, Campylopus surinamensis, Cephaloziella granatensis, Dicranella hilariana, Fissidens angustifolius, F. zollingeri, Frullania brasilensis, Lophocolea lepthanta, Orthotrichum cupulatum Plagiochila aerea y P. pachyloma son nuevos registros para Cundinamarca.
Palabras clave. Región Subxerofítica de La Herrera, líquenes, briófitos, diversidad alfa.
ABSTRACT
The lichen and bryophyte diversity, in the subxerofitic region of La Herrera is evaluated, in terms of species richness and structure. The grasslands were the less diverse and in turn less uniform, while the gullies and the scrub were the most favorable for the development of the bryophytes. The lichens, in spite of being characteristic of naked floors and rocks, were best represented in the scrub, where they also had the highest values of uniformity. Aomobryum conicum, Calymperes erosum, C. rubiginosum, Campylopus surinamensis, Cephaloziella granatensis, Dicranella hilariana, Fissidens angustifolius, F. zollingeri, Frullania brasilensis, Lophocolea lepthanta, Orthotrichum cupulatum, Plagiochila aerea and P. pachyloma are new records for Cundinamarca.
Key words. Bryophytes, alfa diversity, lichens, subxerofitic region, La Herrera.
INTRODUCCIÓN
A nivel mundial, los líquenes y los briófitos en zonas xerofíticas o subxerofíticas han sido estudiados en Asia, Oceanía (Australia), Norte de África, Norteamérica (Estados Unidos y México) y Suramérica (Chile y Perú), y se han producido diversos niveles de información, desde extensas listas hasta análisis anatómicos, morfológicos, ecológicos o fisiológicos (véanse Rogers & Lange 1971, 1972, Nash et al. 1977, Rogers 1977, 1982, Alpert 1979, Bell 1982, Galum et al. 1982, Lange & Tenhunen 1982, Llimona 1982, Longton 1982, Nash & Mooser 1982, Redon 1982, Rundel 1982, Stark & Castetter 1987).
En Colombia, se han realizado estudios sobre líquenes y briófitos de zonas subxerofíticas en la Sabana de Bogotá, entre 2500 y 3000 m de altitud, al suroccidente, en La Herrera (Pinzón 2000, Pinzón & Linares 2001) y al noroccidente, en Suesca (Cortés 2002), regiones que sufren marcada degradación ambiental por actividades antrópicas relacionadas con la minería, la ganadería, la plantación de especies exóticas y la acumulación de basuras. Los aspectos hasta ahora tratados se relacionan con la composición florística y la distribución general. En total se han registrado 191 especies de líquenes y briófitos, pertenecientes a 92 géneros y 53 familias.
La región subxerofítica de La Herrera, ubicada en el suroccidente de la Sabana de Bogotá, entre 2550 y 2900 m de altitud, es un enclave actualmente sometido a diversas presiones ambientales que comprometen su existencia (Pinzón 2000, Pinzón & Linares 2001, Vera-Ardila 2003, Vera-Ardila & Linares 2005); entre las actividades antrópicas, la extracción de gravas y arenas, con más de 30 canteras a cielo abierto, en cortes verticales que sobrepasan los 200 m, constituye la amenaza más evidente.
La diversidad biológica ha sido definida como “la variabilidad entre los organismos vivientes, así como los complejos ecológicos de los cuales forman parte” (UNEP 1992 en: Moreno 2001). Al estudiar la biodiversidad, es importante aclarar cuál enfoque se sigue, respecto del nivel alfa, beta o gamma, que en su conjunto permiten caracterizar la diversidad a diferentes escalas. La mayoría de los métodos propuestos para evaluar la diversidad de especies, se refiere a la diversidad alfa, la cual puede ser entendida no solo como un proceso evolutivo que se manifiesta en la existencia de diferentes especies en un ambiente particular, sino también como una herramienta que aporta información sobre la abundancia relativa de cada especie, con el fin de identificar aquellas especies, que por su escasa representatividad parecen ser más susceptibles a las perturbaciones ambientales (Moreno 2001).
Puesto que los líquenes y briófitos presentan amplia distribución en La Herrera y son componente importante de las comunidades vegetales (Pinzón 2000) allí desarrolladas, se presenta aquí una aproximación a la diversidad alfa, desde la óptica de la riqueza y la estructura, con base en la evaluación de cinco ambientes característicos de la región: suelos desnudos, rocas (grandes afloramientos rocosos), prados (nativos y exóticos), matorrales y cañadas (cárcavas producto de la erosión).
ÁREA DE ESTUDIO
La región subxerofítica de La Herrera corresponde a un ramal de la sierra que se extiende en sentido SE-NW y que demarca la porción suroccidental de la altiplanicie de Bogotá. Se encuentra localizada en el límite suroccidental de la Sabana de Bogotá y se extiende desde el bajo valle del río Tunjuelo hasta cerca de Bojacá, en un rango altitudinal comprendido entre 2550 y 2900 m de altitud, en jurisdicción de los municipios de Bogotá, Bosa, Soacha, Bojacá, Madrid y Mosquera entre los 04º37’-04º42’ de latitud norte y los 74º14’-74º19’ de longitud occidental (Garavito et al. 1977). De acuerdo con Pinzón (2000) el régimen de lluvias es bimodal con picos en abril-junio y septiembre-octubre, con valores medios, máximos y mínimos de 91,3 mm, 86,5 mm y 0,4 mm, respectivamente. La precipitación media mensual multianual presenta incrementos entre abril-mayo y octubre-noviembre, sin llegar a sobrepasar los 100 mm. Los valores más bajos de precipitación, se registran en enero (22,5 mm) y febrero (31,8 mm), mientras que los máximos valores se registran en abril (85,9 mm) y octubre (91,3 mm). La temperatura media anual es de 13,1ºC, una máxima promedio anual de 16,4ºC y una mínima media anual de 9,7ºC. De acuerdo con los valores medios anuales de temperatura, el mes menos seco es enero con 12,7ºC, mientras que abril y mayo corresponden a los más secos con 13,7ºC cada uno.
La evapotranspiración anual es de 660 mm, con valores mínimos durante los meses de enero (52 mm) y febrero (50,1 mm), mientras que abril (57,1 mm), mayo (58,2 mm) y junio (60,5 mm) corresponden a los meses con valores de evapotranspiración más altos. Los meses de máxima evaporación son enero (109 mm), marzo (106,4 mm) y agosto (101,1 mm), en tanto que los de menor evapotranspiración son mayo (86,1 mm) y junio (82,9 mm). La velocidad del viento oscila entre 1,3 y 1,5 m/sg con máximos en julio (3,2 m/sg) y agosto (3,6 m/sg). De acuerdo con el balance hídrico la región es C2rB’1a’, correspondiente a un régimen semihúmedo (C2), con poca deficiencia de agua (r), mesotermal (B’1) y con concentración baja de calor en la época de verano térmico para el hemisferio norte (a’). Las generalidades sobre los aspectos geológicos y edáficos pueden ser consultados en Garavito et al. (1977). El balance hídrico muestra que los periodos de déficit de agua, coinciden con los periodos de mínima precipitación. No se presenta déficit de almacenamiento y es posible observar un exceso de almacenamiento para los meses de octubre y noviembre.
A continuación se caracterizan sucintamente cada una de las unidades del paisaje (ambientes), en las que se estudió la diversidad de líquenes y briófitos:
Suelos desnudos: Ocupan gran parte del área de estudio. Presentan una topografía que varía desde plana hasta bastante inclinada, con montículos arenosos organizados en grupos, como una serie de lomas rectas a ligeramente curvadas. Son comunes los barrancos suaves y poco profundos hasta bastante inclinados y abruptos, con tendencia a la formación de cárcavas producto de la erosión. En su mayoría los suelos son agrietados, medianamente compactos en la Cuchilla Las Cátedras, hasta levemente compactos en la Cuchilla Mondoñedo, en donde se observan sectores constituidos principalmente por arcillas blancas o por arenas amarillas, rojas o anaranjadas. Este ambiente se encuentra expuesto a procesos denudativos, con erosión acelerada, principalmente de tipo hídrico y eólico, que limita el establecimiento y desarrollo de un significativo número de especies, no sólo de criptógamas sino también de plantas vasculares.
Rocas: Gran parte de la región presenta afloramientos rocosos dispersos, constituidos como enormes conglomerados que varían desde un metro de lado o de alto, hasta enormes moles que alcanzan 15 metros de altura y más de 30 metros de ancho. Estas rocas presentan superficies lisas o fuertemente agrietadas, con hendiduras de diversa profundidad en las que se acumula polvo y proporcionan refugio para algunas plantas vasculares (Polypodium spp., Stelis spp., Epidendrum spp. y gramíneas).
Prados: Se desarrollan sobre extensas áreas planas y semiplanas, en algunos casos con charcos y pantanos temporales, en las que prevalecen plantas vasculares herbáceas de porte pequeño, entre 10 y 20 cm de alto. Domina Selaginella sellowi, acompañada por Evolvulus bogotensis, Stenandrium dulce, Dichondra repens y Lachemilla aphanoides; en zonas medianamente disturbadas Pennisetum clandestinum compite con las especies nativas, incluidas las criptógamas, y limita su desarrollo, mientras que en sitios fuertemente intervenidos los prados nativos son completamente reemplazados por P. clandestinum.
Matorrales: Se extienden desde zonas planas hasta abruptamente inclinadas. En su mayoría se encuentran conformados por arbustos pequeños (1-1,50 m de altura) dominados por Chromolaena leivensis y Salvia bogotensis, acompañadas por Solanum lycioides, Baccharis latifolia, Eupatorium baccharoides, Dodonaea viscosa y Lantana boyacana. En ocasiones se presentan grupos de cardonales de hasta cuatro metros de alto, dominados por Opuntia spp. o de pencas de Furcraea humboldtii.
Cañadas: Se presentan en zanjas de 1 a 4 metros de profundidad, cubiertas de vegetación arbustiva, compuesta principalmente por Baccharis latifolia, Duranta coriacea y Cestrum tomentosum, umbrosas y muy húmedas, con suelos anaranjados con alto contenido de materia orgánica.
MÉTODOS
Se establecieron dos transectos lineales en el gradiente altitudinal 2550-2900 m, a través de la zona más quebrada de la región, en el sector correspondiente al Zanjón de Las Cátedras, cañón formado por las cuchillas Las Cátedras y Mondoñedo. A lo largo de estos transectos se estudió la vegetación de briófitos y líquenes presentes en aquellos ambientes que fuesen tocados por una piola extendida en el gradiente. Para calcular la cobertura de cada una de las especies se utilizaron áreas de 100 o 400 cm2 (Iwatzuki 1960), mediante la utilización de una plantilla de acetato transparente que presenta una trama cuadriculada cada centímetro. En total se realizaron 362 levantamientos (suelos desnudos 64, rocas 78, prados 19, matorrales 94 y cañadas 107).
Para la evaluación de la diversidad alfa se consideró la riqueza específica y la estructura, pues ambos parámetros son complementarios y en su conjunto permiten hacer una mejor interpretación de la diversidad a esta escala. En cuanto a la riqueza de especies se calculó el índice de riqueza específica (S), que consistió en cuantificar el número de especies encontradas en cada uno de los ambientes evaluados; siendo esta la forma mas sencilla de medir la biodiversidad, ya que se basa únicamente en el número de especies presentes, sin tener en cuenta el valor de importancia de las mismas. Se presenta también el número total de familias y géneros registrados para cada ambiente. A partir del registro de las coberturas de cada una de las especies, se evaluó la estructura por medio de dos índices de abundancia proporcional: El índice de Simpson (D) como parámetro de dominancia, y el índice de Shanon-Wiener (H’), como parámetro de uniformidad. El índice de Simpson toma en cuenta la representatividad de las especies con mayor valor de importancia, es decir que esta influido por la importancia de las especies mas dominantes.
Los valores obtenidos con este índice, se consideran inversamente proporcionales a la diversidad, ya que los valores altos de D representan una baja diversidad, mientras que los valores bajos de D se relacionan con un incremento de la misma (Moreno 2001). Respecto al índice de dominancia escogido (H’), se asume que tanto los briofitos como los líquenes fueron seleccionados al azar y que todas las especies estuvieron representadas en la muestra. El índice de Shanon-Wiener (H’), adquiere valores entre cero cuando hay una sola especie y el logaritmo de S cuando todas las especies están representadas (Brower et al. 1997; Moreno 2001). Debido a la gran cantidad de datos registrados en campo, los índices no fueron calculados manualmente, sino por medio del programa PAST-Palaeontological Statistics, ver. 1.12., 2003.
Los ejemplares colectados se encuentran depositados en el Herbario Nacional Colombiano (COL), con duplicados en el herbario de la Pontificia Universidad Javeriana (HPUJ), bajo la numeración de Pinzón. Con base en Churchill & Linares (1995) y Uribe & Gradstein (1998) se establecen los nuevos registros de musgos y hepáticas para Cundinamarca.
RESULTADOS
Riqueza
Las familias más diversas de la región fueron Dicranaceae, Parmeliaceae, Fissidentaceae, Bryaceae, Frullaniaceae, Pottiaceae y Plagiochilaceae. Los géneros más diversos fueron Campylopus, Fissidens, Frullania, Brachythecium, Plagiochila y Leptodontium. Los musgos Anomobryum conicum, Calymperes erosum, C. rubiginosum, Campylopus surinamensis, Dicranella hilariana, Fissidens angustifolius, F. zollingeri y Orthotrichum cupulatum, y las hepáticas Cephaloziella granatensis, Frullania brasilensis, Lophocolea lepthanta, Plagiochila aerea y P. pachyloma, son nuevos registros para Cundinamarca (Anexo 1).
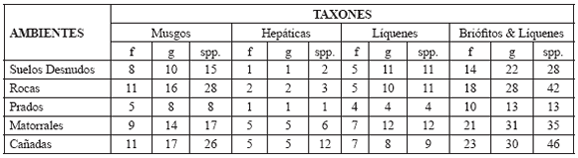
Los resultados de riqueza, respecto de familias, géneros y especies, para los líquenes y los briófitos (musgos y hepáticas) en los cinco ambientes estudiados, muestran que, en general, los prados fue el ambiente con menor riqueza, mientras que en los matorrales y las cañadas la riqueza fue mayor. Por el contrario, las rocas y los suelos desnudos presentaron riqueza intermedia respecto de los anteriores ambientes (Tabla 1).
Tabla 1. Riqueza de familias, géneros y especies de briófitos y líquenes presentes en los distintos ambientes de la región subxerofítica de La Herrera (f = familias, g = géneros, spp. = especies).
Tanto los líquenes cono los briófitos se hallaron en todos los ambientes, aunque con preferencias de hábitats. Los líquenes, principalmente Parmeliaceae, se hallaron en su mayoría heliófilos en suelos desnudos, rocas, prados y ramas y ejes de arbustos en matorrales y cañadas; en contadas ocasiones sobre el suelo al interior de estos dos últimos ambientes. Los musgos, la mayoría terrestres, desde los ambientes más expuestos al macroclima regional (suelos desnudos, rocas y prados) hasta los menos expuestos (matorrales y cañadas), en masas compactas de tamaño variable, particularmente en Pottiaceae, Dicranaceae o Bryaceae. Por el contrario, las hepáticas presentaron menor riqueza a nivel de todos los taxones, en todos los ambientes, excepto en el suelo de las cañadas, en donde presentaron su más alto número de especies.
Familias: La riqueza de musgos es bastante similar entre dos conjuntos de ambientes contrastantes, suelos desnudos-rocas y matorrales-cañadas, en tanto que en prados disminuye en aproximadamente el 50%. En hepáticas por el contrario la mayor riqueza ocurre al interior de matorrales y cañadas, y disminuye en un 60% en rocas y 80% en suelos desnudos y prados. En líquenes la tendencia es similar a lo observado en musgos, con diferencias menores entre suelos desnudos-rocas respecto de prados.
Géneros: En musgos, hepáticas y líquenes la riqueza es similar a lo observado en familias. Sin embargo, en suelos desnudos, rocas y matorrales los líquenes presentan mayor incremento de géneros respecto de las cañadas.
Especies: En musgos y líquenes se presenta mayor riqueza en los conjuntos de ambientes suelos desnudos-rocas y matorrales-cañadas. Sin embargo, en el caso particular de los musgos, ocurre mayor riqueza en rocas y cañadas respecto de suelos desnudos y matorrales, en particular, porque las rocas presentan pequeños intersticios o grietas, en donde se acumula materia orgánica y humedad que favorece el desarrollo de musgos acrocárpicos. Las hepáticas presentaron mayor riqueza en cañadas y en matorrales, ambiente este último con 50% menos de especies.
A continuación se presentan los resultados de riqueza por cada uno de los ambientes estudiados:
Suelos desnudos: Se encontraron 28 especies, pertenecientes a 22 géneros y 14 familias. El 39,29% de la riqueza correspondió a líquenes y el 60,71% a briófitos (musgos 53,57% y hepáticas 7,14%). La familia de líquenes más diversa fue Parmeliaceae con 50% (6 spp.), mientras que Collemataceae y Physciaceae constituyeron solo el 8,33% (1 sp. c/u). Las familias de musgos más diversas fueron Dicranaceae y Pottiaceae (26,66%; 4 spp. c/u), seguido por Fabroniaceae, Fissidentaceae, Hedwigiaceae, Orthotrichaceae y Polytrichaceae que estuvieron representadas por 1 especie (6,66% c/u). En las hepáticas, Frullaniaceae fue la más diversa (66,66%; 2 spp.). Los géneros más diversos fueron: Campylopus (20%, 3 spp.) en musgos y Frullania (66,66%, 2 spp.) en hepáticas. En líquenes no hubo ningún género con alto número de especies.
Rocas: Se encontraron 42 especies pertenecientes a 28 géneros y 18 familias. El 26,19% de la riqueza correspondió a líquenes, y el 73,81% a briófitos (musgos 66,67%, y hepáticas 7,14%). La familia de líquenes de mayor riqueza fue Parmeliaceae con el 54,54% (6 spp.) mientras que Candelariaceae y Physciaceae, presentaron el 9,09% (1 sp.). La familia de musgos más diversa fue Dicranaceae con 8 especies (28,57%) seguida de Bryaceae y Pottiaceae (4 spp., 14,28%, c/u). En las hepáticas Frullaniaceae fue la más rica (66,66%; 2 spp.), mientras que Cephaloziellaceae estuvo representada por 1 especie (33,33%). Los géneros más ricos fueron Rimelia (18,18%, 2 spp.) en líquenes, Campylopus (28,57%, 8 spp.) en musgos, y Frullania (66,66%, 2 spp.) en hepáticas.
Prados: Este ambiente es el de menor diversidad de la región, con apenas 13 especies, pertenecientes a 13 géneros y 10 familias. El 30,76% correspondió a líquenes y el 69,23% a briófitos (musgos 61,53% y hepáticas 7,7%). Tanto en líquenes como en hepáticas, ninguna familia presentó más de una especie, a diferencia de los musgos, en donde Pottiaceae fue la más diversa (37,5%; 3 spp.), contrastando con Bartramiaceae, Bryaceae y Polytrichaceae como las de menor número de especies (1 sp., 12,5% c/u). Ningún taxón presentó predominio en este ambiente.
Matorrales: Se encontraron 35 especies pertenecientes a 31 géneros y 21 familias. El 34,29% correspondió a líquenes y el 65,71% a briófitos (musgos 48,57%, hepáticas 17,14%). La familia de líquenes de mayor diversidad fue Parmeliaceae con 50% (6 spp.) mientras que las restantes apenas presentaron 1 especie (8,33% c/u). En cuanto a los musgos Pottiaceae fue la más diversa (23,52%; 4 spp.), a diferencia de Brachytheciaceae, Meteoriaceae, Orthotrichaceae, Polytrichaceae y Thuidiaceae (5,88%, 1 sp. c/u). La familia de hepáticas con el mayor número de especies fue Frullaniaceae (33,33%, 2 spp.), mientras que las restantes solo presentaron 1 especie (16,16% c/u). Los géneros más diversos fueron Bryum, Fabronia y Leptodontium (11,76%, 2 spp. c/u) en musgos, y Frullania (33,33%, 2 spp.) en hepáticas. Los líquenes no presentaron ningún género predominante.
Cañadas: Se encontraron 47 especies, pertenecientes a 30 géneros y 23 familias. El 19,15% correspondió a líquenes y el 80,85% a briófitos (musgos 55,32% y hepáticas 25,53%). Las familias de líquenes de mayor diversidad fueron Cladoniaceae, Lobariaceae y Parmeliaceae (22,22%, 2 spp. c/u) mientras que las restantes, solo registraron 1 especie (11,11% c/u). La familia de musgos más diversa fue Fissidentaceae (26,09%, 6 spp.), seguida de Brachytheciaceae que presentó cuatro especies (15,38%), a diferencia de Bartramiaceae, Calymperaceae, Fabroniaceae, Hypopterygiaceae y Polytrichaceae que presentaron 1 especie (3,84% c/u). Respecto a las hepáticas, Frullaniaceae y Plagiochilaceae fueron las más diversas (33,33%, 4 spp. c/u), mientras que Aytoniaceae y Metzgeriaceae fueron las menos diversas (1 spp., 8,33% c/u). Los géneros más ricos fueron Sticta (22,22%, 2 spp.) en líquenes, Fissidens (23,07%, 6 spp.) y Brachythecium (15,38%, 4 spp.) en musgos y Frullania y Plagiochila en hepáticas (33,33%, 4 spp. c/u).
Estructura
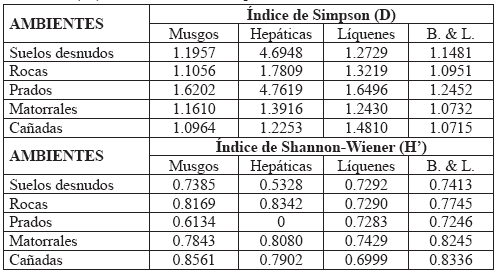
En términos de dominancia, las cañadas fueron el ambiente más diverso cuando se observan los briófitos (musgos y hepáticas; 1.0964 y 1.2253, respectivamente), mientras que los matorrales fueron los más diversos respecto de los líquenes (1.2430). Al evaluar los briófitos y líquenes en su conjunto, el ambiente más diverso fue las cañadas (1.0715), seguido de matorrales, rocas, suelos desnudos y prados, respectivamente (Tabla 2).
Tabla 2. Índices de abundancia proporcional, para las especies de briófitos y líquenes presentes en los distintos ambientes de la región subxerofítica de La Herrera. Dominancia (D), Uniformidad (H’). B = Briófitos, L = Líquenes.
En cuanto a la uniformidad, las cañadas fueron el ambiente más adecuado para el desarrollo de musgos (0,8561), las hepáticas fueron más uniformes en rocas (0,8342), mientras que los líquenes presentan su mayor uniformidad en los matorrales (0,7429). Sin embargo al observar los briófitos y líquenes en su conjunto, se mantiene la tendencia dada en lo relacionado con la dominancia, pues las cañadas fueron las de mayor uniformidad (0,8336), seguidas de matorrales, rocas, suelos y prados (Tabla 2).
DISCUSIÓN
En La Herrera los ambientes estudiados, respecto de la presencia de líquenes y briófitos, se pueden agrupar en 1) suelos desnudos, rocas y prados, en los que la vegetación vascular es homogénea y de porte bastante bajo (hasta 20 cm de altura, prados) o se presenta rala y dispersa o no existe (rocas) o no existe y el sustrato es de moderada a fuertemente móvil (suelos desnudos), con fuerte influencia del macroclima regional, y 2) matorrales y cañadas, con vegetación arbustiva densa entre 1-4 m de altura, con abundante materia orgánica en descomposición y suelos húmedos.
En términos generales, La Herrera se encuentra sometida a altas temperaturas, fuertes vientos y bajas precipitaciones, que no sobrepasan los 100 mm mensuales (Pinzón 2000). Respecto de estas condiciones macroclimáticas, los líquenes, con preferencia heliófilos, ocuparon los ambientes del grupo 1 (suelos desnudos, rocas y prados) y ramas y ejes de arbustos de matorrales y ramas de arbustos de cañadas (grupo 2), en tanto que los briófitos (musgos y hepáticas) tendieron a incrementar su diversidad desde los ambientes en los que la vegetación vascular es menos compleja (prados y rocas) hasta la más compleja (matorrales y cañadas), en donde hallan resguardo de los efectos del clima regional. Los briófitos incrementan el número de especies y la cobertura de las especies más importantes, sobre el suelo y la parte media y baja de los ejes de Chromolaena leivensis, Salvia bogotensis, Solanum lycioides, Baccharis latifolia, Dodonaea viscosa, Opuntia schumannii, Duranta coriacea y Cestrum tomentosum, plantas vasculares de amplio dominio en La Herrera.
La particular distribución de la diversidad de líquenes y briófitos, en términos de riqueza y estructura, en la región subxerofítica de La Herrera, parece tener su justificación en las adaptaciones fisiológicas y morfológicas que permiten a las diferentes especies soportar el estrés hídrico, la radiación fuerte y el efecto secante del viento, como ya ha sido evaluado en ambientes similares en otras áreas del planeta (véanse Thompson 1982, Wilson 1982, Rogers 1982, Llimona 1982, Nash & Mooser 1982, Rundel 1982, Redon 1982 y Lange & Tenhunen 1982).
La riqueza de líquenes en los ambientes del grupo 1 y parcialmente en ambientes del grupo 2 (parte aérea), puede tener relación con la humedad del aire y las adaptaciones morfológicas. En La Herrera, es común la niebla en la madrugada y hasta aproximadamente las 7-8 a.m., en que se pueden observar los talos de los líquenes todavía blandos; con la marcha del día el macroclima regional deseca la vegetación, y los talos de los líquenes se endurecen y se tornan quebradizos. Rundell (1982) en líquenes de zonas secas encontró relación directa entre los talos húmedos, la fotosíntesis y la presencia de humedad en la madrugada. En consecuencia, es factible considerar que en una fracción muy corta del día, 1-2 horas, los líquenes producen suficiente energía para la realización de sus funciones vitales. Igualmente, los líquenes presentan adaptaciones morfológicas ligadas al color (lustrosos u oscuros), que les permiten regular la temperatura del talo mediante la refracción de la radiación o limitar la penetración de la luz y el calor con la consecuente restricción de la pérdida de agua (véanse Galum 1963, en Rogers 1977). En La Herrera, líquenes con amplia distribución y abundancia, tales como Xanthoparmelia taractica, Rimelia reticulata, Flavoparmelia caperata y Flavopunctelia flaventior, de talo folioso, o Cladia aggregata, Cladina arcuata, Cladonia andesita y Usnea bogotensis, de talo fruticoso o ramificado, tienen talos lustrosos que varían desde el negro o gris hasta el verde, y responden perfectamente a los esquemas analizados por Galum.
Por otro lado, en la región subxerofítica de La Herrera, los géneros Ramalina, Heterodermia, Usnea, Candelariella, Teloschistes, Xanthoparmelia, Diploschistes, Sticta, Cladonia y Leptogium, caracterizan la riqueza de líquenes que crecen principalmente sobre rocas, suelos desnudos, prados y ramas de arbustos, y se corresponden con los resultados hallados para otras áreas secas del planeta por Thompson (1982), Filson (1982), Rogers (1982), Llimona (1982), Nash & Mooser (1982), Rundel (1982), Redon (1982) y Lange & Tenhunen (1982).
Al igual que para los líquenes, los briófitos presentan variadas adaptaciones de orden morfológico que permiten su establecimiento en ambientes extremos como los de La Herrera. Bell (1982) relaciona la presencia de papilas en la lámina, las márgenes enrolladas (involutas), la costa gruesa y robusta, y la presencia de pelos hialinos en los extremos de las hojas, como adaptaciones que favorecen el establecimiento de los musgos en ambientes secos. En este estudio Pottiaceae, Dicranaceae y Bryaceae, fueron las familias más importantes en todos los ambientes. Pottiaceae (v.g. Syntrichia fragilis, Pseudocrossidium replicatum, Leptodontium longicaule), presentó las más grandes poblaciones de briófitos en La Herrera, se caracteriza por presentar numerosas papilas sobre la lámina, además de márgenes fuertemente involutas. En zonas secas de otras regiones, esta familia con diferentes representantes constituye el grupo más preponderante (véanse Stark & Castetter 1987, Moore & Scott 1979, Zander 1993). Por otro lado, la costa robusta y gruesa de especies como Leptodontium pungens (Pottiaceae) y Campylopus spp. (Dicranaceae), responden a las características anteriormente señaladas. Hedwigia ciliata (Hedwigiaceae), Bryum argenteum (Bryaceae) y Campylopus richardii (Dicranaceae), crecen principalmente sobre rocas y barrancos expuestos y presentan los extremos de las hojas canescentes. La presencia en La Herrera de varios géneros (v.g. Bryum, Orthotrichum, Hedwigia, Brachythecium, Fissidens, Pseudocrossidium, Philonotis, Fabronia, Plagiochasma), igualmente corrobora resultados hallados por Stark & Castetter (1987) en Estados Unidos.
La alta riqueza especifica de musgos en las rocas podría explicarse por la elevada cantidad de fisuras y agujeros, en los que se acumula polvo, materia orgánica y temporalmente agua, lo que favorece el desarrollo de un buen número de especies de musgos, principalmente de crecimiento acrocárpico, como Campylopus biotropii, C. edithae, C. fragilis, C. flexuosus, C. pauper, C. pilifer, C. richardii y C. surinamensis, entre otros. Por el contrario, al interior de las cañadas el dominio es de los musgos pleurocárpicos (Meteoridium remotifolium, Fabronia ciliaris, F. jamesonii y Thuidium urceolatum). Aquí se puede concluir, al comparar rocas y cañadas, que la cantidad de nichos no es proporcional a la calidad de los mismos. Aunque en estos dos ambientes se presentó el mismo número de especies, en uno, las rocas, los musgos crecieron erectos en masas apretadas como estrategia para conservar humedad, en tanto que en el otro, las cañadas, el crecimiento se dio extendido y ralo sobre el sustrato, ante la presencia de humedad y sombra. Las hepáticas, importantes en las cañadas, responden a este último esquema analizado para los musgos.
La presencia en La Herrera de Plagiochasma rupestre, hepática marchantioide, bajo matorrales con el talo expandido o bajo matorrales ralos o prados con el talo enrollado y las escamas ventrales de color violeta expuestas, muestra otra estrategia de adaptación en la que se combinan lámina y pigmentos para evitar la desecación; esto ya había sido observado en áreas secas por Longton (1988) y Zander & Gradstein (1988). Por otro lado, Zander & Gradstein (1988), mencionan a Lophocolea martiana como especie eventualmente xerofítica y a Frullania sphaerocephala como especie rupícola. En La Herrera L. martiana y varias especies de Frullania, crecen frecuentemente sobre las superficies de las rocas, pero es Frullania sp. 2 la que presenta poblaciones grandes sobre las rocas y pigmentos rojo oscuros.
En general, la estructura (dominancia y uniformidad) de la vegetación estudiada en La Herrera presenta la misma tendencia que para la riqueza: los prados es el ambiente menos estable para el desarrollo de líquenes y briófitos, en tanto que el conjunto matorrales-cañadas es el más propicio.
Para los líquenes, los matorrales y los suelos desnudos son los ambientes en donde son dominantes. En los matorrales existe mayor cantidad de nichos, en ejes y ramas de arbustos, donde la competencia con los briófitos es nula, en tanto que en suelos desnudos, aunque no hay mayor cantidad de nichos, la competencia sigue siendo baja. Las adaptaciones señaladas con anterioridad, en el análisis de riqueza, corroboran esta tendencia: los briófitos son dominantes en matorrales y cañadas, en donde presentaron las más altas coberturas (80-100%).
Los líquenes presentaron similar uniformidad en suelos desnudos, rocas, prados y matorrales (ejes y ramas), y menor en cañadas, en donde la vegetación vascular es extremadamente densa y existe mayor competencia con los briófitos. En briófitos la mayor uniformidad se presentó en cañadas, rocas y matorrales; particularmente en cañadas y matorrales, un buen número de briófitos presentaron coberturas constantes, a diferencia de las rocas, en las que sólo dos especies, con altas coberturas (entre 60 y 100%), fueron preponderantes: Frullania sp. 2., en hepáticas, y Hedwigidium integrifolium, en musgos.
Finalmente, se puede establecer que en la región subxerofítica de La Herrera la riqueza de líquenes y briófitos está ligada a las estrategias de sobrevivencia, que les confiere a las especie capacidad para tolerar la desecación o evadir la sequía. Las especies tolerantes a la desecación, que crecen en los ambientes del grupo 1 (suelos desnudos, rocas y prados) o parcialmente en ambientes del grupo 2 (ramas), presentan o forma de crecimiento erecta (acrocárpicas), papilas, costa gruesa o ancha, con variados pigmentos desde el pardo amarillo hasta el negro y enrollamiento de las láminas (v.g. Leptodontium pungens, Syntrichia fragilis, Pseudocrossidium replicatum, Orthotrichum cupulatum, Campylopus spp.), o talos postrados (láminas) o erectos, colores lustrosos y respuesta fisiológica para realizar fotosíntesis en las primeras horas de la mañana (v.g. Xanthoparmelia taractica, Rimelia reticulata, Flavoparmelia caperata, Flavopunctelia flaventior, Cladia aggregata, Cladina arcuata, Cladonia andesita, Usnea bogotensis), o plantas postradas (pleurocárpicas) o erectas (acrocárpicas) con pelos canescentes que difractan la luz (v.g. Hedwigia ciliata, Campylopus richardii, Bryum argenteum), o plantas postradas dispersas, con talos laminares verdes, que retuercen sus márgenes para exponer las escamas ventrales de color violeta (Plagiochasma rupestre), o con talos foliosos en masas compactas sobre las rocas y abundantes pigmentos pardo rojizos (Frullania spp.).
Las especies que evaden la sequía crecen al interior de los ambientes del grupo 2 (matorrales y cañadas), y se caracterizan por crecer con preferencia sobre el suelo y en contadas ocasiones en la parte inferior de los ejes de las plantas vasculares, y por presentar, en general, formas de crecimiento reptante, de ramas dispersas o laxas y pigmentos verdes (v.g. Rhynchostegium scariosum, Thuidium urceolatum, Meteoridium remotifolium, Fabronia ciliaris, F. jamesonii, Hypopterygium tamariscinum, Plagiochasma rupestre, Cephaloziella granatensis Plagiochila spp., Lophocolea lepthanta, Metzgeria decipiens, Leptogium spp.).
AGRADECIMIENTOS
Expresamos nuestro agradecimiento al Profesor Pedro Sánchez, del Departamento de Biología de la Universidad Nacional de Colombia, por sus valiosas y oportunas observaciones sobre el manejo de la información.
LITERATURA CITADA
1. Alpert, P. 1979. Desiccation of Desert Mosses following a summer rainstorm. The Bryologist, 82(1):65-71. [ Links ]
2. Bell, G., 1982. Leaf morphology of Arid-Zone moss species from South Australia. Journal of the Hattori Botanical Laboratory, 53:147-151. [ Links ]
3. Brower J. E., J.H. Zar & C. N. von Ende, 1997. Field and laboratory methods for general ecology. 4ta. Edición. Editorial McGraw-Hill. Estados Unidos. 251 pp. [ Links ]
4. Churchill, S.P. & E.L. Linares. 1995. Prodromus Bryologiae Novo-Granatensis: Introducción a la Flora de Musgos de Colombia. Biblioteca “José Jerónimo Triana” No. 12. Vol. 1, 2. Instituto de Ciencias Naturales- Museo de Historia Natural, Universidad Nacional de Colombia, Bogotá.
5. Cortés, D. 2002. Diversidad, distribución y abundancia de los líquenes y briófitos de una región semiárida en Suesca (Cundinamarca). Trabajo de Grado. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia. Bogotá. Inédito. [ Links ]
6. Filson, R.B., 1982. Lichens of Continental Antarctica. Journal of the Hattori Botanical Laboratory, 53:357-360. [ Links ]
7. Galum, M., P. Bubrick & J. Garty, 1982. Structural and Metabolic Diversity of two Desert-Lichen Populations. Journal of the Hattori Botanical Laboratory, 53:312-324. [ Links ]
8. Garavito, N. F., M. Silva, Z. Carlos, C. Bernal, 1977. Estudio General y Detallado de Suelos de los Municipios de Cota, Funza, Mosquera y Parte de Madrid (Departamento de Cundinamarca). IGAC Subdirección Agrícola (Bogotá) 513 p. [ Links ]
9. Iwatzuki, A. 1960. The epiphytic bryophyte communities in Japan. Journal of the Hattori Botanical Laboratory, 22: 159-339. [ Links ]
10. Lange, O.L. & J.D. Tenhunen, 1982. Water Relations and Photosynthesis of Deserts Lichens. Journal of the Hattori Botanical Laboratory, 53:309-313. [ Links ]
11. Llimona, X., 1982. Lichens of the Arid Mediterranean area and North Africa. Journal of the Hattori Botanical Laboratory, 53:345-349. [ Links ]
12. Longton, B.E. 1988. Life-History Strategies among Bryophytes of arid regions. Journal of the Hattori Botanical Laboratory, 64:15-28. [ Links ]
13. Magnusson M., 1982. Composition and Succession of Lichen Communites in an Inner Coastal Dune Area in Southern Sweden. Lichenologist, 14(2):153-163 [ Links ]
14. Moreno C., 2001. Métodos para medir la biodiversidad. M.& T. Manuales y Tesis SEA Vol. 1. Zaragoza, 84 pp. [ Links ]
15. Moore C.J. & A.M. Scott, 1979. The Ecology of Mosses on a Sand Dune in Victoria, Australia. Journal of Bryology, 10:291-311. [ Links ]
16. Nash, T.H. & T.J. Mooser, 1982. Vegetational and Physiological patterns of Lichens in North American Deserts. Journal of the Hattori Botanical Laboratory, 53:331-336. [ Links ]
17. Nash T.S., S.L., White and J.E., Marsh, 1977. Lichen and Moss Distribution and Biomass in Hot Desert Ecosystems. The Bryologist; 80:470-479. [ Links ]
18. Pinzón, M. 2000. Distribución y diversidad de briófitos y líquenes de la región subxerofítica de la Herrera, Mosquera (Cundinamarca). Trabajo de Grado. Departamento de Biología, Pontificia Universidad Javeriana, Bogotá 102 pp., 5 anexos. Inédito. [ Links ]
19. Pinzón, M. & E. Linares, 2001. Catálogo comentado de los líquenes y briófitos de la región subxerofítica de la Herrera (Mosquera, Cundinamarca). Caldasia, 23 (1):237-246. [ Links ]
20. Plazas, A. 2003. Catálogo ilustrado de frutos y semillas de la Región Subxerofítica de La Herrera, Mosquera, Cundinamarca, Colombia. Trabajo de Grado. Departamento de Biología, Universidad Nacional de Colombia. Bogotá. Inédito. [ Links ]
21. Redon, J., 1982. Lichens of Arid South America. Journal of the Hattori Botanical Laboratory, 53:337-339. [ Links ]
22. Rogers R., 1977. Lichens of the Hot Arid and Semi-arid Lands. Pp. 213-251. En: Seaward, R.D. (ed.), Lichen Ecology. Academic Press. London. [ Links ]
23. Rogers, R., 1982. Lichens of Arid Australia. Journal of the Hattori Botanical Laboratory, 53:351-355. [ Links ]
24. Rogers R. & R.T. Lange. 1971. Lichen Populations on Arid Soil Crusts around Sheep Watering Places in South Australia. Oikos, 22: 93-100. [ Links ]
25. Rogers R. & R.T. Lange. 1972. Soil Surface Lichens in Arid and Subarid South-eastern Australia I. Introduction and Floristics. Aust. J. Bot., 20:197-213. [ Links ]
26. Rundel, P.W., 1982. The Role of Morphology in the Water Relations of Desert Lichens. Journal of the Hattori Botanical Laboratory, 53:315-320. [ Links ]
27. Stark, L. & R.C. Castetter, 1987. A Gradient Analysis of Bryophyte Populations in a Desert Mountain Range. Memoirs of the New York Botanical Garden, 45:186-197. [ Links ]
28. Thompson, J.W., 1982. Lichen Vegetation and Ecological Patterns in the High Artic. Journal of the Hattori Botanical Laboratory, 53:361-364. [ Links ]
29. Uribe, J. & S.R. Gradstein. 1998. Catalogue of the hepaticae and anthocerotae of Colombia. Bryophytorum Bibliotheca Band 53. [ Links ]
30. Vera, M. 2003. Gasterópodos de la región subxerofítica de La Herrera (Mosquera, Cundinamarca), Colombia. Trabajo de Grado, Departamento de Biología, Universidad Nacional de Colombia. Bogotá. Inédito. [ Links ]
31. Vera, M. & E.L. Linares. 2005. Los gasterópodos de la región subxerofítica de La Herrera, Mosquera, Cundinamarca. Revista de la Academia de Ciencias Exactas, Físicas y Naturales, 29(112):439-456. [ Links ]
32. Zander R.H., 1993. Genera of the Pottiaceae: Mosses of Harsh Environments. Bulletin of the Buffalo Society of Natural Sciences, Buffalo, New York, Vol 32. [ Links ]
33. Zander, B.O. & S.R. Gradstein, 1988. Experimental Dispersal Geography of Neotropical Liverworts. Nova Hedwigia, 90:41-94. [ Links ]
Recibido: 30/05/2006
Aceptado: 23/11/2006