Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.29 no.2 Bogotá July/Dec. 2007
CARACTERÍSTICAS REPRODUCTIVAS DE LA TORTUGA TRACHEMYS CALLIROSTRIS CALLIROSTRIS (TESTUDINATA: EMYDIDAE) EN ISLA LEÓN, DEPRESIÓN MOMPOSINA, COLOMBIA
Reproductive characteristics of the turtle Trachemys callirostris callirostris (Testudinata: Emydidae) at Isla León, Mompós Depression, Colombia
ADRIANA RESTREPO
VICTOR J. PIÑEROS
VIVIAN P. PÁEZ
Instituto de Biología, Universidad de Antioquia, Bloque 7-106, Apartado 1226, Medellín, Colombia. restrepoadriana78@gmail.com
Instituto de Biología, Universidad de Antioquia, Bloque 7-106, Apartado aéreo 1226, Medellín, Colombia. vppaez@gmail.com
RESUMEN
Trachemys callirostris callirostris es posiblemente la tortuga más explotada en Colombia tanto con fines de subsistencia como comerciales. Ya que son pocos los trabajos publicados sobre la biología reproductiva de esta especie realizamos este estudio entre febrero y abril de 2003 en la Depresión Momposina, con el objetivo de evaluar algunas características reproductivas de la especie. Para esto protegimos 55 nidos, de los cuales el 47.27% fueron depredados. El éxito de eclosión de los nidos restantes fue 56%. El tamaño promedio de la nidada fue 9.4 huevos y el periodo promedio de incubación fue 52.8 días. La temperatura promedio del periodo de incubación fue 31.7 °C. Todos los neonatos sexados fueron considerados hembras. Los neonatos de T. c. callirostris presentaron un largo recto del caparazón promedio de 29.30 mm y un peso promedio de 6.4 g.
Palabras clave. Fauna de Colombia, Emydidae, Reproducción de tortugas, Testudines, Trachemys callirostris.
ABSTRACT
Trachemys callirostris callirostris is perhaps the most exploited turtle in Colombia, due to both subsistence and commercial hunting. Given that so few studies have been published on the reproductive biology of this species, we conducted a study from February to April of 2003 in the Mompox Depression with the goal of evaluating some of the reproductive characteristics of this population. To this end, we protected 55 nests of which 47.27% were lost to predation. The hatching success of the remaining nests was 56%. Mean nest size was 9.36 eggs and the mean incubation period was 52.8 days. Mean nest temperatures during egg incubation for the nests that hatched was 31.7 °C. All neonates that were sexed were considered females. Neonates of Trachemys c. callirostris had a mean straight-line carapace length of 29.30 mm and a mean mass of 6.4 g.
Key Words. Fauna of Colombia, Emydidae, Reproduction of turtles, Testudines, Trachemys callirostris.
INTRODUCCIÓN
Trachemys callirostris, especie recientemente reconocida por Seidel (2002), está constituida por dos subespecies: T. c. callirostris, y T. c. chichiriviche. La primera se distribuye en Colombia, encontrándose desde el occidente del Golfo de Urabá hasta el departamento de La Guajira, pasando por los sistemas cenagoso de los ríos Sinú, San Jorge y Magdalena, abarcando casi todo el norte del país (Castaño-M 2002). En Venezuela, T. c. callirostris se ha reportado en el Lago Maracaibo (Pritchard & Trebbau 1984), pero no es claro si su ocurrencia es natural o producto de la liberación antrópica de individuos. A pesar de que T. c. callirostris es posiblemente la tortuga más fuertemente explotada en Colombia, tanto con fines de subsistencia como comerciales (Castaño-M 1997), fue catalogada como “casi amenazada” en el Libro Rojo de Reptiles Amenazados de Colombia (Castaño-M 2002).
Teniendo en cuenta que son pocos los trabajos publicados sobre la biología reproductiva de esta especie (Medem 1975, Bernal et al. 2004) y la gran variación geográfica observada en los patrones reproductivos en tortugas de este mismo género (Gibbons & Greene 1990, Vogt & Flores-Villela 1992) o incluso dentro de una misma área geográfica pero en diferentes temporadas reproductivas (Gibbons et al. 1982), realizamos este estudio en Isla León, Depresión Momposina, con el fin de evaluar algunas de las características reproductivas de la especie y de esta forma ampliar la información biológica existente sobre ella.
MATERIALES Y MÉTODOS
Isla León esta ubicada en el Complejo Cenagoso de Pijiño (9º 17’ N y 74º 24’ W), departamento del Magdalena, dentro de la Depresión Momposina, el área cenagosa más grande de Colombia (Anónimo 2002). La Depresión Momposina se encuentra ubicada en el centro de las llanuras del Caribe del país y está delimitada por el Río Cauca al oriente, el río San Jorge y la ciénaga de Ayapel al occidente, el Brazo de Loba (Río Magdalena) al nororiente y la Serranía de Ayapel al sur (Garramuño 2001). Esta zona se encuentra sujeta a inundaciones periódicas por parte de importantes causes fluviales como los ríos Magdalena, Cauca y San Jorge (Peñas 1993).
El trabajo de campo lo realizamos entre el 5 de febrero y el 15 de abril de 2003, período que corresponde a la temporada reproductiva de esta subespecie en la zona (Bernal et al. 2004). Entre el 5 y el 19 de febrero marcamos 55 nidos encontrados alrededor de Isla León, los cuales fueron ubicados con la ayuda de los habitantes de la zona, quienes los encuentran por inspección visual. Protegimos los nidos con mallas plásticas cilíndricas de aproximadamente 40 cm de diámetro, para disminuir la depredación por parte de vertebrados y para capturar los neonatos en el momento de la eclosión. Para cada nido establecimos la distancia a la que se encontraba del agua por medio de una lienza dispuesta de forma perpendicular al espejo de agua, y el porcentaje de cobertura vegetal usando un cuadrante de 1 m2 con divisiones cada 10 cm. Éste lo ubicamos en el centro de cada nido y cuantificamos el número de cuadros que contenían cada una de las diferentes coberturas vegetales observadas: buchón (B), pasto (P), arbusto (A) o descubierto (D). Establecimos cinco categorías: B, P, A, D y Mixta, dependiendo del tipo de vegetación que representara más del 75% de la cobertura del cuadrante. La categoría Mixta la establecimos cuando no observamos un tipo de cobertura vegetal predominante.
De estos nidos, elegimos 12 de manera aleatoria para introducir una termocupla tipo K en el fondo de la cámara del nido, con el fin de registrar diariamente las temperaturas a las que estaban expuestos los huevos durante la incubación. Estos registros los realizamos desde el día en que encontramos cada nido hasta el día en que observamos el primer neonato en la superficie. Para todos los nidos monitoreados, asumimos que el día de encuentro correspondía al día de postura, ya que los pobladores locales encuentran los nidos sólo cuando estos se encuentran recién puestos, debido a evidencias de excavación de la hembra. El día en que encontramos el primer neonato en la superficie del nido fue determinado como la fecha del fin de la incubación. Realizamos lecturas diarias de la temperatura cada cuatro horas (8:00, 12:00, 16:00 y 20:00) durante todo el período de incubación, con la ayuda de un lector digital marca OMEGA (0,1 ºC de precisión).
Cada neonato emergente fue retirado y marcado mediante cortes de los escudos marginales en combinaciones únicas (Janzen 1995). Obtuvimos un total de 80 neonatos procedentes de 16 nidos, a los cuales les medimos el largo recto del caparazón (LRC), el largo recto del plastrón (LRP), el ancho del caparazón (AC, al nivel del segundo escudo marginal), y el alto del caparazón (ALC) con un calibrador manual marca VIS (0,05 mm de precisión). Además, cada individuo fue pesado con una balanza digital marca OHAUS (0,1 g de precisión). Después de la emergencia del primer neonato, esperamos 72 horas para exhumar el nido y establecer el número de neonatos muertos y huevos no eclosionados. Finalmente, transportamos todos los neonatos al Laboratorio de Herpetología de la Universidad de Antioquia para la identificación de su sexo.
Para cada nido determinamos las siguientes características: a) el tamaño de la nidada, (definido como el número de huevos encontrado dentro del nido (Millar 2000), b) la duración del período de incubación (definido como el tiempo que va desde el día en que se encontró el nido hasta el día en que se encontró el primer neonato en la superficie), c) la tasa de depredación de nidos (definido como el número de nidos depredados del total de nidos ubicados), y d) el éxito de eclosión (definido como el número de huevos eclosionados sobre el número total de huevos en el nido por cien; Mortimer 2000).
Además, evaluamos el éxito reproductivo (definido como el número de neonatos vivos obtenidos dividido por el número total de huevos) en los 55 nidos. Debido a que no conocimos exactamente el número de huevos en todos los nidos (ya que algunos fueron depredados), para estimar el éxito reproductivo utilizamos el tamaño promedio de la nidada hallada a partir de 28 nidos. Colectamos muestras de los invertebrados encontrados en los nidos, los cuales fueron conservados en alcohol al 70% para su posterior identificación.
Para determinar las proporciones sexuales de los neonatos, sacrificamos 80 individuos provenientes de 16 nidos, de los cuales cuatro tenían termocuplas (los otros nidos con registros de temperatura no pudieron ser tenidos en cuenta por haber sido depredados o no haber eclosionado). El sacrificio de neonatos lo realizamos por medio de una inyección de Xilocaina al 2% (4 ml por neonato) en la región cardiaca. Fijamos y preservamos cada neonato en formaldehído buferado al 10% por 14 días y posteriormente extrajimos las dos gónadas (van der Heiden et al. 1985). Inicialmente, conservamos las gónadas en formaldehído buferado al 10% por ocho días, luego las pasamos a alcohol al 70%. La gónada izquierda de cada animal fue enviada al Laboratorio Ángel en Cali para la realización de los cortes histológicos. 42 placas pudieron ser interpretadas con la ayuda de un microscopio marca Olympus, teniendo en cuenta las descripciones histológicas de gónadas de tortugas realizadas por Danni & Alho (1985). El sexo de los 38 individuos restantes fue determinado con base en la morfología externa del sistema urogenital, siguiendo las descripciones e ilustraciones anatómicas de Thachemys dorbignyi realizadas por Malvasio et al. (1999) para el mismo propósito.
RESULTADOS
De los 55 nidos, 26 (47.27%) fueron depredados completamente, 23 por cerdos y tres posiblemente por Tupinambis teguixin. De los 29 nidos restantes, siete (24.14%) no eclosionaron, 16 nidos eclosionaron parcialmente y seis (20.69%) eclosionaron en su totalidad. Encontramos hormigas del género Solenopsis y larvas de moscas de la familia Phoridae consumiendo los huevos en los nidos.
La distancia promedio al agua a la que se encontraron los nidos fue de 3.68 m (con un rango de 0 a 11 m). El éxito de eclosión promedio para los 29 nidos sobrevivientes fue 56%. El tamaño promedio de la nidada obtenido durante esta temporada fue de 9.36, con nidadas entre uno y 22 huevos; el período promedio de incubación fue de 52.85 días, con un período mínimo de 48 días y un máximo de 62. El éxito reproductivo durante esta temporada en Isla León fue de 22.02%.
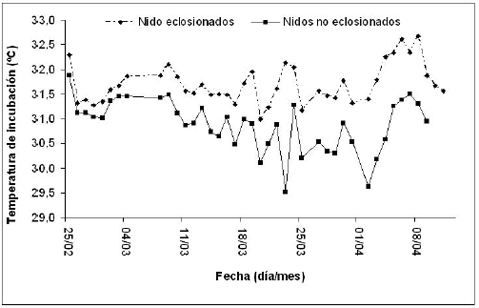
De los 12 nidos a los que les monitoreamos la temperatura, uno no fue tenido en cuenta ya que fue depredado, otros cuatro no concluyeron exitosamente la incubación y siete eclosionaron completamente. Encontramos diferencias significativas entre las temperaturas de incubación de los nidos eclosionados y los no eclosionados (ANOVA, F = 29,.97; p < 0.001; n = 72), estando la temperatura diaria promedio de los nidos no eclosionados por debajo de la de los nidos eclosionados, sobre todo durante el final del período de incubación (Figura 1). Debido a estas diferencias, sólo usamos los datos provenientes de los seis nidos eclosionados para los análisis posteriores. Igualmente, encontramos una relación significativa entre el éxito de eclosión y la temperatura experimentada por los nidos eclosionados durante la incubación (r = 0.644; p = 0.0324; n = 11), en donde los nidos que experimentaron temperaturas de incubación más altas tuvieron mayor éxito de eclosión. La temperatura promedio del período de incubación de los nidos eclosionados fue de 31.7 °C, siendo la menor temperatura de 31 ºC y la mayor de 32.6 °C. No encontramos relación entre la temperatura promedio de incubación de cada nido y el tamaño de la nidada (r = -0.3210; p < 0.05; n = 11), ni entre la temperatura de incubación y la duración del período de incubación (r = -0.30; p < 0.05; n = 6).
Figura 1. Temperatura de incubación promedio diaria de los nidos de Trachemys callirostris callirotris eclosionado y no eclosionado durante la temporada reproductiva de 2003 en Isla León.
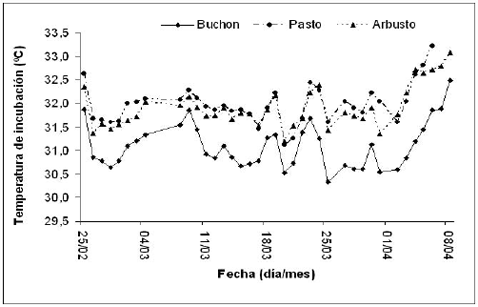
Encontramos diferencias en las temperatura de incubación experimentada por los nidos en las tres coberturas vegetales (Buchón, Pasto y Arbusto; ANOVA, F = 50.49; p < 0.000; n = 11). Una prueba pos hoc de rangos múltiples mostró que la temperatura de los nidos bajo el Buchón difirieron significativamente de la temperatura de los nidos en Pasto y en Arbustos (Figura 2). En las tres coberturas vegetales, la temperatura de los nidos durante el segundo tercio del periodo de incubación se comportó de manera similar que durante el periodo total de incubación. Durante el segundo tercio del periodo de incubación, los nidos experimentaron temperaturas promedio entre 29.1 y 34.1 ºC, y una fluctuación diaria promedio entre 1.96 y 3.15 ºC.
Figura 2. Temperatura de incubación promedio diaria por categoría de cobertura vegetal de los nidos de Trachemys callirostris callirostrois eclosionado en Isla León durante la temporada reproductiva de 2003.
Los 42 neonatos a los que fue posible asignar el sexo a partir de los cortes histológicos fueron determinados como hembras, los 38 neonatos a los que se les asignó el sexo a partir de la comparación de la morfología externa de las gónadas fueron igualmente determinados como hembras.
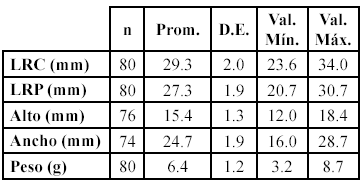
Los 80 neonatos de T. c. callirostris presentaron un largo recto del caparazón (LRC) promedio de 29.30 mm, un largo recto del plastrón (LRP) promedio de 27.33 mm, un alto promedio de 15.39 mm, un ancho promedio de 24.70 mm y un peso promedio de 6.4 g (Tabla 1).
Tabla 1. Medidas tomadas a los neonatos de Trachemys callirostris callirostris eclosionados durante la temporada reproductiva de 2003 en Isla León.
DISCUSIÓN
Los nidos de T. c. callirostris mostraron ser más susceptibles a la depredación si se hallaban más cercanos al borde de la ciénaga, donde además fueron más abundantes (Restrepo et al. 2006). Resultados similares fueron reportados para los nidos de Chrysemys picta marginata (Chritens & Biders 1987) y Chrysemys picta belli (Legler 1954), cuyas tasas de depredación fueron menores cuando estos se encontraron más alejados de los cuerpos de agua. Este resultado puede deberse a que los nidos localizados cerca al agua tienen mayor probabilidad de ser encontrados, ya que los depredadores podrían usar un patrón de búsqueda lineal, que seria más efectivo que la búsqueda en un área de dos dimensiones como se realizaría en campo abierto (Congdon et al. 1983). Además, hay mayor probabilidad que los nidos estén más cercanos unos de otros (más agrupados) cerca al cuerpo de agua que cuando están más alejados, y los depredadores buscarán más intensamente en los sitios particulares donde haya una mayor densidad de nidos (Spencer 2001).
Fue inesperada la falta de asociación entre la depredación y las características de la cobertura vegetal de los nidos de T. c. callirostris, ya que se esperaría que los nidos que estuviesen en sitios expuestos, es decir con menor cantidad de cobertura vegetal o con un tipo de cobertura que no brindara un buen camuflaje al nido, hubiesen tenido tasas de depredación más altas (Spencer 2001). Un estudio previo mostró que las características del hábitat que rodea al nido puede afectar la detección de este por parte de un depredador (Marchand & Litvaitis 2004). Para nidos de Chelydra serpentina, Kolben & Janzen (2002) encontraron que la probabilidad de supervivencia de sus nidos incrementó cuando disminuía la cobertura vegetal.
En este estudio, los cerdos fueron observados como los principales depredadores de los nidos de icotea. Si estos basan la búsqueda de los nidos a través de señales olfativas, como ha sido observado para otros depredadores de nidos de tortugas como el zorro rojo (Vulpes vulpes; Spencer & Thompson 2003), mapaches (Congdon et al. 1987), perro, coyotes y coatíes (Eckrich & Owens 1995), entonces las tasas de depredación de los nidos serían independientes de las características de la cobertura vegetal, explicando de esta manera la falta de una relación entre estas variables. Esto también explicaría el hecho de que la mayoría de los nidos fueron depredados poco tiempo después de haber sido puestos, ya que con el transcurso del desarrollo embrionario los olores emitidos por los fluidos de la hembra o los huevos mismos aparentemente son menos evidentes, haciendo más difícil su detección olfativa (Congdon 1987, Spencer & Thompson 2003).
En el trabajo de Bernal et al (2004) realizado en el mismo sitio de estudio, se reportó que el principal depredador vertebrado de la temporada reproductiva del año 2001 fue el lobo pollero (Tupinambis teguixin). Este resultado difiere del encontrado por este estudio, en donde los cerdos fueron los principales depredadores seguidos por los lobos polleros. Estas diferencias en los dos estudios se deben posiblemente al uso en el segundo de las mallas plásticas alrededor de cada nido, las cuales impidieron parcialmente que el lobo pollero accediera a los huevos, pero no lograron impedir la depredación de los cerdos.
La depredación por vertebrados fue el factor más importante de pérdida de huevos observado en este estudio, concordando con lo reportado para otras especies como Emydoidea blandingi (Congdon et al. 1983) y Chelydra serpentina (Congdon et al. 1987). Sin embargo, en el trabajo de Bernal et al. (2004) encontraron que la principal causa de pérdida de los huevos fue la depredación por invertebrados, principalmente por hormigas del género Solenopsis, quienes destruyeron el 32% de los huevos, a diferencia de nuestros hallazgos, donde estas hormigas destruyeron sólo el 13.75% de los huevos. Las diferencias encontradas en los dos estudios realizados en Isla León podrían estar relacionadas con las diferencias climáticas experimentadas durante las dos estaciones reproductivas, ya que el año en el que se realizó el trabajo de Bernal et al. (2004) fue más húmedo que el año en el que se realizó el presente estudio. Una investigación sobre la depredación de los huevos de Anolis limifrons por parte de hormigas del género Solenopsis encontró que huevos puestos en suelos húmedos tuvieron una mortalidad más alta debido a la acción de estas hormigas, que huevos puestos en suelos secos (Chalcraft & Andrews 1999). Las hormigas del género Solenopsis y las larvas de familia Phoridea han sido reportadas como unos de los principales depredadores invertebrados de huevos de tortuga (Moll & Legler 1971, Acuña-Mensén & Hanson 1990). En el presente estudio se observó que la infestación de los nidos por hormigas coincide con el momento de la eclosión, probablemente debido a que cuando los neonatos rompen la cáscara, se producen señales olfativas muy fuertes asociadas al olor del vítelo y la albúmina dentro del huevo, que pueden atraen a las hormigas.
El éxito reproductivo de T. c. callirostris reportado en este estudio coincide con el éxito reproductivo reportado para Emydoidea blandingi (22%; Congdon et al. 1983). Sin embargo, al igual que en el estudio de Bernal et al. (2004) el éxito reproductivo de la colonia anidante en Isla León fue más alto que el encontrado en otras poblaciones de la subespecie (Medem 1975) y en otras especies del mismo género (3% de éxito de eclosión para Trachemys venusta en Juan Mina, Panamá; Moll & Legler 1971 y 5% de éxito de eclosión para Trachemys floridana peninsulares en la Florida, Estados Unidos; Gibbons 1990). Estas diferencias pueden deberse a que las nidadas monitoreadas estuvieron protegidas por una malla y a que se encontraban en una isla, lo que posiblemente afecta las tasas de mortalidad por vertebrados, debido a que la presencia de éstos es menor en islas, que en áreas continentales (Rand & Robinson 1969). Igualmente, ésta zona ha sido bastante perturbada, lo que ha disminuido considerablemente la fauna silvestre presente (Bernal et al. 2004).
El periodo de incubación reportado para esta temporada reproductiva fue similar al reportado para Trachemys venusta en México, cuyos nidos tuvieron un periodo de incubación promedio de 58.24 días (Zenteno & Bouchot 2001). Esta similitud posiblemente se deba a que en ambos estudios los nidos tuvieron temperaturas de incubación similares (en el presente estudio la temperatura promedio fue de 31.7ºC y el estudio con T. venusta fue de 30ºC). Por el contrario, en Panamá se reportaron periodos de incubación de 71 a 83 días bajo temperaturas de 21 a 32ºC (Moll & Legler 1971) y en Costa Rica, también para nidos de Trachemys venusta, fue registrado un periodo de incubación promedio de 77.4 días bajo una temperatura promedio de incubación de 26.2ºC (Cabrera-Peña et al. 1996). Estos resultados indican que existe una relación inversa entre la temperatura de incubación de los huevos de Trachemys y la duración en el desarrollo de sus embriones, debido posiblemente a un aumento en la tasa metabólica durante el desarrollo embrionario (Litzgus & Hopskins 2003). La relación entre la temperatura de incubación y la duración del periodo de incubación ha sido reportada para otras especies de tortugas (Yntema 1978, Packard et al. 1987, Páez & Bock 2004, 1998) y podría tener un efecto en la sobrevivencia de los nidos, ya que un mayor tiempo de incubación aumentaría el riesgo de pérdida del nido.
La temperatura de incubación es considerada como un factor limitante para el desarrollo de los embriones de tortugas, debido a que las temperaturas extremas, altas o bajas, pueden inhibir su desarrollo y al mismo tiempo disminuir notablemente el éxito de eclosión de los nidos (Packard et al. 1991, Resetarits 1996, Weisrock & Janzen 1999). Las temperaturas de incubación registradas en este estudio fueron notablemente más altas que las reportadas en otros trabajos con tortugas del mismo u otros géneros (Moll & Legler, 1971, Cabrera-Peña et al. 1996, Broderick et al. 2001, Godley et al. 2001, Zenteno & Bouchot 2001). En este estudio los nidos que experimentaron temperaturas de incubación altas tuvieron éxitos de eclosión mayores, alcanzando algunos nidos eclosionados hasta temperaturas máximas de 35.7 ºC. Esto muestra que los embriones de T. c. callirostris pueden tolerar periodos con temperaturas superiores a 35 ºC, temperatura a la cual se inhibe el desarrollo de embrionario en otras especies de tortugas (Ackerman 1997).
Las diferencias observadas en este estudio entre las temperaturas de incubación de nidos eclosionados y no eclosionados se deben posiblemente al aporte del calor metabólico producido durante el desarrollo de los embriones (Broderick et al. 2001). La contribución del calor metabólico en la temperatura de los nidos ya ha sido observada en especies de tortugas que presentan nidadas grandes y construyen nidos profundos, donde el aporte de calor al nido por el desarrollo embrionario es mucho mayor, y la temperatura del nido esta menos afectada por las variaciones ambientales (Podocnemis unifilis, Souza & Vogt 1994; Podocnemis unifilis, Páez & Bock 1998; Chelonia mydas, Broderick et al. 2001; Caretta caretta, Godley et al. 2000). Esta podría ser una de las primeras evidencias de la contribución del calor metabólico en la temperatura del nido en especies con nidadas pequeñas y nidos superficiales. Sin embargo, debido al bajo número de nidos a los que se les monitoreo la temperatura (n = 11) se debe ser cauteloso con la anterior apreciación.
Las diferencias entre las temperaturas de incubación observadas para los nidos cubiertos por Buchón y los nidos bajo otras coberturas vegetales posiblemente se deban a que los nidos en Buchón presentaban condiciones de mayor humedad (Restrepo et al. 2006) y se ha reportado que el potencial hídrico del sustrato donde son colocados los huevos afecta la temperatura de incubación (Gutzke et al. 1987). Además, las características del tipo de vegetación, como su altura y el ancho de sus hojas, podría afectar la cantidad de radiación solar absorbida y retenida por el suelo (Spotila et al. 1994).
Los neonatos que pudieron ser sexados fueron determinados como hembras. Este resultado puede deberse a que las temperaturas experimentadas por los nidos de T. c. callirostris en Isla León estuvieron posiblemente por encima de su temperatura umbral o pivotal (Mrosovsky & Pieau 1991). La temperatura pivotal reportada de la especie Trachemys venusta, para las poblaciones neotropicales al sur de México, fue de 27 ºC (Ewert et al. 1994), la cual también estuvo por debajo de las temperaturas experimentadas por los nidos en este estudio. Sin embargo, hay que tener en cuenta que la temperatura pivotal varía de acuerdo con las condiciones ambientales locales (térmicas e hídricas) a las cuales están expuestas las poblaciones de tortugas (Spotila et al. 1994). En Trachemys se ha observado variación geográfica de la temperatura umbral, donde las poblaciones de zonas templadas presentaron temperaturas pivotales más altas (29.5 ºC) que las poblaciones neotropicales (Etchberger et al. 1991, Vogt & Flores-Villela 1992, Ewert et al. 1994). También se ha observado variación interespecífica de la temperatura umbral dentro de las tortugas acuáticas norteamericanas del género Graptemys (Ewert et al. 1994), por lo que es probable que también haya este tipo de variación dentro del género Trachemys. Por lo anterior, es importante conocer la temperatura pivotal de cada especie y cada población específica (Vogt & Flores-Villela 1992). En tortugas con determinación sexual dependiente de la temperatura (TSD), cambios en el número de machos y hembras producidos en las playas de anidación debido a fenómenos climatológicos como el fenómeno del niño, el calentamiento global o por cambio en las condiciones en las áreas de anidación utilizadas por las hembras pueden afectar la demografía de la población (Hays et al. 2003).
El tamaño de la nidada reportado por este estudio se encontró dentro del rango reportado para otras especies del género (Moll & Legler 1971, Medem 1975, Gibbons 1990, Bernal et al. 2004). Sin embargo, las medidas de los neonatos de Isla León (Tabla 1) fueron menores a las reportados por Bernal et al. (2004). Las diferencias en los resultados de éstos dos trabajos probablemente se deban a las condiciones climáticas experimentadas por los nidos en los diferentes años (el año en que se realizó este estudio se presentó una fuerte sequía en la región, debido posiblemente al fenómeno del niño). Varios estudios han demostrado que la humedad y la temperatura de incubación afectan el tamaño de los neonatos, encontrando que neonatos que emergen de sitios con condiciones más calientes y secas son más pequeños que los neonatos que salen de sitos con condiciones más húmedas y frías (Packard et al. 1993, Tucker et al. 1998, Páez & Bock 2004).
Las medidas de los neonatos de Isla León fueron menores que las reportados en otras poblaciones de Trachemys (Moll & Legler 1971 en Juan Mina, Panamá; Medem, 1975 en la Ciénaga del Totumo, Colombia; Gibbons 1990 en México). Las diferencias en las medidas de los neonatos pueden deberse a las condiciones ambientales a las que fueron incubados los nidos en las diferentes zonas geográficas o pueden estar relacionados a diferencias en los tamaños corporales de las hembras reproductivas, ya que el tamaño de la hembra esta correlacionado con el tamaño de los huevos y los neonatos (Congdon & Gibbons 1983, 1985). Estas posibles diferencias en los tamaños de las hembras quizás se deban a la prolongada presión de caza que experimentan los adultos en la zona de la Depresión Momposina, la cual pudo disminuir el tamaño de las hembras reproductivas (Bernal et al. 2004; Daza & Páez 2007) o a diferencias en la calidad de los hábitat donde las diferentes poblaciones de Trachemys crecieron hasta llegar a la edad adulta (Mitchell & Pague 1990).
AGRADECIMIENTOS
Agradecemos a la Universidad de Antioquia y al Comité para el desarrollo de la Investigación CODI por la financiación de este proyecto, a Juan Manuel Daza por su colaboración en campo y valiosos aportes, a Brian C. Bock por sus valiosos aportes al manuscrito, al Grupo Herpetológico de Antioquia, a la Fundación Neotrópicos por el préstamo de sus instalaciones, a Lucía, Lukas y nuestras familias, y todos los habitantes de Angostura, en especial a Carlos, Elvira y los niños por recibirnos en sus vidas y haber hecho posible la realización de este proyecto.
LITERATURA CITADA
1. Ackerman, R.A. 1997. The nest environment and embryonic development of sea turtles. pp. 83-106 en: Musick JA y Lutz PL (eds.). The biology of sea turtles. CRC Press. Boca Ratón, Florida. [ Links ]
2. Acuña-Mensén, R. & P.E. Hanson 1990. Phorid fly larvae as predators of turtle eggs. Herpetological Review 21(1): 13-14. [ Links ]
3. Anónimo. 1997. Plan de manejo ambiental del complejo cenagoso de Pijiño (Municipios de Pijiño y San Zenon). Informe ejecutivo. 15 pp. [ Links ]
4. Anónimo. 2002. Corporación Autónoma Regional del Sur del Bolívar, CVS. Plan de Manejo Integral de los Humedales, Subregión de la Depresión Momposina y cuenca del Rió Sinú. [ Links ]
5. Bernal-M, M., J.M. Daza-R & V.P. Páez. 2004. Ecología reproductiva y cacería de la tortuga icotea Trachemys scripta callirostris (Testudinata: Emydidae) en el área de la Depresión Momposina, norte de Colombia. Revista de Biología Tropical 52(1): 229-238. [ Links ]
6. Broderick, A.C., B.J. Godley & G.C. Hays. 2001. Metabolic heat and the prediction of sex ratios for green turtles (Chelonia mydas). Physiological and Biochemical Zoology 75: 161-170. [ Links ]
7. Cabrera-Peña, J.C., J.R. Rojas & G. Galeano. 1996. Mortalidad embrionaria y éxito de eclosión en huevos de Trachemys scripta (Testudines: Emydidae) incubados en un área natural protegida. Revista de Biología Tropical 44(2): 841-846. On Line. [ Links ]
8. Castaño-M, O.V. 1997. Status of the tortoises and freshwater turtles of Colombia. pp. 302-306. en: van Abemma J (ed). Proceedings: Conservation, Restoration, and Management of Tortoises and Turtles. An International Conference. New York Turtle and Tortoise Society, Nueva York. [ Links ]
9. Castaño-M, O.V. 2002. Libro Rojo de los Reptiles Amenazados de Colombia. Instituto de Ciencias Naturales, Universidad Nacional de Colombia. Bogotá. D.C. [ Links ]
10. Chalcraft, D.R. & R.M. Andrews. 1999. Predation on lizard eggs by ants: specie interactions in variable physical environments. Oecologica 119: 285-292. [ Links ]
11. Chritens, E. & J.R. Biders. 1987. Nesting activity and hatching success of the painted turtle (Chrysemys picta marginata) in southwestern Quebec. Herpetologica 43: 55-65. [ Links ]
12. Congdon, J.D. & W. Gibbons. 1983. Relationships of reproductive characteristics to body size in Pseudemis scripta. Herpetologica 39:147-151. [ Links ]
13. Congdon, J.D. & W. Gibbons. 1985. Egg components and reproductive characteristics of turtles: Relationships to body size. Herpetologica, 41(2): 194-205. [ Links ]
14. Congdon, J.D. & W. Gibbons. 1987. Morphological constraint on egg size: a challenge to optimal egg size theory? Proceedings on the National Academy of Sciences 84: 4145-4147. [ Links ]
15. Congdon, J.D., W. Gibbons & J.L. Green. 1983. Parental investment in the chicken turtle (Deirochelys reticularia). Ecology 64(3): 419-425. [ Links ]
16. Congdon, J.D., G.L. Breitenbach, R.C. van Loben-Sels & D.W. Tinkle. 1987. Reproduction and nesting ecology of snapping turtles (Chelydra serpentina) in southeasten Michigan. Herpetologica 43: 39-54. [ Links ]
17. Danni, T.M.S & C.J.R. Alho. 1985. Estudio histológico da diferenciaçao sexual em tartarugas recém eclodidas (Podocnemis expansa, Pelomedusidae).Revista Brasilera de Biología 45: 365-368. [ Links ]
18. Daza-R, J.M. & V.P. Páez. 2007. Morphometric variation and its effect on reproductive potential in female Colombian slider turtles Trachemys callirostris callirostris. Herpetologica 63(2): 125-134. [ Links ]
19. Eckrich, C.E. & D.W. Owens. 1995. Solitary versus arribada nesting in the olive ridley sea turtle (Lepidochelys olivacea): a test of the predator-satiation hypothesis. Herpetologica 51: 349-354. [ Links ]
20. Etchberger, C.R., J.P. Phillips, M.A. Ewert, C.E. Nelson & H.D. Prage. 1991. Effect of the oxygen concentration and clutch size on sex determination and physiology in red-eared slider turtles (Trachemys scripta). The Journal of Experimental Zoology 258: 394-403. [ Links ]
21. Ewert, M.A., D.R. Jackson & C.E. Nelson. 1994. Patterns of temperature-dependent sex determination in turtles. The Journal of Experimental Zoology 270: 3-15. [ Links ]
22. Garramuño, E. 2001. Paisajes agropecuarios y biodiversidad: Redescubriendo lo descubierto. Caso de Estudio: Mohana. Seminario Nacional de Agua. Medellín. [ Links ]
23. Gibbons, J.W., J.L. Greene & K.K. Patterson. 1982. Variation in reproductive characteristics of aquatic turtles. Copeia 1982(4): 776-784. [ Links ]
24. Gibbons, J.W. & J.L. Greene. 1990. Reproduction in the slider and other species of turtles. pp. 124-134 en: Gibbons JW (ed.). Life History and Ecology of the Slider Turtle. Smithsonian Institution Press, Washington D.C. [ Links ]
25. Gibbons, J.W. 1990. The slider turtle. pp. 3-18 en: Gibbons JW (ed.). Life History and Ecology of the Slider Turtle. Smithsonian Institution Press, Washington D.C. [ Links ]
26. Godley, B.J., A.C. Broderick, J.R Downie, F. Glen, J.D. Houghton, I. Kirkwood, S. Reece & G.C. Hays. 2001. Thermal conditions in nests of loggerhead turtles: further evidence suggesting female skewed sex ratios of hatchling production in the Mediterranean. Journal of Experimental Marine Biology and Ecology 263: 45-63. [ Links ]
27. Gutzke, W.H., G.C. Packard, M.J. Packard & T.J. Boardman. 1987. Influence of the hydric and thermal environments on eggs and hatchlings of painted turtles (Chrysemys picta). Herpetologica 43: 393-404. [ Links ]
28. Hays, G.C., A.C. Broderick, F. Glen & B.J. Godley. 2003. Climate change and sea turtles: a 150-year reconstruction of incubation temperatures at a major marine turtle rookery. Global Change Biology 9: 642-646. [ Links ]
29. Janzen, F.J. 1995. Experimental evidence for the evolutionary significance of temperature-dependent sex determination. Evolution 49: 864-873. [ Links ]
30. Kolbe, J.J. & F.J. Janzen. 2002. Impact of nest site selection on nest success and nest temperature in natural and disturbed habitats. Ecology 83: 269-281. [ Links ]
31. Legler, J.M. 1954. Nesting habits of the western painted turtle, Chrysemys picta bellii (Gray). Herpetologica 10: 137-144. [ Links ]
32. Litzgus, J.D. & W.A. Hopkins. 2003. Effect of temperature on metabolic rate of the mud turtle (Kinosternon subrubrum). Journal of Thermal Biology 28:595-600. [ Links ]
33. Marchand, M.N. &. J.A. Litvaitis. 2004. Effects of landscape composition, habitat features, and nest distribution on predation rates of simulated turtle nests. Biological Conservation 117:243-251. [ Links ]
34. Malvasio, A., N. Gomes & E.C. Ferias. 1999. Identifição sexual do estudio anatõmico do sietma urogenital em recém-eclodidos e jovens de trachemys dorbignyi (Duméril & Bribon)(Reptilia, Testudines, Emydidae). Reviasta Brasilera de Zoología 16(1):91-102. [ Links ]
35. Medem, F. 1975. La reproducción de la icotea, Pseudemys scripta callirostris (Testudines, Emydidae). Caldasia 11:83-106. [ Links ]
36. Millar, J.D. 2000. Determinación del tamaño de la nidada y el éxito de eclosión. pp. 143-149 en: Eckert K, Bjornal K, Abreu-Grobois F, Donnelly M (eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas. UICN/CSE Grupo especialista en tortugas marinas. Publicación # 4 (Traducción al español). [ Links ]
37. Mitchell, J.C. & C.A. Pague. 1990. Body size, reproductive variation, and growth in the slider turtle at the northeastern edge of its range. pp.146-151 en: Gibbons JW (ed.). Life History and Ecology of the Slider Turtle. Smithsonian Institution Press, Washington D.C. [ Links ]
38. Moll, E.O. & J.M. Legler. 1971. The life history of the neotropical slider turtle, Pseudemys scripta (Schoepff), in Panamá. Bulletin of the Los Angeles County Museum of Natural History Science No.11. 102 pp. [ Links ]
39. Mortimer, J.A. 2000. Reducción de las amenazas a los huevos y a las crías: los viveros. Pp. 199–203 en: Eckert K, Bjornal K, Abreu-Grobois F, Donnelly M (eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas. UICN/CSE Grupo especialista en tortugas marinas. Publicación # 4 (Traducción al español). [ Links ]
40. Mrosovsky, N. & C. Pieau. 1991. Transitional range of temperature, pivotal temperatures and thermosensitive stages for sex determination in reptiles. Amphibia-Reptilia 12: 169-179. [ Links ]
41. Packard, G.C., M.J. Packard & L. Benigan. 1991. Sexual differentiation, growth, and hatching success by embryonic painted turtles incubated in wet and dry environments at fluctuating temperatures. Herpetologica 47(1): 125-132. [ Links ]
42. Packard, G.C., K. Miller & M.J. Packard. 1993. Enviromentally induced variation in body size of turtle hatchlings in natural nests. Oecologia 93: 445-448. [ Links ]
43. Packard, G.C., M.J. Packard, K. Miller & T.J. Boardman. 1987. Influence of moisture, temperature, and substrate on snapping turtle eggs and embryos. Ecology 68: 983-993. [ Links ]
44. Páez, V.P. & B.C. Bock. 1998. Temperature effects on incubation period in the yellow-Spotted river turtle, Podocnemis unifilis, in the Colombian Amazon. Chelonian Conservation and Biology 3(1): 31-36. [ Links ]
45. Páez, V.P. & B.C. Bock. 2004. Pre- and post-hatching factors affecting juvenile growth rates in the yellow-spotted river turtle (Podocnemis unifilis). Actualidades Biológicas 26 (81): 137-151. [ Links ]
46. Peñas, D.E. 1993. Espacio y diacronía en la conformación de la subregión momposina. En: I encuentro regional de historia de la Costa Caribe colombiana, Mompós, Edición especial. Boletín Historial No.26. Medellín 238pp. [ Links ]
47. Pritchard, P.C. & P. Trebbau. 1984. The Turtles of Venezuela. Society for the Study of Amphibians and Reptiles, Lawrance, Kansas. [ Links ]
48. Rand, A.S. & M.H. Robinson. 1969. Predation on iguana nests. Herpetologica, 25: 172-174. [ Links ]
49. Souza, R. & R.C. Vogt. 1994. Incubation temperature influences sex and hatchling size in the neotropcal turtle, Podocnemis unifilis. Journal of Herpetology 28: 453-464. [ Links ]
50. Resetarits, W Jr. 1996. Oviposition site choice and life history evolution. American Zoologist 36: 205-215. [ Links ]
51. Restrepo, A, V. Piñeros & V.P. Páez. 2006. Nest site selection by Colombian slider turtles, Trachemys callirostris callirostris (Testudines: Emydidae) in the Mompos Depression, Colombia. Chelonian Conservation and Biology 5 (2):249-254. [ Links ]
52. Robinson, C. & J.R. Binder. 1988. Nesting synchrony: a strategy to decrease predation of snapping turtle, Chelydra serpentina, nests. Journal of Herpetology 22:470– 473. [ Links ]
53. Seidel, M.E. 2002. Taxonomic observations on extant species and subspecies of slider turtles, genus Trachemys. Journal of Herpetology 36(2):285-292. [ Links ]
54. Spencer, R.J. 2001. The murray river turtle, Emydura macquarii: Population dynamics, nesting ecology, and impact of the introduced red fox, Vulpes vulpes. Tesis de Doctorado. School of Biological Sciences, University of Sidney. [ Links ]
55. Spencer, R.J. & M.B. Thompson. 2003. The significance of predation in nest site selection in turtles: An experimental consideration of macro - and microhabitat preferences. Oikos 102:592-600. [ Links ]
56. Spotila, J., L. Zimmerman, C. Binckley, J. Grumbles, D. Rostal, A. List, E. Beyer, K. Phillips & S. Kemp.1994. Effects of incubation condition on sex determination, hatching success, and growth of hatchling desert tortoises, Gopherus agassizii. Herpetological Monograph 8:103-116. [ Links ]
57. Tucker, J.K., N.I. Filoramo, G.L. Paukstis & F.J. Janzen. 1998. Response of red-eared slider, Trachemys scripta elegans, eggs to slightly differing water potentials. Journal of Herpetology 32: 124-128. [ Links ]
58. Turbay, S., G.A. Gómez, A.D. López, C. Alzate & O.J. Álvarez. 2000. La fauna de la Depresión Momposina. Editorial Lealon. Medellín. 102 pp. [ Links ]
59. Van der Heiden, A.M., R. Briseño & D. Ríos-Olmeda. 1985. A simplified method for determining sex in hatchling sea turtles. Copeia 1983 (3): 779-782. [ Links ]
60. Vogt, R.C. 1980. Natural history of the map turtles Graptemys pseudogeografica and G. ouachitensis in Wisconsin. Tulane Studies in Zoology and Botany 22: 17-48. [ Links ]
61. Vogt, R.C. & O. Flores-Villela. 1992. Effects of incubation temperature on sex determination in a community of neotropical freshwater turtles in southern Mexico. Herpetologica 48: 265–270. [ Links ]
62. Weisrock, D.W. & F.J. Janzen. 1999. Thermal and fitness-related consequences of nest location in painted turtles (Chrysemys picta). Functional Ecology 13: 94-101. [ Links ]
63. Yntema, C.L. 1978. Incubation times for eggs of the turtle Chelydra serpetina (Testudine: Chlydridae) at various temperatures. Herpetologica 34: 274-277. [ Links ]
64. Zenteno, C.E. & C. Bouchot. 2001. Reproducción de la tortuga pinta (Trachemys scripta venusta) en una laguna de la planicie costera Veracruzana. Universidad y Ciencia 17(33): 37-42. [ Links ]
Recibido: 16/06/2006
Aceptado: 18/09/2007