Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.29 no.2 Bogotá July/Dec. 2007
DIVERSIDAD Y DISTRIBUCIÓN DE LA FAUNA QUIROPTERA EN UN TRANSECTO ALTITUDINAL EN EL DEPARTAMENTO DEL TOLIMA,COLOMBIA
Bat diversity and distribution along an altitudinal transect in the Tolima region of Colombia
DAVID ALFONSO BEJARANO-BONILLA
ALEXANDER YATE-RIVAS
MANUEL HERNANDO BERNAL-BAUTISTA
Reserva Natural Ibanasca. Grupo de Investigación en Zoología, Universidad del Tolima, Ibagué, Colombia. david.bejarano-bonilla@plymouth.ac.uk
Grupo de Investigación en Zoología, Universidad del Tolima, Ibagué. Colombia.
Departamento de Biología, Grupo de Investigación en Zoología, Universidad de Tolima, Ibagué, Colombia. mhbernal@ut.edu.co
RESUMEN
Se estudió la diversidad y la distribución de la quiroterofauna registrada sobre un sector de la vertiente Oriental de la cordillera Central en el departamento del Tolima, en un transecto altitudinal dividido en cuatro zonas de muestreo (I: 350-1000; II: 1000-2000; III: 2000-3000 y IV: 3000-4000). Se encontraron 42 especies correspondientes a 21 géneros y cuatro familias. La familia Phyllostomidae fue las más diversa y abundante, con 34 especies y 92.5% del número de individuos colectados. Por su parte, entre las zonas estudiadas la que presentó la mayor diversidad y abundancia fue la zona II, que correspondió a elevaciones intermedias. El género Sturnira presentó el rango más amplio de distribución, mientras el número de especies del género Artibeus descendió a medida que se incrementó la altitud. Las especies Sturnira lilium, Sturnira luisi, Sturnira erythromos, Sturnira ludovici, Carollia perspicillata, Myotis keaysi, Artibeus cf. phaeotis y Desmodus rotundus, tuvieron los rangos de distribución altitudinal más amplios. La única especie registrada en nuestros muestreos sobre los 3000 m fue Histiotus montanus. Once nuevos reportes de especies de murciélagos son adicionados para el departamento del Tolima: Chiroderma salvini, Lonchophylla mordax, Molossops planirostris, Myotis keaysi, Promops centralis, Pteronotus parnellii, Sturnira aratathomasi, S. bogotensis, S. luisi, S. tildae, Vampyrops aurarius y cinco para la zona andina del país: Ch. salvini, M. planirostris, S. luisi, S. tildae y V. aurarius. Esta investigación evidencia la necesidad de estudiar sistemáticamente regiones que aportan datos importantes sobre la comunidad de murciélagos de Colombia.
Palabras clave. Quiropterofauna, Distribución de murciélagos, Gradiente altitudinal, Fauna de Colombia.
ABSTRACT
The diversity and distribution of bats was recorded on the eastern slope of the Central mountain chain in the Department of the Tolima, along an altitudinal transect, divided in four sample zones (I: 350-1000, II: 1000-2000, III: 2000-3000, IV: 3000-4000). Forty-two species in 21 genera, and four families were identified. Phyllostomidae was the most diverse and abundant family, with 34 species and 92.5 % of the number of collected individuals. The zone with the highest diversity and abundance was zone II, corresponding to intermediate elevations. The Sturnira genus presented the wider range of distribution, while the decreasing number of species of the Artibeus genus was linked to increases in altitude. Species with wider altitudinal distribution ranges were Sturnira lilium, Sturnira luisi, Sturnira erythromos, Sturnira ludovici, Carollia perspicillata, Myotis keaysi, Artibeus cf. phaeotis and Desmodus rotundus. Only one species, Histiotus montanus, was registered at 3000 m. Our study adds eleven new bat records for the Department of Tolima: Chiroderma salvini, Lonchophylla mordax, Molossops planirostris, Myotis keaysi, Promops centralis, Pteronotus parnellii, Sturnira aratathomasi, S. bogotensis, S. luisi, S. tildae, Vampyrops aurarius, and five new records for the Andean zone of the country: Ch. salvini, M. planirostris, S. luisi, S. tildae and V. aurarius. This study makes evident that there are still regions that need to be systematically studied, because they contribute important information about of the community of bats in Colombia.
Key Words. Altitudinal gradient, Distribution of bats, Fauna of Colombia.
INTRODUCCIÓN
Los murciélagos son uno de los grupos más importantes y abundantes en la región neotropical, ya que representan aproximadamente el 50% de la fauna de los mamíferos (Humphrey & Bonaccorso 1979, Voss & Emmons 1996). En Colombia, los quirópteros son el orden más diverso, seguido por los roedores (Alberico et al. 2000), y con 178 especies es el segundo país con mayor diversidad de especies en el mundo y primero en América (Mickleburgh et al. 2002).
Los murciélagos se distribuyen por todo el mundo, con excepción del Ártico y la Antártica, pero se localizan principalmente en el neotrópico (Mickleburgh et al. 2002). A nivel altitudinal se ha encontrado una relación inversa entre la diversidad, el rango de distribución y la abundancia con respecto al incremento en altitud (Rhabek 1995, Brown & Lomolino 1998). Una tendencia ampliamente referida en literatura al igual que para otros grupos taxonómicos (Karr 1971, Terborgh 1971, 1977, Graham 1990, Patterson et al. 1996, Narváez & Soriano 1996, Shepherd & Kelt 1999). Entre las razones a las que se les atribuye esta disminución en la diversidad con la altitud están la temperatura y la disponibilidad de los recursos, los cuales pueden influir de forma independiente o asociada (Graham 1983).
Los murciélagos desempeñan un papel primordial en la dinámica de los ecosistemas tropicales, al incluir especies en todos los niveles tróficos y al establecer relaciones muy estrechas con especies vegetales importantes tanto en la economía del hombre como en el mantenimiento de los ecosistemas (Kunz 1973, Wilson 1973, Jones 1976, Sazima & Sazima 1978, Howell 1979, Gorchov et al. 1993). Pero a pesar de su importancia y del incremento de estudios en este grupo, aún hay muchos aspectos de su biología y diversidad regional que son desconocidos y esto dificulta la elaboración de planes para su conservación (Fenton 1997). Así, el presente trabajo pretende contribuir al conocimiento sobre la diversidad y la distribución de este grupo de mamíferos en el departamento del Tolima, estimar su riqueza y el cambio en la composición de estas especies a lo largo de un gradiente altitudinal en la vertiente oriental de la Cordillera Central colombiana.
MATERIALES Y MÉTODOS
Se estableció un transecto altitudinal entre los 350 m y los 4000 m, delimitados en cuatro zonas de muestreo (Tabla 1). En la zona I se muestrearon los sitios Batatas (1), a 350 m 4° 02’ N 74° 49’W en el municipio de Suárez y Gualanday (2), a 550 m 4° 15’ N 74° 59’ W en el municipio de Coello; según Holdrige (1982), estos sitios están ubicados en la zona de vida del bosque seco tropical; la temperatura media anual es de 26,5ºC y la precipitación promedio anual es de 2600 mm (Rangel 1997); los hábitats muestreados fueron bosques de galería, bosques secundarios y potreros. En la zona II se muestrearon los sitios Pastales (3), a 1600 m 4° 30’ N 75° 18’ W y el corregimiento de Juntas (4), a 1900 m 4° 33’ N 75° 19’ W ambos en el municipio de Ibagué; estos sitios se encuentran en la zona de vida del bosque premontano bajo (Holdrige 1982), la temperatura promedia es 17,5ºC y la precipitación anual es de 1866 mm (Rangel 1997); los hábitats muestreados fueron bosques de galería, bosques secundarios y potreros. En la zona III se muestrearon los sitios El Silencio (5), a 2600 m 4° 36’ N 75° 20’ W y El Almorzadero (6), a 2900 m 4° 36’ N 75° 22’ W en el municipio de Ibagué; éstos sitios se encuentran en la zona de vida de bosque premontano alto o bosque alto andino, en donde la precipitación anual es de 1869 mm; los hábitats muestreados fueron bosques de galería, bosques primarios, bosques secundarios y potreros. En la zona IV se muestrearon los sitios La Cueva (7), a 3600 m 4° 37’ N 75° 19’ W y el Páramo (8), a 4000 m 4° 38’ N 75° 19’ W en el municipio de Ibagué; éstos sitios se encuentran en la zona de vida del bosque alto andino y páramo, respectivamente, la temperatura promedio es 5ºC; los hábitats muestreados fueron bosques primarios y páramo.
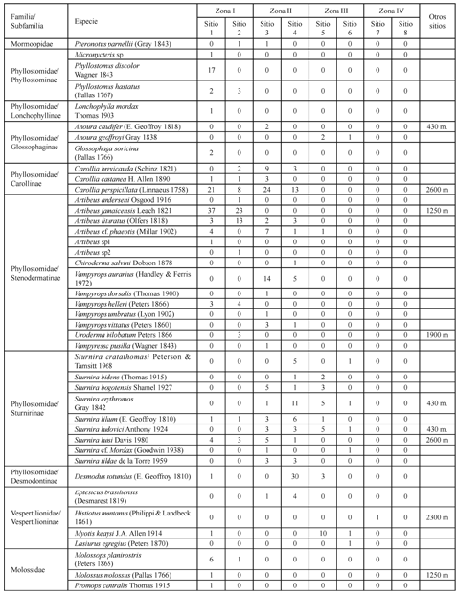
Tabla 1. Número de murciélagos encontrados en un transecto altitudinal en el departamento del Tolima, Colombia. El orden taxonómico se presenta según Koopman (1993). (Véase la descripción de sitios y zonas en Materiales y Métodos).
Cada una de las zonas se visitó tres veces durante los meses de julio de 2002 y enero de 2003. Cada sitio se muestreó durante seis horas, desde las 18:00 hasta las 24:00 (Ospina-Ante & Gómez 1999), en épocas de luna nueva, teniendo en cuenta que la actividad de los murciélagos puede verse afectada por la luminosidad de la luna llena, especialmente cuando no se muestrea dentro de los bosques (Tamssit y Valdivieso 1961, La Val 1970, Ercker 1974, Turner 1975). También, durante el desarrollo del trabajo se visitaron de manera ocasional otros sitios alternos, datos obtenidos de estas localidades se han tenido en cuenta como información complementaria y no han sido incluidos en el análisis estadístico.
Se utilizaron cuatro redes de niebla de nylon para la captura de los animales, dos de 6 m X 2,5 m y dos de 12 m X 2,5 m, con un ojo de malla de 30 mm. Dos redes se instalaron desde el nivel del suelo hasta 2,5 m de altura y las otras desde el nivel del suelo hasta los 5 m de altura, con el fin de optimizar la colecta de algunas especies que tienen menos probabilidad de ser atrapadas a baja altura (Pérez-Torres 2000). Se utilizaron parámetros morfológicos convencionales para la determinación taxonómica de los ejemplares, de acuerdo con las claves de Muñoz-Arango (1995, 2001), Linares (1987), Fernández et al. (1988), Eisenberg (1979) y Koopman (1993). Las especies se llevaron al Laboratorio de Zoología de la Universidad del Tolima en donde se extrajeron los cráneos y se tomaron medidas morfométricas como apoyo para su determinación, en algunos casos, se compararon con ejemplares de la colección de referencia del Instituto de Ciencias de la Universidad Nacional de Colombia, bajo la asesoría de la profesora Yaneth Muñoz-Saba.
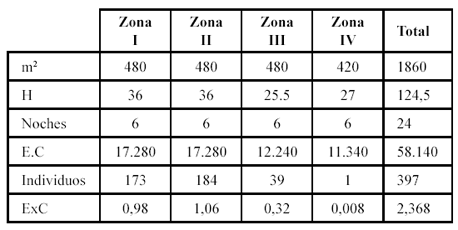
El análisis de los datos se hizo de manera descriptiva. En tanto que el esfuerzo de captura (EC) fue establecido a partir del producto de los metros de redes instalados por el número de horas de muestreo (m2h). El éxito de captura (ExC) se calculó a partir de la relación entre el número de individuos colectados y el esfuerzo de captura multiplicados por 100 (Tabla 2).
Tabla 2. Datos generales sobre la quiropterofauna registrada en un gradiente altitudinal en el departamento del Tolima, Colombia.
m2 = metros cuadrados de redes instalados, H= horas de muestreo, E.C= Esfuerzo de captura, ExC= Exito de captura (Ver descripción de zonas de muestreo en Materiales y Métodos).
RESULTADOS Y DISCUSIÓN
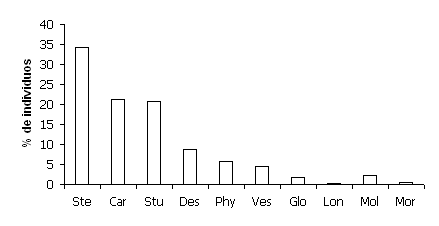
Se capturaron 397 individuos correspondientes a 42 especies, las cuales representan un 23,6% de las 178 especies encontradas en el país (Alberico et al. 2000). Estas especies pertenecen a 21 géneros y cuatro familias: Vespertilionidae, Mormoopidae, Molossidae y Phyllostomidae, de las cuales, la última fue la más diversa y abundante con 34 especies (92,5%). Entre los registros de los Phyllostómidos las subfamilias: Stenodermatinae, Carollinae y Sturnirinae presentaron las abundancias relativas (proporción de individuos del total colectado) más altas, 34,2%; 21,2% y 20,7%, respectivamente (Figura 1). Por su parte, las especies con las mayores abundancias relativas en todo el transecto fueron: C. perspicillata, A. jamaicensis, D. rotundus, A. lituratus y V. aurarius. A su vez, para la zona I, las especies con las mayores abundancias relativas fueron: A. jamaicensis, C. perspicillata, A. lituratus y P. discolor; para la zona II: C. perspicillata, D. rotundus y V. aurarius; y para la zona III: M. keaysi, S. ludovici y S. erythromos (Tabla 1).
Figura 1. Abundancias relativas de las familias y subfamilias de murciélagos en un gradiente altitudinal en el departamento del Tolima, Colombia. (Ste: Stenodermatinae, Car: Carollinae, Stu: Sturnirinae, Des: Desmodontinae, Phy: Phyllostominae, Ves: Vespertilioninae, Glo: Glossophaginae, Lon: Lonchophylinae, Mol: Molossidae y Mor: Mormoopidae).
La notable abundancia de la familia Phyllostomidae no es de extrañar, ya que es considerada la familia de murciélagos más abundante en el neotrópico (Tamsitt 1966 y 1967, Muñoz-Arango 1986, Ospina-Ante & Gómez 1999). Posiblemente, la radiación extensiva de ésta familia se puede asociar con la alta diversidad de plantas que se presentan en el neotrópico y que son su principal recurso alimenticio (Flemming 1986). Dumont (1999) y Freeman (2000) indican que la radiación adaptativa de grupos de murciélagos tales como los Phyllostómidos, que presentan la capacidad de localizarse en nichos tróficos inexplorados, son la base de la alta diversidad de las comunidades de murciélagos neotropicales.
Para las familias Molossidae, Vespertilionidae y Mormoopidae, se podría atribuir su poca representatividad quizá al método de muestreo, ya que éstas familias son insectívoras y por sus hábitos de vuelo y forrajeo no son fáciles de colectar con redes; es el caso de Molossus molossus, especie de la que solo se capturó un individuo a 425 m. Sin embargo, en el área urbana de la ciudad de Ibagué (1250 m) esta especie es muy abundante y frecuente (Bejarano-Bonilla, Obs. Pers.), este mismo patrón ha sido observado en otras ciudades del país (Alberico et al. 2005). Una parte de las especies insectívoras colectadas se encontraron dentro del gremio “insectívoros de follaje”, las cuales se caracterizan por volar a baja altura y capturar sus presas en el suelo o en las hojas (Fenton 1972, 1990, Norberg & Rayner 1987). En lo que tiene que ver con las especies de las familias Vespertilionidae y Molossidae registradas en las tierras altas, se podría justificar su presencia en estos sitos por sus adaptaciones a estos ambientes variables y fríos, como los de alta montaña; Soriano (2000), considera que estas especies que no son de origen tropical se pueden encontrar en la alta montaña por presentar una distribución amplia en ambos hemisferios del continente.
La zona II fue la más diversa en relación con las otras zonas (24 especies y 184 individuos colectados), esta diversidad correspondiente a elevaciones intermedias, difiere con lo hallado por Humphrey y Bonaccorso (1979), quienes encontraron que la diversidad declina continuamente con el incremento de la elevación. Aunque otros estudios referentes a mamíferos para el neotrópico confirman que los niveles altitudinales intermedios son los que comparten la mayoría de especies (Humphrey & Bonaccorso 1979, Rhabek 1995, Brown & Lomolino 1998). Quizá también sea debido a que los muestreos en esta zona intermedia, zona II, se realizaron en su mayoría en bosques secundarios y, según Connell (1978), los bosques secundarios generan un espacio más propicio para una alta diversidad de especies. Además, el incremento de la diversidad de hábitat en estos bosques con perturbación moderada puede permitir la coexistencia de muchas más especies (Silva 1979).
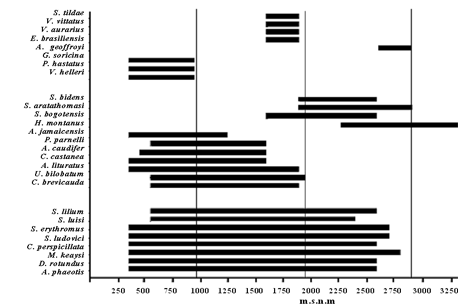
Respecto a los rangos de distribución altitudinal de las especies, se encontraron tres patrones generales (Figura 2): Primero, especies con rangos de distribución amplios, como el caso de S. lilium, S. luisi, S. erythromos, S. ludovici, C. perspicillata, M. keaysi, A. cf. phaeotis y D. rotundus. Particularmente, D. rotundus fue registrado en los muestreos que se realizaron en potreros a diferentes alturas. Soriano (2000) afirma que es posible localizar a estos murciélagos hematófagos en bosques altoandinos pero siempre asociados a actividades antrópicas ganaderas, ya que de lo contrario no podrían habitar estos bosques por su lento metabolismo que no compensaría la pérdida de calor sin abundancia de proteínas (sangre) para su mantenimiento. En cuanto a C. perspicillata y las especies del género Sturnira se podría atribuir su distribución a la condición de especies generalistas (Flemming et al. 1977, Gardner 1977, Heithaus & Flemming 1978, Humphrey & Bonaccorso 1979, Flemming & Heithaus 1986, Isaac-Junior & Sabato 1994, Pedro & Taddei 1997 y Medellín et al. 2000). Por su parte, A. cf. phaeotis todavía no está claramente determinada, ya que consideramos que hay alguna confusión con Artibeus cinereus y según Yaneth Muñoz-Saba (com. pers.) “hay un problema taxonómico con estas especies”.
Figura 2. Patrones de distribución de algunas especies de murciélagos encontrados en un gradiente altitudinal en el departamento el Tolima, Colombia.
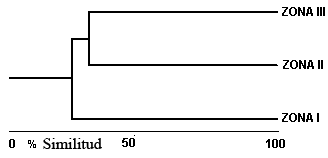
Segundo, especies con un rango de distribución que va desde el centro del gradiente altitudinal hacia los extremos, que en el presente caso corresponde a especies que parten desde la zona II. Este resultado se puede apreciar a través del dendrograma de similitud de Jaccard, en donde la zona II se relaciona principalmente con la zona III (Figura 5). En este patrón hacia las zonas altas se evidencia una simpatría de especies del género Sturnira (S. bidens, S. bogotensis y S. aratathomasi), Humphrey y Bonaccorso (1979) y Soriano et. al. (1999) afirman que estos murciélagos sedentarios presentan una buena asociación a este tipo de ambientes de alta montaña, además, son los únicos representantes de los Phyllostómidos para estos ambientes.
Figura 5. Dendrograma de similitud entre las zonas de estudio en un gradiente altitudinal en el departamento el Tolima, Colombia. Zona I (350-450 m), Zona II (1650-1900 m), Zona III (2600-2900m).
Tercero, especies con distribuciones restringidas: G. soricina, S. tildae, V. vittatus, V. aurarius, E. brasiliensis, A. geoffroyi, P. hastatus y V. helleri. Posiblemente su adaptabilidad a un rango en particular se deba a sus tamaños, dietas o niveles fisiológicos, que restringen sus áreas de hábitat; como el caso de P. hastatus, según Mc Manus (1977) y Burns (1979), su tamaño puede limitar la colonización de hábitat de alta montaña, además, estos hábitat se caracterizan por la escasez de recursos importantes en la dieta de estos animales como son los lagartos (Humphrey & Bonaccorso, 1979). Otros estudios confirman estos patrones a través de los gradientes de elevación (Brown 2001).
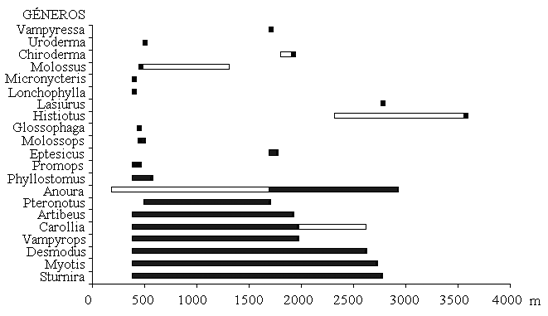
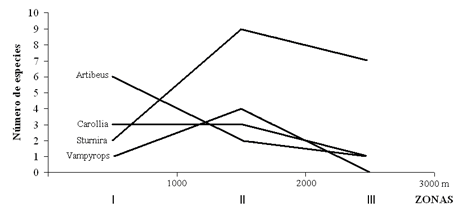
Respecto a la distribución altitudinal de los géneros, se encontró que Sturnira, Myotis, Desmodus, Vampyrops, Carollia, Artibeus, Molossus, Anoura e Histiotus tuvieron los mayores rangos de distribución (Figura 3). El número de especies del género Artibeus descendió a medida que el gradiente altitudinal se incrementó; las especies del género Sturnira ocuparon todo el gradiente altitudinal con un número mayor de especies en las zonas altas (Figura 4); lo que puede indicar su adaptación a este tipo de elevaciones (Humphrey & Bonaccorso 1979). Por su parte, la especie Histiotus montanus fue la única capturada en los muestreos sobre los 3000 m. Aunque el primer autor posteriormente la registró a 2300 m en la Reserva Natural Ibanasca, en horas diurnas (09:30 h). Esta actividad en horas del día puede estar asociada al forrajeo de recursos específicos como himenópteros, de hábitos diurnos, reportados por Canals et al. (2005) como parte de la dieta de esta especie.
Figura 3. Rango de distribución de los géneros encontrados en un gradiente altitudinal en el departamento del Tolima, Colombia. Las barras solidas corresponden a datos en los sitios de muestreo y las barras vacías corresponden al complemento en otros sitios (Véase la tabla 1 y materiales y métodos).
Figura 4. Número de especies encontradas en las zonas de estudio en los cuatro géneros con mayor distribución en un transecto altitudinal en el departamento del Tolima, Colombia.
Entre las especies capturadas hay que destacar que 11 son nuevos reportes para el departamento del Tolima: C. salvini, L. mordax, M. planirostris, M. keaysi, P. centralis, P. parnellii, S. aratathomasi, S. bogotensis, S. luisi, S. tildae, y V. aurarius; y cinco especies son nuevos reportes para la región Andina: C. salvini, M. planirostris, S. luisi, S. tildae y V. aurarius (Alberico et al 2000 y Muñoz-Arango 2001). Cabe anotar que se registraron dos especies que podrían ampliar más la diversidad de murciélagos en el departamento del Tolima y están aún por confirmar su determinación taxonómica: A. cf anderseni y S. cf mordax. Esto demuestra como aún hay regiones del país que faltan por estudiar adecuadamente y que aportan datos importantes a la composición de la comunidad de murciélagos de Colombia.
AGRADECIMIENTOS
A Yaneth Muñóz-Saba, Francisco Villa y Paul Ramsay por su asesoría. Emma Yisel Galindo, Judy Andrea Pacheco, Sandra Cepeda, Juan Miguel Díaz, María Teresa Cardona, Jhon Edison Yate y Jorge García por su colaboración en campo. Jackie Chávez, Timothy Carter, Roberto Backlay y Pedro Sánchez por la bibliografía obsequiada. Hugo Mantilla-Meluk por los comentarios pertinentes para la determinación taxonómica de algunas especies. A las instituciones: Alcaldía de Ibagué con su “Proyecto Integral Jóvenes del Cañón del Río Combeima”; Comité Central de Investigaciones de la Universidad del Tolima, Corporación para la Conservación, Investigación y Desarrollo de los Ecosistemas, GEOBIOTA, y Idea Wild, por el apoyo financiero y logístico para el desarrollo de este trabajo.
LITERATURA CITADA
1. Alberico, M., A. Cadena, J. Hernández-Camacho & Y. Muñoz-Saba. 2000. Mamíferos (Synapsida:Theria) de Colombia. Biota Colombiana 1(1):43-75 [ Links ]
2. Alberico, M., C.A. Saavedra-R. & H. García-Paredes. 2005. Murciélagos caseros de Cali (Valle del Cauca-Colombia). Caldasia 27(1): 117-126. [ Links ]
3. Brown, J. H. 2001. Mammals on mountain sides: elevation patterns of diversity. Global Ecology & Biogeography 10:101-109. [ Links ]
4. Brown, J.H. & M.V. Lomolino. 1998. Biogeography. 2a Edn. Sinauser, Sunderland. Massachusetts. [ Links ]
5. Burns, J. M. 1979. General physiology en: Biology of Bats of the New World family Phillostomidae. Part III. Robert Baker, J. Knox jr. And Carter D. C. Special publication the Museum Texas Tech University. No. 16. [ Links ]
6. Canals, M., B. Grossi, J. Iriarte-Díaz & C. Veloso. 2005. Relaciones biomecánicas y ecológicas de la morfología alar de ocho quirópteros chilenos. Revista Chilena de Historia Natural. 78:207-214. [ Links ]
7. Connel, J.H. 1978. Diversity in Tropical Rain Forests and Coral Reefs. Science 199: 1302-1310. [ Links ]
8. Dumont, E. R. 1999. The effect of food hartness of feeding behavior in frugivorous bats (Phyllostomidae): an experimental study. Journal Zoology, London 248, 219-229. En: L. Aguirre & H.G. Ercker. 1974. Der einfluss des mondlichtes auf die aktivitatsperiodik nachtaktiver saugetiere. Oecologia, 14:269-287. En: Fenton M. B. and Kunz T. H. 1997. Movements and behavior en Biology of Bats of the New World family Phillostomidae. Part II. Robert Baker, J. Knox jr. And Carter D. C. Special publication the Museum Texas Tech University. No. 13. [ Links ]
9. Eisenberg, J. F: 1989. Mammals of the neotropics. The northern neotropics. Volume 1. The University of Chicago Press. [ Links ]
10. Fenton, M. B. 1972. The structure of aerial-feeding bat fauna as indicated by ears and wing elements. Canadian Journal of Zoology 50:287-296. [ Links ]
11. Fenton, M.B. 1990. The foraging behavior ecology of animal-eating bats. Canadian Journal of Zoology 68:411-422. [ Links ]
12. Fenton, M.B. 1997. Science and the conservation bats. Journal of Mammalogy 78 (1) 1-14. [ Links ]
13. Fernández-B., A., R. Guerrero, R. Lord, J. Ochoa & G. Ulloa. 1988. Mamíferos de Venezuela. Lista y Claves para su identificación. [ Links ]
14. Flemming, T.H. 1986. The structure of neotropical bat communities: a preliminary analysis. Revista Chilena de Historia Natural. 59:135-150. En: P. Sánchez-Palomino, P. Rivas-Pava & A. Cadena (eds). 1993. Composición, abundancia y riqueza de especies de la comunidad de murciélagos en bosques de galería en la serranía La Macarena (Meta, Colombia). Caldasia 17(2): 3001-312. [ Links ]
15. Flemming, T.H. & E.R. Heithaus. 1986. Seasonal foraging behavior of the frugivorous bat Carollia perspicillata. Journal Mammalogy 67: 660-671. [ Links ]
16. Flemming, T.H., E.R. Heithaus & W.B. Sawyer. 1977. An experimental analysis of the food location behavior of frugivorous bats. Ecology 58: 619-627. [ Links ]
17. Freeman, P. 2000. Macroevolution in microchiropteran: recopling morphology and ecology with phylogeny. Evolutionary Ecology Research 2:317-335. En Aguirre L. F., Herrel A., Van Damme R y Maticen E. 2003. The implications of hardness for diet in bats. Functional Ecology 17: 201-212. [ Links ]
18. Gardner, A.L. 1977. Feeding habits. Pp 293-350 en Robert Baker, J. Knox jr. And Carter D. C. (eds.) Biology of Bats of the New World family Phillostomidae. Part II. Special publication the Museum Texas Tech University No. 13. [ Links ]
19. Gorchov, D.L., F. Cornejo, C. Ascorra & M. Jaramillo. 1993. The role of seed dispersal in the natural regeneration of rain forest after strip-cutting in the Peruvian Amazon. Vegetation 107-108: 339-349. [ Links ]
20. Graham, G.L. 1983. Changes in bat species-diversity along an elevational gradient up the peruvian andes. Journal Mammalogy 64(4):559-571. [ Links ]
21. Graham, G.L. 1990. Bats versus Birds: comparation among Peruvian volant vertebrates faunas along an elevation gradient. Journal of Biogeography 17: 657-668. [ Links ]
22. Heithaus, E.R. & T.H. Flemming. 1978. Foraging movements of a frugivorous bat, Carollia perspicillata. Ecological Monographs 48: 127-143. [ Links ]
23. Holdrige, L.R. 1982. Ecología basada en zonas de vida. Instituto Interamericano de Cooperación para la Agricultura. San José, Costa Rica. [ Links ]
24. Howell, D.L. 1979. Flock foraging in nectar-feeding bats: adventages to the bats and the host plants. American Naturalist 114: 817-832. [ Links ]
25. Humphrey, S.R. & F.J. Bonaccorso. 1979. Population and Community Ecology en Biology of Bats of the New World family Phyllostomidae. Part III. Robert Baker, J. Knox jr. And Carter D. C. Special publication the Museum Texas Tech University No. 16 [ Links ]
26. Jones, C. 1976. Economics and conservation. Pp 133-145 en Biology of bats of the new world. Family Phyllostomidae. Part I. Robert Baker, J. Knox jr. And Carter D. C. Special publication the Museum Texas Tech University. [ Links ]
27. Isaac-Junior, J.B. & E.L. Sabato. 1994. Caracterização da fauna de morcegos (Mammalian:Chiroptera), na área de influencia da variante ferroviaria Capitao Eduardo/Costa Laserda no municipio de Caeté (Minas Gerais). Bios, Belo Horizonte 2(2): 25-29. [ Links ]
28. Karr, J. R. 1971. Structure of avian communities in selected Panama and Illinois habitats. Ecology Monographs 41:207-233. [ Links ]
29. Koopman, K.F. 1993. Order Chiroptera. Pp 137-241 en Mammals species of the world, 2nd ed. D.E. Wilson & D. M. Reeder, eds. Smithsonian Institution Press, Washington D.C. [ Links ]
30. Kunz, T.H. 1973. Resource utilization: temporal and spacial components of bat activity in Central Iowa. Journal Mammalogy 54(1): 14-32. [ Links ]
31. La Val, R.K. 1970. Banding returns and activity periods of some Costa Rican bats. Southwertern Nat. 15:1-10 en Fenton M. B. and Kunz T. H. 1997. Movements and behavior in Biology of Bats of the New World family Phillostomidae. Part II. Robert Baker, J. Knox jr. And Carter D. C. Special publication the Museum Texas Tech University No. 13 [ Links ]
32. Linares, O.J. 1987. Murciélagos de Venezuela. Cuadernos Lagoven. [ Links ]
33. Mc Manus, J.J. 1977. Thermoregulation. en Biology of Bats of the New World family Phillostomidae. Part II. Robert Baker, J. Knox Jr. And Carter D. C. Special publication the Museum Texas Tech University No. 13. [ Links ]
34. Medellín, R.A., M. Equihua & M.A. Almin. 2000. Bat diversity and abundance as indicator of disturbance in Neotropical Rainforest. Conservation Biology 14(6): 1666-1675. [ Links ]
35. Mickleburgh, S.P., A.M. Hutson & P. Racey. 2002. A review of the global conservation status of bats. The International Journal of Conservation Oryx 36(1): 18-34. [ Links ]
36. Muñoz-Arango, J. 1986. Murciélagos del Parque Natural El Refugio (Antioquia, Colombia) Actualidades Biológicas 15:26-34. [ Links ]
37. Muñoz-Arango, J. 1995. Clave de murciélagos vivientes de Colombia. Editorial Universidad de Antioquia, Medellín. [ Links ]
38. Muñoz-Arango, J. 2001. Los murciélagos de Colombia. Sistemática, Distribución, Descripción, Historia natural y Ecología. Editorial Universidad de Antioquia, Medellín. [ Links ]
39. Narváez, Z. & P.J. Soriano. 1996. Composición y estructura de la comunidad de Sphingidae (Insecta: Lepidoptera) de una selva nublada andina. Ecotropicos 9: 9-20. [ Links ]
40. Norberg, U.M. & J.M.V. Rayner. 1987. Ecological morphology and flight in bats (Mammalian:Chiroptera): wing adaptation, flight performance, foraging strategy and echolocation. Philosophic Transactions of the Royal Society of London, Biological Sciences 316: 335-427. [ Links ]
41. Ospina-Ante, O. & L.G. Gómez. 1999. Riqueza, abundancia relativa y patrones de actividad temporal de la comunidad de murciélagos de la Reserva Natural La Planada, Nariño, Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. 23(Suplemento especial): 659-669. [ Links ]
42. Patterson, B.P., V. Pacheco & S. Solari. 1996. Distribution of bats along an elevation gradient in the Andes of south-eastern Peru. Journal of Zoology 240: 637-658. [ Links ]
43. Pedro , W. A. & V.A. Taddei. 1997. Taxonomic assamblage of bats from Panga Reserve, southeastern Brazil: abundant patterns and trophic relation in the Phyllostomidae (Chiroptera). Boletín do Museu de Biología Mello Leitao, Nova Serie, Santa Teresa, 6:3-21. [ Links ]
44. Pérez-Torrez, J. 2000. Estructura y composición de la comunidad de murciélagos: Comparación entre fragmentos y áreas continuas de bosque andino. Fundación para la Promoción de la investigación y la tecnología. Proyecto No. 915. [ Links ]
45. Rangel, J.O. 1997. Colombia Diversidad Biotica I. Instituto de Ciencias, Universidad Nacional de Colombia. Bogotá D.C. [ Links ]
46. Rhabek, C. 1995. The elevation gradient of species richness: a uniform pattern? Ecography 18: 200-205. [ Links ]
47.Sazima, M. & I. Sazima. 1978. Bat pollination of the passion flower, Passiflora mucronata in sothwestern Brazil. Biotropica 10(2):100-109. [ Links ]
48. Shepherd, U.L. & D.A. Kelt. 1999. Mammalian species richness and morphological complexy along an elevation gradient in the arid south-west. Journal of Biogeography 26: 843-855. [ Links ]
49. Silva, T.G. 1979. Los murciélagos de Cuba. Academia de Ciencias de Cuba. La Habana. [ Links ]
50. Soriano, P.J. 2000. Functional structure of bat communities in tropical rainforest and Andean cloud forest. Ecotropicos 13(1): 1-20. [ Links ]
51. Soriano, P. J., A. Díaz de Pascula, J. Ochoa & M. Aguilera. 1999. Biogeographic análisis of the mammal communities of the Venezuela Andes. En: P.J. Soriano (ed.). 2000. Functional structure of bat communities in tropical rainforest and Andean cloud forest. Ecotropicos 13(1): 1-20. [ Links ]
52. Tamsitt, J.R. 1966. Altitudinal distribution, ecology and general life history of bats in the Andes of Colombia. American Physiology Society. Yearbook. pp.372-373. [ Links ]
53. Tamsitt, J. R.1967. Niche and species diversity in neotropical bats. Nature 5078(213): 784-786. [ Links ]
54. Tamsitt, J.R. & D. Valdivieso. 1961. Notas sobre actividades nocturnas y estados de reproducción de algunos quirópteros de Costa Rica. Revista Biología Tropical 9:219-225. En: Fenton M. B. and Kunz T. H. 1997. Movements and behavior en Biology of Bats of the New World family Phillostomidae. Part II. Robert Baker, J. Knox jr. And Carter D. C. Special publication the Museum Texas Tech University. No. 13 [ Links ]
55. Terborgh, J. 1971. Distribution on enviromental gradients: Theory and a preliminary interpretation of distribution patterns in the avifauna of the Cordillera Vilcabamba, Peru. Ecology 52: 23-40. [ Links ]
56. Terborgh, J. 1977. Bird species diversity on an Andean elevational gradient. Ecology 58: 1007-1019. [ Links ]
57. Turner, D. C. 1975. The vampiro bats, a field study in behavior and ecology. Jhon Hopkins University Press, Baltimore, vii + 1-145 en Fenton M. B. and Kunz T. H. 1997. Movements and behavior in Biology of Bats of the New World family Phillostomidae. Part II. Robert Baker, J. Knox jr. And Carter D. C. Special publication the Museum Texas Tech University. No. 13 [ Links ]
58. Voss R. S y Emmons L. H. 1996. Mammalian diversity on neotropical lowland rain forest: a preliminary assessment. American Museum of Natural History 230: 3-115. [ Links ]
59. Wilson, D. E. 1973. Bat faunas: a trophic comparison. Systematic Zoology 22(1): 14-29. [ Links ]
Recibido: 22/11/2006
Aceptado: 27/04/2007
Especímenes testigo
Pteronotus parnellii: CZUT-M: 0186-0280; Phyllostomus discolor: CZUT-M: 0237-0360-0361; Phyllostomus hastatus: CZUT-M: 0285-0306; Lonchophylla mordax: CZUT-M: 0315; Anoura caudifer: CZUT-M: 0204-0263; Anoura geoffroyi: CZUT-M: 0223-0258; Carollia brevicauda: CZUT-M: 0187-0199-0200-0201-0202-0203-0209-0240-0284-0318-0319-0320-0349-0365; Carollia castanea: CZUT-M: 0358; Carollia perspicillata: CZUT-M: 0190-0191-0194-0195-0196-0197-0212-0230-0231-0232-0241-0242-0266-0267-0268-0269-0308-0309-0310-0311-0312-0313-0335-0342-0343-0353-0354-0355-0371-0372-0376-0380; Artibeus jamaicensis: CZUT-M: 0233-0243-0244-0245-0251-0252-0253-0254-0255-0256-0257-0286-0287-0288-0289-0290-0291-0292-0293-0294-0295-0298-0299-0300-0301-0302-0303-0304-0305-0345-0346-0347-0377; Artibeus lituratus: CZUT-M: 0225-0247-0248-0270-0271-0272-0273-0274-0275-0276-0277-0278-0279-0329-0330-0344-0363; Artibeus cf. phaeotis: CZUT-M: 0316-0333-0348-0356-0368-0369-0384; Sturnira aratathomasi: CZUT-M: 0260-0261-0378-0379; Vampyrops aurarius: CZUT-M: 0206-0207-0208-0226-0227-0228-0317-0331-0359; Vampyrops dorsalis: CZUT-M: 0189; Vampyrops helleri: CZUT-M: 0249-0250-0281-0282-0341-0364; Vampyrops umbratus: CZUT-M: 0224; Vampyrops vittatus: CZUT-M: 0188-0198-0327; Sturnira bidens: CZUT-M: 0328-0390; Sturnira bogotensis: CZUT-M: 0210-0211-0221-0357; Sturnira erythromos : CZUT-M: 0205-0213-0214-0215-0216-0217-0218-0219-0322-0323-0324-0325-0338-0339-0389-0392; Sturnira lilium: CZUT-M: 0234-0238-0239-0307-0334-0362; Sturnira ludovici: CZUT-M: 0192-0193-0222-0321-0336-0340-0373-0391; Sturnira luisi: CZUT-M: 0246-0296-0350-0351-0352-0374; Sturnira tildae: CZUT-M: 0370; Uroderma bilobatum : CZUT-M: 0262-0283-0375: Vampyressa pusilla: CZUT-M: 0229-0264-0265-0332; Desmodus rotundus : CZUT-M: 0220-0326-0381-0382-0385; Eptesicus brasiliensis: CZUT-M: 0367-0383; Histiotus montanus: CZUT-M: 0259; Myotis keaysi: CZUT-M: 0337-0386-0387-0388-0393; Lasiurus egregius: CZUT-M: 0213; Molossops planirostris: CZUT-M: 0235-0236-0297; Promops centralis: CZUT-M: 0314.