Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Caldasia
versão impressa ISSN 0366-5232versão On-line ISSN 2357-3759
Caldasia v.29 n.2 Bogotá jul./dez. 2007
ESTRUCTURA DE LA MACROFAUNA DE INVERTEBRADOS PRESENTE EN LOS NIDOS DEL PEZ MALACANTHUS PLUMIERI (BLOCH, 1786) (PERCIFORMES: MALACANTHIDAE) EN LA BAHÍA DE NENGUANGE, PARQUE NACIONAL NATURAL TAYRONA, MAR CARIBE COLOMBIANO
Invertebrate macrofaunal structure present in nests of Malacanthus plumieri (Bloch, 1786) (Perciformes: Malacanthidae) in Nenguange Bay, Tayrona Natural Park, Colombian Caribbean sea
JOSÉ MANUEL GUTIÉRREZ-SALCEDO
MARÍA ISABEL AGUILAR-PÉREZ
ADRIANA BERMUDEZ
NÉSTOR HERNANDO CAMPOS
GABRIEL R. NAVAS-S.
Instituto de Investigaciones Marinas y Costeras (INVEMAR), Cerro Punta de Betín, Apartado 1016, Santa Marta, Colombia. manologutierrezsalcedo@hotmail.com
Universidad Francisco de Paula Santander, Norte de Santander, Colombia. mariaiaguilar@hotmail.com
Museo de Historia Natural Marina de Colombia, INVEMAR, Apartado 1016 Santa Marta, Colombia. abermudezt@gmail.com
CECIMAR, Instituto de Ciencias Naturales, Universidad Nacional de Colombia, INVEMAR, Apartado 1016, Santa Marta, Colombia. nhcamposc@bt.unal.edu.co
Museo de Historia Natural Marina de Colombia, INVEMAR, Apartado 1016 Santa Marta, Colombia. gnavas@invemar.org.co
RESUMEN
Se realizó la caracterización de la estructura de invertebrados presentes en los montículos de nidos del pez Malacanthus plumieri durante el segundo semestre de 2003, en la bahía de Nenguange, con el fin de establecer diferencias entre dos grupos de nidos diferenciados por su profundidad (5 y 17 m). Se colectaron en total 1760 individuos pertenecientes a 152 especies de siete Phyla, la mayoría de las cuales se encuentra asociadas a sustratos rocosos, arrecifes, fondos blandos y cascajo. Por medio de un análisis ecológico multivariado, se estableció la estructura de la comunidad, además, se calcularon los principales atributos ecológicos tales como riqueza, abundancia, diversidad, uniformidad y equidad para cada uno de los grupos de nidos establecidos previamente. La caracterización de la comunidad mostró la presencia de 32 especies generalistas (presentes en los dos grupos de nidos) de las cuales Brachycarpus biunguiculatus, Micropanope spinipes y Synalpheus fritzmuelleri tienen una frecuencia relativa superior al 70% cada una. En la franja de los 5 m de profundidad se colectaron, además de las generalistas, 39 especies características (ej. Mithrax sculptus y Mithrax forceps) y 38 especies representadas por un solo individuo. En la franja de los 17 m de profundidad se presentaron 19 especies características (ej. Munida angulata y Petrolisthes galathinus) y 24 especies representadas por un solo individuo. Los atributos ecológicos evaluados no mostraron diferencias significativas entre las dos franjas batimétricas; el índice de correlación tampoco mostró una influencia directa entre el perímetro de los montículos y la estructura de la comunidad.
Palabras clave. Malacanthus plumieri, ensamblaje, invertebrados, bahía de Nenguange, Caribe colombiano.
ABSTRACT
A characterization of the macrofauna structure of invertebrates present in the mound nests of the fish Malacanthus plumieri, was performed in Bahía Nenguange during the second semester of 2003 in order to establish differences between two groups of nests at different depths (5 and 17 m). A total of 1 760 organisms, belonging to 152 species from 7 Phyla were collected; most of these organisms have been previously associated to rocky bottoms, reefs, soft bottoms and rubble. The structure of the community was established using multivariate ecological analysis (i.e. CLUSTER, NMDS), in addition, different ecological indexes such as richness, abundance, diversity, uniformity and evenness were applied for each of the groups of nests previously mentioned. The characterization of the community showed the presence of 32 generalistic species (present in both groups of nests); from these, Brachycarpus biunguiculatus, Micropanope spinipes y Synalpheus fritzmuelleri showed a relative frequency higher than 70% each. At the 5m depth interval, beside the generalistic species, 39 characteristic species (i.e. Mithrax sculptus y Mithrax forceps) and 24 species represented by only one organisms were collected. At the 17m depth interval, 19 characteristic species (i.e. Munida angulata y Petrolisthes galathinus) and 24 species represented by only one organism were gathered. The ecological attributes evaluated did not show significative differences between depth intervals; the correlation index did not show direct differences between the mound’s perimeter and the community structure.
Key Words. Malacanthus plumieri, assemblages, invertebrates, Nenguange bay, Colombian Caribbean Sea.
INTRODUCCIÓN
Existen numerosos trabajos taxonómicos sobre la distribución geográfica y el valor comercial de las especies de la familia Malacanthidae, entre ellas Malacanthus plumieri (Bloch 1786) (e.g. Dooley 1978, Cervigón & Fischer 1979, Zaneveld 1983, Cervigón et al. 1992, Anónimo 1 1999, Anónimo 2 2001). Esta especie es llamada comúnmente en el mar Caribe como Matajuelo. Es un pez alargado y fusiforme, de color azul verdoso siendo más oscura su parte dorsal, con aletas anal y dorsal largas, amarillas y continuas, alcanzando hasta 60 cm de longitud total (Cervigón et al. 1992). M. plumieri habita usualmente entre 10 y 60 m de profundidad (Cervigón et al. 1992, Coleman & Williams 2002) en zonas marginales de los arrecifes coralinos, asociado preferentemente a fondos arenosos (U.S. Caribbean Fishery Management Council 1998, Sedberry et al. 2004). Es una especie sedentaria, fuerte y territorialista, que pasa la mayor parte de su ciclo de vida alrededor de un solo nido (Baird & Baird 1992) formando “pueblos” o “condominios” (Northeast Region Essential Fish Habitat Steering Committee 2002, Coleman & Williams 2002). Cada nido está compuesto por una depresión del tamaño del cuerpo del individuo formado por las ondulaciones del pez sobre la arena y encima de esta depresión, el pez pone fragmentos de roca, coral muerto y conchas construyendo activamente un montículo de cascajo, el cual utiliza como refugio (Colin 1973, Dooley 1978, Büttner 1996). Dichos fragmentos varían en tamaño entre 2 y 18 cm, los cuales son dispuestos por el pez de forma diferencial en el nido, ubicando los de menor tamaño al centro de la estructura. El tamaño medio de los montículos en el área de Santa Marta es de 133 x 102 x 22 cm (Büttner 1996).
Aparentemente la función de los montículos es proveer al M. plumieri de protección contra los depredadores y las condiciones hidrodinámicas. Además puede aprovechar como fuente de alimento a otras especies tanto de invertebrados como de vertebrados pequeños que utilizan el espacio entre los materiales del nido como refugio, los cuales utilizan un sustrato rocoso inusual en medio de fondos típicamente arenosos. Entre los grupos más conspicuos encontrados en los montículos de M. plumieri se pueden mencionar las algas calcáreas, verdes, rojas y pardas, los foraminíferos, los bryozoos, los hidroides, los tunicados y las esponjas (Baird 1988, Baird & Liley 1989, Coleman & Williams 2002, Northeast Region Essential Fish Habitat Steering Committee 2002, Sedberry et al. 2004). También es común encontrar larvas de diversas especies, así como peces pequeños y macroinvertebrados (Büttner 1996). De estos últimos los más representativos en bahía de Nenguange son los crustáceos de las familias Majidae (Vélez 1977) y Xanthidae (Schmitting-Falk 1990), los moluscos de las familias Turridae, Fissurellidae y Columbellidae (caracoles) y Veneridae y Tellinidae (bivalvos) (Díaz 1994, García-Valencia & Díaz 2000), los equinodermos como Amphiuridae (estrellas quebradizas) y Cidaridae (erizos) (Álvarez & Ramón 1981, Gallo 1988a, 1988b), y los poliquetos como Sabellidae y Nereidae (Laverde-Castillo & Rodríguez-Gómez 1987). Por ello, M. plumieri es considerado un “Constructor de Ecosistemas” (Baird 1988, Baird & Liley 1989, Coleman & Williams 2002).
Pese a lo diverso e interesante de los nidos de M. plumieri en Colombia, solamente se ha realizado un estudio de la fauna asociada a los montículos, enfocado principalmente a la ictiofauna y el tipo de cascajo (Büttner 1996). Para complementar la información referente a la estructura de la macrofauna de invertebrados presente en los montículos, se realizaron muestreos en los nidos de M. plumieri en la bahía de Nenguange, Parque Nacional Natural Tayrona (PNNT) a dos profundidades diferentes entre agosto y octubre de 2003.
MATERIALES Y MÉTODOS
El PNNT está ubicado sobre la costa oriental del departamento del Magdalena, constituyendo parte de un complejo litoral formado por la fracción noroccidental de la Sierra Nevada de Santa Marta, lo que ocasiona la presencia de costas acantiladas, bahías y ensenadas con fondos duros, y una plataforma continental muy estrecha (Garzón-Ferreira & Cano 1991).
Entre las características oceanográficas más sobresalientes de la región está un evento estacional de surgencia (Bula-Meyer 1977, Díaz & Gómez 2000) durante los meses de diciembre – abril (época seca), provocado por la interacción de los vientos Alisios con la geomorfología costera. Este evento genera un descenso en la temperatura superficial del agua (34.5ºC en promedio) y aumento de la salinidad (30 en promedio). En el segundo periodo del año, de mayo a noviembre (época lluviosa), la influencia de la contracorriente del Caribe aporta aguas cálidas (36ºC en promedio) de menor salinidad (28 en promedio) y con alto contenido de material disuelto y en suspensión (Ramírez 1983, Giraldo 1994, Garzón-Ferreira 1998). Dicho régimen climático puede tener variaciones interanuales (Bula-Meyer 1985).
La elevada heterogeneidad topográfica y las condiciones climáticas imperantes, permiten la concentración de la mayoría de los ambientes litorales del neotrópico en un área relativamente reducida (Díaz et al. 2000). Ambientes como fondos sedimentarios, arrecifes coralinos, litorales rocosos, praderas de fanerógamas, tapetes de algas, playas de arena y pequeños manglares, se conjugan en un mosaico de comunidades biológicas muy diversas particularmente concentradas en el interior de las bahías (Díaz 1991).
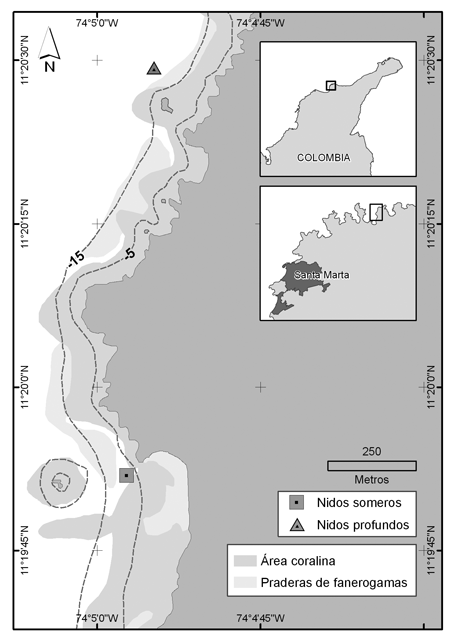
En el área de estudio se realizaron buceos exploratorios, permitiendo la ubicación de 28 nidos formados por individuos de la especie M. plumieri, de los cuales 15 (nidos N1 a N15) estaban ubicados entre 4.6 y 7.6 m de profundidad y 13 (nidos N16 a N28) entre 13.7 y 21.3 m. Los nidos N1 a N15 se muestrearon frente de playa del Muerto (Figura 1), en un plano arenoso somero, rodeado por formaciones de corales masivos grandes y abundantes pastos marinos; con condiciones hidrodinámicas estables (poco viento y oleaje) debido a la protección del acantilado. Los nidos N16 a N28, estaban aproximadamente a un kilómetro de distancia de la primera zona en dirección a la boca de la bahía (Figura 1). También se hallaban en un plano arenoso, adyacentes a formaciones coralinas pequeñas, de especies ramificadas sobre las rocas acumuladas de la erosión de los acantilados; con poca presencia de pastos marinos distantes de los nidos; la ubicación de esta zona la expone a mayor influencia del viento y del oleaje (Díaz et al. 2000).
Figura 1. Ubicación del área de muestreo en la bahía de Nenguange (PNNT). El cuadrado señala la ubicación de los nidos de la franja somera (5 m aprox.) y el triángulo los nidos de la zona profunda (17 m. aprox.) (Laboratorio Sistemas de Información. INVEMAR 2006).
Para cada nido se midió la profundidad mediante un profundímetro y el perímetro con un decámetro y las muestras fueron colectadas mediante un succionador semejante al descrito por Brook (1978). La succión del material del nido se realizó durante 1.5 min en cada nido, removiendo el cascajo durante la colecta del material con el fin de aumentar la efectividad de la captura de acuerdo con las recomendaciones de Puentes (1990) y en cada nido se utilizó una bolsa colectora nueva. El material colectado fue llevado al laboratorio en bolsas de plástico con agua de mar, para luego ser preservado en etanol al 70%. Una vez en el laboratorio todo el material fue separado por grupos taxonómicos y se realizó la identificación del material hasta el nivel taxonómico más preciso posible, dependiendo de la literatura disponible y el estado de los ejemplares, en la mayoría de los casos se determinó hasta especie y en algunos casos solamente se logró la identificación hasta género y familia.
Con base en el número de individuos y de especies colectados se determinó la abundancia y la frecuencia relativas por especie. Los datos fueron transformados con raíz cuadrada para disminuir el dominio de las especies con mayor abundancia. Con el propósito de comparar las estructuras de la comunidad con respecto a la batimetría se realizaron un Análisis de Similitud de la Matriz de Abundancia a una vía (ANOSIM), y prueba de T o de Mann-Whitney a los siguientes descriptores univariados: índice de diversidad de Shannon – Wiener (H’), el H’ máximo, la diversidad de Hill (N1), la uniformidad de Pielou (J’) y la equidad de Hill (E5) (Ludwig & Reynolds 1988, Clarke & Warwick 1994).
Con el fin de caracterizar la composición de especies de las dos franjas batimétricas se realizó un análisis inverso, determinando las especies generalistas (< 70% de abundancia relativa en los dos grupos), características (70-90 % de abundancia relativa dentro del grupo) y exclusivas (> 90 % de abundancia relativa dentro del grupo). Además, dentro de esta clasificación, se tuvieron en cuenta como representativas para cada grupo, las especies que tenían valores de frecuencia relativa mayores del 70%. Finalmente, se evaluó la relación del perímetro de cada nido y la profundidad con la estructura del ensamblaje de invertebrados mediante un análisis de ordenación (Escalamiento Multidimensional no Métrico - NMDS), de clasificación (CLUSTER) y una prueba de BIO-ENV basados en el índice de similitud de Bray-Curtis entre nidos, por medio del programa estadístico PRIMER-E versión 5.2.2. (Ludwig & Reynolds 1988, Clarke & Warwick 1994).
RESULTADOS
Los nidos muestreados estaban en dos franjas batimétricas, la primera ubicada entre 4 y 7 m de profundidad con un promedio de X= 5.95 (± 0.94 m d.e.), la cual será denominada en este trabajo como la franja somera. La segunda franja fue ubicada entre 12 y 25 m de profundidad con un promedio de X= 17.13 (± 2.22 m d.e.) la cual será denominada como la franja profunda. Los nidos someros fueron más pequeños y uniformes (X: 3.45 ± 0.95 m d.e. de perímetro) que los profundos (X: 4.45 ± 1.39 m d.e.). Se colectaron en total 1 760 individuos pertenecientes a 152 especies de siete Phyla, de los cuales, 1074 individuos (117 especies de siete Phyla) fueron colectados en los nidos someros y 686 individuos (97 especies de seis Phylla) en los profundos. De todas las especies, 62 estuvieron representadas por un solo individuo (Tabla 1).
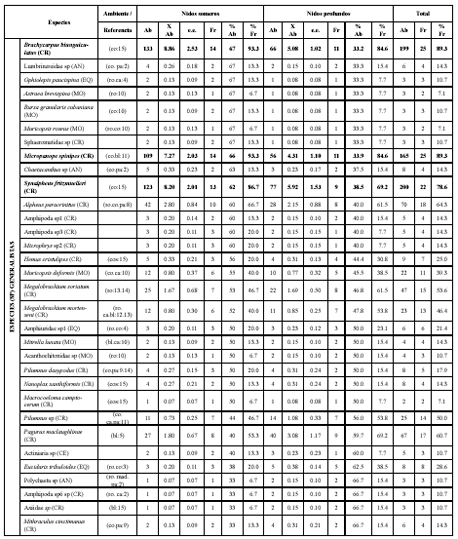
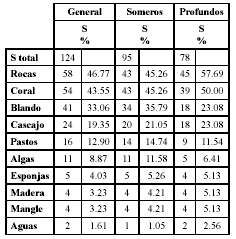
Tabla 1. Análisis inverso de las especies de invertebrados colectadas los montículos del pez Malacanthus plumieri en bahía de Nenguange durante el segundo periodo de 2003.
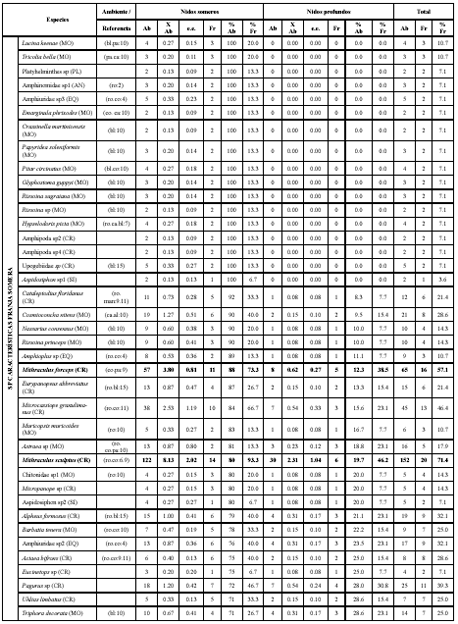
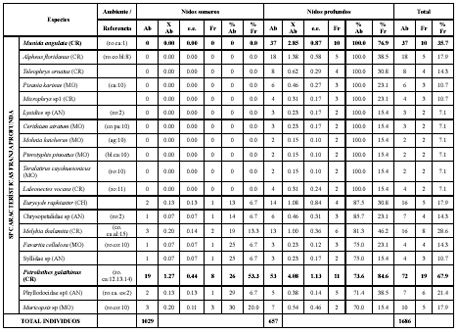
Ab: abundancia, Fr: frecuencia, %Ab: abundancia relativa, %Fr: frecuencia relativa, XAb: promedio de abundancia, e.e.: error estándar. AN: anélidos, CE: celenterados, CH: chelicerata, CR: crustáceos, EQ: equinodermos, MO: moluscos, PL: platelmintos, SI: sipuncúlidos. ag: aguas profundas, al: algas, bl: fondos blandos, ca: cascajo, co: corales, cos: cosmopolita, es: esponjas, mad: madera, man: mangle, pa: pastos marinos, ro: hábitat rocoso. 1: Büttner (1993), 2: Fauchald (1977), 3: Gallo (1988 a), 4: Gallo (1988 b), 5: Garcia-Gómez (1982), 6: Hazlett (1979), 7: Humann y Deloach (2002), 8: Kim y Abele (1988), 9: Lemaitre (1981), 10: Puyana y Díaz (1994), 11: Rathbun (1930), 12: Rodríguez (1980), 13: Werding (1978), 14: Werding (1984), 15: Williams (1984). Los valores en negrilla corresponden a las especies con más del 70% de abundancia y frecuencia relativa.
La mayor abundancia correspondió a los crustáceos decápodos, entre los que se destacaron Synalpheus fritzmuelleri y Brachycarpus biunguiculatus. Ninguna de las especies estuvo presente en todas las muestras y solamente Micropanope spinipes, Mithraculus sculptus, S. fritzmuelleri y B. biunguiculatus alcanzaron un frecuencia relativa mayor al 70 %. Para los nidos someros, los decápodos Mithraculus forceps, S. fritzmuelleri, B. biunguiculatus, M. spinipes y M. sculptus, alcanzaron abundancias y frecuencias superiores al 70 % dentro del grupo; y para los profundos, lo hicieron Munida angulata, Petrolisthes galathinus, B. biunguiculatus y M. spinipes (Tabla 1).
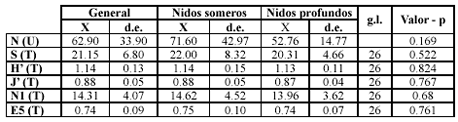
El ANOSIM a una vía mostró diferencias significativas entre la composición del ensamblaje de invertebrados de los nidos someros y profundos (R global 0.225; p = 0.001; 999 permutaciones), pero no se encontraron diferencias significativas en los atributos descriptivos del ensamblaje con las pruebas de T y Mann-Witney (Tabla 2).
Tabla 2. Comparación de los índices ecológicos, mediante la prueba T (T) y el Test de Mann-Witney (Wilcoxon) (U), con Valores p > 0,05. N: abundancia, S: riqueza, H’: índice de Shannon, J’: uniformidad de Pielou, N1: especies abundantes, E5: equidad de Hill. X: promedio; d.e.: desviación estándar; g.l.: grados de libertad.
De acuerdo con el análisis inverso, se clasificaron como representativas del grupo de especies generalistas de los montículos a B. biunguiculatus, M. spinipes y S. fritzmuelleri; las especies representativas del grupo de especies características de los nidos someros fueron M. sculptus y M. forceps y solamente P. galathinus fue representativa del grupo de especies características de los nidos profundos. El único individuo representativo del grupo de especies exclusivas, fue M. angulata (Tabla 1). Aparte de estas especies, se identificaron 55 especies (36.2 % del total) presentes únicamente en los nidos someros y 34 para los profundos (22.4 % del total). Mientras que para las especies que se hallaron en las dos profundidades, sólo 29 especies (19.1 % del total) se distribuyeron uniformemente, 20 (13.2 % del total) tenían más abundancia en los nidos someros y siete especies (4.6 % del total) fueron más abundantes en los profundos.
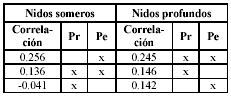
El análisis BIO-ENV mostró que la máxima correlación con la estructura de los ensamblajes de los nidos fue el perímetro del nido en los montículos someros, y la combinación profundidad - perímetro en los profundos, aunque con un valor de correlación bajo (Tabla 3).
Tabla 3. Factor de correlación (BIO-ENV) entre la composición de especies y la abundancia, y el perímetro (Pr) y la profundidad (Pe) de los nidos del pez M. plumieri colectados en el segundo periodo de 2003.
La ordenación y clasificación de los nidos someros mostraron que tres nidos (N9, N11 y N13) presentan un comportamiento independiente, debido a su baja riqueza y abundancia, mientras que los 12 restantes forman un grupo homogéneo. Los nidos profundos forman aparentemente una comunidad homogénea (Figura 2 y Figura 3).
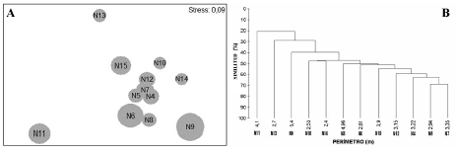
Figura 2. Análisis multivariados basados en los perímetros de los nidos colectados en el segundo periodo de 2003. A. Mapa de ordenación (NMDS) de los nidos de la franja somera; B. Dendrograma de los nidos de la franja somera. N4: 3.22 m; N5: 2.94 m; N6: 4.96 m; N7: 3.35 m; N8: 2.81 m; N9: 5.40 m; N10: 2.53 m; N11: 4.10 m; N12: 3.15 m; N13: 2.70 m; N14: 2.40 m; N15: 3.90 m.
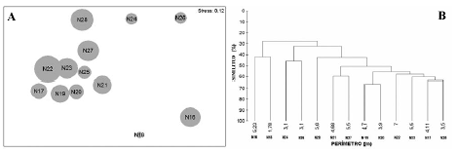
Figura 3. Análisis multivariados basados en los perímetros de los nidos colectados en el segundo periodo de 2003. A. Mapa de ordenación (NMDS) de los nidos de la franja profunda; B. Dendrograma de los nidos de la franja profunda. N16: 5.23 m; N17: 4.11 m; N18: 1.78 m; N19: 4.70 m; N20: 3.90 m; N21: 4.68 m; N22: 7.00 m; N23: 5.50 m; N24: 3.10 m; N25: 3.50 m; N26: 3.10 m; N27: 5.50 m; N28: 5.80 m.
La influencia del perímetro de los nidos someros en la estructura de los ensamblajes, se observó en el NMDS, siguiendo una tendencia en diagonal de derecha a izquierda, con los nidos de menor diámetro en la parte superior derecha y los de mayor diámetro en la parte inferior izquierda. En los nidos profundos, no se observó influencia del perímetro (Figura 2 y Figura 3).
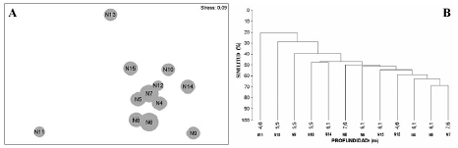
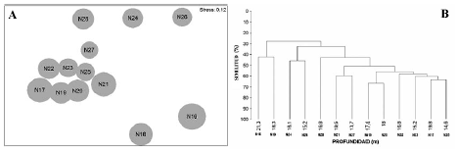
La ordenación y la clasificación de los nidos de la franja somera no evidenció una influencia de la profundidad. Por el contrario, en la franja de mayor profundidad los nidos menos profundos tienden a agruparse en la parte superior del NMDS y los de mayor profundidad hacia la parte de abajo. Los nidos alejados poseen profundidades similares, y se encuentran en parejas por ejemplo los nidos N16 y N18 (profundidad promedio de 19.3 + 2.1 m) y N24 y N26 (15.7 + 0.6 m). Estas tendencias son apoyadas por los respectivos dendrogramas en cada franja batimétrica (Figura 4 y Figura 5).
Figura 4. Análisis multivariados basados en la profundidad de los nidos colectados en el segundo periodo de 2003. A. Mapa de ordenación (NMDS) de los nidos de la franja somera; B. Dendrograma de los nidos de la franja somera. N4: 3.22 m; N5: 2.94 m; N6: 4.96 m; N7: 3.35 m; N8: 2.81 m; N9: 5.40 m; N10: 2.53 m; N11: 4.10 m; N12: 3.15 m; N13: 2.70 m; N14: 2.40 m; N15: 3.90 m.
Figura 5. Análisis multivariados basados en la profundidad de los nidos colectados en el segundo periodo de 2003. A. Mapa de ordenación (NMDS) de los nidos de la franja profunda; B. Dendrograma de los nidos de la franja profunda. N16: 5.23 m; N17: 4.11 m; N18: 1.78 m; N19: 4.70 m; N20: 3.90 m; N21: 4.68 m; N22: 7.00 m; N23: 5.50 m; N24: 3.10 m; N25: 3.50 m; N26: 3.10 m; N27: 5.50 m; N28: 5.80 m.
DISCUSIÓN
La fauna de invertebrados presente en los nidos del pez M. plumieri en bahía de Nenguange, estuvo constituida por especies que suelen encontrarse bajo rocas y cantos rodados o en litorales rocosos, arrecifes coralinos, sustratos blandos, cascajo y pastos marinos (Rathbun 1925, 1930; Fauchald 1977, Werding 1978, Hazlett 1979, Rodríguez 1980, Lemaitre 1981, García-Gómez 1982, Williams 1984, Laverde-Castillo & Rodríguez-Gómez 1987, Gallo 1988a, 1988b, Kim & Abele 1988, Rodríguez 1988, Díaz & Puyana 1994, Humann & Deloach 2002); todos estos ambientes fueron encontrados cerca de los fondos arenosos en donde se realizaron los muestreos (Tabla 1).
La mayoría de las especies colectadas durante el muestreo en los montículos de M. plumieri, habitan comúnmente, en sustratos rocosos y coralinos, seguidos de especies con preferencias por sustratos blandos y de cascajo (Tabla 4).
Tabla 4. Proporción de las especies de invertebrados presentes en los montículos de cascajo de los nidos del pez M. plumieri colectados en el segundo periodo de 2003 que aportan los diferentes hábitats. S: número de especies que viven en dichos hábitats; %: proporción de las especies.
Las especies colectadas presentan comportamientos crípticos, con tamaños y formas corporales que les permiten camuflarse, defenderse de predadores y conseguir alimento entre los espacios intersticiales que forman el cascajo de los montículos (Büttner 1996), debido a que pueden presentar estructuras especializadas para la locomoción y alimentación en este tipo de biotopos (e.g. apéndices articulados y cortos en crustáceos). Esta diversidad de estrategias de vida y segregación de nichos permite la coexistencia de varios grupos en un mismo espacio y tiempo determinado (Young & Young 1982, Orth et al. 1984, Virnstein 1987).
Los camarones S. fritzmuelleri y B. biunguiculatus, especies generalistas identificadas en esta investigación, poseen intervalos batimétricos amplios (0 a 200 m de profundidad), con actividad nocturna, que utilizan como refugio las grietas de rocas y espacios entre los arrecifes coralinos para evitar los predadores potenciales durante el día. B. biunguiculatus es una especie limpiadora de peces arrecifales de las familias Pomacentridae y Muraenidae (Corredor 1978), peces típicos del arrecife coralino adyacente a los nidos en el PNNT (Büttner 1996). S. fritzmuelleri es una especie detritívora que se alimenta en los depósitos de sedimento que se forman en el cascajo (Felder 1982, Reed et al. 1982, Kim & Abele 1988).
Los anomuros comensales, como el ermitaño Pagurus maclaughlinae (Sánchez & Campos 1978, García-Gómez 1982) y las especies de hábitos filtradores como los porcelánidos Megalobrachium soriatum y P. galathinus, se encuentran hasta los 50 m de profundidad. M. soriatum habita generalmente sustratos someros, mientras que P. galathinus se encuentra a mayores profundidades. Su distribución depende, en gran medida, de organismos sésiles formadores de hábitat y son indicadores de alta diversidad y complejidad de las estructuras de sustratos duros (Reed et al. 1982). Los porcelánidos emplean el tercer par de maxilípedos para capturar partículas en suspensión mientras están posados en el cascajo, siendo muy abundantes en casi todos los ambientes litorales del mar Caribe colombiano (Werding 1978, 1982, 1984). Munida angulata de la familia Galatheidae, es de hábitos crípticos y carnívoros, aunque pueden presentar comportamientos detritívoros, los ejemplares de esta especie viven solitarios en estado adulto y son territorialistas (Gutiérrez-Salcedo & Aguilar-Pérez com. per.). Ejemplares de esta especie han sido colectados en arrastres de más de 40 m de profundidad (Haig 1956), sin embargo se puede encontrar en los nidos del PNNT a 25 y 15 m (Büttner 1996).
Los cangrejos májidos Mithrculus sculptus y M. forceps se encuentran generalmente sobre sustratos duros someros, suelen ser agresivos y no presentan camuflaje. Su dieta alimenticia se basa principalmente en algas, material particulado y otros organismos. Muestran preferencia por hábitats con presencia de praderas de pastos marinos y de rocas y cantos sobre el sustrato. Presentan un caparazón redondeado u ovalado, más o menos liso y aplanado, con apéndices cortos, les permite ocupar cuevas y otros espacios reducidos. Estas especies son frecuentes y abundantes en toda la zona del PNNT y del Caribe (Vélez 1977, 1978, Lemaitre 1981, Puentes et al. 1990).
Los moluscos fueron el segundo grupo más representativo en el estudio, mostrando valores altos de riqueza y bajos de abundancia con respecto a los valores de los crustáceos. Este esquema de distribución de la diversidad del grupo, ha sido documentado en ecosistemas de praderas de pastos marinos (Young & Young 1982), sustratos mixtos (Díaz 1994) y arrecifes coralinos (Díaz et al. 1990). La baja abundancia del grupo puede deberse a diferentes factores biológicos, como poca producción de larvas, estadios larvales con pocas defensas y limitada movilidad que facilita a sus predadores capturarlos (Young & Young 1982) y factores como las surgencias de aguas frías y la casi ausencia de la plataforma continental (Díaz 1994, Díaz & Puyana 1994). Por el contrario, este grupo presentó valores de riqueza de especies alta, la cual puede estar relacionada con la alta diversidad de sustratos y el mosaico de ecosistemas presentes en la zona. Este efecto permite, en un espacio relativamente reducido, la existencia de varios microhábitats que favorece la presencia de una alta diversidad de especies moluscos (Díaz et al. 1990). En los montículos de cascajo de M. plumieri se destacan las especies de gasterópodos de las familias Muricidae, Bursidae y Buccinidae que se distinguen por poseer conchas coniformes y tener un amplio espectro alimenticio (carnívoros de tejidos blandos de corales, esponjas, tunicados, equinodermos y otros moluscos, herbívoros y detritívoros) (Díaz & Puyana 1994).
Los otros grupos presentes, obtuvieron valores de abundancia y riqueza por debajo del 10 %. Los equinodermos estuvieron representados por el erizo de mar Eucidaris tribuloides, que puede ser encontrado entre conchas de moluscos, corales y bajo rocas en el borde del arrecife coralino adyacente a los nidos hasta unos 22 m de profundidad. Es una especie de cuerpo globoso-radial que puede soportar el embate del oleaje. También se encontraron varias especies de estrellas quebradizas de la familia Amphiuridae que habitan escombros de coral y rocas hasta los 15 m, este grupo se caracteriza por presentar movilidad limitada y un estrecho espectro alimenticio, la mayoría son herbívoras o detritívoras (Gallo 1988a, 1988b).
Las familias de poliquetos Phyllodocidae, Amphinomidae y Chrysopetalidae se caracterizan por ser de vida libre que viven en grietas o hendiduras, y tener abundancias y riquezas bajas con respecto a otros grupos de poliquetos de sustrato duros. Aunque se observaron numerosas especies formadoras de tubos, como las familias Eunicidae y las perforadoras de conchas y rocas como las familias Sabellidae y Pectinidae, éstas no fueron colectadas ni cuantificadas por el método de extracción empleado en este trabajo. Sin embargo, estudios como el de Fauchald (1977) muestran que la abundancia y riqueza de estos poliquetos en ambientes rocosos, es alta y supera a la diversidad de poliquetos de vida libre.
Con base en la estructura de la comunidad (composición y abundancia de especies) y por medio del ANOSIM se lograron establecer diferencias significativas entre los nidos ubicados en la franja somera y en la franja profunda. Esta evidencia de heterogeneidad, aún en áreas geográficamente cercanas, se ha registrado en otros estudios, los cuales sugieren que las características particulares de las zonas pueden generar microhábitats únicos dentro del área de distribución de las especies (Brook 1978, Virnstein 1987, Franke 2001). Además, se puede aceptar la hipótesis de partida de este estudio que asumía diferencias entre las zonas de muestreo reflejadas en la composición faunística de cada uno de los grupos de los nidos, suponiendo que la colonización de los montículos se hacía principalmente, de forma activa por los juveniles y adultos provenientes de los hábitats adyacentes a los montículos. Por esto se esperaba que la cercanía de los montículos de la franja somera a parches coralinos, praderas de pastos y litoral rocoso determinara las especies y su abundancia en esta franja. Los nidos de la franja profunda deberían a su vez reflejar así mismo la fauna característica de los sustratos blandos que rodean estos montículos como lo planteó Büttner (1996).
Las pruebas estadísticas de los índices ecológicos, no mostraron diferencias significativas entre los dos grupos batimétricos, lo que permite suponer que la estructura (ensamblajes) de la comunidad, aunque tiene diferencias en la distribución de la composición y abundancias de especie, mantiene una misma configuración comunitaria, es decir que aunque las especies presentes en cada uno de los grupos son distintas, los valores de abundancia, riqueza y equidad se mantienen similares entre los dos grupos.
Los valores altos de diversidad (H’) con respecto a su máximo (H’máx), están dados por una alta uniformidad (J’) y baja dominancia (?), reflejando que muchas de las especies presentes en el estudio aprovechan casi al máximo, los espacios intersticiales que ofrecen los nidos del pez M. plumieri, sugiriendo a su vez, una mayor cantidad de interacciones intra e interespecíficas (Margalef 1991). Estas interacciones se presentan tanto entre las especies que habitan los montículos del pez como entre ellas y las especies de los ecosistemas adyacentes tales como: parches coralinos, pradera de pastos y litoral rocoso. La baja variabilidad del índice de Equidad (E5) podría deberse a la existencia de muchos microhábitats dentro de los nidos, lo que facilita el desarrollo exitoso de varias especies simultáneamente (Campos & Reyes 1992).
El análisis inverso y los datos obtenidos de riqueza y abundancia confirmaron el resultado del ANOSIM, mostrando la diferencia entre los dos ensamblajes debido una distribución independiente de las especies entre los dos grupos batimétricos, inclusive dentro de las especies generalistas (presentes en las dos zonas de muestreo), que evidenciaron una pequeña diferencia en cuanto a la abundancia, influenciada aparentemente por la profundidad.
Comparando los datos de correlación del perímetro del nido y de los gradientes de profundidad obtenidos mediante el BIO-ENV para cada grupo de profundidad, con los valores registrados en la literatura para otras variables abióticas (correlaciones de 0.5 a 0.8) (Guzmán-Alvis & Díaz 1996, Guzmán-Alvis & García 1996, Guzmán-Alvis et al. 2001), y las agrupaciones de los montículos obtenidas mediante los análisis multivariados (NMDS y CLUSTER), se pudo concluir que estos dos factores, no solamente condicionan la estructura de la comunidad. Es posible que el efecto de otros factores como el régimen climático, la dinámica marina, la incidencia lumínica, la temperatura, la salinidad, el tamaño y el tipo de cascajo que conforman el nido, entre otros, ejerzan una influencia importante sobre la composición y abundancia de especies (Parker 1963, Gray 1981, Campos & Reyes 1992, Campos 1995, Mayer & Piependurg 1996, Córdoba 1997, López 1997).
El análisis de clasificación permitió además, sugerir que la fauna de invertebrados presente en los nidos del pez M. plumieri de bahía de Nenguange, se puede considerar como una “comunidad continua”, en donde las especies se superponen o sobrelapan en su distribución, sin existir límites discretos, es decir, las especies se presentan a lo largo de un gradiente ambiental donde cada una de ellas posee un intervalo óptimo (Gray 1981). Esto se podría afirmar porque el dendrograma tiene una forma en escalera con reducidos escalonamiento entre los grupos.
CONCLUSIONES
La fauna invertebrada encontrada en los montículos de M. plumieri de la bahía de Nenguange, se caracterizó por la presencia de especies típicas de hábitats de sustratos rocosos y arrecifales. En su mayoría, las especies colectadas mostraron particularidades morfológicas, fisiológicas y ecológicas que les confieren un grado alto de adaptación a este tipo de sustratos y garantizan su supervivencia a pesar de la competencia intra e interespecífica generada en ambientes limitados y con espacios reducidos. Se puede señalar también que los montículos de cascajo crean hábitats estructurados, de tamaños similares, que le facilita la colonización por parte de la macrofauna de invertebrados bentónicos de fondos predominantemente arenosos, encontrándose dos ensamblajes de estructura en composición y abundancia de especies diferentes, pero con atributos comunitarios similares.
Se determinó una variación en la composición de especies entre los dos grupos de nidos sin dominio de alguna en particular. Especies como Brachycarpus biunguiculatus, Micropanope spinipes y Synalpheus fritzmuelleri se consideraron especies generalistas del ensamblaje, Mithraculus sculptus y M. forceps características en los nidos someros, y Petrolisthes galathinus especie característica y Munida angulata exclusiva de los profundos respectivamente.
AGRADECIMIENTOS
Agradecemos el apoyo logístico brindado por la Universidad Jorge Tadeo Lozano, sede Santa Marta, al Instituto de Investigaciones Marinas y Costeras INVEMAR y a la Universidad Nacional de Colombia. A todas las personas que nos prestaron su ayuda, en especial a Adolfo Sanjuán por sus enseñanzas estadísticas; a Carlos Alberto Charris y Orlando Cervantes por el apoyo en las salidas de campo; a Daniel Rozo por el apoyo en la elaboración el mapa; a Diego Gil por la revisión del resumen en inglés; y demás compañeros, amigos y familiares que nos acompañaron en todo el proceso. Agradecemos los acertados comentarios de los evaluadores de este artículo.
LITERATURA CITADA
1. Álvarez, L. R. & L. Ramón. 1981. Listado preliminar de los equinodermos de la Costa Atlántica Colombiana. Boletín del Museo Marino. Bogotá-Colombia 10: 24-39. [ Links ]
2. Anónimo 1. 1999. Fish collection database of the Natural History Museum, London (formerly British Museum of Natural History -BMNH-). [ Links ]
3. Anónimo 2. 2001. Fish collection database of the National Museum of Natural History (Smithsonian Institution). Smithsonian Institution - Division of Fishes. [ Links ]
4. Baird, T. 1988. Female and male territoriality and mating systems of the sand tilefish Malacanthus plumieri. Enviromental Biology of Fishes 22: 101-116. [ Links ]
5. Baird, T. & T. Baird. 1992. Colony formation and some possible benefits and costs of gregarious living in the territorial sand tilefish Malacanthus plumieri. Bulletin of Marine Science 50: 56-65. [ Links ]
6. Baird, T. & N.R. Liley. 1989. The evolutionary significance of harem polygyny in the sand tilefish Malacanthus plumieri: resource of female defence?. Animal Behavior Bulletin 38: 817-829. [ Links ]
7. Bloch, M. E. 1786. Naturgeschichte der ausländischen Fische. Berlín. Naturgeschichte der ausländischen Fische 5:160. [ Links ]
8. Brook, I.M. 1978. Comparative macrofaunal abundance in Turtle-grass (Thalassia testudinum) communities in South Florida characterized by high blade density. Bulletin of Marine Science 28(1): 212-217. [ Links ]
9. Bula-Meyer, G.A. 1977. Algas marinas bénticas indicadoras de un área afectada por aguas de surgencia frente a la costa Caribe de Colombia. Anales del Instituto de Investigaciones Marinas de Punta de Betin. 9: 45-71 [ Links ]
10. Bula-Meyer, G.A. 1985. Un núcleo nuevo de surgencia en el Caribe colombiano detectado en correlación con las macroalgas. Boletín Ecotrópica 12: 3-25. [ Links ]
11. Büttner, H. 1996. Rubble mounds of sand Tilefish Malacanthus plumieri (Bloch, 1787) and associate fishes in Colombia. Bulletin of Marine Science 58(1): 248-260. [ Links ]
12. Campos, N.H. 1995. Crustáceos decápodos asociados a comunidades algales en la región de Santa Marta, Caribe colombiano. Caldasia 18(86): 57-69. [ Links ]
13. Campos, N.H. & R. Reyes. 1992. Moluscos, Anélidos y Crustáceos asociados a las raíces de Rhizophora mangle Linnaeus, en la región de Santa Marta, Caribe colombiano. Caldasia 17(1): 133-148. [ Links ]
14. Cervigón F. & W. Fischer. 1979. INFOPESCA. Catálogo de especies marinas de interés económico actual o potencial para América Latina. Parte 1. Atlántico Centro y Sur occidental. Roma. FAO/UNDP, SIC/79. 1372 pp. [ Links ]
15. Cervigón, F., R. Cipriani, W. Fischer, L. Garibaldi, M.E. Hendrickx, A.J. Lemus, R. Márquez, J.M. Poutiers, G. Robaina & B. Rodríguez. 1992. Fichas FAO de identificación de especies para los fines de la pesca. Guía de campo de las especies comerciales marinas y de aguas salobres de la costa septentrional de Sur América. Preparado con el financiamiento de la Comisión de Comunidades Europeas y de NORAD. Roma, FAO. 513 pp. [ Links ]
16. Clarke, K. R. & R. M. Warwick. 1994. Change in marine communities: an approach to statistical analysis and interpretation. Natural Environment Research Council. UK. 141 pp. [ Links ]
17. Coleman F. & S. Williams. 2002. Overexploiting marine ecosystem engineers: potential consequences for biodiversity. Trends in Ecology & Evolution 17(1): 40-44. [ Links ]
18. Colin, P. L. 1973. Burrowing behavior of the yellowhead jawfish Opistonathus aurifrons. Copeia 1: 84-90. [ Links ]
19. Córdoba, M. 1997. Macrofauna bentónica asociada a fondos blandos de la plataforma continental de Pozos Colorados y el Rodadero, Caribe colombiano. Trabajo de Grado Facultad de Biología Marina, Universidad Jorge Tadeo Lozano, Santa Marta, 107 pp.
20. Corredor, L. 1978. Notes on the behavior and ecology of the new fish cleaner shrimp Brachycarpus biunguiculatus (Lucas) (Decapoda: Natantia: Palaemonidae). Crustaceana 35(1): 35-40. [ Links ]
21. Díaz, J.M. 1991. Biodiversidad e importancia ecológica del sistema marino – costero del Parque Nacional Natural Tayrona. CORPES. Memorias y Conclusiones del Seminario “Situación Actual y perspectivas del Parque Nacional Tayrona”. Mayo 8 y 9, Santa Marta. [ Links ]
22. Díaz, J.M. 1994. La Malacofauna de la zona costera de Santa Marta y Parque Nacional Natural Tayrona, Caribe Colombiano. Anales del Instituto de Investigaciones Marinas de Punta de Betin 23: 15-43. [ Links ]
23. Díaz J. M. & D. J. Gómez. 2000. Programa Nacional de Investigación en Biodiversidad Marina y Costera (PNIBM). INVEMAR, FONADE, MMA, Santa Marta, 83 pp. [ Links ]
24. Díaz, J.M. & M. Puyana. 1994. Moluscos del Caribe colombiano: un catálogo ilustrado. COLCIENCIAS-Fundación Natura-INVEMAR, Santafé de Bogotá, 291 p + lám. color + 74 lám. B. & N. [ Links ]
25. Díaz, J.M., L. Escobar & L. Velásquez. 1990. Reef associated molluscan fauna of the Santa Marta area, Caribbean Coast of Colombia. Anales del Instituto de Investigaciones Marinas de Punta de Betín 19-20: 173-196. [ Links ]
26. Díaz, J.M., M. Barrios, M. Sendales, J. Garzón-Ferreira, J. Geister, M. López-Victoria, G. Ospina, F. Parra-Velandia, J. Pinzón, B. Vargas-Ángel, F. Zapata & S. Zea. 2000. Áreas Coralinas de Colombia. INVEMAR, Serie Publicaciones Especiales No 5, Santa Marta-Colombia, 176 pp. [ Links ]
27. Dooley, J. 1978. Systematics and Biology of the Tilefishes (Perciformes: Branchiostegidae and Malacanthidae), with Descriptions of two new species. NOAA Tech. Rep. NMFS Cir. 411: 1-78. [ Links ]
28. Fauchald, K. 1977. The Polychaete worms: Definitions and keys to the orders, families and genera. Natural History Museum of Los Angeles County. Science Series 28: 1-188. [ Links ]
29. Felder, D.L. 1982. Reproduction of the snapping shrimps Synalpheus fritzmuelleri and S. apioceros (Crustacea: Decapoda: Alpheidae) on sublittoral Reef of Texas. Journal of Crustacean Biology 2(4): 535-543. [ Links ]
30. Franke, R. 2001. Evaluación de las comunidades epifaunales de las praderas de Thalassia testudinum en el Parque Nacional Natural Tayrona. Tesis M.Sc. Departamento de Biología, Universidad Nacional de Colombia, Santa Marta, 86 pp.
31. Gallo, J. 1988a. Contribución al conocimiento de los Equinodermos del Parque Nacional Natural Tayrona: I. Echinoidea. Trianea 1: 99-110. [ Links ]
32. Gallo, J. 1988b. Contribución al conocimiento de los Equinodermos del Parque Nacional Natural Tayrona: II. Ophiuroidea. Trianea 2: 383-402. [ Links ]
33. García-Gómez, J. 1982. The Provenzanoi group of hermit Crabs (Crustacea, Decapoda, Paguridae) in the Western Atlantic: I. Pagurus maclaughlinae, a new species. Bulletin of Marine Science 32(3): 647-654. [ Links ]
34. García-Valencia, C. & J. M. Díaz. 2000. Moluscos y su taxocenosis en los fondos someros del sector sur de la plataforma continental del Caribe colombiano. Boletín de Investigaciones Marinas y Costeras 29: 73-80. [ Links ]
35. Garzón-Ferreira, J. 1998. Problemática ambiental en los mares colombianos. Colombia patria de tres mares. Expolisboa 98: 214-220. [ Links ]
36. Garzón-Ferreira, J. & M. Cano. 1991. Tipos, distribución, extensión y estado de conservación de los ecosistemas marinos costeros del Parque Nacional Natural Tayrona. Versión presentada al Séptimo Concurso Nacional de Ecología “Enrique Pérez Arbeláez”. Fondo Para la Protección del Medio Ambiente - FEN Colombia, Santa Marta, 82 pp. [ Links ]
37. Giraldo, L. O. 1994. Análisis de masas de agua y control de calidad de la información oceanográfica. Boletín Científico CIOH 15: 17-38. [ Links ]
38. Gray, J. 1981. The ecology of marine sediments. Cambridge University Press. Londres, 185 pp. [ Links ]
39. Guzmán-Alvis, A. & J.M. Díaz. 1996. Soft-bottom macrobenthic assemblages of Santa Marta, Caribbean coast of Colombia. Caribbean Journal of Science 32: 176-186. [ Links ]
40. Guzmán-Alvis, A. & C. B. García. 1996. Taxonomic aggregation and the detection of patterns in a tropical marine benthos data set. Revista de Biología Tropical 44(2): 907-910. [ Links ]
41. Guzmán-Alvis, A., O.D. Solano, M. Córdoba-Tejada & A. López-Rodríguez. 2001. Comunidad macroinfaunal de fondos blandos someros tropicales (Caribe colombiano). Boletín de Investigaciones Marinas y Costeras 30: 39-66. [ Links ]
42. Haig, J. 1956. The Galatheidea (Crustacea Anomura) of the Allan Hancock Atlantic Expedition with a review of the Porcellanidae of the Western North Atlantic. Allan Hancock Atlantic Expedition. Report 8: 1-45. [ Links ]
43. Hazlett, B. 1979. Biotic aspects of the distribution crabs Panopeus herbstii and Mithrax sculptus. Bulletin of Marine Science 29(4): 576-580. [ Links ]
44. Humann, P. & N. Deloach. 2002. Reef creature identification: Florida, Caribbean, Bahamas. 2a ed, New World Publ., Jacksonville, USA, 481 pp. [ Links ]
45. Kim, W. & L.G. Abele. 1988. The snapping shrimp Genus Alpheus from the Eastern Pacific (Decapoda: Caridea: Alpheidae). Smithsonian Contributions to Zoology 454: 119 pp. [ Links ]
46. Laverde-Castillo, J. & H. Rodríguez-Gómez. 1987. Lista de Poliquetos registrados para el Caribe colombiano, incluyendo comentarios sobre su zoogeografía. Anales del Instituto de Investigaciones Marinas de Punta de Betin 17: 95-112. [ Links ]
47. Lemaitre, R. 1981. Shallow water Crabs (Decapoda: Brachyura) collected in the Southern Caribbean near Cartagena, Colombia. Bulletin of Marine Science 31(2): 234-266. [ Links ]
48. López, A. 1997. Caracterización espacio-temporal de la taxocenosis Mollusca-Crustacea-Echinodermata en la Ensenada de Pozos Colorados y sectores aledaños, Caribe colombiano. Tesis de Grado, Universidad Jorge Tadeo Lozano, Santa Marta, 119 pp.
49. Ludwig, J. A. & J. F. Reynolds. 1988. Statistical ecology. A PREMIER on methods and computing. John Wiley and Sons, Nueva York, 337 pp. [ Links ]
50. Margalef, R. 1991. Ecología. 7. ed, Ediciones Omega S.A., Barcelona-España, 951 pp. [ Links ]
51. Mayer, M. & D. Piependurg. 1996. Epibenthic community patterns on the continental slope of East Greenland at 75 ° N. Mar. Marine Ecology Progress Series 143: 151-164. [ Links ]
52. Northeast Region Essential Fish Habitat Steering Committee. 2002. Workshop on the Effects of Fishing Gear on Marine Habitats off the Northeastern United States. Northeast Fisheries Science Center Reference Document. Boston, Massachusetts, 86 pp. [ Links ]
53. Orth, R.J., K.L. Heck & J. van Montrans. 1984. Faunal communities in seagrass beds: a review of influence of plant structure and prey characteristics on predator-prey relationship. Estuaries 7(4): 339-350. [ Links ]
54. Parker, R.H. 1963. Zoogeography and ecology of some macro-invertebrates, particularly mollusks, in the Gulf of California and the continental slope off Mexico. Videnskabelige Meddelelser fra dansk Naturhistorisk Forening 126: 1-178. [ Links ]
55. Puentes, L. 1990. Estructura y composición de las poblaciones de camarones (Crustacea: Decapoda: Natantia) asociadas a praderas de Thalassia testudinum, en la región de Santa Marta, Caribe Colombiano. Tesis M. Sc., Universidad Nacional de Colombia, Santa Marta, 145 pp.
56. Puentes, L., N.H. Campos & R. Reyes. 1990. Decápodos de fondos blandos hallados en el área comprendida entre Pozos Colorados y la bahía de Taganga, Caribe colombiano. Boletín Ecotrópica 23: 31-41. [ Links ]
57. Ramírez, G. 1983. Características fisicoquímicas de la bahía de Santa Marta (agosto 1980-julio1981) Anales del Instituto de Investigaciones Marinas de Punta de Betin 13: 111-121. [ Links ]
58. Rathbun, M.J. 1925. The spider crabs of America. Smithsonian Institution Bulletin of the United States National Museum 129, 613 pp. [ Links ]
59. Rathbun, M.J. 1930. The cancroid crabs of America of the families Euryalidae, Portunidae, Atelecyclidae, Cancridae and Xanthidae. Smithsonian Institution, Bulletin of the United States National Museum 152, 609 pp. [ Links ]
60. Reed, J., R. Gore, L. Scott & K. Wilson. 1982. Community composition, structure, area and trophic relationships of decapods associated whit shallow-and deep-water Oculina varicose Coral Reefs: Studies on Decapods Crustacea from the Indians River Region of Florida, XXIV. Bulletin of Marine Science 32(3): 761-786. [ Links ]
61. Rodríguez, G. 1980. Los crustáceos decápodos de Venezuela. Instituto venezolano de Investigaciones científicas, Caracas, 494 pp. [ Links ]
62. Rodríguez, H. 1988. Contribución al conocimiento de los Anélidos (Annelidae: Polychaeta) de aguas someras de la bahía de Neguange, Parque Nacional Natural Tayrona. Trianea 2: 403-443. [ Links ]
63. Sánchez, N. & N.H. Campos. 1978. Cangrejos ermitaños (Crustacea, Anomura, Paguridae) de la costa norte colombiana: Parte I. Anales del Instituto de Investigaciones Marinas de Punta de Betin 10: 15-62. [ Links ]
64. Schmitting-Falk, M. 1990. Zur Systematik und Faunistik der Xanthidae (Crustacea, Brachyura) im Bereich Von Santa Marta, Kolumbien. Alemania, 149 pp. Diplomarbeit, Justus-Liebig- Universität Giessen. [ Links ]
65. Sedberry, G.R., C.L. Cooksey, S.F. Crowe, J. Hyland, P.C. Jutte, C.M. Ralph & L.R. Sautter. 2004. Characterization of deep reef habitat with particular emphasis on discovery, exploration and description of reef fish spawning sites. National Ocean Service: Center for Coastal Environmental Health and Biomolecular Research. Charleston, USA. 72 pp. [ Links ]
66. U.S. Caribbean Fishery Management Council. 1998. Essential Fish Habitat Generic Amendment to the Fishery Management Plans of the U.S. Caribbean. San Juan-Costa Rica, 169 pp. [ Links ]
67. Vélez, M. 1977. Distribución y ecología de los Majidae (Crustacea: Brachyura) en la región de Santa Marta, Colombia. Anales del Instituto de Investigaciones Marinas de Punta de Betin 9: 109-140. [ Links ]
68. Vélez, M. 1978. Reporte sobre algunas especies de Majidae (Crustacea: Brachyura) para la costa atlántica colombiana. Anales del Instituto de Investigaciones Marinas de Punta de Betin 10: 69-80. [ Links ]
69. Virnstein, R. 1987. Seagrass-associated invertebrate communities of the Southeastern U.S.A.: A review. En: M. Durako, et al. (ed.). Proceeding of the Symposium on Subtropical-Tropical Seagrasses of the Southeastern U.S.A. Florida Marine Research Publications (42): 89-116. [ Links ]
70. Werding, B. 1978. Los Porcelánidos (Crustacea: Anomura: Porcellanidae) de la región de Acandí (Golfo de Urabá), con algunos encuentros nuevos de la región de Santa Marta (Colombia). Anales del Instituto de Investigaciones Marinas de Punta de Betin 10: 221-231. [ Links ]
71. Werding, B. 1982. Porcellanid Crabs of the Islas del Rosario, Caribbean Coast of Colombia, with a description of Petrolisthes rosariensis new species (Crustacea: Anomura). Bulletin of Marine Science 32 (2): 439-447. [ Links ]
72. Werding, B. 1984. Porcelánidos (Crustacea: Anomura: Porcellanidae) de la Isla de Providencia, Colombia. Anales del Instituto de Investigaciones Marinas de Punta de Betin 14: 3-16. [ Links ]
73. Williams, A.B. 1984. Shrimps, lobsters and crabs of the Atlantic coast of the eastern United States, Maine to Florida. S.I. Press (ed.) Washington., D. C. 550 pp. [ Links ]
74. Young, D. K. & M. W. Young. 1982. Macrobenthic invertebrates in bare sand and seagrass (Thalassia testudinum) at Carrie Bow Cay, Belize. En: K. Rützler y I. G. Macintyre (eds.). The Atlantic barrier reef ecosystem at Carrie Bow Cay, Belize I. Structure and communities, S. I. Press, Washington. pp. 115-126. [ Links ]
75. Zaneveld, J.S. 1983. Caribbean Fish Life. Index to the local and scientific names of the marine fishes and fishlike invertebrates of the Caribbean area (Tropical Western Central Atlantic Ocean). E.J. Brill / Dr. W. Backhuys, Leiden, 163 pp. [ Links ]
Recibido: 20/02/2007
Aceptado: 27/04/2007