Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.30 no.2 Bogotá July/Dec. 2008
EDGAR J. RINCÓN-BARÓN
SUSANA ORTIZ-BÁEZ
NICOLÁS ROCHA-NUÑEZ
MARCELA MANTILLA-MARTÍNEZ
OSCAR TORRES-MONTAGUT
BLANCA PÉREZ- GARCÍA
Escuela de Biología, Laboratorio de Histotecnia, Universidad Industrial de Santander, Bucaramanga, Colombia. ejrbaron@gmail.com; pinkblack8@hotmail.com; nicolasrocha6@hotmail.com; mottymarzh@hotmail.com; torrestoy@hotmail.com
Departamento de Biología, Botánica Estructural y Sistemática Vegetal, Universidad Autónoma Metropolitana Iztapalapa, México, bpg@xanum.uam.mx
RESUMEN
Se describe la morfogénesis del gametofito de Cyclopeltis semicordata (Lomariopsidaceae). El material fue recolectado en Bucaramanga, Departamento de Santander, Colombia. Las esporas son monoletes, elipsoidales con perina plegada y no clorofílicas. La germinación es del tipo Vittaria y se inicia entre los 8 y los 12 días después de la siembra; el desarrollo protálico es del tipo Aspidium; los gametofitos adultos son cordiforme–espatulados, monoicos, con tricomas unicelulares, ligeramente capitados, generalmente con secreción de aceite extracelular, éstos se ubican marginal y superficialmente en el prótalo. Los rizoides del prótalo no poseen cloroplastos. Los gametangios son del tipo común de los helechos leptosporangiados; son protándricos; las primeras hojas del esporofito se desarrollaron después del día 131 a partir de la germinación de las esporas. El desarrollo protálico de C. semicordata es similar al citado para las especies de Tectariaceae y Dryopteridaceae.
Palabras clave. Flora de Colombia, Cyclopeltis, gametofito, Lomariopsidaceae, morfogénesis.
ABSTRACT
Morphogenesis of the gametophyte of Cyclopeltis semicordata (Lomariopsidaceae) is describedfrom material collected in Bucaramanga, Santander Department, Colombia. The spores are monolete, ellipsoid with folded perina, and non-chlorophyllous. The germination is Vittaria- type and occurs 8 to 12 days after the spores are sown; the prothallial development is Aspidium-type; adult gametophytes are cordiform-spatulate, monoecious, with unicellular, slightly capitate trichomes, generally secreting extracellular oilsand located marginally and superficially in the prothallus. Rhizoids of the prothallus lack chloroplasts. Gametangia are of the type commonly found in leptosporangiate homosporous ferns; they are protandrous.The first leaves of the sporophyte were observed after the 131st day following spore germination. The prothallial development of the species C. semicordata is similar to that registered for other species belonging to Tectariaceae and Dryopteridaceae.
Key words. Flora of Colombia, Cyclopeltis, gametophyte, Lomariopsidaceae, morphogenesis.
INTRODUCCIÓN
El género Cyclopeltis J. Sm., fue tratado por Tryon & Tryon (1982) dentro de la familia Dryopteridaceae; posteriormente Moran (1995) lo incluye en las Tectariaceae; finalmente Smith et al. (2006), utilizando datos morfológicos y moleculares, lo incluyeron en la familia Lomariopsidaceae. El género Cyclopeltis está representado por seis especies de amplia distribución tropical; pero sólo C. semicordata se encuentra en América desde México (Chiapas) hasta Bolivia y Brasil, incluyendo las Antillas (Tryon & Tryon 1982, Moran 1995, Mickel & Smith 2004).
En Colombia, C. semicordata ha sido citada por Murillo & Harker (1990) y crece en bosques tropicales húmedos o secos, en suelos rocosos, desde el nivel del mar hasta los 750 m. Cyclopeltis semicordata es un helecho terrestre con el rizoma suberecto, escamoso; hojas monomórficas, raquis puberulento en ambas superficies, con escamas lineares oscuras; lamina 1-pinnada; pinnas con el lado basiscópico traslapado al raquis; soros redondeados dispuestos en 1-3(-4) hileras entre la costa y el margen; indusio peltado y persistente; esporas monoletes, con perina plegada e incospicuamente equinuladas (Tryon & Tryon 1982, Moran 1995).
Con respecto al estudio de la fase sexual, se han publicado varios trabajos que describen la morfología de los gametofitos de algunas especies de helechos de las familias Dryopteridaceae (Mendoza et al. 1999, 2002, Pérez-García et al. 1999, 2001, Mendoza & Pérez-García 2003), Tectariaceae (Kaur & Devi 1976, Pérez-García & Mendoza-Ruiz 2005) y con relación a la nueva organización de géneros propuesta por Smith et al. (2006) dentro de la familia Lomariopsidaceae sólo se registra la morfogénesis protálica para algunas especies del género Nephrolepis (Javalgekar & Mahabale 1959, Nauman 1989). Finalmente, solo Stokey (1960) menciona la presencia de tricomas septados y abundantes en Cyclopeltis crenata (Fée) C. Chr. y C. presliana Berkl, pero no describe la morfología de los gametofitos.
Este trabajo aporta información nueva y original sobre el desarrollo gametofítico de C. semicordata, con el fin de contribuir al conocimiento de la fase sexual de los helechos colombianos.
MATERIALES Y MÉTODOS
Los ejemplares de C. semicordata se recolectaron en la escarpa occidental de la meseta de Bucaramanga, en el Departamento de Santander, Colombia, a 980 msnm en un bosque seco tropical (Holdridge 2000); el material de respaldo se encuentra depositado en el Herbario de la Universidad Industrial de Santander (UIS), referido a un numero de muestra con la clave Cs-001.
Las pinnas fértiles fueron guardadas en bolsas de papel, dejándolas secar a temperatura ambiente, para propiciar de esta forma la esporulación. Las esporas fueron sembradas de forma masiva sin tamizar y sin eliminar los restos de los esporangios; en cinco recipientes plásticos de polietileno (Fig. 1 y Fig. 2). A cada recipiente se agregaron 240 g de ladrillo rojo parcialmente triturado y previamente esterilizado con agua caliente; posteriormente este sustrato se mezcló con dos gr de fertilizante comercial (triple 15) con porcentaje de 15-15-15 para nitrógeno-fósforo-potasio, dejando reposar por 24 horas antes de la siembra de las esporas.


Los cultivos se mantuvieron en condiciones de campo, protegidos con una malla negra plástica dándoles un 75% de sombra, a una temperatura promedio de 21 ºC, humedad relativa del 70% y un régimen de iluminación 12 horas luz / oscuridad, regando cada cinco días con diez ml de agua esterilizada utilizando micropulverizador.
Las observaciones de los cultivos se llevaron a cabo cada cuatro días, iniciándose desde el momento de la siembra de las esporas y se continuaron durante todo el desarrollo de los gametofitos; hasta el momento de la formación de las primeras hojas del esporofito. Las fotomicrografías se tomaron con un microscopio óptico Olympus CHS y una cámara digital Sony DSC-P71, utilizando material vivo.
Para las mediciones de las esporas se hicieron réplicas de 50 y estas medidas quedaron representadas por la medida mínima, media aritmética y medida máxima del largo y ancho; las medidas de la perina se representaron como el promedio de la longitud de los pliegues cortos, intermedios y largos con un n = 50 y los tricomas fueron medidos en la zona medial-basal cerca al margen de los protalos (n=50)
RESULTADOS
Las esporas son monoletes, elipsoidales a esféricas, de color pardo a pardo oscuro, con perina plegada y espinas cortas (Tryon & Tryon 1982, Tryon & Lugardon 1991); el tamaño de las esporas fue de (33) 35 (43) x (25) 32 (35) µm, excluyendo la perina, el perisporio de (3.2) 5.2 (7.9) µm, en promedio (Fig. 3). El patrón de germinación es de tipo Vittaria (Nayar & Kaur 1971), este se inicia entre los días 8 a 12 después de la siembra de las esporas; primero se desarrolla un rizoide corto, unicelular, hialino y sin cloroplastos (Fig. 4), posteriormente surge la célula protálica la cual es alargada y con abundantes cloroplastos; durante esta etapa del desarrollo se retiene la cubierta de la espora (Fig. 5).
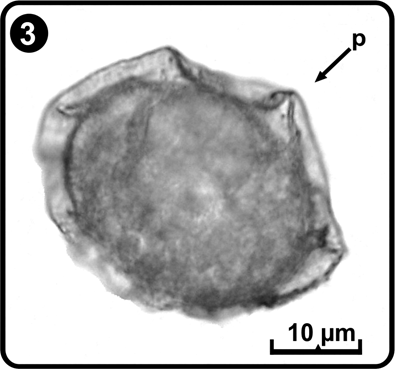
p= perisporio
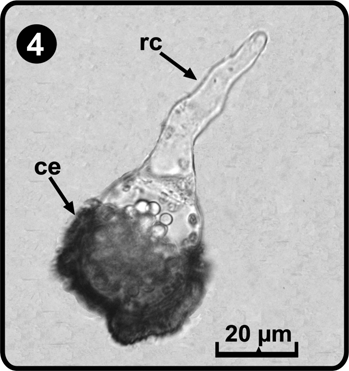
ce= cubierta de la espora, rc= célula rizoidal
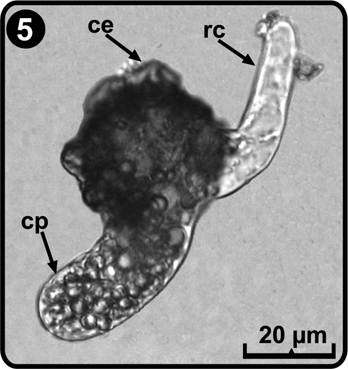
ce= cubierta de la espora, cp= célula protálica, rc= célula rizoidal
El crecimiento de la célula rizoidal y el filamento germinal es paralelo al eje polar de la espora, seguido de una serie de divisiones perpendiculares al eje mayor del filamento que originan una estructura elongada y uniseriada. Este filamento esta constituido por cinco a seis células alargadas en forma de barril y con numerosos cloroplastos (Fig. 6). La fase filamentosa se inicia aproximadamente entre los días 14 y16 después de la germinación de las esporas.
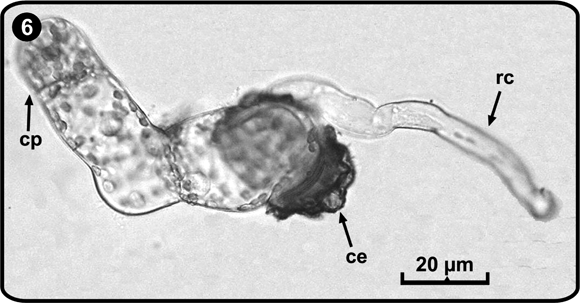
ce= cubierta de la espora, cp= célula protálica, rc= célula rizoidal
Posteriormente, en el día 16 después de la germinación de las esporas, las células terminales del filamento sufren una división paralela al eje mayor del filamento con lo cual se originan dos capas celulares; esta fase concluye con el desarrollo de un tricoma apical en una de las células terminales del filamento (Fig. 7); las células por debajo del tricoma se dividen longitudinalmente para establecer la región meristemática en posición lateral, la cual se divide para formar la lamina protálica que inicialmente es asimétrica; espatulada ó reniforme (Fig. 8), esta forma de crecimiento del prótalo corresponde al tipo Aspidium (Nayar & Kaur 1969); esta etapa del desarrollo se inicia aproximadamente a los días 24 a 26 después de la germinación y se caracteriza porque el prótalo desarrolla tricomas en la zona ventral y dorsal y en el margen del gametofito.
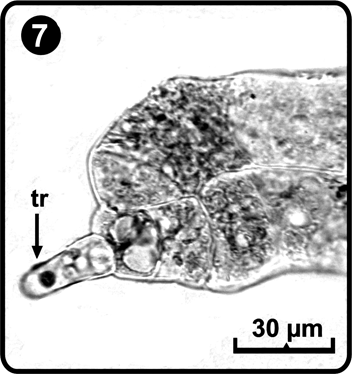
tr= tricoma
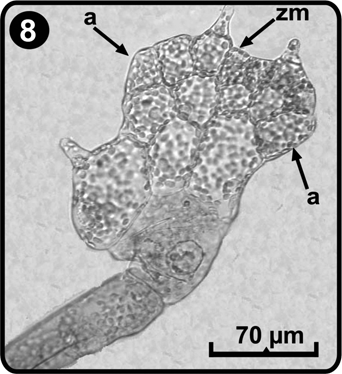
a= alas, zm= zona meristemática
Debido a la actividad meristemática, la fase adulta se alcanza entre los días 48 a 51 después de la siembra; para este momento, el prótalo se torna cordiforme-espatulado, con alas amplias y el cojinete definido en la región central media del prótalo (Fig. 9).
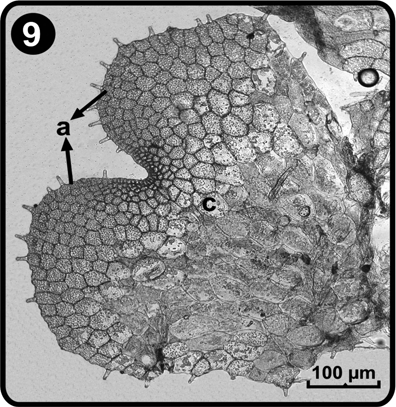
a= alas, c= cojinete
Los tricomas en los gametofitos adultos se presentan principalmente en posición marginal, son unicelulares, ligeramente capitados y con secreción de aceite (sudan III); su tamaño oscila en promedio entre 45-100 µm de largo por 16-18 µm de ancho en la base. La parte terminal de los tricomas es globosa debido a la presencia de una cubierta de secreción extracelular que presenta un grosor entre 3 y 10 µm (Fig. 10).
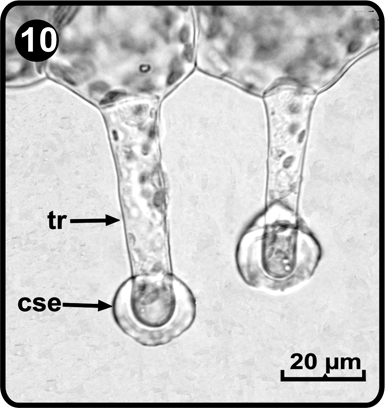
cse= cubierta de secreción extracelular, tr= tricoma
Los prótalos adultos son unisexuales protándricos y los gametangios son típicamente del tipo de los helechos homospóricos leptosporangiados, e inician la diferenciación entre los días 48 a 61 después de la germinación de las esporas (Fig. 11).
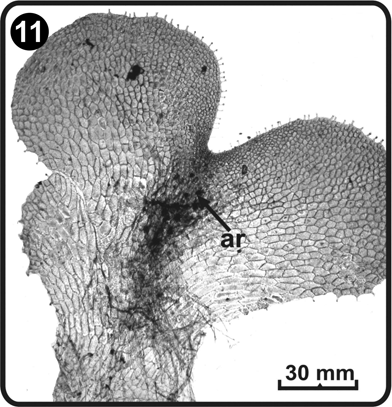
ar= arquegonios
Los anteridios se desarrollan a partir del día 48, después de la germinación de las esporas y se distribuyen sobre la superficie inferior de la lámina principalmente sobre la zona basal media; son globosos y están constituidos por tres células: la basal, la anular y la opercular (Fig. 12). Los anterozoides son helicoidales, el largo y su diámetro apical fué respectivamente de 25 y 13 µm (Fig. 13).
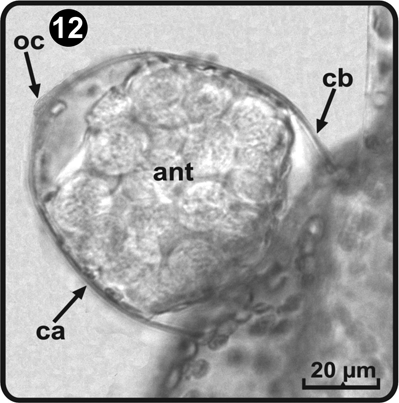
ant= anterozoides, ca= célula anular, cb= célula basal, oc= célula opercular
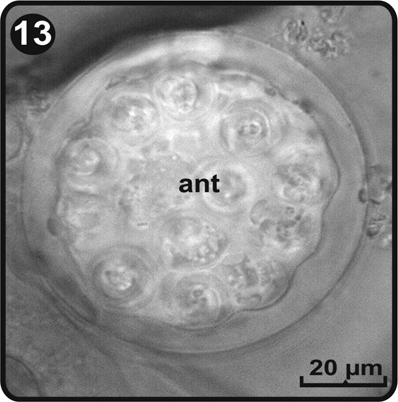
ant= anterozoides
Los arquegonios se desarrollan a partir del día 61, después de la germinación de las esporas y se ubican en la zona ventral del cojinete, justo debajo de la región meristemática (Fig. 11). El cuello de los arquegonios está constituido por cuatro hileras de células y cada hilera consta de cuatro a cinco células de largo (Fig. 14 y Fig. 15). Los cuellos de los arquegonios y su boca se orientan hacia la base del gametofito, donde se ubican los anteridios, sugiriendo autofecundación.
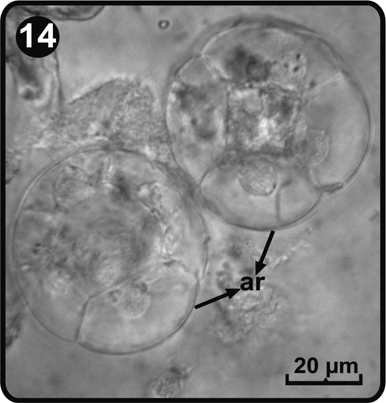
ar= arquegonios
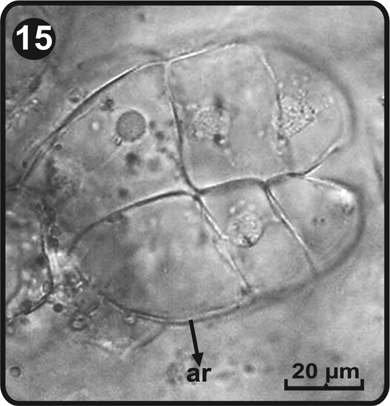
ar= arquegonios
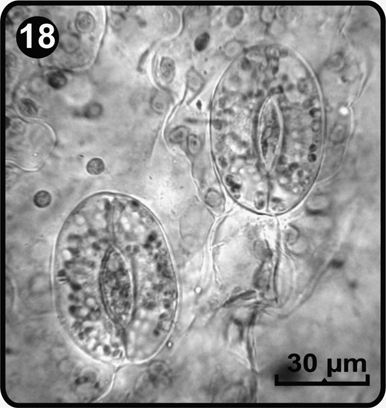
La primera hoja del esporofito se observó después de 131 días, a partir de la germinación. La hoja es entera y espatulada con una sola vena que se divide dicotómicamente y un lóbulo en el ápice (Fig. 16); posteriormente se torna reniforme–lobulada a bi-trilobulada. Los esporofitos presentan numerosos tricomas pluricelulares (bi o tricelulares) y escasos tricomas unicelulares secretores, que se distribuyen sobre toda la superficie de la lámina tanto por la cara adaxial como abaxial, en el margen, venas y pecíolo de las hojas (Fig. 17). El patrón estomático es anomocítico y los estomas se localizan en la superficie abaxial de la hoja del esporofito (Fig. 18). Las hojas pinnadas del esporofito se aprecian después de 220 días de la germinación de las esporas (Fig. 19).

esp= esporofito

tr= tricomas

Dentro de los recipientes plásticos fue posible observar protalos en diferentes etapas de desarrollo (asincronía). En algunos prótalos filamentosos que crecían junto a gametófitos maduros se observó gran número de anteridios, pero no de arquegonios (Fig. 20 y Fig. 21).
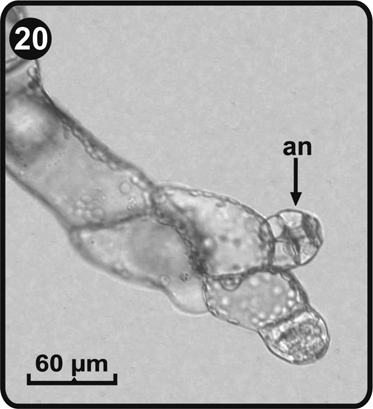
an= anteridios
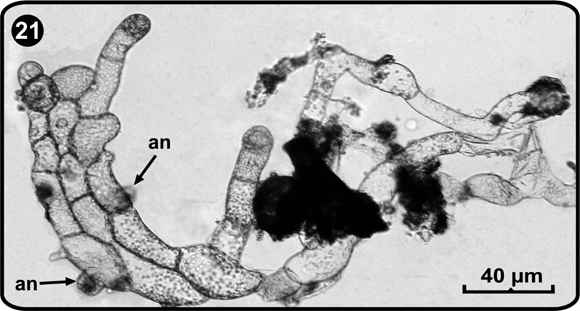
an= anteridios
DISCUSIÓN
Basándonos en los datos morfológicos observados podemos concluir que la germinación de las esporas es del tipo Vittaria y el desarrollo gametofítico del tipo Aspidium, como lo descrito por Pérez-García & Mendoza-Ruiz (2005) para algunas especies de la familia Tectariaceae y Pérez-García et al. (2001) para el género Dryopteris.
Stokey (1960) menciona la presencia de tricomas unicelulares o bicelulares e incluso ramificados en los gametofitos de Cyclopeltis presliana y C. crenata; esta condición no se observó en C. semicordata ya que solo se registra la presencia de tricomas unicelulares secretores en cualquier etapa del desarrollo protálico; así mismo Kaur & Devi (1976) indican la presencia de tricomas unicelulares, bicelulares y ramificados para algunos helechos Tectariáceos. Pérez-García & Mendoza-Ruiz (2005) amplían la observación de tricomas pluricelulares en los gametofitos maduros de especies de Tectaria del nuevo mundo.
Concordamos en que los tricomas encontrados en C. semicordata guardan mayor grado de similitud con los presentes en los gametófitos descritos para los helechos Dryopteridáceos y las especies estudiadas de Nephrolepis.
En cuanto a la expresión sexual, los gametófitos estudiados fueron monoicos y protándricos situación presente en algunas especies de Nephrolepis (Nauman 1989), sin embargo este carácter es variable dentro de los helechos Tectariáceos y Dryopteridáceos.
El origen del esporofito es sexual y no hay evidencia de desarrollo apogámico, aunque es una condición común en la familia Dryopteridaceae y algunas especies del género Tectaria y Nephrolepis.
Dado que la taxonomía del genero Cyclopeltis ha sido conflictiva y puesto que varios autores han demostrado que la morfología de los gametófitos es útil en la diferenciación de los taxa de helechos (Atkinson & Stokey 1964, Nayar & Kaur 1971, Atkinson 1973) consideramos necesario describir detalladamente en el futuro el desarrollo protálico de las cinco especies restantes incluídas dentro del género para determinar si existe uniformidad morfogenética y si el tipo de patrón y desarrollo protálico es consistente con lo descrito para algunos géneros de las familias Tectariaceae y Dryopteridaceae.
Nuestras observaciones sobre el desarrollo de gran cantidad de anteridios en gametofitos filamentosos nos hace sospechar sobre la presencia de sustancias anteridiógenas producidas por gametofitos adultos de C. semicordata como ha sido citado por algunos autores para otras especies de helechos (Näf 1968, Voeller, 1971, Näf et al. 1975, Mendoza et al. 1999), sin embargo para los géneros que en la actualidad se ubican dentro de Lomariopsidaceae (Smith et al. 2006) no se ha registrado la presencia de anteridiógenos; pero sí la respuesta positiva de Nephrolepis cordifolia (L.) Presl y N. hirsutula (J.R. Forst.) K. Presl a anteridiógenos de Pteridium (L.) Maxon (Näf et al. 1975).
Los anteridiógenos estimulan el desarrollo de anteridios (Raghavan 1989) sin embargo su papel evolutivo no es claro, probablemente promueven el entrecruzamiento entre las poblaciones naturales (Tryon & Vitale 1977).
Es importante mencionar, que Smith et al. (2006) atendiendo a datos morfológicos y moleculares consideran una nueva organización de géneros en la familia Lomariopsidaceae; este nuevo ensamble incluye a los géneros Lomariopsis, Cyclopeltis, Nephrolepis y Thysanosoria. Considerando que la ubicación del género Nephrolepis dentro de esta familia es tentativa, nuestro trabajo sobre gametofitos aportaría información nueva y original para la familia Lomariopsidaceae.
AGRADECIMIENTOS
A los profesores Dagoberto Arrieta Prieto, Beatriz Elena Guerra (UIS), Aniceto Mendoza Ruiz (Universidad Autónoma Metropolitana de México) y al biólogo Jose Sergio Hleap (Universidad del Valle) por la lectura crítica del documento así como sus oportunas sugerencias y comentarios; a la estudiante de biología (UIS) Leidy Viviana Gélvez L. por su valiosa colaboración en el tratamiento y edición fotográfica; finalmente a la Vicerrectoría de Investigación y Extensión y a la Vicerrectoría Académica de la Universidad Industrial de Santander (UIS) por todo su apoyo.
LITERATURA CITADA
1. ATKINSON, L.R. & A. G.STOKEY. 1964. Comparative morphology of the gametophyte of homosporous ferns. Phytomorphplogy 14: 51-70. [ Links ]
2. ATKINSON, L. R. 1973. The gametophyte and family relationships. P. 73-90. In: A. C. Jermy, J. A. Crabbe & B. A. Thomas (eds.). The phylogeny and classification of the ferns. Academic Press, Nueva York. [ Links ]
3. HOLDRIDGE, L.R. 2000. Ecología basada en zonas de vida. Instituto Interamericano de Cooperación para la Agricultura, San José. [ Links ]
4. JAVALGEKAR, S.R. & T.S. MAHABALE. 1959. Germination of the spores and Protalli in two species of Nephrolepis, N. exaltata Schott and N. acuta Presl. Proceedings of the National Academy of Sciences of India 25(6): 333-338. [ Links ]
5. KAUR, S. & S, DEVI. 1976. Prothallus morphology in some tectarioid ferns. American Fern Journal 66(3):102-106. [ Links ]
6. MENDOZA, A., B. PERÉZ-GARCÍA & R. RIBA. 1999. Morfogénesis de la fase sexual del helecho Arachniodes denticulada (Dryopteridaceae). Revista de Biología Tropical 47(4): 791-797. [ Links ]
7. MENDOZA, R.A., B. PERÉZ-GARCÍA & R. RIBA. 2002. Comparative research of gametophytes of Olfersia alata and Olfersia cervina (Dryopteridaceae). American Fern Journal 92(3):229- 238. [ Links ]
8. MENDOZA, R.A. & B. PERÉZ-GARCÍA. 2003. Comparative analysis of the sexual phase of Phanerophlebia (Dryopteridaceae) in Mexico. Canadian Journal of Botany 81: 501-516. [ Links ]
9. MICKEL, J.T. & A.R. SMITH. 2004. The pteridophytes of Mexico. New York Botanical Garden 88:1–1054. [ Links ]
10. MORAN, R.C. 1995. Tectariaceae. Pp. 204–209 In R. C. Moran and R. Riba, eds. Flora Mesoamericana. Psilotaceae and Salviniaceae. Instituto de Biología UNAM, Missouri Botanical Garden and the Natural History Museum (Londres). [ Links ]
11. MURILLO, M.T. & M.A. HARKER. 1990. Helechos y plantas afines de Colombia. Academia Colombiana de Ciencias Exactas, Físicas y Naturales, Colección Enrique Álvarez Lleras Nº 2 Bogotá. pp 209-210. [ Links ]
12. NÄF, U. 1968. On separation and identity of the fern antheridiogens. Plant Cell Physiology 9: 27-33. [ Links ]
13. NÄF, U., K. NAKANISHI & M. ENDO. 1975. On the physiology and chemistry of fern antheridiogen. Botanical Review 41: 315-359. [ Links ]
14. NAUMAN, C.E. 1989. Gametophyte development and morphology in seven neotropical taxa of the Nephrolepis Schott. Phytomorphology 39(1): 29-39. [ Links ]
15. NAYAR, B.K. & S. KAUR. 1969. Types of prothallial development in homosporous ferns. Phytomorphology 19: 179–188. [ Links ]
16. NAYAR, B.K. & S. KAUR. 1971. Gametophytes of homosporous ferns. Botanical Review 37: 295–396. [ Links ]
17. PÉREZ-GARCÍA, B., R.A. MENDOZA, J.I. REYES & R. RIBA. 1999. Morfogénesis de la fase sexual de seis especies mexicanas de helechos del género Dryopteris (Dryopteridaceae). Revista de Biología Tropical 47(1-2): 69-81. [ Links ]
18. PÉREZ-GARCÍA, B., R.A. MENDOZA, J.I. REYES & R. RIBA. 2001. Morfogénesis de la fase sexual de seis especies mexicanas del género Dryopteris (Dryopteridaceae), Parte II. Revista de Biología Tropical 49(1): 265-278. [ Links ]
19. PÉREZ-GARCÍA, B. & A. MENDOZA-RUIZ. 2005. Comparative studies of the gametophytes of five New World Species of Tectaria (Tectariaceae). American Fern Journal 95(4):141-152. [ Links ]
20. RAGHAVAN, V. 1989. Developmental biology of fern gametophytes. Cambridge University Press. Londres. [ Links ]
21. SMITH, A.R., K.M. PRYER, E. SCHUETTPELZ, P. KORALL, H. SCHNEIDER & P.G. WOLF. 2006. A classification for extant ferns. Taxon 55(3): 705-731. [ Links ]
22. STOKEY, A.G. 1960. Multicellular and branched hairs on the fern gametophyte. American Fern Journal 50: 78–87. [ Links ]
23. TRYON, R.M. & G. VITALE. 1977. Evidence for antheridiogen production and its mediation of a mating system in natural populations of fern gametophytes. Botanical Journal of the Linnean Society 74:243:249. [ Links ]
24. TRYON, R.M. & A.F. TRYON. 1982. Ferns and allied plants with special reference to tropical America. Springer-Verlag, Nueva York. [ Links ]
25. TRYON, A.F. & B. LUGARDON. 1991. Spores of the Pteridophyta: surface, wall structure, and diversity based on electron microscope studies. Springer-Verlag, Nueva York. [ Links ]
26. VOELLER, B.R. 1971. Developmental physiology of fern gametophytes: relevance for biology. BioScience 21: 266-77. [ Links ]
Recibido: 10/11/2007
Aceptado: 19/07/2008














