Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.30 no.2 Bogotá July/Dec. 2008
JOSÉ NICOLÁS URBINA-CARDONA
MARIA CECILIA LONDOÑO-MURCIA
DANIEL GUILLERMO GARCÍA-ÁVILA
Museo de Zoología "Alfonso L. Herrera", Facultad de Ciencias, Universidad Nacional Autónoma de México. México, D.F. 04510 México. nurbina@yahoo.com
Laboratorio de Sistemas de Información Geográfica, Instituto de Biología, Universidad Nacional Autónoma de México. México, D.F. 04510 México. ninaatelopus@yahoo.com
Fundación Ecotrek, Bogotá, D.C. Colombia. boulder8@yahoo.com
RESUMEN
En la actualidad los entornos naturales se han convertido en paisajes fragmentados por actividades como la agricultura y la ganadería. La alteración antropogénica determina cambios en la diversidad de serpientes al alterar físicamente el paisaje y generar cambios en la estructura de la vegetación y el microclima. En el presente estudio se determinó la diversidad de serpientes de cuatro hábitats con diferente grado de alteración antropogénica en la Isla Gorgona. A partir de búsquedas visuales durante junio-julio 2001 y febrero-abril 2004 y a lo largo de 32 transectos lineales se registraron 51 individuos pertenecientes a 13 especies de serpientes. Se determinó una representatividad del muestreo entre el 60 y el 78% de las especies estimadas. La mayor riqueza se encontró en el bosque secundario, seguido por el primario y los cultivos. El mayor recambio de especies se presentó entre la prisión y los cultivos, y entre la prisión y el bosque primario. En el bosque secundario y primario la abundancia de serpientes se duplicó durante las lluvias mientras que en cultivos y prisión la abundancia fue mayor en época seca. Es posible que la alteración antropogénica afecte negativamente a las especies Leptophis ahaetulla, Micrurus dumerili, Oxybelis brevirostris y Tantilla longifrontalis, sin embargo, ninguna de éstas se encuentra categorizada en la lista de especies en peligro de extinción. Es necesario invertir mayor esfuerzo de captura de serpientes en ambientes conservados que en hábitats alterados, y es importante determinar la dinámica espacio- temporal en el ensamblaje de serpientes para enfocar correctamente los planes de manejo y conservación de la ofidiofauna en ambientes alterados.
Palabras clave. Diversidad Alfa y Beta, patrones de abundancia, alteración antropogénica, Serpientes, dinámica temporal.
ABSTRACT
Due to cattle ranching and agriculture, natural environments have been transformed into fragmented landscapes. Anthropogenic disturbance affects vegetation structure and microclimate, and changes patterns of snake diversity. This study determines snakes diversity in four habitats that differ in degree of anthropogenic disturbance onGorgona Island, in the Colombian pacific. Visual encounter surveys were conducted during June-July 2001 and February-April 2004 along 31 linear transects, encountering 51 individuals belonging to 13 snake species. We determined inventory completeness to be between 60 and 78%. Highest species richness was found in the secondary forest followed by primary forest and coconut plantations (eight, six and six species, respectively). Highest species complementarity was detected between the prison and coconut plantations, and the prison and primary forest. In conserved habitats (secondary and primary forests) snake diversity doubled, while in the prison and coconut plantations snake abundance increased during the dry season. It is possible that anthropogenic disturbance negatively affects Leptophis ahaetulla, Micrurus dumerili, Oxybelis brevirostris and Tantilla longifrontalis snake species. It is important to invest more effort in snake capture in conserved environments than in disturbed habitats. Data on spatio-temporal dynamics in snake ensembles are essential to correctly focus conservation plans and management of the snake fauna in disturbed environments.
Key words. Alpha and Beta Diversity, abundance patterns, anthropogenic disturbance, Snakes, seasonal dynamics.
INTRODUCCIÓNLa modificación de origen antropogénico en ambientes naturales causa alteraciones en la estructura y la composición de la vegetación y afecta las condiciones ambientales del microhábitat (Saunders et al. 1991). Para las especies de serpientes, el mayor factor de amenaza es la interacción entre las características ambientales y el impacto humano en la pérdida del hábitat (Filippi & Luiselli, 2000). Estos cambios a su vez generan la disminución de presas y de poblaciones de serpientes y en algunos casos puede causar la extinción (Prior & Weatherhead 1996, Gibbons et al. 2000, Keller & Heske 2000, Dickerson 2001).
Las serpientes ocupan una posición importante en la cadena trófica y cumplen funciones ecológicas importantes en ambientes tropicales al controlar poblaciones de ranas, serpientes, lagartos, mamíferos y aves (Lancini 1986, Martins & Gordo 1993, Keller & Heske 2000). Los requerimientos y disposición de recursos, como el hábitat y el alimento, son aspectos que determinan la reproducción y sobrevivencia de las especies (McAllister 1995, Plummer 2002). La influencia del ambiente sobre este grupo de organismos, se basa principalmente en la regulación de los requerimientos fisiológicos mediante el aprovechamiento de la temperatura ambiental para los procesos metabólicos (Beaupre 1995). En general, las serpientes que presentan alta capacidad de dispersión pueden adaptarse eficientemente en ambientes antropogénicos mientras haya buena disposición de alimento (Lowell 1994).
Dado que las serpientes son organismos complejos de estudiar en el campo, muchos aspectos importantes de su ecología e historia natural no son bien conocidos (Seigel & Novak 1987, Seigel & Collins 1993). En el ensamblaje de serpientes una alta proporción de especies son raras, usan microhábitats puntuales, tienen requerimientos fisiológicos y comportamentales específicos, y presentan baja capacidad de dispersión y de adaptación al disturbio (Reinert 1993, Luiselli & Capizzi 1997, Kjoss & Litvaitis 2001, Urbina-Cardona & Reynoso 2005). Parent & Weatherhead (2000) reportan que en ambientes con alta presencia humana las serpientes tienden a moverse distancias más cortas y con menor frecuencia. Así mismo, en los paisajes antropogénicos las serpientes se ven amenazadas directamente por el hombre, debido a que algunas especies son temidas y eliminadas y otras presentan alta demanda para pieles o para uso como mascotas (Dodd 1987, Sánchez et al. 1995, Rueda 1999, Gibbons et al. 2000). Actualmente no hay estudios sobre del impacto de las perturbaciones antropogénicas en comunidades tropicales de serpientes (Kjoss & Litvaitis 2001). En los ecosistemas insulares, las especies introducidas de predadores (e.g. gatos, ratas, mangostas y cerdos) son consideradas la más seria amenaza para los reptiles insulares, esto es debido a que estas especies degradan los hábitats y compiten eficientemente frente a las especies nativas (Hedges 2006, Tolson & Henderson 2006).
El análisis de la diversidad es una herramienta importante al tratar de evidenciar los efectos de las actividades antropogénicas en las comunidades ecológicas y comparar sus efectos en diferentes hábitats (Whittaker 1972). De esta forma, el estudio de la estructura y de la composición de los ensambles para homogenizar terminos de serpientes permite plantear pautas para la caracterización de un hábitat, entendiendo éste como el lugar más comúnmente utilizado por un organismo debido a que sus condiciones y características, las cuales le generan beneficios reproductivos, alimenticios y de protección (Thomas 1998, Cross & Petersen 2001). Para el área continental del Chocó Biogeográfico, Vargas & Bolaños (1999) reportaron que las áreas intervenidas presentaron mayor riqueza y diversidad de reptiles debido a sus condiciones fisiológicas. Para la Isla de Gorgona, Urbina-Cardona & Londoño-Murcia (2003) determinaron que las áreas con mayor diversidad de herpetofauna son los bosques secundarios, los cuales comparten un importante número de especies con los bosques primarios; a su vez los cultivos de cocos comparten gran parte de su herpetofauna con las áreas intervenidas de la prisión. En bosques conservados la distribución de las especies se halla influenciada por la cobertura vegetal, mientras que en áreas intervenidas el determinante es la temperatura (Urbina-Cardona & Londoño-Murcia 2003). El presente estudio determina los patrones de abundancia y la diversidad local y de recambio de la ofidiofauna en cuatro hábitats con diferente grado de perturbación antropogénica del Parque Nacional Natural Isla Gorgona.
MÉTODOS
Área de estudio
El estudio se realizó en el ecosistema de bosque lluvioso tropical (Holdridge 1947) en el Parque Nacional Natural Isla Gorgona, en el departamento del Cauca, entre los 2°47´ y 3°6´ Norte y 78°6´ y 78°18´ Oeste, en aguas territoriales de Colombia. El régimen de precipitaciones de la isla es unímodal y biestacional, con aproximadamente 6694 mm de lluvia, observándose dos picos altos de precipitación a lo largo del año: de mayo a junio, y de septiembre a octubre. El período con menor precipitación se encuentra entre los meses de enero y abril. Las temperaturas medias anuales son de 26ºC y la humedad relativa se encuentra por encima de 85.2%, lo cual enmarca al parque dentro de un clima super húmedo tropical (Aguirre & Rangel 1990, IDEAM 2003).
El área de la isla es de 1568.4 hectáreas, de las cuales 1364 son de topografía escarpada con fuertes pendientes que oscilan entre los 12 y 75 grados y solamente 222 hectáreas son planas o con inclinaciones suaves entre 1 y 12 grados (Chamorro 1987). La isla se encuentra constituida casi en su totalidad por rocas ígneas de origen volcánico con diferentes estratigrafías, las cuales al parecer provienen de la era mesozoica (Llinás et al. 1990).
La isla fue utilizada como una prisión insular de alta seguridad de 1959 a 1985, periodo durante el cual se introdujeron especies animales foráneas (e.g. vacas, ratas, puercos, perros y gatos) y se llevaron a cabo actividades cómo tala de bosque, construcción de carreteras e instalaciones, extracción selectiva de madera para construcción y combustible, cacería, pesca y cultivos de frutales (Psidium guajaba, Citrus medica y Persea americana), y cocos (Cocos nucifera), alterando la fisionomía y composición florística de la vegetación natural del costado oriental de la isla (Aguirre & Rangel 1990, Rangel-Ch. 1995). La isla fue decretada Parque Nacional Natural desde hace más de 20 años y desde ese momento las actividades económicas (e.g. tala de madera, pesca y cacería) fueron interrumpidas (Rangel-Ch. 1995). En la actualidad, la isla presenta diversos hábitats en regeneración ya que sufrieron diferentes grados de perturbación antropogénica. Para el presente estudio se definieron cuatro hábitats con diferente grado de perturbación de la siguiente manera:
a) Área de ruinas de la prisión: Comprende zonas con una alta afluencia de visitantes en donde se encuentran las instalaciones abandonadas de la prisión, las bodegas de almacenamiento, la estación de buceo, el poblado y algunos senderos de ecoturismo ubicados en el sector oriental de la isla. El área del poblado incluye las instalaciones actuales del comedor, sala de conferencias y alojamientos para los visitantes de ecoturismo y allí habitan alrededor de 20 funcionarios permanentes del Parque. La vegetación predominante está conformada por pastos bajos, trepadoras, arbustos, plantas ornamentales, briofitas y helechos.
b) Área de cultivos de coco (Cocos nucifera): Se distribuyen a lo largo de la isla en el costado oriental y sur occidental, conformando una franja de hasta 15 metros de ancho, de ellos se aprovechan únicamente los frutos, los cuales son colectados periódicamente por funcionarios del parque o personal encargado para tal fin. También se pueden encontrar arboles frutales como Psidium guajaba, Citrus medica y Persea americana.
c) Área de vegetación secundaria por clareo: En la vegetación secundaria por clareo se observan diversos grados de sucesión vegetal en zonas cómo Yundigua y el acueducto, al costado norte de la isla y occidente del poblado respectivamente. En estas zonas se presenta alta cobertura arbustiva y herbácea dominada principalmente por Triolena spicata, Tara sp., Tetrorchidium gorgonae y Wedelia troliba, mientras que los estratos arbóreos se encuentran conformados por Vismia baccifera, Cecropia garciae y Cespedesia macrophylla (Rangel 1995).
d) Área de vegetación natural o de bosque primario: Comprende la vegetación de tipo selvático que se encuentra principalmente en las partes altas de la isla entre los 40 y 300 metros sobre el nivel del mar, son áreas con acceso restringido para visitantes y destinadas a la recuperación (Aguirre & Rangel 1990). El acceso a estas áreas se encuentra delimitado por el camino al cerro La Trinidad y el camino hacia las lagunas, los cuales son empleados únicamente por personal de investigación. En estas áreas se encuentran las alianzas vegetales Cespedesia - Symphonion globuliferae y Ossaeo sessilifoliae - Anaxagoretum phaeocarpae (Rangel 1995).
Muestreos
Identificación de especies. Todas las especies encontradas en el estudio fueron fotografiadas, los organismos fueron determinados hasta especie utilizando claves taxonómicas especializadas y corroborados con los ejemplares de la colección científica del Parque Nacional Natural Gorgona.
Método de muestreo. Se realizaron dos salidas al campo durante junio y julio de 2001 (temporada de lluvias) y febrero y abril de 2004 (temporada seca). En cada uno de los cuatro hábitats con diferente grado de perturbación antropogénica: prisión (área muy perturbada), cultivos (perturbación media-alta), bosque secundario (perturbación media) y bosque primario (ausencia de perturbación), se ubicaron aleatoriamente 8 transectos permanentes de 300 m de largo. A lo largo de cada transecto se realizó una búsqueda visual con captura manual (Crump & Scott 1994) durante el día, la tarde y la noche. Los organismos se capturaron con ayuda de ganchos herpetológicos y fueron introducidos en bolsas de tela. Las serpientes se registraron en la vegetación herbácea, arbustiva y arbórea, a dos metros a cada lado del transecto y hasta dos metros de altura, por los cual este tipo de muestreo evalúa la diversidad de serpientes que habitan el sotobosque de la selva (Urbina-Cardona & Reynoso 2005). En la noche se utilizaron lámparas de cabeza y se evitó muestrear en noches con luna llena. Cada transecto fue muestreado una vez de día y otra de noche durante cada salida. Se estandarizó la unidad de esfuerzo de muestreo a 90 minutos-transecto/hombre para un el esfuerzo total de 192 horas-hombre a lo largo de 32 transectos.
Análisis de datos
Diversidad total de especies. Se realizó una predicción de la riqueza específica como una función de la acumulación de especies (Magurran 1988, Colwell & Coddington 1994), usando tres estimadores no paramétricos de riqueza, Boostrap, Jacknife de primer y segundo orden, en el programa Species Diversity and Richness 3.02 (Henderson & Seaby 2002). Se usaron los estimadores Jacknife de primero y segundo orden (Jacknife 1 y 2) ya que no asumen homogeneidad ambiental en la muestra y Bootstrap por que arroja resultados más precisos al estimar la riqueza de ensamblajes con gran cantidad de especies raras (Magurran 2004).
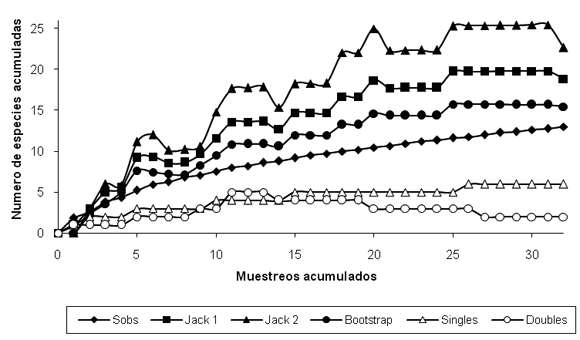
Se graficaron las especies únicas (Singletons) y dobles (doubletons) con el fin de determinar si las especies raras se redujeron a medida que el muestreo se intensificó. Con base en los valores máximos de riqueza estimada por los estimadores de riqueza y asumiendo este valor como el 100%, se determinó el porcentaje de representatividad de especies registradas durante el presente estudio (sensu completeness, Soberón & Llorente 1993).
Abundancia y composición de especies. Se generó una matriz de similitud de Bray–Curtis usando las abundancias relativas normalizadas de las especies. Con base en esta matriz se realizó una prueba de similitud no paramétrica de dos vías (ANOSIM subrutina del programa PRIMER, Plymouth, UK) con el fin de probar la hipótesis de diferencia entre la composición del ensamblaje de serpientes en distintos hábitats. ANOSIM es una prueba basada en permutaciones que es aplicada a diseños anidados simples para detectar diferencias entre grupos provenientes de muestras multivariadas (Clarke & Warwick 2001).
El porcentaje de similitud entre los hábitats, y las especies responsables de esta variabilidad se determinó con el análisis de porcentaje de similitud (SIMPER subrutina del programa PRIMER, Plymouth, UK). Para comparar los patrones de abundancia y equidad de especies entre hábitats se usaron curvas de rango-abundancia (Feinsinger 2001). Para cada hábitat se graficó la abundancia relativa de las especies en escala logarítmica contra el rango ocupado por cada especie de la más abundante a la de menor abundancia.
Diversidad alfa de especies. Se realizó una predicción de la riqueza específica como una función de la acumulación de especies (Magurran 1988, Colwell & Coddington 1994), por medio de los estimadores de riqueza no paramétricos: Boostrap y Chao Cuantitativo, en el programa Diversity and Richness 3.02 (Henderson & Seaby 2002). El Chao cuantitativo es idóneo para estimar la riqueza de especies en muestras que provienen del mismo hábitat (Magurran 2004).
Se determinó la equidad a través del índice de Shannon (H´) con logaritmo natural (Moreno 2001), el cual le da más peso a las especies raras en la muestra (Brower et al. 1998). Éste índice expresa la uniformidad de los valores de importancia de las especies y mide el grado de incertidumbre en predecir a cual especie pertenecerá un individuo de una colección, asumiendo que todas las especies están representadas en una muestra homogénea y que todos los individuos son muestreados al azar (Pielou 1975, Magurran 1988).
Para detectar diferencias en la diversidad entre hábitats se usó el método de Bootstrap, que estima los intervalos de confianza al 95% para realizar comparaciones gráficas directas entre el índice de Shannon. Para detectar diferencias en la diversidad de serpientes entre las dos temporadas por cada hábitat, se uso el índice de Solow (1993) que re-muestrea 10000 veces la distribución en la abundancia de las especies producida por la suma de las dos muestras. De esta manera la diferencia entre los índices de Shannon de las dos temporadas es llamada Delta y los valores observados de Delta son comparados contra la distribución de los valores de Delta generados de manera aleatoria, determinando si los valores observados de Shannon (por la diferencia entre los índices de las dos muestras) podrían haber sido generados por casualidad (Henderson & Seaby 2002).
Diversidad beta de especies. Se utilizó el índice de complementariedad que mide el grado de recambio en la composición de especies entre diferentes hábitats. Relaciona el número de especies en un área A, con el número de especies en un área B y el número de especies en común entre A y B (Colwell & Coddington 1994, Magurran 2004). De esta forma, la riqueza total para ambos hábitats combinados es:
S AB = a + b – c
donde a es el número de especies del sitio A, b es el número de especies del sitio B, y c es el número de especies en común entre los sitios A y B. El número de especies únicas a cualquiera de los dos sitios es:
UAB = a + b - 2c
Finalmente, a partir de estos valores calculamos la complementariedad de los sitios A y B como:
C AB = U AB / S AB
Los valores obtenidos a partir del análisis de complementariedad, varían desde cero, cuando ambos sitios son idénticos en composición de especies, hasta uno, cuando las especies de ambos sitios son completamente distintas (Colwell & Coddington 1994).
RESULTADOS
Diversidad total
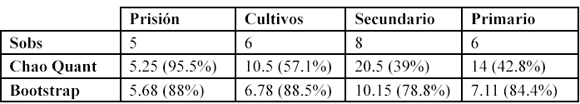
Para la Isla de Gorgona se reportaron 13 especies de serpientes pertenecientes a once géneros y cuatro familias. Las curvas de acumulación de especies no llegaron a una asíntota. Los estimadores Jacknife de primer y segundo orden presentaron un patrón similar en la riqueza de serpientes a lo largo de los muestreos, sobreestimando la riqueza y determinando una representatividad entre el 60-78% (Tabla 1).
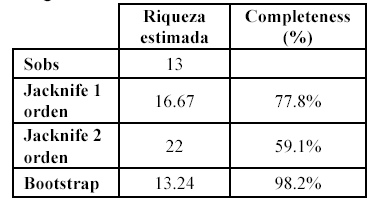
Por su parte el Bootstrap estimó una riqueza muy similar a la observada en campo (98%). Las especies únicas (singles) se asemejaron al patrón de la curva de riqueza observada aumentando a medida que se acumularon los muestreos (Figura 1).
Abundancia y composición
Se registraron 51 individuos pertenecientes a 13 especies (Tabla 2).
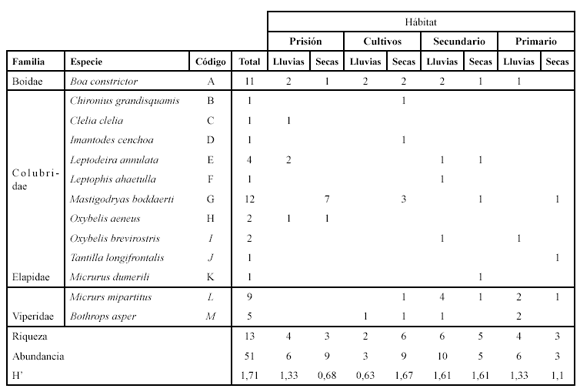
Se determinó a través del ANOSIM que no existen diferencias en la composición de serpientes entre los hábitats (p = 0.34). Se detectaron diferencias en la composición de serpientes entre las temporadas (lluvias vs secas) anidadas entre las áreas (p = 0.03). Durante la temporada de lluvias, las especies dominantes fueron Boa constrictor y Bothrops asper (SIMPER, porcentaje de contribución a la similitud de 67.3 y 12.8, respectivamente). En la temporada seca, las especies dominantes fueron Mastigodryas boddaerti y Boa constrictor (SIMPER, porcentaje de contribución a la similitud de 78.7 y 12.9, respectivamente).
Las curvas de rango abundancia presentaron pendientes similares entre los hábitats (Figura 2).
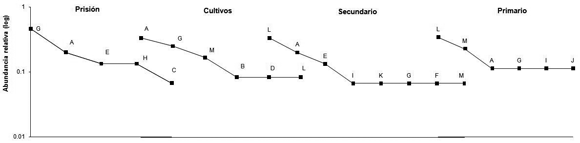
Los patrones de distribución de la abundancia y el orden jerárquico de las especies fueron diferentes entre los cuatro hábitats (Figura 2). En las áreas de cultivo las especies dominantes fueron Boa constrictor y Mastigodryas boddaerti (SIMPER, porcentaje de contribución a la similitud de 64.4 y 27.4, respectivamente), en la prisión Mastigodryas boddaerti y Boa constrictor (SIMPER, porcentaje de contribución a la similitud de 49.1 y 31.1, respectivamente), en el bosque secundario las especies dominantes fueron Micrurus mipartitus y Boa constrictor (SIMPER, porcentaje de contribución a la similitud de 56.4 y 32.3, respectivamente), y en el primario las especies dominantes fueron Micrurus mipartitus y Bothrops asper (SIMPER, porcentaje de contribución a la similitud de 78.6 y 21.4, respectivamente). El bosque secundario presentó mayor número de especies raras (cinco especies) seguido por cuatro especies en el bosque primario y tres especies en los cultivos (Figura 2).
Diversidad Alfa
El hábitat con mayor riqueza fue el bosque secundario (ocho especies) seguido por los cultivos y el bosque primario donde se registraron seis especies en ambos. Para los diferentes hábitats el estimador Bootstrap determinó un porcentaje de representatividad entre el 79 y 88%. El Chao cuantitativo varió entre el 95% para la prisión y el 39% para el bosque secundario (Tabla 3).
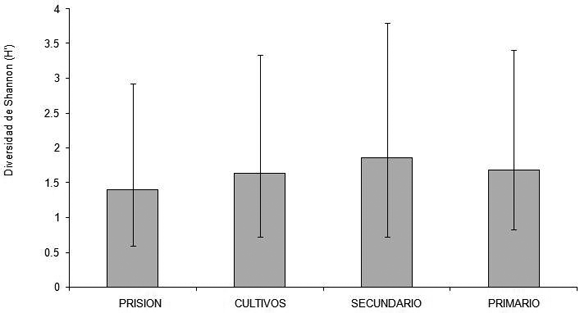
La equidad de serpientes no varió entre hábitats (Figura 3). En la prisión la equidad fue significativamente mayor durante la temporada de lluvias (delta = -0.64) y en los cultivos fue mayor en la temporada de secas (delta = 0.23).
La riqueza y la abundancia variaron a lo largo de las temporadas en todos los hábitats (Tabla 2). En el bosque (secundario y primario) la abundancia se duplicó durante la temporada de lluvias, mientras que en hábitats perturbados (cultivos y prisión) la abundancia fue mayor en secas (Tabla 2). La riqueza fue similar en los hábitats durante las dos temporadas, exceptuando por los cultivos donde el número de especies aumentó durante la temporada de secas (seis especies).
Diversidad Beta
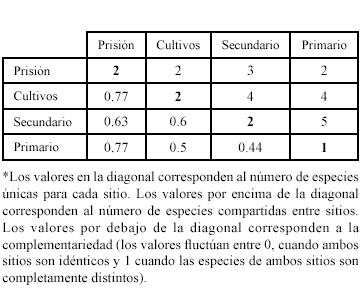
El mayor grado de recambio de especies (0.77) se presentó entre la prisión y los cultivos, y la prisión y el bosque primario (Tabla 4). Las áreas más similares en composición de especies fueron los bosques secundario y primario con una complementariedad del 0.44. Se registraron dos especies exclusivas para cada uno de los hábitats de prisión, cultivo y bosque secundario, y una especie exclusiva en el bosque primario.
DISCUSIÓN
Riqueza estimada y representatividad de serpientes
En el presente estudio se registraron 13 especies de serpientes, lo que constituye el 76.4% del total de la ofidiofauna registrada para la Isla de Gorgona (Rangel 1995) y el 72% de la ofidiofauna insular para todo el país (Sánchez et al. 1995). En general los estimadores de riqueza (Bootstrap y Jacknife 1 y 2) estimaron entre cuatro y nueve especies más para el ensamblaje de serpientes, y no llegaron a la asíntota debido a que las especies raras (6 únicas y 2 dobles) tendieron a aumentar a medida que se incrementaba el esfuerzo de muestreo. Debido a esto los estimadores Jacknife 1 y 2 establecen un porcentaje de representatividad entre 60 y 77.8%, mientras que el Bootstrap determina una representatividad del 98.2% con un mejor desempeño al estimar la riqueza total de organismos como las serpientes. Algunos estudios exhaustivos en reptiles de selvas neotropicales reportan, con 1296 horas-hombre de muestreo, una representatividad entre 65.3% con Jack 2 y 87% con Bootstrap (Urbina-Cardona 2007). Aunque para otros grupos de especies se ha propuesto que el 80% de representatividad es necesario para poder hacer comparaciones válidas entre inventarios o hábitats (Soberón & Llorente 1993, Pineda & Halffter 2003), dada su naturaleza de grandes predadores, las serpientes son normalmente menos abundantes que otros reptiles (Rugiero & Luiselli 1996) por lo cual, son difíciles de estudiar en campo (Seigel & Collins 1993). Es posible que las comparaciones de inventarios de serpientes puedan ser válidas con valores de representatividad por encima del 70%, o bien se podrían restringir las comparaciones de riqueza estimada de serpientes tropicales, a los resultados arrojados por el o por el Bootstrap el cual es un estimador idóneo para determinar la riqueza de ensamblajes con una gran cantidad de especies raras (Magurran 2004) como lo son las serpientes.
Diversidad de hábitat
La riqueza estimada por Chao para los diferentes hábitats demuestra que existe una alta probabilidad de encontrar especies adicionales en los bosques primarios y secundarios, y disminuye en hábitats de cultivos o prisión. Al tomar a la representatividad de especies como un indicador de la riqueza potencial de un hábitat; el bosque secundario y primario serían los que potencialmente podrían presentar mayor número de especies adicionales, mientras que la prisión sería el hábitat con menor riqueza esperada, y representa prácticamente todas sus especies en la muestra actual. Se debe invertir un mayor esfuerzo de captura de serpientes en hábitat conservados dado su bajo porcentaje de representatividad, ya que la complejidad en la estructura vegetal no permite detectar fácilmente a las especies.
La riqueza y la abundancia de serpientes en ambientes de selva (bosque primario y secundario) fue mayor durante la época de lluvias. Es necesario considerar que la distancia de casi 3 años entre los muestreos, podría incluir el factor de variaciones anuales climáticas en los patrones encontrados. Sin embargo, la diversidad de serpientes en este estudio no varió entre temporadas indicando que la estructura de la ofidiofauna se mantiene constante. Esto puede ser debido a que la distribución de la herpetofauna en áreas de bosque primario y secundario está asociada a la estructura vegetal (e.g. cobertura herbácea y de dosel y densidad de sotobosque) que promueve microhábitats mas húmedos y con menor temperatura (Urbina-Cardona & Londoño-Murcia 2003). A su vez esta estructura vegetal mantiene un ambiente estable en los microhábitats selváticos a lo largo de las temporadas (Urbina-Cardona et al. 2006).
En el caso de las áreas perturbadas la diversidad de serpientes es mayor en prisión durante la temporada de lluvias y en cultivos durante la temporada de sequía. En áreas perturbadas por el hombre, la distribución de la herpetofauna está determinada por la temperatura (Urbina-Cardona & Londoño-Murcia 2003) y esta tiende a aumentar en áreas abiertas siendo idónea para la termorregulación de los reptiles (Urbina-Cardona et al. 2006). Dado que la temperatura varía a lo largo del año, es lógico pensar que en áreas abiertas la dominancia de algunas especies puede cambiar entre temporadas, dependiendo de sus tolerancias ecofisiológicas. Este es el caso de Mastigodryas boddaerti que incrementa su abundancia durante época seca. Sin embargo, se debe tener en cuenta que para algunas especies la perturbación antropogénica genera estrés, reduce el tamaño de la camada (Farr & Gregory 1991), el éxito de forrajeo y afecta algunos procesos fisiológicos como la digestión y el crecimiento (Lillywhite 1987). De esta forma la perturbación del hábitat afecta de manera distinta a las especies, genera cambios en la dominancia de especies y a nivel de ensamblaje empobrece la "calidad de las especies" (e.g. composición de especies) y reduce la diversidad de serpientes en hábitats degradados.
El bosque primario y los cultivos presentaron una similitud media en la composición de serpientes (50%), compartiendo el 66.6% de las especies. En general, las áreas que han sido usadas para cultivos tienen la capacidad de mantener estados sucesionales tempranos, soportando mayor diversidad de plantas y animales (DeGraff et al. 1992, Litvaitis et al. 1999). Sin embargo, se debe tener en cuenta que en hábitats de cultivo las serpientes tienden a desplazarse en menor medida (Capizzi & Luiselli 1996) a diferencia de los bosques secundarios y primarios contiguos donde pueden dispersarse ampliamente. De esta manera el grado de aislamiento en interacción con la estructura vegetal afecta la distribución y abundancia relativa de serpientes (Luiselli & Capizzi 1997). Cabe resaltar que en los cultivos de cocos en la Isla Gorgona la dominancia de las especies tiende a aumentar por la perturbación antropogénica, por ello es muy importante contrastar los patrones en la composición de especies con los patrones en la abundancia para tener un panorama más amplio de los ensamblajes.
Para la Isla Gorgona, es posible que especies de mediano y gran tamaño como B. asper, B. constrictor y M. boddaerti presenten requerimientos de hábitat menos específicos y toleren eficientemente los cambios microclimáticos asociadas a todo el gradiente de perturbación antropogénica. Estos resultados contrastan con el planteamiento de Scott & Seigel (1992) y Dodd (1993) quienes sostienen que las serpientes que son conspicuas, tienen un gran tamaño corporal, tiempo de vida largo y bajo potencial reproductivo se ven afectadas en mayor medida por perturbaciones en su hábitat (Scott & Seigel 1992, Dodd 1993). Esto podría ser debido a que la isla Gorgona presenta alta humedad relativa durante casi todo el año y la regeneración vegetal se ha producido desde hace 30 años en las áreas perturbadas amortiguando el disturbio. Dado que algunas especies se comportan ante el disturbio de manera diferencial en la isla a como lo hacen en el continente (Urbina-Cardona & Londoño-Murcia 2003) es importante contrastar los patrones descritos en el presente estudio con futuros trabajos en el continente.
Implicaciones para la conservación de las serpientes
En la selva de Los Tuxtlas (México) se determinó que la estacionalidad en interacción con el hábitat (gradiente potrero-borde-interior) tiene un efecto significativo en la abundancia y composición de los reptiles en la selva (Urbina-Cardona 2007). Este resultado es similar al encontrado en la Isla Gorgona lo que demuestra que la perturbación antropogénica estimula una compleja dinámica en la estructura de las serpientes que habitan en ambientes tropicales. Estudios ecológicos que relacionen la ofidiofauna con las características de su hábitat son necesarios para plantear estrategias de conservación adecuadas (Dodd 1993). En este estudio se determinó que la presencia de especies con bajas densidades poblacionales como Leptophis ahaetulla, Micrurus dumerili, Oxybelis brevirostris y Tantilla longifrontalis en áreas restringidas de distribución como lo son los bosques primarios y secundarios, justifica la preservación de estas áreas, ya que son poblaciones propensas a sufrir procesos de extinción cuando las condiciones de su medio se modifican a gran escala. Es importante verificar los patrones de uso de hábitat por parte de estas especies en el continente para determinar si la pérdida de hábitat representa un riesgo para estas especies y por tanto deben ser incluidas en alguna categoría de Amenaza.
En Colombia no se han incluido especies de serpientes en las categorías de Amenaza de la UICN por la falta de conocimiento de su distribución, historia natural y autoecología. Estudios que registren la composición, la estructura y los patrones de abundancia de serpientes entre distintos hábitats y temporadas, proveen información robusta para clasificar a las especies en alguna categoría de Amenaza de la UICN. Simultáneamente se deben realizar estudios poblacionales para conocer la estructura de edades y sexos, movimientos, dieta y diversidad genética de las serpientes con el fin de conocer el estado de aislamiento de las poblaciones. Finalmente estudios sociales que permitan conocer la percepción y el uso que las comunidades humanas hacen de las serpientes locales permitirá ingresar algunas especies en el listado del CITES.
AGRADECIMIENTOS
A la Profesora Olga Castaño Mora por la revisión y comentarios de la versión preliminar del manuscrito. A la Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales (UAESPNN) del Ministerio del Medio Ambiente por darnos el permiso de investigación. Al Servicio de Guardaparques Voluntarios de la UAESPNN por permitirnos la estancia como Guardaparque-investigador. Este estudio fue posible gracias a la colaboración del personal del Parque Nacional Natural Isla Gorgona, funcionarios, guardaparques y agentes de policía.
LITERATURA CITADA
1. AGUIRRE-C., J. & J.O. RANGEL-CH. 1990. Biota y Ecosistemas de Gorgona. Fondo FEN, Bogotá. [ Links ]
2. BEAUPRE, S. 1995. Effects of Geographically Variable Thermal Environment on Bioenergetics of Mottled Rock Rattlesnake. Ecology 76: 1655-1665. [ Links ]
3. BROWER, J., J. ZAR & C. VON ENDE. 1998. Field and Laboratory methods for General ecology. Fourth edition. WCB/McGraw-Hill. USA. [ Links ]
4. CAPIZZI, D. & L. LUISELLI. 1996. Feeding relationships and competitive interactions between phylogenetically unrelated predators (owls and snakes). Acta Oecologica 17: 265-84. [ Links ]
5. CHAMORRO, C. 1987. Parque Nacional Isla de Gorgona. Colombia sus gentes y regiones. Instituto Geográfico Agustín Codazzi 5: 2-17. Bogotá. [ Links ]
6. CLARKE, K.R. & R.M. WARWICK. 2001. Change in Marine Communities: An Approach to Statistical Analysis and Interpretation. Natural Environment Research Council, UK. [ Links ]
7. COLWELL, R. & J. CODDINGTONG. 1994. Estimating Terrstrial Biodiversity through Extrapolation. Philosophical Transaction: Biological Science 344: 101-108. [ Links ]
8. CROSS, C. & C. PETERSEN. 2001. Modeling snake microhabitat from Radio telemetry Studies Using Polytomous Logistic Regression. Journal of Herpetology 35: 590-597. [ Links ]
9. CRUMP, M.L. & N.J. SCOTT. 1994. Visual encounter surveys. Pp 364. In: Heyer, W., Donnelley, M. A., McDiarmid, R. A., Hayec, L. C. & Foster, M. C. (eds.). Measuring and Monitoring Biological Diversity. Standard Methods for Amphibians. Smithsonian Instituton Press, Washington D.C. [ Links ]
10. DE GRAFF, R.M., M. YAMASAKY, W.B. LEAK & J.W. LANIER. 1992. New England wildlife: management of forested habitats. General Technical Report NE-144. US Department of Agriculture, Forest Service. Northeastern Forest Experiment Station, Radnor, Pennsylvania. [ Links ]
11. DICKERSON, N. 2001 Riparian Habitat Management for Reptiles and Amphibians on Corps of Engineers Projects. ERDC TN-EMRRP-SI-22 August 2001. [ Links ]
12. DODD JR, C.K. 1993. Strategies for snake conservation. In: Seigel, R.A. & Collins, J.T. (eds.), Snakes: Ecology and Behavior. McGraw-Hill, Nueva York, pp. 363-393. [ Links ]
13. DODD JR, C.K. 1987. Status, conservation and management. En: Siegel, R. A., Collins, J. T. & Novak, S. S. (eds.). Snakes: Ecology and Evolutionary Biology. Pp. 478-513. McGrawHill, Inc., Nueva York. [ Links ]
14. FARR, D.R. & P.T. GREGORY. 1991. Sources of variation in estimating litter characteristics of the garter snake, Thamnophis elegans. Journal of Herpetology 25:261–268. [ Links ]
15. FEINSINGER, P. 2001. Designing Field Studies for Biodiversity Conservation. Island Press, Washington, DC. [ Links ]
16. FILIPPI, E. & L. LUISELLI. 2000. Status of the Italian snake fauna and assessment of conservation. Biological Conservation 93:219-225. [ Links ]
17. GIBBONS, J.W., D.E. SCOTT, T.J. RYAN, K.A. BUHLMANN, T.D. TUBERVILLE, B.S. METTS, J.L. GREENE, T. MILLS, Y. LEIDEN, S. POPPY & C.T. WINNER. 2000. The global decline of reptiles, de´ja` vu amphibians. BioScience 50: 653–661. [ Links ]
18. HEDGES, S.B. 2006. An overview of the evolution and conservation of West Indian amphibians and reptiles. Applied Herpetology 3:281-292. [ Links ]
19. HENDERSON, P.A. & R.M. SEABY. 2002. Species Diversity and Richness Version 3.02 Pisces Conservation Ltd., Lymington. [ Links ]
20. HOLDRIDGE, L. 1947. Determination of World Formation from Simple Climate data. Science 105:367-368. [ Links ]
21. IDEAM. 2003. Datos Históricos de Precipitación 1987 – 2003. [ Links ]
22. KELLER, L. & E. HESKE. 2000. Habitat Use by Three spices ok Snakes at the Middle Fork Fish and Wildlife area Illinois. Journal of Herpetology 34:558-564. [ Links ]
23. KJOSS, V.A. & J.A. LITVAITIS. 2001. Community structure of snakes in a human-dominated landscape. Biological Conservation 98: 285-292. [ Links ]
24. LANCINI, A. 1986. Serpientes de Venezuela. Ed. Ernesto Armitano. Caracas. [ Links ]
25. LILLYWHITE, H.B. 1987. Temperature, energetics and physiological ecology. In: Seigel RA, Collins JT & Novak SS (eds.) Snakes: ecology and evolutionary biology. pp 422–477. Collier Macmillan Canada, Toronto. [ Links ]
26. LITVAITIS J.A., D.L. WAGNER, J.L. CONFER, M.D. TARR & E.J. SNYDER. 1999. Early-succesional forests and shrub-dominated habitats: land-use artifact or critical community in the northeastern Unied States?. Northeast Wildlife 54:101-118. [ Links ]
27. LLINAS, R., J. PINTO, F. PEÑA & F.G. CARO. 1990. Geología. Pp. 244-251. En: Aguirre C. y Rangel. Ch. (eds.). Biota y Ecosistemas de Gorgona. Fondo FEN, Bogotá. [ Links ]
28. LOWELL, A. 1994. Urban Wildlife Habitats: A landscape perspective. Pp. 65-80. In: Weller. M.(ed.). Wildlife Habitats. University of Minnesota Press. Londres. [ Links ]
29. LUISELLI, L. & D. CAPIZZI. 1997. Influences of area, isolation and habitat features on distribution of snakes in Mediterranean fragmented woodlands. Biological Conservation 6:1339-1351. [ Links ]
30. MAGURRAN, A. 1988. Diversidad Ecológica y su Medición. Primera edición. Ediciones Vedra. Barcelona. [ Links ]
31. MAGURRAN, A. 2004. Measuring biological diversity. Blackwell Publishing. [ Links ]
32. MARTINS, M. & M. GORDO. 1993. Bothrops asper (Common Lancehead): Diet. Herpetological Review 24:151-152. [ Links ]
33. MCALLISTER, A. 1995. Wetland Habitat Use by the Black Rat Snake, Elape obsoleta, in Eastern Ontario. Canadian Field-Naturalist 109: 449-451. [ Links ]
34. MORENO, C. 2001. Métodos para medir la Biodiversidad. Manuales y Tesis. Sociedad Entomológica Aragonesa. 1: 1-83. [ Links ]
35. PARENT, C. & P.J. WEATHERHEAD. 2000. Behavioral and life history responses of eastern massasauga rattlesnakes (Sistrurus catenatus catenatus) to human disturbance. Oecologia 125:170-178. [ Links ]
36. PIELOU, E.C. 1975. Ecological Diversity. Wiley-Interscience Publication. [ Links ]
37. PINEDA, E. & G. HALFFTER. 2003. Species Diversity and Habitat Fragmentation: Frogs in a Tropical Montane Landscape in Mexico. Biological Conservation 117: 499- 508. [ Links ]
38. PRIOR, K. & P. WEATHERHEAD. 1996. Habitat Features of Black Rat Snake Hibernacula in Ontario. Journal of Herpetology 30: 211-218. [ Links ]
39. PLUMMER, M. 2002. Observation of hibernacula and over wintering Ecology of Eastern Hog-nose Snake (Heterodon platichinos). Journal of Herpetology 34: 565-575. [ Links ]
40. RANGEL-CH, J.O. 1995. Isla de Gorgona y Gorgonilla. Pp. 145-154. En: Rangel-Ch, J. (ed.). Colombia: Diversidad Biótica I. Editora Guadalupe, Universidad Nacional de Colombia. Bogotá. [ Links ]
41. REINERT, H. 1993. Habitat selection in snakes. Pp: 201-240. In: Seigel, R.A. & Collins, J.T. (eds.) Snakes: Ecology and Behavior. McGraw-Hill, Nueva York. [ Links ]
42. RUEDA, J.V. 1999. Anfibios y reptiles amenazados de extinción en Colombia. Revista de la Academia Colombiana de Ciencias 23: 474-497. [ Links ]
43. RUGIERO L. & L. LUISELLI. 1996. Ecological notes on an isolated population of Elaphe quatuorlineata. Herpetological Journal 6: 93-95. [ Links ]
44. SÁNCHEZ, H., O. CASTAÑO & G. CARDENAS. 1995. Diversidad de los Reptiles en Colombia. Pp. 277-325. En: Rangel-Ch. J. (ed.). Colombia Diversidad Biotica I. Instituto de Ciencias Naturales. FEN. Bogotá. [ Links ]
45. SAUNDERS, D., R. HOBBS & C. MARGULES. 1991. Biological consecuences of ecosystem fragmentation: A review. Conservation Biology 5: 18-32. [ Links ]
46. SCOTT JR., N.J. & R.A. SEIGEL. 1992. The management of Amphibian and Reptile populations: species priorities and methodological and theoretical constraints. In: McCullough, D.R. & Barrett, H.R. (eds.), Wildlife 2001: Populations. Elsevier Applied Science, Londres, pp. 343-368. [ Links ]
47. SEIGEL, R.A. & J.T. COLLINS. 1993. Snakes: Ecology and Behavior. McGrawHill, Inc., Nueva York. [ Links ]
48. SEIGEL, R.A., J.T. COLLINS & S.S. NOVAK. 1993. Snakes: Ecology and Evolutionary Biology. McGrawHill, Inc., Nueva York. [ Links ]
49. SOBERÓN, J. & J. LLORENTE. 1993. The use of Species Accumulation Functions for the Prediction of Species Richness. Conservation Biology 7: 480-488. [ Links ]
50. SOLOW, A.R. 1993. A simple test for change in community structure. Journal of Animal Ecology 62: 191-193. [ Links ]
51. THOMAS, E. 1998. Are Microhabitat Preferences of Coexisting Species under Selection and Adaptive. Ecology 79: 656-670. [ Links ]
52. TOLSON, P.J. & R.W. HENDERSON. 2006. An overview of snake conservation in the West Indies. Applied Herpetology 3:345-356. [ Links ]
53. URBINA-CARDONA, J.N. 2007. Evaluación del efecto de borde sobre la composición de la comunidad de herpetofauna en áreas con diferente uso del suelo y orientación del borde en la Reserva Los Tuxtlas, Veracruz. Tesis Doctoral. Universidad Nacional Autónoma de México (UNAM), México DF. [ Links ]
54. URBINA-CARDONA, J.N., M. OLIVARES-PÉREZ & V.H. REYNOSO. 2006. Herpetofauna diversity and microenvironment correlates across the pasture-edge-interior gradient in tropical rainforest fragments in the region of Los Tuxtlas, Veracruz. Biological Conservation 132:61-75. [ Links ]
55. URBINA-CARDONA, J.N. & V.H. REYNOSO. 2005. Recambio de anfibios y reptiles en el gradiente potrero-borde-interior en la Reserva de Los Tuxtlas, Veracruz, México. Capítulo 15. En: Halffter, G., J.Soberón, P. Koleff y A. Melic (eds.) Sobre Diversidad Biológica: El significado de las Diversidades Alfa, Beta y Gamma. CONABIO, SEA, DIVERSITAS y CONACyT. Volumen 4. Editorial Monografías Tercer Milenio, Zaragoza. Pp:191-207. [ Links ]
56. URBINA-CARDONA, J.N. & M.C. LONDOÑO-MURCIA. 2003. Distribución de la Comunidad de herpetofauna Asociada a Cuatro Áreas con diferente Grado de Perturbación en la Isla Gorgona, Pacifico Colombiano. Revista de la Academia Colombiana de Ciencias 27:105-113. [ Links ]
57. VARGAS, F. & M.E. BOLAÑOS. 1999. Anfibios y reptiles presentes en hábitats perturbados de selva lluviosa tropical en el bajo Anchicayá, Pacífico colombiano. Revista de la Academia Colombiana de Ciencias 23: 499-511. [ Links ]
58. WHITTAKER, R. 1972. Evolution and measurement of species diversity. Taxon 21:213-251. [ Links ]
Recibido: 01/12/2007
Aceptado: 08/07/2008














