Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.31 no.1 Bogotá Jan./June 2009
Anuran ensembles inhabiting productive systems and forests at the Piedemonte Llanero, Meta department, Colombia
SANDRA P. CÁCERES-ANDRADE
J. NICOLÁS URBINA-CARDONA
INGETEC S.A., Carrera 6 # 30A-30, Bogotá D.C., Colombia. sapacandrade@yahoo.com
Conservation International, Colombia. Carrera 13 # 71-41, Bogotá D.C., Colombia. nurbina@yahoo.com
RESUMEN
La perturbación antropogénica en el hábitat genera cambios en la riqueza, la composición y los patrones de abundancia de las especies de anuros. Dada su estrecha relación con las variables del microhábitat, los anuros pueden experimentar estos cambios a lo largo de gradientes de disturbio en el hábitat y la cobertura vegetal. Para abordar este proceso en el piedemonte llanero del Meta se muestrearon, entre septiembre y diciembre de 2001 (representando las épocas de lluvias y sequía), áreas con diferente grado de perturbación antropogénica (cultivos, potreros y bosques), para así determinar la diversidad biológica de ranas en gradientes espacio-temporales. Se registraron 247 individuos de 16 especies de anuros (7 en potrero, 9 en cultivos y 9 en bosque). La riqueza y abundancia fue mayor durante la época de lluvias en las tres áreas, pero la equidad sólo fue mayor en el bosque durante las lluvias. En general la composición y dominancia de especies fluctuó entre temporadas y áreas. La especie más dominante fue Dendropsophus mathiassoni predominando principalmente en cultivos. Los anuros que pueden verse más afectados por la perturbación antropogénica, la fragmentación y la pérdida del bosque en el piedemonte llanero del departamento del Meta son: Pristimantis medemi, Dendropsophus minutus, Leptodactylus fragilis y Allobates marchesianus. Esta última especie, puede estar especialmente amenazada debido a la sinergia entre la sensibilidad a cambios en el hábitat y su especificidad en la tolerancia de gradientes ambientales. Así mismo la ausencia de registros de Pristimantis frater, Pristimantis savagei, Allobates juani y Allobates ranoides podría indicar que los sistemas productivos que rodean los fragmentos de bosque remanente, en el piedemonte llanero, generan tal grado de perturbación que reducen las poblaciones de anuros que no toleran la matriz antropogénica. De manera general, la humedad relativa, la distancia a cuerpos de agua y la cobertura de dosel influencian la distribución de los anuros en el mosaico de hábitats del piedemonte llanero. Para conservar localmente estas especies es importante mantener cuerpos de agua en los bosques remanentes, así como alta cobertura de dosel que genere una gruesa capa de hojarasca en el suelo y ambientes con temperaturas estables y bajas. Es prioritario realizar en el país estudios detallados de las variables que determinan la presencia de los anuros en los microhábitats y del uso que estos organismos hacen de gradientes espacio-temporales. Esta información no sólo contribuye al conocimiento de la historia natural y autoecología de los anuros colombianos, sino que genera herramientas robustas para el manejo y conservación de estos organismos en paisajes fragmentados.
Palabras clave. Diversidad de anuros, perturbación antropogénica, uso del microhábitat, variables ambientales, gradientes espacio-temporales.
ABSTRACT
Anthropogenic habitat disturbances generate changes in the composition, diversity and abundance patterns of frogs. Due to the strict relationship with microhabitat, frogs could reflect environmental changes along disturbance and vegetation structure gradients. Between September and December 2001 we surveyed frogs in three different areas (pastures, cultivated areas, and forests) representing both dry and wet seasons at the piedemonte llanero (Meta Department savannas). We registered 247 individuals of 16 frog species (7 in pasture, 9 in cultivated areas, and 9 in forest). There was an increase in frog species richness and abundance during wet seasons, and species diversity was significantly higher during wet season in forest. As a general rule species composition and dominance fluctuated along seasons and areas. Most dominant species at the study site were Dendropsophus mathiassoni, principally at cultivated lands. Most vulnerable anurans to anthropogenic disturbance and habitat fragmentation and loss of Meta savannas were: Pristimantis medemi, Dendropsophus minutus, Leptodactylus fragilis and Allobates marchesianus. Specially A. marchesianus may be particularly at risk from the synergy between sensitivity to changes in habitat and its specificity in tolerance of environmental gradients. Likewise, the absence of records of Pristimantis frater, Pristimantis savagei, Allobates juani and Allobates ranoides could indicate that production systems surrounding forest fragments remaining in the piedmont plains generate a degree of disturbance that reduces the populations of frogs that do not tolerate anthropogenic matrix. In general, relative humidity, distance to bodies of water, and the canopy coverage, influence the distribution of anurans in the mosaic of habitats in the piedmont plains. Locally to conserve these species it is important to maintain bodies of water inside forest remnants, and high canopy cover that generates a wide layer of leaf litter on the soil and environments with stable and low temperatures. It is a priority in the country to carry out detailed studies of the variables that determine the presence of anurans in microhabitat and their distribution along spatio-temporal gradients. This information not only contributes to the knowledge of the autoecology and natural history of Colombian anurans, but generates robust tools for management and conservation of these organisms in fragmented landscape.
Key words. Frog diversity, anthropogenic disturbance, microhabitat use, environmental variables, spatio-temporal gradients.
INTRODUCCIÓN
A nivel global, los trópicos presentan la mayor diversidad debido a que las especies presentan adaptaciones y especializaciones muy finas (Krebs 2001). En los trópicos americanos la heterogeneidad vegetal genera condiciones climáticas óptimas (e.g. alta humedad y baja estacionalidad) para los anuros (Duellman & Trueb 1986, Duellman 1999), determinando nichos más restringidos y más especies por unidad de área (Krebs 2001). Estas condiciones favorecen la diversidad y abundancia de anuros ya que les confieren diversos sitios de refugio, alimentación y oviposición (Crump 1971, 1974, Duellman & Trueb 1986, Lips & Donnelly 2005). La distribución espacial de las especies de anfibios está dada por la interacción entre los requerimientos fisiológicos de los organismos, la disposición de recursos (comida, refugio, reproducción, sitios para la termorregulación, rutas de escape, entre otros) y las características físicas del hábitat (Zug et al. 2001, Urbina-Cardona et al. 2006). En el caso de los anuros de tierras bajas, éstos se enfrentan al reto de encontrar la humedad adecuada que permita el desarrollo tanto de los estadios larvarios como de los adultos, debido a que la lluvia no está garantizada y los niveles de humedad pueden fluctuar (Duellman 1992).
Colombia cuenta con 753 especies de anfibios (Acosta 2008), ocupando el segundo puesto mundial con el 11.7% de anfibios mundiales. La diversidad de especies de anuros y el grado de endemismo es relativamente bajo en regiones subhúmedas colombianas, como los Llanos Orientales (Lynch et al. 1997, Duellman 1999), a pesar de su gran extensión, lo cual, contrasta con la región del Pacífico que alberga un número considerable de especies y presenta alto grado de endemismo (Lynch et al. 1997). Recientemente se ha demostrado que, en tierras bajas, los modos reproductivos confieren a las especies diferentes estrategias de tolerancia a los gradientes de perturbación antropogénica que están relacionados con la desecación, el uso del microhábitat y la evasión de predadores (Magnusson & Hero 1991, Haddad & Prado 2005, Urbina-Cardona & Reynoso 2005, Becker et al. 2007, da Silva et al. 2008). El 30% de los anfibios colombianos se encuentran categorizados dentro de algún grado de amenaza de extinción (0.88% EX, 24.2% CR, 38.3% EN, 36.5% VU; IUCN 2009), ocupando el primer lugar a nivel mundial en la lista de especies con mayor número de especies amenazadas de anfibios (Ángulo et al. 2006). Llama la atención el hecho de que el 16% de las especies colombianas esté reportado como "Datos deficientes", ya que resalta la prioridad de realizar estudios básicos que permitan conocer, los estados poblacionales actuales de ese "desconocido grupo", y su grado de vulnerabilidad a factores antropogénicos para así ubicarlas dentro de los parámetros de IUCN de una manera mas precisa (Urbina-Cardona 2008a).
El principal factor que amenaza la supervivencia de los anfibios neotropicales es la pérdida y el deterioro del hábitat, causado por actividades antropogenicas (Crump 2003, Young et al. 2004, Urbina-Cardona 2008a). En Colombia existe una alta tasa de deforestación, incluido el piedemonte llanero (IGAC et al. 1984, Etter et al. 2006), siendo estos ecosistemas los más transformados (Wyngaarden & Fandiño-Lozano 2005), debido a procesos de urbanización y el desarrollo de actividades económicas tales como agricultura y ganadería (Gonzáles et al. 1989, Correa et al. 2005).
Sin embargo, para el país poco se sabe sobre los efectos de la transformación de los ecosistemas por actividades ganaderas en la biodiversidad de piedemonte llanero (Etter et al. 2008). Las actividades humanas en el piedemonte llanero del departamento del Meta presentan una tendencia de apertura de campos para la ganadería de extensión que trae como consecuencia la transformación de las sabanas naturales y la pérdida del bosque remanente (Gonzáles et al. 1989, IGAC 1991). Este estudio evaluó la diversidad y el uso del microhábitat de los anuros presentes en sistemas productivos (potrero y cultivo) y bosques en el piedemonte llanero en el departamento del Meta.
MÉTODOS
Área de estudio
El departamento del Meta representa el 7.5% del territorio nacional y según el reporte más reciente cuenta con 70 especies de anfibios (Acosta 2008) a largo de todo su gradiente altitudinal desde 100 hasta 4000 msnm. El piedemonte llanero colombiano comprende tierras con elevaciones entre 100 y 4500 msnm que se encuentran en las proximidades de las estribaciones de la Cordillera Oriental (Gonzáles et al. 1989, Rangel et al. 1997, López-Ramos 2004) generando diversos microclimas asociados a la circulación de los vientos regionales y locales entre la cordillera y las tierras bajas (Cabildo Verde 1999). La región presenta un régimen climático monomodal, con una época de lluvias de abril a octubre en donde junio y julio son los meses más lluviosos y una época de sequía entre noviembre y marzo, siendo enero el más seco. El promedio anual de precipitación es de 2600 mm, la temperatura promedio es de 27ºC entre enero y marzo y de 26ºC entre abril y diciembre; y la humedad relativa promedio es de 75% (entre 65% y 90%; Galvis et al. 1989).
La selva húmeda tropical fue la cobertura original de la región donde actualmente se distribuye el piedemonte llanero. Con la explotación forestal (IGAC 1991) y con la acelerada colonización al inicio de los años cincuentas (Gonzáles et al. 1989) las selvas fueron transformadas en sabanas para las actividades agrícolas y pecuarias, base de la economía departamental (Gonzáles et al. 1989, IGAC 1991, Martínez-S 1991). El crecimiento del área urbana generó el desarrollo de infraestructura, estimulando la valorización de las tierras y con ello la migración de personas de diferentes regiones del país, convirtiendo la región en el centro de mercadeo agropecuario de Colombia (ICAG 1991). En la actualidad en el piedemonte llanero existen relictos de bosque dentro de los que se encuentran los bosques de terrazas y de altillanuras intervenidos, que poseen una composición florística y una fisionomía similar a los bosques de galería de los Llanos Orientales (IGAC et al. 1984), pero con características de vegetación de transición entre el bosque de la Cordillera Oriental y el de la sabana (Rangel et al. 1997).
El área de estudio se encuentra a una altitud entre los 467 y 570 msnm y comprende dos regiones:
a) El Municipio de Restrepo (4º 16" N, 73º 34' 25" O) limita al norte con el Departamento de Cundinamarca y el municipio de Cumaral, al occidente con los municipios de San Juanito, El Calvario y Villavicencio, al sur con el municipio de Puerto López y al oriente con el municipio de Cumaral. Presenta mesetas, terrazas antiguas, terrazas bajas y abanicos aluviales recientes (Orduz-Quijano 1998). El área de muestreo cubre tres fincas con diferente tiempo de fundación: Las Delicias, Los Limoncitos y La Fortuna (16 años, 67 años y 8 años respectivamente).
b) El municipio de Villavicencio (04º 09' 00,83" N y 73º 38' 24,26" O) limita al norte con El Calvario y el municipio de Restrepo, al occidente con el departamento de Cundinamarca y Acacías, al sur con Acacías y San Carlos de Guaroa y al oriente con Puerto López (IGAC 1991, Martínez-S 1991). El Jardín Botánico está ubicado al noroccidente de la ciudad, en el barrio La Azotea, (4º 09´ 00" N, 79º 39´ 30" W) y cuenta con una extensión aproximada de 47 hectáreas siendo el fragmento de bosque de mayor tamaño en el área de estudio.
En cada región se seleccionaron tres tipos de vegetación con diferente grado de perturbación antropogénica, que incluyeran cuerpos de agua aledaños a los transectos (e.g. estanques, lagunas, quebradas):
Potrero. Esta área presenta sabanas dedicadas al ganado de extensión de más de 10 años de antigüedad colindando con algunas fincas dedicadas a la búsqueda de tecnologías alternativas, para el manejo del suelo.
Cultivos. Esta área presenta un mosaico de cultivos, entre 5 y 10 años de antigüedad, compuesto por caña panelera, Chonque (Xanthosoma sagittifolium) y una asociación Chonque- Bore (Alocasia macrorrhiza).
Bosque. Esta área fue evaluada en tres fragmentos de bosque en regeneración, con bordes de distintas edades (entre 13 y 16 años) y con una extensión de entre 3 y 47 ha. A pesar de que en esta área no se permiten actividades productivas, sirven como zona de paso a los habitantes de zonas aledañas y hay cacería selectiva de monos, armadillos y algunos roedores.
Muestreo de anuros
Se estandarizó el protocolo de muestreo durante los meses de Julio y Agosto de 2001 y se ubicaron tres transectos permanentes de 100 m de longitud y 4 de ancho (2 a cada lado) en cada área: potrero, cultivo y bosque. Los muestreos fueron realizados durante cuatro salidas al campo entre septiembre y diciembre 2001, representado el final de la época de lluvias y el inicio de la sequía. Para registrar a los anuros en sus microhábitats se utilizó la técnica del conteo visual con captura manual (Crump & Scott 1994) a lo largo de transectos replicados en el paisaje (Urbina-Cardona et al. 2006). En cada salida se muestrearon los transectos hasta dos metros de altura durante dos horas en la mañana (desde 6:30 horas) y dos horas en la noche (desde 17 horas), para un esfuerzo total de 144 horas/hombre.
Medición del microhábitat
Durante la fase de premuestreo se midió la distancia a cuerpos de agua y la cobertura de dosel para cada uno de los transectos (n = 9). De esta forma, en cada transecto, se realizó una caracterización de la vegetación a lo largo de transectos de 25 m de longitud, realizando levantamientos hasta 2 m a cada lado del transecto (Sutherland 1996). Cada 5 m se estimó la cobertura de dosel con la ayuda de un densiómetro, (espejo convexo con cuadrícula), en donde se contabilizaron los recuadros sombreados. La distancia a cuerpos de agua fue medida con un GPS, georeferenciando todos los transectos y haciendo uso de la función "Go To" desde el cuerpo de agua más cercano a cada transecto.
Durante los muestreos de los anuros se midieron otras variables, en el sustrato en que se observó por primera vez cada organismo: altura sobre el suelo, temperatura, humedad relativa y espesor de la capa de hojarasca (n = 247) con el fin de caracterizar el microhabitat de cada individuo y debido a que estas variables fluctúan a lo largo del transecto. La altura sobre el suelo se midió con una regla graduada; la temperatura y humedad relativa se registró situando en el microhábitat una sonda comunicada a un termohigrómetro durante 30 segundos; finalmente la profundidad de la hojarasca se midió empleando una vara con una punta afilada de metal, la cual se enterraba en el suelo en algunos puntos aleatorios aledaños al lugar de observación del organismo y se promedió el número de hojas ensartadas en la punta de la vara.
Para el análisis de datos se tuvieron en cuenta la totalidad de las observaciones (n = 247) para cada variable, asumiendo que las variables tomadas por transecto (n = 9) influencian a los organismos también a nivel del microhábitat (sensu Urbina-Cardona et al. 2006).
Análisis de datos
Diversidad total. Es definida como el conjunto de especies registradas en el sitio de estudio y se midió como la riqueza específica obtenida por medio de dos estimadores de riqueza no paramétricos (Magurran 1988, Colwell & Coddington 1994): Jacknife de primero y segundo orden en el programa Species Diversity and Richness 3.02 (Henderson & Seaby 2002). Se utilizó el Jack1 y 2 debido a que suponen heterogeneidad en las muestras, siendo idóneos para estimar la riqueza de anuros en el área de estudio compuesta por potrero, cultivos y bosque (Magurran 2004).
Se graficaron las especies únicas (Singletons) y dobles (Doubletons) con el fin de determinar si las especies raras de anuros, se reducían a medida que el muestreo se intensificó. Con base en los valores máximos de riqueza predicha por los estimadores, se determinó el porcentaje de especies observadas que fueron capturadas durante el presente estudio (sensu representatividad, Pineda & Halffter 2003, Carvajal-Cogollo & Urbina-Cardona 2008).
Diversidad alfa. Es el número de especies de anuros en cada área (cultivo, potrero o bosque) y es medida mediante estimadores de riqueza no paramétricos. Se realizó una predicción de la riqueza especifica, como una función de la acumulación de especies (Magurran 1988, Colwell & Coddington 1994), por medio de dos estimadores Boostrap y Chao cuantitativo en el programa Species Diversity and Richness 3.02 (Henderson & Seaby 2002). Se utilizó el Chao cuantitativo debido a que supone homogeneidad de hábitat en las muestras, siendo idóneo para estimar la riqueza de anuros para cada área por separado (Magurran 2004).
La equidad se determinó a través del índice de Shannon con logaritmo natural (Magurran 2004). Este índice permite subdividir la escala de análisis en el ensamblaje y trabajar con componentes aditivos como diversidad de hábitat (Pielou 1975). Expresa la uniformidad de los valores de importancia, a través de todas las especies encontradas (Magurran 1988) y mide el grado de incertidumbre en predecir a cual especie pertenecerá un individuo de una colección (Pielou 1975, Magurran 1988), dándole más peso a las especies raras en la muestra (Brower et al. 1998). Supone que todas las especies están representadas en una muestra homogénea y que todos los individuos son muestreados al azar (una comunidad infinita, en el sentido en que, al remover muestras de ella no se generan cambios apreciables, o en el caso de muestreos con reemplazo; Pielou 1975, Magurran 1988, Zar 1999).
Para detectar diferencias significativas en la equidad entre dos áreas se usó el método de Bootstrap y el índice de Solow (1993): El Bootstrap estima los intervalos de confianza al 95% para realizar comparaciones gráficas directas entre los valores del índice de Shannon y el índice de Solow remuestrea 10000 veces la distribución en la abundancia de las especies producida por la suma de dos muestras. En el índice de Solow, la diferencia entre los índices de Shannon en dos sitios es llamada Delta y los valores observados de Delta son comparados contra la distribución de los valores de Delta generados de manera aleatoria, para determinar si el valor observado por la diferencia entre los índices de las dos muestras podrían haber sido generados al azar (Henderson & Seaby 2002).
Patrones en la abundancia. El porcentaje de similitud y las especies responsables de la variabilidad entre áreas se determinaron con el análisis SIMPER, subrutina del programa PRIMER (Clarke & Gorley 2001).
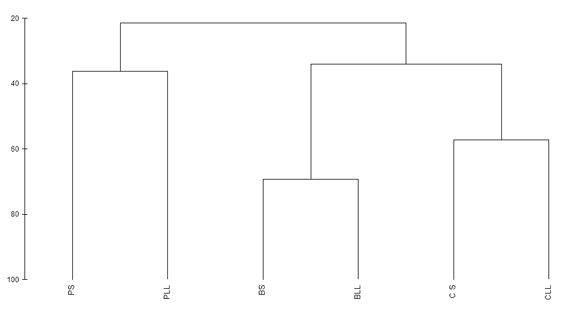
Diversidad beta. Es el grado de cambio o reemplazo en la composición de anuros entre diferentes áreas. Para evaluar la similitud cuantitativa de las especies de anuros entre tipos de hábitat se utilizó el coeficiente de Bray Curtis y se transformó la abundancia a raíz cuadrada en el programa PRIMER (Clarke & Gorley 2001). A partir de las matrices obtenidas se realizó la representación gráfica con ligamiento promedio (group-average linking en inglés). Ésta configuración de agrupamiento jerárquico es la más apropiada para identificar grupos de áreas con estructura de comunidad biótica distinta, ya que usa la contribución de las especies comunes en relación a las especies raras, sin perder información (Clarke & Gorley 2001).
Uso del microhábitat. Para la descripción del uso del microhábitat por parte de los anuros, se consideró el número de individuos de cada especie en el tipo de sustrato particular en el cual fue observado por primera vez (hojarasca, hoja, rama, tronco, suelo con sombra, suelo soleado, bajo roca, estanque, laguna, quebrada, bajo tronco, planta acuática, infraestructura humana).
Variables del microhábitat. Se usaron modelos de regresión múltiple por pasos en STATISTICA 6 (Statsoft 2000), para detectar las variables del microhábitat, relacionadas con la presencia de los anuros más comunes (abundancia total n > 5), en los microhábitats evaluados en las tres áreas (n = 247). Las variables ambientales que presentaron una prueba de F no significativa (p < 0.05) fueron eliminadas del modelo. Para cada modelo se evaluó la normalidad de los residuales de la regresión, con una prueba de Shapiro-Wilk.
RESULTADOS
Diversidad taxonómica
Al concluir 144 horas-hombre de muestreo se registró un total de 247 individuos en 16 especies de anuros, pertenecientes a 10 géneros y 6 familias. Hylidae fue la familia más representativa con ocho especies correspondientes a cuatro géneros, siendo este el 50 % del total de las especies colectadas.
Los géneros más diversos fueron Hypsiboas y Leptodactylus con tres especies cada uno; y Rhinella, Dendropsophus, Scinax con dos especies cada uno (Tabla 1).
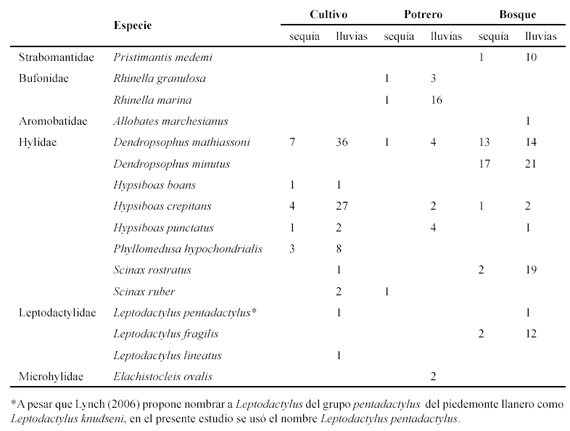
Diversidad total
Los estimadores de riqueza de Jacknife de primero y segundo orden reflejaron un número de especies muy similar al encontrado en campo, representando entre el 86% y 100% de la riqueza esperada (sensu representatividad, Urbina-Cardona et al. 2008, Carvajal-Cogollo & Urbina-Cardona 2008). El número de especies únicas se mantuvo constante a lo largo del estudio, mientras que las especies dobles se redujeron al final del muestreo (Fig. 1).
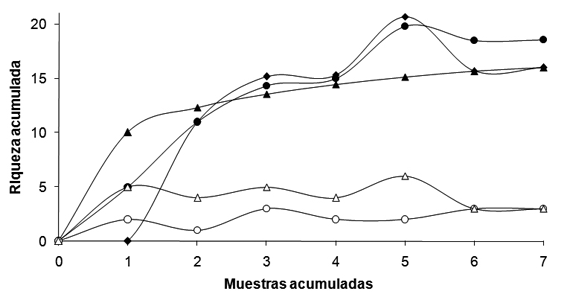
Diversidad espacio-temporal: Alfa
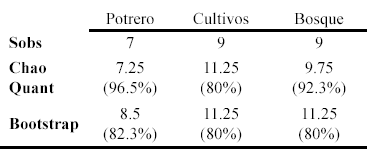
La riqueza de anuros fue mayor en bosque (9 especies) y cultivos (9 especies), seguido por el área de potrero (7 especies). Los estimadores de riqueza Chao cuantitativo y Bootstrap reflejaron un número de especies similar al reportado en campo, representando para el potrero entre el 82.3% y 96.5% de la riqueza; para los cultivos el 80% de la riqueza; y para el bosque entre el 80% y 92.3% de la riqueza (Tabla 2).
En general la riqueza de anuros tendió a aumentar en las tres áreas durante la época de lluvias (Fig. 2). La mayor riqueza se reportó en los cultivos y bosques durante la época de lluvias (9 especies para ambos) sugiriendo cierto grado de recambio en la composición de las especies.
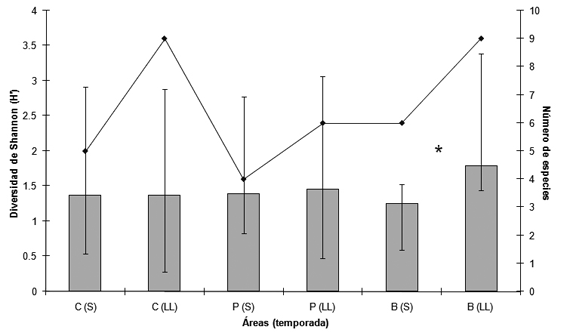
La equidad de anuros se mantuvo constante durante las temporadas de lluvias y sequía en las áreas de potrero y cultivos. En el bosque la equidad fue significativamente mayor en la época de lluvias (Delta= 0.546, p=0.0013) mostrando cierto grado de cambio en la estructura o detectabilidad de los anuros (Fig. 2).
Patrones de abundancia de especies
El análisis SIMPER detectó que D. mathiassoni contribuyó con un mayor porcentaje a la similitud (91.6%), presentando la mayor dominancia en los anuros durante la época de lluvias. En época de sequía la dominancia de D. mathiassoni disminuye, complementándose con H. crepitans e Hypsiboas punctatus (contribución a la similitud de 62.8%, 19.1% y 13.1%, respectivamente).
De manera general, el área de cultivo estuvo dominada por D. mathiassoni e H. crepitans (contribución a la similitud de 43.7% y 25%, respectivamente). El área de potrero estuvo dominada por Rhinella granulosa y Rhinella marina (contribución a la similitud de 33.3% para ambas especies). El área de cultivo estuvo dominada por Dendropsophus minutus y D. mathiassoni (contribución a la similitud de 47.2% y 36.1%, respectivamente).
Diversidad Espacio-temporal: Beta
El mayor grado de similitud, en en la anurofauna, se dio entre las temporadas de lluvias y sequía en el bosque, seguido por el recambio entre estas temporadas en los cultivos (Fig. 3). Los cultivos y el bosque presentaron una composición muy diferentes respecto al potrero, siendo éste el que presentó el mayor recambio de especies entre temporadas.
Uso del microhábitat
Los microhábitats arborícolas soportaron mayor número de especies (el haz de hojas 8 especies; ramas 7 especies) seguidos por el suelo soleado y estanques (cinco especies en ambos sustratos). Los otros cuerpos de agua presentaron el menor número de anuros (laguna una especie, quebrada ningún registro; Tabla 3).

El mayor número de individuos se registró en el haz de las hojas (microhábitat dominado por D. mathiassoni y Scinax rostratus), las ramas (siendo dominado por D. mathiassoni y H. crepitans) y las plantas acuáticas (con mayor dominancia por parte de D. minutus; Tabla 3).
Variables del microhábitat
Las variables que determinaron positivamente la presencia de Pristimantis medemi en los microhábitats evaluados fueron la distancia a cuerpos de agua y la cobertura de dosel; y negativamente la temperatura (Tabla 4).
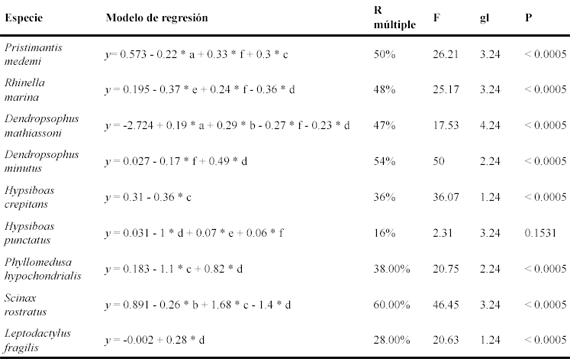
La presencia de R. marina en los microhábitats estuvo relacionada directamente con la distancia a cuerpos de agua e inversamente con la altura sobre el suelo y el espesor de la capa de hojarasca (Tabla 4).
Las variables que determinaron positivamente la presencia de D. mathiassoni en los microhábitats evaluados fueron la temperatura y la humedad relativa; y negativamente la distancia a cuerpos de agua y el espesor de la capa de hojarasca (Tabla 4).
Las variables que determinaron positivamente la presencia de D. minutus en los microhábitats evaluados fueron el espesor de la capa de hojarasca; y negativamente la distancia a cuerpos de agua (Tabla 4).
La variable que determinó negativamente la presencia de H. crepitans en los microhábitats evaluados fue la cobertura de dosel (Tabla 4).
Las variables que determinaron positivamente la presencia de Phyllomedusa hypochondrialis en los microhábitats evaluados fue el espesor de la capa de hojarasca; y negativamente la cobertura de dosel (Tabla 4).
Las variables que determinaron positivamente la presencia de S. rostratus en los microhábitats evaluados fueron la cobertura de dosel; y negativamente la humedad relativa y el espesor de la capa de hojarasca (Tabla 4).
La variable que determinó positivamente la presencia de Leptodactylus fragilis en los microhábitats evaluados fue espesor de la capa de hojarasca (Tabla 4).
DISCUSIÓN
En ambientes tropicales, la competencia entre anuros se ve mediada por la distribución de las especies en gradientes espacio-temporales en el hábitat. Esto no es más que el reflejo de la partición del hábitat que hacen las especies, tanto a nivel intra como ínterespecífico, para su coexistencia en ambientes perturbados (sensu ecotonos) con limitantes en la disponibilidad de microhábitats debido a la presencia de especies provenientes de bosques y áreas de cultivo. Se determino que los Hylidos son el grupo predominante para la region del Piedemonte y a éstos le siguen las especies de la familia Leptodactylidae que presentan modos reproductivos asociados a cuerpos de agua expuestos, pues el nido de espuma protege a las larvas contra la desecación y la predación teniendo un desarrollo larval rápido (Lynch 2006).
De las especies reportadas por Lynch (2006) para la región de Villavicencio, 32 anuros generalistas y tolerantes a las modificaciones en el hábitat (categorizados como de preocupación menor por la IUCN 2009), no fueron reportados en este estudio, probablemente porque en los hábitats muestreados no se incluyeron sabanas inundables y ambientes premontanos, lo cual podría servir como razón para la ausencia de reportes de especies que se encuentran en la transición de lluvia a sequía tales como Bufo glaberrimus y Leptodactylus fuscus (Lynch 2006). Hay que tener en cuenta que el presente estudio reporta la anurofauna de la región del piedemonte llanero del Departamento del Meta, región que está relacionada también con la herpetofauna amazónica (Allobates marchesianus) adicional a una especie (L. fragilis) que de igual forma no fue reportada por Lynch (2006). Esta región presenta un ensamblaje interesante que sería recomendable monitorear durante varios años, para ver las variaciones en la composición y las poblaciones de los anuros de anuros, teniendo en cuenta las temporadas de picos máximos y mínimos de temperatura y precipitación.
Perturbación antropogénica en relación con los anuros
Los anfibios en ambientes tropicales fragmentados responden a cambios en los gradientes ambientales y estructurales de distintas maneras. Esto puede verse reflejado no necesariamente en la abundancia o riqueza de especies, pero sí en la composición de las mismas (Carvajal-Cogollo & Urbina-Cardona 2008). Como resultado se refleja la preferencia de cada especie de acuerdo a los microhábitats disponibles, reflejando un amplio rango ecofisiológico de tolerancia dentro del ensamblaje (Urbina-Cardona & Londoño 2003, Urbina-Cardona et al. 2006).
A pesar que la riqueza en cultivos y bosques es igual (nueve especies), la composición de las mismas varía a lo largo del gradiente de hábitats. En el presente estudio se reportan algunas especies que habitan preferencialmente una de las áreas del mosaico: P. medemi, A. marchesianus, D. minutus y L. fragilis fueron exclusivamente registradas en bosque, mientras que H. boans, P. hypochondrialis y Leptodactylus lineatus fueron registradas en cultivos únicamente. De este grupo de especies registradas en el presente estudio, A. marchesianus podría estar más amenazada por la fragmentación y pérdida de hábitat, debido a sus requerimientos ecofisiológicos específicos.
Pese a las diferencias reportadas en la composición de anuros, se observaron igualmente especies comunes entre áreas: D. mathiassoni, H. crepitans e H. punctatus. Estas tres especies reflejan amplia plasticidad para tolerar los gradientes ambientales y estructurales generados por la perturbación antropogénica, mientras que R. marina y Elachistocleis ovalis pueden servir de indicadores de perturbación en los hábitats de la región. En el caso de R. marina, ésta es exitosa en sitios altamente alterados debido a sus características físicas y fisiológicas, como la piel tuberculada y gruesa que le ayuda a evitar la pérdida de agua y su toxicidad para algunos animales predadores. Adicionalmente su modo reproductivo con la postura de numerosos huevos pequeños y pigmentados, le permite absorber más calor y tener una metamorfosis rápida (2 días en promedio) protegiéndose a la vez de la radiación ultravioleta (Downie et al. 2004). De tal forma R. marina selecciona una gran variedad de sitios para la ovoposición como son las charcas efímeras en áreas abiertas o canales de riego y caños de desagüe asociados a las actividades antrópicas, pero siempre estando relacionados con la humedad del suelo (Seebacher & Alford 1999). Por su parte E. ovalis es una especie fosorial asociada a termiteros, de donde obtiene principalmente su alimento siendo un reproductor oportunista dado a que los eventos reproductivos de la especie tienen lugar después de épocas de fuertes lluvias.
Los bosques estudiados tienen un periodo considerable de regeneración (superior a los 13 años), el reducido tamaño de los fragmentos hace que se comporten como bordes, debido a que la mortalidad de árboles, el viento y la invasión de especies, provenientes de la matriz, pueden penetrar hacia el interior del bosque alterando las dinámicas internas de los fragmentos (sensu Laurance et al. 2002). La perturbación de los fragmentos se puede ver reflejada en el bosque por el aumento de poblaciones de especies generalistas (D. mathiassoni, H. crepitans, e H. punctatus), que son más comunes en sistemas productivos. De manera general, en el presente estudio no se registraron 35 especies que habían sido reportadas anteriormente para la región (Lynch 2006). Específicamente la ausencia de cuatro especies típicas de bosque en el piedemonte llanero podrían indicar que estan siendo amenazadas por los sistemas productivos asociados a la degradación del bosque remanente debido a la distribución geográfica restringida y fragmentada de las especies y por su grado de declive poblacional: Pristimantis frater (Vulnerable; Castro et al. 2004), Pristimantis savagei (Casi Amenazada; Ramírez-Pinilla et al. 2004), Allobates juani (Críticamente amenazada; Acosta-Galvis & Rueda 2004) y Allobates ranoides (Amenazada; Acosta-Galvis et al. 2004).
La perturbación antrópica que se ha dado sobre los bosques muestreados puede haber ocasionado un cambio en la cobertura vegetal, que a su vez, ha alterado la composición de especies de anfibios debido a la relación entre las especies estudiadas y la cobertura de dosel y el espesor de hojarasca (ver Tabla 4). Esta razón puede ser quizá la explicación del por qué se reportó una baja riqueza de especies del género Pristimantis las cuales son típicas de ambientes neotropicales y aunque muestran mayor abundancia en altitudes superiores a los 2000 msnm (Lynch & Rueda-Almonacid 1997), se ha demostrado que habitan ambientes con baja perturbación antropogénica (Vargas & Bolaños 1999, Vargas & Castro 1999, Arroyo et al. 2003, Urbina-Cardona & Londoño 2003, Gutiérrez-Lamus et al. 2004, Herrera-Montes et al. 2004, Suárez-Badillo & Ramírez-Pinilla 2004, García-R. et al. 2005, Urbina-Cardona et al. 2006, Bernal & Lynch 2008, Cortés et al. 2008). Así mismo las especies de este género depositan sus huevos sobre la hojarasca y requieren por tanto de ambientes con elevada humedad relativa. En el Piedemonte los períodos de lluvias y sequías son muy marcados, y pese a que en la época de lluvias se da un incremento en el volumen de agua, en la época seca la humedad relativa es baja incluso dentro de ambientes boscosos. Esto puede explicar el por qué, en esa zona en general, la diversidad de Pristimantis es notablemente reducida dado a su desarrollo directo, y el por qué predominan especies que tienen un ciclo de vida con modos reproductivos generalistas, adaptados a lugares en los que los períodos de sequía son prolongados.
En el caso del Jardín Botánico de Villavicencio, se observa que pese a ser el fragmento de bosque de mayor tamaño (47 ha), el hombre aún ejerce una presión fuerte sobre el ecosistema, debido a las actividades que desarrolla en éste (cacería y zona de paso entre los barrios circundantes), afectando así la presencia de especies con requerimientos ecológicos más específicos. Esto sugiere que los bosques muestreados, pese a su tiempo de regeneración, no logran un tamaño que les permita amortizar el efecto de borde y la perturbación causada por las actividades del hombre, teniendo un hábitat de calidad para las especies propias de interior de bosque (sensu Urbina-Cardona et al. 2006), en el cual se esperarían ambientes más propicios para la supervivencia de las especies con requerimientos de microhábitat más específicos.
Dinámica espacio-temporal de los anuros y modos reproductivos
En las épocas de lluvias se observó una mayor abundancia de especies para las tres áreas muestreadas. La mayor abundancia la poseen especies con modos reproductivos asociados a estanques, charcos y lagunas (e.g. R. marina, D. mathiassoni, D. minutus, H. crepitans y S. rostratus), mientras que solo el 19% de las especies (P. medemi, P. hypochondrialis, L. fragilis y A. marchesianus) tuvieron relación con el hábitat terrestre para su reproducción. Sin embargo, a través de los análisis se detectó que la distribución de P. medemi se ve influenciada por la cercanía a cuerpos de agua (ver Tabla 4), a pesar de que en su modo reproductivo de desarrollo directo carecen de presencia de larvas acuáticas. Esta relación indirecta de algunas especies de Pristimantis con los cuerpos de agua para la reproducción ha sido reportada anteriormente (Urbina-Cardona 2008b) y demuestra como este grupo de especies utiliza combinaciones únicas pero complejas de las variables del microhábitat, basado en los valores de tolerancia de cada especie a las características ambientales y estructurales (Urbina-Cardona y Pérez-Torres 2002).
La presencia de individuos en el microhabitat, se relaciona con el modo reproductivo que cada especie posee y en el caso de la anurofauna regiustrada, los modos reproductivos se encuentran ligados estrechamente a cursos de agua (Crump 2003, Haddad & Prado 2005, da Silva et al. 2008). Las especies con la mayor abundancia D. mathiasson, H. crepitans, D. minutus y R. marina (22%, 12.5%, 8.5% y 6.5% del total de individuos registrados, respectivamente), presentan una actividad reproductiva asociada al inicio de la temporada de lluvias. En estas especies tanto los huevos como los renacuajos, son dependientes del agua para su desarrollo e incluso en su estadío adulto conservan una estrecha relación con los cursos de agua, al no encontrarse muy alejados de los mismos (Haddad & Prado 2005, da Silva et al. 2008).
En el presente estudio se determinó que la humedad relativa es la variable que influencia la distribución del 44% de los anuros en los microhábitats del mosaico de hábitats en el piedemonte llanero, seguida por la distancia a cuerpos de agua y la cobertura de dosel, las cuales influencian la distribución del 31% y 25% de las especies respectivamente. Dada la estrecha relación entre el modo reproductivo de las especies de tierras bajas y la cercanía al agua, es probable que en época seca, los anuros de potrero se desplacen a los cultivos (H. crepitans, H. punctatus, D. mathiassoni y S. ruber) en busca de microhábitats más húmedos y por ende menos expuestos a las elevadas temperaturas que se pueden dar en esta época (ver Tabla 1). Así mismo, otras especies pueden optar por enterrarse, en época de sequía, como método de protección a la desecación (E. ovalis). Esto se explica con el caso específico de D. mathiassoni que, a pesar de ser generalista, cambia abruptamente su abundancia entre lluvias y sequía, en potreros y cultivos, mientras que en el bosque permanece constante pese a tener mayor competencia inter-específica, por ser menos dominante en el ensamblaje de esta área.
R. marina y R. granulosa se registraron únicamente en potreros con una mayor abundancia en época de lluvias, sin embargo, su presencia exclusiva en estos potreros e igualmente en época seca, se desconoce, por lo cual se hace necesario realizar investigaciones enfocadas hacia el conocimiento etológico de las especies, de acuerdo a las épocas de lluvias y sequía. A partir de este estudio se demuestra estadísticamente que R. marina prefiere microhábitats cercanos a los cuerpos de agua y con poco espesor de la capa de hojarasca (ver Tabla 4). En la medida que se conozca la ecofisiología, el ámbito hogareño y la dispersión de especies, como R. marina, se podrá entender mejor los factores que hacen que esta especie sea una invasora eficiente en ambientes fuera de su área nativa y se podrá predecir mejor la tendencia de ésta especie a colonizar ambientes montanos en el Neotrópico, en escenarios de cambio climático.
En el análisis de similitud de la anurofauna se encontró que las áreas muestreadas forman dos grupos claros: potreros y cultivo - bosque. Esta diferencia puede estar asociada a la relación entre la estructura vegetal y las variables ambientales del microhábitat, en el cual la cobertura de dosel genera una gruesa capa de hojarasca en el suelo y ambientes con temperaturas más estables y bajas en el bosque. De esta manera la heterogeneidad vegetal ayuda a reducir la desecación de los organismos, genera mayor diversidad de microhábitats y por tanto aumenta la capacidad de albergar a un mayor número de especies y de individuos en el hábitat donde puedan coexistir, debido a la partición espacio-temporal que las mismas hacen del ambiente (Crump 1982).
En la única área muestreada donde la equidad varió entre la época de lluvia y sequía es el bosque debido a que el cambio en las dominancias es abrupta entre las temporadas, presentándose dos especies abundantes en sequía (D. mathiassoni y D. minutus) y cuatro en lluvias (P. medemi, D. mathiassoni, D. minutus y L. fragilis). Esto se relaciona con el microclima del bosque, para el cual es más estable y los cambios de humedad entre las épocas son amortizados por la presencia del dosel y de la capa de hojarasca en el suelo (Urbina-Cardona et al. 2006), a diferencia de potreros y cultivos que son ambientes con una estructura vegetal menos compleja, dejando expuestos a los organismos ante los cambios en la temperatura (Urbina-Cardona & Londoño 2003) que se presentan entre las temporadas de lluvias y sequía.
CONCLUSIONES
En el piedemonte llanero del departamento del Meta, la abundancia y riqueza de anuros tiende a aumentar durante la época de lluvias, mientras que la equidad de anuros aumenta solamente en el bosque durante las lluvias. Los anuros dominantes varían para cada área siendo D. mathiassoni predominante en cultivos; R. granulosa y R. marina predominantes en potrero; y D. minutus predominante en bosque. Estas son evidencias contundentes del recambio espacio-temporal de anuros en hábitats con diferente grado de perturbación antropogénica.
A pesar de que los microhábitats arborícolas, como las hojas y las ramas, presentaron mayor riqueza de especies (56% del total de anuros), las variables del microhábitat en covarianza con la estructura vegetal son las que determinan el uso que potencialmente puedan hacer los anuros de los sustratos disponibles, dependiendo de sus requerimientos ecofisiológicos y sus rangos de tolerancia.
Estudios detallados y sistemáticos del uso del microhábitat por parte de los anuros y de las variables que determinan su presencia en los sustratos son muy necesarios en el país, ya que aportan herramientas robustas para entender la plasticidad de las especies (Urbina-Cardona & Pérez-Torres 2002) y su respuesta a los gradientes de perturbación antropogénica. Es importante mantener, en los bosques remanentes del piedemonte llanero del departamento del Meta, cuerpos de agua con alta cobertura de dosel que permitan mantener una capa de hojarasca en el suelo y con temperaturas bajas y poco fluctuantes.
En el presente estudio se reportan cuatro anuros (P. medemi, A. marchesianus, D. minutus y L. fragilis) que pueden ser vulnerables al efecto deletéreo de los sistemas productivos sobre los hábitats naturales del piedemonte llanero y pueden llegar a desaparecer de la región, si la calidad del hábitat se ve afectada por la perturbación antropogénica. Dado que la mayoría de la vegetación natural de Colombia se encuentra altamente fragmentada (Etter et al. 2006) es prioritario profundizar en una línea de investigación sobre las respuestas de los anfibios a los efectos de la pérdida y fragmentación del hábitat, sus consecuencias (e.g. efectos de borde y de matriz) y los efectos cascada a nivel del microhabitat (sensu Urbina-Cardona et al. 2006).
AGRADECIMIENTOS
Expresamos nuestros agradecimientos a A.A. Velásquez-Álvarez, P. Isaacs y F. Cantillo-Rodríguez por los comentarios realizados a la versión preliminar del presente trabajo. N. Andrade y N. Cáceres quienes financiaron la presente investigación. N. Arango y M. Crump por la orientación y aportes que enriquecieron ésta investigación desde su inicio. A. Acosta-Galvis por la identificación de las especies de anuros. Igualmente agradecemos a aquellas personas que permitieron la realización del trabajo de campo, en especial a L.S. González y M. Avellaneda por su colaboración, hospedaje y compañía durante este tiempo. A M. Andrade por su valioso apoyo, colaboración, comentarios y aportes a lo largo de la elaboración del trabajo.
Literatura citada
1. ACOSTA, A.R. 2008. Lista de los Anfibios de Colombia. [en línea]. (versión octubre 2008). Unidad de Ecología y Sistemática UNESIS, Museo Javeriano de Historia Natural Lorenzo Uribe S.J. Facultad de Ciencias, Pontificia Universidad Javeriana. Bogotá, Colombia. [Consulta: 19 diciembre 2008]. <http://www.javeriana.edu.co/Facultades/Ciencias/unesis/secciones/herpetologia/pages/Lista%20de%20los%20anfibios%20de%20Colombia.htm > [ Links ]
2. ACOSTA-GALVIS, A. & J.V. RUEDA. 2004. Allobates juanii. In: IUCN 2008. 2008 IUCN Red List of Threatened Species. <www.iucnredlist.org>. 6 de abril de 2009. [ Links ]
3. ACOSTA-GALVIS, A., J.V. RUEDA & F. CASTRO. 2004. Allobates ranoides. In: IUCN 2008. 2008 IUCN Red List of Threatened Species. <www.iucnredlist.org>. 6 de abril de 2009. [ Links ]
4. ANGULO, A., J.V. RUEDA-ALMONACID, J.V. RODRÍGUEZ-MAHECHA & E. LA MARCA (Eds). 2006. Técnicas de inventario y monitoreo para los anfibios de la región tropical andina. Conservación Internacional. Serie Manuales de Campo Nº 2. Panamericana Formas e Impresos S.A., Bogotá D.C. [ Links ]
5. ARROYO, S., A. JEREZ & M.A. RAMÍREZ-PINILLA. 2003. Anuros de un Bosque de Niebla de la Cordillera Oriental de Colombia. Caldasia 25(1): 153-167. [ Links ]
6. BECKER, C.G., C.R. FONSECA, C.F.B. HADDAD, R.F. BATISTA & P.I. PRADO. 2007. Habitat Split and the Global Decline of Amphibians. Science 318: 1775-1777.7 [ Links ]
7. BERNAL, M.H. & J.D. LYNCH. 2008. Review and Analysis of Altitudinal Distribution of the Andean Anurans in Colombia. Zootaxa 1826: 1-25. [ Links ]
8. BROWER, J., J. ZAR & C. VON ENDE. 1998. Field and Laboratory Methods for General Ecology. 4th edition. WCB/McGraw-Hill. [ Links ]
9. CABILDO VERDE. 1999. Proyecto: Pautas para el fortalecimiento y desarrollo de una cultura ecológica de los habitantes de Restrepo basados en lo modelos de lo agroecosistemas múltiples implementados en el municipio. Informe Final. Primera Etapa. [ Links ]
10. CARVAJAL-COGOLLO, J.E. & J.N. URBINA-CARDONA. 2008. Patrones de Diversidad y Composición de Reptiles en Fragmentos de Bosque Seco Tropical en Córdoba, Colombia. Tropical Conservation Science 1(4): 397-416. < http://tropicalconservationscience.mongabay.com/content/v1/08-12-01-Carvajal-Cogollo_and_Urbina-Cardona_397-416.pdf > [ Links ]
11. CASTRO, F., M.I. HERRERA & J.V. RUEDA. 2004. Pristimantis frater. En: IUCN 2008. 2008 IUCN Red List of Threatened Species. <www.iucnredlist.org>. 6 de abril de 2009. [ Links ]
12. CLARKE, K.R. & R.N. GORLEY. 2001. PRIMER User Manual: Plymouth Routines in Multivariate Ecological Research. Plymouth Marine Laboratory, Plymouth. [ Links ]
13. COLWELL, R. & J. CODDINGTON. 1994. Estimating Terrstrial Biodiversity through Extrapolation. Philosophical Transaction: Biological Science 344: 101-108. [ Links ]
14. CORTÉS, A., M.P. RAMÍREZ-PINILLA, H.A. SUÁREZ & E. TOVAR. 2008. Edge effects on richness, abundance and diversity of frogs in Andean cloud forest fragments. South American Journal of Herpetology 3: 213-222. [ Links ]
15. CRUMP, M.L. 1971. Quantitative Analysis of the Ecological Distribution of a Topical Herpetofauna. Ocas. Pap. Mus. Nat. Hist. Univ. Kansas 3: 1-63. [ Links ]
16. CRUMP, M.L. 1974. Reproductive strategies in a Tropical Anuran Community. Mus. Nat. Hist. Univ. Kansas Miscellaneous Publication No. 61. Lawrence. [ Links ]
17. CRUMP, M.L. 1982. Amphibian Reproductive Ecology in the Community Level. En: Scott Jr., N.J. (ed). Herpetofaunal Communities: A Symposium of the Study of Amphibians and Reptiles and the Herpetologist League. Widlife Reserch Report 13. Washington, D.C. Pp. 26-31. [ Links ]
18. CRUMP, M.L. & N.J. SCOTT. 1994. Visual Encuonter Surveys. En: W.M. Heyer, A. Donnelly, R.A. McDiarmid, L.C. Hayec & M.C. Foster (eds). Measuring and Monitoring Biological Diversity. Standard Method for Amphibians. Smithsonian Institution Press, Washington, D.C. 364p. [ Links ]
19. CRUMP, M.L. 2003. Conservation of amphibians in the New World tropics. In: Semlitsch, R.D. (edt.) Amphibian Conservation. Smithsonian Institution. Pp. 53-69. [ Links ]
20. DA SILVA W., G. GOMES & C. ARZABE. 2008. Diversity of reproductive modes in anurans communities in Caatinga (dryland) of northeastern Brazil. Biodiversity Conservation. 18: 55-66. [ Links ]
21. DOWNIE, J.R., R. BRYCE & J. SMITH. 2004. Metamorphic duration: an under-studied variable in frog life histories. Biological Journal of the Linnean Society 83: 261-272. [ Links ]
22. DUELLMAN, W.E. & L. TRUEB. 1986. Biology of Amphibians. McGraw Hill. Nueva York. [ Links ]
23. DUELLMAN, W.E. 1992. Estrategias Reproductoras de las Ranas. Investigación y Ciencia. 54-61. [ Links ]
24. DUELLMAN, W.E. 1999. Distribution Patterns of Amphibian in South America. En: W.E. Duellman (ed). Patterns of Distribution of Amphibians : A global perspective. The Johns Hopkins University Press. Baltimore y Londres. [ Links ]
25. ETTER, A., C. MCALPINE, D. PULLARD & H. POSSINGHAM. 2006. Modeling the conversion of Colombian lowland ecosystems since 1940: Drivers, patterns and rates. Journal of Environmental Management 79: 74-87. [ Links ]
26. ETTER, A., C. MCALPINE & H. POSSINGHAM. 2008. Historical Patterns and Drivers of Landscape Change in Colombia Since 1500: A Regionalized Spatial Approach. Annals of the American Association of Geographers 98: 2-23. [ Links ]
27. GALVIS, G., J.I. MOJICA & F. RODRÍGUEZ. 1989. Estudio ecológico de una laguna de desborde del Río Meta. Fondo FEN Colombia. Universidad Nacional de Colombia. Primera Ed. 164p. [ Links ]
28. GARCÍA-R., J.C., F. CASTRO-H. & H. CÁRDENAS-H. 2005. Relación Entre la Distribución de Anuros y Variables del Hábitat en el Sector La Romelia del Parque Nacional Natural Munchique (Cauca, Colombia). Caldasia 27(2): 299-310. [ Links ]
29. GONZÁLES, E., G. GUILLOT, N. MIRANDA & D. POMBO. 1989. Perfil Ambiental de Colombia. Impresión. Bogotá. [ Links ]
30. GUTIERREZ-LAMUS, D.L., V.H. SERRANO & M-P. RAMÍREZ-PINILLA. 2004. Composición y Abundancia de Anuros en Dos Tipos de Bosque (Natural y Cultivado) en la Cordillera Oriental Colombiana. Caldasia 26(1): 245-264. [ Links ]
31. HADDAD, C.F.B. & C.P.A. PRADO. 2005. Reproductive Modes in Frogs and their unexpected Diversity in the Atlantic Forest. BioScience 55(3): 207. [ Links ]
32. HENDERSON, P.A. & R.M. SEABY. 2002. Species Diversity and Richness Version 3.02. Pisces Conservation Ltd., Lymington. [ Links ]
33. HERRERA-MONTES, A., L.A. OLAYA-M & F. CASTRO-H. 2004. Incidencia de la perturbación antrópica en la diversidad, la riqueza y la distribución de Eleutherodactylus (Anura: Leptodactylidae) en un bosque nublado del suroccidente colombiano. Caldasia 26(1): 265-274. [ Links ]
34. IGAC, INDERENA, CONIF. 1984. Bosques de Colombia. Memoria Explicativa. Bogotá, D.C. [ Links ]
35. IGAC. 1991. Meta: Características geográficas. Bogotá, D.C. [ Links ]
36. IUCN. 2009. IUCN Red List of Threatened Species. Version 2009.1 <http://www.iucnredlist.org>. 29 de mayo de 2009. [ Links ]
37. KREBS, C.J. 2001. Ecology: The experimental analysis of distribution and abundance. 5th ed. Benjamin Cummings Publishers. California. [ Links ]
38. LÓPEZ-RAMOS. E. 2004. Aspectos Más Relevantes de la Geomorfología y Geología. Instituto Colombiano de Geología y Minería INGEOMINAS. 23 pp. Bogotá. [ Links ]
39. LAURANCE, W.F., T.E., LOVEJOY, H.L., VASCONCELOS, E.M., BRUNA, R.K., DIDHAM, P.C., STOUFFER, C., GASCON, R.O., BIERREGAARD, S.G. LAURANCE & E., SAMPAIO. 2002. Ecosystem Decay of Amazonian Forest Fragments: a 22-Year Investigation. Conservation Biology 16(3): 605-618. [ Links ]
40. LYNCH, J.D., P.M. RUÍZ-CARRANZA & M.C. ARDILA-ROBAYO. 1997. Biogeographic Patterns of Colombian Frogs and Toads. Revs. Acad. Colomb. Cienc. 21(80): 237-248. [ Links ]
41. LYNCH, J.D. & J.V. RUEDA-ALMONACID. 1997. Three new frogs (Eleutherodactylus:Leptodactylidae) from cloud forest in eastern Departamento Caldas, Colombia. Revista Acad. Colomb. Cienc. 21: 131-142. [ Links ]
42. LYNCH, J.D. 2006. The Amphibian Fauna in the Villavicencio Region of Eastern Colombia. Caldasia 28(1): 135-155. [ Links ]
43. LIPS, K.R. & M.A. DONNELLY. 2005. Lessons from the Tropics. In: Amphibian Declines: The conservation status of United States Species. Lanoo, M. (ed.). University of California Press. [ Links ]
44. MAGNUSSON W. & J-M. HERO. 1991. Predation and the Evolution of Complex Oviposition Behaviour in Amazon Rainforest Frogs. Oecologia 86(3): 310-318. [ Links ]
45. MAGURRAN, A. 1988. Diversidad Ecológica y su Medición. Primera edición. Ediciones Vedra. Barcelona. [ Links ]
46. MAGURRAN, A. 2004. Measuring biological diversity. Blackwell Publishing. [ Links ]
47. MARTÍNEZ-S., G. 1991. Marginalidad en el crecimiento urbano de la ciudad de Villavicencio. Tesis (Magister en Ciencias Geográficas). Universidad Pedagógica. Bogotá, D.C. 129 p. [ Links ]
48. ORDUZ-QUIJANO, O. 1998. Diagnóstico Agropecuario Municipal, Zona Rural, Restrepo, Meta. Tesis de Grado. Universidad del Llano, Villavicencio. [ Links ]
49. PIELOU, E.C. 1975. Ecological Diversity. Wiley-Interscience Publication. [ Links ]
50. PINEDA, E. & G. HALFFTER. 2003. Species Diversity and Habitat Fragmentation: Frogs in a Tropical Montane Landscape in Mexico. Biological Conservation 117: 499-508. [ Links ]
51. RAMÍREZ-PINILLA, M.P., M. OSORNO-MUÑOZ, J.V. RUEDA, A. AMÉZQUITA, M.C. ARDILA-ROBAYO. 2004. Pristimantis savagei. En: IUCN 2008. 2008 IUCN Red List of Threatened Species. <www.iucnredlist.org>. 6 de abril de 2009. [ Links ]
52. RANGEL-CH., J.O., P.D. LOWY & M. AGUILAR. 1997. Colombia. Diversidad Biótica II. Tipos de vegetación en Colombia. Ed. Guadalupe Ltda. Universidad Nacional de Colombia. Bogotá. [ Links ]
53. SEEBACHER, F. & R.A. ALFORD. Movement and microhabitat use of terrestrial amphibian (Bufo marinus) on a tropical island: Seasonal variation and environmental correlates. Journal of Herpetology 33(2): 208-214. [ Links ]
54. SOLOW, A.R. 1993. A simple test for change in community structure. Journal of Animal Ecology 62: 191-193. [ Links ]
55. STATSOFT. 2001. STATISTICA: Data Analysis Software System, Version 6.0. StatSoft, Oklahoma. [ Links ]
56. SUÁREZ-BADILLO, H.A. & M.A., RAMÍREZ-PINILLA. 2004. Anuros del Gradiente Altitudinal de la Estación Experimetal y Demostrativa el Rasgón (Santander, Colombia). Caldasia 26(2): 395-416. [ Links ]
57. SUTHERLAND, W.S. 1996. Ecological Census Techniques : A Handbook. Cambridge University Press. [ Links ]
58. URBINA-CARDONA, J.N. & J. PÉREZ-TORRES. 2002. Dinámica y preferencias de microhábitat en dos especies del género Eleutherodactylus (Anura: Leptodactylidae) de Bosque Andino. En: C.A. Jaramillo, C. Castaño-Uribe, F.A. Hincapie, J.V. Rodriguez & C.L. Duran (eds.). Libro del Congreso Mundial de Páramos. Tomo I. Pp. 278-288. [ Links ]
59. URBINA-CARDONA, J.N. & M.C. LONDOÑO. 2003. Distribución de la comunidad de herpetofauna asociada a cuatro áreas con diferente grado de perturbación en la Isla Gorgona, Pacífico colombiano. Revista Acad. Colomb. Cienc. 27(102): 105-113. [ Links ]
60. URBINA-CARDONA, J.N & V.H. REYNOSO. 2005. Recambio de anfibios y reptiles en el gradiente potrero-borde-interior en la Reserva de Los Tuxtlas, Veracruz, México. Capítulo 15. En: G. Halffter, J. Soberón, P. Koleff & A. Melic (eds.) Sobre Diversidad Biológica: El significado de las Diversidades Alfa, Beta y Gamma. CONABIO, SEA, DIVERSITAS & CONACyT. Volumen 4. Editorial Monografías Tercer Milenio, Zaragoza, España. Pp.191-207. [ Links ]
61. URBINA-CARDONA, J.N., M. OLIVARES-PÉREZ & V.H. REYNOSO. 2006. Herpetofauna diversity and microenvironment correlates across the pasture-edge-interior gradient in tropical rainforest fragments in the region of Los Tuxtlas, Veracruz. Biological Conservation 132: 61-75. [ Links ]
62. URBINA-CARDONA, J.N. 2008a. Conservation of Neotropical Herpetofauna: Research Trends and Challenges. Tropical Conservation Science 1(4): 359-375. < http://tropicalconservationscience.mongabay.com/content/v1/08-12-01-Urbina-Cardona_359-375.pdf > [ Links ]
63. URBINA-CARDONA, J.N. 2008b. Craugastor berkenbuschii (Berkenbusch`s Robber Frog). Microhabitat use. Herpetological Review 39(2): 206. [ Links ]
64. URBINA-CARDONA, J.N., M.C. LONDOÑO-MURCIA & D.G. GARCÍA-ÁVILA. 2008. Dinámica Espacio-Temporal en la Diversidad de Serpientes en Cuatro Hábitats con Diferente Grado de Alteración Antropogénica en el Parque Nacional Natural Isla Gorgona, Pacífico Colombiano. Caldasia 30(2): 479-493. [ Links ]
65. VARGAS-S., F. & M.E. BOLAÑOS. 1999. Anfibios y Reptiles Presentes en Hábitats Perturbados de Selva Lluviosa Topical en el Bajo Anchicayá, Pacífico Colombiano. Rev. Acad. Colomb. Cienc. Suplemento Especial. 23: 499-511. [ Links ]
66. VARGAS-S., F. & F. CASTRO-H. 1999. Distribución y Preferencias de Microhábitat en Anuros (Amphibia) en Bosques Maduros y Áreas Perturbadas en Anchicayá, Pacífico Colombiano. Caldasia 21(1): 95-109. [ Links ]
67. YOUNG, B.E., S.N. STUART, J.S. CHANSON, N.A. COX & T.M. BOUCHER. 2004. Joyas que están desapareciendo: El estado de los anfibios en el Nuevo Mundo. NatureServe, Arlington, Virginia. 60 p. <http://www.natureserve.org/publications/joyas_desapareciendo.pdf > [ Links ]
68. ZAR, J.H. 1999. Biostatistical Analisis. 3ra Ed. Prentice Hall. [ Links ]
69. ZUG, G.R., L.J. VITT & J.P. CALDWELL. 2001. Herpetology: An Introductory Biology of Amphibians and Reptiles. 2th ed. Academic press. California. [ Links ]
Recibido: 06/01/2009
Aceptado: 05/05/2009














