Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.31 no.2 Bogotá July/Dec. 2009
Phylogenetic and biogeographic analysis of species the genus Bryconamericus (Characiformes, Characidae) from lower Central America
CÉSAR ROMÁN-VALENCIA
JAMES A. VANEGAS-RÍOS
Universidad del Quindío, Laboratorio de Ictiología, Apartado 2639, Armenia, Quindío, Colombia. ceroman@uniquindio.edu.co; anyelovr@gmail.com
RESUMEN
Se presenta una hipótesis preliminar de monofilia para las especies de Bryconamericus de la baja América Central, basada en caracteres moleculares de ADNmt, que resulta en el siguiente arreglo de relaciones filogenéticas: (B. emperador (B. gonzalezoi (B. bayano, (B. terrabensis, B. scleroparius)))). Esta hipótesis es preliminar en el contexto filogenético del género, sin embargo, aumenta la probabilidad de que este grupo se constituya en un grupo natural. Se halla concordancia entre la hipótesis de relaciones presentada para las especies de Bryconamericus analizadas aquí y los hallazgos con base en caracteres morfológicos. A través de biogeografia cladística, cladogramas de áreas, cladogramas resueltos de áreas y Análisis de Dispersión-Vicarianza (DIVA) se comprueba que la hipótesis biogeográfica para las especies de Bryconamericus está relacionada con un proceso de dispersión desde el noroeste de América del Sur, que permitió colonizar la baja Centroamérica. Simultáneamente ocurrieron extinciones, y como producto de la reorganización geológica y aislamiento geográfico de las poblaciones, aparece la vicarianza.
Palabras clave. Biogeografía, Characidae, sistemática molecular, Bryconamericus, peces dulceacuícolas
ABSTRACT
A preliminary hypothesis for the monophyly of Bryconamericus species from lower Central America is presented based on an analysis of molecular characters (mtDNA) that results in the following phylogenetic relationships: (B. emperador (B. gonzalezoi (B. bayano, (B. terrabensis, B. scleroparius)))). This hypothesis is a step towards understanding the phylogenetic relationships within the genus, increasing the probability of Bryconamericus being a natural group. The hypothesis of relationships among the analyzed species is congruent with our findings based on morphological characters. Through cladistic biogeography, area cladograms, resolved area cladograms, and Dispersal-Vicariance Analysis (DIVA), the biogeographic hypothesis for species of Bryconamericus is shown to be related to a process of dispersal from Northwestern South America that allowed colonization of lower Central America. Simultaneously, extinction events occurred, and geologic rearrangements caused geographic isolation of populations and vicariance.
Key words. Biogeography, Characidae, molecular systematics, freshwater fish.
Recibido: 16/03/2009
Aceptado: 15/10/2009
El género Bryconamericus Eigenmann comprende cerca de 70 especies (Román-Valencia et al. 2008a). Las especies son de tamaño variable (adultos entre 20 mm y 120 mm de longitud estándar: Román-Valencia et al. 2008a, Román-Valencia et al. 2009), distribuidas desde la baja América Central hasta el oeste de Argentina (Lima et al. 2003, Langeani et al. 2005, Román-Valencia et al. 2008a, Román-Valencia et al. 2008b, Román-Valencia et al. 2009) en una variedad de ecosistemas dulceacuícolas de las partes bajas y altas de los rios, en ambos lados de la Cordillera de los Andes (Vari & Siebert 1990, Román-Valencia 2002).
En la más reciente revisión hecha para las especies de Bryconamericus de países bajos de América Central, se registran cinco especies válidas: B. bayano (Fink), B. emperador Eigenmann & Ogle, B. gonzalezoi Román-Valencia, B. scleroparius (Regan) y B. terrabensis Regan (Román-Valencia 2002). Román-Valencia (2000, 2002) efectúa un análisis de las especies de Bryconamericus de América Central y del Sur; además, plantea que los procesos de especiación en las especies de Bryconamericus son más evidentes y conservadores en su ADNmt. Existen algunos trabajos, donde se plantea que el género no constituye una entidad natural (Malabarba & Malabarba 1994, Silva & Malabarba 1996, Malabarba & Weitzman 2003, Silva 2004). Estos autores no realizan un análisis filogenético para apoyar sus afirmaciones y mucho menos para abordar parte del problema del grupo.
Con respecto al estado filogenético de Bryconamericus, no existe acuerdo sobre su monofilia. Ha sido incluido en diversos estudios filogenéticos: Lucena (1993) reporta a Bryconamericus dentro de una gran politomía relacionada con Hemibrycon, pero sin ningún sustento de su monofilia; Malabarba & Weitzman (2003) ubican a Bryconamericus como miembro de un grupo no resuelto denominado clado A, el cual es soportado por dos sinapomorfías (cuatro dientes en la hilera interna del premaxilar y dos radios simples y ocho ramificados en la aleta dorsal); Calcagnotto et al. (2005) soportan la monofilia para el clado Bryconamericus, Knodus, Creagrutus Günther y Hemibrycon; Vanegas-Ríos et al. (Manuscrito) encuentran un clado para las especies de Bryconamericus de la baja América Central y su relación con las especies del noroeste de América del Sur, con caracteres morfológicos; se observó gran afinidad filogenética de Bryconamericus con géneros como Hemibrycon y Creagrutus. Aunque el conocimiento filogenetico que se tiene sobre Bryconamericus es aun incipiente, desde la evidencia morfológica se ha podido demostrar la monofilia de varios grandes grupos de especies de Bryconamericus de América Central y de América del Sur (Vanegas-Ríos et al. manuscrito, Vanegas & Román-Valencia, datos no publicados).
Reeves & Bermingham (2006) efectuaron un análisis filogeográfico, entre otras, de las supuestas especies de Bryconamericus de la baja América Central, pero sus cladogramas están interpretados erróneamente, se basaron en una taxonomía del grupo desactualizada, por lo tanto sus datos e información usados no produjeron adelantos sobre el conocimiento filogenético y biogeográfíco de los Bryconamericus centroamericanos. En concordancia con los hallazgos descritos por Román-Valencia (2000, 2002) y Vanegas-Ríos et al. (Manuscrito) el propósito de este artículo es efectuar un análisis filogenético y biogeográfico para las especies válidas del género Bryconamericus de la baja América Central, con caracteres moleculares y sobre la base de la hipótesis de monofilia y taxonomía (Román-Valencia 2002, Vanegas-Ríos et al. Manuscrito) que se tiene para el grupo en la región de estudio. Secundariamente, se pretende reorientar y corregir la nomenclatura, taxonomía y biogeografía presentada por Reeves & Bermingham (2006).
MATERIALES Y MÉTODOS
Filogenia. Se utilizó información obtenida en el banco de genes de la NCBI (http://www.ncbi.nlm.nih.gov; parcialmente anali-zada por Reeves & Bermingham 2006) sobre las especies válidas (sensu Román-Valencia 2002): B. bayano (incorrecto como Eretmobrycon bayano Fink en el NCBI), B. emperador, B. gonzalezoi (erroneo como B. ricae (Hildebrand) en el NCBI), B. scleroparius y B. terrabensis. Para tener certeza que las secuencias que aparecían en el banco de genes correspondían correctamente con cada una de las especies de Bryconamericus de la baja América Central, se hizo una búsqueda de los nombres científicos de estas especies identificándose concordancias entre el número de catálogo de STRI (Smithsonian Tropical Research Institute) que tiene cada secuencia, con el respectivo número de catalogo usado en el material examinado en la revisión más reciente del grupo (Román-Valencia, 2002); estas especies correspondieron con el grupo de estudio (grupo interno). A su vez fue consultada la información de tres géneros externos con respecto a Bryconamericus (Astyanax mexicanus De Filippi, Brycon meeki Eigenmann & Hildebrand y Roeboides dayi Steindachner), basados en Lucena (1993), Calcagnotto et al. (2005) y Weitzman et al. (2005). Las secuencias utilizadas correspondieron a dos genes de ADNmt secuenciados completamente (subunidades 6 y 8 de la ATP sintetasa). Las referencias de los datos moleculares y el número de nucleótidos se consignaron en la tabla 1.
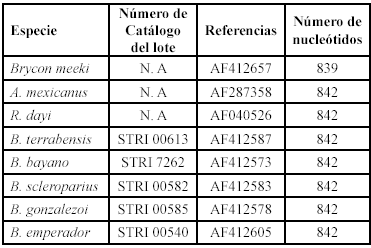
Se hizo un análisis filogenético como sigue: 1) se realizó un alineamiento de las secuencias en el programa Clustal X 1.81 (Thompson et al. 1997). Allí se siguieron las siguientes indicaciones: opción de alineamiento múltiple y completo, con la selección del parámetro de desactivación de todos las delecciones e inserciones (gaps) en las secuencias, antes del alineamiento; 2) se aplicó el método de máxima verosimilitud (basado en el alineamiento) en el programa PAUP 4.0 beta 10 bajo DOS-Windows (Swofford 1999) con los parámetros de estimación del vecino más cercano (neighbor joining), un bootstrap (Felsenstein 1985) de 250 replicaciones, bajo el modelo de substitución de nucleótidos HKY85 (Hasegawa et al. 1985). La elección de este modelo de sustitución, se basa en que las secuencias de ADNmt de las subunidades 6 y 8 de la ATPasa usados aquí, fueron analizadas parcialmente por Reeves & Berminghan (2006) para un propósito filogeográfico, donde se demostró la eficacia de este modelo, además, de lo encontrado por Montoya-Burgos (2003) para otros grupos de peces. Los parámetros de transición y transversión y frecuencias de nucleótidos fueron calculados del conjunto de datos, se empleó una tasa de heterogeneidad uniforme a través de una búsqueda exacta. Los demás parámetros del modelo siguen los valores por defecto o defaults según las especificaciones del programa. Los conceptos filogenéticos sobre máxima verosimilitud se consultaron a partir de los estudios de Felsenstein (1981), Hasegawa et al. (1991), Yang et al. (1995), Huelsenbeck & Crandall (1997), Lió & Goldman (1998) y Steel & Penny (2000).
Biogeografía histórica. Se siguieron los principios de la biogeografía histórica vicariante inicialmente propuesta por Nelson & Platnick (1980), Nelson & Rosen (1981), y posteriormente desarrollada por Wiley (1988), Humphries et al. (1988), Parenti (1991), Morrone & Crisci (1995), Van Veller et al. (1999, 2000), Crisci (2001), Van Veller et al. (2003), Morrone (2005) y Ebach & Morrone (2005).
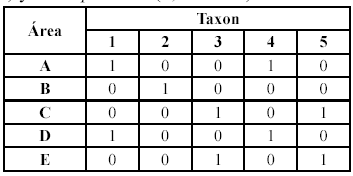
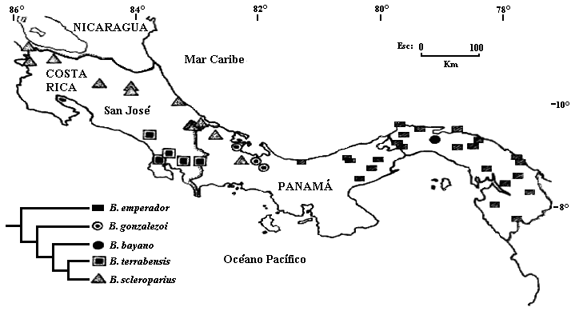
Se emplearon dos técnicas para reconstruir la biogeografía de las especies de Bryconamericus de la baja América Central, la biogeografía cladística y el Análisis de Dispersión-Vicarianza (DIVA). En ambas técnicas se usaron la filogenia y distribución de los taxones analizados aquí, como sigue: cuenca de los ríos Koi, Puerto Viejo, San Juan y Bongie de Panamá y Costa Rica (= A para B. scleroparius), cuenca del río Térraba, vertiente del Pacífico de Costa Rica (= B para B. terrabensis), cuenca del río Bayano, vertiente del Pacífico en Panamá (= C para B. bayano), cuenca de los ríos Sixaola, Cañaza y Bongie, vertiente del Caribe en Costa Rica y Panamá (= D para B. gonzalezoi) y cuencas de los ríos Chagres, Bayano, Tuira y Santa María, vertientes del Caribe y Pacífico de Panamá y cuencas de los ríos Baudó, San Juan, Atrato y drenajes costeros del Pacífico en Colombia (= E para B. emperador). Esta distribución siguió a Román-Valencia (2002). Además, para identificar rápidamente y de una manera resumida los nombres de las especies en los apartes biogeográficos se uso el siguiente arreglo: B. scleroparius (1), B. terrabensis (2), B. bayano (3), B. gonzalezoi (4) y B. emperador (5).
La primera metodología en biogeografía cladística se basa en usar la filogenia propuesta aquí para construir el cladograma taxonómico de áreas, el cladograma de áreas y el cladograma resuelto de áreas. Este último cladograma fue reconstruido mediante el uso del supuesto 0 (Morrone & Crisci 1995, Van Veller et al. 1999), que usa a priori la explicación por vicarianza y a posteriori por dispersión y extinción; consecutivamente fue elaborada la matriz de ausencia y presencia de la distribución de las especies de estudio. Un mapa con la distribución de las especies para la baja América Central fue comparado con su filogenia para resumir la información. La segunda técnica siguió la metodología conocida como Análisis de Dispersión-Vicarianza (DIVA), donde una matriz de costos de tres dimensiones es construida para calcular el escenario biogeográfico óptimo para el grupo (Ronquist 1996, 1997). El DIVA se fundamenta en la escuela biogeográfica basada en procesos discutida por Ronquist (1996, 1997, 1998), Zink et al. (2000) y Sanmartín & Ronquist (2002). El programa DIVA 1.1 bajo Windows (Ronquist 1996, 1997) se utilizó para reconstruir el escenario biogeográfico del grupo de estudio. Las indicaciones ejecutadas en DIVA 1.1 fueron: unidades de área maximizadas= cinco, uniones para la longitud de las reconstrucciones optimizadas= 250, grupo de máximo número de alternativas reconstrucciones= 1000, peso = uno y edad del nodo más interno en el árbol= uno. Las áreas ancestrales (letras A-E) que se usaron fueron relacionadas con los nodos (uno al cuatro) identificados en el árbol biogeográfico reconstruido a partir del DIVA. Así, la hipótesis biogeográfica fue reconstruida basándose en las técnicas mencionadas y la información geológica disponible.
RESULTADOS
Filogenia. Del alineamiento de las 842 posiciones de nucleótidos fueron obtenidos 468 sitios constantes y 192 sitios variables, de los cuales cuatro fueron persistentes. Se concluye que las especies de Bryconamericus analizadas están más emparentadas entre si, que con cualquier otro taxon incluido (Fig. 1).
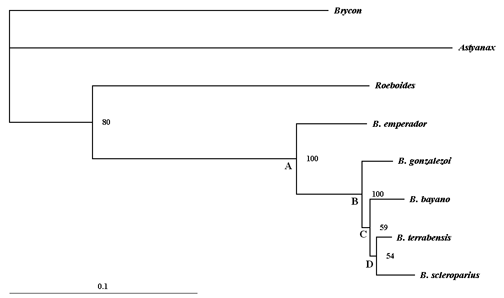
La distancia promedio del árbol filogenético fue de 0,2322. Dentro de este árbol fueron encontrados valores de bootstrap cercanos a 100, lo que dio sustento a las ramas internas del mismo. Así, los clados A y B tienen soporte con valor igual a 100, mientras los clados C y D registraron frecuencias superiores a 50.
Del árbol obtenido (Fig. 1) se concluye que las especies de Bryconamericus forman un clado. Esta sería una hipótesis preliminar de monofilia de las especies de Bryconamericus de la baja América Central, que se constituye en un adelanto para llegar a la monofilia de todo el género. Las especies del clado D (B. terrabensis, B. scleroparius) están más cercanamente emparentadas con B. bayano, formando un clado que tiene por grupo hermano a B. gonzalezoi (Fig. 1). Bryconamericus emperador es la especie hermana de las cuatro especies del clado B.
Biogeografía cladística. Se obtuvo un cladograma resuelto de áreas mediante el supuesto 0, a partir del cladograma taxonómico de áreas (Fig. 2).
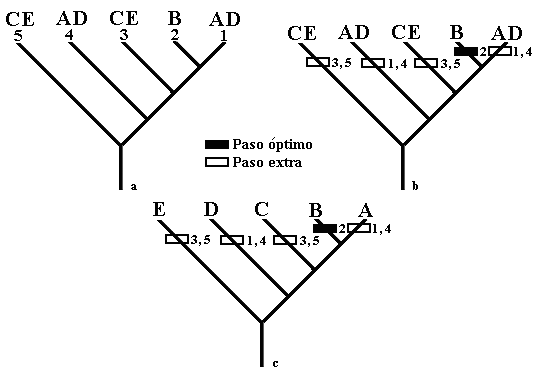
El cladograma resuelto de áreas necesitó cuatro pasos extra (especies ubicadas más de una vez en el árbol) y uno óptimo (especie ubicada una sola vez) para explicar el patrón de distribución (Fig. 2c), por lo que el supuesto 0 mostró que las relaciones entre las áreas pueden conservarse conforme a la filogenia de las especies (se asumió la monofilia para maximizar la vicarianza a priori). El área más ancestral (Tabla 2, parte más oriental de América Central y el noroeste de América del Sur) es la distribución de B. emperador, relacionado estrechamente con las distribuciones de las otras especies en América Central. Además, con estos resultados (Fig. 2) se asumió vicarianza a priori y se resolvieron los problemas de los taxones simpátricos (especies uno y cuatro, tres y cinco) mediante una explicación a posteriori por dispersión y extinción. Así, las áreas que ocuparon las especies centroamericanas fueron producto de dispersión, extinción y vicarianza consecutivamente. Por lo tanto, se encontró estrecha interrelación entre la filogenia del grupo y las áreas de distribución en América Central (Fig. 3).
Análisis de dispersión-vicarianza (DIVA). El DIVA arrojó mediante una búsqueda exacta 64 reconstrucciones alternativas e igualmente óptimas. Se encontró el siguiente número de áreas ancestrales: una para el nodo 1, cuatro para el nodo 2, trece para el nodo 3 y tres para el nodo 4 (Tabla 3).

El DIVA identificó los siguientes procesos: tres extinciones, cinco dispersiones (la dispersión inicial ocurrida en nodo uno se tomó como alterna a la formación de las áreas ancestrales) y vicarianza para explicar la biogeografía de los taxones (Fig. 4). Dos extinciones se ubicaron después de la formación de una sola distribución ancestral (ABCDE), mientras la última ocurrió cuando las primeras dispersiones fueron efectuadas. Los procesos de dispersión obtenidos explicaron la mayor parte de las áreas ancestrales ubicadas en los nodos dos al cuatro. Mientras la vicarianza ocurrió al inicio de los procesos de extinción y dispersión del grupo (nodo 1, Fig. 4).
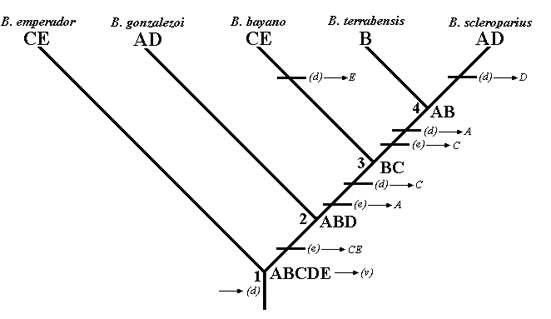
De esta forma, el análisis mediante DIVA explica la distribución de Bryconamericus en la baja América Central por un proceso de dispersión inicial y posteriormente vicarianza, que ocurrió justo cuando se formó el área ancestral ABCDE (nodo 1, Fig. 4), donde se diferenciaron las especies centroamericanas de B. emperador y posiblemente otras que presentan distribución en el norte de América del Sur.
DISCUSIÓN
Filogenia. En relación con el clado C (B. bayano, (B. terrabensis, B. scleroparius)), los resultados obtenidos coinciden con las inferencias por Román-Valencia (2002), sobre la base de caracteres morfológicos. Román-Valencia (2000) observó que las especies de Bryconamericus de la baja América Central formaron un clado en estrecha relación con un grupo formado por las poblaciones del noroeste de Colombia; no registró lo mismo con las especies de Paraná en Argentina, Amazonia Ecuatoriana y Colombiana, Alto Cauca y cuenca del Catatumbo en Venezuela. Es muy probable que las poblaciones de Bryconamericus centroamericanas derivaran de una población ancestral en el noroeste de América del Sur.
Del árbol filogenético obtenido se concluye que las especies de Bryconamericus de la baja América Central forman un clado, aún así, no es suficiente para inferir que el género sea monofilético, debido principalmente a que este esta constituido por muchas especies (cerca de 70). Los resultados son un avance y desarrollo en el conocimiento filogenético del grupo, además, demuestran que es necesario continuar en la construcción de hipótesis filogenéticas incluyendo más especies, y sobretodo, combinando caracteres moleculares y morfológicos. Silva (2004) consideró que las interrelaciones entre Bryconamericus, Knodus y Eretmobrycon son inciertas, aunque, no tomo en cuenta a Román-Valencia (2002) para hacer sus anotaciones. Román-Valencia (2002), Vanegas-Ríos et al. (Manuscrito) y este estudio confirman que Eretmobrycon es una nueva combinación de Bryconamericus.
Como mencionaron Weitzman et al. (2005), el género Bryconamericus necesita estudios como los aquí planteados para ampliar su conocimiento filogenético. Y lo mismo ocurre con Knodus, un género discutido por Román-Valencia (2000) y Weitzman et al. (2005). En conclusión, este artículo demuestra que los datos moleculares, parcialmente usados por Reeves & Bermigham (2006), son informativos para reconocer un clado para el grupo en Centroamérica. Además, el hecho de efectuar el análisis sobre la base de la taxonomía actual del grupo (Román-Valencia 2002) y una hipótesis filogenética con datos morfológicos (Vanegas-Ríos et al. Manuscrito) corroboran la utilidad de los resultados y validez de las relaciones filogenéticas encontradas.
Biogeografía histórica. Los resultados obtenidos a partir de la biogeografía cladística y el DIVA evidenciaron la necesidad de utilizar los procesos de dispersión y extinción, además de vicarianza, para explicar las relaciones entre las áreas y la biogeografía de los taxones. La dispersión como proceso inicial explica el patrón de distribución de Bryconamericus en la baja América Central, también se puede mencionar que otros estudios en peces dulceacuícolas de zonas similares citan la dispersión en la biogeografía histórica de los peces de América del Sur con respecto a América Central (Bussing 1985, Bermingham & Martín 1998, Smith & Bermingham 2005).
Jackson & Budd (1996) afirman que las inferencias históricas sobre la biota dependen de las correlaciones entre las antiguas condiciones ambientales y el cambio de los organismos. La historia geológica de América Central ha sido documentada por Rubio (1949), Hernández et al. (1992), Hedges (1996), Coates & Obando (1996), Jackson & Budd (1996), Brown & Lomolino (1998), Iturralde-Vinent & MacPhee (1999) y De Porta (2003). Jackson & Budd (1996) indican que la diversificación en América Central estuvo fuertemente influenciada por el incremento de la complejidad del hábitat, asociado con la formación del Istmo de Panamá (F. I. P), un proceso complejo producido en los últimos 15 millones de años. Cuando se cerró el Istmo, también se incluyó el crecimiento y migración de los arcos volcánicos de América Central, y la unión de las placas del Pacífico y Caribe, además de su colisión con América del Sur. La edad final de culminación del Istmo de Panamá podría estar entre 3,5 y 3,1 m. a, en la mitad del Plioceno (Coates & Obando 1996, Brown & Lomolino 1998, Iturralde-Vinent & MacPhee 1999, De Porta 2003). Según Brown & Lomolino (1998) la emergencia de América Central en el Neógeno fue producto de la convergencia de las placas de Cocos, Nazca y del Caribe. Aunque Iturralde-Vinent & MacPhee (1999) y De Porta (2003) reportan que desde hace diez a cinco millones de años (10 a 5 m.a.) el archipiélago de América Central formó una ruta de pequeños fragmentos insulares que permitieron la dispersión de organismos terrestres, pero sólo aproximadamente 3.5 m. a. atrás, este archipiélago finalmente se unió con América del Sur para formar el gran puente de conexión entre las regiones Neotropical y Neártica. La hipótesis aquí planteada para Bryconamericus no se ajusta a esa posible conexión mencionada para el Mioceno; es muy probable que aun existiera una barrera marina aislante, que peces dulceacuícolas no hubieran podido atravesar. Así sólo el Istmo de Panamá es la consolidación del gran proceso de dispersión que efectuaron las poblaciones de Bryconamericus.
La hipótesis biogeográfica propuesta mostró un patrón de distribución de las especies de Bryconamericus con dos problemas. El primero fue una distribución redundante, donde las áreas A, C, D y E simultáneamente albergaron dos taxones y, el segundo un problema de taxones de amplia distribución, donde las especies 1 y 4 se localizaron en las áreas A y D, mientras las especies 3 y 5 en las áreas C y E (Fig. 2 y Fig. 4). Sin embargo, ambos problemas fueron solucionados por el supuesto 0, al usar una explicación a posteriori por dispersión y extinción, procesos considerados azarosos en la historia de un grupo (Van Veller et al. 1999). El evento vicariante (explicación de primer orden) no fue suficiente para explicar una hipótesis del grupo y las áreas.
Los resultados obtenidos de la biogeografía cladística y del DIVA permiten establecer la hipótesis aquí expuesta: el primer proceso de dispersión efectuado por las poblaciones ancestrales de Bryconamericus en el noroeste de América del Sur, pudo ser producto de un efecto fundador o especiación alopátrica tipo Ib (se superaron tanto barreras físicas del ambiente, como fisiológicas de los organismos) en el sentido de Bush (1975). Así, las conexiones entre las cuencas de los bloques del Chocó y de Chorotega permitieron que una pequeña población emigrara y consecuentemente colonizara el sur de América Central, donde por tasas de especiación altas y mecanismos de aislamiento reproductivo comenzaron los primeros esbozos de especiación. Posiblemente como lo plantearon Bussing (1985) y Román-Valencia (2002) durante y posteriormente a este evento ocurrieron varios procesos de extinción (Fig. 4). Los procesos que continuaron fueron otras dispersiones, posiblemente consecuencia de los procesos de glaciación y cambios en el nivel del mar que ocurrieron durante y posteriormente a la formación del Istmo de Panamá (Jackson & Budd 1996). Se crearon rutas de conexión por anastomosis de las cuencas o ríos debido al aumento del nivel del mar, lo que permitió posiblemente que poblaciones de Bryconamericus llegaran hasta los límites donde actualmente se localiza Costa Rica. Por último, la vicarianza mostrada entre B. terrabensis y B. scleroparius pudo ser producto de la disyunción creada por el aislamiento de la cuenca de Térraba, ya que la naturaleza terrestre y volcánica de esta cuenca en el Plioceno (es una de las más antiguas formaciones del Neógeno en América Central; Coates & Obando 1996), permitió que por orogénesis y vulcanismo se modificaran, posteriormente a la dispersión y a la colonización, las rutas de conexión y dieran origen a un proceso de especiación alopátrida tipo I en el sentido de Bush (1975). Además, los eventos vicariantes se incrementaron en América Central posiblemente por un acoplamiento del clima seco y un incremento en el nivel del mar (Bussing 1985).
El modelo de distribución geográfica de las especies de Bryconamericus para América Central mencionados por Reeves & Bermingham (2006), es confuso y de poca utilidad porque no se sustentaron en taxonomía rigurosa, actualizada, y en los linajes de sus árboles no se reportan taxones terminales identificables. Según Bussing (1985) los peces dulceacuícolas tienen una baja vagilidad; no significa esto que por una dispersión pasiva o activa las poblaciones ancestrales no pudieran colonizar las cuencas de las actuales Panamá y Costa Rica. Es posible que la categorización que el autor hizo para ubicar a Bryconamericus en zonas ancestrales y novedosas más hacia el sur sea actualmente, de acuerdo con la evidencia geológica moderna y a los resultados obtenidos aquí, modificada completamente, en el sentido que Bryconamericus posiblemente solo pudo efectuar la dispersión por efecto fundador cuando el Istmo de Panamá se formó y no antes.
AGRADECIMIENTOS
Juan I. Montoya-Burgos planteó sugerencias en una versión inicial del manuscrito. Este artículo se beneficio con sugerencias y correcciones realizadas por Juan J. Morrone, Pablo A. Goloboff, Francisco Langeani y tres revisores anónimos. Paulo A. Backup (MNRJ) y Donald C. Taphorn (MHNG, USA) corrigieron el resumen en portugués e inglés respectivamente.
LITERATURA CITADA
1. BERMINGHAM, E. & A.P MARTIN. 1998. Comparative mtDNA phylogeography of neotropical freshwater fishes: Testing shared history to infer the evolutionary landscape of lower Central America. Molecular Ecology 7: 499-517. [ Links ]
2. BROWN, J.H. & M.V. LOMOLINO. 1998. Biogeography. Second Edition, Sinaur Associates, Inc., Sunderland, Massachusetts. [ Links ]
3. BUSH, G.L. 1975. Modes of animal speciation. Annual Review of Ecology and Systematics 6: 339-364. [ Links ]
4. BUSSING, W.A. 1985. Patterns of distribution of the Central American ichthyofauna. Págs. 453-473 en: F.G. Stehli & S.D. Webb (eds), The Great American Biotic Interchange. Plenum, Nueva York. [ Links ]
5. CALCAGNOTTO, D., S.A. SCHAEFER & R. DESALLE. 2005. Relationships among characiform fishes inferred from analysis of nuclear and mitochondrial gene sequences. Molecular Phylogenetics and Evolution 36: 135-153. [ Links ]
6. COATES, A.G. & OBANDO, J.A.. 1996. The geological evolution of the Central American. Págs. 21-56 en: J.B.C. Jackson, A.F. Budd & A.G. Coates (eds.), Evolution & Environment in Tropical America. The University of Chicago Press, Chicago & Londres. [ Links ]
7. CRISCI, J.V. 2001. The voice of historical biogeography. Journal of Biogeography 28: 157-168. [ Links ]
8. DE PORTA, J. 2003. La formación del Istmo de Panamá: su incidencia en Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales 27: 191-216. [ Links ]
9. EBACH, M.C. J.J. & MORRONE. 2005. Forum on historical biogeography: What is cladistic biogeography?. Journal of Biogeography 32: 2179-2187. [ Links ]
10. FELSENSTEIN, J. 1985. Confidence limits on phylogenies: an approach using the bootstrap. Evolution 39: 783-791. [ Links ]
11. FELSENSTEIN, J. 1981. Evolutionary trees from DNA sequences: A maximum likelihood approach. Journal of Molecular Evolution 17: 368-376. [ Links ]
12. HASEGAWA, M., H. KISHINO, & K. YANO. 1985. Dating of the human-ape splitting by a molecular clock of mitochondrial DNA. Journal Molecular and Evolution 22: 160-174. [ Links ]
13. HASEGAWA M, H. KISHINO & N. SAITOU.1991. On the maximum likelihood method in molecular phylogenetics. Journal of Molecular Evolution 32: 443-445. [ Links ]
14. HEDGES, S.B. 1996. Vicariance and dispersal in Caribbean biogeography. Herpetologica 52: 466-473. [ Links ]
15. HERNÁNDEZ, C. J., T. WALSHBURGER, Q.R. ORTIZ & G.A. HURTADO. 1992. Origen y distribución de la biota Suramericana y Colombiana. Págs. 55-104 en: G. Halffter (Comp.), La Diversidad Biológica de Iberoamérica. Acta Zoología Mejicana (Volumen especial). [ Links ]
16. HUELSENBECK, J.P. & K.A. CRANDALL. 1997. Phylogeny estimation and hypothesis testing using maximum likelihood. Annual Review of Ecology and Systematics 28: 437-466. [ Links ]
17. HUMPHIES, C.J., P.Y. LADIGES, M. ROSS & M. ZANDEE. 1988. Cladistic biogeography. Págs. 372-403 en: A.A. Myers & P.S. Giller (eds.), Analytical biogeography: An integrated approach to study of animal and plants distributions. Chapman and Hall, Londres & Nueva York. [ Links ]
18. ITURRALDE-VINENT, M.A. & R.D.E. MACPHEE. 1999. Paleogeography of the Caribbean region: implications for cenozoic biogeography. Bulletin of the American Museum of Natural History 238:1-95. [ Links ]
19. JACKSON, J.B.C. & A.F. BUDD. 1996. Evolution and environment: Introduction and overview. Págs. 1-20 en: J.B.C. Jackson, A.F. Budd & A.G. Coates (eds.), Evolution & Environment in Tropical America. The University of Chicago Press, Chicago & Londres. [ Links ]
20. LANGEANI, F., Z.M.S. DE LUCENA, J.P. LIMA & F.J. TARELHO-PEREIRA. 2005. Bryconamericus turiuba, a new species from the upper Rio Paraná system (Ostariophysi: Characiformes). Copeia 2005: 386-392. [ Links ]
21. LIÒ, P. & GOLDMAN, N. 1998. Models of molecular evolution and phylogeny. Genome Research 8: 1233-1244. [ Links ]
22. LIMA, F.T.C., L.R. MALABARBA, P.A. BUCKUP, J.F.P. DA SILVA, R.P. VARI, A. HAROLD, R. BENINE, O.T. OYAKAWA, C.S. PAVANELI, N.A. MENEZES, C.A.S. LUCENA, M.C.S.L. MALABARBA, Z.M.S. LUCENA, R.E. REIS, F. LANGEANI, L. CASSATI, V.A. BERTACO, C. MOREIRA & P.H.F. LUCINDA. 2003. Págs. 106-169. en: Genera Incertae Sedis in Characidae. In: Reis, R.E., Kullander, S.O. & Ferraris Jr.C.J. (eds.), Check list of the freshwater fishes of South and Central America. Edipucrs, Porto Alegre. [ Links ]
23. LUCENA, C.A.S. 1993. Estudo filogenético da familia Characidae com una discussão dos grupos naturais propostos (Teleostei, Ostariophysi, Characiformes). Tesis de Doctorado, Universidade de Sâo Pâulo, Sâo Paulo. [ Links ]
24. MALABARBA, M.C.S.L. & L.R. MALABARBA. 1994. Hypobrycon maromba, a new genus and species of characiform fish from the upper rio Uruguay, Brazil (Ostariophysi: Characidae). Ichthyological Exploration of Freshwaters 5: 19-24. [ Links ]
25. MALABARBA, L.R. & WEITZMAN, S.H. 2003. Description of new genus with six new species from southern Brazil, Uruguay and Argentina, with a discussion of a putative characid clade (Teleostei: Characiformes: Characidae). Comunicações do Museu de Ciências e Tecnologia da PUCRS, Série Zoologia, Porto Alegre 16: 67-151. [ Links ]
26. MORRONE, J.J. 2005. Cladistic biogeography: Identity and place. Journal of Biogeography 32: 1281-1286. [ Links ]
27. MORRONE, J.J. & J.V. CRISCI. 1995. Historical biogeography: Introduction to methods. Annual Review of Ecology and Systematics 26: 373-401. [ Links ]
28. MONTOYA-BURGOS, J.I. 2003. Historical biogeography of catfish genus Hypostomus (Siluriformes: Loricariidae), with implications on the diversification of Neotropical ichthyofauna. Molecular Ecology 12: 1855-1867. [ Links ]
29. NELSON, G. & N.I. PLATNICK. 1980. A vicariance approach to historical biogeography. BioScience 30: 339-343. [ Links ]
30. NELSON, G. & D.E. ROSEN. (eds.) 1981. Vicariance biogeography: A critique. Columbia University Press, Nueva York. [ Links ]
31. PARENTI, L.R. 1991. Ocean basin and the biogeography of freshwater fishes. Australian Systematic Botany 4: 137-149. [ Links ]
32. REEVES, R.G. & BERMINGHAM, E. 2006. Colonization, population expansion, and lineage turnover: Phylogeography of mesoamerican characiform fish. Biological Journal of the Linnean Society 88: 235-255. [ Links ]
33. ROMAN-VALENCIA, C. 2000. Tres nuevas especies de Bryconamericus (Ostariophysi: Characidae) de Colombia y diagnóstico del género. Revista de Biología Tropical 48: 449-464. [ Links ]
34. ROMAN-VALENCIA, C. 2002. Revisión sistemática de las especies del género Bryconamericus (Teleostei: Characidae) de Centroamérica. Revista de Biología Tropical 50: 173-192. [ Links ]
35. ROMAN-VALENCIA, C., J.A. VANEGAS-RIOS & R.I. RUIZ-C. 2008a. Una nueva especie de pez del género Bryconamericus (Ostariophysi: Characidae) del río Magdalena, con una clave para las especies de Colombia. Revista de Biología Tropical 56: 1749-1763. [ Links ]
36. ROMAN-VALENCIA, C., D.C. TAPHORN & R.I. RUIZ-C. 2008b. Two new Bryconamericus (Characiformes: Characidae) from the Cinaruco River, Orinoco Basin, with keys to all Venezuelan species. Animal Biodiversity and Conservation 31: 15-27. [ Links ]
37. ROMAN-VALENCIA, C., J.A. VANEGAS-RIOS & R.I. RUIZ-C. 2009. Una nueva especie del género Bryconamericus (Teleostei: Characidae) del río Fonce, sistema río Magdalena, Colombia. Revista Mexicana de Biodiversidad 80: 455-463. [ Links ]
38. RONQUIST, F. 1996. DIVA 1.1. user's manual. Department of Systematic Zoology, Uppsala University. http://www.ebc.uu.se/systzoo/research/diva/diva.html (consultado el 7 diciembre de 2008). [ Links ]
39. RONQUIST, F. 1997. Dispersal-Vicariance analysis: A new approach to the quantification of historical biogeography. Systematic Biology 46: 195-203. [ Links ]
40. RONQUIST, F. 1998. Three-Dimensional cost-matrix optimization and maximum cospeciation. Cladistics 14: 167-172. [ Links ]
41. RUBIO, A. 1949. Notas sobre la geología de Panamá. Departamento de Cultura y Publicaciones del Ministerio de Educación, Imprenta Nacional, Panamá. [ Links ]
42. SANMARTIN, I. & F. RONQUIST. 2002. New solutions to old problems: Widespread taxa, redundant distributions and missing areas in event-based biogeography. Animal Biodiversity and Conservation 25: 75-93. [ Links ]
43. SILVA, J.F.P. & L.R. MALABARBA. 1996. Description of a new species of Hypobrycon from the upper rio Uruguai, Brazil (Ostariophysi: Characidae). Comunicações do Museu de Ciências e Tecnologia da PUCRS, Série Zoologia, Porto Alegre 9: 45-53. [ Links ]
44. SILVA, J.F.P. 2004. Two new species of Bryconamericus Eigenmann (Characiformes: Characidae) from southern Brazil. Neotropical Ichthyology 2(2): 55-60. [ Links ]
45. SMITH, S.A. & E. BERMINGHAM. 2005. The biogeography of lower Mesoamerican freshwater fishes. Journal of Biogeography 32: 1835-1854. [ Links ]
46. STEEL, M. & D. PENNY. 2000. Parsimony, likelihood, and the role of models in molecular phylogenetics. Molecular Biology and Evolution 17: 839-850. [ Links ]
47. SWOFFORD, D.L. 1999. Phylogenetic Analysis Using Parsimony (and other Methods) PAUP* 4.0. Sinauer Associates, Inc, Sunderland. [ Links ]
48. THOMPSON, J.D., T.J. GIBSON, F. PLEWNIAK, F. JEANMOUGIN & D.G. HIGGINS. 1997. The Clustal_X windows interface: Flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research 25: 4876-4882. [ Links ]
49. VANEGAS-RIOS, J.A., C. ROMAN-VALENCIA & D.C. TAPHORN. Manuscrito. Phylogeny and biogeography of Bryconamericus (Characiformes: Characidae) from Lower Central America and northwestern South America. Zootaxa. [ Links ]
50. VAN VELLER, M.G.P., M. ZANDEE & D.J. KORNET. 1999. Two requirements for obtaining valid common patterns under different assumptions in vicariance biogeography. Cladistics 15: 393-406. [ Links ]
51. VAN VELLER, M.G.P., D.J. KORNET & M. ZANDEE. 2000. Methods in vicariance biogeography: Assessment of implementations of assumptions 0, 1, and 2. Cladistics 16: 319-345. [ Links ]
52. VAN VELLER, M.G.P., D.R. BROOKS & R. ZANDEE. 2003. Cladistic and phylogenetic biogeography: The art and the science of discovery. Journal of Biogeography 30: 319-329. [ Links ]
53. VARI, R.P. & D. J. SIEBERT. 1990. A new, unusually sexually dimorphic species of Bryconamericus (Pisces: Ostariophysi: Characidae) from the peruvian amazon. Proceedings of the Biological Society of Washington 103: 516-524. [ Links ]
54. WEITZMAN, S.H., N.A. MENEZES, H.G. EVERS & J.R. BURNS. 2005. Putative relationships among inseminating and externally fertilizing characids, with a description of a new genus and species of Brazilian inseminating fish bearing an anal-fin gland in males (Characiformes: Characidae). Neotropical Ichthyology 3: 329-360. [ Links ]
55. WILEY, E. O. 1988. Vicariance biogeography. Annual Review of Ecology and Systematics 19: 513-542. [ Links ]
56. YANG, Z., N. GOLDMAN & A. FIRIDAY, A. 1995. Maximum likelihood trees from DNA sequences: A peculiar statistical estimation problem. Systematic Biology 44: 384-399. [ Links ]
57. ZINK, R.M., R.C. BLACKWELL-RAGO & F. RONQUIST. 2000. The shifting roles of dispersal and vicariance in biogeography. Proceedings of the Royal Society of London 267: 497-503. [ Links ]