Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.33 no.2 Bogotá Jul./Dec. 2011
Corticolous lichens in the Caribbean region of Colombia
ANGÉLICA RINCÓN-ESPITIA
JAIME AGUIRRE-C.
ROBERT LÜCKING
Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá D.C., Colombia. ajrincone@unal.edu.co; angelica.rincon@yahoo.es
Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Apartado 7495. Bogotá, D. C., Colombia. jaguirrec@unal.edu.co
Department of Botany, The Field Museum, 1400 South Lake Shore Drive, Chicago, IL 60605-2496, USA. rlucking@fieldmuseum.org
RESUMEN
Se documentó la composición de la flora liquénica corticícola de cinco localidades de la región Caribe colombiana, tres de tierras bajas (planicies) y dos de tierras altas (macizos montañosos). Se encontraron 348 morfoespecies de líquenes corticícolas, basadas en 950 ejemplares, de las cuales 215 se determinaron a nivel de especie y 62 a género (debido a la ausencia de estructuras reproductivas o a la carencia de trabajos taxonómicos). El resto de las especies (71) constituyó un grupo líquenes costrosos estériles que carecen de caracteres específicos para su identificación. Se encontraron 115 registros nuevos para Colombia, la mayoría de especies son registros nuevos para las áreas de estudio. El número total de especies para la región Caribe, incluyendo los estudios previos de macrolíquenes y líquenes foliícolas, se estimó en aproximadamente 400.
Palabras clave. Líquenes corticícolas, biodiversidad de líquenes, registros nuevos, Caribe colombiano.
ABSTRACT
We documented the corticolous lichen flora composition in five localities of the Colombian Caribbean region, three in the lowlands (plains) and two in the highlands (massifs). We found 348 species based on approximately 950 specimens, 215 were determined at the species level and 62 at the genus level (due to the absence of reproductive structures or lack of taxonomic works). The remaining species (71) belong to a group of sterile crustose lichens that could not be determined because they did not have specific characters for their identification. We found 115 new records for Colombia, most species are new records for the study areas. The total number of species for the Caribbean region, including earlier studies of foliicolous lichens and macrolichens, is estimated at about 400.
Key words. Corticolous lichens, lichen biodiversity, new records, Caribbean region of Colombia.
Recibido: 17/07/2011
Aceptado: 24/10/2011
INTRODUCCIÓN
La región Caribe de Colombia presenta una variedad de ambientes, debido en principio, a la fisiografía que separa dos grandes escenarios, las planicies y los macizos montañosos (Sierras y Serranías) (Rangel, en preparación). La heterogeneidad climática ofrece gran variedad de tipos de vegetación, al igual que hábitats, que favorecen el desarrollo y el establecimiento de los líquenes corticícolas. Los estudios en esta región se han centrando en los macizos montañosos, como la Sierra Nevada de Santa Marta y la Serranía de Perijá, en líquenes foliícolas y macrolíquenes, respectivamente (Nowak & Winkler 1970; Sipman 1984; Avendaño & Aguirre 2009).
Los líquenes corticícolas (epífitos) presentan gran importancia al momento de documentar el estado de conservación de los remanentes de bosque, gracias a su sensibilidad ante los cambios en la estructura y/o la fragmentación de los mismos (Cáceres et al. 2007) y debido a la rápida degradación de los bosques colombianos se está comprometiendo implícitamente la continuidad de la comunidad liquénica que soportan.
La información sobre estos organismos es escasa, antes de este estudio representaba menos del 15 % de los líquenes conocidos a nivel nacional, es decir 176 especies estaban registradas para esta región (Aguirre 2008). Por esta razón, se planteó como objetivo principal documentar la composición de la flora liquénica corticícola en algunas tierras bajas y altas del Caribe colombiano y así, contribuir con el conocimiento de la riqueza y diversidad liquénica.
ÁREA DE ESTUDIO
La zona Norte de Colombia comprende la región Caribe, cuenta con una extensión aproximada de 142.000 km2, que corresponde al 11,6% de la superficie total del territorio nacional (Rangel-Ch. et al.1997; Rangel-Ch. & Carvajal-Cogollo 2009). Las áreas de muestreo se concentraron en cuatro departamentos:
1. Departamento del Atlántico, municipio de Juan de Acosta, Localidad La Batatilla. Bosque seco tropical. Altura promedio de 120 a 141 m. Coordenadas 10° 46' 39.6" N y 75° 02' 40.4" W.
2. Departamento del Cesar, municipio de Río de Oro, Veredas: Garaguya, El Gitano y Santa María. Bosque húmedo (Serranía del Perijá). Altura promedio de 1500-1546 m. Coordenadas 08° 15.9' 0.9" N y 73° 25.0' 12" W.
3. Departamento de Córdoba, municipio Los Córdobas, vereda Santa Rosa de la caña. Bosque de semihúmedo. Altura promedio de 90 a 100 m. Coordenadas 08° 47' 42.5" N y 76° 19' 24.6" W.
4. Departamento de Córdoba, municipio de Tierralta, vereda Tuis Tuis. Bosque húmedo- pluvial. Altura promedio de 160 a 190 m. Coordenadas 08° 02' 20.1" N y 76° 05' 40.3"W.
5. Departamento La Guajira, municipio Urumita, vereda Tierra Nueva. Bosque húmedo. Serranía del Perijá. Altura promedio de 1800- 1870 m. Coordenadas 10° 27' 25.1" N, 72° 57' 20.7" W.
MATERIALES Y MÉTODOS
Fase de campo
El material liquénico se recolectó en cinco salidas de campo, llevadas a cabo entre agosto de 2009 y septiembre de 2010. Se desarrollaron dos métodos de muestreo, oportunístico no cuantitativo y transecto cuantitativo.
Para el muestreo oportunístico no cuantitativo, se siguieron los lineamientos propuestos por Sipman (1996). Se estableció un transecto en línea recta de 100 m dentro del área, se escogieron los forófitos que se encontraban circundando el sendero, principalmente por la presencia de talos liquénicos conspicuos. Se inspeccionaron y posteriormente, se recolectaron las muestras. Este método fue aplicado en los bosques de Los Córdobas (Córdoba), Tierralta (Córdoba) y Urumita (La Guajira).
En el muestreo por transecto cuantitativo se siguieron las sugerencias de Lücking et al. (2009) pero a diferencia del anterior, se realizó un transecto en línea recta de 500 m en el interior del bosque, efectuando levantamientos cada 50 m. En cada uno de los puntos de muestreo se seleccionaron dos forófitos, para un total de 20 árboles por área de muestreo. En los cuales se realizó un muestreo vertical hasta 1,5 m de altura y se dividió en tres secciones (0 a 0.50 m, 0.50 a 1 m y 1 a 1.50 m.) para el proceso de muestreo. Esta técnica se utilizó en las zonas de Juan de Acosta (Atlántico) y Río de Oro (Cesar).
Fase de laboratorio
El material recolectado se determinó en el Herbario Nacional Colombiano (COL) y en el Herbario Emilio-Mahecha-sección criptógamas, de la Universidad Distrital Francisco José de Caldas (UDBC). Se realizaron observaciones macroscópicas y microscópicas, se describieron los caracteres morfológicos y anatómicos, estos últimos generalmente de ascomas (apotecios, peritecios o lirelas), cuando estaban presentes. Los análisis químicos se basaron en pruebas de coloración, por medio del uso de reactivos químicos K (Hidróxido de potasio), C (Hipoclorito de sodio), P (parafenilenodiamina), generalmente en el talo para reconocer algunos los metabolitos secundarios y la prueba I (solución yodada) para determinar la amiloidea del himenio, ascas y ascosporas. La identificación se llevó a cabo mediante el uso de literatura disponible, claves y descripciones.
RESULTADOS Y DISCUSIÓN
Se encontraron 348 morfoespecies de líquenes, se determinaron 215 a nivel de especie, a nivel de género 62, debido a que no presentaban estructuras reproductivas, que son indispensables para su determinación o por la carencia de trabajos taxonómicos, como es el caso de Pertusaria, Cryptothecia, entre otros y 71 morfoespecies constituidas por un grupo grande líquenes costrosos estériles, que carecen de caracteres específicos para su respectiva identificación, los cuales fueron excluidos para realizar los análisis de riqueza. En el material estudiado están representados 77 géneros, distribuidos en 28 familias y nueve órdenes (Anexo 1.).
Las familias con mayor número de géneros y especies fueron Graphidaceae (10-45), seguido de Parmeliaceae (7-28), Roccellaceae (7-22), Thelotremataceae (7-11) y Physciaceae (6-11). Es importante resaltar que estas familias presentan un número considerable de géneros y son abundantes en el Neotrópico. Sin embargo, también se puede observar en la figura 1, que existen otras familias representativas, como Pyrenulaceae, Porinaceae y Trypetheliaceae, que si bien poseen pocos géneros están representadas por una cantidad importante de especies en el Caribe colombiano.
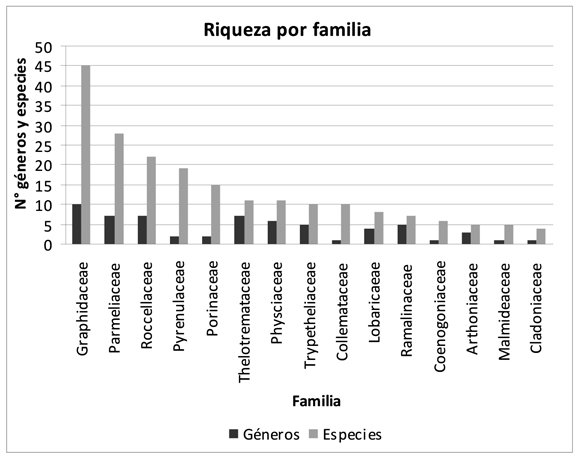
Graphidaceae se caracteriza por dominar las comunidades de microlíquenes costrosos tropicales desde el nivel del mar hasta aproximadamente 2000 m (Staiger 2002; Archer 2006; Lücking et al. 2008; Lücking & Rivas-Plata, 2008). La familia Thelotremataceae, al igual que Graphidaceae, domina en bosques tropicales en altitudes bajas a medianas (regiones de vida tropical y subandina), donde su mayor abundancia y riqueza se presenta en bosques primarios y húmedos (Frisch 2006; Mangold et al. 2008). En cuanto a los líquenes foliosos, las familias Parmeliaceae y Physciaceae tienen su óptimo de expresión en bosques de elevaciones medianas, es decir en las regiones de vida subandina y andina (Aguirre 2008), en micrositios abiertos.
Los géneros con mayor representatividad en la flora liquénica corticícola fueron Graphis (23), Parmotrema (18), Pyrenula (17), Porina (14), Phaeographis (11) y Leptogium (10); éstos representan aproximadamente el 40% del total de especies; el 60% restante está repartido en 71 géneros, los cuales, en general están constituidos por cinco o menos especies (Figura 2).
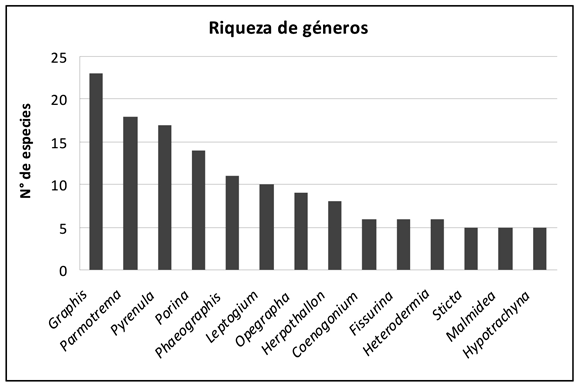
Graphis y Parmotrema, se caracterizan por ser géneros cosmopolita, costrosos y foliosos respectivamente, los cuales presentan su mayor distribución en zonas tropicales, en altitudes entre 0 y 2000m (Kirk et al. 2001; Lücking et al. 2008, Lücking et al. 2009a). Estos géneros se encontraron distribuidos en todos los ambientes, a excepción del bosque seco. Leptogium, a pesar de ser cosmopolita, crece en bosques húmedos a muy húmedos (Cunha 2007), por esta razón en las planicies no fue muy común encontrarlo. En los líquenes pyrenocarpos (con peritecios como cuerpos fructíferos), como Pyrenula y Porina, la mayor distribución se presentó en las planicies, ya que presentan adaptaciones ecomorfológicas, que les permite ser dominantes en elevaciones bajas, especialmente en microhábitats expuestos (Aptroot et al. 2008). Finalmente, Phaeogaphis crece en ambientes poco sombreados de bosques tropicales húmedos (Staiger 2005; Lücking & Rivas-Plata 2008), donde su mayor abundancia fue en los macizos montañosos.
En cuanto a las formas de crecimiento de los líquenes corticícolas encontrados en el Caribe colombiano, estuvieron representados en su mayoría por líquenes costrosos (76.7%), seguido de foliosos (19.6%), dimórficos (1.2%), fruticosos (1.2 %), escuamulosos (0.86%) y filamentosos (0.86%). La alta diversidad de líquenes costrosos se debe principalmente, a las adaptaciones fisiológicas que presentan estos organismos ante las altas concentraciones de humedad y baja intensidad lumínica, condiciones propias de los sotobosques muestreados (Lakatos et al. 2006).
El inventario de líquenes del Caribe colombiano, generó 115 nuevos registros para el territorio colombiano (Figura 3, figura 4). Adicional a éstos, 76 especies constituyeron nuevos registros para la región Caribe y se amplió la distribución departamental de 51 especies. Además, 14 especies que se encontraban restringidas para la región Amazónica y dos para el Chocó, fueron encontradas en el área de estudio (Aguirre 2008). Las características generales de las especies encontradas en el Caribe colombiano se describen en las tabla 1, tabla 2.
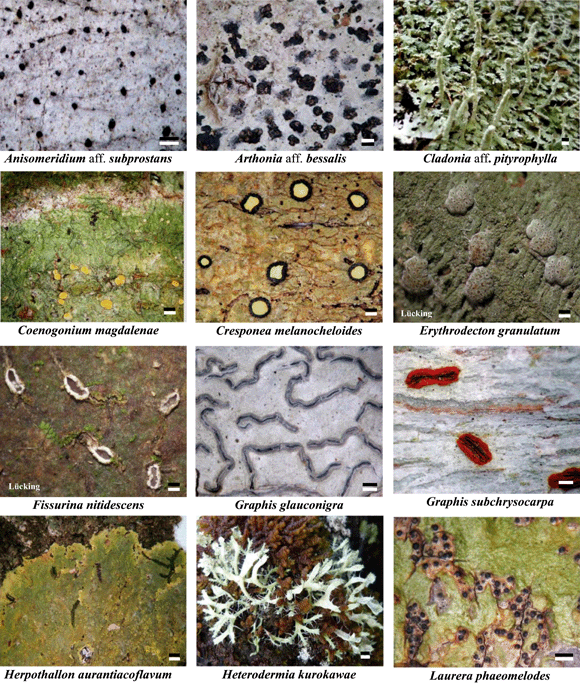
Figura 3. Nuevos registros para el territorio colombiano de líquenes corticícolas del Caribe colombiano. Escala = 1mm. Tomadas de A. Rincón-Espitia:COL 495/COL 350/ COL 161/ COL 879/ COL 032/ COL 022/ COL 556/ COL 348/ COL 804/ COL 302/ COL 126/ COL 477, respectivamente.

Figura 4. Nuevos registros para el territorio colombiano de líquenes corticícolas del Caribe colombiano. Escala = 1mm. Tomadas de A. Rincón-Espitia:COL 1093/ COL 957/ COL 460/ COL 352/ COL 775/ COL 895/ COL 036/ COL 962/ COL 569/ COL 523/ COL 905/ COL 819, respectivamente.
Los líquenes corticícolas encontrados en este estudio no presentan una afinidad por un tipo de ascoma determinado, siendo los más comunes los apotecios (57 especies), seguido de las lirelas (55 especies) y finalmente los peritecios (46 especies). En cuanto a la coloración del ascoma, se manifiesta un predominio por los colores oscuros, como el negro (53 especies) y el marrón (35 especies), seguido de ascomas concoloros al talo (margen talino; 30 especies) y las coloraciones claras junto con ascomas provistos de pruina estuvieron representados 11 o menos especies. Las coloraciones oscuras en los ascomas se deben probablemente a la bioquímica básica que presentan los líquenes, principalmente por la ausencia de metabolitos secundarios como los del grupo de las antraquinonas, que son las encargadas de proporcionar los pigmentos fuertes, no solo en estos organismos, sino también en algunos hongos y en plantas superiores (Nash III 2008). El himenio claro y no amiloide (I-) predominó encontrándose en 97 especies, seguido de himenio claro y amiloide (I+ azul) con 33 especies y el himenio claro y hemiamiloide (I+ rojo) con 17 especies; las pocas especies que presentaron un himenio insperso pertenecen al género Phaeographis y Megalospora. El tipo de ascospora dominante fue la fusiforme-septada con 65 especies, el resto de las formas de las ascosporas estuvieron constituidas por 17 o menos especies. La coloración de las ascosporas que predominó fue la hialina no amiloide (80 especies), seguido por las ascosporas hialinas amiloides (36 especies) y finalmente las ascosporas marrones no amiloides (30 especies).
Según Cáceres et al. (2008), la pigmentación de las ascosporas se genera como una estrategia ante algunas condiciones ambientales, como la fuerte intensidad lumínica y extensas o prolongadas sequias, características que se presentaron en un solo sitio de muestreo (Juan de Acosta, atlántico), de donde provienen la mayoría de especies de Pyrenula, que presentan ascosporas marrones. En cuanto al tamaño de las ascosporas existió una dominancia por las más pequeñas (7 a 24 m) con 82 especies, encontrando menor número de especies con el incremento del tamaño de las ascosporas. Esta dominancia por parte de las ascosporas de menor tamaño, se explica como una estrategia de dispersión, ya que las ascosporas pequeñas y livianas son fácilmente transportadas por el viento, pudiendo alcanzar largas distancias (Sipman & Harris 1989; Nash III 2008). Finalmente, se observó una dominancia por parte de las ascosporas con paredes gruesas (92 especies) en comparación con las ascosporas de paredes delgadas o finas (47 especies). Esta característica es frecuente en los líquenes de bosques tropicales y se insinúa que es una función de almacenaje del material extracelular (Sipman & Harris 1989).
En los líquenes sin ascomas se examinaron diferentes características, entre ellas la coloración del talo, que en la mayoría de los líquenes se encontró una coloración verde grisácea (24 especies), seguido de una coloración verde (21 especies) y una grisácea (16 especies). En la coloración de la médula se presentó una afinidad por las médulas blancas, ya que tan solo cuatro especies presentaron una médula amarilla. La propagación vegetativa es un método común de reproducción en los líquenes y en este estudio se estableció que no existe una preferencia por alguna estructura especializada (isidias o soralios), ya que las isidias estuvieron representadas en 23 especies y los soralios que se encontraron en 21 especies. Estas estructuras son abundantes en los líquenes de bosques tropicales, sin embargo, su efectividad en la dispersión es menor en comparación con las ascosporas (Sipman & Harris 1989). Finalmente, en las estructuras de adhesión al sustrato, 17 especies presentaron rizinas, 15 especies no presentaron ningún tipo de estructuras, doce especies presentaron cilios y rizinas; el resto de especies presentaron protalo (diez), cilios (siete) y tomento (6). Se evidencia que de acuerdo a los hábitos de crecimiento varían los apéndices de fijación, es así que líquenes foliosos presentan principalmente rizinas y/o cilios y los líquenes costrosos generalmente presentan un protalo.
CONCLUSIONES
La riqueza encontrada en el presente estudio no puede ser directamente comparada con la riqueza hallada en otros estudios en regiones tropicales, debido principalmente a los diferentes métodos de muestreo empleados, el tamaño del área muestreada, la cantidad de forófitos y al esfuerzo por determinar no solamente los macrolíquenes sino también los microlíquenes.
Los registros actuales para la región Caribe, incluyendo los estudios previos de macrolíquenes y líquenes foliícolas, alcanzan aproximadamente 400 especies con este estudio, duplicando el número de registros para la región, con la cual se supera la cantidad de especies y géneros conocidos para las regiones de la Amazonia y el Chocó biogeográfico del país (Aguirre 2008).
La flora liquénica corticícola está conformada por diferentes formas de crecimiento, el 76.7% costroso, 19.6 % folioso, 1.2 % fruticoso, 1.2 % dimórfico, 0.86% escuamuloso y 0.86% filamentoso, donde los líquenes costrosos dominan la composición de la flora tanto en las planicies como en los macizos. Sin embrago, en este último ambiente, la mayor humedad ambiental en el gradiente de montaña y la mayor complejidad en los tipos y la estructura de la vegetación, favorecen la aparición de líquenes con diversos hábitos de crecimiento.
El inventario actual de la región Caribe, permite concluir que aún falta realizar muestreos más exhaustivos para lograr un conocimiento real de la biodiversidad liquénica en los diferentes ecosistemas de la región, como los son los manglares y las zonas de páramo.
AGRADECIMIENTOS
Al proyecto Síntesis de la Biodiversidad del Caribe colombiano del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, dirigido por el profesor Orlando Rangel-Ch. Al Herbario Emilio Mahecha- sección criptógamas de la Universidad Distrital Francisco José de Caldas y al Herbario Nacional Colombiano (COL). A la NSF de Estados Unidos por el soporte logístico parcial, mediante la beca “Neotropical Epiphytic Microlichens-An Innovative Inventory of a Highly Diverse yet Little Known Group of Symbiotic Organisms” (DEB 715660 al The Field Museum; Investigador Principal R. Lücking). A la Magister Bibiana Moncada por la revisión del género Sticta y a Leonardo Romero por la revisión del género Leptogium.
LITERATURA CITADA
1. AGUIRRE-C, J. 2008. Diversidad y Riqueza de líquenes en Colombia. En: J. O. Rangel-Ch. (ed.) Colombia Diversidad Biótica VI Riqueza y diversidad de los musgos y líquenes en Colombia. Universidad Nacional de Colombia, Bogotá D.C. 598 pp. [ Links ]
2. APTROOT, A., R. LÜCKING, H. J. M. SIPMAN, L. UMAÑA & J. L. CHAVES. 2008. Pyrenocarpous lichens with bitunicate asci. A first assessment of the lichen biodiversity inventory in Costa Rica. Bibliotheca Lichenologica 94: 1-191. [ Links ]
3. ARCHER, A. W. 2006. The lichen family Graphidaceae in Australia. Bibliotheca Lichenologica, Berlin-Sttutgart. 191 pp. [ Links ]
4. AVENDAÑO-T., K. & J. AGUIRRE-C. 2009. Estudio preliminar de los líquenes de la Serranía de Perijá. En: J. O. Rangel-Ch. (ed.) Colombia Diversidad Biótica VIII Media y baja montaña de la Serranía del Perijá. Universidad Nacional de Colombia, Bogotá D.C. 223-228. [ Links ]
5. CÁCERES, M. S., R. LÜCKING & G. RAMBOLD. 2007. Phorophyte specificity and environmental parameters versus stochasticity as determinants for species composition of corticolous crustose lichen communities in the Atlantic rain forest of northeastern Brazil. Mycol Progress 10: 190-210. [ Links ]
6. CÁCERES, M. S., R. LÜCKING & G. RAMBOLD. 2008. Corticolous microlichens in northeastern Brazil: habitat differentiation between coastal Mata Atlantica, Caatinga and Brejos de Altitude. The Bryologist. 111(1): 1-20. [ Links ]
7. CUNHA, I. P. 2007. Fungos liquenizados do gênero Leptogium (Ascomycetes) no litoral sul do Estado de São Paulo. UNESP – Universidade Estadual Paulista Câmpus de Botucatu Instituto de Biociências. 114 pp. [ Links ]
8. ERIKSSON, O.E. (ed.). 2006. Myconet 12: 1-82. Acceso a internet en http://www.fieldmuseum.org/myconet/outline.asp en Diciembre 2010 [ Links ]
9. FRISCH, A., K. Kalb & M. Grube 2006. Contributions towards a new systematics of the lichen family Thelotremataceae. Bibliotheca Lichenologica 92: 1-558. [ Links ]
10. KIRK, P.M., P.F. CANNON, J.C. DAVID & J.A. STALPERS. 2001. Dictionary of the Fungy. 9ª edition. Cabi Bioscience, Cambridge. 655 pp. [ Links ]
11. LAKATOS M., U. RASCHER & B. BÜDEL 2006. Functional characteristics of corticolous lichens in the understory of a tropical lowland rain forest. New phytologist 172: 679–695. [ Links ]
12. LÜCKING, R. & E. RIVAS PLATA. 2008. Clave y Guía Ilustrada para géneros de Graphidaceae. Glalia 1: 1-41. [ Links ]
13. LÜCKING, R., J.L. CHAVES, H.J.M. SIPMAN, L. UMAÑA, & A. APTROOT. 2008. A first assessment of the Ticolichen biodiversity inventory in Costa Rica: the genus Graphis, with notes on the genus Hemithecium (Ascomycota: Ostropales: Graphidaceae). Fieldiana (Botany), New series 46: 1-131. [ Links ]
14. LÜCKING, R., E. RIVAS PLATA, J. CHAVES, L. UMAÑA & H. J. M. SIPMAN. 2009. How many tropical lichens are there... really? Bibliotheca Lichenologica 100: 399-418. [ Links ]
15. LÜCKING, R., A. ARCHER & A. APTROOT. 2009 a. A Word-wide key to the genus Graphis (Ostropales: Graphidaceae). The Lichenologist 41(4):363-452. [ Links ]
16. MANGOLD, A., J. A. ELIX & H. THORSTEN LUMBSCH. 2008. Thelotremataceae. Flora of Australia 57: 195-420. [ Links ]
17. NASH III. 2008. Lichen Biology. Second Edition. Arizona State University. Cambridge University Press, Nueva York. 477 pp. [ Links ]
18. NOWAK, R & S. WINKLER. 1970. Foliicole Flechten der Sierra Nevada de Santa Marta (Kolumbien) und ihre gegenseitigen Bezieshungen. Plant Systematics and Evolution. 118. 5:456-486. [ Links ]
19. RANGEL-CH., J.O., P. D. LOWY-C & M. AGUILAR-P. 1997. Distribución de los tipos de vegetación en las regiones naturales de Colombia. En Rangel-Ch, O, P. D. Lowy-C y M. Aguilar-P. (Ed.). Colombia Diversidad Biótica II, Tipos de vegetación en Colombia. Instituto de Ciencias Naturales-Universidad Nacional de Colombia, Ministerio de Medio Ambiente, Bogotá D.C. 383-402. [ Links ]
20. RANGEL-CH., J.O. & J. CARVAJAL-COGOLLO. 2009. Clima de la Serranía de Perijá En: J. O. Rangel-Ch. (ed.). Colombia Diversidad Biótica VIII. Media y baja montaña de la Serranía del Perijá. Universidad Nacional de Colombia, Bogotá D.C. 3-49. [ Links ]
21. SIPMAN, H.J.M. 1984. Líquenes del transecto Buritaca-La cumbre. La Sierra Nevada de Santa Marta, Colombia. En: T. Van der Hammen & P. Ruiz (eds). Studies on tropical Andean ecosystems 2: 185-188. [ Links ]
22. SIPMAN, H.J.M. & R. C. HARRIS. 1989. Lichens. En: Lieth, H. & M. J. A. Werger (eds). Tropical rain forest ecosystems. Elsevier Science Publishers, Amsterdam. 302-308. [ Links ]
23. SIPMAN, H.J.M. 1996. Corticolous lichens. In: Gradstein SR, Hietz P, Lücking R, Lücking A, Sipman HJM, Vester HFM, Wolf JHD, Gardette E (eds) How to sample the epiphytic diversity of tropical rainforests. Ecotropica 2:66–67. [ Links ]
24. SIPMAN, H. J. M., W. HEKKING, J. AGUIRRE-C. 2008. Checklist of lichenized and lichenicolous fungi from Colombia. Instituto Ciencias Naturales. Facultad de Ciencias. Universidad Nacional de Colombia. Biblioteca José Jerónimo Triana N° 20, Bogotá D.C. 235 pp. [ Links ]
25. STAIGER, B. 2002. Die Flechtenfamilie Graphidaceae. Studien in Richtung einer natürlicheren Gliederung. Bibliotheca Lichenologica 85:1-526. [ Links ]
26. STAIGER, B. 2005. How to arrange the diversity of a tropical lichen family? Systematics and generic concepts in the lichen family Graphidaceae. Archives des Sciences 58: 53-62. [ Links ]
1. AGUIRRE-C, J. 2008. Diversidad y Riqueza de líquenes en Colombia. En: J. O. Rangel-Ch. (ed.) Colombia Diversidad Biótica VI Riqueza y diversidad de los musgos y líquenes en Colombia. Universidad Nacional de Colombia, Bogotá D.C. 598 pp.
2. APTROOT, A., R. LÜCKING, H. J. M. SIPMAN, L. UMAÑA & J. L. CHAVES. 2008. Pyrenocarpous lichens with bitunicate asci. A first assessment of the lichen biodiversity inventory in Costa Rica. Bibliotheca Lichenologica 94: 1-191.
3. ARCHER, A. W. 2006. The lichen family Graphidaceae in Australia. Bibliotheca Lichenologica, Berlin-Sttutgart. 191 pp.
4. AVENDAÑO-T., K. & J. AGUIRRE-C. 2009. Estudio preliminar de los líquenes de la Serranía de Perijá. En: J. O. Rangel-Ch. (ed.) Colombia Diversidad Biótica VIII Media y baja montaña de la Serranía del Perijá. Universidad Nacional de Colombia, Bogotá D.C. 223-228.
5. CÁCERES, M. S., R. LÜCKING & G. RAMBOLD. 2007. Phorophyte specificity and environmental parameters versus stochasticity as determinants for species composition of corticolous crustose lichen communities in the Atlantic rain forest of northeastern Brazil. Mycol Progress 10: 190-210.
6. CÁCERES, M. S., R. LÜCKING & G. RAMBOLD. 2008. Corticolous microlichens in northeastern Brazil: habitat differentiation between coastal Mata Atlantica, Caatinga and Brejos de Altitude. The Bryologist. 111(1): 1-20.
7. CUNHA, I. P. 2007. Fungos liquenizados do gênero Leptogium (Ascomycetes) no litoral sul do Estado de São Paulo. UNESP – Universidade Estadual Paulista Câmpus de Botucatu Instituto de Biociências. 114 pp.
8. ERIKSSON, O.E. (ed.). 2006. Myconet 12: 1-82. Acceso a internet en http://www.fieldmuseum.org/myconet/outline.asp en Diciembre 2010
9. FRISCH, A., K. Kalb & M. Grube 2006. Contributions towards a new systematics of the lichen family Thelotremataceae. Bibliotheca Lichenologica 92: 1-558.
10. KIRK, P.M., P.F. CANNON, J.C. DAVID & J.A. STALPERS. 2001. Dictionary of the Fungy. 9ª edition. Cabi Bioscience, Cambridge. 655 pp.
11. LAKATOS M., U. RASCHER & B. BÜDEL 2006. Functional characteristics of corticolous lichens in the understory of a tropical lowland rain forest. New phytologist 172: 679–695.
12. LÜCKING, R. & E. RIVAS PLATA. 2008. Clave y Guía Ilustrada para géneros de Graphidaceae. Glalia 1: 1-41.
13. LÜCKING, R., J.L. CHAVES, H.J.M. SIPMAN, L. UMAÑA, & A. APTROOT. 2008. A first assessment of the Ticolichen biodiversity inventory in Costa Rica: the genus Graphis, with notes on the genus Hemithecium (Ascomycota: Ostropales: Graphidaceae). Fieldiana (Botany), New series 46: 1-131.
14. LÜCKING, R., E. RIVAS PLATA, J. CHAVES, L. UMAÑA & H. J. M. SIPMAN. 2009. How many tropical lichens are there... really? Bibliotheca Lichenologica 100: 399-418.
15. LÜCKING, R., A. ARCHER & A. APTROOT. 2009 a. A Word-wide key to the genus Graphis (Ostropales: Graphidaceae). The Lichenologist 41(4):363-452.
16. MANGOLD, A., J. A. ELIX & H. THORSTEN LUMBSCH. 2008. Thelotremataceae. Flora of Australia 57: 195-420.
17. NASH III. 2008. Lichen Biology. Second Edition. Arizona State University. Cambridge University Press, Nueva York. 477 pp.
18. NOWAK, R & S. WINKLER. 1970. Foliicole Flechten der Sierra Nevada de Santa Marta (Kolumbien) und ihre gegenseitigen Bezieshungen. Plant Systematics and Evolution. 118. 5:456-486.
19. RANGEL-CH., J.O., P. D. LOWY-C & M. AGUILAR-P. 1997. Distribución de los tipos de vegetación en las regiones naturales de Colombia. En Rangel-Ch, O, P. D. Lowy-C y M. Aguilar-P. (Ed.). Colombia Diversidad Biótica II, Tipos de vegetación en Colombia. Instituto de Ciencias Naturales-Universidad Nacional de Colombia, Ministerio de Medio Ambiente, Bogotá D.C. 383-402.
20. RANGEL-CH., J.O. & J. CARVAJAL-COGOLLO. 2009. Clima de la Serranía de Perijá En: J. O. Rangel-Ch. (ed.). Colombia Diversidad Biótica VIII. Media y baja montaña de la Serranía del Perijá. Universidad Nacional de Colombia, Bogotá D.C. 3-49.
21. SIPMAN, H.J.M. 1984. Líquenes del transecto Buritaca-La cumbre. La Sierra Nevada de Santa Marta, Colombia. En: T. Van der Hammen & P. Ruiz (eds). Studies on tropical Andean ecosystems 2: 185-188.
22. SIPMAN, H.J.M. & R. C. HARRIS. 1989. Lichens. En: Lieth, H. & M. J. A. Werger (eds). Tropical rain forest ecosystems. Elsevier Science Publishers, Amsterdam. 302-308.
23. SIPMAN, H.J.M. 1996. Corticolous lichens. In: Gradstein SR, Hietz P, Lücking R, Lücking A, Sipman HJM, Vester HFM, Wolf JHD, Gardette E (eds) How to sample the epiphytic diversity of tropical rainforests. Ecotropica 2:66–67.
24. SIPMAN, H. J. M., W. HEKKING, J. AGUIRRE-C. 2008. Checklist of lichenized and lichenicolous fungi from Colombia. Instituto Ciencias Naturales. Facultad de Ciencias. Universidad Nacional de Colombia. Biblioteca José Jerónimo Triana N° 20, Bogotá D.C. 235 pp.
25. STAIGER, B. 2002. Die Flechtenfamilie Graphidaceae. Studien in Richtung einer natürlicheren Gliederung. Bibliotheca Lichenologica 85:1-526.
26. STAIGER, B. 2005. How to arrange the diversity of a tropical lichen family? Systematics and generic concepts in the lichen family Graphidaceae. Archives des Sciences 58: 53-62.














