Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.33 no.2 Bogotá Jul./Dec. 2011
Floral and reproductive biology of the "gulupa" Passiflora edulis Sims f. edulis
CATALINA ÁNGEL-COCA
GUIOMAR NATES-PARRA
RODULFO OSPINA-TORRES
CARLOS DANIEL MELO ORTIZ
MARISOL AMAYA-MÁRQUEZ
Departamento de Biología, Universidad Nacional de Colombia, Apartado 46527, Bogotá D. C., Colombia. lcangelc@unal.edu.co; mgnatesp@unal.edu.co; rospinat@unal.edu.co; cardaniel@gmail.com
Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Apartado 7495. Bogotá, D. C., Colombia. mamayam@unal.edu.co
RESUMEN
Se estudió la biología floral y reproductiva de Passiflora edulis f. edulis en cultivos ubicados en la Cordillera Oriental en los Andes colombianos (Buenavista, Boyacá). La flor presentó antesis entre las 6 y las 8 hrs, la longevidad floral promedio fue de 25 hrs. Se reconocieron cuatro fases fenológicas: (1) Femenina con hercogamia (2) Homógama con hercogamia (3) Homógama sin hercogamia y (4) Senescente. Aunque el estigma está receptivo durante todas las fases florales, se obtuvo mayor producción de frutos en las fases segunda y tercera. La donación del polen, en su mayoría ocurrió en la fase dos con una viabilidad del 96%. El néctar mostró una tendencia ascendente durante la vida floral. Los experimentos de polinización indican que la gulupa es una variedad altamente autocompatible, pero requiere de los polinizadores para producir una buena cosecha, pues sólo el 33% de los frutos se forma sin el acceso de éstos. Los resultados sugieren que la gulupa tiene una estrategia floral mixta con el potencial para promover endogamia y entrecruzamiento genético, y que la conservación de las abejas polinizadoras es crucial en la productividad de este frutal.
Palabras clave. Gulupa,Passiflora edulis f. edulis, Biología floral, Biología reproductiva, Servicio de polinización, Colombia.
ABSTRACT
The floral and reproductive biology of Passiflora edulis f. edulis was studied in crops located at the Cordillera Oriental in the Colombian Andes (Buenavista, Boyacá). The floral anthesis occurred between 6 and 8 hrs, and the average floral longevity was of 25 hrs. Four phenological flower phases were recognized: (1) Female with herkogamy, (2) Homogamy with herkogamy, (3) Homogamy with not herkogamy, and (4) Senescence. Although the stigmas were receptive during all floral phases, there was a higher fruit production from pollination carried out at the second and third phases. Pollen donation occurs at phase 2 with 96% of viability. The production of nectar showed an increasing tendency through the floral life. Pollination experiments showed that although P. edulis f. edulis is highly auto-compatible, it requires of pollinators to increase fruit harvesting, as indicated by the low percentage (33%) of fruits obtained without pollinators. Our results suggest that gulupa has a mixed reproductive strategy promoting endogamy in some floral phases while promoting crossing in others. The conservation of gulupa's pollinators in Buenavista is crucial to keep fruit production as a sustainable activity in the region.
Key words. Gulupa, Passiflora edulis f. edulis, Floral Biology, Reproductive Biology, Pollination service, Colombia.
Recibido: 17/02/2011
Aceptado: 08/09/2011
INTRODUCCIÓN
El éxito en la reproducción sexual de las plantas con flores se refleja en la cantidad y la calidad de la descendencia producida. Sin embargo, el proceso no es trivial, la producción de nuevos esporofitos en las plantas con flores implica complejas interacciones ecológicas entre las especies y el medio, las cuales se establecen a partir de la estructura, la fenología, y la fisiología de los vástagos reproductivos. Los rasgos y el funcionamiento de las flores e inflorescencias aunque están, en su mayor parte, determinados genéticamente son afectados por factores externos tales como: la región geográfica, la disponibilidad de parejas, de nutrientes, de agua, de polinizadores y de dispersores. De acuerdo con Dafni (1992) el sistema reproductivo de las especies de plantas puede variar a lo largo de gradientes altitudinales y ecológicos. Por lo tanto, el conocimiento de la biología floral y del sistema reproductivo de las plantas con flores es fundamental para su manejo local, en particular, es importante conocer las variaciones geográficas en el comportamiento reproductivo de especies promisorias con el fin de propagarlas y cultivarlas de manera óptima en diferentes regiones.
Numerosas plantas del género Passiflora L. producen frutos comestibles y se les denomina, en general, frutas de la pasión, siendo dentro de este grupo Passiflora edulis Sims la especie más importante y conocida (Ulmer & MacDougal 2004; Ocampo et al. 2007). Esta especie consiste de dos variedades: el maracuyá (Passiflora edulis Sims f. flavicarpa Degener) y la gulupa (Passiflora edulis Sims f. edulis), ambas muy apreciadas por sus frutos comestibles. La gulupa aunque es originaria de Brasil, actualmente se cultiva en regiones tropicales, subtropicales y templadas de: Sur América, Sur África, India, Malasia, Australia, Nueva Zelanda, Hawai, y Asia. La gulupa es la forma más tolerante al frío y se reproduce bien en elevaciones entre 600 y 2000 m (Cervi 1997; Ulmer & McDougal 2004), y es una variedad autocompatible (Moncur 1988; Bruckner et al. 1995), factores que, en parte explican el éxito de esta planta en su expansión geográfica. En Colombia fue introducida en el año 1950 y actualmente crece cultivada o de forma silvestre en las regiones Andina, Pacífica y Amazónica en un rango de elevación entre 1100 y 2750 m. Es conocida como gulupa en Cundinamarca y como curuba redonda en Antioquia, Caldas, Risaralda y Quindío (Ocampo et al. 2007). Se siembra en los municipios de La Mesa, Fusagasugá, Cachipay (Cundinamarca) y bajo invernadero en la sabana de Bogotá (Avendaño & Quevedo 1989), también en los departamentos del Huila, Caldas, Santander, Meta (Alméciga & Herrera 2008) y Boyacá.
El fruto comestible de la gulupa ha generado una demanda en los mercados internacionales, ocupando el tercer renglón dentro de las frutas exportadas de Colombia hacia el mercado europeo (Pinzón et al. 2007). Lo anterior ha despertado el interés por conocer la biología de esta planta con el fin de mejorar la producción en el país, pues a pesar de ser ésta una forma extensivamente cultivada, el conocimiento de su biología es escaso (Alméciga & Herrera 2008).
Existen numerosos estudios sobre la biología floral y reproductiva de P. edulis f. flavicarpa (Nishida 1958; Ruggiero et al. 1976; Hardin 1986; Endress 1994; Magalhães Souza et al. 2004; Viana et al. 2011 en prensa), pero existe menos información sobre estos aspectos en P. edulis f. edulis (Gilmartin 1958; Kishore et al. 2010), y en Colombia los estudios realizados son escasos (Girón van der Huck 1991). Estudios previos realizados en pasionarias indican que los polinizadores, y la biología floral y reproductiva de estas plantas varía con la ubicación geográfica, evidenciándose la labilidad del sistema incluso entre localidades separadas por pocos kilómetros de distancia (Free 1993; Holland & Lanza 2008). En Colombia, el gradiente altitudinal en el cual se cultiva la gulupa es muy amplio, pudiendo variar el comportamiento reproductivo de la planta y el tipo de polinizadores de acuerdo con las condiciones geográficas y ambientales.
Con el fin de optimizar la producción de gulupa en el municipio de Buenavista en Boyacá, en particular por ser éste un cultivo nuevo para la región, decidimos estudiar los aspectos básicos de su biología floral y reproductiva en cultivos locales. Las preguntas que guiaron la presente investigación fueron: (1) ¿Cuáles son las fases fenológicas y funcionales que experimentan las flores de la gulupa a lo largo de su vida floral? (2) ¿Requiere la gulupa de la polinización para la producción de frutos? Siendo una variedad autocompatible, cual es su dependencia de los polinizadores para la producción de frutos? (3) ¿Cómo es el patrón de producción de néctar en las flores de gulupa? (4) ¿Cuál es el grado de autocompatibilidad genética en la localidad estudiada? Estas preguntas fueron abordadas en el marco de la investigación: "Manejo de la polinización con abejas en cultivos de gulupa y granadilla" del Laboratorio de investigaciones en abejas (LABUN, Universidad Nacional de Colombia).
MATERIALES Y MÉTODOS
El estudio se realizó en el municipio de Buenavista en el departamento de Boyacá, Colombia, ubicado en las estribaciones occidentales de la cordillera Oriental. Se utilizaron dos cultivos de gulupa, el primero ubicado en la vereda Dominguito, (5°29'29" N-073°58'11" W a 1657 m (C1) con una extensión de 1 he., y el segundo en la vereda Sabaneta, 5°31'04,6" N-073°56'29,7" W a 2255 m (C2) con una extensión de 1.6 he. La toma de datos se llevó a cabo de mayo a octubre de 2009.
BIOLOGÍA FLORAL
Morfología floral. Las observaciones se hicieron directamente en el campo en plantas vivas, y se complementaron con observaciones de flores colectadas y fijadas en alcohol al 70% bajo el estereoscopio. La descripción siguió la terminología utilizada en botánica taxonómica.
Fenología floral. Las fases florales se caracterizaron con base en el estado sexual de la flor y en los cambios fenológicos evidentes con la edad floral. Se realizaron observaciones continuas desde el momento de la antesis floral hasta el cierre de la flor, registrando cambios en posición, tamaño y coloración de los verticilos florales y de la corona. Las observaciones se realizaron en C1 debido a la mayor cantidad de flores en este cultivo al momento de realizar las observaciones. Para ello se escogieron 15 flores de 15 plantas diferentes, marcadas individualmente desde el estado de botón floral. Las variables registradas en la flor fueron: fecha y hora de apertura, longevidad, diámetro de la flor, posición de los estigmas y de los estambres, distancia entre las anteras y los estigmas, y ángulo formado entre los estilos con relación al plano de la corona. Una vez establecidas las fases fenológicas se evaluaron las funciones sexuales y la producción de néctar en cada una de éstas. Para cada prueba se utilizaron grupos diferentes de flores. La función femenina se cuantificó con pruebas de receptividad del estigma, mientras que la función masculina se evaluó registrando el momento en que ocurría la dehiscencia de las anteras, y cuantificando la viabilidad del polen liberado por éstas.
Receptividad estigmática
Se realizaron tres pruebas de receptividad estigmática: una histoquímica y dos basadas en polinización manual midiendo la respuesta de las fases florales en términos de: (a) tubos polínicos germinados, y (b) desarrollo de frutos. Estas pruebas se realizaron en los dos cultivos.
Prueba de reacción a la peroxidasa: el método de la actividad de la enzima peroxidasa se realizó siguiendo a Osborn et al. (1998). La respuesta se consideró positiva cuando se formaron burbujas inmediatamente después de la inmersión (Fig. 1 A y B). Esta prueba se realizó con cinco flores de cada fase para un total de 20 flores muestreadas.
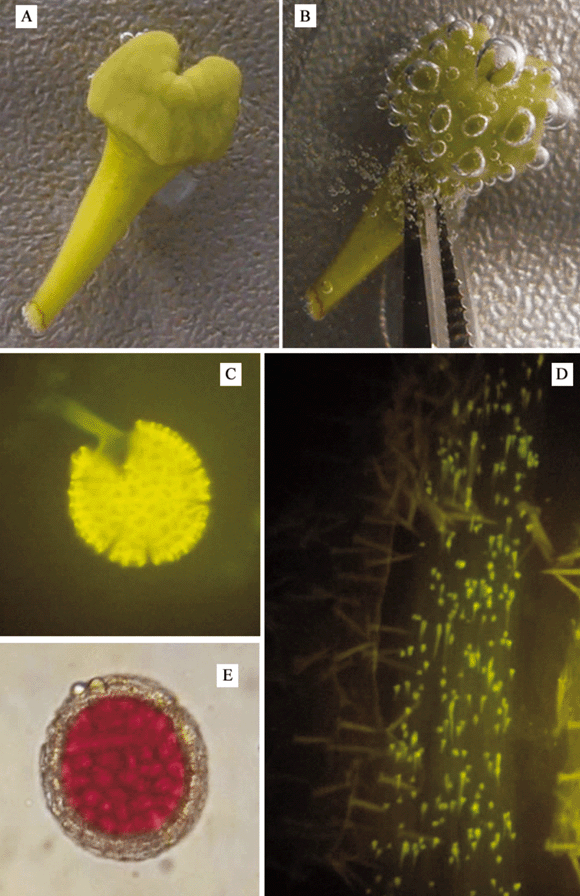
Prueba de crecimiento de tubos polínicos: Se polinizaron manualmente flores en cada fase floral con una mezcla de polen procedente de tres plantas parentales externas al grupo experimental Las flores estuvieron embolsadas con malla de nilón antes y después de efectuada la polinización manual; pasadas 24 horas se recogieron los estilos de las flores y se fijaron en FAA con el fin de utilizar el procedimiento descrito por Martin (1959) para observar los tubos polínicos al microscopio de epifluorescencia. Se contaron los tubos polínicos que hubieran alcanzado un desarrollo, al menos hasta la mitad del estilo (Fig. 1 C y D). Se examinaron los tres estilos de la flor en cinco flores de cada fase fenológica, para un total de 20 flores muestreadas.
Formación de frutos por polinización manual: se realizó polinización manual de la misma forma que en el caso anterior, las bolsas se retiraron después del cierre de la flor. Cinco días después se verificó la formación de frutos, y a los 2 meses se recogieron los frutos. Para esta prueba se utilizaron 20 flores por fase floral para un total de 80 flores muestreadas.
Viabilidad del polen. De cada flor se tomó una muestra de polen sobre una lámina y se tiñó con acetocarmín; luego se cubrió con una laminilla y se observó en el microscopio óptico. Se consideraron viables los granos enteros que tiñeron de rojo el citoplasma (Fig. 1 E). Se contaron 500 granos por flor en campos aleatorios siguiendo el procedimiento descrito por Dafni et al. (2005). Para esta prueba se escogieron cinco flores por fase floral, para un total de 15 muestras representativas de las tres últimas fases florales, puesto que en la primera fase floral las anteras no están dehiscentes.
Producción de néctar. A las flores se les extrajo el néctar hacia el final de cada fase floral, utilizando para ello capilares calibrados. Se midieron el volumen y la concentración del néctar, esta última con ayuda de un refractómetro de mano. Las flores, excepto al momento del muestreo, se mantuvieron embolsadas en malla de nilón para evitar que los visitantes florales afectaran la cantidad de néctar disponible. A partir de estos datos se calculó la producción de azúcar, mediante la ecuación de regresión exponencial de Galetto presentada en Galetto & Bernardello (2005):
y=0.00226+(0.00937x) + (0.0000585x2)
Donde: x= concentración del néctar
y= mg de azúcar por µL de néctar.
Para esta prueba se escogieron 15 flores por fase floral para un total de 60 flores muestreadas.
BIOLOGÍA REPRODUCTIVA
Con el fin de conocer los aspectos básicos de la biología reproductiva de P. edulis f. edulis se realizaron experimentos de polinización controlada evaluando el efecto de los diferentes tratamientos de polinización sobre la producción de frutos y semillas. Estas pruebas se llevaron a cabo en C2 debido a que en este cultivo existía mayor disponibilidad de flores en el momento de estudio. Los experimentos se llevaron a cabo en 90 flores pertenecientes a 15 plantas individuales. Se marcaron seis flores por planta para aplicar los siguientes tratamientos:
Tratamiento I (Agamospermia = A): se marcaron y se embolsaron flores desde el estado de botón floral, apenas abrieron se emascularon y se embolsaron nuevamente.
Tratamiento II (Polinización espontánea = PE): se marcaron y embolsaron flores desde el estado de botón evitando la visita de los agentes polinizadores.
Tratamiento III (Polinización natural = PN): se marcaron flores antes de la antesis y se dejaron expuestas a los polinizadores.
Tratamiento IV (Polinización natural con flor emasculada= PNE): se marcaron flores antes de la antesis, se retiraron los estambres al momento de la apertura floral y se dejaron expuestas a los polinizadores.
Tratamiento V (Autopolinización = AP): se marcaron y se embolsaron flores desde el estado de botón floral, se polinizaron manualmente con polen de la misma flor y se embolsaron nuevamente.
Tratamiento VI (Cruzada = PC): se marcaron y embolsaron botones florales; las flores se emascularon al momento de la apertura floral, volviéndose a embolsar hasta el momento de la polinización; el tratamiento se realizó con polen proveniente de cuatro plantas donantes. Una vez realizada la polinización la flor fue embolsada nuevamente.
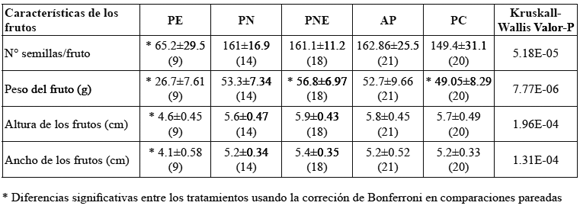
En los tratamientos que requerían polinización manual, ésta se realizó en la fase fenológica (F3) debido a que las pruebas preliminares de receptividad estigmática in vivo mostraron que en esta fase de desarrollo floral se forma la mayor cantidad de frutos. Cinco días después de aplicado el tratamiento de polinización se examinó la formación de fruto y dos meses después éstos se recogieron. A los frutos desarrollados se les midió el peso, el tamaño (la altura y el ancho) y se les contó el número de semillas.
Tratamiento estadístico. Se utilizó la prueba no paramétrica Kruskall-Wallis para comparar: (1) el número de tubos polínicos desarrollados por fase, (2) la duración de las fases fenológicas en los sitios de muestreo, y (3) las características de los frutos recogidos por tratamiento de polinización; en este último se utilizó la corrección de Bonferroni para hacer comparaciones pareadas múltiples. El nivel de significancia de las pruebas fue del 95%.
RESULTADOS
BIOLOGÍA FLORAL DE LA GULUPA
Morfología floral. Las flores de gulupa son perfectas y completas, están conformadas por ocho o nueve verticilos: cáliz, corola, androceo, gineceo, y entre cuatro y cinco verticilos de filamentos. El cáliz es pentámero, los sépalos son verdes en la cara abaxial y blancos en la cara adaxial, cada sépalo presenta un proceso unifacial en su cara abaxial el cual tiene apariencia de espina, tomando coloraciones verdes o rojizas. La corola es pentámera, los pétalos son blancos. Cáliz y corola descansan sobre un receptáculo floral en forma de copa, el cual tiene un tamaño de 1.3 X 1.2 cm. La corona está conformada por cientos de filamentos dispuestos en cuatro o cinco verticilos, los cuales representan extensiones del receptáculo, los filamentos de los dos verticilos externos son liguliformes de 2.7 cm de longitud, color púrpura en una longitud de 5 mm en la base del filamento el resto es homogéneamente blanco, creando en conjunto una imagen de dos anillos concéntricos diferencialmente coloreados; los verticilos internos están conformados por filamentos reducidos a procesos dentiformes que toman una coloración rojiza o violácea. El opérculo está situado en el interior del receptáculo debajo de la corona, consiste de una pequeña membrana circular lisa de 2 mm que cubre al nectario. La cámara nectarífera se encuentra por debajo del opérculo en la base del receptáculo. El androceo y el gineceo se encuentran sostenidos por un androginóforo. El androceo está conformado por 5 estambres libres; el filamento tiene 0.8 cm de longitud, es verde con puntos violeta, la antera oblonga es de 1 X 0.3 cm con dos tecas cada una, y dehiscencia longitudinal; la unión entre el filamento y la antera es dorsifija. El gineceo es trímero, paracárpico, con placentación parietal; el ovario es globoso, 0.6 X 0.4 cm; el estilo se divide en tres ramas estilares verdes, cada una llevando un estigma capitado de 0.5 cm de diámetro. El androginóforo tiene una longitud de 1.7 cm y es verde con máculas violáceas (Fig. 2).

Fenología floral. Las flores de la gulupa son diurnas, presentaron antesis entre las 6 y las 8 hrs. con una duración de alrededor de 25 hrs. (±7, n=15). La fase previa a la antesis floral se denominó F0 y corresponde al estado floral inmediatamente anterior a la apertura floral. Se reconocieron cuatro fases fenológicas y éstas fueron fácilmente identificables por los movimientos de: los sépalos los cuales abren, se reflectan y luego se cierran nuevamente; los estilos los cuales inician erectos y luego se recurvan hasta dejar los estigmas en la misma orientación de las anteras; y por la torsión de las anteras. Estos movimientos florales estuvieron asociados con cambios en las funciones sexuales de la flor, como se ilustra en la descripción de las fases florales. No se observaron cambios notables en la coloración, ni se detecto aroma en las flores desde la apertura hasta el cierre, excepto algunos cambios en coloración asociados al marchitamiento en la fase F4.
Fase F0: pre-antesis
El gineceo, el androceo, la corona, y la corola se encuentran totalmente cubiertos por el cáliz. En esta fase los sépalos convergen hacia el centro de la flor prácticamente tocándose por su margen, la distancia entre los procesos unifaciales entre sépalos opuestos está en el rango entre 0 y 1.7 cm. Las estructuras reproductivas no son visibles (Fig. 3A).

Fase F1: flor femenina con hercogamia
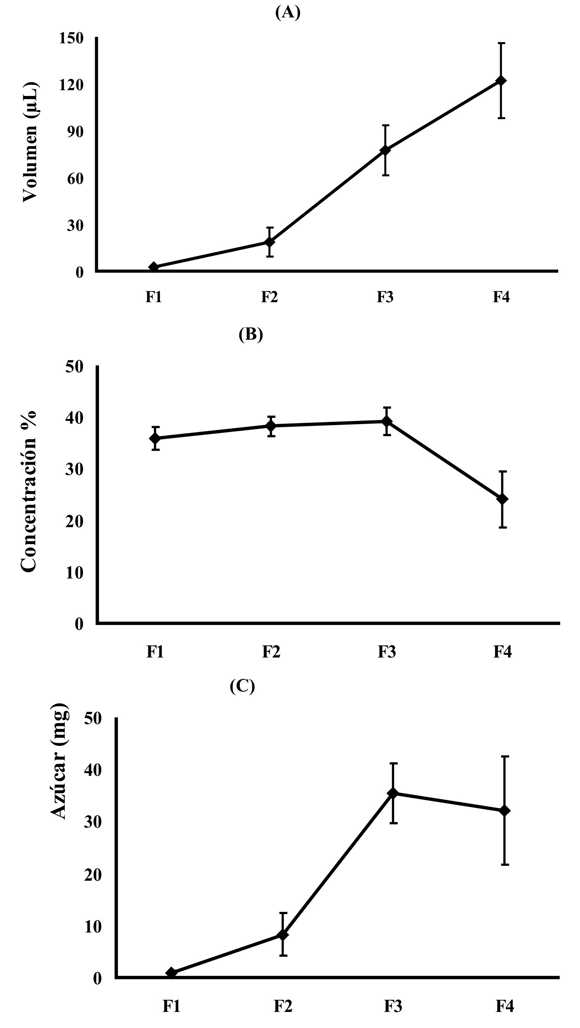
Esta fase tiene una duración de 29 min (±9, n=15), la flor inicia su apertura, la distancia entre los procesos unifaciales de los sépalos se incrementa paulatina y continuamente dejando a las estructuras reproductivas completamente expuestas al medio externo. Inicialmente los estilos están erectos y las anteras introrsas con la dehiscencia orientada hacia arriba, posteriormente esta orientación cambia 180º y la dehiscencia de las anteras queda orientada hacia la base de la flor. Los estilos a partir de una posición erecta en la cual forman un ángulo de 90º con respecto al plano de la corona, empiezan a inclinarse hasta alcanzar un ángulo aproximado de 40º (Fig. 3B). Durante esta fase la flor es funcionalmente femenina como lo evidencian las pruebas de receptividad realizadas en este periodo (Fig. 4A y 4B) y las anteras están indehiscentes. La fase termina cuando los sépalos alcanzan un ángulo de cero grados con respecto al plano de la corona En esta fase la flor inicia la producción de pequeñas cantidades de néctar (X= 2.37 µL ± 0.99, n=15) de concentración 35.9 % P/P (±2.2, n=15), con una producción total de azúcar de 0.97 mg (±0.38, n=15) (Fig. 6).
Fase F2: flor homógama con hercogamia
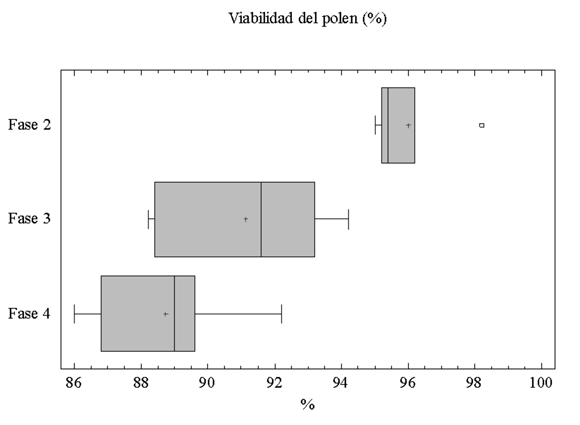
Esta fase tiene una duración de 182 min (±35, n=15) en la cual la flor alcanza su máxima apertura (diámetro floral X=6.6 cm ± 0,25; n=15). Los estigmas continúan receptivos (Fig. 4A y 4B) y los estilos continúan descendiendo; las anteras comienzan la donación de polen, el cual en su mayoría es viable (96 %) (Fig. 5). La corona floral se extiende en un plano horizontal mientras que los pétalos y los sépalos se reflectan acercándose al pedicelo, este último fenómeno aumenta la separación espacial entre los verticilos estériles y la corona. (Fig. 3C). Esta fase floral es homógama y presenta hercogamia, con una separación espacial entre estigmas y anteras (X = 0.9 cm ± 0.28, n=15). La producción de néctar en esta fase aumenta en volumen a 18.6 µL (±9.19, n=15), y en concentración a 38,2% P/P (±9.19, n=15), reflejándose en un incremento en la producción de azúcar (8.25 mg, ±4.63, n=15) (Fig. 6).
Fase F3: Flor homógama sin hercogamia
Este fase tiene una duración de 1039 min (±89, n=12); la hercogamia desaparece, los estigmas forman un ángulo de cero grados con respecto al plano de la corona y la distancia vertical entre estigmas y anteras es cero. De este modo los estigmas y las anteras toman la misma ubicación espacial, quedando orientados en el mismo plano e intercalados (Fig. 3D). Después de este momento se observó que en algunas flores los estigmas regresan a la posición erecta inicial. La fase femenina y masculina se presentan simultáneamente, pues el estigma continua receptivo (Fig. 4A y 4B) y el polen está disponible y viable en un 91% (Fig. 5). Hacia el final de la fase los sépalos comienzan a subir nuevamente hasta quedar en el plano horizontal de la corona. La producción de néctar que se acumula en esta fase es de 77.58 µL (±16.02, n=15), presentando un incremento neto de cuatro veces con respecto a la fase anterior, con una concentración de 39.2% P/P (±2.6, n=15). La flor produce la máxima cantidad de azúcar en esta fase (35.34 mg ±5.77, n=15) (Fig. 6). No todas las flores estudiadas evidenciaron el patrón anteriormente descrito, debido a que los estilos no descienden. Observaciones adicionales realizadas para evaluar la incidencia de este fenómeno, mostraron que el 13% de las flores tienen estilos que nunca descienden (n=60).
Fase F4: Flor senescente
Esta fase se caracteriza por el inicio de la senescencia floral, la cual se evidencia en el cierre de la flor, y por las señales de marchitamiento de los pétalos, los cuales se amarillean levemente. Los sépalos y los pétalos retornan a una posición erecta, manteniendo un ángulo positivo con relación al plano de la corona; los estigmas pueden quedar erectos o recurvados hacia abajo. A pesar de este proceso de marchitamiento floral la receptividad del estigma y la viabilidad del polen se mantienen (Fig. 4A, 4B, fig. 5). Las estructuras reproductivas están disponibles a los polinizadores por un corto tiempo, debido a que el cierre de la flor va impidiendo la entrada de los mismos (Fig. 3E y 3F). La producción de néctar en esta fase presenta un comportamiento contrastante en cuanto a los patrones de volumen y concentración, en los cuales pese al incremento de volumen a un valor de 122.05 µL (±23.96, n=15), la concentración baja a 24% P/P (±5,4, n=15), por lo tanto la producción de azúcar disminuyó en esta fase a 32.14 mg (±10.35, n=15) (Fig. 6).
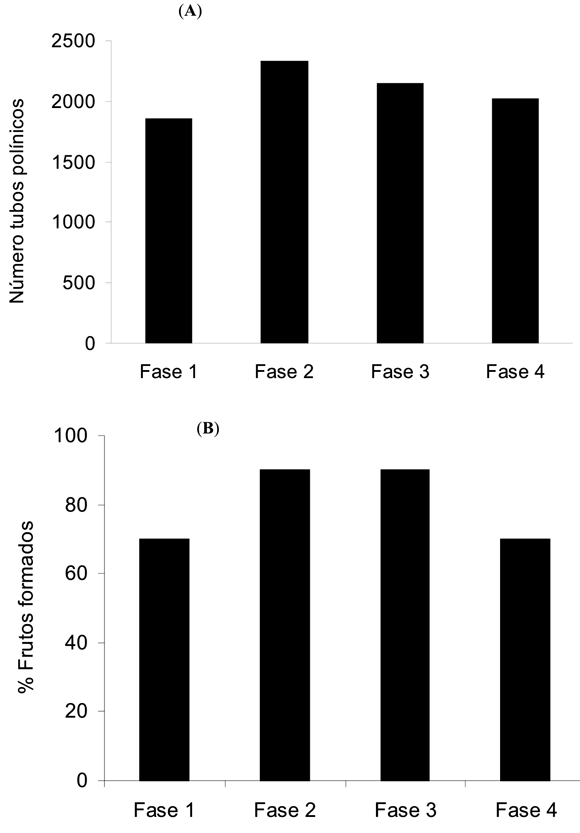
Receptividad estigmática. La prueba de la peroxidasa fue positiva en todos los casos indicando que los estigmas están receptivos desde la apertura floral hasta el cierre (n=20). Lo anterior se corroboró con el resultado obtenido en las otras dos pruebas de receptividad estigmática. Con la tinción fluorescente se observó la formación de tubos polínicos en todas las fases (Fig. 4A) y en la prueba de polinización in vivo también hubo formación de frutos como resultado de la polinización manual realizada en todas las fases fenológicas (figura 4B), aunque con una mayor formación de frutos en las fases 2 y 3 (Fig. 4B). No se encontraron diferencias significativas entre el número de tubos polínicos desarrollados por fase (K-W=0.881, n=20).
Viabilidad del polen. La viabilidad de los granos de polen varió en las diferentes fases fenológicas, siendo mayor en F2, seguida por F3 y F4 (Figura 5); estas diferencias fueron significativas (K-W=0.006; n=15).
BIOLOGÍA REPRODUCTIVA DE GULUPA
P. edulis f. edulis no formó frutos por agamospermia y sólo un 33% por polinización espontánea; los demás tratamientos mostraron un alto porcentaje de formación de fruto, siendo mayor en el tratamiento de polinización natural con flor emasculada (97%), seguido por los demás tratamientos (polinización natural, autopolinización y polinización cruzada) (93%) (Fig.7). No fue necesario calcular el índice de auto-compatibilidad porque la producción de frutos mayor al 90% en los experimentos de autopolinización evidenció una alta autocompatibilidad genética en la gulupa. No todos los frutos formados sobrevivieron hasta el momento de la recolección, debido al ataque de plagas de moscas y thrips. Se encontraron diferencias significativas en todas las características de los frutos formados por tratamiento (Tabla 1). Al realizar comparaciones pareadas por tratamientos usando la corrección de Bonferroni, se encontró que las diferencias encontradas en las variables número de semillas, ancho y alto de los frutos son causadas por los frutos formados en el tratamiento PE (Fig. 8C). El numero de semillas formadas por fruto en el tratamiento PE fue diferente del numero de semillas en los frutos formados en todos los demás tratamientos (Fig. 8A). El peso de los frutos formados en el tratamiento PE fue diferente del peso de los frutos formados en todos los demás tratamientos (Fig. 8B). También fue significativa la diferencia de peso entre los frutos formados en los tratamientos PNE y PC (Fig. 8B).
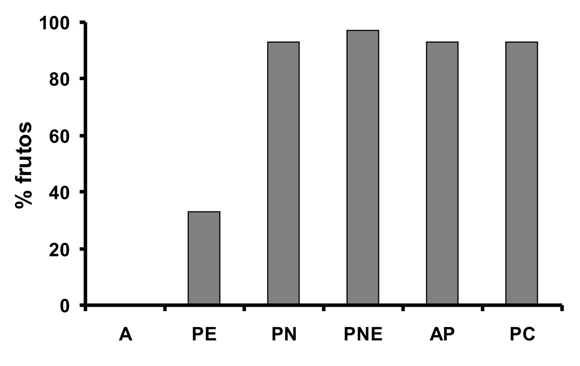
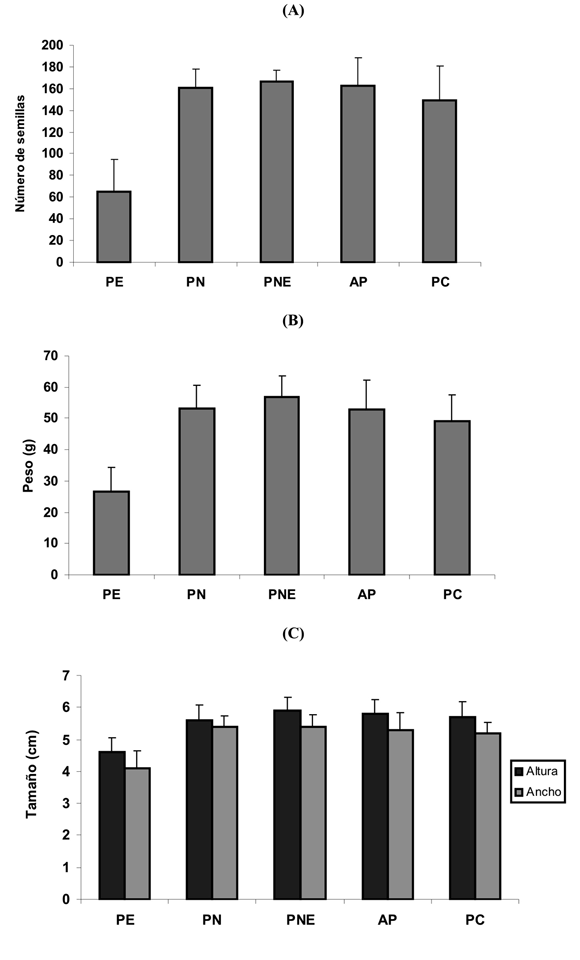
Tabla 1. Características de los frutos formados en diferentes tratamientos de polinización aplicados a Passiflora edulis f. edulis. Las cantidades indican la media y la desviación estándar, el tamaño de la muestra se señala entre paréntesis. PE = Polinización Espontánea, PN = Polinización Natural, PNE = Polinización Natural flor Emasculada, AP = Autopolinización, PC = Polinización Cruzada.
DISCUSIÓN
BIOLOGÍA FLORAL DE LA GULUPA
La flor de la gulupa (P. edulis f. edulis) exhibe rasgos florales que señalan alta especialización para la polinización por abejas grandes. Estos son: un gran tamaño (6.6 cm en su diámetro máximo), perianto blanco y corona conformada por filamentos blancos y púrpura en la base formando una guía circular que atrae y guía visualmente a los polinizadores al opérculo, duración floral de un día, producción de néctar abundante y en concentraciones entre 36-39% valores similares a los reportados para otras especies de Passiflora polinizadas por abejas (Koschnitzke & Sazima 1997), de difícil acceso gracias al opérculo que evita: el robo por parte de ladrones de néctar (Endress 1994; Tcherkez 2004) y el acceso a visitantes oportunistas. El conjunto de rasgos florales de la gulupa es coherente con el síndrome de polinización melitófilo (sensu Faegri & van der Pijl 1979; Proctor et al. 1996; Baker & Baker 1983), y la distancia entre el opérculo y las estructuras sexuales de la flor, sugiere que la gulupa ha evolucionado para ser polinizada por una o varias especies de abejas grandes. En efecto, durante el estudio de las flores in vivo fueron frecuentemente observadas visitas por parte de abejas grandes de los géneros Xylocopa y Epicharis, Apis mellifera, y colibríes. Medina (2009) provee datos específicos de la eficiencia de polinización efectuada por estos visitantes en la región de estudio, los cuales indican que las abejas grandes tienen una mayor eficiencia, así: Epicharis sp. (100%), Xylocopa (73%), mientras que Apis mellifera es eficiente en sólo un 53%, y los colibríes en un 8%. Sin embargo, en un estudio realizado en la India, el mejor polinizador de la gulupa fue la abeja melífera, pese a la existencia de abejas xilocopas en la región (Kishore et al. 2010). Una posible razón para explicar esta discrepancia podría encontrarse en el estudio comparativo de varias especies de Passiflora realizado por Koschnitzke & Sazima (1997) donde muestran como el tamaño del tipo de abeja polinizadora de las diversas especies de plantas, se correlaciona con la longitud del androginóforo (incluyendo la presencia de salientes y limen). Esto indica que si existe variación interpoblacional en el tamaño de las flores de la gulupa, ésta tendrá una mayor plasticidad ecológica para utilizar polinizadores de diferente tamaño. Los resultados son coherentes con una visión en donde las interacciones planta-polinizador altamente especializadas se reflejan en mosaicos ecológicos locales, de maneras muy diversas. Así, investigaciones con especies del género Passiflora realizados en regiones geográficas diferentes, han mostrado que la composición de polinizadores, e incluso la especie que funciona como polinizador principal cambia regionalmente (Holland & Lanza 2008; Kishore et al. 2010).
Las flores de la gulupa tuvieron una duración de 25 hrs., lo cual junto con los movimientos de las estructuras florales parece corresponder a una carga genética del género Passiflora, pues como lo ha señalado Endress (1994), todas las especies del género exhiben dichos movimientos. Las flores abrieron entre las 6 y las 8 hrs., datos muy similares a los obtenidos en los estudios de gulupa realizados en India en donde la mayoría de las flores abren entre las 6 y la 7 hrs. aunque allí el espectro en la hora de antesis es más amplio, ocurriendo desde las 5 hasta las 10 hrs. (Kishore et al. 2010).
En las dos primeras fases fenológicas correspondientes al 2% (F1) y al 12 % (F2) de la vida floral, las flores de la gulupa evitan la autopolinización, debido a que en F1 son funcionalmente femeninas y en F2 homógamas pero con hercogamia. En estas fases la flor produjo néctar para atraer a los polinizadores y se presentó un alto porcentaje de formación de frutos, señalando que las flores tienen la capacidad biológica para promover la reproducción xenógama. Sin embargo, debido a que en F1 y F2 los estilos no han alcanzado la curvatura ideal para la polinización, se requiere obtener información adicional sobre el comportamiento de los polinizadores en las flores en fase F1 y F2 y verificar si en condiciones naturales los estigmas de estas fases están recibiendo polen xenógamo por parte de sus vectores. En la fase F3 la flor es bisexual y no presenta hercogamia (Fig. 3D), produce la mayor cantidad de azúcar en el néctar (Fig. 6C) y tiene la mayor duración (71% de la vida floral); esta es la fase en que es más probable que el estigma entre en contacto con su propio polen, sin embargo esto no conduce a la interferencia sexual entre las gametas de la misma planta debido la alta autocompatibilidad mostrada por la gulupa (Fig. 7). En esta fase el comportamiento y tipo de polinizador pueden promover no sólo la autopolinización sino también la polinización cruzada.
Numerosas especies de pasifloras han desarrollado un sistema de polinización con abejas grandes (Janzen 1968; Corbet & Willmer 1980; Koschnitzke & Sazima 1997; Magalhães Freitas & Oliveira Filho 2001; Viana et al. 2007) las cuales usualmente tienen un rango de forrajeo mayor que las abejas pequeñas, pudiéndose desplazar distancias de varios kilómetros en sus rutas de recolección de alimento (Janzen 1971; Roubik 1989), y de acuerdo con Janzen (1968) el dorso de estas abejas puede contener polen de entre 25 y 50 flores donantes, lo cual permite pensar que la flor de la gulupa en fase F3 se beneficia de la visita de una abeja grande recibiendo cargas de polen propio y de diferentes donantes. En la F4, la flor comienza a cerrar, por lo que sus estructuras reproductivas no están expuestas por mucho tiempo (15% de la vida floral), sin embargo es factible producir frutos y la hercogamia puede o no ocurrir; también se mantiene el néctar como recompensa a los polinizadores, pero mucho más diluido. Esto quiere decir que la flor se mantiene fértil hasta el último momento, pudiendo aprovechar eventos de polinización que ocurran incluso en la fase de senescencia. Este comportamiento floral es entendible debido a la corta duración de la flor y a la alta necesidad de gametas masculinas para fecundar cientos de óvulos. La producción de néctar diluido en la fase de senescencia deja la incógnita sobre el valor funcional de este rasgo en las flores de gulupa y si existe otro grupo de organismos, diferente a los reportados en esta investigación que estén haciendo uso de dicho recurso.
Resultados similares a los hallados en esta investigación han sido reportados para P. suberosa, otra pasionaria autocompatible, en la cual la receptividad de los estigmas se presenta en todos los estados florales incluso antes que ocurra la dehiscencia de las anteras (Amela-García 2008) pero difieren de los estudios que reportan a P. edulis como protándrica (Cox 1957). Estudios fenológicos realizados en P. edulis f. flavicarpa han reportado una alta declinación de la receptividad femenina después de 2 hrs. de la antesis floral (Magalhães Souza et al. 2004), resultado que contrasta con nuestros hallazgos en P. edulis f. edulis, pues si bien registramos un óptimo de receptividad estigmática para las fases F2 y F3, en la F4 la cual ocurre 20 hrs. después de la antesis, muestra valores de receptividad estigmática aún muy altos, como lo evidencia la formación de frutos en 70% de las flores polinizadas en esta fase (Fig. 4B).
BIOLOGÍA REPRODUCTIVA DE LA GULUPA
La gulupa requiere de la polinización y la fecundación para reproducirse, pues no produce frutos por agamospermia (A) (Fig. 7). Es altamente autocompatible, y aunque es capaz de reproducirse por autopolinización espontánea, requiere de los vectores de polen para producir un mayor número de frutos, pues produjo sólo un 33% de éstos por polinización espontánea, mientras que en los tratamientos de polinización natural (PN y PNE) y polinización manual (PC) alcanzó una producción de frutos mayor al 93%. La ausencia de polinización mediada por un agente de polen no sólo afectó la cantidad de frutos formados, también disminuyó su calidad. Los frutos producidos por polinización espontánea (PE) presentaron menor número de semillas, menor peso, y menor tamaño (Fig. 8). Deginani (2001) ha argumentado que a pesar de la cercanía entre anteras y estigmas en alguna de las fases florales de las Passifloras la transferencia pasiva de polen es rara, posiblemente porque el grano de polen es pesado y pegajoso lo que le dificulta su transporte al estigma por viento, requiriendo de vectores animales para la producción de frutos de buena calidad. En Japón, en donde no existen los polinizadores naturales, se emplea la polinización manual (Ishihata 1991), práctica que genera costos adicionales de mano de obra a los productores. Los datos del peso de los frutos obtenidos por polinización cruzada manual (PC) y polinización natural de flores emasculadas (PNE ) indican que la participación de los polinizadores incrementa el peso del fruto (Tabla 1) puesto que en el tratamiento PNE las flores estuvieron expuestas a numerosas visitas por parte de los polinizadores, mientras que en PC la polinización se efectúo una sola vez. Este resultado indica que en el caso de la gulupa y en ausencia de sus polinizadores naturales, los costos por polinización manual serían aún mucho más altos pues las flores tendrían que ser polinizadas varias veces.
A pesar de que P. edulis f. edulis tiene flores especializadas para la polinización biótica, en condición silvestre puede afrontar restricciones para la reproducción sexual, pues siendo plantas trepadoras con distribución espacial dispersa, pueden más fácilmente afrontar la limitación de parejas para la reproducción xenógama y de polinizadores "ruteadores" que las visiten, esto último especialmente en especies de Passiflora que carecen de aroma floral para ser localizada por sus polinizadores. Bajo este escenario y con incapacidad de reproducción por agamospermia, el aseguramiento reproductivo por autopolinización espontánea, le permite a la gulupa producir al menos 1/3 de la descendencia potencial (Fig. 7), lo cual se torna en una gran adaptación de la planta para reproducirse incluso en ausencia de polinizadores. Con la presencia de polinizadores se incrementa dramáticamente la producción de frutos incluso en ausencia de parejas xenógamas, y si finalmente las condiciones son lo suficientemente beneficiosas para la planta, contando con otros individuos en el vecindario para la reproducción cruzada, se tiene el beneficio de incrementar la heterosis en la población.
Los resultados concuerdan con la hipótesis del aseguramiento reproductivo, la cual plantea que éste debe mantenerse en plantas que enfrentan limitaciones de polinizadores o de parejas para su reproducción (Darwin 1876). Los datos y la teoría en general apoyan la hipótesis que los autocompatibles son buenos colonizadores (Elle 2004), la gulupa es una planta introducida que actualmente crece silvestre, a diferencia del maracuyá, que es autoincompatible y excepcionalmente se encuentra fuera de los cultivos (Ocampo et al. 2007). Una de las ventajas de los autocompatibles es contribuir con dos copias de genes a cada generación producto de autogamia, comparado con una única copia que aportan los alogámicos a la siguiente generación (Fisher 1941) y que a partir de un único individuo se pueda formar una nueva población, sin embargo el costo de esta estrategia reproductiva, es la depresión por endogamia la cual puede disminuir la aptitud biológica de la planta de forma tan severa que muchos hermafroditas previenen la autopolinización mediante una variedad de mecanismos fisiológicos de autoincompatibilidad (Wilson & Harder 2003) o simplemente con mecanismos dicogámicos o hercogámicos. Estudios realizados en Clarkia xantiana señalan que el aseguramiento reproductivo es una estrategia adaptativa en respuesta a las probabilidades de reproducción cruzada de los individuos (Fausto et al. 2001). Esta es una hipótesis interesante para someter a prueba, en poblaciones silvestres de gulupa expuestas a servicios diferenciales de polinización, y evaluar si la respuesta poblacional de aseguramiento reproductivo funciona como una adaptación ecológica local y si tiene un componente genético. De acuerdo con lo expuesto anteriormente y siguiendo los criterios de Cruden & Lyon (1989) (cit. en Kearns & Inouye 1993) el sistema reproductivo de la gulupa sería xenógamo facultativo.
En el cultivo de gulupa estudiado, el 13% de las flores tuvieron estigmas que no se recurvan permaneciendo siempre erectos. Según los estudios de Ishihata (1991), estas flores no producen frutos, pero sí polen viable, funcionando así como flores funcionalmente masculinas y las de estigmas recurvados como hermafroditas, esto determina a la planta como funcionalmente andromonoica (May & Spears 1988). Con base en esto concluimos que la gulupa estudiada en los cultivos de Boyacá es 13% andromonoica, datos que ameritan profundizar el estudio de esta esterilidad femenina, evaluando si es un rasgo heredado genéticamente, su valor funcional, y su efecto en la productividad del cultivo.
Los resultados de la presente investigación deben ser incorporados a los planes de manejo regional del cultivo de gulupa en el municipio de Buenavista, porque evidencian que el 67% de la producción de frutos y la calidad de éstos, depende de los polinizadores. La producción de gulupa como una actividad de desarrollo regional, sostenible en el tiempo, requiere de la conservación y el buen manejo de sus polinizadores.
AGRADECIMIENTOS
A la Universidad Nacional de Colombia por la financiación de esta investigación (DIB: 8003251, QUIPU: 2002010011561); a Martha Bueno por su colaboración con el uso del laboratorio de citogenética para realizar las observaciones de los tubos polínicos; a Diego Giraldo-Cañas por la revisión del manuscrito y sus valiosas observaciones; a los agricultores y autoridades del municipio de Buenavista por su apoyo para la realización de esta investigación. Finalmente a cuatro evaluadores anónimos por sus valiosos comentarios al manuscrito.
LITERATURA CITADA
1. ALMÉCIGA, J.C. & E.G. HERRERA. 2008. Inventario preliminar de la entomofauna asociada al cultivo de gulupa (Passiflora edulis f. edulis Sims), en los municipios de Choachí y Ubaque, Cundinamarca, Colombia. Trabajo de grado. Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá, D.C. 1-45 pp. [ Links ]
2. AMELA GARCÍA, M.T. 2008. Breeding system and related floral features under natural and experimental conditions of Passiflora suberosa (Passifloraceae). Boletín de la Sociedad Argentina de Botánica 43: 83-93. [ Links ]
3. AVENDAÑO, J.C. & E. QUEVEDO. 1989. Análisis de la floración y fructificación bajo tres sistemas de soporte en la gulupa. Trabajo de grado. Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá, D.C. 5-15 pp. [ Links ]
4. BAKER, H. G. & I. BAKER. 1983. Floral nectar sugar constituents in relation to pollination type. En: Handbook of experimental pollination biology. Jones, C. E. & R. J. Little (Eds.). Van Nostrand Reinhold, Nueva York. 117-141 pp. [ Links ]
5. BRUCKNER, C.H., V.W.D. CASALI MOARAES, A.J. RAGAZZI & E.M.A. SILVA. 1995. Self-incompatibility in passion fruit (Passiflora edulis Sims). Acta Horticulturae 370: 45-57. [ Links ]
6. CERVI, A.C. 1997. Passifloraceae do Brasil: estudo do gênero Passiflora L., subgênero Passiflora. Cyanus, S. L., Madrid. 42-45 pp. [ Links ]
7. CORBET, S.A. & P.G. WILLMER. 1980. Pollination of the yellow passion fruit: Nectar, pollen and carpenter bees. Journal of Agricultural Science 95: 655-666. [ Links ]
8. COX, J.E. 1957. Flowering and pollination of the yellow passion fruit. Agricultural Gazette of New South Wales 68: 573-576. [ Links ]
9. CRUDEN, R.W. & D.L. LYON. 1989. Facultative xenogamy: examination of a mixed mating system. The Evolutionary Ecology of Plants. Bock, J. H. & Y. B. Linhart (Eds.). Westview Press, Boulder, Colorado. 171-207 pp. [ Links ]
10. DAFNI, A. 1992. Pollination Ecology: A Practical Approach. The Practical Approach Series. Rickwood, D. & B. D. Hames (Eds.). IRL Press. Oxford University Press Inc., Nueva York. 250 pp. [ Links ]
11. DAFNI, A., E. PACINI & M. NEPI. 2005. Pollen and stigma biology. En: Practical pollination biology. Dafni, A; P. G. Kevan & B. Husband (Eds.). Eviroquest Ltd., Cambridge, Ontario, Canadá. 83-146 pp. [ Links ]
12. DARWIN, C. 1876. On the Effects of Cross and Self Fertilization in the Vegetable Kingdom. John Murray, Londres. [ Links ]
13. DEGINANI, N.B. 2001. Las especies argentinas del género Passiflora (Passifloraceae). Darwiniana 39: 43-129. [ Links ]
14. ELLE, E. 2004. Floral adaptations and biotic and abiotic selection pressures. En: Plant adaptation: Molecular Genetics and Ecology. Cronk, Q. C. B. (Ed.). Ottawa. 111-116 pp. [ Links ]
15. ENDRESS, P.K. 1994. Diversity and evolutionary biology of tropical flowers. Cambridge University Press, Cambridge. 249-255 pp. [ Links ]
16. FAEGRI, K. & L. VAN DER PILJ. 1979. The principles of pollination ecology. Pergamon Press Ltd., Oxford. [ Links ]
17. FAUSTO, J.A. JR., V.M. ECKHART & M.A. GEBER. 2001. Reproductive assurance and the evolutionary ecology of self-pollination in Clarkia xantiana (Onagraceae). American Journal of Botany 88: 1794-1800. [ Links ]
18. FREE, J.B. 1993. Insect pollination of crops. Academic Press, Londres. 404-409. [ Links ]
19. FISHER, R.A. 1941. Average excess and average effect of a gene substitution. Annals of Eugenics 11: 53-63. [ Links ]
20. GALETTO, L. & G. BERNARDELLO. 2005. Nectar: 261-328. En: Practical pollination biology. Dafni, A; P. G. Kevan & B. Husband (Eds.) Eviroquest Ltd., Cambridge, Ontario, Canadá. [ Links ]
21. GILMARTIN, A. 1958. Post-fertilization, seed and ovary development in Passiflora edulis Sims. Tropical Agriculture-Trinidad 35: 41-58. [ Links ]
22. GIRÓN VAN DER HUCK, M. 1991. Biología floral de dos especies de pasifloras. Primer Simposio Internacional de Passifloras: memorias. 89-93 pp. Universidad Nacional de Colombia. Palmira. [ Links ]
23. HARDIN, C.L. 1986. Floral biology and breeding system of the yellow passion fruit, Passiflora edulis f. flavicarpa En: Proceedings of the Interamerican Society for Tropical Horticulture 30: 35-44. [ Links ]
24. HOLLAND, J.B. & J. LANZA. 2008. Geographic variation in pollination biology of Passiflora lutea (Passifloraceae). Journal of the Arkansas Academy of Science 62: 32-36. [ Links ]
25. ISHIHATA, K. 1991. Studies on pollen germination and tube growth from normal and upright style flowers in purple passion fruit Passiflora edulis Sims using various artificial media. Japanese Journal of Tropical Agriculture 35: 98-103. [ Links ]
26. JANZEN, D.H. 1968. Reproductive behavior in the Passifloraceae and some of its pollinators in Central America. Behaviour 32: 33-48. [ Links ]
27. JANZEN, D.H. 1971. Euglossine bees as long-distance pollinators of tropical plants. Science 171: 203-205. [ Links ]
28. KEARNS, C.A. & D.W. INOUYE. 1993. Techniques for pollination biologists. University Press of Colorado, Colorado. [ Links ]
29. KISHORE, K., K.A. PATHAK, R. SHUKLA & R. BHARALI. 2010. Studies on floral biology of passion fruit (Passiflora spp.). Pakistan Journal of Botany 42: 21-29. [ Links ]
30. KOSCHNITZKE, C. & M. SAZIMA. 1997. Biologia floral de cinco espécies de Passiflora L. (Passifloraceae) em mata semidecídua. Revista Brasileira de Botânica 20: 119-126. [ Links ]
31. MAGALHÃES FREITAS, B. & J. H. DE OLIVEIRA FILHO. 2001. Criação racional de mamangavas para polinização em áreas agrícolas. Banco do Nordeste. Fortaleza, Brasil. 96 pp. [ Links ]
32. MAGALHÃES SOUZA, M., T.N. SANTANA PEREIRA, A. PIO VIANA, M. GONZAGA PEREIRA, A. TEXEIRA DO AMARAL JÚNIOR & H. CHAGAS MADUREIRA. 2004. Flower receptivity and fruit characteristics associated to time of pollination in the yellow passion fruit Passiflora edulis Sims f. flavicarpa Degener (Passifloraceae). Scientia Horticulturae 101: 373-385. [ Links ]
33. MARTIN, F.W. 1959. Staining and observing pollen tubes by means of fluorescence. Stain Technology 34:125-128. [ Links ]
34. MAY, P.G. & E. SPEARS. 1988. Andromonoecy and variation in Phenotypic Gender of Passiflora incarnata (Passifloraceae). American Journal of Botany 75: 1830-1841. [ Links ]
35. MEDINA, J. 2009. Estudio de agentes polinizadores de gulupa Passiflora edulis f. edulis en dos cultivos a diferente altitud en Buenavista-Boyacá, Colombia. Trabajo de grado. Departamento de Biología, Universidad Nacional de Colombia. Bogotá, D.C. [ Links ]
36. MONCUR, M.W. 1988. Floral Development of Tropical and Subtropical Fruit and Nut Species. An Atlas of Scanning Electron Micrographs. CSIRO, Canberra. [ Links ]
37. NISHIDA, T. 1958. Pollination of passion fruit in Hawaii. Journal of Economical Entomology 51:146-148. [ Links ]
38. OCAMPO PÉREZ, O., G. COPPENS D'EECKENBRUGGE, M. RESTREPO, A. JARVIS, M. SALAZAR & C. CAETANO. 2007. Diversity of Colombian Passifloraceae: biogeography and an updated list for conservation. Biota Colombiana 8: 1-45. [ Links ]
39. OSBORN, N.M., P.G. KEVAN & M. LANE. 1998. Pollination biology of Opuntia polyacantha and Opuntia phaeacantha (Cactaceae) in southern Colorado. Plant Systematics and Evolution 159: 85-94. [ Links ]
40. PINZÓN, M., G. FISCHER & G. CORREDOR. 2007. Determinación de los estados de madurez del fruto de la gulupa (Passiflora edulis Sims). Agronomía Colombiana 25: 83-95. [ Links ]
41. PROCTOR, M., P. YEO & A. LACK. 1996. The Natural History of Pollination. Timber Press, Portland, Oregon. [ Links ]
42. ROUBIK, D.W. 1989. Ecology and Natural History of Tropical Bees. Cambridge University Press, Cambridge. 514 pp. [ Links ]
43. RUGGIERO, C., A. LAM-SANCHEZ & R. CARVALHO. 1976. Ocôrrencia de diferentes tipos de flores de maracujá amarelo (Passiflora edulis f. Flavicarpa Deg). Científica (Jaboticabal) 4: 82-86. [ Links ]
44. TCHERKEZ, T. 2004. Flower evolution of the floral Architecture of Angiosperms. Science Publishers, New Hampshire. [ Links ]
45. ULMER, T. & J. M. MACDOUGAL. 2004. Passiflora: passion flowers of the world. Timber Press Portland, Oregon. 69-70 pp. [ Links ]
46. VIANA, B.F., P.L.B. ROCHA, F.O. SILVA & A.M. KLEIN. 2007. Exploring causes of pollinator limitation of yellow passion fruit (Passiflora edulis Sims) in Northeast of Brazil. In: International Pollination Synposium, Ames, Iowa. 135-136 pp. [ Links ]
47. VIANA, B.F., A.M. ALMEIDA & F.O. SILVA. 2011. Polinização do maracujá-amarelo no semi-árido da Bahia. PROBIO. [ Links ]
48. WILSON, W.G. & L.D. HARDER. 2003. Reproductive uncertainty and the relative competitiveness of simultaneous hermaphroditism versus dioecy. The American Naturalist 162: 220-241. [ Links ]