Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Caldasia
versión impresa ISSN 0366-5232versión On-line ISSN 2357-3759
Caldasia v.33 n.2 Bogotá jul./dic. 2011
Interaction of flowers flies (Diptera: Syrphidae) and Salvia bogotensis (Lamiaceae) in the Botanical Garden of Bogotá (Colombia)
MÓNICA ZAMORA-CARRILLO
GERMÁN D. AMAT-GARCÍA
JOSÉ LUIS FERNÁNDEZ-ALONSO
Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá D.C., Colombia. mmzamorac@unal.edu.co
Grupo Insectos de Colombia, Instituto de Ciencias Naturales, Facultad de Ciencias, Universidad Nacional de Colombia, Apartado 7495, Bogotá D.C., Colombia. gdamatg@unal.edu.co
Real Jardín Botánico CSIC, Plaza de Murillo 2, 28014 Madrid, España. jlfernandeza@rjb.csic.es
RESUMEN
El objetivo de esta investigación fue describir la interacción entre Salvia bogotensis (Lamiaceae) y las moscas de las flores (Diptera: Syrphidae) en un ambiente urbano, el jardín botánico “José Celestino Mutis” (Bogotá D.C.). Una vez comprobada la existencia del síndrome de entomofilia, se caracterizó la morfología floral, la composición taxonómica, la riqueza y la abundancia de las especies de sírfidos identificadas como visitantes florales, así como la morfometría cefálica y bucal. S. bogotensis presenta el síndrome de la entomofilia con ausencia de autofecundación. La comunidad de sírfidos asociada con esta comprende nueve especies, agrupadas en cinco géneros. Las especies son Allograpta neotropica Curran, 1936, Allograpta exotica Wiedermann, 1830, Allograpta annulipes Macquart, 1850, Allograpta aenea Hull, 1937, Lejops mexicana Macquart, 1842, Platycheirus ecuadoriensis Fluke, 1945, Platycheirus fenestrata Macquart, 1842, Syrphus shoree Fluke, 1950 y Toxomerus sp.1. Las especies de moscas identificadas presentan en su conjunto características conductuales y morfológicas asociadas a polinizadores de baja eficiencia, con una baja tasa de visitas, incapacidad de activación de los balancines y un mínimo contacto corporal del insecto con las anteras y el estigma de la flor. Adicionalmente, las moscas presentan una carga muy baja de granos de polen de S. bogotensis sobre el cuerpo y alta inversión de tiempo en la limpieza de su cuerpo (acicalamiento). Las flores visitadas por estos insectos no dieron origen a frutos. Todo lo anterior permite concluir que dichas moscas no son polinizadores efectivos de S. bogotensis. Además de dípteros, se observaron varias especies de insectos visitantes florales de S. bogotensis pertenecientes a las familias Apidae, Halictidae y Megachilidae. Los sírfidos se benefician por el consumo de polen de S. bogotensis, pero no interfieren en el crecimiento y el desarrollo de la planta, por lo cual se infiere que la interacción entre las moscas de las flores y S. bogotensis es de tipo comensalismo.
Palabras clave. Comensalismo, Diptera, Lamiaceae, moscas de las flores, polinización, Salvia bogotensis, Syrphidae.
ABSTRACT
The goal of this research was to describe the biological interaction between Salvia bogotensis (Lamiaceae) and the flower flies (Diptera:Syrphidae) in an urban setting, the Jardín Botánico “José Celestino Mutis” (Bogotá DC). After verifying the existence of the entomophily syndrome, the following aspects were studied: floral morphology, taxonomic composition, richness and abundance of syrphid species identified as flower visitors, and their cephalic and oral morphometry. S. bogotensis presents entomophily syndrome with absence of selfing. The Syrphid community associated with S.bogotensis included the following nine species in five genera: Allograpta neotropica Curran, 1936, Allograpta exotica Wiedermann, 1830, Allograpta annulipes Macquart, 1850, Allograpta aenea Hull, 1937, Lejops mexicana Macquart, 1842, Platycheirus ecuadoriensis Fluke, 1945, Platycheirus fenestrata Macquart, 1842, Syrphus shoree Fluke, 1950 and Toxomerus sp. 1. The species of flower flies (Syrphidae), as a whole, showed behavioral and morphological characteristics associated with low-efficiency pollinators, with a low rate of visits, inability for activation of levers staminal and minimal contact insect body with the anthers and stigma of the flower. Additionally, the flies showed a very low load of pollen grains of S. bogotensis in the body, and with high investment of time in cleaning its body (grooming). Flowers visited by these flies did not result in fruit. These results suggest that flower flies do not effectively participate in the pollination of S. bogotensis. Other insect visitors that might be responsible for the pollination of S. bogotensis were species of the families Apidae, Halictidae, and Megachilidae. Flower flies feed on the pollen of S. bogotensis but do not interfere with growth and plant development, indicating a commensalistic relationship with S. bogotensis.
Key words. Comensalism, Diptera, Lamiaceae, flowers flies, polinization, Salvia bogotensis, Syrphidae.
Recibido: 14/01/2011
Aceptado: 03/07/2011
INTRODUCCIÓN
Entre los aspectos más importantes que regulan la polinización de las plantas bajo condiciones de síndrome entomofílico se cuentan: 1) la morfología y morfometría floral, 2) la morfología y morfometría de las piezas bucales y otras estructuras anatómicas de los polinizadores, 3) la composición, riqueza y abundancia de los polinizadores, 4) el comportamiento de los polinizadores (Barret et al., 1997, Goulson & Wright, 1998, Dudareva & Pichersky, 2006 y Geber & Moeller, 2006). Estos caracteres permiten reconocer la condición de polinizador de los visitantes florales, su eficiencia como vector de polen y el tipo de interacción entre la planta y el insecto (Goulson & Wright, 1998).
Debido a las visitas florales de los insectos se posibilitan interacciones biológicas, como son, por ejemplo, mutualismos, comensalismos o antagonismos (Lunau, 2004). Las plantas benefician a los insectos por sus visitas ofreciéndoles recursos (néctar, polen, alimento para estados inmaduros) y/o servicios (sitios de cópula o hábitat), mientras que el insecto puede beneficiar a la planta en su condición de vector de polen y/o como enemigo natural de un insecto que afecte el crecimiento de la planta hospedera (Muñoz, 2005).
Salvia bogotensis Benth. es una especie endémica de la Cordillera Oriental colombiana de la familia Lamiaceae. Entre sus estructuras responsables de la reproducción llaman la atención los estambres provistos de balancines (palancas estaminales), que sugieren procesos de polinización especializados (Fernández-Alonso 1995). Las flores de las salvias de la Cordillera Oriental de Colombia son visitadas por aves (Trochilidae), mariposas (Lepidoptera), abejas y abejorros (Hymenoptera) y moscas de las flores (Diptera: Syrphidae) (Fernández-Alonso, 2008); estas últimas han sido poco estudiadas en su papel de polinizadores, en comparación con especies del orden Hymenoptera. Las moscas de las flores pertenecen al orden Diptera, suborden Brachycera, familia Syrphidae. Esta familia cuenta con cerca de 6000 especies agrupadas en tres subfamilias: Microdontinae, asociada con depredación de hormigas; Eristalinae y Syrphinae, cuyas especies son polinizadoras y en su estado larvario son descomponedoras de la materia orgánica o enemigos naturales de insectos (Schneider, 1969, Thompson, 1999, Sadeghi & Gilbert, 2000 y Rojo et al.2003). Debido a la gran diversidad en los hábitos alimenticios, las especies de Syrphidae son consideradas como indicadores ambientales (Castella & Speight, 1996 y Sommagio, 1999).
Salvia bogotensis reviste hoy gran interés por su gran potencialidad en la industria de fármacos, ya que cuenta con un complejo de lectinas que son sustancias similares al Tn-antigeno, empleadas en el diagnóstico del cáncer (Barroso et al., 2005, MADR, 2007). Según el programa "Iniciativa Internacional para la conservación y uso sostenible de los polinizadores" de la FAO, los estudios de relaciones biológicas permiten tener bases para la conservación de los polinizadores, los cuales se han visto afectados en cuanto a su riqueza y abundancia debido a las actividades humanas (FAO, 2010). Muchas especies de moscas de las flores se han adaptado exitosamente a los ambientes intervenidos (Arrignon et al., 2007). Por todo lo anterior, la asociación S. bogotensis-moscas de las flores merece abordarse para conocer aspectos ecológicos de la interacción y comprobar la efectiva participación de estos insectos en los procesos reproductivos de S. bogotensis, establecida en un ambiente urbano como el jardín botánico "José Celestino Mutis".
MATERIALES Y MÉTODOS
Este estudio se realizó en el jardín botánico "José Celestino Mutis", ubicado a 2551 m de altitud en la ciudad de Bogotá, a 4º 40' Norte y 74º 06' Oeste. La investigación comprendió las siguientes etapas: 1) síndrome de entomofilia, 2) reconocimiento taxonómico de las especies de Syrphidae que visitan las flores, 3) número de las visitas florales, 4) Caracterización de la inflorescencia, la flor y el grano de polen de S. bogotensis, 5) morfometría de cabeza y piezas bucales de Syrphidae, 6) actividades en la flor, 7) formación de frutos y cargas polínicas y 8) efecto de vecindad.
1) Síndrome de entomofilia: este ensayo se realizó en plantas propagadas por semilla. Antes de iniciar la prueba, se aseguró que las plantas tuvieran el vigor para la formación de semillas mediante pruebas artificiales de polinización. El primer tratamiento correspondió a plantas en presencia de insectos polinizadores y el segundo a plantas en ausencia de los mismos, lo cual se garantizó mediante el uso de bolsas de tela. Por cada tratamiento se emplearon tres plantas y en cada planta se le hizo seguimiento a tres inflorescencias para un total de 820 flores evaluadas en el primer tratamiento y 760 flores evaluadas en el segundo tratamiento. El porcentaje de formación de frutos (FF) se estimó dividiendo el número de flores que presentaron formación de frutos (NF) entre el número de flores totales (FT). (FF=(NF/FT)*100). La comparación estadística entre tratamientos se realizó mediante la prueba de Mann - Whitney. Anterior a este ensayo se realizaron dos ensayos en macetas y en suelo y se observó que solo las flores polinizadas artificialmente de las inflorescencias cubiertas con bolsas de tela, presentaron formación de fruto con lo cual primero se descartó un sistema reproductivo autogamo y/o apomictico y segundo se concluyó que otros pequeños insectos que entran a la bolsa como trips o cucarrones (coccinalidae) no actúan como agentes polinizadores.
2) Reconocimiento taxonómico de las especies de Syrphidae: se realizaron capturas manuales de individuos de Syrphidae visitantes de las plantas de S. bogotensis durante un lapso de diez días desde las 8 am hasta las 10 am y por cada hora se realizaron 12 observaciones por planta en lapsos de cinco minutos. Los individuos colectados se introdujeron en viales con etanol al 70% y se llevaron al laboratorio para el reconocimiento taxonómico de géneros y especies basado en Carver y Thompson (2003) y Carrejo et al. (2006). Se montaron en seco individuos de las especies encontradas y se depositaron en la colección entomológica del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, sede Bogotá (ICN-048905 a ICN-048931).
3) Número de las visitas florales: se realizaron premuestreos durante 10 días para determinar y codificar los comportamientos del insecto en la flor y para estandarizar los protocolos. Luego se realizaron 3920 observaciones para evaluar la presencia o ausencia de los visitantes florales pertenecientes a Syrphidae mediante evaluaciones desde las 8 am hasta las 10 am y por cada hora se realizaron 12 observaciones. Cada observación se realizó cada cinco minutos. Con estos datos se determinaron las tasas de visitas por especie de sírfido.4) Caracterización de la inflorescencia, la flor y el grano de polen de S. bogotensis: a partir de 50 flores se tomaron medidas de longitud (desde la base de la flor hasta el punto en donde se bifurca la corola) y ancho de la apertura floral. Posteriormente, se realizó una descripción de la inflorescencia, la flor y el grano de polen. Para la descripción de los granos de polen mediante la metodología del ICN a 10 unidades se les evaluó tipo de grano, polaridad, simetría, tipo de abertura, tipo de ámbito, tipo de exina, longitud del eje ecuatorial, longitud del eje polar, longitud del lado apocólpico y longitud de exina total.
5) Morfometría de cabeza y piezas bucales de especies de Syrphidae: tomando 41 ejemplares de Syrphidae se midió la anchura del tagma cefálico. Para la medición de la probóscide, con el uso de reglilla, se extrajo el aparato bucal con previo aclaramiento en KOH. Los datos morfométricos de las flores y de los insectos posteriormente se discutió con los datos tomados en campo sobre la capacidad de activación de los balancines y consumo de néctar por parte de los sírfidos. Si el tamaño del aparato bucal no es superior a la profundidad de la corola y/o el tamaño del tagma cefálico menor a la apertura floral esto explica el no consumo de néctar y la no activación de los balancines, lo cual es uno de los aspectos que permite entender si los insectos de la familia Syrphidae actúan como vectores del polen teniendo en cuenta que los polinizadores eficientes producen activación de estos balancines. Esta información se analizó estadísticamente mediante la prueba t-student a las especies que presentaron mínimo cuatro individuos durante el tiempo de muestreo y en general a la familia.
6) Actividades en la flor: la frecuencia absoluta de cada una de las actividades del visitante floral (FC) se estimó como el número de veces que se observó cada uno de los comportamientos registrados en el apartado tres.
7) Formación de frutos y cargas polínicas: para medir el porcentaje de formación de frutos se extirparon las flores y frutos, formados o en formación, de cuarenta inflorescencias correspondientes a cuatro plantas mediante unas pinzas, luego se cubrieron con bolsas de tela y después de una semana se retiraron para su exposición a las visitas de Syrphidae. Durante 20 días se realizaron observaciones desde las 8 hasta las 10 am y las flores que fueron visitadas se marcaron con tinta indeleble, se cuantificaron y la inflorescencia se cubrió nuevamente con la bolsa de tela. En total, se evaluaron 58 visitas. Para el reconocimiento y estimación de las cargas polínicas efectivas, se tuvo en cuenta el protocolo del Laboratorio de Palinología del Instituto de Ciencias Naturales (ICN) de Colombia. Para tal fin, se recolectaron 55 individuos correspondientes a 9 especies, cada uno en un eppendorf de 1,5 mm con etanol al 70%. Al cabo de una semana se retiraron los individuos, se realizó centrifugación al eppendorf con alcohol a 4500 rpm durante cinco minutos, luego se aplicaron dos gotas de glicerina a cada eppendorf, con posterior exposición en un estufa a 55 ºC. Posteriormente, se procedió al montaje, tinción, identificación y conteo de los granos de polen de S. bogotensis y granos de otras familias, bajo microscopio óptico, teniendo en cuenta la previa descripción del grano de polen realizado en la etapa cuatro. Se usó como testigo el contenido estomacal de varios sírfidos visitantes.
8) Efecto de vecindad: para evaluar el efecto de plantas aledañas en floración (PF) los días en los cuales se tomaron los datos sobre la tasa de visitas florales a S. bogotensis, se registró la presencia de éstas para determinar si la floración de plantas aledañas incrementa el número de visitas y especies visitantes de Syrphidae a S. bogotensis. Para estimar el efecto de plantas aledañas en floración, se emplearon los datos cuando hubo floración (FA) y cuando no hubo floración en plantas aledañas (SA), (PF=FA-SA). Para analizar la información se aplicó la prueba no paramétrica de Mann-Whitney para determinar la existencia de diferencias significativas entre la frecuencia de visitas florales a S. bogotensis en presencia y ausencia de floración de plantas aledañas.
RESULTADOS
1) Prueba para síndrome de entomofilia: Las flores de las inflorescencias visitadas por insectos, correspondientes al tratamiento en presencia de insectos, tuvieron un 13,98% de formación de frutos, mientras tanto que aquellas en las que se impidió el acceso de polinizadores presentaron aborto floral. La diferencia en formación de frutos entre estos dos tratamientos es significativa (Prueba de Mann- Whitney H=0, p<0,05). Las familias de insectos que se observaron, junto a Syrphidae, fueron Apidae, Halictidae y Megachilidae.
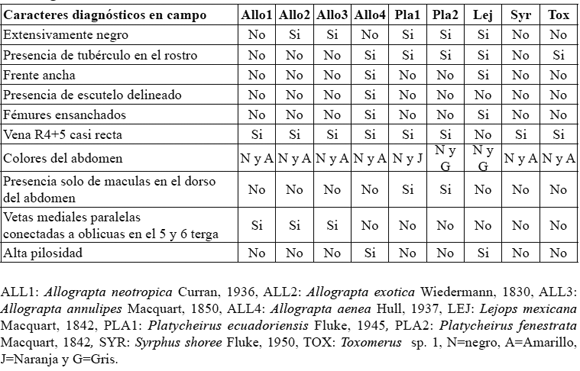
2) Reconocimiento taxonómico de las especies de Syrphidae: la comunidad de sírfidos asociada a S. bogotensis está compuesta por nueve especies agrupadas en cinco géneros. Las especies son Allograpta neotropica Curran, 1936, Allograpta exotica Wiedermann, 1830, Allograpta annulipes Macquart, 1850, Allograpta aenea Hull, 1937, Lejops mexicana Macquart, 1842, Platycheirus ecuadoriensis Fluke, 1945, Platycheirus fenestrata Macquart, 1842, Syrphus shoree Fluke, 1950 y Toxomerus sp. 1 (Tabla 1 y Figura 1).
Tabla 1. Caracteres diagnósticos para la identificación de las especies de Syrphidae visitantes de S. bogotensis.

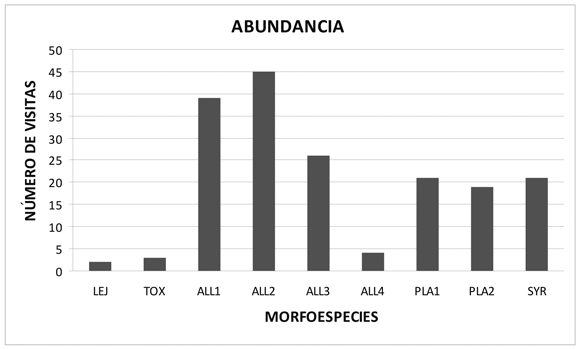
3) Número de visitas florales: las especies que presentaron mayor frecuencia de visitas florales correspondieron al género Allograpta Osten Sacken (ALL1, ALL2, ALL3 y ALL4) en un 63.33%, seguidas de los géneros Platycheirus Lepeletier (PLA1, PLA2) en un 22.22%, Syrphus Fabricius (SYR) en un 11.7%, Toxomerus Macquart (TOX) en un 1.67% y Lejops (Asemosyrphus) (LEJ) en un 1.11% (Figura 2).
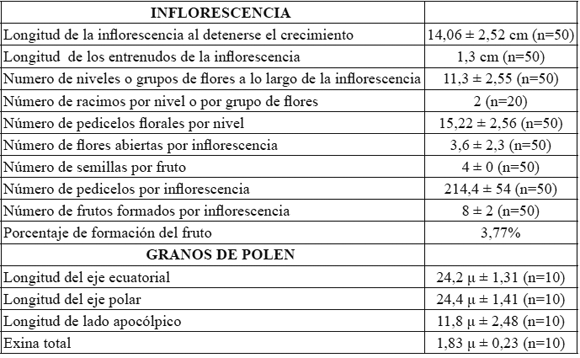
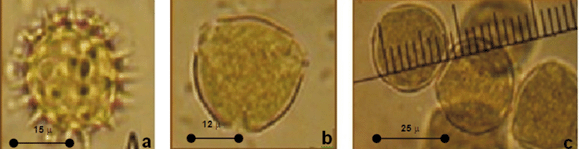
4) Caracterización de la inflorescencia, la flor y el grano de polen de S. bogotensis: S. bogotensis se propaga sexualmente por semilla y asexualmente por acodo (Figura 3a y 3b). Posee inflorescencias indeterminadas de tipo verticilastro con flores agrupadas en dos grupos cada 1,3 cm en promedio (n=50) a lo largo de la inflorescencia (Figura 3e, tabla 2); las flores tienen guías de néctar (Figura 3c), son de color azul-violáceo, hermafroditas, zigomorfas; el cáliz es pubescente y bilabiado, posee cinco pétalos soldados, connados; el labio inferior se dispone hacia abajo y hacia afuera y está formado de tres lóbulos y el labio superior se extiende hacia arriba y se arquea en forma de casco o galea compuesto de dos lóbulos; este último tiene vellosidades en la superficie externa, en donde quedan los granos de polen que traen diferentes visitantes florales, poseen hercogamia, las anteras están cubiertas por el labio superior de la corola. Los estambres están reducidos a dos, son fértiles y tienen balancines estaminales (Figura 3d), que se dirigen en dirección contraria al gineceo cuando son activadas por los insectos. El ovario es súpero, de dos carpelos soldados con cuatro cavidades, con un óvulo basal cada uno. El estilo es ginobásico, que nace de la base y entre los lóbulos del ovario; el estigma se encuentra por fuera del labio superior y se ramifica en dos partes, una larga excerta al labio superior de la corola y otra más corta en dirección contraria a la primera; en la base del ovario se encuentran los nectarios; el fruto es un tetraquenio con cuatro semillas. El grano de polen de S. bogotensis posee las siguientes características: es de tipo mónada, isopolar, radiosimétrico, con tipo de abertura estefanocolpado, ámbito circular, exina microreticulada y tectada. Posee 24,2 μµ ± 1,31 (n=10) de longitud del eje ecuatorial y 24,4 μµ ± 1,41 (n=10) longitud del eje polar (Figura 3f, 3g y tabla 2).
Tabla 2. Caracteres cuantitativos de la inflorescencia y del grano de polen en S. bogotensis.

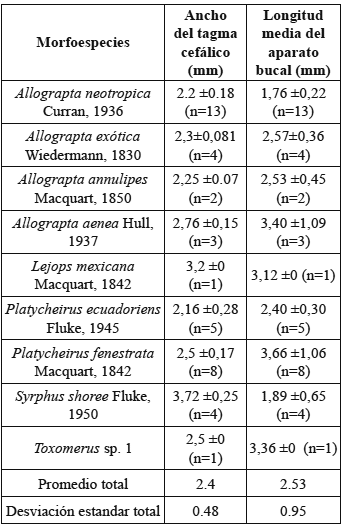
5) Morfometría de cabeza y piezas bucales de Syrphidae: se observó en estos insectos restricciones en el consumo de néctar debido a que la longitud del aparato bucal 2.53 ±0.95 mm (n=41) es menor que la profundidad de la corola 7.36 ± 0.56 mm (n=50) lo cual se cumplió para cada una de las especies (Prueba t-student familia syrphidae t=-208.45 p<0,01, Prueba t-student Allograpta neotropica Curran, 1936 t=-330.909 p<0,01, Prueba t-student Allograpta exotica Wiedermann, 1830 t=-53.22 p<0,01, Prueba t-student Platycheirus ecuadoriensis Fluke, 1945 t=-82.66 p<0,01, Prueba t-student Platycheirus fenestrata Macquart, 1842 t=-27.92p<0,01, Prueba t-student Syrphus shoree Fluke, 1950 t=-33.66 p<0,01) y la anchura del tagma cefálico 2.4 ± 0.48 mm (n=51) es mayor que la anchura de la apertura floral 2.2 ± 0.4 mm (n=50) (Prueba t-student familia Syrphidae t= 31.40 p<0,01, Prueba t-student Allograpta neotropica Curran, 1936 t=2.88 p<0,01, Prueba t-student Allograpta exotica Wiedermann, 1830 t=4.93 p<0,01, Prueba t-student Platycheirus ecuadoriensis Fluke, 1945 t=8.51 p<0,01, Prueba t-student Platycheirus fenestrata Macquart, 1842 t=14.11 p<0,01, Prueba t-student Syrphus shoree Fluke, 1950 t=24.32 p<0,01) (Tabla 3). El hecho de que estos insectos tengan restricciones en cuanto al consumo del néctar los imposibilita para activar los balancines, los cuales son el mecanismo mediante el cual esta planta adhiere el polen a los insectos para que pueda ser llevado a otras plantas.
Tabla 3. Morfometría del aparato bucal de las especies de sírfidas visitantes de S. bogotensis.
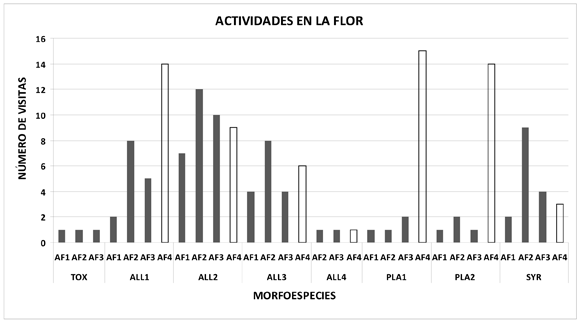
6) Actividades en la flor: las actividades de los sírfidos observadas sobre flores de S. bogotensis fueron las siguientes: 1) el insecto se posa en el labio superior de la corola y consume polen presente en las vellosidades de la corola (CF1), observado en el 12% de todas las visitas registradas; 2) el insecto consume polen de las vellosidades de la corola y posteriormente consume polen directamente de las anteras (CF2), observado en un 28% de todas las visitas registradas; 3) el insecto se aproxima a las guías del néctar y luego consume polen de las anteras (CF3), en un 19% de todas las visitas, y 4) el insecto se posa en la flor y consume polen directamente de las anteras (CF4), en un 1,3%. En todas las morfoespecies de sírfidos se observaron restricciones en la toma de los recursos florales (CF1, CF2 y CF3) (Figura 4, figura 5).

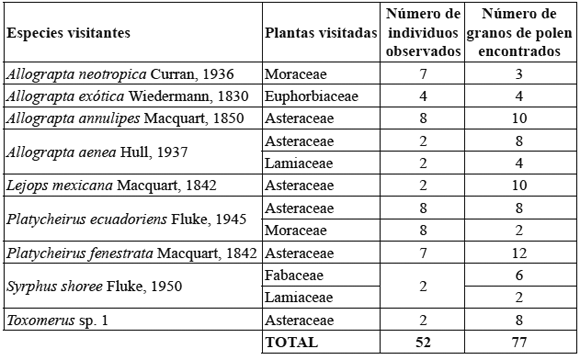
7) Formación de fruto y cargas polínicas: las flores visitadas por insectos de la familia Syrphidae no presentaron formación de fruto y se encontró una carga de polen de S. bogotensis muy baja (6 granos en 52 insectos observados); sin embargo, se observó polen de otras familias de plantas sobre estos insectos (Tabla 4 y Figura 6).
Tabla 4. Especies de sírfidos visitantes, espectro de plantas visitadas y densidad de cargas polínicas.
8) Efecto de vecindad: Durante la floración de Acaciella holtonii Britton & Killip, Dodonea viscosa (L.) Jacq. y Cleome anómala L., la tasa de visitas florales y riqueza promedio de las moscas de las flores asociadas a S. bogotensis fue mayor que en los días en los cuales estas plantas no se encontraban en floración. Según el análisis estadístico se presentaron diferencias en la tasa de visitas (Prueba de Mann- Whitney U=0 P<0.005) y en la riqueza (Prueba de Mann- Whitney U=6 P<0.005).
DISCUSIÓN
En este estudio se observó que S. bogotensis no presenta autofecundación debido a la hercogamia y recubrimiento de las anteras con el labio superior de la corola, que actuó como una barrera entre el polen y el estigma lo cual es muy común en el género Salvia según Mann (1959), debido a mecanismos que favorecen la alogamia, tales como: la protandría, hercogamia o androesterilidad. Las excepciones se dan en casos de autofecundación en especies con presencia de homostilia y pequeño tamaño de las flores Rodríguez-Riaño & Dafni (2007).
S. bogotensis solo presenta formación de semilla en presencia de insectos y no se observó presencia de aves; en consecuencia, se concluye que esta especie es entomófila. Heywood (1985) afirma que en el género Salvia los mecanismos de polinización están asociados con insectos y aves. Las especies que presentan ornitofilia tienen corolas en forma tubular de color escarlata, características no presentes en S. bogotensis. Según Walker & Sytsma (2007), las especies del género Salvia que han coevolucionado con insectos presentan balancines y estambres incluidos en el labio superior de la corola, como se ha comprobado en este estudio. Según Claßen-Bockhoff & Wester (2007), en estas plantas existe un equilibrio en el uso del polen para atraer los insectos polinizadores y para la fertilización de los óvulos. En este sentido, los balancines y la inclusión de los estambres en el labio superior de la corola son adaptaciones de las salvias para la economía del polen y para favorecer la polinización cruzada mediante insectos. Otros rasgos que favorecen la polinización cruzada en S. bogotensis, con los insectos como vectores del polen son: las guías del néctar, el color azul-violáceo de la corola, la presencia de hercogamia y la corola bilabiada dispuesta a modo de plataforma, que usan los insectos buscadores de néctar.
La riqueza de moscas de la familia Syrphidae asociadas a S. bogotensis es alta (nueve especies a diferencia de las otras familias observadas que solo presentaron una o dos morfoespecies), a pesar de que el lugar de estudio es un ambiente urbano. Según Arrignon et al. (2007), muchas especies de la familia Syrphidae se han adaptado exitosamente a ambientes intervenidos por el hombre debido a su multiplicidad de hábitos. Según Gilbert et al. (1985a), entre las especies de Syrphidae no se cumple el "principio de exclusión competitiva", sino el "principio de coexistencia", lo cual coincide con otros autores y se evidencio en este estudio (Morales & Köhler, 2006 y Grim, 2006).
El elevado número de especies de la subfamilia Syrphinae asociadas a S. bogotensis es un indicativo de importantes factores atrayentes de esta planta sobre este grupo de moscas, las cuales, según Vockeroth & Thompson (1987), cumplen funciones ya ampliamente comprobadas como polinizadores y depredadores de insectos plaga. En este estudio por planta en promedio se observaron 151 flores vigorosas, en antesis y en las cuatro horas de observación se cuantifico en promedio 9 visitas de insectos de la familia Syrphidae, lo cual evidenció la no limitación de recursos o capacidad límite de carga en S. bogotensis descartando una posible relación de parasitismo.
Ocho de las nueve morfoespecies de sírfidos que presentaron visitas florales a S. bogotensis pertenecen a la subfamilia Syrphinae posiblemente porque: 1) Este taxón posee una mayor abundancia de individuos por especie y mayor riqueza de especies que la subfamilia Eristalinae Gilbert et al. (1985) y 2) Según Gittings et al. (2006), especies vegetales de porte bajo y biotipológicamente similares a S. bogotensis favorecen la presencia y gran abundancia de moscas del polen de la subfamilia Syrphinae.
Los adultos de las subfamilias Syrphinae y Eristalinae se encuentran asociados principalmente a plantas con flores y los componentes de su dieta son néctar y polen Vockeroth & Thompson, (1987). El néctar es una fuente de energía y el polen es una fuente de proteína para los machos en la espermatogenesis y para las hembras en la formación de los huevos Goulson & Wrigth (1998), Irvin et al. (1999) y Hickman et al. (1995). En este estudio se observó que los sírfidos visitantes de S. bogotensis consumieron polen de las vellosidades del labio superior de la corola, estigmas y las anteras de las flores, lo cual es característico de la subfamilia Syrphinae, como ya se había mencionado.
Los organismos se adaptan a su ambiente y esto usualmente se ve reflejado en rasgos morfológicos. Estudios previos han demostrado la relación entre morfología y función ecológica en la familia Syrphidae. En organismos que colectan néctar y polen, se debe focalizar la atención en el aparato bucal Gilbert (1981). La relación entre la longitud de la probóscide y de la corola de la flor ha sido considerada previamente en modelos de tasas de visitas y hábitos de recolección de néctar y polen en la familia Syrphidae Gilbert et al. (1985) y Holloway (1976). Un ejemplo de esto son los sírfidos más primitivos, de hace 70 millones de años, los cuales eran pequeños, tenían aparatos bucales cortos y por ende solo consumían polen Gilbert (1985 b), características similares a la actual subfamilia Syrphinae, que según análisis filogenéticos de Guinilla et al. (2003) resultaría ser un grupo más basal que Eristalinae.
Respecto al consumo de néctar, los sírfidos se acercaron a las guías florales y trataron de tener acceso al néctar, pero no alcanzaron el recurso, puesto que la longitud de la probóscide es menor a la longitud de la corola y la anchura del tagma cefálico es mayor que la aberturade la corola. La desventaja de la probóscide corta de estos sírfidos es que no pueden alimentarse de néctar de un amplio rango de angiospermas, a diferencia de la subfamilia Eristalinae; sin embargo, la abundancia y riqueza en especies de esta subfamilia es mayor que la subfamilia Eristalinae, por efecto de la dieta en estado larval Gilbert et al. (1985).
El hecho de que las moscas de las flores no puedan alcanzar el néctar de S. bogotensis debido a las limitaciones de la longitud del aparato bucal, implica la falta de activación de los balancines, los cuales son una innovación clave en el género de las salvias que permite la adherencia del polen al insecto, y por ende, propicia la polinización cruzada.
Los estambres se encuentran dentro del labio superior de la corola lo que evita el consumo de polen por insectos polinívoros. Cuando el polinizador consume el néctar, los balancines son activados de tal manera que las anteras se proyectan hacia el exterior, entran en contacto con el cuerpo del insecto y adhieren los granos de polen al dorso del tagma cefálico del visitante, lugar en el cual el insecto no puede tener acceso para su consumo. Esto aumenta la probabilidad de que el polen sea llevado al estigma de otra flor. El primero en estudiar el papel de los balancines en la biología reproductiva de las plantas fue Sprengel (1793, citado por Walker & Sytsma 2007). Posteriormente, Wester y Claßen-Bockhoff (2007) propusieron que los balancines son la innovación evolutiva responsable de la radiación adaptativa que ha diversificado el género Salvia de tal manera, que con cerca de 1000 especies es el más diverso de la familia Lamiaceae.
Holloway (1976) relaciona las características morfológicas y conductuales de los sírfidos con la eficiencia en la polinización y en base a ello clasifica las moscas de las flores en dos grupos. El primer grupo incluye la subfamilia Syrphinae y se caracteriza por especies con: 1) aparatos bucales cortos, con restricciones en la toma de los recursos florales, de tal manera que el polen lo consumen de superficies a las cuales ha llegado por la acción del viento o de plantas con flores que tienen los recursos expuestos (plantas de las familias Apiaceae, Compositae, Verbenaceae); 2) pilosidad escasa por lo cual poseen una menor eficiencia en la carga de polen en comparación con los individuos de la familia Eristalinae; y 3) actividades de acicalamiento muy frecuentes que consisten en la recolección de los pocos granos de polen que se adhieren al cuerpo, aglutinación en las patas anteriores para su posterior consumo. Otras características mencionadas por otros autores incluyen la preferencia por el polen de algunas especies de gimnospermas Leereveld (1982) y un bajo número de casos de polinización Shi et al. (2009). El segundo grupo comprende a la subfamilia Eristalinae y se caracteriza por especies con: 1) aparatos bucales largos, gracias a los cuales los individuos pueden acceder a los recursos florales de un alto número de especies vegetales y 2) con mucha pilosidad, que les permite una eficiente carga del polen.
En este estudio se observó la presencia de visitantes del primer grupo, los cuales presentaron los siguientes comportamientos: 1) no siempre llegaron directamente a la flor (52,3% de las actividades registradas en la planta), 2) no consumieron néctar y si el polen adherido al labio superior de la corola y estigma (12% de las actividades registradas en la flor), y 3) presentaron actividades de limpieza (72,73% de las actividades registradas en tallos y hojas). El hecho de que un elevado porcentaje de actividades de especies de la subfamilia Syrphinae estén relacionadas con el acicalamiento, representa una baja eficiencia como vectores del polen, debido a que invierten mucho tiempo en esta actividad y además, los pocos granos que se adhieren a su cuerpo son consumidos y no son destinados a la polinización.
Los sírfidos visitantes apenas tuvieron contacto del cuerpo con las anteras de las flores (sólo la probóscide) y la escasa pilosidad no les permite una eficiente carga del polen. En estudios realizados por Barret & Harder (1997), Mac Leod (1999), Sjödin et al. (2008) y Frank (1999) se observó que si hay una mayor diversidad de especies vegetales en floración, son más frecuentes las visitas de los polinizadores y hay menos limitaciones en la formación de las semillas. El efecto de la vecindad ecológica se evidenció en la mayor abundancia y riqueza de especies de la familia Syrphidae asociadas a S. bogotensis cuando Acaciella holtonii, Dodonea viscosa y/o Cleome anómala L. se encontraban en floración.
El hecho de que los sírfidos observados consuman recursos florales de dos o más especies puede ser debido a que: 1) los polinizadores tienden al generalismo para asegurar su supervivencia para el caso de que una especie vegetal se extinga o no se encuentre en período de floración Waser (2006), 2) las moscas de las flores consumen recursos florales de un amplio número de especies vegetales es decir que son polilécticas Irvin et al. (1999) y 3) un polinizador puede consumir recursos florales de varias especies que son complementarios en su dieta y no substituibles Geber & Moeller (2006).
Finalmente, se puede concluir que: 1) el estudio de relaciones ecológicas en los ambientes urbanos es importante considerarlo, ya que hay especies que se han venido adaptando a estas condiciones como el sistema S: bogotensis-Familia Syrphidae. 2) respecto a S. bogotensis es una especie alogama que requiere de los insectos para la formación de semilla y 3) las moscas de las flores no actúan en la polinización de S. bogotensis pero se ven beneficiadas en cuanto al consumo de polen sin generar limitación del recurso floral, por lo cual se infiere que la relación en el sistema de estudio es de comensalismo.
AGRADECIMIENTOS
Los autores expresan sinceros agradecimientos al Instituto de Ciencias Naturales y al jardín botánico "José Celestino Mutis" de Bogotá por su apoyo logístico. Especial agradecimiento a Augusto Montoya por su colaboración en la determinación taxonómica de las especies de Syrphidae, a Leider Palacios por la información palinológica brindada y a los profesores Xavier Marquínez y Rosario Rojas por sus valiosas observaciones al manuscrito. Agradecimientos especiales a Victoria Correa por su apoyo en la identificación taxonómica de los granos de polen y a Ana Milena García por su excelente trabajo editorial.
LITERATURA CITADA
1. ARRIGNON, F., M. DECONCHAT, J. SARTHOU, G. BALENT & C. MONTEIL.2007. Modelling the overwintering strategy of a beneficial insect in a heterogeneus landscape using a multi-agent system. Ecol. Model. 205: 423-436. [ Links ]
2. BARRET, S., L.HARDER & A.WORLEY. 1997. Capitulo 6: The Comparative Biology of Pollination and mating in flowering plants. pp. 57-77 En: M. Silvertown, M. Franco y J. Harper (eds). Plant life histories, University Press, Cambridge. [ Links ]
3. BARROSO, P., H. MURCIA, N. VEGA & G. PÉREZ. 2005. Obtención y purificación de IgY dirigidas contra la lectina de Salvia bogotensis. Biomedica 25:496-510. [ Links ]
4. CARREJO, N., J.R. VOCKEROTH, E. GEOFFREY, L. MARIONI, C. PEREZ, S. ROJO, G.E. ROTHERAY, G. STAHL, F.C. THOMSON & M. A. ZUMBADO. 2006. Primer Taller de Identificación. Syrphidae del Neotropico. Universidad del Valle. Cali-Colombia. Febrero 21-27. [ Links ]
5. CARVER M. & F.C. THOMPSON. 2003. Two new species of Syrphidae (Diptera) from Australia. Stud. Dipterol 1: 37-41. [ Links ]
6. CASTELLA, E. & M. SPEIGHT. 1996. Knowledge representation using fuzzy coded variables: an example based on the use of Syrphidae (Insecta: Diptera) in the assessment of riverine wetlands. Ecol. Model. 85: 13-25. [ Links ]
7. CLAßEN–BOCKHOFF & P. WESTER. 2007. Floral diversity and pollen transfer mechanism in bird-pollinated Salvia species. Ann. Bot. 100: 4701-421. [ Links ]
8. DUDAREVA, N. & E. PICHERSKY. 2006. Biology of floral scent. CRC/Taylor y Francis. Boca Raton, FL. pp. 150-155. [ Links ]
9. FOOD AND AGRICULTURE ORGANIZATION (FAO). Biodiversidad para un mundo sin hambre. En: http://www.fao.org/biodiversity/components/polinizadores/es/; consulta: septiembre 2010. [ Links ]
10. FERNÁNDEZ-ALONSO, J.L. 1995. Estudios en Labiatae de Colombia – I. Novedades en los géneros Salvia e Hyptis. Rev. Acad. Colomb. Cienc. Exact. 19(74): 469-480. [ Links ]
11. FERNÁNDEZ-ALONSO, J.L. 2008. Estudios en Labiatae – VI. Hibridación en el género Salvia en Colombia y su interés horticultural. Caldasia 30: 21-48. [ Links ]
12. FRANK, T. 1999. Density of adult hoverflies (Diptera : Syrphidae) in sown weep strips and adjacent fields. J. Appl. Entomol. 123: 351-355. [ Links ]
13. GEBER, M.A. & D.A. MOELLER. 2006. Capítulo 6: Pollinator responses to plant communities and implications for reproductive character evolution. pp. 102-116. En: Harder, L. D. y Barret, S. C. Ecology and Evolution of Flowers. Oxford, Nueva York. 370 p. [ Links ]
14. GILBERT, F.S. 1981. Foraging ecology of hoverflies: morphology and the mouth parts in relation to feeding on nectar and pollen in some common urban species. Ecol. Entomol. 6: 245-262. [ Links ]
15. GILBERT, F.S. 1985 (a). Ecomorphological relationships in hoverflies (Diptera:Syrphidae). Proc. R. Soc. Lond. 224: 91-105. [ Links ]
16. GILBERT, F.S. 1985 (b). Morphometric patterns in hoverflies (Diptera, Syrphidae). Proc. R. Soc. Lond.B 224: 79-90. [ Links ]
17. GILBERT, F., E. HARDING, J. LINE & L. PERRY. 1985. Morphological approaches to community structure in hoverflies (Diptera, Syrphidae). Proc. R. Soc. Lond. B 224: 115-130. [ Links ]
18. GITTINGS, T., J. HALLORAN, T. KELLY & P. GILLER. 2006. The contribution of open spaces to the maintenance of hoverfly (Diptera: Syrphidae) biodiversity in Irish plantation forest. Ecol. and Manag. 237: 290-300. [ Links ]
19. GOULSON, D. & N. WRIGHT. 1998. Flower constancy in the hoverflies Episyrphus balteatus (Degeer) and Syrphus ribesii (L.) (Syrphidae) Behav. Ecol. 9: 215-219. [ Links ]
20. GRIM, 2006. An exceptionally high diversity of hoverflies (Syrphidae) in the food of the reer warbler (Acrocephalus scirpaceus). Biol. Brat. 61:235-239. [ Links ]
21. GUINILLA, S., H. HIPPA, G. ROTHERAY, J. MUONA & F. GILBER. 2003. Phylogeny of Syrphidae (Diptera) inferred from combined analysis of molecular and morphological characters. Syst. Entomol. 28:433-450. [ Links ]
22. HICKMAN, J.M., G.L. LOVEI & S.D. WRATTEN. 1995: Pollen feeding by adults of the hover fly Melanostoma fasciatum (Diptera : Syrphidae). N. Z. Journ. Zool. 22: 387-392. [ Links ]
23. HOLLOWAY, B. 1976. Pollen-feeding in hover-flies (Diptera: Syrphidae). N. Z. Journ. Zool. 3: 339-350. [ Links ]
24. IRVIN, N.A., S.D. WRATTEN, C.M. FRAMPTON, M.H. BOWIE, A.M. EVANS & N.T. MOAR. 1999. The phenology and polen feeding of thress hover fly (Diptera:Sryrphidae) species in Canterbury. N. Z. Journ. Zool. 26:105-115. [ Links ]
25. LEEREVELD, H. 1982. Anthecological relations between reputed anemophilus flowers and syrphid flies. III World wide survey of crop and intestine contens of certain anemophilus syrphid flies. Tijdschrift Entomol. 125:25-35. [ Links ]
26. LUNAU, K. 2004. Adaptive radiation and coevolution - pollination biology case studies. Organisms Diversity and Evolution. 4: 207-224. [ Links ]
27. MINISTERIO DE AGRICULTURA Y DESARROLLO RURAL (MADR). 2007. Términos de referencia de la convocatoria nacional para la cofinanciación de programas y proyectos de investigación, desarrollo tecnológico e innovación para el sector agropecuario por cadenasproductivas. http://sigp.minagricultura.gov.co/soporte/antecedentes/01términos_de_Referencia_VI_Convocatoria_2007.pdf; consulta: noviembre 2009. [ Links ]
28. MACLEOD, L. 1999. Attraction and retention of Epysyrphus balteatus DeGreer (Diptera: Syrphidae) at an arable field margin with rich and por floral resources. Agr. Ecosys. and Environ. 73: 237-244. [ Links ]
29. MANN, P. 1959. Systematics of flowerings plants. Methuen and Co. Ltd. Londres. pp. 254-255. [ Links ]
30. MORALES M.N. & A. KÖHLER. 2006. Espécies de Syrphidae (Diptera) visitantes das flores de Eryngium horridum (Apiaceae) no Vale do Rio Pardo, RS, Brasil. Iheringia, Sér. Zool. 96: 41-45 [ Links ]
31. MUÑOZ, A. 2005. Polinización de los cultivos. Ediciones Mundi-prensa. 38-39 pp. [ Links ]
32. RODRÍGUEZ-RIAÑO, T. & A. DAFNI. 2007. Pollen-Stigma Interference in Two Gynodioecious Species of Lamiaceae with Intermediate Individuals. Ann. Bot. 100:423-431. [ Links ]
33. ROJO, S., F. GILBERT, M. MARCOS-GARCIA, J. NIETO & M. MIER. 2003. A world review of predatory hoverflies (Diptera, Syrphidae: Syrphinae) and their pray. Centro Iberoamericano de la Biodiversidad. Alicante. 319 p. [ Links ]
34. SADEGHI, H. & F. GILBERT. 2000. Aphid suitability and its relationship to oviposition preference in predatory hoverflies. J. An. Ecol. 69: 771-784. [ Links ]
35. SCHNEIDER, 1969. Bionomics and physiology of aphidophagous Syrphidae. Ann. Rev. Entomol. 25:103-124. [ Links ]
36. SHI, J., Y.B. LUO, P. BERNHARDT, J.C. RAN, Z.J. LIU & Q. ZHOU. 2009. Pollination by deceit in Paphiopedilum barbigerum (Orchidaceae): a staminode exploits the innate colour preferences of hoverflies (Syrphidae). Plant Biol (Stuttg) 11:17-28. [ Links ]
37. SJÖDIN, N., J. BENGTSSON & B. EKBOM. 2008. The influence of grazing intensity and landscape composition on the diversity and abundance of flower-visiting insects. J. App. Ecol. 45: 763–772. [ Links ]
38. SOMMAGIO, D. 1999. Syrphidae: can they be used as environmental bioindicators. Ag. Ecosys. Environm. 74: 343-356. [ Links ]
39. THOMPSON, F.C. 1999. A key to the genera of the flower flies (Diptera:Syrphidae) of the Neotropical region including descriptions of new genera and species and a glossary of taxonomic terms contributions on Entomology Internacional. 3:321-378. [ Links ]
40. VOCKEROTH J.R. & F.C. THOMPSON. 1987. Syrphidae. Chapter 52 pp. 713-743 En: J.F. McAlpine, (Ed.) Manual of the Neartic Diptera, Vol 2, Research Branch, Agriculture Canada Monograph 28, Ottawa. [ Links ]
41. WALKER, J.B. & K.J. SYTSMA, 2007. Staminal Evolution in the Genus Salvia (Lamiaceae): Molecular Phylogenetic Evidence for Multiple Origins of the Staminal Lever. Ann. Bot. 100(2): 375-391. [ Links ]
42. WASER, N. M. 2006. Capitulo 1: Specialization and generalization in plant – pollinator interactions: A historical perspective. Wasser, N. pp. 3-18. En: N. M. Waser & J. Ollerton (eds). Plant-pollinator interactions from specialization to generalization. The University of Chicago. Londres. 445p. [ Links ]
43. WESTER, P. & R. CLAßEN–BOCKHOFF. 2007. Floral diversity and pollen transfer mechanism in bird-pollinated Salvia species. Ann. Bot. 100: 401-421. [ Links ]