Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.33 no.2 Bogotá Jul./Dec. 2011
Habitat characterization of the river turtle Podocnemis lewyana in the Prado river, downstream of Hidroprado dam, Tolima, Colombia
ADRIANA GONZÁLEZ-ZÁRATE
OLGA LUCÍA MONTENEGRO
OLGA VICTORIA CASTAÑO-MORA
Grupo de Conservación y Manejo de Vida Silvestre, Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Apartado 7495, Bogotá, D. C., Colombia. azul.adriana.azul@gmail.com
Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Apartado 7495, Bogotá, D. C., Colombia. olmontenegrod@gmail.com; olvicastano@yahoo.es
RESUMEN
En esta investigación se buscó evaluar cuáles son las características del hábitat en los sitios con presencia permanente de tortugas (PPT) en el río Prado que, comparadas con las de los sitios sin PPT, permitan dilucidar el posible agrupamiento de Podocnemis lewyana en estas áreas determinadas. En la caracterización de la vegetación del borde del río Prado se encontraron 63 especies de plantas, de las cuales 28 hacen parte de la dieta de la tortuga de río. En los sitios con PPT la diversidad, la cobertura de los estratos arbustivo y arbóreo, el número de plantas por m2 y el número de especies vegetales encontradas en la dieta de la tortuga fueron mayores con respecto a las de los sitios sin PPT. La mayor riqueza de especies la tuvo Leguminosae, seguida por Anacardiaceae, Moraceae y Sapindaceae. En la caracterización de las variables fisicoquímicas del agua, en los sitios con PPT se encontró que la profundidad del río fue mayor y la velocidad de la corriente menor, comparada con los sitios sin PPT, y que los niveles de oxígeno disuelto en el agua fueron muy bajos para lo esperado en la zona. Respecto a la disponibilidad de lugares potenciales de refugio, descanso y asoleamiento para la tortuga de río, no se encontraron diferencias en las frecuencias de barrancos, playas de piedra, playas de arena, madera y rocas disponibles por kilómetro entre los sitios con y sin PPT. En la evaluación de la disponibilidad de alimento para P. lewyana en el río Prado se encontró que el número de especies vegetales integrantes de la dieta de la tortuga y el aporte en biomasa de estas especies fue mayor en los sitios con PPT. De las variables de hábitat medidas, la velocidad de la corriente fue la más relacionada con la presencia de P. lewyana en el río Prado, mientras que la profundidad del río, la cobertura de la vegetación ribereña y el oxígeno disuelto en el agua estaban relacionados directamente con su abundancia.
Palabras clave. Caracterización, hábitat, conservación, tortugas, Podocnemis lewyana, ríos, Colombia.
ABSTRACT
This study was aimed at assessing habitat characteristics in Prado River, in sites with permanent presence of turtles (PPT) compared to sites without PPT, to elucidate the possible grouping of P. lewyana in these particular areas. With the vegetation characterization along the Prado River, we found 63 plant species, 28 of which are part of the diet of P. lewyana. The number of plants that are part of the turtle’s diet, plant diversity, and coverage of shrubs and trees was higher at the sites with PPT than in sites without PPT. Leguminosae was the richest plant family in number of species, followed by Anacardiaceae, Moraceae, and Sapindaceae. In the characterization of water physicochemical variables, we found a greater depth of the river and lower flow velocity at sites with PPT compared with sites without PPT. The water oxygen levels were lower than expected in the area. Regarding the availability of refuge places, resting, and basking spots, there were no differences in the frequencies of ravines, rocky beaches, sandy beaches, wood and rocks available per kilometer for P. lewyana between the sites with and without PPT. In assessing food availability for P. lewyana in the river, we found that the number of plant species belonging to the turtle’s diet and the biomass contribution of these species was greater at sites with PPT than in those without PPT. Among the habitat variables analyzed, flow velocity was the most related variable with the presence of P. lewyana in the Prado River while depth of the river, riparian vegetation cover and dissolved oxygen in water were directly related with its abundance.
Key words. Characterization, habitat, conservation, turtles, Podocnemis lewyana, rivers, Colombia.
Recibido: 02/02/2011
Aceptado: 14/10/2011
INTRODUCCIÓN
El hábitat se ha definido como el área que presenta una mezcla de recursos y factores ambientales que favorecen su ocupación por individuos de una especie o población y que permiten su sobrevivencia y reproducción (Gysel & Lyon 1980, Morrison et al. 1998). Un hábitat óptimo es único para cada especie, puede variar anual o estacionalmente y depende de las necesidades del animal (Morrison et al. 1998, Anderson & Gutzwiller 2005). Sin embargo, la presencia de una población en un hábitat particular, no es garantía de que sus condiciones sean óptimas para ella, o que lo haya seleccionado preferencialmente (Bury 1979).
Los factores requeridos para la existencia de una población incluyen alimento, agua, y lugares de descanso y refugio (Dassman 1971, Morrison et al. 1998). Cada especie animal tiene necesidades específicas de hábitat, de manera que la distribución y la abundancia de la especie estarán limitadas en un área por la cantidad, la calidad y la heterogeneidad del hábitat disponible (Gysel & Lyon 1980, Morrison et al. 1998).
En las tortugas de río, se conoce que la estructura de la vegetación, la anchura y la profundidad del río, la luz, la cantidad de alimento, el área de sitios de soleamiento y de playas de anidación, son factores determinantes que se relacionan positivamente con la abundancia de las poblaciones y que en conjunto, indican hábitats de buena calidad (Boyer 1965, Graham 1979, Flaherty & Bider 1984, Shively & Jackson 1985, Harrel et al. 1996, Morrison et al.1998, Roosenburg 1999, Bodie 2001, Schleicher & Loehr 2001, Moll & Moll 2004). Estos factores, sin embargo, pueden verse afectados por alteraciones en el ambiente debido a las actividades antrópicas (Mitchell & Klemens 2000, Primack et al. 2001). La agricultura, la ganadería, la urbanización de las zonas riparias y sobre todo el represamiento de los ríos para la creación de embalses, hacen parte de las actividades de mayor efecto negativo, ya que ocasionan una remoción directa del hábitat y cambian la hidrología de las corrientes, temperatura y carga de nutrientes del río. Estos efectos pueden ser significativamente perjudiciales para especies endémicas o con distribución muy restringida (Moll 1997, Moll & Moll 2000, Bodie 2001, Márquez & Guillot 2001, Moll & Moll 2004, Aresco 2005).
Los efectos del represamiento de los cursos de agua en las tortugas de río incluyen cambios importantes en su hábitat, como la alteración de la calidad de las aguas, cambios en los recursos alimenticios, aumento de la erosión mediante la liberación irregular de caudales, cambios en los ciclos hídricos importantes en su reproducción y la interrupción de migraciones (Moll 1997, Moll & Moll 2000, Bodie 2001, Moll & Moll 2004).
En Colombia, se encuentra una especie de tortuga endémica, Podocnemis lewyana, también conocida como tortuga de río. Las poblaciones de esta especie se localizan en las cuencas de los ríos Sinú, San Jorge, bajo Cauca y Magdalena (Dahl & Medem 1964, Dahl et al. 1965, Hurtado 1973, Pritchard 1979, Iverson 1992). Dada su condición de endemismo, la alteración de sus hábitats y su uso por comunidades locales, esta especie se encuentra en peligro de extinción (Castaño 2002, UICN 2010). El río Prado hace parte del sector sur de la distribución geográfica de esta tortuga, se sabe que la población de P. lewyana fue fraccionada en dos núcleos poblacionales al momento de la creación del embalse de Hidroprado (Vargas-Ramírez et al. 2007) en la década de los 70's (Márquez 1985), y que en las aguas del río Prado se vierten aceites, residuos químicos y aguas no tratadas provenientes de la hidroeléctrica, de los cultivos aledaños al río y de los asentamientos humanos (Vargas-Ramírez et al. 2007). Debido a que la población de la tortuga en el río Prado parece ser la más abundante estudiada hasta el momento en toda su área de distribución (González-Zárate 2010), a la poca longitud del río Prado y a la actitud de los lugareños en pro de la conservación de la tortuga de río, se convierte en un punto central para la investigación, la conservación y el manejo de la especie, que podrían servir de base a otros estudios en zonas más complejas.
En un estudio preliminar aguas abajo de la represa, se encontró que P. lewyana no se distribuye homogéneamente a lo largo del río Prado, sino que se localiza agrupadamente en diferentes sectores del río (Vargas-Ramírez et al. 2007). Sin embargo, aún no se conoce si la causa de tal sectorización está asociada a factores del hábitat característicos del río Prado en estas zonas. Por lo tanto, la pregunta de esta investigación fue ¿Cuáles son las características del hábitat del río Prado, en los sitios con y sin presencia permanente de Podocnemis lewyana en el sector aguas abajo de la represa de Hidroprado? Para abordar esta pregunta, se buscó caracterizar el hábitat de P. lewyana en términos de estructura de la vegetación ribereña, variables fisicoquímicas del agua, y disponibilidad de alimento y sitios de refugio, descanso y asoleamiento, tanto en los sitios con presencia permanente de la tortuga (PPT), como en aquellos donde no hay presencia permanente de la misma.
ÁREA DE ESTUDIO
Esta investigación se realizó en el río Prado, municipio de Prado, departamento del Tolima, Colombia (03°46'10.8" Norte 74°55'37.3" Oeste). El río Prado inicia en las compuertas del embalse de Hidroprado, el cual se formó en 1973. La inundación llenó un profundo cañón cubierto de vegetación natural y de cultivos que no fueron eliminados antes del llenado, sobre un área que estuvo originalmente cubierta por bosque seco y bosque húmedo tropical (Márquez 1985, Márquez & Guillot 2001). Actualmente, el río Prado se extiende un poco más de 18 km y desemboca en el río Magdalena (Fig. 1). Este río está localizado a 321 m de altitud, sobre una planicie que hace parte de la cuenca alta del río Magdalena entre las cordilleras Oriental y Central. El clima de la zona es cálido, con una temperatura promedio ambiental de 26 °C, un periodo seco largo entre junio-septiembre y un periodo seco corto entre enero-marzo. El régimen de lluvias es bimodal con eventos máximos en abril-mayo y octubre-noviembre. La precipitación en el municipio de Prado está entre los 1500-2000 mm (Instituto Geográfico Agustín Codazzi 1996).
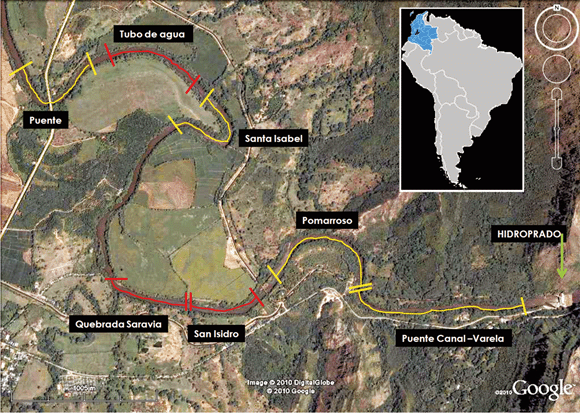
El río Prado ha perdido su ciclo natural de crecimiento y merma según la época del año, ya que ahora está a cargo de la hidroeléctrica y su caudal depende de la cantidad de energía que ésta necesite producir.
MÉTODOS
Época y sitios de muestreo. La fase de campo de esta investigación se realizó entre los meses de junio y septiembre, época seca larga del año 2009. En el río Prado, se escogieron siete sitios de muestreo (Fig. 1), cuatro con presencia permanente de tortugas (PPT) y tres donde no hubo PPT. Los sitios con PPT se escogieron en base a observaciones directas que se hicieron tanto en el 2009 (González-Zárate 2010), como en una investigación previa realizada en el 2007 (Vargas-Ramírez et al. 2007), además en entrevistas hechas a los lugareños se confirmó que estos sitios han tenido PPT de mucho tiempo atrás, incluso el establecimiento de estas tortugas en estos sitios siguió poco tiempo después de la creación del embalse (1973). Se sabe que los sitios sin PPT son usados ocasionalmente por estos animales. Otro criterio para la definición de los sitios correspondió a las características de la vegetación del borde del río Prado.
TOMA DE DATOS
Caracterización de la vegetación. La caracterización de la vegetación del río Prado se realizó por medio de 43 transectos de 10 m de longitud por 5 m de ancho (50 m2) cada uno, ubicados al borde y paralelos al río, para un total de 2150 m2. Como se muestreó aproximadamente 10% de la longitud de cada uno de los siete sitios escogidos (Fig. 1), se tienen 33 transectos que corresponden a sitios donde hay PPT y 10 transectos a sitios en los que no hay PPT. Con el fin de determinar cómo fue la estructura de la vegetación, sin tener en cuenta las hierbas, se midieron todas las plantas con diámetro a la altura del pecho (DAP) mayor a 3 cm (Gysel & Lyon 1980, Gentry 1982, Phillips et al. 2002, Duque et al. 2003). Se evaluaron cinco variables de la vegetación (Tabla 1). Para establecer la identidad taxonómica de los individuos se colectaron muestras botánicas, las cuales se depositaron en el Herbario Nacional Colombiano COL del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia.
Tabla 1. Variables del hábitat medidas en los sitios con y sin presencia permanente de tortugas (PPT) en el río Prado, Tolima, Colombia.
Variables fisicoquímicas del agua. Se midieron siete variables fisicoquímicas del agua en cada uno de los siete sitios de muestreo (Tabla 1). Dentro de cada uno de los sitios se escogieron nueve puntos donde se tomaron los valores de cada variable, esto con el fin de registrar los posibles cambios de la franja del río muestreada y determinar si había diferencias de inicio a fin de la época seca y/o entre sitios (tres puntos en cada una de las márgenes del río y tres en el centro). Las variables fisicoquímicas el agua se midieron mensualmente en los mismos nueve puntos por sitio. A excepción de la profundidad, las variables fueron medidas en la superficie del agua.
Lugares de refugio, descanso y asoleamiento. En los sitios con y sin PPT, se contaron el número de perchas disponibles por kilómetro recorrido (Tabla 1).
Disponibilidad de alimento. P. lewyana es herbívora en su ambiente natural (Dahl & Medem 1964, Dahl et al. 1965, Hurtado 1973, Gallego-García 2004), se alimenta del material vegetal que crece en el río o que cae en él. Sin embargo, para esta investigación se tuvo en cuenta únicamente este último, debido a que las corrientes producidas por la hidroeléctrica, limitan el establecimiento de plantas acuáticas sobre el cauce del río Prado, excepto en los pocos remansos que se forman cerca a su desembocadura en el río Magdalena. Por lo tanto, para determinar la disponibilidad del alimento de la tortuga se instalaron al borde del río Prado, muy cerca o sobre la superficie del agua, trampas de hojarasca con un área de cobertura de 1 m2. Se ubicaron ocho trampas en cada uno de los sitios de muestreo (56 trampas en total). Las trampas se revisaron y recogieron mensualmente entre junio y septiembre de 2009. El material colectado fue separado por especie de planta para estimar la contribución relativa al río de las distintas fracciones de hojarasca por peso en gramos (Quinto et al. 2007). Algunas plantas se nombraron como morfotipos puesto que al ser identificadas únicamente con base en fracciones de hojarasca no se contó con el material necesario para su determinación específica. La lista de las 33 especies vegetales registradas hasta el momento que hacen parte de la dieta de P. lewyana en el río Prado (Vargas- Ramírez et al. 2007, González-Zárate 2010) se encuentra en el Anexo 1.
ANÁLISIS DE DATOS
Caracterización de la vegetación.
Representatividad del muestreo de vegetación. Para evaluar si el muestreo de vegetación fue representativo se utilizaron los estimadores, Chao 1 y Chao 2 (Chao 1984, Colwell & Coddington 1994). Estos estimadores se basan en la rareza de algunas especies en el muestreo, que puede estar dada por su baja abundancia, como los singletons (especies con abundancia 1 en la muestra) y doubletons (abundancia 2 en la muestra) utilizados para el cálculo del estimador Chao 1. El estimador Chao 2 considera taxones raros por su baja frecuencia en las muestras independientemente de las abundancias como los uniques (especies con frecuencia 1) y duplicates (especies que aparecen exactamente en dos muestras). Para esto se usó el programa estadístico EstimateS versión 8.2.0 (Colwell 2009).
Riqueza de especies vegetales. La riqueza se define como el número de taxa que tipifican a una localidad, región o parcela (Rangel-Ch. & Velásquez 1997). La riqueza se estimó como el número total de especies vegetales encontradas en cada uno de los sitios muestreados. Se determinó por medio de una prueba U de Mann-Whitney si existían diferencias en la riqueza entre los sitios con y sin PPT.
Diversidad de especies vegetales. La diversidad de un área es comúnmente descrita en términos del número total de especies (riqueza) y su abundancia relativa. La abundancia usualmente se basa en el número de individuos por especie, pero otras variables como la biomasa o el porcentaje de cobertura también pueden ser usadas (Ludwig & Reynolds 1988). Como medida de abundancia se calculó un Índice de Valor de Importancia para las especies (IVI) que resulta de la suma de los datos relativos de densidad, dominancia (área basal) y frecuencia por cada especie. También se calculó un Índice de Predominio Fisionómico (IPF) que proviene de la suma de los datos relativos de densidad, dominancia y cobertura (Rangel-Ch. & Velásquez 1997). Para determinar si había diferencias en la diversidad de la vegetación entre los sitios con y sin PPT se calculó un índice de Shannon-Wiener y se comparó entre pares de sitios con una prueba t de diversidad (Magurran 2004). Las pruebas se hicieron en el programa PAST 1.97 (Hammer et al. 2001).
Estructura vertical de la vegetación. Para cada uno de los siete sitios muestreados se estimó el porcentaje de cobertura de cada uno de los estratos como la relación entre la cobertura y el área total muestreada. Los estratos corresponden a arbustivo de 1.5-5 m de alto, arbolitos de 5-12 m y árboles de ≥12 m (Rangel-Ch. & Velásquez 1997). Se hizo un promedio de cobertura de cada estrato por m2 de los sitios con y sin PPT por separado. Se registró el número de plantas por estrato y por m2 (relación entre el número de plantas y el área total muestreada).
Variables fisicoquímicas del agua. Se determinó el porcentaje de saturación de Oxígeno (O2) disuelto en el agua del río Prado en los diferentes sitios de muestreo por medio de la siguiente ecuación: % O2 = (O2 observado x 100 x K) / S, donde K es el factor de corrección, el cual corresponde al coeficiente de solubilidad según la ley de Henry y S es la solubilidad del O2 en el agua a 760 mm Hg (Roldán & Ramírez 2008).
Para determinar si había diferencias significativas en las variables fisicoquímicas entre los cuatro meses de muestreo y entre sitios con y sin PPT se utilizó la prueba no paramétrica de Kruskal-Wallis. Las pruebas se hicieron en el programa PAST 1.97 (Hammer et al. 2001).
Lugares de refugio, descanso y asoleamiento. Por medio de una prueba de x2 se compararon las frecuencias de barrancos, playas de piedra, playas de arena, madera y rocas disponibles por kilómetro entre los sitios con y sin PPT.
Disponibilidad de alimento. Se comparó por medio de una prueba U de Mann-Whitney si había diferencias estadísticas entre los sitios con y sin PPT en cuanto al peso relativo en gramos del material vegetal recolectado en las trampas de hojarasca en el total del tiempo muestreado. Se hizo el mismo análisis solo con el material vegetal que consume la tortuga (Sokal & Rolf 1985). Gráficamente se comparó la contribución relativa por trampa de hojas, flores, frutos, semillas y restos no identificados, entre los sitios con y sin PPT.
Relación entre las variables del hábitat con la presencia y la abundancia relativa de P. lewyana en el río Prado. Para las variables de la vegetación y las variables fisicoquímicas del agua, se determinó inicialmente si existió correlación entre pares de variables. Para esto, se utilizó el coeficiente de correlación no paramétrico de Spearman (Sokal & Rolf 1985). Las variables correlacionadas entre sí fueron retiradas de los análisis posteriores que se indican a continuación. Todas las variables fueron registradas mensualmente (junio, julio, agosto y septiembre) como un promedio de los valores por cada uno de los siete sitios para un total de 28 datos por variable.
Para encontrar la relación entre las variables del hábitat (variables de vegetación y fisicoquímicas del agua) y la presencia de P. lewyana en el río Prado se utilizó un modelo de regresión logístico por pasos (Backward stepwise). Se buscó el mejor ajuste, la significancia de cada modelo y sus componentes. Como este tipo de regresión se basa en una distribución binomial y no en una distribución gaussiana no fue necesario contrastar la normalidad, independencia y homogeneidad de varianza de los residuales (Legendre & Legendre 1998, Compton et al. 2002). Se utilizó el programa R versión 2.6.1 (Gentleman & Ihaka 1997).
Para encontrar la relación entre las variables del hábitat, ya no con la presencia, sino con la abundancia relativa de P. lewyana en el río Prado, se utilizó un modelo de regresión multilineal por pasos (Backward stepwise). Se buscó el mejor ajuste, la significancia de cada modelo y sus componentes. El modelo escogido cumplió los supuestos de normalidad, independencia y homogeneidad de varianza de los residuales que se probaron con las pruebas de Shapiro-Wilk, Durbin Watson y Levene, respectivamente (Legendre & Legendre 1998). Los datos de abundancia relativa que se usaron para este modelo fueron tomados en la misma época y zona de estudio, para tal caso, se hicieron conteos mensuales y se registró el número de tortugas por kilómetro en cada uno de los sitios de muestreo (González-Zárate 2010). Se utilizó el programa R versión 2.6.1 (Gentleman & Ihaka 1997).
RESULTADOS
Caracterización de la vegetación.
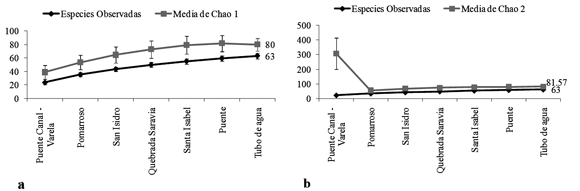
Representatividad del muestreo de vegetación. Se registró el 79% de las especies esperadas, según el estimador Chao 1 (Fig. 2a) (63 especies encontradas de 80 estimadas) y el 77% de las especies esperadas según el estimador Chao 2 (63 especies encontradas de 81.57 especies esperadas). Estos resultados indican que el muestreo fue representativo (Fig. 2b).
Riqueza de especies. Se encontraron 63 especies de árboles, arbustos y lianas en total, incluidas en 33 familias (Anexo 1.). Cinco especies vegetales fueron compartidas por los siete sitios muestreados del río Prado: Erythrina poeppigiana (Cachimbo), Guazuma ulmifolia (Guácimo), Maclura tinctoria (Dinde), Cupania latifolia (Guacharaco) y Triplaris americana (Varasanta). Las tres primeras especies están incluidas en la dieta de la tortuga de río.
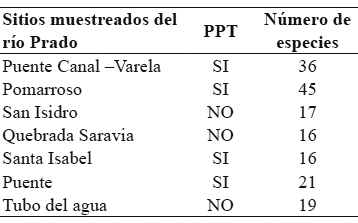
Aunque no se encontraron diferencias significativas en la riqueza de especies vegetales entre los sitios con y sin PPT (U = 2.5 p = 0.2845), los sitios Puente Canal-Varela y Pomarroso presentaron casi el doble de especies de los demás sitios muestreados (Tabla 2).
Tabla 2. Número de especies vegetales en los sitios con y sin presencia permanente de tortugas (PPT) en el río Prado (Tolima, Colombia).
La mayor riqueza de especies en el borde del río Prado la tuvo Leguminosae, seguida por Anacardiaceae, Moraceae y Sapindaceae, grupos típicos de los Bosques Secos Tropicales Bs-T (IAvH 1998). La mayoría de las especies de estos grupos encontradas en el río Prado son consumidas por P. lewyana. En el borde del río Prado, también se encontraron dos géneros (Crescentia y Malpighia) pertenecientes a la lista de géneros de plantas con flores, endémicos y restringidos a Bs-T en Colombia (IAvH 1998), el segundo se incluye en la dieta de P. lewyana. En el borde del río Prado se encontraron las siguientes especies de árboles propias de Bs-T: Astronium graveolens, Gliricidia sepium, Crescentia cujete, Ochroma pyramidale, Pseudosamanea guachapele, Pithecellobium dulce, Samanea saman, Guazuma ulmifolia (Lozano 2005). Estos árboles son importantes para la tortuga de río, ya que las cinco últimas especies aquí nombradas se encontraron predominantemente en su dieta.
Diversidad de especies. En total en los transectos se registraron 63 especies vegetales. Para los sitios con PPT se encontraron 61 de estas 63, de las cuales 28 hacen parte de la dieta de la tortuga de río (33 especies vegetales componen la dieta de la tortuga). En los sitios donde no hay PPT se registraron 29 especies del total de 63 y tan solo 16 de estas sirven de alimento a P. lewyana. Solo dos especies (Pisonia sp. y Combretum fruticosum) presentes en los sitios donde no hay PPT, estuvieron ausentes en los sitios con PPT.
Se encontraron diferencias en la diversidad vegetal medida tanto con el IVI (H'(con PPT) = 3.388, H'(sin PPT) = 2.796; t541.6; 0.05 = 5.4929, p<<0.05), como con el IPF (H'(con PPT) = 2.898, H'(sin PPT) = 2.357; t531.36; 0.05 = 3.6342; p = 0.0003), entre los sitios con y sin PPT. La diversidad fue mayor en los sitios con PPT (Anexo 1.).
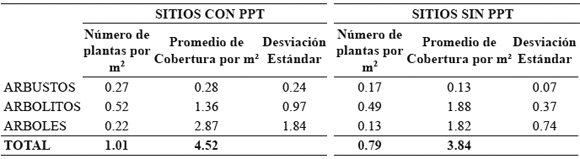
Estructura vertical de la vegetación. En promedio fue mayor la cobertura por m2 de la vegetación del estrato arbustivo y arbóreo de los sitios con PPT. El número de plantas por estrato encontradas por m2 fue mayor en los sitios con PPT (Tabla 3).
Tabla 3. Número de plantas y promedio de cobertura vegetal por m2 y por estrato en sitios con y sin presencia permanente de tortugas (PPT) en el río Prado (Tolima, Colombia).
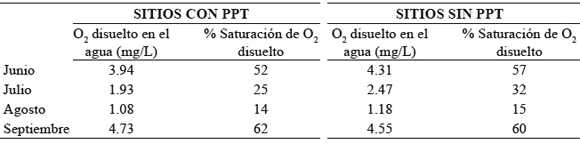
Variables fisicoquímicas del agua. Los porcentajes de saturación de O2 disuelto para los sitios con y sin PPT se consideran bajos (14% a 60%) comparados con el valor esperado de O2 disuelto en el agua de 7.7 mg/L para el río Prado, valor determinado según la ecuación registrada por Roldán & Ramírez (2008) a una temperatura del agua promedio de 28 °C y a 361 m de altitud (Tabla 4). El porcentaje de O2 disuelto fue diferente en los meses muestreados entre los sitios con y sin PPT a excepción de agosto, los valores más altos de O2 disuelto se presentan en junio y septiembre (Tabla 5).
Tabla 4. Porcentaje de saturación del O2 disuelto en el agua por mes, en los sitios con y sin presencia permanente de tortugas (PPT). El valor esperado es de 7.7 mg/L a una temperatura del agua promedio de 28°C y a 361 msnm (río Prado, Tolima, Colombia).
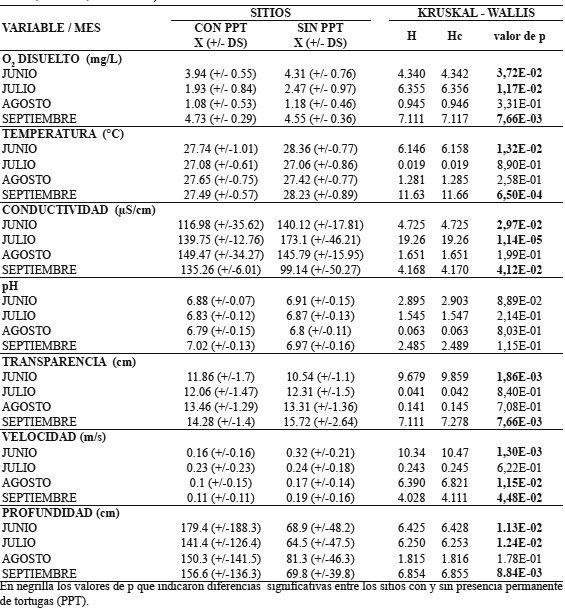
Tabla 5. Promedio, desviación estándar (X (+/- DS) y resultados de la prueba de Kruskal-Wallis de las variables fisicoquímicas del agua entre sitios con (n=36 puntos muestreados por mes) y sin (n=27 puntos muestreados por mes) presencia permanente de tortugas (PPT) (río Prado, Tolima, Colombia).
La conductividad del agua y la profundidad fueron diferentes en los meses muestreados entre los sitios con y sin PPT menos en agosto. La profundidad en los sitios con PPT fue más alta que la de los sitios sin PPT. Los sitios con PPT presentaron una profundidad mayor a 450 cm, con valores de más de 600 cm, mientras que en los sitios donde no hubo PPT la profundidad llegó únicamente hasta 200 cm (Tabla 5).
La velocidad de la corriente fue diferente en los meses de muestreo para los sitios con y sin PPT excepto en julio. Los valores fueron más bajos en los sitios con PPT (Tabla 5).
La temperatura y la transparencia del agua presentaron diferencias en junio y septiembre para los sitios con y sin PPT. El pH del agua no fue diferente entre los sitios en ninguno de los meses (Tabla 5).
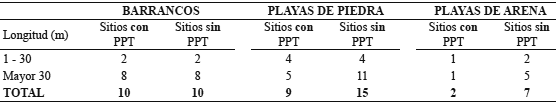
Lugares de refugio, descanso y asoleamiento. Los peñones se encontraron únicamente en los sitios con PPT, en los cuales se contó un peñón por kilómetro recorrido. No hubo diferencias entre los sitios con y sin PPT en cuanto a las frecuencias de barrancos, playas de piedra, playas de arena, madera y rocas disponibles por kilómetro para la tortuga de río (x2 4;0.05= 2.4; p = 0.655) (Tabla 6, tabla 7).
Tabla 6. Número de barrancos, playas de piedra y playas de arena por kilómetro, en sitios con y sin presencia permanente de tortugas (PPT) (río Prado, Tolima, Colombia).
Tabla 7. Número de perchas de madera y roca por kilómetro en sitios con y sin presencia permanente de tortugas (PPT) en el río Prado (Tolima, Colombia).
Disponibilidad de alimento. En total en las trampas de hojarasca se recolectaron 98 especies vegetales. A excepción de Citrus limón, Machaerium moritzianum, Melicoccus bijugatus, Monstera adansonii y Senna reticulata, todas las especies encontradas en los sitios sin PPT se encuentran en los sitios con PPT (Anexo 2.). En las trampas se recolectaron 92 especies de plantas en los sitios con PPT, de las cuales 23 hacen parte de la dieta de P. lewyana. En los sitios sin PPT se recogieron 52 especies vegetales, de las cuales 17 se encontraron en la lista de plantas consumidas por la tortuga en el río Prado (Anexo 2.).
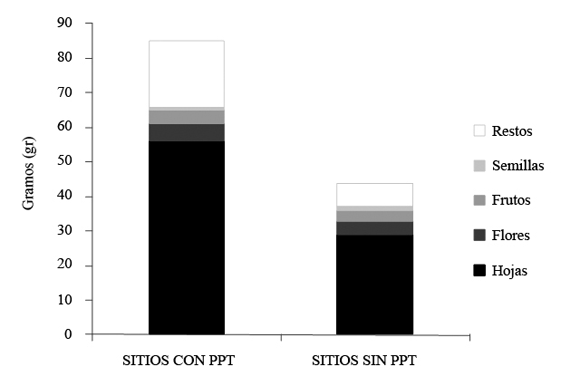
Se encontraron diferencias entre los sitios con (n=32) y sin (n=24) PPT en cuanto al peso relativo en gramos del material vegetal recolectado en las trampas de hojarasca (U= 183; p= 0.0009), el cual fue mayor en los sitios con PPT. Igualmente, hubo diferencias entre los sitios con y sin PPT en el aporte relativo en peso (gr) de las especies consumidas por P. lewyana (U= 250; p= 0.027), también fue mayor en los sitios con PPT. Por otra parte, en la figura 3 se muestra que por trampa había un mayor aporte en gramos de las fracciones de hojarasca en los sitios con PPT.
Relación entre las variables del hábitat con la presencia y la abundancia relativa de P. lewyana en el río Prado. Las variables fisicoquímicas y de la vegetación que se emplearon para los modelos de regresión fueron la profundidad (cm), velocidad de la corriente (m/seg), O2 disuelto en el agua (mg/L), número de especies vegetales, número de especies vegetales consumidas por la tortuga de río y cobertura (m2) de las plantas encontradas en el borde del río Prado. La transparencia, la conductividad del agua (µS/cm), el pH y la temperatura del agua (°C) se eliminaron de la matriz usada en la regresión porque no presentaron variación entre sitios ni entre meses. Puesto que se encontró una alta correlación entre el área basal y la altura (m) con algunas de las otras variables, estas también fueron excluidas del análisis de regresión.
La presencia de las tortugas se relacionó con velocidades bajas de la corriente (p intercepto = 0.0343, p velocidad = 0.0438). La abundancia de las tortugas se relacionó directamente con la profundidad del río, el O2 disuelto en el agua y la cobertura vegetal del borde del río (p intercepto = 0.0018, p profundidad = 0.0151, p oxígeno = 0.3112, p cobertura = 0.1908). El modelo de regresión multilineal explicó en un 42% la abundancia de las tortugas en el río Prado (R2 múltiple= 0.42; F3,24= 5.78; p= 0.004).
DISCUSIÓN
Caracterización de la vegetación. La estructura de la vegetación a orillas del río Prado proporciona información acerca de la densidad de plantas que aportan a la dieta de la tortuga y de su disponibilidad. La estructura de la vegetación en los sitios con PPT es más compleja, más estable y está en un nivel de intervención menor que en los sitios sin PPT, ya que en los sitios con PPT la diversidad de especies vegetales, el número de individuos y la cobertura promedio de los diferentes estratos es mayor. En los sitios sin PPT, se observó en la franja de vegetación riparia un grado de intervención mayor, debido a que esta franja está rodeada por cultivos, potreros y/o asentamientos humanos.
La vegetación del borde río Prado es importante para el hábitat de P. lewyana. En la actualidad la ribera del río Prado es un remanente del Bosque seco tropical (Bs-T) inundado en el establecimiento del embalse (Márquez 1985). En otras poblaciones, P. lewyana se ha encontrado asociada a estos bosques (Castaño-Mora et al. 2005, Restrepo 2008) y su protección y restauración en el río Prado no solo será de beneficio para la tortuga sino que también servirá para la recuperación de los Bs-T, de los cuales en Colombia solo queda el 1.5% de su cobertura original (IAvH 1998).
En el río Prado, los sitios Puente Canal-Varela y Pomarroso que están en la parte alta del río, pueden ser usados como áreas de protección para la tortuga y el Bs-T, mientras que el resto de los sectores del río Prado necesitan prioritariamente acciones de restauración, manejo y conservación de la vegetación ribereña.
Variables fisicoquímicas del agua. Los niveles de O2 disuelto encontrados en el río Prado fueron bajos con respecto al valor esperado para esta zona, la razón es que el agua que corre por el río Prado proviene de los niveles más bajos de la represa donde prácticamente el agua es anóxica (Márquez & Guillot 2001). En el río Prado el O2 disuelto es mayor en los sitios sin PPT, este resultado puede estar asociado a que en estos sitios hay una menor profundidad y una velocidad de la corriente mayor, lo cual aumenta la turbulencia del agua provocando una mejor oxigenación (Roldan & Ramírez 2008). En junio y septiembre el promedio de O2 disuelto fue mayor al de julio y agosto, podría ser porque en junio la hidroeléctrica aún está abriendo regularmente las compuertas para producir energía, mientras que en los meses de julio y agosto (los meses más secos) la apertura de las mismas se hace con más baja frecuencia, por tanto las aguas se quedan quietas y el O2 disuelto disminuye. En septiembre que inician de nuevo las lluvias, se vuelven a abrir las compuertas constantemente.
Los niveles de O2 disuelto en el agua menores a 3 mg/L ejercen presión sobre la mayoría de los organismos acuáticos (Bales & Conklin 2000) y aunque las tortugas respiren aire, las bajas proporciones de O2 disuelto en el agua afectan la calidad de la misma y esto puede tener presuntas repercusiones sobre estos quelonios, por ejemplo en especies que hagan parte de su alimentación. En el río Prado, la cantidad de O2 disuelto es suficiente para soportar vida acuática, sin embargo, el aumento de la temperatura del agua y el descenso del caudal del río en los meses en que la sequía es más fuerte (julio y agosto), ocasionan que los niveles de O2 sean bajos (con porcentajes de saturación de O2 disuelto menores al 60%), lo cual baja la calidad del agua y produce una elevada mortandad de especies en el río. En el río Prado no se encontró vegetación vascular acuática, debido a que la fuerte corriente no permite que este tipo de plantas se establezcan aquí, sin embargo, un abundante O2 disuelto en el agua sería benéfico para el crecimiento de estas especies vegetales, los ramilletes de estas plantas podrían servir de refugio para las tortugas y presumiblemente como alimento (Urueña-Aranda 2007). Es probable que la condición actual del río Prado sea diferente a la del pasado, antes de la creación del embalse, razón por la cual estos resultados no coinciden con lo reportado para P. lewyana, donde se menciona que la tortuga prefiere las aguas del río con abundante O2 disuelto (Hurtado 1973).
La transparencia del agua oscila entre 10-16 cm en el río Prado, esto indica que el agua es bastante turbia. Estos resultados no coinciden con Hurtado (1973), quien mencionó que P. lewyana prefiere las aguas transparentes de los ríos. Sin embargo, la turbidez del agua es benéfica para las tortugas en cuanto a que disminuye la visibilidad de los depredadores, al tiempo que aumenta su camuflaje impidiendo su depredación (Reese & Welsh 1998, Urueña-Aranda 2007).
En los sectores del río Prado donde no hay PPT las condiciones físicas del río pueden no ser apropiadas para los movimientos de las tortugas, ya que el agua es poco profunda, las corrientes son fuertes y el lecho del río es pedregoso. Dahl & Medem (1964) sugieren que P. lewyana puede ser capaz de manejar las fuertes corrientes en aguas profundas pero no en aguas someras, debido a que en estas últimas hay más obstáculos (por ejemplo rocas) que eludir. Es precisamente en los sitios del río Prado que tienen una velocidad de corriente menor y una profundidad del río mayor donde se encontró PPT. Lo anterior concuerda con lo encontrado por Hurtado (1973) en el río Cocorná, Antioquía, y por Castaño-Mora et al. (2005) y Gallego-García & Castaño-Mora (2008) en el río Sinú, Córdoba, quienes señalan que la tortuga de río se encuentra en remansos profundos con fondos llenos de hojas y palos para refugiarse, incluso Gallego-García (2004) encontró que a una mayor profundidad del río, se encuentran individuos de P. lewyana de mayor tamaño.
Lugares de refugio, descanso y asoleamiento. En los sitios donde hay PPT, las rocas que sobresalen del agua y los peñones que están presentes únicamente en estos sitios son bastante anchos, tienen la cualidad de tener bajo el agua túneles, cuevas y solapas que sirven de resguardo a las tortugas, lo que les provee un lugar de asoleamiento y refugio simultáneos.
En el río Prado el número de empalizadas no difirieron entre sitios con y sin PPT. Si se asocia este tipo de perchas, que generalmente tienen espacios intrincados bajo el agua, con la profundidad del río, se tiene una cobertura de refugio y escape mayor bajo el agua en lugares más profundos, es decir, en los sitios con PPT. Esta asociación también provee a las tortugas de lugares simultáneos de asoleamiento y refugio (Hurtado 1973, Reese & Welsh 1998).
Las perchas o sitios de asoleamiento son críticos en la termorregulación de las tortugas, particularmente cuando la temperatura del agua es baja, esto puede significar que las tortugas pasen más tiempo asoleándose, hasta que la temperatura del cuerpo sea apta para permitir que los procesos fisiológicos y energéticos resultantes sean adecuados para las funciones de la vida normal, como la alimentación, la evitación de depredadores y la reproducción (Boyer 1965, Reese & Welsh 1998). No obstante su importancia, es evidente que no solo la cantidad de lugares de descanso y asoleamiento determinan el uso de ciertos sitios en el río Prado por parte de las tortugas, la disponibilidad de alimento suficiente, de playas de anidación y ciertas características físicas del río parecen ser más relevantes para las tortugas a la hora de escoger sus lugares de estancia, como lo registraron para otras especies de tortugas Boyer (1965), Bury (1979), Flaherty & Bider (1984), Shively & Jackson (1985), Harrel et al. (1996), Roosenburg (1999), Schleicher & Loehr (2001), Bodie (2001), Moll & Moll (2004) y Urueña-Aranda (2007).
Disponibilidad de alimento. En las trampas de hojarasca se recolectó un mayor número de especies vegetales y de especies que hacen parte de la dieta de P. lewyana en los sitios con PPT. En estos sitios el aporte relativo de peso en gramos de las plantas también fue mayor, lo cual significa una mayor disponibilidad de alimento en los sitios con PPT.
Aunque existe una gran lista de especies consumidas por P. lewyana en el río Prado, hay más plantas disponibles que probablemente hagan parte de su dieta y que aún no se han detectado. El número de especies vegetales recolectadas en las trampas de hojarasca en los sitios con PPT fue mayor al número de plantas registradas en los transectos de la caracterización de la vegetación, esto se debe a que en los transectos solo se tuvo en cuenta plantas con DAP mayor a 3 cm. Lo anterior hace evidente que hay plantas como enredaderas, lianas, epífitas, etc., con diámetros más pequeños que también aportan material al río y que es probable que la tortuga consuma. Es necesario seguir con estudios acerca de la dieta de esta tortuga en el río Prado y en las demás áreas de su distribución, con el fin de usar esta información en la creación y desarrollo del plan de conservación y manejo de la especie.
Relación entre las variables del hábitat con la presencia y la abundancia relativa de P. lewyana en el río Prado. La velocidad de la corriente, la profundidad del río, la cobertura de la vegetación ribereña y el O2 disuelto en el agua, fueron de las variables medidas, las que más influyeron en las tortugas del río Prado, la primera en la presencia de P. lewyana y las otras tres en su abundancia. Como se mencionó anteriormente, la baja velocidad de la corriente permite a las tortugas una estabilidad y maniobrabilidad mejor en el agua sin demasiado esfuerzo. Una profundidad alta les ofrece a las tortugas mayor espacio de movimiento (Urueña-Aranda 2007), si esta variable se asocia con las perchas, brinda a las tortugas mayores áreas de refugio y cobertura de escape (Reese & Welsh 1998). Una mayor cobertura de la vegetación unida a una mayor diversidad de especies vegetales les ofrece más alimento a las tortugas. Resultados similares sobre las características del hábitat fueron documentadas para la tortuga blanca (Dermatemys mawii) en México (Ureña-Aranda 2007), en donde también se evidenció la importancia de la profundidad del río, la cobertura de la vegetación ribereña y el O2 disuelto en el agua, como aspectos determinantes en la presencia de las tortugas.
Como recomendación para la conservación de P. lewyana en el río Prado se debe proteger y restaurar la vegetación del borde del río, lo cual tendría beneficios no solo para la tortuga, sino también para los Bosques Secos Tropicales, bioma tan amenazado en Colombia. Por otro lado, como perspectivas futuras se sugiere emprender estudios acerca de la contaminación por residuos químicos, basuras y aguas residuales en el río Prado, y buscar las mejores soluciones para el tratamiento de las aguas y determinar sus efectos en las tortugas de río. También se propone enseñar y concientizar a los habitantes de la región que la restauración del hábitat de la tortuga también les brindará beneficios a ellos mismos y a otras especies de animales de importancia económica en la zona. Finalmente, se recomienda realizar estudios de caracterización del hábitat en otras poblaciones de la tortuga con el fin de crear planes de manejo y conservación para la especie a nivel nacional.
AGRADECIMIENTOS
Agradecemos a la Universidad Nacional de Colombia, en especial al Instituto de Ciencias Naturales y a los grupos de Reptiles y de Conservación y Manejo de Vida Silvestre por su colaboración en el desarrollo del proyecto. A la Turtle Conservation Fund (TCF) y a la División de Investigación de Bogotá (DIB) de la Universidad Nacional de Colombia por la financiación del proyecto. A las entidades administrativas, educativas y personas del municipio de Prado, y a los biólogos que colaboraron con todo el proceso de esta investigación.
LITERATURA CITADA
1. ANDERSON, S.H. & K.J. GUTZWILLER. 2005. Habitat Evaluation Methods. Pp. 592-606 en: Techniques for Wildlife Investigations and Management. Edited by Clait e Braun. Grouse Inc. And School of Natural Resources. University of Arizona. Tucson. Arizona. [ Links ]
2. ARESCO, M.J. 2005. The effect of sex-specific terrestrial movements and roads on the sex ratio of freshwater turtles. Biological Conservation 123: 37-44. [ Links ]
3. BALES, R.C. & M.H. CONKLIN. 2000. GLOBE Guía para Educadores. Universidad de Arizona, Tucson, Arizona, Estados Unidos. 221 pp. (http://archive.globe.gov/sda/tg97es/hidrologia/Contenidos_toc.html) [ Links ]
4. BODIE, J. R. 2001. Stream and riparian management for freshwater turtles. Journal of Environmental Management 62: 443-455. [ Links ]
5. BOYER, D.R. 1965. Ecology of the Basking Habit in Turtles. Ecology 46 (1/2): 99-118. [ Links ]
6. Bury, R.B. 1979. Population Ecology of Freshwater Turtles. Pp. 571-602 en: Harless M. & H. Morlock. Turtles. Perspectives and Research. A Wiley Intercience Publication. John Wiley and Sons, New York. 695 pp. [ Links ]
7. CASTAÑO-MORA, O.V., G. CÁRDENAS-ARÉVALO, N. GALLEGO-GARCÍA & O. RIVERA-DÍAZ. 2005. Protección y Conservación de los Quelonios Continentales en el departamento de Córdoba. Convenio No. 28. Universidad Nacional de Colombia, Instituto de Ciencias Naturales – Corporación Autónoma Regional de los Valles del Sinú y San Jorge CVS. Bogotá, D.C. 185 pp. [ Links ]
8. CASTAÑO M., O.V. & F. MEDEM. 2002. Podocnemis lewyana. Pp. 92-94 en Castaño M., O.V. Libro Rojo de Reptiles de Colombia. Instituto de Ciencias Naturales – Universidad Nacional de Colombia, Ministerio del Medio Ambiente, Conservación Internacional – Colombia. Bogotá, D.C. [ Links ]
9. CHAO, A. 1984. Nonparametric estimation of the number of classes in a population. Scandinavian Journal of Statistics 11: 265-270. [ Links ]
10. COLWELL, R.K. 2009. Statistical estimation of species richness and shared species from samples. University of Connecticut, USA. Version 8.2.0. 20 Julio 2009. [ Links ]
11. COLWELL, R.K. & CODDINGTON, J.A. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of the Royal Society (Series B) 345:101-118. [ Links ]
12. COMPTON, B.W., J.M. RHYMER & M. MCCOLLOUGH. 2002. Habitat Selection by Wood Turtles (Clemmys insculpta): An Application of Paired Logistic Regression. Ecology 83(3): 833-843. [ Links ]
13. DAHL, G. & F. MEDEM. 1964. Parte II: Los Reptiles Acuáticos de la Hoya del Sinú. Pp. 110-151 en: Informe sobre la fauna acuática del Sinú. Corporación Autónoma Regional de los valles del Magdalena y Sinú (CMV). Departamento de Pesca. Invest. Ictiol. Fauna. 160 pp. [ Links ]
14. DAHL, G., F. MEDEM & A. RAMOS H. 1965. Informe. El Bocachico. Contribución al estudio de su biología y de su ambiente. Departamento de pesca de la Corporación Autónoma Regional de los valles del Magdalena y del río Sinú (CMV). Bogotá, D.C. 144 pp. [ Links ]
15. DASSMAN, W. 1971. If Deer are to Survive. Stackpole Press, Harrisburg. 127 pp. [ Links ]
16. DUQUE, Á., D. CÁRDENAS & N. RODRÍGUEZ. 2003. Dominancia florística y variabilidad estructural en bosques de tierra firme en el noroccidente de la Amazonía colombiana. Caldasia 25(1): 139-152. [ Links ]
17. FLAHERTY, N. & J.R. BIDER. 1984. Physical Structures and the Social Factor as Determinants of Habitat Use by Graptemys geographica in Southwestern Quebec. American Midland Naturalist 111(2): 259-266. [ Links ]
18. GALLEGO-GARCÍA, N. 2004. Anotaciones sobre la historia natural de la tortuga de río Podocnemis lewyana (Testudinata: Podocnemididae) en el río Sinú, Córdoba, Colombia. Tesis de pregrado en Biología. Universidad Militar Nueva Granada. Bogotá, D.C. 83 pp. [ Links ]
19. GALLEGO-GARCÍA, N & O.V. CASTAÑO-MORA. 2008. Ecology and Status of the Magdalena River Turtle, Podocnemis lewyana, a Colombian Endemic. Chelonian Conservation and Biology 7(1): 37-44. [ Links ]
20. GENTLEMAN, R. & R. IHAKA. 1997. The R foundation for statistical computing, version 2.6.1 (2007-11-26). The Statistics Department of the University of Auckland. [ Links ]
21. GENTRY, A. 1982. Phytogeographic patterns in northwest South America and South Central America as evidence for a Chocó refuge. In G. Prance (ed.). Biological diversification in the tropics. Columbia. University Press. Nueva York. Pp. 112-136. [ Links ]
22. GONZÁLEZ-ZÁRATE, A. 2010. Caracterización del hábitat, uso de recursos y estado de conservación de la tortuga de río Podocnemis lewyana, en el río Prado, aguas abajo del embalse de Hidroprado, Tolima, Colombia. Tesis de maestría. Universidad Nacional de Colombia. MSc Biología, Línea de Manejo y Conservación de Vida Silvestre. Bogotá, D.C. 129 pp. [ Links ]
23. GRAHAM, T.E. 1979. Life History Techniques. Pp. 73-95 en: Harless M. & H. Morlock. Turtles. Perspectives and Research. A Wiley Intercience Publication. John Wiley and Sons, New York 695 pp. [ Links ]
24. GYSEL L.W. & L.J. LYON. 1980. Análisis y Evaluación de Hábitat. Pp. 321-343. En: R. Rodríguez Tarrés (ed.). Manual de Técnicas de Gestión de Vida Silvestre. Wildlife Society. Maryland. 703 pp. [ Links ]
25. HAMMER, O., D.T.A. HARPER & P.D. RYAN. 2001. Past: Paleontological statistics software package for education and data analysis. Paleontología Electrónica 4 (1): 1-9. Past version 1.97. [ Links ]
26. HARREL, J.B., C.M. ALLEN & S.J. HEBERT. 1996. Movements and Habitat Use of Subadult Alligator Snapping Turtles (Macroclemys temminckii) in Louisiana. American Midland Naturalist 135(1): 60-67. [ Links ]
27. HURTADO S., N. 1973. Algunos aspectos bioecológicos de Podocnemis lewyana (Dumeril 1852); (Testudinata, Pleurodira, Pelomedusidae 1830). Informe. Centro de Investigaciones Biológico Pesquero del Río Magdalena "La Dorada" Caldas. 34 pp. [ Links ]
28. IAVH. 1998. Instituto Alexander von Humboldt. El Bosque seco Tropical (Bs-T) en Colombia. Programa de Inventario de la Biodiversidad. Grupo de Exploraciones y Monitoreo Ambiental GEMA. Villa de Leyva. 24 pp. [ Links ]
29. INSTITUTO GEOGRÁFICO AGUSTÍN CODAZZI. 1996. Diccionario Geográfico de Colombia. Tomo 3. Tercera edición. Bogotá. 1774 pp. [ Links ]
30. IVERSON, J.V. 1992. A revised checklist with distribution maps of the turtles of the word. Earlham College. Privately Printed. Richmond, Indiana. 75 pp. [ Links ]
31. LEGENDRE, P. & L. LEGENDRE. 1998. Numerical Ecology. 2nd English Ed. Elsevier. 853 pp. [ Links ]
32. LOZANO B., L.A. 2005. Tesis de Maestría. Patrones Ecológicos de un Relicto de Bosque Seco Tropical Ribereño, en el C.U.R.N. de la Universidad del Tolima. Universidad del Tolima. Facultad De Ciencias. Ibagué. Armero - Guayabal - Colombia. 105 pp. [ Links ]
33. LUDWIG, J.A. & J.F. REYNOLDS. 1988. Statistical ecology. A primer on methods and computing. John Wiley and Sons. Nueva York. 337 pp. [ Links ]
34. MAGURRAN, A.E. 2004. Measuring biological diversity. Blackwell Science Ltd. Oxford. 256 pp. [ Links ]
35. MÁRQUEZ C., G. 1985. Sucesión ecológica en impacto ambiental en el Embalse de Hidroprado, Tolima, Colombia. Universidad Nacional de Colombia. Boletín Departamento de Biología 2(6): 69-85. [ Links ]
36. MÁRQUEZ C., G. & G. GUILLOT M. 2001. Ecología y efecto ambiental de embalses. Aproximación con casos colombianos. Facultad de Minas, Instituto de estudios ambientales. Facultad de Ciencias, Departamento de Biología, Universidad Nacional de Colombia. Medellín. 218 pp. [ Links ]
37. MITCHELL, J.C. & M.W. KLEMENS. 2000. Primary and Secondary Effects of Habitat Alteration. En M.W. Klemens. Turtle Conservation. Smithsonian Institution Press. Washington D.C. y Londres. 334 pp. [ Links ]
38. MOLL, E.O. 1997. Effects of habitat alteration on river turtles of tropical Asia with emphasis on sand mining and dams: 37-41. In: J. Van Abbema (ed.). Proceedings: Conservation, Restoration, and Management of Tortoises and Turtles - An International Conference. Nueva York. [ Links ]
39. MOLL, D. & E.O. MOLL. 2000. Conservation of River Turtles. Pp. 126-155 en: Klemens, M.W. Turtle Conservation. Smithsonian Institution Press, Washington D.C. [ Links ]
40. MOLL, D. & E.O. MOLL. 2004. The Ecology, Exploitation and Conservation of River Turtles. Oxford. University Press. Nueva York. 241-263 pp. [ Links ]
41. MORRISON, M.L., B.G. MARCOT & R.W. MANNAN. 1998. Wildlife – Habitat Relationships. Concepts and Applications. Second edition. The University of Wisconsin Press. 435 pp. [ Links ]
42. PHILLIPS, O., M. JAMES & A. GENTRY. 2002. Global Patterns of Plant Diversity. Alwyn H. Gentry Forest Transect Data Set (MSB 89). Missouri Botanical Garden Press, St. Loius. [ Links ]
43. PRIMACK, R., R. ROZII, F. MASSARDO & P. FEINSINGER. 2001. Destrucción y Degradación del Hábitat: 183-223. En: Primack, R., R. Rozii, P. Feinsinger, R. Dirzo & F. Massardo. Fundamentos de Conservación Biológica, Perspectivas latinoamericanas. Fondo de cultura económica. México, D.F. [ Links ]
44. PRITCHARD, PCH. 1979. Encyclopedia of turtles. TFH Publications, Neptune, New Jersey. 755-757 pp. [ Links ]
45. QUINTO M., H., Y.A. RAMOS P. & D. ABADÍA B. 2007. Hojarasca como medida de la productividad primaria neta en un bosque pluvial tropical en Salero, Chocó, Colombia. Revista Institucional Universidad Tecnológica del Chocó D.L.C. 26: 28-41. [ Links ]
46. RANGEL-CH, J.O & A. VELÁSQUEZ. 1997. Métodos de estudio de la vegetación: 59-87. En: J.O. Rangel-Ch., P.D. Lowy C. & M.A. Puentes. Colombia Diversidad Biótica II. Tipos de vegetación en Colombia. Universidad Nacional de Colombia. Ministerio del Medio Ambiente. Bogotá, D.C. [ Links ]
47. REESE, D.A. & H.H. JR. WELSH. 1998. Habitat use by western pond turtles in the Trinity River, California. Journal of Wildlife Management 62(3): 842-853. [ Links ]
48. RESTREPO, A. 2008. Diferencias poblacionales y estado de conservación de la tortuga de río, Podocnemis lewyana, en la Depresión Momposina, Colombia. Tesis de Maestría. Instituto de Biología. Universidad de Antioquia, Medellín. 109 pp. [ Links ]
49. ROLDAN P., G. & J.J. RAMÍREZ R. 2008. Fundamentos de limnología neotropical. 2ª Edición. Editorial Universidad de Antioquía, Medellín. 440 pp. [ Links ]
50. ROOSENBURG, W.M., K.L. HALEY & S. MCGUIRE. 1999. Habitat Selection and Movements of Diamondback Terrapins, Malaclemys terrapin, in Maryland Estuary. Chelonian Conservation 3(3): 425-429. [ Links ]
51. SCHLEICHER, A. & V.J.T. LOEHR. 2001. Husbandry, Behavior and Captive Breeding of the Nama Padloper, Homopus bergeri, from Southwestern Namibia. Chelonian Conservation and Biology 4(1): 165-170. [ Links ]
52. SHIVELY, S.H. & J.F. JACKSON. 1985. Factors Limiting the Upstream Distribution of the Sabine Map Tutle. American Midland Naturalist 114(2): 292-303. [ Links ]
53. SOKAL, R.R. & F.J. ROLF. 1985. Biometry. 3ra edition. W.H. Freeman and Company, Nueva York. 888 pp. [ Links ]
54. UICN. 2010. The UICN Red List of Threatened Species. http://www.redlist.org/search. Consultado 10 de octubre de 2008. [ Links ]
55. URUEÑA-ARANDA, C. 2007. Evaluación de hábitat de la tortuga blanca (Dermatemys mawii, Gray 1847) en humedales de la Cuenca baja del río Papaloapan, Veracruz. Tesis de maestría. Xalapa, Veracruz, México. 87 pp. [ Links ]
56. VARGAS-RAMÍREZ, M., N. MESA-FERNÁNDEZ, A. GONZÁLEZ-ZÁRATE & O.V. CASTAÑO-MORA. 2007. Participatory research towards the conservation of the endangered-endemic river turtle Podocnemis lewyana in the Upper Magdalena River, Colombia. Biological component. Final report. http://www.fundacionbiodiversa.org/proyectos_tortuga.htm. 60 pp. [ Links ]