Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.33 no.2 Bogotá Jul./Dec. 2011
Effects of water level fluctuation on rotifers assemblage structure in Largo lake (Yahuarcaca sistem - river Amazon floodplain - Colombia)
CAMILO ANDRADE-SOSSA
MIGDALIA GARCÍA-FOLLECO
CARLOS A. RODRÍGUEZ-MUNAR
SANTIAGO R. DUQUE
EMILIO REALPE
Grupo de Estudios en Recursos Hidrobiológicos Continentales, Grupo de Estudios en Zooplancton Neotropical. Profesor Departamento de Biología, Universidad del Cauca, Popayán, Colombia. ceandrade@unicauca.edu.co
Grupo de Investigación de Bioprocesos y Flujos Reactivos, Universidad Nacional de Colombia, Sede Medellín. migarciaf@unal.edu.co
U.T. T.I.P Petrolabin, Instituto Colombiano del Petróleo -ICP- Ecopetrol, Piedecuesta, Colombia. labbiotecnologiaecotoxicidad@ecopetrol.com.co
Instituto Amazónico de Investigaciones-Imani, Universidad Nacional de Colombia - Sede Amazonia, Leticia, Colombia. srduquee@unal.edu.co
Laboratorio de Zoología y Ecología Acuática - LAZOEA, Departamento de Ciencias Biológicas, Bogotá D.C., Colombia. erealpe@uniandes.edu.co
RESUMEN
Se realizó un reconocimiento taxonómico y estimación de la densidad en el ensamblaje de rotíferos en el lago Largo, del sistema de lagos Yahuarcaca, en la ribera colombiana del río Amazonas, a partir de muestreos en las fases hidrológicas de aguas bajas, ascenso y descenso. Se identificaron 68 especies, 28 de ellas son nuevos registros para ambientes colombianos. Se encontró aumento en la riqueza en las épocas de ascenso y descenso, siendo mayor en la zona litoral respecto de la limnética, y la tendencia a mayor similitud taxonómica entre ambas zonas en el periodo de aguas bajas, debido al mínimo desarrollo de macrófitas en esta fase y la consecuente menor heterogeneidad espacial. Se observó el predominio de rotíferos con trofi adaptados para moler y triturar partículas (maleado y maleorramado) en las épocas de aguas bajas (Brachionus ahlstromi) y descenso (Filina saltator) y en la época de ascenso de Polyarthra vulgaris, con trofi adaptado para perforar y succionar fluidos de algas y otros organismos (virgado) y apéndices que favorecen la rápida natación. En general, se establecieron posibles relaciones entre la riqueza y la densidad de rotíferos con cambios en características como el desarrollo de vegetación acuática en el litoral, profundidad del lago, nivel de conectividad con los otros lagos del sistema Yahuarcaca, influencia de aguas blancas del Amazonas y negras de origen local, potenciales recursos nutricionales y depredadores, y posible efecto de arrastre por la corriente.
Palabras clave. Zooplancton, plancton, Amazonia, rotífera, pulso de inundación.
ABSTRACT
We conducted a taxonomic recognition and density estimation of the assemblage of rotifers in Lake Largo, in the floodplain system of Yahuarcaca, connected with the Amazon River, in Colombia. Two samplings were made for each hydrological phase (low water, filling and draining phases); 68 species were identified, 28 of them are new records for Colombian environments. We found an increased in species richness in the filling and draining phases, being higher in the littoral than in limnetic region, and a tendency to a higher taxonomic similarity between the two areas during low water periods, due to the reduced macrophyte development in that period and consequent reduced spatial heterogeneity. We observed the predominance of rotifers with trophi adapted for grinding and crushing particles (malleate and malleorramate) in low water phase (Brachionus ahlstromi) and draining phase (Filina saltator) and Polyarthra vulgaris, with a trophi adapted to pierce and suck out the fluids of algae and other organisms (virgate), and appendices that support the rapid swimming, at the filling phase. In general, we established possible relations between rotifers richness and density with changes in characteristics as the development of aquatic vegetation in the littoral zone, lake depth, level of connectivity with other lakes of Yahuarcaca system, level of influence of white waters from the Amazon river, and black waters from local origin, potentials nutritional resources and predators, and drag effect by the current.
Key words. Zooplankton, Plankton, Amazon, Rotifera, Flood pulse.
Recibido: 12/04/2010
Aceptado: 04/11/2011
INTRODUCCIÓN
El plancton en los ambientes asociados al sistema río-planicie de inundación (Junk et al. 1989) es afectado por el grado de conexión entre ríos y los lagos, de una forma directa a través del transporte por flujos de agua y/o indirecta, por los cambios en propiedades físicas y químicas (Aoyagui & Bonecker 2004a). La dinámica fluvial en sistemas con planicie de inundación implica cuatro fases hidrológicas (Drago 1981): (1) Ascenso, en donde materiales alóctonos comienzan a entrar a los lagos desde el río, (2) Inundación, cuando pierden su estado lenítico, (3) Descenso-drenaje, cuando la biomasa es transportada desde los lagos hacia el río y (4) Aislamiento, cuando restablecen su condición de hábitats leníticos y las comunidades son reguladas por procesos in situ. Como resultado de esta dinámica espacial y temporal, en los lagos asociados a la planicie de inundación se encuentra alta riqueza y abundancia de rotíferos, que juegan un papel importante en la cadena alimentaria, al transferir energía desde fuentes detríticas y los productores primarios, también extremadamente diversos, hasta niveles tróficos superiores (Robertson & Hardy 1984, Bonecker et al. 2005). Los rotíferos son particularmente importantes en el análisis de los efectos de la dinámica fluvial, debido a que presentan altas tasas de crecimiento intrínseco y cortos intervalos de renovación poblacional y con frecuencia alta tolerancia a una variedad de factores ambientales (Allan 1976).
Para la cuenca amazónica, investigaciones intensivas sobre taxonomía y ecología del zooplancton Rotífera de este tipo de ambientes han sido realizadas principalmente en la región central, comprendiendo la várzea, igapó y ríos de la Amazonia brasileña, donde la riqueza es próxima a 300 especies (Aoyagui & Bonecker 2004b). En general dentro de Suramérica los países con menor número de estudios son Colombia, Guyana y Guayana Francesa, a pesar de poseer una importante porción de lagos de la cuenca amazónica (Koste y José de Paggi 1982, Aoyagui & Bonecker 2004b). En Suramérica la mayoría de los estudios sobre rotíferos en sistemas de planos de inundación se han realizado en Brasil, Argentina y Venezuela y principalmente en los ríos Amazonas, Paraná y Orinoco; en la mayoría se observa una mayor riqueza dentro de las familias Lecanidae, Brachionidae, and Trichocercidae y la tendencia a una mayor densidad en los períodos de aguas bajas, pero mayor riqueza en aguas altas especialmente relacionada con la homogenización faunística al incrementar la conectividad entre lagos (Aoyagui & Bonecker 2004a).
Los estudios publicados sobre rotíferos en lagos de planos inundables colombianos no costeros, son muy escasos; se restringen a algunos complejos cenagosos asociados a los ríos San Jorge y Sinú, en sus tramos medio y bajo, respectivamente (Álvarez, 2010), San Jorge en su tramo inferior (Gallo-Sánchez et al. 2009, Villabona-González et al. 2011), Orinoco y Meta (Rivera et al. 2010) y Caquetá (Pinilla et al. 2007). En todos ellos, los rotíferos son los más ricos en especies dentro del zooplancton y en su mayoría tienen la más alta densidad. La riqueza ha sido usualmente mayor en aguas altas y su densidad mayor en aguas bajas, pero muestra particularidades en las tendencias de cambio que se han relacionado con diferencias en factores como el nivel de desarrollo y el tipo de vegetación acuática, magnitud de las modificaciones en la estructura física, los períodos de conexión entre lagos y afluentes, la oferta de recursos y la presión de depredadores, entre otros.
Considerando que no hay información publicada de los múltiples ambientes y amplias zonas inundables no costeras, asociadas a los sectores medio y bajo de numerosos ríos entre los que se destacan el Magdalena, Cauca y Atrato (vertiente Caribe), San Juan, Patía y Baudó (vertiente Pacífico), Amazonas y Putumayo (vertiente del Amazonas), es claro que el conocimiento taxonómico de los rotíferos de planos inundables colombianos y de los patrones de cambio en composición y abundancia es aún muy escaso, lo que también se aplica para los ambientes de la alta Amazonia, en Colombia, Perú, Ecuador y Bolivia (Aoyagui & Bonecker 2004b). El presente estudio plantea la hipótesis de que si las fases de inundación por aguas del Amazonas y la quebrada Yahuarcaca generan cambios en la conectividad entre ambientes del sistema de lagos, en la posibilidad de arrastre por la corriente y en la oferta de alimento, como concentración de partículas suspendidas y organismos asociados y la densidad de algas, entonces estos serán reflejados en el lago Largo con el aumento en la riqueza en los períodos de mayor conexión hidrológica y en el predominio de rotíferos con diferentes estrategias alimenticias y de locomoción a través de los períodos de aguas bajas, ascenso y descenso. Los objetivos de este estudio son 1) Identificar las especies de rotíferos litorales y limnéticos del lago Largo, 2) Determinar los cambios en la composición específica, riqueza, densidad poblacional, y estrategias tróficas dominantes, a partir de muestreos realizados durante los períodos de aguas bajas, ascenso y descenso 3) Hacer algunas observaciones sobre la forma como las características físico-químicas (pH, conductividad, penetración lumínica) varían entre periodos de muestreo y podrían reflejar a su vez cambios que afecten la estructura del ensamblaje de rotíferos.
MATERIALES Y MÉTODOS
Descripción del área de estudio
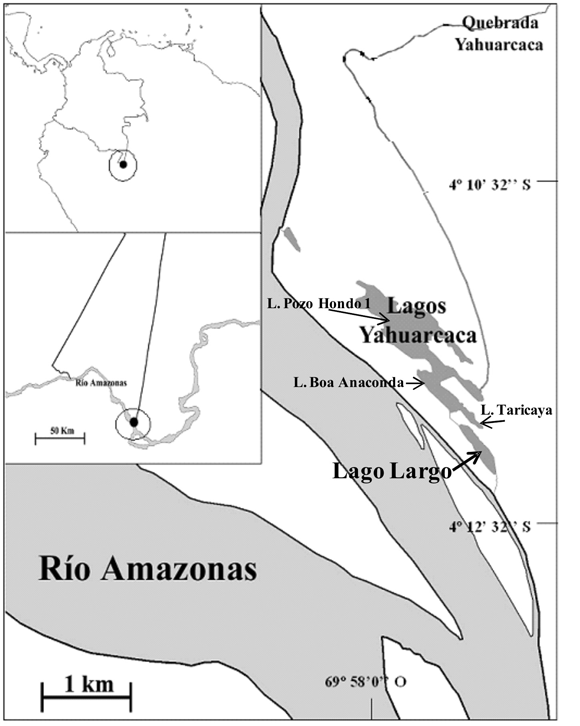
El sistema de lagos de Yahuarcaca se localiza en la margen colombiana del río Amazonas, a 2 km al oeste de la ciudad de Leticia (4°11'16" LS y 69°58'16" LW), a una altitud de 82 msnm. Este sistema está constituido por 17 lagos interconectados por canales naturales que pueden llegar a desconectarse entre sí en los períodos de estiaje (Salcedo-Hernández et al. 2011). Sus cuatro lagos principales, se ubican justo antes de la desembocadura de la quebrada Yahuarcaca en el Amazonas (Figura 1): Largo (lago I), Taricaya (II), Boa Anaconda (III) y Pozo Hondo 1 (IV). Los lagos II al IV son influenciados más frecuente y directamente por aguas negras Tipo I (según convención de Núñez-Avellaneda & Duque 2001) provenientes de la quebrada Yahuarcaca, mientras que el Lago Largo recibe en forma más directa influencia de aguas blancas Tipo I del río Amazonas, estando separado de éste por una barra de sedimentos aluviales pero conectado en forma directa a través de un canal de doble flujo con aproximadamente 150 m de longitud. En las orillas de este lago (litoral), en épocas de aguas altas se desarrolla una matriz de plantas acuáticas donde predomina el gramalote (Paspalum repens) y en ocasiones también son abundantes Pistia stratiotes y Lemna gibba, entre otras. Este lago tiene un área de aproximadamente 0.1 km2 en la época de aguas más bajas y presenta profundidades que fluctúan entre 2 y 8 m de acuerdo con el período hidrológico. Tiene un patrón de estratificación térmica que se acerca al modelo polimíctico continuo cálido que indica Lewis (1983), aunque la información existente muestra que usualmente la estratificación solo dura unas pocas horas en la tarde (Salcedo-Hernández et al. 2011). El patrón de distribución de las lluvias es unimodal-biestacional, presentándose un período de bajas lluvias en julio y agosto, un período de transición de septiembre a noviembre y el período de altas lluvias de diciembre hasta abril, cuando inicia una transición hacia bajas lluvias. En el sector colombiano del río Amazonas (116 km) se presentan fluctuaciones del nivel que dependen del régimen de lluvias en la zona andina, que difiere del régimen local; para el período de estudio los niveles máximos se presentaron en marzo, abril y mayo (13.4 m), en junio comenzó a decrecer hasta alcanzar niveles mínimos en septiembre y octubre (1.9 m).
Análisis de campo y laboratorio
Coincidiendo con las épocas hidrológicas de aguas bajas, ascenso y descenso, se tomaron muestras en dos estaciones: una en aguas abiertas (limnética) y otra en aguas libres dentro de los macrófitos del litoral. En la época de aguas bajas no se presentó crecimiento notable de macrófitos en el lago Largo, por lo cual se muestreo en el área limnética y en una zona cercana a la ribera, con escasa cobertura vegetal. En cada sitio se realizaron dos muestreos de plancton por período hidrológico (distanciados ocho días) y se midieron las variables: profundidad total (Ecosonda Garmin), transparencia (profundidad de Secchi), temperatura, pH, conductividad (YSI 33) y oxígeno disuelto (Equipo YSI 55 multiparamétrico). Las muestras de rotíferos fueron colectadas usando una trampa Schindler-Patalas, con la cual se tomaron 20 litros a nivel sub-superficial, a la profundidad del Disco Secchi (DS) y a 3DS; el volumen total fue filtrado a través de una red de 35 µm. La fijación se realizó con formalina hasta obtener una concentración final del 4%. Adicionalmente, se transportaron hasta el laboratorio muestras refrigeradas con los especímenes vivos para facilitar la determinación taxonómica, que se basó principalmente en Ruttner-Kolisko (1974), Koste (1978), De Smet & Pourriot (1995), Segers (1995), Nogrady et al. (1995), Nogrady & Segers (2002). Los conteos se realizaron con cámara Sedwick-Rafter bajo microscopio binocular, de acuerdo con las técnicas convencionales (José de Paggi y Paggi 1995).
Tratamiento de datos
Como diversidad alfa se consideró la riqueza (número de especies). Para la diversidad beta, se exploraron similitudes entre períodos y zonas de muestreo, de dos formas: 1. Calculando la afinidad faunística con el coeficiente de Jaccard, graficada utilizando la técnica de ligamiento promedio (UPGMA); 2. Realizando un análisis de ordenación no métrico multidimensional (NMDS) con base en el coeficiente de Morisita (1959). Para analizar algún tipo de preferencia en la distribución de las especies por el sector litoral o limnético, estas fueron organizadas de acuerdo al índice de constancia, expresado como el porcentaje de muestras (en cada zona de muestreo) donde una especie dada estuvo presente: Especies constantes C > 50% de las muestras, especies accesorias 25% > C < 50%, especies accidentales C < 25%. A partir de este índice y de la frecuencia dentro de cada zona de estudio, se exploraron grupos de especies que se pudieran definir como: 1 y 2: características de la zona limnética y litoral, respectivamente, por ser solo constantes en cada una de ellas y en ocasiones además exclusivas; 3. Características en general del lago Largo para todo el estudio, por tener una frecuencia similar y alta en ambas zonas de muestreo; 4. Raras en todo el lago, con frecuencias muy bajas en ambas zonas de muestreo y 5. Muy raras, por ser exclusivas de una zona y a la vez muy poco frecuentes.
RESULTADOS
Aspectos hidrológicos y variables físico-químicas
Las fluctuaciones durante el período de estudio reflejan de una parte la influencia de la variación del nivel del río Amazonas (determinado por las lluvias en la región andina) y de otra, las variaciones del aporte indirecto de aguas desde la quebrada Yahuarcaca a través del sistema de lagos, determinado por las lluvias de tipo local en este sector sur de la Amazonia colombiana. Se distinguieron tres fases hidrológicas:
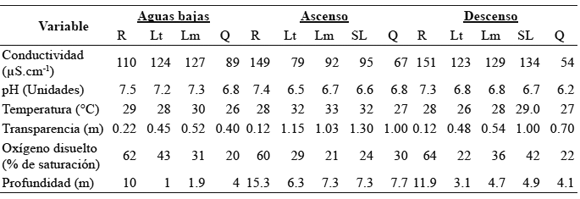
a) Fase de aguas bajas: Se evidenció únicamente drenaje en el eje lago - río y tendencia al aislamiento del lago Largo con respecto a los otros del sistema de Yahuarcaca (julio). Correspondió al período de menor profundidad en el lago (1.9 m en la zona limnética), debido a la ausencia de aportes desde el río y disminución desde la quebrada, ya que coincidieron el período de aguas bajas de los dos tributarios (nivel río: 10 m; quebrada: 4 m) y el de menor precipitación a nivel local. A pesar del drenaje hacia el río y la desconexión al final del período de muestreo, el lago Largo, con una escasa profundidad (media: 1.45 m; CV: 44), presentó valores en las variables físico-químicas más similares a las del Amazonas que a las de la quebrada Yahuarcaca, con elevada concentración de iones (conductividad media: 126 µS.cm-1 CV: 1.7), baja transparencia de Secchi (media: 0.49 m; CV: 10) y un pH superior a 7 (media: 7.2; CV: 1), características típicas de sistemas de aguas blancas en la Amazonia (Tabla 1). La cobertura de macrófitas fue muy reducida y no existió claramente un sector litoral con un cinturón de vegetación acuática en este lago.
Tabla 1. Variables físico-químicas en los periodos de muestreo.
b) Fase de ascenso, tanto del nivel del lago como del río y la quebrada. El Amazonas se encontraba en un nivel medio-alto (15 m), en proceso de aumento y a su vez ingresando hacia el lago a través del canal de conexión (finales de enero y comienzos de febrero). Pero también correspondió a la época de mayor pluviosidad de tipo local, lo que aumenta el aporte de aguas negras Tipo 1 desde la quebrada Yahuarcaca (con una profundidad de 8 m) y través del sistema de lagos, generando un fenómeno de dilución que se ve reflejado en una disminución de la conductividad promedio en el lago Largo (86 µS.cm-1; CV: 11). Al igual que la conductividad, características como el pH (media: 6.6; CV: 2.1) y transparencia (media: 1.1 m; CV: 7.8) presentan registros más similares a la quebrada que al río Amazonas (Tabla 1). La entrada del río hace que se observe un estancamiento del flujo de la quebrada Yahuarcaca provocando la inundación del bosque cercano y cubriendo áreas terrestres bajas que permanecen sumergidas temporalmente en zonas aledañas a la quebrada y a todo el sistema de lagos. En este período, el lago Largo presenta un notable aumento en profundidad (media: 6.8 m; CV: 10), y un sector litoral bien definido por el desarrollo de un cinturón de vegetación acuática con algunos desplazamientos de tapetes flotantes de macrófitos.
c) Fase de descenso. Coincidió el inicio de la fase de descenso del río (nivel: 12 m) y del lago (profundidad media: 3.9 m; CV: 29), con el final del período de transición hacia mínimas lluvias a nivel local (últimas fechas de junio) y consecuente disminución del nivel de la quebrada (4.1 m). Al ser el más próximo al canal principal de drenaje de todo sistema hacia el río Amazonas, las características físico-químicas del lago Largo en esta fase de descenso, están más influenciadas por el llenado previo debido a la inundación del río y combinación con las aguas del sistema de lagos, que por el aporte momentáneo de aguas negras Tipo 1 desde la quebrada Yahuarcaca. Esto se refleja en una mayor conductividad (media 126 µS.cm-1; CV: 3.4), ligero aumento en el pH (media: 6.8; CV: 0.0) y disminución de la transparencia (media: 0.5 m; CV: 8.3) en comparación con el período de ascenso. Al igual que en el período anterior, se presenta aún un sector litoral cubierto por vegetación acuática.
Composición específica y diversidad
En el lago Largo se determinaron 68 especies de rotíferos (pertenecientes a 28 géneros) que equivalen aproximadamente al 20% de las especies amazónicas conocidas. La mayoría son de amplia distribución, dos son exclusivas de la región neotropical (Brachionus amazonicus y Testudinella haueriensis) y de una tercera (Lecane eutarsa), según Seger (2007), se tienen sólo dudosos registros para otra zona diferente a la Neotropical. Se presentan 28 nuevos registros de especies con respecto a los publicados para ambientes colombianos (tabla 2). Los géneros Lecane (20 especies) y Brachionus (6) tuvieron la mayor riqueza; el número total de especies de rotíferos fue muy superior en la zona litoral (65) con respecto a la limnética (31). Los menores valores de riqueza se hallaron en la época de aguas bajas, con sólo 10 especies en la estación litoral y 13 en la limnética, en tanto que en las otras dos fases la riqueza en el litoral fue casi el doble que la de la región limnética (Figura 2). En comparación con la riqueza total del estudio, el promedio de cada muestreo fue bajo tanto en el litoral (media: 23; CV: 44.2) como en la zona limnética (media: 15.5; CV: 14), reflejando la aparición de un considerable número de especies diferentes entre uno y otro muestreo. La similitud faunística entre las dos zonas de muestreo fue en general baja (media: 35.4% CV: 28.2). El dendrograma refleja la mayor afinidad faunística entre muestreos del mismo sector y fase hidrológica; las únicas muestras litorales que tienden a asociarse con las limnéticas son las de la época de aguas bajas, cuando en el lago Largo el espejo de agua es pequeño, el desarrollo de macrófitos es muy escaso y la heterogeneidad ambiental es menor (Figura 3). Las mayores diferencias se deben a la riqueza del género Lecane en la zona litoral, con numerosos congéneres co-ocurrentes (hasta 12 especies en aguas en ascenso y 10 en descenso); únicamente tres especies de este género se encontraron en la región limnética (L. hamata, L. curvicornis y L. pusilla).
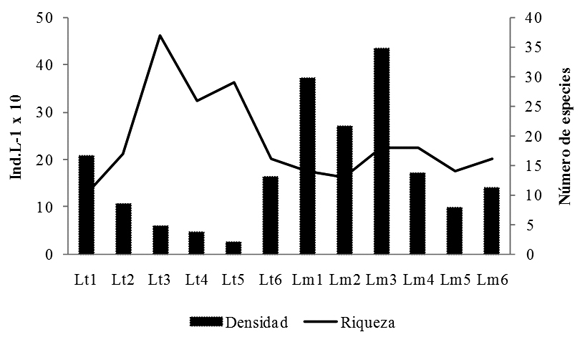
Lt: Litoral; Lm: Limnética. Fase de aguas bajas: 1 y 2; Fase de ascenso: 3 y 4; Fase de descenso: 5 y 6.
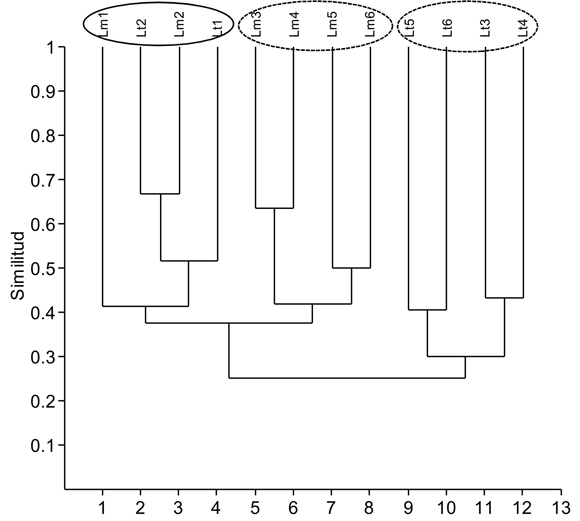
Algoritmo: Coeficiente de Jaccard. Método de aglomeración: UPGMA. Lt: litoral; Lm: limnética. Fase de aguas bajas: 1 y 2; fase de ascenso: 3 y 4; fase de descenso: 5 y 6.
En general, con diferentes valores del índice de constancia, más del 50% de las especies determinadas para el lago sólo se hallaron en la zona litoral. Con base en la frecuencia de presencia y el índice de constancia (tabla 2) se pudieron detectar cinco grupos de especies: 1) Las que sólo presentaron alta frecuencia y constancia en la zona limnética: A. sieboldi, E. clavulata, L. patela, S. pectinata, T. braziliensis y H. intermedia brasiliensis. 2) Sólo fueron constantes en la zona litoral y en los cuatro primeros casos exclusivas de este sector: L. rhomboides, L. bulla, L. pyriformis, L. tenuiseta, L. hamata, P. patulus var. macracanthus, A. navicula y T. similis. 3) Tuvieron una frecuencia similar y alta en las zonas litoral y limnética y corresponden a su vez con las más abundantes en varios de los muestreos: P. vulgaris, B. ahlstromi, A. fissa, F. saltator, F. longiseta, T. pusilla, P. complanata y D. claviger. 4) Especies que son igualmente accesorias en las dos estaciones: B. caudatus f. insuetus, C. dossuarius, T. patina. 5) El último grupo lo conforman en su mayoría especies accesorias y accidentales que fueron exclusivas de las muestras litorales y generalmente están incluidas dentro de los géneros Lecane, Brachionus, Platyias, Testudinella, Scaridium y Keratella, principalmente.
Densidad y estructura
Las especies dominantes en el área limnética y litoral fueron las mismas: B. ahlstromi, P. vulgaris y F. saltator, que presentaron las mayores densidades promedio y se encuentran en el grupo de los taxones constantes, con una frecuencia alta para ambas zonas del lago. Estas estuvieron acompañadas, con abundancias moderadamente altas en algunos períodos, por F. longiseta en la zona litoral y A. fissa y A. sieboldi en la zona limnética. Se presentaron fluctuaciones en la densidad total de rotíferos con respecto a las fases hidrológicas en los dos sectores de muestreo, pero fueron más evidentes en la zona litoral (Figura 2). La mayor densidad promedio corresponde a la época de aguas bajas para las dos estaciones (Limnética: 321 Ind.L-1, CV: 22.3; Litoral: 157 Ind.L-1, CV: 45.9). A pesar de que se podría esperar una fuerte reducción debido al notable aumento de profundidad en la fase de ascenso (el promedio pasa de 1.4 m a 6.8 m) en la zona limnética la densidad promedio sólo disminuye levemente (media: 303 Ind.L-1, CV: 61.1) y posteriormente, en lugar de aumentar en el periodo de descenso cuando la profundidad disminuye en promedio hasta los 3.9 m, la densidad se reduce a menos de la mitad (media: 120 Ind.L-1; CV: 61.1). En la zona litoral si se observa una reducción considerable en la densidad, cuando sube el nivel del agua en el ascenso (53 Ind.l-1; CV: 14.8) y tiende a aumentar nuevamente al iniciar el drenaje (100 Ind.L-1). Durante la época de agua bajas predominó B. ahlstromi, con densidad promedio de 121 Ind.L-1 (media: 51% de la densidad total, CV: 39), seguido en la zona limnética por A. fisa en el primer muestreo y por P. vulgaris en el segundo muestreo (Figura 4). Este último taxón dominó en el período de ascenso en los dos sectores del lago (media: 69%, CV: 19), alcanzando incluso las mayores densidades de todo el estudio en la zona limnética al inicio de la fase de ascenso (hasta 372 Ind.L-1), al tiempo que las demás especies presentan abundancias muy bajas. En el periodo de descenso, predominó F. saltator en ambos sectores de muestreo (media: 50%, CV: 20). Como un reflejo de las diferencias en las especies dominantes y de los cambios en las densidades, el análisis NMDS separó las tres fases hidrológicas y además evidenció: 1. Una mayor afinidad entre puntos y muestreos durante la fase de ascenso por el marcado predominio de P. vulgaris , 2. En el caso de aguas en descenso, mayor similitud entre muestreos de una misma zona que entre las dos zonas en un mismo momento.
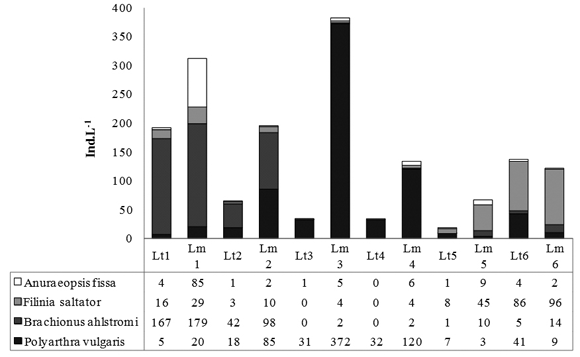
Representan entre el 56% y el 92% de la densidad total. Lt: Litoral; Lm: Limnética. Fase de aguas bajas: 1 y 2; Fase de ascenso: 3 y 4; Fase de descenso: 5 y 6.
DISCUSIÓN
La presencia de numerosas especies del género Brachionus, es un aspecto general de las aguas tropicales y subtropicales, como lo han apuntado autores como Pejler (1977), Green (1971) y específicamente en la región amazónica Robertson & Hardy (1984). Brachionus y Lecane se han considerado característicos de la zona tropical (Fernando 1980) y en la lista de chequeo proporcionada por Robertson & Hardy (1984) para los rotíferos en lagos y ríos amazónicos, Lecane es el taxón más rico en especies. Estos dos géneros suelen ser ricos en ambientes someros y su mayor diversidad se manifiesta en lagos con vegetación flotante (Segers et al. 1993). La vegetación litoral contribuye al aumento en la heterogeneidad ambiental, expresado como gradientes de complejidad morfológica-estructural, de formas de vida, de crecimiento y fenología y hasta de bioquímica en las macrófitas, facilitando una mayor disponibilidad de hábitats y nichos, fina partición espacial y consecuente baja competencia inter-específica (José de Paggi 1993, Lansac-Tôha et al. 2003, Poi de Neiff & Neiff 2006, Fulone 2008). Este ambiente es rico en material en descomposición sedimentado o adherido a las partes sumergidas de la vegetación, al igual que en perifiton y partículas suspendidas, con sus correspondientes comunidades de bacterias, hongos, protozoos y algas asociadas. Sedimentos, detritus y especialmente los organismos asociados, representan una valiosa oferta de alimento para numerosos rotíferos litorales tales como L. rhomboides L. bulla, L. pyriformis, L. tenuiseta, L. hamata, P. patulus var. macracantus, A. navicula y T. similis, que sólo fueron constantes en la zona litoral y en varios casos únicamente se encontraron en este sector. Taxones con menor frecuencia, pero también exclusivos de esta estación y conocidos como habitantes sobre vegetación acuática en descomposición (Hardy et al. 1984), fueron 15 especies del género Lecane, junto con P. patulus, T. dendradena, C. uncinata y M. ventralis.
La drástica reducción en tamaño y profundidad de lago, junto con la ausencia de un cinturón desarrollado de vegetación acuática durante la fase de aguas bajas, explican entonces que sólo en este período se asocien las muestras litorales con las limnéticas en el análisis de similitud faunística de Jaccard. Si bien dentro del lago Largo la heterogeneidad disminuye, es muy probable que en períodos de aguas bajas la heterogeneidad de todo el sistema Yahuarcaca aumente, debido a que al retirarse el río Amazonas y bajar al tiempo el nivel de la quebrada, la conectividad se reduce y la mayor influencia de factores locales hace que los lagos desarrollen su propias características limnológicas (Ward et al. 1999, Thomaz et al. 2007). En las fases de ascenso y descenso, la mayor superficie inundada, distancia entre las estaciones y en especial el desarrollo de una amplia matriz de vegetación litoral, incrementan la heterogeneidad espacial dentro del lago Largo, aunque la presencia de algunas especies típicamente limnéticas en la zona litoral (P. vulgaris, F. longiseta, entre otras) y viceversa (especies de Lecane, Mytilina y Brachionus, por ejemplo) permiten presumir la existencia de zonas de transición, a través de las cuales hay intercambio de especies, ayudado por el efecto del viento y las corrientes (José de Paggi 1993). Esta mayor heterogeneidad dentro del lago Largo, que hace que la similitud en la composición de rotíferos entre zonas litoral y limnética disminuya, probablemente contraste con la homogenización en fauna para el sistema de lagos de Yahuarcaca, debida a la más extensiva conexión entre ambientes, como es usual en los sistemas de planos de inundación (Aoyagui & Bonecker 2004a; Lansac-Tôha et al. 2004 y 2009; José de Paggi & Paggi 2008). La mayor riqueza en épocas de aguas altas en el lago Largo, puede estar también relacionada con dicha homogenización faunística entre lagos del sistema Yahuarcaca y por la incorporación de taxones bénticos y perifíticos favorecidos por la alta disponibilidad de alimento resultante de la descomposición de vegetación inundada (Aoyagui & Bonecker 2004a, Agostinho et al. 2008).
La contribución promedio de los rotíferos a la densidad total del zooplancton en los lagos de várzea amazónicos difiere considerablemente, pero es común que la densidad del zooplancton sea superior en la época de aguas bajas, cuando además los rotíferos son los dominantes (Brandorff & Andrade 1978, Carvalho 1983, Hardy et al.1984). Esto podría esperarse debido a que al reducirse el volumen de agua, presumible por la disminución de tamaño y de profundidad en el lago Largo, los organismos se concentrarían más y serían colectados entonces en mayor cantidad por unidad de volumen. Sin embargo, aún que en aguas bajas la profundidad de la zona fótica es reducida, junto al aumento en la concentración de nutrientes se da también un incremento en la densidad, productividad y biomasa fitoplanctónica (Salcedo-Hernández et al. 2011) y esta mayor oferta de algas planctónicas se convierte en un mayor recurso potencial para el zooplancton y puede explicar en parte su incremento en densidad. Twombly & Lewis (1987 y 1989) resaltaron para la laguna Orsinera, que los altos tamaños poblacionales de rotíferos y cladóceros en la época de aguas bajas indican que la producción primaria y abundancia del fitoplancton no fue un factor limitante a pesar de la alta turbidez. Además, este aumento puede ser también atribuido a la concentración de partículas y sustancias nutritivas provenientes de la región inundada en el período previo de aguas altas y a que dada la escasa profundidad, las partículas orgánicas pueden ser re-suspendidas fácilmente desde el fondo y mantenerse como un recurso disponible en la columna de agua (Carvalho 1983). La mayor disponibilidad de material orgánico particulado, con pequeñas algas, protozoos y organismos descomponedores asociados (bacterias y hongos), es evidenciado por el predominio de B. ahlstromi y de A. fissa en aguas bajas y en conjunto de F. saltator y F. longiseta en aguas en descenso. Las dos primeras, correspondientes a la familia Brachionidae, que posee trophi maleado, especialmente adaptado para agarrar partículas y molerlas antes de enviar el material triturado al esófago, las otras dos corresponden al orden Flosculariacea, caracterizado por poseer un trophi maleorramado, con una estructura similar al maleado y también utilizado para moler y triturar detritus y organismos asociados (Nogrady et al.1993).
La disminución de la conductividad y el aumento de la transparencia durante la fase de ascenso, cuando se combinan las aguas blancas y negras Tipo I, provenientes del río y la quebrada, indican que la concentración de sólidos disueltos y de material particulado suspendido es menor que en la época de aguas bajas. Esto se puede relacionar con el cambio en las especies que predominan; así, a pesar de que los detritívoros y moledores de partículas son en esta fase más ricos en número de especies, son reemplazados en dominancia por Polyarthra vulgaris; especie reconocida como planctónica (Hardy et al. 1984) y que posee un trofi virgado, con acción penetrante y de bombeo y que le sirve para alimentarse eficientemente de células algales (Nogrady et al. 1993). Se ha demostrado que Polyarthra vulgaris consume principalmente bacterias, clorofíceas unicelulares y pequeñas diatomeas (Bogdan & Gilbert 1987) y algunas Crysomonadales y Chryptomonadales (Buikema et al. 1977); estas dos últimas corresponden a la clase Cryptophyceae que en promedio es la más abundante dentro del fitoplancton del lago Largo (Salcedo-Hernández et al. 2011). Además, morfológicamente Polyarthra presenta paquetes de apéndices que actúan como remos, permitiéndole desplazarse normalmente a través de saltos con una velocidad cercana a 0.24 mm/seg, pero también desarrollar cortos estallidos de rápidos movimientos de escape con un promedio de 35mm/s (Nogrady et al. 1993). Esto podría ser una eficaz adaptación para huir de la actividad predatoria de rotíferos planctónicos como A. sieboldi (Gilbert 1980) o S. pectinata, que alcanza una abundancia de hasta 13 Ind.L-1 (3.0 %) en el período de ascenso, de copépodos depredadores de los géneros Mesocyclops y Termocyclops que Solarte (2008) reportó como más abundantes al inicio del ascenso y tal vez de larvas de Chaoborus (Moore & Gilbert 1987) cuyas fluctuaciones poblacionales no han sido analizadas en este lago.
Además, un factor que puede estar afectando la reducción en densidad de las otras especies de rotíferos es la corriente causada por el ingreso del río y por la salida de las aguas de los lagos, que llega inclusive a generar el movimiento de grandes praderas flotantes de macrófitos, cuya matriz está compuesta principalmente por Paspalum repens. El efecto negativo de la fuerza de la corriente sobre la densidad y la riqueza de especies zooplanctónicas ha sido también sugerido por Hardy et al. (1984) para el lago Camaleão (Amazonia central brasileña) y por varios autores en sistemas lóticos (José de Paggi 1981, Vásquez & Rey 1989). La estrategia de desplazamiento de Polyarthra podría entonces facilitar también su natación y permanencia en las aguas libres durante este período de ascenso, cuando fue el único taxón realmente dominante entre los rotíferos (media: 69%, CV: 19%) y en el tercer muestreo alcanza en la estación limnética la mayor densidad registrada por especie alguna durante todo el estudio (372 Ind.L-1 = 86% de la densidad de rotíferos) la cual fue inclusive mayor al promedio de densidad total de rotíferos para la época de aguas bajas.
Teniendo un predominio tan marcado, la abundancia de Polyarthra en el período de ascenso influye mucho en que la densidad total de rotíferos solo disminuya en un 6%, con respecto al promedio que había en época de aguas bajas, a pesar del esperado efecto de dilución y la tendencia a la reducción de iones, partículas suspendidas y densidad, biomasa y productividad algal que se da al aumentar el volumen de agua (Salcedo-Hernández et al. 2011). No existe evidencia de que las aguas del río contribuyeron directamente con organismos que explicaran esta escasa disminución en densidad, como si ha ocurrido en otros lagos en planicies inundables donde hay un incremento en densidades durante la inundación (Vásquez 1984) y de hecho Rodríguez (2003) para el mismo sistema de Yahuarcaca encontró una baja densidad de rotíferos en el canal de acceso durante los períodos en que el río ingresaba a los lagos. Además, el paso a través del canal de acceso y los sectores próximos a él sobre el lago Largo, estuvieron cubiertos por vegetación acuática durante la fase de ascenso, siendo de esperar una retención de organismos planctónicos por los macrófitos, como ha sido descrito para lagos en planicies inundables del Orinoco (Hamilton et al. 1990). La densidad es mayor en la época de aguas bajas, como ha sido registrado para varios lagos en planicies de inundación neotropicales (Brandorff & Andrade 1978, Carvalho 1983, Hardy et al. 1984, José de Paggi 1993, Lansac-Tôha et al. 2004, Pinilla et al. 2007, Gallo-Sánchez et al. 2009, Álvarez 2010, Villabona-González et al. 2011); sin embargo, con una reducción de tan sólo el 6% en la densidad total de rotíferos y un aumento de más de 5 m en la profundidad promedio (pasando de 1.4 m a 6.8 m), es de esperar que la abundancia total de rotíferos en el lago haya sido muy superior en la época de ascenso que en la de aguas bajas. Incrementos en el tamaño de las poblaciones del zooplancton al tiempo que disminuye la densidad también han sido observados por Twombly & Lewis JR. (1987) y Caraballo (1992) y podría ocurrir en muchos otros lagos de planos de inundación donde son comunes las extremas fluctuaciones de profundidad (Caraballo 2010). Esto no quiere decir que se deba dejar de lado la estimación de densidades, pues esta variable puede ser ecológicamente más importante que la abundancia total, ya que está relacionada con la forma como se distribuyen los organismos en el volumen de agua y esto a su vez influye en múltiples aspectos de las interacciones bióticas, como competencia y depredación, que son claves en la regulación de las comunidades acuáticas, pero si permite resaltar la importancia de considerar la estimación de los cambios en el volumen de los lagos de inundación, a pesar de lo complejo y en ocasiones costoso que esto pueda resultar, para poder estimar los cambios reales en la abundancia dentro de los lagos.
Durante el período de descenso, cuando la profundidad y la superficie inundada es intermedia con respecto a las otras dos fases hidrológicas, la conductividad y la transparencia (relacionada con la abundancia de material en suspensión) volvieron a ser semejantes a la época de aguas bajas, por lo cual, aunque las densidades promedio totales de rotíferos no llegaron a ser tan altas, los organismos con trofi moledores de partículas son nuevamente el grupo dominante; en este caso representados principalmente por las especies planctónicas F. saltator y F. longiseta. Las especies de este género presentan dos setas móviles anterolaterales que se ha considerado están relacionadas con la disuasión de los depredadores y tienen además una mayor actividad coronal posterior que les facilita los saltos a través de la columna de agua (Hochberg & Gurbuz 2007) lo que podría favorecer en parte su abundancia en este período, cuando los rotíferos depredadores presentan abundancias promedio entre el 4% y 9% en la estación limnética y hay un descenso de aguas desde los lagos hacia el río, con su consecuente efecto en la corriente.
Las fluctuaciones en el nivel del agua en el Lago Largo determinaron una mayor riqueza en los períodos de ascenso y descenso, pero esto no sólo estuvo relacionado con el aumento en la conectividad entre los lagos del sistema de Yahuarcaca, sino que fue especialmente determinado por el desarrollo de un cinturón de vegetación acuática que es ausente en el período de aguas bajas y que introduce una mayor heterogeneidad ambiental en el lago, lo que contrasta con el esperado efecto homogenizador de la inundación. La estructura del ensamblaje se modificó también por el cambio en las especies dominantes, siendo favorecidas en la fase de aguas bajas, y parcialmente en aguas en descenso, las que están mejor adaptadas para aprovechar el aumento de material en suspensión y organismos asociados, teniendo aparatos mandibulares que muelen y trituran alimento y en ascenso las que al parecer soportan en mejor forma el arrastre por la corriente y la presión de depredación de invertebrados, al tener estructuras que permiten rápidos desplazamientos en el agua y utilizar la estrategia de perforación y succión de alimento, en especial de pequeñas algas y bacterias. Se requieren, sin embargo, estudios adicionales que involucren análisis paralelos en diferentes niveles de las rutas tróficas (bacterioplancton, algas, otros grupos zooplanctónicos, peces), junto con mediciones más directas, al menos en las especies dominantes, del efecto de interacciones bióticas y cambios en variables como nutrientes, material orgánico suspendido y velocidad de corriente, para poder comprender en mejor forma las causas de las variaciones en la estructura del ensamblaje de rotíferos en el Lago Largo y el sistema Yahuarcaca en general.
AGRADECIMIENTOS
A la Sede Amazonia y a la Vicerrectoría de Investigación de la Universidad Nacional de Colombia (Proyectos 2009 y Programa Bicentenario - Amazonia) y a la Universidad del Cauca por el apoyo logístico y económico para la realización de las actividades de campo y laboratorio. Al profesor Ewald Roessler por sus sugerencias durante las actividades en laboratorio.
LITERATURA CITADA
1. AGOSTINHO, A., C.C. BONECKER & L.C. GOMES. 2008. Effects of water quantity on connectivity: the case of the upper Paraná River Floodplain. Echohidrology & Hidrobiology 10: 1-15. [ Links ]
2. ALLAN, J.D. 1976. Life history patterns in zooplankton. American Naturalist 110: 165–180. [ Links ]
3. ÁLVAREZ, J.P. 2010. Caracterización limnológica de las ciénagas de Arcial, El Porro y Cintura (Río San Jorge) y Bañó, Charco Pescao y Pantano Bonito (Río Sinú) departamento de Córdoba. En: J.O. Rangel-Ch. (ed.). Colombia Diversidad Biótica IX. Ciénagas de Córdoba: Biodiversidad, ecología y manejo ambiental. Instituto de Ciencias Naturales, Bogotá D.C. 818 p. [ Links ]
4. AOYAGUI, A.S.M. & C.C. BONECKER. 2004a. Rotifers in different environments of the Upper Paraná River floodplain (Brazil): richness, abundance and the relationship with connectivity Hydrobiologia 522: 281-290. [ Links ]
5. AOYAGUI, A.S.M. & C.C. BONECKER. 2004b. The art status of rotifer studies in natural environments of South America: floodplains. Acta Scientiarum. Biological Sciences 26 (4): 385-406. [ Links ]
6. BOGDAN, K.G. & J.J. GILBERT. 1987. Quantitative comparison of food niches in some freshwater zooplankton; a multi-tracer cell approach. Oecologia (72): 331-340. [ Links ]
7. BONECKER, C.C., CH.L. DA COSTA, L.F.M. VELHO & F.A. LANSAC-TÔHA. 2005. Diversity and abundance of planktonic rotifers in diferent environments of the Upper Paraná River floodplain (Paraná State – Mato Grosso do Sul State, Brazil). Hydrobiologia 546: 405-414. [ Links ]
8. BRANDORFF, G.O. & E.R. ANDRADE. 1978. The relationship between the water level of The Amazon River and the fate of the zooplankton population in Lago Jacaretinga, a varzea lake in Central Amazon. Studies on Neotropical Fauna and Environment 13: 63-70. [ Links ]
9. BUIKEMA, A.L. JR., J. JR. CAIRNS, P.C. EDMUNDS, T.H. KRAKAUER. 1977. Culturing and ecology studies of the rotifer Polyarthra vulgaris. Environmental Protection Agency, Report EPA 600/3-71-051. Washington, D.C. 53 p. [ Links ]
10. CARVALHO, M. L. 1983. Efeitos da fluctaçäo do nivel da agua sobre a densidad e composição do zooplancton em um Lago de Várzea da Amazonia, Brasil. Acta Amazonica 13(5-6): 715-724. [ Links ]
11. CARABALLO. P. 1992. Historia de vida e dinâmica populacional de Daphnia gessneri e Ceriodaphnia cornuta (Crustacea-Cladocera) no Lago Calado, AM. Dissertação de Mestrado. Pós-graduação INPA/FUA, Manaus. 145p. [ Links ]
12. CARABALLO, P. 2010. O papel da alça microbiana na dinâmica trofica de um lago de várzea na amazônia central . INPA. Programa de Pós-Graduação em Ecologia PGECO. Tese para obtenção do título de Doutor. Manaus. 219 p. [ Links ]
13. DE SMET, W.H. & R. POURRIOT. 1995. Rotifera Volume 5: The Dicranophoridae (Monogononta) and the Ituridae (Monogononta). T Nogrady, ed. Guides to the identification of the microinvertebrates of the continental waters of the world 12. SPB Academic Publishing, Amsterdam. [ Links ]
14. DRAGO, E.C. 1981. Grados de conexión y fases hidrológicas en ambientes leníticos de la llanura aluvial del río Paraná (Argentina). Ecología (Argentina) 6:27–33. [ Links ]
15. FERNANDO, C.H. 1980. The freshwater zooplankton of Sir Lanka, with a discussion of tropical freshwater zooplankton composition. Int. Revue. Ges. Hydrobiol. 65 (1): 85-125. [ Links ]
16. FULONE, L.J. 2008. Influência da complexidade estrutural de macrófitas aquáticas sobre a diversidade de organismos perifíticos. Universidade Estadual de Maringá. Dissertação de Mestrado. Maringá. 41p. [ Links ]
17. GALLO-SÁNCHEZ, L., N. AGUIRRE-RAMÍREZ, J. PALACIO-BAENA & J. RAMÍREZ-RESTREPO. 2009. Zooplancton (Rotifera y microcrustacea) y su relación con los cambios del nivel del agua en la ciénaga de Ayapel, Córdoba, Colombia. Caldasia 31(2):339-353. [ Links ]
18. GILBERT, J. 1980. Feeding in the rotifer Asplanchna: behavior, cannivalims, selectivity, prey defenses and impact on rotifer communities. . In W.C. Kerfoot (ed.). Evolution and Ecology of Zooplankton Communities. University of New England, Hanover, New Hampsshoire, USA. [ Links ]
19. GREEN, J. 1971. Latitudinal variation in associations of planktonic Rotifera. J. Zool. Soc. Lond. 167: 31-39. [ Links ]
20. HAMILTON, S., S. SIPPEL, W.M. LEWIS & J.J. SAUNDERS. 1990. Zooplankton abundance and evidence for its reduction by macrophyte mats in two Orinoco floodplain lakes. J. Plankton Res. 12: 345-363. [ Links ]
21. HARDY, E.R., B. ROBERTSON & W. KOSTE 1984. About the relationship between the zooplankton and fluctuating water levels of Lago Camaleão, a Central Amazonian varzea lake. Amazoniana 10(1): 43-52. [ Links ]
22. HOCHBERG, R. & O.A. GURBUZ. 2007. Functional morphology of somatic muscles and anterolateral setae in Filinia novaezealandiae Shiel and Sanoamuang, 1993 (Rotifera). Zoologischer Anzeiger - A Journal of Comparative Zoology 246 (1): 11-22. [ Links ]
23. JOSÉ DE PAGGI, S. 1981. Variaciones temporales y distribución horizontal del zooplancton en algunos cauces secundarios del río Paraná Medio. Studies on Neotropical Fauna and Environment 16: 185-199. [ Links ]
24. JOSE DE PAGGI, S. 1993. Composition and seasonality of planctonic rotifers in limnetic and litoral regions of a floodplain lake (Paraná River sytem). Rev. Hydrobiol. Trop. 26: 53-63. [ Links ]
25. JOSE DE PAGGI, S.J. & J.C. PAGGI. 1995. Determinación de la abundancia y biomasa zooplanctónica. Págs. 315–321. En: Ecosistemas de Aguas Continentales. Metodologías para su estudio. E. Lopretto & G. Tell (eds.). Ediciones Sur. La Plata, Argentina. [ Links ]
26. JOSE DE PAGGI, S.J. & J.C. PAGGI. 2008. Hydrological connectivity as a shaping force in the zooplankton community of two lakes in the Paraná River floodplain. International Review Hydrobiology 93(6): 659-678. [ Links ]
27. JUNK, W., P.B. BAYLEY & R.E. SPARKS. 1989. The flood pulse concept in river-floodplain systems. In: D.P. Dodge (ed.). Proceeding of the International Large River Symposium. Can. Spec. Public. Fish. Aquatic. Sci. 106: 110-127. [ Links ]
28. KOSTE, W. 1978. Rotatoria. Die Rädertiere Mitteleuporas. Ein Bestimmungswerk begr. Von M. Voigt. Überordnung Monogononta. I Textband VIII + 1-673, II Tafelbd. III + 1-146 mit 234 Tafeln, Stuttgart. [ Links ]
29. KOSTE, W. & S. JOSE DE PAGGI. 1982. Rotifera of the Superorder Monogononta Recorded from Neotropics. Gawässer 68/69: 71-102. [ Links ]
30. LANSAC-TÔHA F.A., L.F.M. VELHO, C.C. BONECKER. 2003. Influência de macrófitas aquáticas sobre a estrutura da comunidade planctônica. In: Thomaz SM, Bini LM (eds) Ecologia e manejo de macrófitas aquáticas. Maringá: EDUEM, pp. 231-242. [ Links ]
31. LANSAC-TÔHA, F.A., C.C. BONECKER, L.F.M. VELHO, E.M. TAKAHASHI & MY. NAGAE. 2004. Zooplankton in the upper Paraná river floodplain: composition, richness, abundance and relationships with the hydrological level and the connectivity. In Agostinho, AA., L. Rodrigues, L.C. Gomes, S.M. Thomaz & L.E. Miranda (Eds.). Structure and functioning of the Paraná river and its floodplain. Maringá: EDUEM. p. 75-84. [ Links ]
32. LANSAC-TÔHA F.A., C.C. BONECKER, L.F.M. VELHO, N.R. SIMÕES, J.D. DIAS, G.M. ALVES & E.M. TAKAHASHI. 2009. Biodiversity of zooplankton communities in the Upper Paraná River floodplain: interannual variation from long-term studies. Braz. J. Biol. 69(2, Suppl.): 539-549. [ Links ]
33. LEWIS, W. M. JR. 1983. A revised classification of Lakes based on mixing. Can. J. Fish Aquat. Sci. 40: 1779-1787. [ Links ]
34. MOORE, M. V. & J. J. GILBERT. 1987. Age-specific Chaoborus predation on rotifer prey. Freshwater Biology 17: 223-236. [ Links ]
35. MORISITA, M. 1959. Measuring of dispertion of individuals and analysis of the distribution patterns. Mem Fac. Kyushu., 2: 215-235. [ Links ]
36. NOGRADY, T., R.L. WALLACE & T.W. SNELL. 1993. Rotifera, Volumen 1: Biology, Ecology and Sistematics. En: Dumont, H.J. Ed. 1993. Guides to the identification of the microinvertebrates of the Continental Waters of the World. SPB Academic Publishing bv The Hague. 142 p. [ Links ]
37. NOGRADY, T., R. POURRIOT & H. SEGERS. 1995. Rotifera, Volume 3: The Notommatidae and the Scaridiidae. Guides to the identification of the microinvertebrates of the continental waters of the world 8. SPB Academic Publishing. Amsterdam. 229 pp. [ Links ]
38. NOGRADY, T. & H. SEGERS (eds). 2002. Rotifera Volume 6: Asplanchnidae, Gastropodidae, Lindiidae, Microcodidae, Synchaetidae, Trochosphaeridae and Filinia. Guides to the identification of the microinvertebrates of the continental waters of the world 18. Leiden, The Netherlands: Backhuys Publishers. [ Links ]
39. NÚÑEZ-AVELLANEDA M. & S. R DUQUE 2001. Fitoplancton en algunos ríos y lagos de la Amazonia Colombiana. Pp: 305-335. En Franky & Zárate (eds.). Imani Mundo: Estudios en la Amazonia colombiana. Unibiblos, Bogotá D.C. [ Links ]
40. PEJLER, B. 1977. On the global distribution of the family Brachionidae (Rotatoria). Arch. Hydrobiol. Suppl. 53: 255-306. [ Links ]
41. PINILLA, G.A. & A. CANOSA, A. VARGAS, M. GAVILÁN & L. LÓPEZ. 2007. Acoplamiento entre las comunidades planctónicas de un lago amazónico de aguas claras (lago Boa, Colombia). Limnetica 26 (1): 53-65. [ Links ]
42. POI DE NEIFF A. & J.J. NEIFF. 2006. Riqueza de especies y similaridad de los invertebrados que viven en plantas flotantes de la planicie de inundación del río Paraná (Argentina). Interciencia 31: 220-225. [ Links ]
43. RIVERA C.A., A.M. ZAPATA, D. PÉREZ, Y. MORALES, H. OVALLE & J.P. ÁLVAREZ. 2010. Caracterización limnológica de humedales de la planicie de inundación del río Orinoco (Orinoquía, Colombia). Acta Biol. Colomb. 15(1): 145-166. [ Links ]
44. ROBERTSON, B.A. & E.R. HARDY. 1984. Zooplancton of Amazonian Lakes and Rivers. En: Sioli, (ed.). The Amazon. Limnology and landscape ecology of a mighty tropical river and its basin. Dr. W. Junk Publishers. Monographiae Biologicae 56: 337-352. [ Links ]
45. RODRÍGUEZ, C. 2003. Cambios en la estructura de la comunidad de rotíferos en el lago Yahuarcaca. Planicie de inundación del Río Amazonas. Trabajo de grado (Biólogo). Pontificia Universidad Javeriana, Bogotá D.C. 122p. [ Links ]
46. RUTTNER-KOLISKO, A. 1974. Plankton Rotifers. Biology and Taxonomy. Die Binnengewässer 26/1, suppl., Stuttgart. [ Links ]
47. SALCEDO-HERNÁNDEZ M.J., S.R. DUQUE, L. PALMA, A. TORRES-BEJARANO, D. MONTENEGRO, N. BAHAMÓN, L. LAGOS, L.F. ALVARADO, M. GÓMEZ & A.P. ALBA. 2011. Evaluación histórica de la dinámica hidrológica y ecología del fitoplancton del Sistema Lagunar de Yahuarcaca, Amazonas, Colombia. Mundo Amazónico, en imprenta. [ Links ]
48. SEGERS, H. 1995. Rotifera. Volume 2: The Lecanidae (Monogononta). En Dumont H.J.F. (Ed.). Guides to the Identification of the Microinvertebrates of the Continental Waters of the World. SPB Academic Publishing bv. The Hague. [ Links ]
49. SEGERS, H. 2007. Annotated checklist of the rotifers (Phylum Rotifera), with notes on nomenclature, taxonomy and distribution. Zootaxa 1564: 1-104. [ Links ]
50. SEGERS, H., N. WADIARO & H. DUMONT.1993. Rotifera of some lakes in the floodplain of the River Niger (Imo State Nigeria). II Faunal composition and diversity. Hydrobiologia 250: 63-71. [ Links ]
51. SOLARTE, E., 2008. Diversidad alfa y beta de microcrustáceos planctónicos (copépodos y cladóceros) en las dimensiones longitudinal y temporal del sistema de lagos Yahuarcaca (Amazonia Colombiana). Tesis de pregrado. Departamento de Biología. Universidad del Cauca, Popayán. [ Links ]
52. THOMAZ, S.M., L.M. BINI & R.L. BOZELLI. 2007. Floods increase similarity among habitats in river-floodplain systems. Hydrobiologia 579: 1-13. [ Links ]
53. TWOMBLY, S. & W.M. LEWIS JR. 1987. Zooplankton abundance and species composition in Laguna la Orsinera, a Venezuelan floodplain lake. Arch. Hydrobiol. Suppl. 79(1): 87-107. [ Links ]
54. TWOMBLY, S. & W.M. LEWIS JR. 1989. Factors regulating cladoceran dinamycs in a Venezuelan floodplain lake. Journal of Plankton Research 11(2): 317-333. [ Links ]
55. VÁSQUEZ, E. 1984. Estudios de las comunidades de rotíferos del Orinoco Medio, Bajo Caroní y algunas lagunas de inundación (Venezuela). Memoria de la Sociedad de Ciencias Naturales La Salle 44: 95-108. [ Links ]
56. VÁSQUEZ, E. & J. REY. 1989. A longitudinal study of zooplankton along the lower Orinoco River and its Delta (Venezuela). Annls. Limnol. 28: 3-18. [ Links ]
57. VILLABONA-GONZÁLEZ, S.L., N.J. AGUIRRE & A.L. ESTRADA. 2011. Influencia de las macrófitas sobre la estructura poblacional de rotíferos y microscrustáceos en un plano de inundación tropical. Rev. Biol. Trop. 59 (2): 853-870. [ Links ]
58. WARD, J.V., K. TOCKNER & F. SCHIEMER. 1999. Biodiversity of floodplain river ecosystems: ecotones and connectivity. Regulated Rivers: Research and Management 15: 125-139. [ Links ]