Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Caldasia
versión impresa ISSN 0366-5232versión On-line ISSN 2357-3759
Caldasia v.34 n.1 Bogotá ene./jun. 2012
ALAN GIRALDO
MARIO F. GARCÉS-RESTREPO
JOHN L. CARR
JHONATAN LOAIZA
Universidad del Valle, Facultad de Ciencias, Departamento de Biología, Sección de Zoología, Grupo de Investigación en Ecología Animal, Apartado 25360, Cali, Colombia. agiraldo@univalle.edu.co, ecologia@univalle.edu.co
Universidad del Valle, Facultad de Ciencias, Departamento de Biología, Sección de Zoología, Grupo de Investigación en Ecología Animal, Apartado 25360, Cali, Colombia. Universidad de Louisiana, Departamento de Biología, Monroe, Louisiana, 71209-0520. EE.UU. carr@ulm.edu
Universidad del Valle, Facultad de Ciencias, Departamento de Biología, Sección de Zoología, Grupo de Investigación en Ecología Animal, Apartado 25360, Cali, Colombia.
RESUMEN
Rhinoclemmys nasuta (Boulenger 1902) es una especie endémica que se encuentra registrada en el libro rojo de los reptiles de Colombia y está catalogada como casi amenazada a nivel mundial. Esta especie, de tamaño mediano, habita los cursos de agua en la región Tumbes-Chocó, desde la cuenca del río Esmeraldas ( Ecuador ) hasta la zona media de la cuenca del río Atrato ( Chocó, Colombia ). Hasta la fecha no se ha podido realizar una adecuada valoración de su estado de conservación debido a diferentes vacíos de conocimientos identificados con relación a la historia natural y la ecología de la especie. En el presente trabajo se recogen los resultados del análisis del tamaño y estructura de una población de R. nasuta estudiada en un ambiente insular del Pacífico colombiano (Isla Palma, Bahía Málaga, Valle del Cauca). En las condiciones de estudio, la población estuvo dominada por individuos adultos siendo la proporción Hembras: Machos: Juveniles de 1.00: 0.71: 0.85. Las hembras fueron consistentemente más grandes que los machos (♀: 179.87 ± 3.27 mm; ♂:151.83 ± 2.41 mm), definiéndose un índice general de dimorfismo sexual de 1.18. Con base en los registros de captura-recaptura, se estimó que el tamaño de la población de esta especie en Isla Palma durante el periodo de estudio fue de 990 individuos (IC90%: 941 a 1044 ind), con una densidad promedio de 2444 ± 122 tortugas por cada hectárea de río. Al evaluar la relación tamaño-peso, se estableció que el crecimiento de R. nasuta es de tipo isométrico (b = 3.04), siendo la tendencia de crecimiento similar entre machos y hembras a pesar del dimorfismo sexual detectado. Este trabajo es el primer esfuerzo de investigación en la región pacífica de Colombia que aborda el estudio sistemático de una población de tortugas continentales. Además, proporciona información sobre la historia natural de R. nasuta que fortalecerá las iniciativas de conservación de tortugas en Colombia.
Palabras clave. Tortugas neotropicales, tamaño poblacional, densidad poblacional, morfometría, dimorfismo sexual, Rhinoclemmys, tortuga sabaletera, Colombia.
ABSTRACT
Rhinoclemmys nasuta (Boulenger 1902) is an endemic turtle listed in the Colombian red book of reptiles as an endangered species. This is a mid-sized aquatic turtle that inhabits rivers and creeks in the Tumbes-Chocó region, from the Esmeraldas River basin ( Ecuador ) to the middle region of the Atrato River basin ( Chocó, Colombia ). To date, the limited knowledge of the natural history and ecology of this species has impeded an appropriate assessment of its conservation status. Herein, we analyzed the population size and structure of R. nasuta from an insular locality in the Colombian Pacific region (Isla Palma, Bahía Málaga, Valle del Cauca). The studied population was dominated by adult individuals, with a female: male: juvenile ratio of 1.00: 0.71: 0.85. Females were significantly larger than males (♀: 179.87 ± 3.27 mm; ♂: 151.83 ± 2.41 mm) with a sexual dimorphism index of 1.18. The population size estimate based on capture-recapture records was 990 individuals (CI90%: 941 to 1044 ind) with a mean density of 2444 ± 122 turtles per ha. Despite the strong sexual dimorphism detected, the relationship between carapace length and weight indicates isometric growth (b=3.04), with a similar growth tendency in both females and males. This is the first study on the ecology of a continental turtle species from the Pacific region of Colombia. This information on R. nasuta will be useful in the conservation initiatives for the turtles of Colombia
Key words. Neotropical turtles, population size, population density, morphometrics, sexual dimorphism, Rhinoclemmys, larged-nosed wood turtle, Colombia.
Recibido: 26/02/2011
Aceptado: 20/09/2011
INTRODUCCIÓN
Colombia es considerado uno de los países con mayor riqueza de tortugas continentales, estando registradas 27 de las 64 especies identificadas para la zona neotropical (Ceballos 2000, Rueda-Almonacid et al. 2007). Estos organismos han sido tradicionalmente utilizados por las comunidades humanas como fuente complementaria de proteína animal (Mittermeier et al. 1992, Merchán 2003). Sin embargo, su explotación desmedida, el deterioro paulatino de su hábitat y el aumento del tráfico de fauna silvestre, han incrementado significativamente la presión sobre las tortugas (e.g. Corredor et al. 2007), al punto que cerca del 60% de las especies registradas en Colombia se encuentra bajo alguna de las categorías de amenaza establecidas por la UICN (Castaño-Mora 2002, MMA 2002).
Entre las diferentes especies de tortugas continentales que habitan la región Pacífica colombiana, Rhinoclemmys nasuta (Boulenger 1902) es quizás una de las menos conocidas. Esta especie, catalogada como casi amenazada (NT) a nivel mundial e incluida en el libro rojo de reptiles de Colombia (Castaño-Mora 2002) como datos deficientes (DD), fue descrita por Boulenger (1902) con base en ejemplares recolectados en la provincia de Esmeraldas en Ecuador. Inicialmente fue nombrada como Nicoria nasuta, adquiriendo su denominación actual a partir del trabajo de Pritchard (1979). Ésta hace parte de la familia Geoemydidae Theobald 1868 (Fritz & Havaš 2007), presenta un hocico en forma de punta, caparazón levemente aplanado, medianamente quillado y levemente aserrado en la parte posterior, con una coloración negro a café rojizo con costuras negras. El plastrón está bien desarrollado, ligeramente levantado en la parte anterior y recortado en la posterior, y es de color amarillo con manchas café-rojizo a negro en cada escudo. La parte dorsal y lateral de la cabeza son negras, y presenta dorsalmente dos líneas blancuzcas o amarillentas desde la punta de la nariz hasta la punta anterior de la órbita, que se discontinúan en la zona orbital, y se proyectan por la parte dorsal de la cabeza hasta la tercera parte de la nuca (Ernst 1980, Ernst & Barbour 1989, Carr & Giraldo 2009).
Esta especie se encuentra en toda la planicie baja del Pacífico desde la cuenca del río Esmeraldas (Ecuador) hasta la cuenca media del río Atrato (Colombia) (Carr & Giraldo 2009), condición que permite catalogarla como endémica del Chocó Biogeográfico (Ippi & Flores 2001). Es de hábitos acuáticos, tamaño mediano y habita principalmente las zonas de remansos de ríos grandes, caños, esteros y riachuelos de segundo y tercer orden, incluso zonas inundables temporales (Medem 1962, Carr & Giraldo 2009). La información sobre la historia natural y los aspectos ecológicos generales de esta especie es escasa, destacándose los trabajos realizados por Medem (1962) quien con base en 30 individuos de nueve localidades del departamento del Chocó realizó la descripción merística general presentando algunas anotaciones sobre su alimentación y reproducción, y el trabajo de Carr & Giraldo (2009) quienes realizaron una recopilación de la información científica publicada y la información técnica de baja circulación (informes técnicos y trabajos de grado) disponible sobre esta especie.
En el presente trabajo se describe el tamaño y la estructura de una población de R. nasuta en un ambiente insular del Pacífico colombiano, con el propósito de generar información que permita fortalecer las iniciativas regionales de conservación. Específicamente se responden las siguientes preguntas de investigación: 1. ¿Cuál es el tamaño poblacional y la densidad de R. nasuta en Isla Palma?, 2. ¿Cuál es el rango de tamaño y peso para machos y hembras de R. nasuta en Isla Palma?, 3. ¿Existen variaciones locales de tamaño entre los individuos de R. nasuta que habitan en Isla Palma?, y 4. ¿Presenta R. nasuta dimorfismo sexual en términos del tamaño del caparazón en esta localidad insular del Pacífico colombiano?
MATERIALES Y MÉTODOS
Isla Palma (3° 54,5' Norte; 77° 21,4' Oeste), es una isla bajo administración de la Dirección General Marítima de Colombia (DIMAR) que se localiza en la zona central del Pacífico colombiano, a la entrada de Bahía de Málaga, y hace parte del Chocó Biogeográfico (Fig. 1). La formación vegetal que se desarrolla en esta zona insular corresponde a selva muy húmeda tropical o selva neotropical inferior, en la que predominan formas arbóreas, con alturas promedio de 10 m, y árboles emergentes de hasta 50 m (Cuatrecasas 1958, Rangel & Rivera-Díaz 2004). Las raíces no son profundas, estando el sotobosque conformado por gran cantidad de especies de árboles pequeños, grandes arbustos e hierbas de gran tamaño, además de gran cantidad de bejucos, epífitas, gramíneas y ciperáceas de hojas grandes.
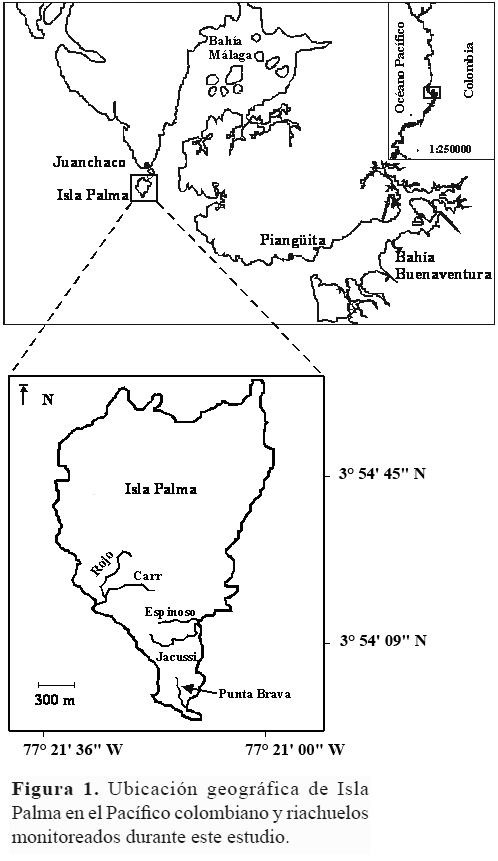
La precipitación anual es superior a 7.000 mm con dos máximos, uno entre septiembre y noviembre, y otro de menor intensidad en abril y mayo. La humedad relativa es superior al 90% y la temperatura ambiente promedio anual es de 29° C (Cantera et al. 1998, Poveda et al. 2004). Siguiendo la escala de Köppen-Geiger para la clasificación climática mundial (Peel et al. 2007), esta localidad pertenecería a la categoría Af (bosque húmedo tropical). La isla tiene una extensión de 138 ha y está rodeada de acantilados de rocas duras uniformemente distribuidos cuya altura varía desde los seis hasta los 15 metros y playas arenosas que se descubren solamente durante la marea baja. Debido a la alta precipitación y al tipo de relieve, se desarrollan numerosos riachuelos de segundo y tercer orden.
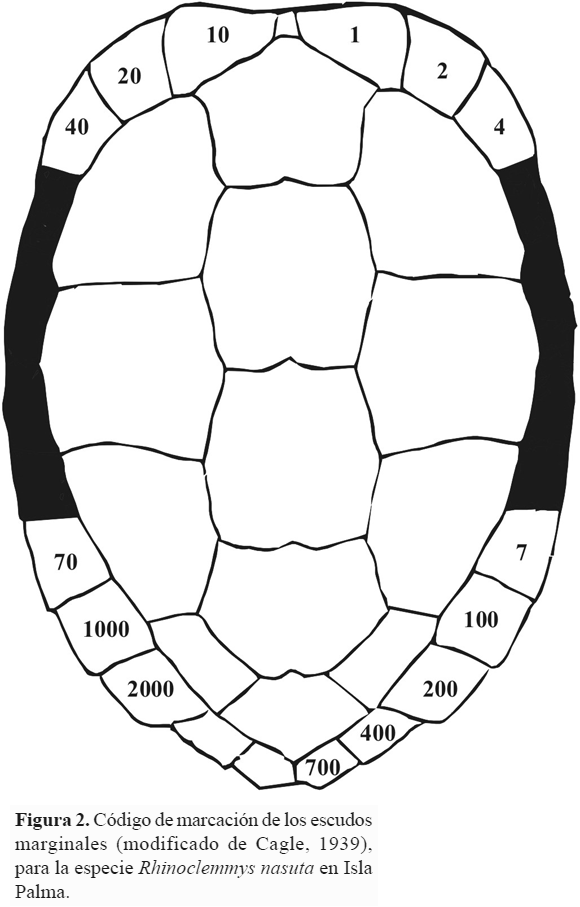
Entre abril de 2005 y septiembre de 2007 se realizaron nueve temporadas de captura de tortugas en cinco riachuelos de segundo orden de Isla Palma (Fig. 1). Todas las capturas se hicieron manualmente durante la noche (20:00 – 24:00 horas). A cada individuo capturado se le asignó un número único de identificación siguiendo el sistema de marcaje en los escudos propuesto por Cagle (1939) con algunas modificaciones (Fig. 2). Este número también se utilizó para marcar el punto de captura, lo que permitió retornar a cada individuo a su lugar original en los riachuelos.
La densidad de Rhinoclemmys nasuta en Isla Palma se estimó dividiendo el tamaño de la población por el área efectiva de captura (Krebs 1999). Esta área se definió como la sumatoria del área de muestreo en cada riachuelo, la cual fue establecida en función de la longitud y registro de ancho húmedo cada 10 m. Para estimar el tamaño de la población se asumieron condiciones de población cerrada toda vez que el trabajo se realizó en un ambiente insular (no hay ingreso o salida de individuos de la isla) y que R. nasuta es una especie con baja fecundidad (Carr & Giraldo 2007) y baja tasa de crecimiento [0.51 cm año-1 (Pérez 2007)] lo que reduce la probabilidad de ingreso de nuevos individuos a la población de interés en un periodo corto de muestreo.
Se construyó la historia individual de captura–recaptura y se utilizó el método de Schumacher & Eschmeyer (1943) descrito en Krebs (1999) para establecer el tamaño de la población. En términos generales, este método asume que se presenta una relación lineal entre la proporción de individuos marcados en cada muestreo y el número total de individuos previamente marcados, de tal manera que el tamaño de la población (N) estaría definido como:
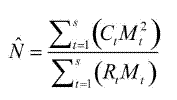
donde Ct es el total de individuos capturados en el tiempo i, Rt es el número de individuos marcados que son capturados en el tiempo i, Mt es el número de individuos marcados presentes en la población antes del tiempo i, y S es el número total de periodos de muestreo.
Para definir el intervalo de confianza del estimado de población se utilizó la aproximación general propuesta por Seber (1982) para muestreos con grandes tamaños de recaptura (> 50 individuos), la cual utiliza el error estándar (ES) y la tabla de t-student (t) para establecer los límites del intervalo de confianza como:
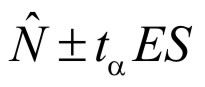
donde el error estandar se definió en función de los registros de captura - recaptura como:
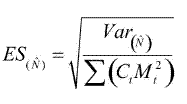
y la varianza (Var(N)) como:
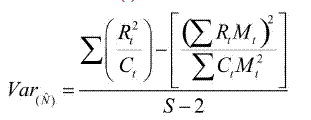
Se registró la longitud recta del caparazón (LR) utilizando un calibrador con precisión de 0.1 mm y se estimó el peso utilizando un dinamómetro con precisión de 20 g para los adultos y 1 g para individuos juveniles. Se seleccionó LR para describir el tamaño de las tortugas debido a que proporcionan una medición realista y facilita las comparaciones directas entre sexos. El sexo se estableció a partir del tamaño y forma del caparazón, la longitud de la cola, palpado inguinal y eversión del pene durante la manipulación. Los individuos con longitud total de caparazón menor a 140 mm y que no pudieron ser sexados fueron considerados como individuos juveniles.
Se realizaron comparaciones del tamaño de las tortugas entre los diferentes riachuelos considerando el sexo. Para este propósito se utilizó un análisis de varianza por rangos de Kruskal-Wallis. Además, se comparó el tamaño de machos y hembras en cada riachuelo utilizando una prueba de comparación por rangos de Mann-Whitney. Se construyó un índice de dimorfismo sexual (IDS) con base en la razón entre el tamaño promedio de las hembras y el tamaño promedio de los machos para cada uno de los ríos evaluados, y se estableció la proporción de hembras, machos y juveniles para cada riachuelo. De acuerdo con Gibbons & Lovich (1990), el IDS a partir de la proporción de talla promedio es una aproximación apropiada para describir las diferencias en tamaño entre sexos en especies de tortugas, además permite realizar comparaciones directas entre especies. Finalmente se estableció la relación peso-tamaño para R. nasuta en Isla Palma como una aproximación para describir la curva de crecimiento de esta especie.
Todos los análisis numéricos relacionados con los estimados de población se realizaron utilizando el programa estadístico Ecological Methodology 6.1 (Krebs 2002), mientras que los análisis numéricos relacionados con la descripción morfológica, comparaciones y relaciones de variables morfométricas se realizaron utilizando el modulo estadístico del programa computacional SigmaPlot® 12 (Systat Software 2010).
RESULTADOS
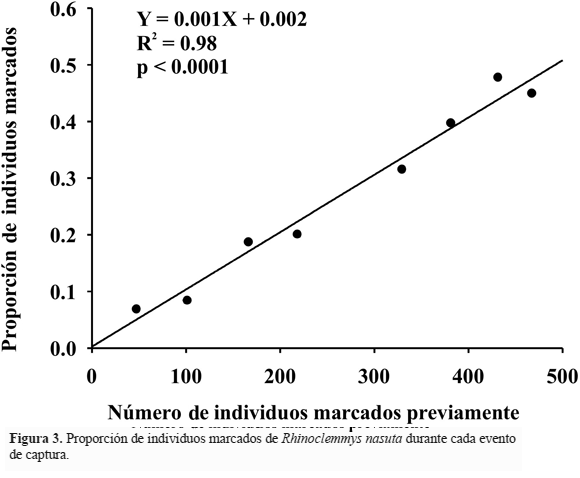
El área total de muestreo considerando los cinco riachuelos seleccionados fue de 0.4 ha. En total se realizaron 687 capturas durante los nueve eventos de muestreo de las cuales 176 correspondieron a individuos recapturados. Aunque se registró un individuo juvenil alimentándose en tierra de un cuerpo en descomposición de Chironectes minumus (Carr et al. 2010), no se registraron desplazamientos de individuos marcados entre los riachuelos durante el periodo de estudio lo que sugiere una alta fidelidad de sitio. El individuo de menor tamaño ( 68.4 mm longitud total caparazón) fue capturado durante el cuarto esfuerzo de muestreo (abril 2006). Asumiendo una tasa de crecimiento constante de 5.1 mm año-1 (Pérez 2007) hasta el final del estudio (septiembre de 2007) este individuo habría alcanzado un tamaño de 75.6 mm. Al revisar la historia de captura, solamente 14 individuos (2% del total de capturas) fueron juveniles con un tamaño de caparazón menor a 75.6 mm y de estos solamente uno (0.1% del total de capturas) fue recapturado durante el periodo de estudio. Adicionalmente, la proporción de individuos marcados durante cada evento de captura incrementó linealmente con el esfuerzo de muestreo (Fig. 3). Estos resultados confirmaron la pertinencia de asumir condiciones de población cerrada y utilizar el método de Schumacher & Eschmeyer para estimar el tamaño de la población de Rhinoclemmys nasuta en Isla Palma. En este sentido, se estableció que el tamaño de la población estudiada fue de 990 individuos (IC 90%: 941 a 1044 ind), con una densidad promedio estimada de 2444 ± 122 tortugas ha-1 de río en Isla Palma.
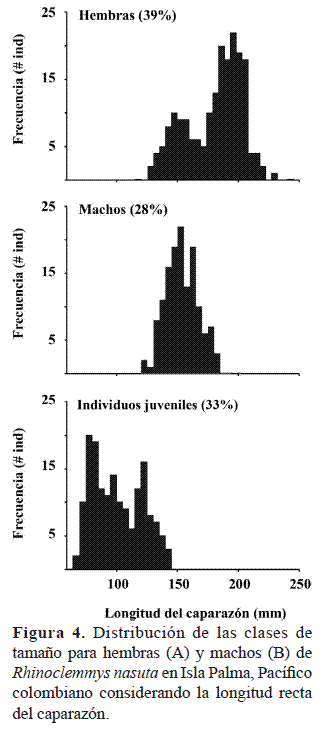
Al evaluar la estructura general de la población se encontró que el 39% de los individuos capturados fueron hembras, el 28% machos y el 33% individuos juveniles (Fig. 4). Se encontraron diferencias significativas en la proporción de sexos (hembra:macho) (H:M observada 1.00:0.71, Z = 2.91, p = 0.004).
Con base en el análisis de la estructura de la población para cada riachuelo, se encontró que en el sector sur de la Isla (río Punta Brava) la población estuvo dominada por individuos juveniles y machos mientras que en el sector norte (río Rojo y río Carr) la población estuvo dominada por hembras (Tabla 1). La mayor presencia de individuos juveniles se registró en los ríos Punta Brava, Espinoso y Jacussi respectivamente (Tabla 1), ríos que se caracterizaron por tener un curso de agua somero, lento, con fondo blando y alta acumulación de materia orgánica en descomposición. Por el contrario, los ríos en donde se encontraron menor cantidad de juveniles (río Carr y el río Rojo) se caracterizaron por presentar un curso de agua de mayor amplitud, más profundo, con fondo duro y menor acumulación de materia orgánica.
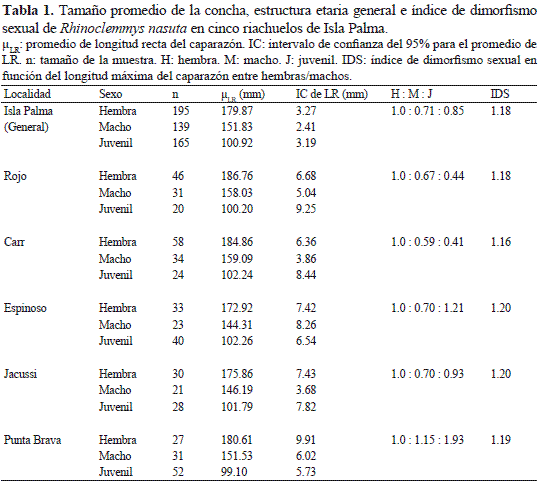
El índice de dimorfismo sexual (IDS) fue mayor a 1.0 en todos los riachuelos (Tabla 1), siendo las hembras significativamente más grandes que los machos (Fig. 5, Tabla 2).
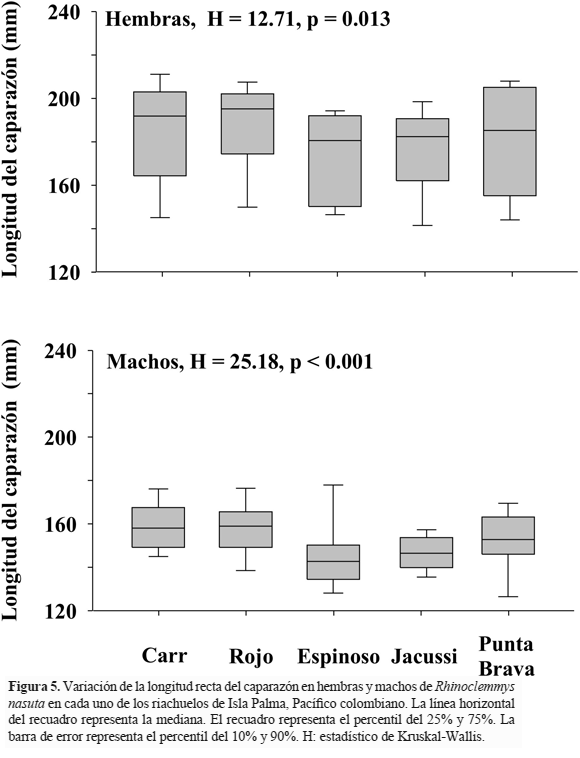
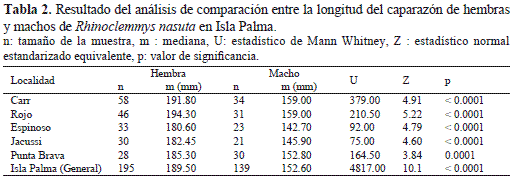
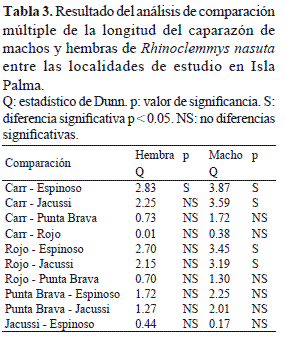
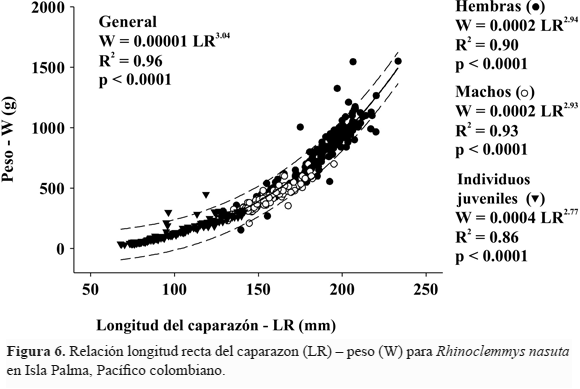
Al evaluar la variación en el tamaño de las hembras y de los machos entre los riachuelos estudiados se encontró que las hembras en el río Carr fueron significativamente más grandes que las del río Espinoso y que los machos de los riachuelos del norte (río Carr y río Rojo) fueron significativamente más grandes que los de la zona central del área de estudio (río Jacussi y río Espinoso) (Tabla 3). Finalmente, el crecimiento de R. nasuta en Isla Palma con respecto a la relación tamaño – peso fue de tipo isométrico (Fig. 6) y aunque se establecieron diferencias significativas en el tamaño entre machos y hembras, la tendencia de la relación tamaño-peso no fue significativamente diferente entre estos dos grupos (F = 0.0009, p = 0.976).
DISCUSIÓN
En términos generales las tortugas se caracterizan por ser organismos longevos con una maduración sexual tardía, una prolongada actividad reproductiva y una alta tasa de sobrevivencia de adultos. Sumado a lo anterior, el gran tamaño de postura que se registra en muchas de las especies conlleva a que las poblaciones tiendan a estar dominadas por huevos, individuos juveniles y subadultos, aunque los juveniles pueden llegar a representar el 30% de los individuos en condiciones naturales (Bury 1979, Gibbs & Amato 2000). En Isla Palma el 66.9% de los individuos de R. nasuta fueron adultos y el 33.1% juveniles. Este resultado fue similar a lo reportado por Le Gratiet & Métrailler (1996) para R. punctularia en la Guayana Francesa en donde el 67% de los individuos capturados fueron adultos, y coincide con lo establecido para otras poblaciones de tortugas acuáticas neotropicales como Podocnemis sextuberculata (Fachín-Terán et al. 2003), P. unifilis (Fachín-Terán & Vogt 2004), Trachemys dorbigni (Fagundes et al. 2010), T. venusta (Moll & Legler 1971), Kinosternon scorpioides (Forero-Medina et al. 2007, Barreto et al. 2009), Phrynops geoffroanus (Souza & Abe 2001), Hydromedusa tectifera (Lescano et al. 2008) y H. maximiliani (Martins & Souza 2009).
Otro elemento a considerar en la estructura de las poblaciones de tortugas es la proporción de sexos. En este contexto, varios autores han destacado la dependencia del sexo de los neonatos con la temperatura de incubación (TSD), condición que puede afectar drásticamente la proporción de sexos en una población (Gibbons 1990, Remor de Souza & Vogt 1994, Janzen 1994, Valenzuela 2004, Schwanz et al. 2010). Básicamente se identifican dos patrones de respuesta diferentes, el patrón tipo I (TSD-I) que se caracteriza por machos asociados con temperatura de incubación baja y hembras asociadas a temperaturas de incubación altas, y el patrón tipo II (TSD-II) que se caracteriza por hembras asociadas con temperaturas de incubación bajas y altas, y machos asociados con temperaturas de incubación intermedias (Ewert & Nelson 1991). Aunque aún no ha sido confirmada la condición TSD en R. nasuta, dos especies hermanas R. areolata y R. pulcherrima presentan una condición tipo TSD-I (Ewert & Nelson 1991). Por lo tanto, la mayor presencia de hembras en la población de R. nasuta de Isla Palma podría estar asociada con las condiciones térmicas locales y su efecto sobre el sexo de los neonatos, hipótesis que debe ser evaluada experimentalmente.
De acuerdo con Pritchard & Trebbau (1984) la proporción sexual en especies de Rhinoclemmys, parece estar sesgada hacia las hembras. Sin embargo, los pocos datos publicados sobre poblaciones naturales de este género son contrastantes. En este sentido, Le Gratiet & Métrailler (1996) encontraron que la proporción entre sexos en R. punctularia en la Guayana Francesa era igual, mientras que Vogt et al. (2009) encontraron que la proporción de sexos en R. areolata en una localidad de Belize y otra de México estuvieron dominadas por hembras (H:M = 80:61 y 25:13 respectivamente). En términos generales, la proporción de machos:hembras en las poblaciones de tortugas pueden ser altamente variables. En algunas especies, como T. dorbigni (Fagundes et al. 2010), T. adiutrix y K. scorpioides (Barreto et al. 2009), P. geoffroanus (Souza & Abe 2001), o H. tectifera (Lescano et al. 2008) la proporción entre machos:hembras no es significantemente diferente de 1:1. En otras especies, como T. venusta, (Moll & Legler 1971), P. sextuberculata y P. unifilis (Fachín-Terán et al. 2003, Fachín-Terán & Vogt 2004), o Geochelone denticulata (Stevenson et al. 2007) la relación es a favor de los machos. Mientras que en algunas tortugas neotropicales como K. scorpioides (Forero-Medina et al. 2007) y H. maximiliani (Martins & Souza 2009) es común encontrar que la relación machos:hembras sea a favor de hembras, como se estableció para R. nasuta en Isla Palma. Frecuentemente se propone que el desbalance en la proporción entre machos:hembras que se registra en algunos estudios de poblaciones de tortugas es el resultado de sesgos durante el esfuerzo de muestreo (Gibbons 1990). Sin embargo, Gibbs & Steen (2005) demostraron que las metodologías objetivas de captura (como conteo directo o capturas con trampas con esfuerzo estandarizado y replicado) no tienen un efecto significativo sobre los estimados de proporción machos:hembras.
Aunque el establecer el tamaño de una población a partir de registros de captura-recaptura con amplios intervalos de tiempo entre periodos de muestreo debe considerar el ingreso de nuevos individuos a la población por nacimiento e inmigración, al igual que salida de individuos por emigración o mortalidad (natural o inducida), asumir condiciones de población cerrada será una buena aproximación siempre y cuando las características biológicas, ecológicas y geográficas lo permitan (Conroy & Carroll 2009). En este sentido, la condición insular del área de estudio sumada a la preferencia de R. nasuta por los ambientes dulceacuícolas (Medem 1962, Carr & Giraldo 2009) y la baja movilidad y la alta fidelidad de sitio (Pérez 2007), permitieron descartar procesos de inmigración o emigración significativos en la población de interés. Además, la baja tasa de captura o recaptura de neonatos (individuos < 75 mm LR) durante el periodo de estudio, sumado a la baja fecundidad (Medem 1962, Carr & Giraldo 2009) y baja tasa de crecimiento ( 5.1 mm año-1) (Pérez 2007, Carr & Giraldo 2009), permite asumir con alto nivel de certeza que el efecto de nacimientos sobre el estimado del tamaño de la población establecido en este estudio es insignificante.
En la literatura científica hay muy pocos reportes de densidad poblacional para especies de tortugas neotropicales y menos aún en ambientes insulares. De acuerdo con Vogt et al. (2009) la densidad de R. areolata, una pequeña tortuga terrestre, en las tierras bajas de Belize es entre 5-6 ind ha-1, aunque también reporta una mayor captura por unidad de esfuerzo en un ambiente insular de México debido a la ausencia de predadores en esta localidad. Con respeto a tortugas de agua dulce, se destaca el trabajo realizado por Forero-Medina et al. (2007) en la Isla de San Andrés, quienes estimaron la densidad de K. scorpioides en los bosques de manglar con baja salinidad en 254 ind ha-1. En Argentina, se estimó una densidad de 219 ind ha-1 para H. tectifera (Lescano et al. 2008) mientras que en Brasil se estimó una densidad de 193 ind ha-1 para H. maximiliani (Souza & Abe 1997).
El estimado de densidad para R. nasuta en Isla Palma es un orden de magnitud mayor que los reportados para otras especies acuáticas neotropicales (Souza & Abe 1997, Forero-Medina et al. 2007, Lescano et al. 2008) y quizás es uno de los registros más altos para tortugas en general (Bury 1979). Probablemente este resultado sea una consecuencia de la buena calidad del hábitat, la baja presión de depredación y la reducida intervención humana en esta localidad. En este sentido, las características topográficas y climáticas de Isla Palma favorecen el desarrollo de numerosos riachuelos y una exuberante vegetación que proporciona las condiciones de hábitat favorables para esta especie. Además, el acceso restringido a Isla Palma por ser un área administrada por la Dirección General Marítima de Colombia – DIMAR ha reducido el impacto por consumo humano y ha evitado la transformación del hábitat. Finalmente, los predadores naturales de R. nasuta detectados en Isla Palma durante esta investigación no tienen la capacidad de alimentarse de individuos adultos, ya que se reducen a tres especies de marsupial (Chironectes minimus, Philander oposum y Didelphis marsupialis), y dos especie de reptiles (Boa constrictor y Chironius grandisquamis) (obs. pers.) los cuales podrían concentrar su accionar sobre huevos e individuos juveniles. Por lo tanto, una vez que un individuo supera el tamaño crítico de aprovechamiento incrementa significativamente la probabilidad de llegar a ser un individuo adulto.
Aunque la mortalidad natural es quizás una de las variables demográficas más difíciles de estimar (Gibbons 1987, Bodie & Semlitsch 2000), es importante destacar que durante el periodo de estudio no se registró ningún individuo muerto en los riachuelos, en las zonas cercanas a los riachuelos ( 10 m a lado y lado) o en la zona de playa en donde desembocan los riachuelos. Probablemente la preferencia de esta especie por ingresar a las pequeñas cuevas que se forman en la base del talud del cauce, estar asociadas a las zonas de raíces de árboles que ingresan a los riachuelos (Rueda-Almonacid et al. 2007, Carr & Giraldo 2009), o incluso la presencia de restos vegetales acumulados a lo largo del cauce de los riachuelos, les permita refugiarse rápidamente en caso de un incremento paulatino en el caudal, reduciendo significativamente la probabilidad de ser arrastrados por una creciente.
El dimorfismo sexual en función del tamaño es una condición comúnmente reportada en las tortugas (Zuffi & Plaitano 2007) que generalmente ha sido asociado con el desarrollo de características sexuales secundarias como tamaño de la cola, coloración o tamaño corporal (Valenzuela et al. 2004). En R. nasuta, las hembras tienden a ser significativamente más grandes que los machos, condición que se convierte en una herramienta directa para establecer proporciones sexuales e igualmente se convierte en un elemento clave para una futura evaluación de la viabilidad de la población. Diferentes hipótesis se han planteado para explicar la variación en la duración del crecimiento antes de la madurez estando la mayoría de ellas asociada con tasas de crecimiento diferenciales como consecuencia del efecto de factores ambientales como la temperatura, presiones de selección antagónicas durante procesos de selección sexual, características reproductivas (postura de huevos, cortejo, cópula) y/o con la disponibilidad y calidad del alimento (Berry & Shine 1980, Shine 1989, Dunham & Gibbons 1990, Willette et al. 2005, Miller & Dinkelacker 2008). En R. nasuta el dimorfismo sexual podría estar asociado principalmente a dos condiciones: el tamaño del huevo que es equivalente al 34% del tamaño (LR) de una hembra adulta por lo que requiere un gran volumen corporal para su desarrollo y/o por los elaborados procesos de cortejo-cópula típicamente descritos en especies de tortugas de hábitos acuáticos como R. nasuta en los cuales los machos deben tener una mayor capacidad de movimiento por lo que un tamaño pequeño sería favorable (ver Berry & Shine 1980).
En conclusión serían varios los elementos que de manera simultánea estarían modulando la estructura etaria, la relación machos:hembras y el tamaño de la población de R. nasuta en Isla Palma. El primer elemento estaría relacionado con factores ambientales como la temperatura durante el periodo de incubación ya que podría determinar el sexo de los neonato (Pritchard & Trebbau 1984, Gibbons 1990, Janzen & Phillips 2006). El segundo elemento estaría relacionado con factores ecológicos como depredación, mortalidad y sobrevivencia que podrían modular la estructura etaria de la población (Congdon et al. 1993, 1994, Heppell et al. 1996, Gibbs & Steen 2005, Martins & Souza 2009, Schwanz et al. 2010), y el tercer elemento estaría relacionado con el bajo nivel de intervención humana sobre su hábitat natural que podrían favorecer la presencia de adultos grandes en la población al igual que una alta densidad local (Kuchling 1988, Burke et al. 2000, Klemens 2000, Moll & Moll 2000, 2004, TCF 2002, Spinks et al. 2003).
Finalmente, es necesario destacar que uno de los principales retos para los programas de conservación de fauna silvestre es disponer de una adecuada información relacionada con la historia de vida de la especie de interés. En las zonas tropicales el panorama es aun más preocupante por las dificultades técnicas, logísticas y de orden público asociadas con el acceso a las zonas de estudio (Sheil & Lawrence 2004, du Toit et al. 2004, Collen et al. 2008). En este contexto, los resultados del presente trabajo adquieren mayor importancia porque proporcionan información relevante e inédita sobre una especie endémica del Chocó biogeográfico y se convierte en el primer esfuerzo de investigación dirigido sobre una población de tortuga acuática continental en esta región. Además, identifica, describe y caracteriza una población natural de R. nasuta en el Pacífico colombiano que podría convertirse en el corto plazo en un valor objeto de conservación para el recientemente declarado Parque Nacional Natural Uramba Bahía Málaga.
AGRADECIMIENTOS
A todos las personas que colaboraron decididamente durante las diferentes campañas de muestreo, en especial a Bellineth Valencia, Andrés Quintero, Cesar Ortiz, Viviana Pérez y Nataly Calvo. Este trabajo fue financiado parcialmente por la Universidad del Valle (Grupo de Investigación en Ecología Animal), la Universidad de Louisiana (Laboratorio de Herpetología), Linnaeus Fund de la Chelonian Research Foundation, el programa de Jóvenes Investigadores de Colciencias–Univalle y recursos propios. La Dirección General Marítima – DIMAR, autorizó el desarrollo de este trabajo en Isla Palma, permitió el ingreso y facilitó el uso de las instalaciones durante el desarrollo de los muestreos. Los comentarios de tres evaluadores enriquecieron significativamente el contenido de este documento.
LITERATURA CITADA
1. BARRETO, L., L.C. LIMA & S. BARBOSA. 2009. Observations on the ecology of Trachemys adiutrix and Kinosternon scorpioides on Curupu Island, Brazil. Herpetological Review 40: 283-286. [ Links ]
2. BERRY, J.F. & R. SHINE. 1980. Sexual size dimorphism and sexual selection in turtles (Order Testudines). Oecologia (Berl.) 44: 185-191. [ Links ]
3. BODIE, J.R. & R.D. SEMLITSCH. 2000. Size-specific mortality and natural selection in freshwater turtles. Copeia 2000 (3): 732–739. [ Links ]
4. BOULENGER, G.A. 1902. Descriptions of new batrachians and reptiles from north-western Ecuador. Annals and Magazine of Natural History (7) 9: 51-57. [ Links ]
5. BURKE, V.J., J.E. LOVICH & J.W. GIBBONS. 2000. Conservation of freshwater turtles. Pp 156-179. En: M.W. Klemens (ed.). Turtle Conservation. Smithsonian Institution Press, Washington DC. [ Links ]
6. BURY, R.B. 1979. Population ecology of freshwater turtles. Pp 571-602. En: M. Harless and H. Morlock (eds). Turtles: Perspectives and Research. John Wiley and Sons, Nueva York, NY. [ Links ]
7. Cagle, F. R. 1939. A system of marking turtles for future recognition. Copeia 1939:170–173. [ Links ]
8. CANTERA, J.R., R. NEIRA & C. RICAURTE. 1998. Bioerosión en la costa Pacífica colombiana: un estudio de la biodiversidad, la ecología y el impacto de los animales destructores de acantilados rocosos sobre el hombre. Fondo FEN. 133 pp. Cali. [ Links ]
9. CARR, J.L. & A. GIRALDO. 2009. Rhinoclemmys nasuta (Boulenger 1902), Large-Nosed Wood Turtle, Chocoan River Turtle. En: A.G.J. Rhodin, P.C.H. Pritchard, P.P. van Dyke, R.A. Saumure, K.A. Buhlmann, J.B. Iverson & R.A. Mittermeier (eds). Conservation Biology of Freshwater Turtles and Tortoises: A Compilation Project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Monographs 5: 034.1–034.6. [ Links ]
10. CARR, J.L., M.F. GARCÉS, A. QUINTERO-ÁNGEL & A. GIRALDO. 2010. Rhinoclemmys nasuta (Chocoan River Turtle). Diet and feeding behavior. Herpetological Review 41(3): 347-348. [ Links ]
11. CASTAÑO-MORA O.V. (ed). 2002. Libro rojo de reptiles de Colombia. Libros Rojos de Especies Amenazadas de Colombia. Instituto de Ciencias Naturales-Universidad Nacional de Colombia, Ministerio del Medio Ambiente, Conservación Internacional-Colombia. 160 pp. Bogotá D.C. [ Links ]
12. CEBALLOS, C. P. 2000. Tortugas (Testudinata) marinas y continentales de Colombia. Biota Colombiana 1: 187-194. [ Links ]
13. COLLEN, B., M. RAM, T. ZAMIN & L. MCRAE. 2008. The tropical biodiversity data gap: addressing disparity in global monitoring. Tropical Conservation Science 1(2): 75-88. [ Links ]
14. CONGDON, J.D., A.E. DUNHAM & R.C. VAN LOBEN SELS. 1993. Delayed sexual maturity and demographics of Blanding's turtles (Emydoidea blandingii): implications for conservation and management of long lived organisms. Conservation Biology 7: 826-833. [ Links ]
15. CONGDON, J.D., A.E. DUNHAM & R.C. VAN LOBEN SELS. 1994. Demographics of common snapping turtles (Chelydra serpentina): implications for conservation and management of long-lived organisms. American Zoologist 34: 397-408. [ Links ]
16. CORREDOR, G., G. KATTAN, C.A. GALVIS & D. AMOROCHO. 2007. Tortugas del Valle del Cauca. Corporación Autónoma Regional del Valle del Cauca-CVC. 74 pp. Cali. [ Links ]
17. CONROY, M.J. & J. P. CARROLL. 2009. Quantitative conservation of vertebrates. Wiley-Blackwell. Oxford. 342 pp. [ Links ]
18. CUATRECASAS, J. 1958. Aspectos de la vegetación natural de Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales 10: 221-268. [ Links ]
19. DUNHAM, A. E. & J. W. GIBBONS. 1990. Growth of the slider turtle. Pp 135-145. En: J.W. Gibbons. (ed). Life history and ecology of the slider turtle. Smithsonian Institution Press. Washington D.C. [ Links ]
20. DU TOIT, J.T., B.H. WALKER & B.M. CAMPBELL. 2004. Conserving tropical nature: current challenges for ecologists. Trends in Ecology and Evolution 19(1): 12-17. [ Links ]
21. ERNST, C.H. 1980. Rhinoclemmys nasuta. Catalogue of American Amphibians and Reptiles 264:1. [ Links ]
22. ERNST, C.H. & RW. BARBOUR. 1989. Turtles of the World. Smithsonian Institution Press, 314 pp. Washington D.C. [ Links ]
23. EWERT, M.A. & C.E. NELSON. 1991. Sex determination in turtles: diverse patterns and some possible adaptive values. Copeia 1991 (1): 50-69. [ Links ]
24. FACHÍN-TERÁN, A. & R.C. VOGT. 2004. Estrutura populacional, tamanho e razão sexual de Podocnemis unifilis (Testudines, Podocnemididae) no rio Guaporé (RO), norte do Brasil. Phyllomedusa 3: 29-42. [ Links ]
25. FACHÍN-TERÁN, A., R.C. VOGT & J.B. THORBJARNARSON. 2003. Estrutura populacional, razão sexual e abundância de Podocnemis sextuberculata (Testudines, Podocnemididae) na reserva de desenvolvimento sustentável Mamirauá, Amazonas, Brasil. Phyllomedusa 2: 43-63. [ Links ]
26. FAGUNDES, C.K., A. BAGER & S.T. ZANINI-CECHIN. 2010. Trachemys dorbigni in an anthropic environment in southern Brazil: I) Sexual size dimorphism and population estimates. Herpetological Journal 20:185-193. [ Links ]
27. FORERO-MEDINA, G., O.V. CASTAÑO-MORA & O. MONTENEGRO. 2007. Abundance, population structure, and conservation of Kinosternon scorpioides albogulare on the Caribbean island of San Andrés, Colombia. Chelonian Conservation and Biology 6: 163-169. [ Links ]
28. FRITZ, U. & P. HAVAS. 2007. Checklist of the chelonians of the world. Museum of Zoology Dresden. Vertebrate Zoology 57 (2): 159 – 368. [ Links ]
29. GIBBONS, J. W. 1987. Why do turtles live so long?. BioScience 37(4): 262–269. [ Links ]
30. GIBBONS, J. W. 1990. Sex ratios and their significance among turtle populations. Pp. 171–182. En: J. W. Gibbons. (ed). Life history and ecology of the slider turtle. Smithsonian Institution Press. Washington D.C. [ Links ]
31. GIBBONS, J.W. & J. E. LOVICH. 1990. Sexual dimorphism in turtles with emphasis on the slider turtle (Trachemys scripta). Herpetological Monographs 4: 1-29. [ Links ]
32. GIBBS, J.P. & G.D. AMATO. 2000. Genetics and demography in turtle conservation. Pp. 207-217. En: M.W. Klemens (ed.). Turtle Conservation. Smithsonian Institution Press. Washington D.C. [ Links ]
33. GIBBS, J.P. & D.A. STEEN. 2005. Trends in sex ratios of turtles in the United States: implications of road mortality. Conservation Biology 19(2): 552-556. [ Links ]
34. HEPPELL, S.S., L.B. CROWDER & D.T. CROUSE. 1996. Models to evaluate headstarting as a management tool for longlived turtles. Ecological Applications 6:556–565. [ Links ]
35. IPPI, S. & V. FLORES. 2001. Las tortugas neotropicales y sus áreas de endemismo. Acta Zoológica Mexicana 84: 49-63. [ Links ]
36. JANZEN, F.J. 1994. Climate change and temperature-dependent sex determination in reptiles. Proceedings of the National Academy of Sciences, USA. 91: 7487–7490. [ Links ]
37. JANZEN, F.J. & P.C. PHILLIPS. 2006. Exploring the evolution of environmental sex determination, especially in reptiles. Journal of Evolutionary Biology 19(6):1775–1784. [ Links ]
38. KLEMENS, M.W. 2000. Turtle conservation. Smithsonian Institution Press. 334 pp. Washington D.C. [ Links ]
39. KREBS, C. J. 1999. Ecological Methodology 2nd ed. Addison-Welsey Educational Publishers, Inc. 620 pp. Menlo Park. [ Links ]
40. KREBS, C. J. 2002. Programs for Ecological Methodology {computer program}. Version 6.1. Exeter Software, East Setauket. [ Links ]
41. KUCHLING, G. 1988. Population structure, reproductive potential and increasing exploitation of the freshwater turtle Erymnochelys madagascariensis. Biological Conservation 43(2): 107–113. [ Links ]
42. LE GRATIET, G. & S. MÉTRAILLER. 1996. Contribution à la connaissance de Rhinoclemmys punctularia punctularia (Daudin, 1801). C.I.T.S. Bulletin 6: 19-31. [ Links ]
43. LESCANO, J.N., M.F. BONINO & G.C. LEYNAUD. 2008. Density, population structure and activity pattern of Hydromedusa tectifera (Testudines-Chelidae) in a mountain stream of Córdoba province, Argentina. Amphibia-Reptilia 29: 505-512. [ Links ]
44. MARTINS, F. I. & F. L. SOUZA. 2009. Demographic parameters of the Neotropical freshwater turtle Hydromedusa maximiliani (Chelidae). Herpetologica 65: 82-91. [ Links ]
45. MEDEM, F. 1962. La distribución geográfica y ecológica de los Crocodylia y Testudinata en el departamento del Chocó. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales 11(44): 279-342. [ Links ]
46. MERCHÁN, M. 2003. Contribución al conocimiento de la biología de la tortuga negra (Rhinoclemmys funerea) y la tortuga roja (Rhinoclemmys pulcherrima manni) en Costa Rica. Tesis Doctoral. Universidad Complutense de Madrid. 306 pp. Madrid. [ Links ]
47. MILLER, J.D. & S.A. DINKELACKER. 2008. Reproductive structures and strategies of turtles. Pp. 225–278. En: J. Wyneken, M.H. Godfrey & V. Bels (eds.). Biology of Turtles. CRC Press, Boca Raton, FL. [ Links ]
48. MITTERMEIER, R.A., J.L. CARR, I.R. SWINGLAND, T.B. WERNER & R.B. MAST. 1992. Conservation of amphibians and reptiles. Pp. 59-80. En: K. Adler (ed.). Herpetology: current research on the biology of amphibians and reptiles. Ithaca: Society for the Study of Amphibians and Reptiles. [ Links ]
49. MMA (MINISTERIO DEL MEDIO AMBIENTE) 2002. Tortugas marinas y continentales en Colombia: programa nacional para la conservación. 63 pp. Bogotá. [ Links ]
50. MOLL, D. & E.O. MOLL. 2004. The ecology, exploitation, and conservation of river turtles. Oxford University Press. 393 pp. Oxford. [ Links ]
51. MOLL, E.O. & D. MOLL. 2000. Conservation of river turtles. Pp. 126-155. En: M.W. Klemens (ed.). Turtle conservation. Smithsonian Institution Press. Washington D.C. [ Links ]
52. MOLL, E.O. & J.M. LEGLER. 1971. The life history of a Neotropical slider turtle, Pseudemys scripta (Schoepff), in Panama. Bulletin of the Los Angeles County Museum of Natural History. Science (11): 1-102. [ Links ]
53. PEEL, M.C, B.L. FINLAYSON & T.A. MCMAHON. 2007. Updated world map of the Köppen-Geiger climate classification. Hydrology and Earth System Sciences 11:1633-1644. [ Links ]
54. PÉREZ. J.V. 2007. Tasa de crecimiento y rango habitacional de Rhinoclemmys nasuta en Isla Palma, Pacífico colombiano. Trabajo de Grado. Universidad del Valle, Facultad de Ciencias Naturales y Exactas, Departamento de Biología. 39 pp. Cali. [ Links ]
55. POVEDA, I.C., C. ROJAS, A. RUDAS & J.O. RANGEL. 2004. El Chocó biogeográfico: ambiente físico. Pp. 1-22. En: J.O. Rangel. (ed). Colombia Diversidad Biótica IV: El Chocó biogeográfico/Costa Pacífica. Universidad Nacional de Colombia. Bogotá D.C. [ Links ]
56. PRITCHARD, P.C.H. 1979. Encyclopedia of Turtles. Neptune, New Jersey. T. F. H. Publications, 895 pp. [ Links ]
57. PRITCHARD, P.C.H. & P. TREBBAU. 1984. The turtles of Venezuela. Society for the Study of Amphibians and Reptiles. 403 pp. Oxford, Ohio. [ Links ]
58. RANGEL, J.O. & O. RIVERA-DÍAZ. 2004. Diversidad y riqueza de espermatófitos en el Chocó Biogeográfico. Pp. 83-104. En: J.O. Rangel (ed). Colombia Diversidad Biótica IV: El Chocó biogeográfico/Costa Pacífica. Universidad Nacional de Colombia. Bogotá D.C. [ Links ]
59. REMOR DE SOUZA, R. & R. C. VOGT. 1994. Incubation temperature influence sex and hatchling size in the Neotropical turtle Podonecmis unifilis. Journal of Herpetology 28 (4): 453–464. [ Links ]
60. RUEDA-ALMONACID, J. V., J. L. CARR., R. A, MITTERMEIER, J. V. RODRÍGUEZ-MAHECHA, R. B. MAST, R. C. VOGT, A. G. J. RHODIN, J. DE LA OSSA-VELASQUEZ, J. N. RUEDA & C. G. MITTERMEIER. 2007. Las tortugas y los cocodrilianos de los países andinos del trópico. Conservación Internacional. 537 pp. Bogotá D.C. [ Links ]
61. SCHUMACHER, F.X. & R.W. ESCHMEYER. 1943. The estimation of fish population in lakes or ponds. Journal of the Tennessee Academy of Science 18: 228-249. [ Links ]
62. SCHWANZ, L.E., R.J. SPENCER, R.M. BOWDEN & F. J. JANZEN. 2010. Climate and predation dominate juvenile and adults recruitment in a turtle with temperature-dependent sex determination. Ecology 91(10): 3016–3026. [ Links ]
63. SEBER, G. A. F. 1982. The estimation of animal abundance and related parameters. 2nd edition. Macmillan Publishing Co., Inc. 654 pp. Nueva York. [ Links ]
64. SHEIL, D. & A. LAWRENCE. 2004. Tropical biologists, local people and conservation: new opportunities for collaboration. Trends in Ecology and Evolution 19(12): 634-638. [ Links ]
65. SHINE, R. 1989. Ecological causes for the evolution of sexual dimorphism: a review of the evidence. Quarterly Review of Biology 64: 419-461. [ Links ]
66. SOUZA F.L. & A.S. ABE. 1997. Population structure, activity, and conservation of the neotropical freshwater turtle, Hydromedusa maximiliani, in Brazil. Chelonian Conservation and Biology 2(4): 521-525. [ Links ]
67. SOUZA F. L. & A. S. ABE. 2001. Population structure and reproductive aspects of the freshwater turtle, Phrynops geoffroanus, inhabiting an urban river in southeastern Brazil. Studies on Neotropical Fauna and Environment 36(1): 57-62. [ Links ]
68. SPINKS, P.Q., G.B. PAULY, J.J. CRAYON & B. SHAFER. 2003. Survival of the western pond turtle (Emys marmorata) in an urban California environment. Biological Conservation 113(2): 257–267. [ Links ]
69. SYSTAT SOFTWARE. 2010. SigmaPlot®. Version 12. Systat Software, Chicago, IL. [ Links ]
70. STEVENSON, P.R., C.A. BORDA, A.M. ROJAS & M. ÁLVAREZ. 2007. Population size, habitat choice and sexual dimorphism of the Amazonian tortoise (Geochelone denticulata) in Tinigua National Park, Colombia. Amphibia-Reptilia 28: 217-226. [ Links ]
71. TCF (TURTEL CONSERVATION FUND) 2002. A Global Action Plan for Conservation of Tortoises and Freshwater Turtles. Strategy and Funding Prospectus 2002–2007. Conservation International and Chelonian Research Foundation. 30 pp. Washington D.C. [ Links ]
72. VALENZUELA, N. 2004. Evolution and maintenance of temperature-dependent sex determination. Pp. 131-147. En: N. Valenzuela & V.A. Lance. (eds). Temperature-dependent sex determination in vertebrates. Smithsonian Books, Washington D.C. [ Links ]
73. VALENZUELA, N., D.C. ADAMS, R.M. BOWDEN & A.C. GAUGER. 2004. Geometric morphometric sex estimation for hatchling turtles: a powerful alternative for detecting subtle sexual shape dimorphism. Copeia 2004(4): 735-742. [ Links ]
74. VOGT, R.C., S.G. PLATT & T.R. RAINWATER. 2009. Rhinoclemmys areolata (Duméril and Bibron 1851), Furrowed Wood Turtle, Black-bellied Turtle, Mojena. En: A.G.J. Rhodin, P.C.H. Pritchard, P.P. van Dyke, R.A. Saumure, K.A. Buhlmann, J.B. Iverson & R.A. Mittermeier. (eds). Conservation Biology of Freshwater Turtles and Tortoises: A Compilation Project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Monographs 5: 022.1–022.7. [ Links ]
75. WILLETTE, D.A.S., J.K. TUCKER & F.J. JANZEN. 2005. Linking climate and physiology at the population level for a key life-history stage of turtles. Canadian Journal of Zoology 83: 845–850. [ Links ]
76. ZUFFI, M.A.L. & A. PLAITANO. 2007. Similarities and differences in adult tortoises: a morphological approach and its implication for reproduction and mobility between species. Acta Herpetologica 2(2): 79-86. [ Links ]














