Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.34 no.1 Bogotá Jan./June 2012
MIGUEL ANTONIO
MURCIA-RODRÍGUEZ
MARTHA PATRICIA OCHOA-REYES
FIDEL ERNESTO POVEDA-GÓMEZ
Departamento de Biología y Química, Universidad de Pamplona, Pamplona, Norte de Santander, Colombia. miguel.murcia.r@gmail.com, mpochoar@unal.edu.co
Corporación Manaba, Bogotá D.C., Colombia. fierpogo@gmail.com
RESUMEN
Se estudiaron la respiración del suelo (RS) y la caída de hojarasca (CH) en un matorral de Hypericum phellos y Monochaetum strigosum en la franja altoandina del Nororiente de Colombia. Los muestreos mensuales de la RS se realizaron entre enero y diciembre de 2006; la CH se recolectó entre agosto de 2004 y diciembre de 2006. El comportamiento de la respiración del suelo diurna (RSD) fue bimodal con picos en mayo y septiembre (177,65-172,73 mg CO2 m-2 h-1), relacionándose exponencialmente con la temperatura media del aire (R2=0,48; p=0,013) y la humedad relativa (R2=0,40; p=0,028). La respiración del suelo nocturna (RSN) fue trimodal con valores máximos en octubre, agosto y mayo (268,87-181,49-162,79 mg CO2 m-2 h-1). Las tasas anuales de la respiración del suelo diurnas y nocturnas se estimaron entre 35,14 - 39,28 g C m-2 y entre 42,48 - 47,42 g C m-2, respectivamente. Con base en el área del matorral ( 9,1 ha), la liberación de carbono edáfico se calculó entre 3,08 y 3,72 Mg C año-1 para el periodo diurno y nocturno. Las fluctuaciones mensuales de la temperatura media del aire y de la caída de detritus (Dt) determinaron (R2=0,66; p<0,001) la dinámica de la respiración diurna (RSD=77,94TMEDIA+36,45Dt–1142,8) y nocturna RSN=99,05TMEDIA+57,44Dt–1470,3), permitiendo retroinferir que las tasas de respiración en 2005 podrían ser 50% mayores que en 2006. El catabolismo edáfico del matorral dependió menos de las oscilaciones de las variables meteorológicas que el del pastizal.
Palabras clave. Flujo de CO2, producción de detritus, Hypericum phellos, análisis Dummy, retroinferencia.
ABSTRACT
Soil respiration (SR) and litterfall (LF) were studied in a bush dominated by Hypericum phellos and Monochaetum strigosum in a High-Andean forest in northeastern Colombia. SR monthly samples were carried out between January and December 2006 while LF was collected between August and December 2006. The daytime soil respiration (DSR) was bimodal with peaks in May and September (177,65 - 172,73 mg CO2 m-2 h-1) and was exponentially related to mean air temperature (R2=0,48; p=0,013) and relative humidity (R2=0,40; p=0,028). The night soil respiration (NSR) was trimodal with peaks in October, August and May (268,87 - 181,49 - 162,79 mg CO2 m-2 h-1). The yearly DSR and NSR rates were estimated between 35,14 - 39,28 g C m-2 and 42,48 - 47,42 g C m-2, respectively. Based on the bush area ( 9,1 ha), the release of soil organic carbon (SOC) was calculated between 3,08 and 3,72 Mg C year-1 for the daytime and night periods. The monthly fluctuations of the mean air temperature and the detritus fall (Df) determined (R2=0,66; p<0,001) the dynamics of the diurnal (DSR=77,94TMEDIA + 36,45Df–1142,8) and nocturnal respirations (NSR=99,05TMEDIA+ 57,44Df–1470,3), suggesting that the respiration rates in 2005 were 50 % higher than those in 2006. The bush edaphic catabolism was not as depended on the weather variables as in the pastures.
Key words. CO2 flow, Detritus production, Hypericum phellos, Dummy analysis, Backforecasting.
Recibido: 07/10/2011
Aceptado: 18/05/2012
INTRODUCCION
La respiración del suelo (RS) en ecosistemas boscosos se considera como el segundo flujo de carbono (C) más importante que se establece entre la biosfera y la atmósfera, jugando un papel crítico en la dinámica del ciclo global del C: representa el 70% del metabolismo en bosques templados y alcanza un 37% del total del C terrestre en bosque tropicales (Raich & Schlesinger 1992, Dixon et al. 1994, Law et al. 2002). La RS integra la respiración radicular, la actividad heterótrofa de los edafobiontes que reciclan el carbono procedente de la caída de hojarasca, y en menor proporción, la oxidación química de los compuestos de C contenidos en el horizonte orgánico del suelo (Lloyd & Taylor 1994, Raich & Tufekcioglu 2000, Yi et al. 2007). Cerca de la mitad de la respiración del suelo se deriva de la actividad metabólica para soporte y crecimiento radicular y asociación con micorrizas (Hanson et al. 2000, Högberg et al. 2001). La emisión anual de C, a través de la RS, es de 80,4 Pg CO2-C (1Pg=1015g), representa aproximadamente un 10% del total del C atmosférico y es 10 veces más grande que el obtenido por la combustión de compuestos fósiles y la deforestación combinadas (Raich & Schlesinger 1992, Schlesinger & Andrews 2000, Raich et al. 2002). Por lo tanto, pequeños incrementos en la respiración del suelo o cambios en los factores que controlan sus tasas, pueden resultar en cambios significativos en la concentración de CO2 atmosférico y en el balance calórico (Schlesinger & Andrews 2000, Veenendaal et al. 2004, Kane et al. 2005, Dias et al. 2010). La respiración del suelo se ha convertido en el evento central de los cambios ecológicos globales debido a su papel controversial en los procesos de calentamiento global (Giardina & Ryan 2000), ya que contribuye a determinar si un ecosistema dado se comporta como fuente de carbono o sumidero de carbono (Jassal et al. 2007).
Los cambios en la composición florística y en la estructura del bosque, la calidad de la hojarasca en los estadios sucesionales y las actividades humanas (deforestación y revegetalización) afectan la respiración del suelo (Raich & Schelesinger 1992, Houghton & Hackler 1999, Law et al. 2001, Raich & Tufekcioglu 2000, Tedeschi et al. 2006). En el neotrópico, el aporte de hojarasca en diferentes comunidades sucesionales del bosque altoandino conduce a una disminución de las tasas de respiración diurnas e incrementa las tasas de respiración nocturnas a lo largo del gradiente sucesional (Murcia & Ochoa 2008, Murcia 2010).
Las variaciones en la temperatura y en la humedad del suelo explican satisfactoriamente la variación de la RS a corto plazo en el ámbito local (Maier & Kress 2000, O'Neill et al. 2002). La relación entre la RS y la temperatura frecuentemente se describe por una función exponencial (Lloyd & Taylor 1994, Fang & Moncrieff 2001). Wang et al. (2010), concluyeron que el estado sucesional afecta al microclima, la biomasa radicular, la actividad microbiana, las propiedades químicas del suelo y la calidad de la hojarasca, por lo tanto afectan directa e indirectamente la respiración del suelo.
Este estudio trata de estimar y modelar el proceso ecológico de la respiración del suelo en la fase priseral arbustiva de un bosque altoandino en el norte de los Andes, con el fin de fortalecer el marco teórico de la ecología de la restauración y de la biología de la conservación en los orobiomas neotropicales de Colombia. Nuestros objetivos fueron (i) relacionar las variables meteorológicas y la caída de hojarasca con el comportamiento de la respiración del suelo en una comunidad de matorral en la cuenca del río Pamplonita; (ii) determinar cuáles son los principales factores que regulan la respiración del suelo y (iii) establecer un modelo matemático que permita retroinferir el comportamiento hipotético de la RS en el contexto del cambio climático global: la anomalía pluvio-térmica que se presentó en el año 2005.
MATERIALES Y MÉTODOS
Área de estudio
El presente estudio se realizó en la Reserva Natural El Volcán, Municipio de Pamplona (Norte de Santander, Colombia). La reserva se localiza en la cuenca alta del río Pamplonita, entre 2970 y 3450 m de altitud, con coordenadas geográficas (7° 20' 57.4'' N, 72° 42' 12.2'' W), y una extensión aproximada de 590 hectáreas. La cuenca tiene zonas de vida altoandina y de páramo con diferentes grados de perturbación ocasionados por la rotación de la actividad agrícola y ganadera (Murcia & Ochoa 2008). En un sector de aproximadamente 9,1 ha, a 3055 m de altitud, con pendientes entre 30 y 45%, se desarrolla una comunidad arbustiva dominada por Hypericum phellos y Monochaetum strigosum. Esta comunidad corresponde a la segunda fase sucesional del bosque altoandino denominada en este estudio como matorral.
Los registros meteorológicos diarios, mensuales y anuales fueron obtenidos y procesados a partir de la base de datos de la estación climatológica principal tipo AM 1601502 instalada el 1/4/1972 por el actual Instituto de Meteorología y Estudios Ambientales IDEAM a 2340 m de altitud, 7°22' N y 72°38' O, en el Instituto Superior de Educación Rural ISER del municipio de Pamplona, corriente del río Pamplonita (Eslava 1986).
Respiración del suelo y caída de hojarasca
La tasa de respiración del suelo (TRS) se estimó según el comportamiento anual de la concentración de dióxido de carbono con la "caja invertida" de Walter & Haber (1957) descrita por Medina & Zelwer (1972) y empleada por Cavelier & Peñuela (1990) en bosques de niebla y caducifolios en la Serranía de Macuira, Colombia. Se usaron frascos de compota con 10 ml de KOH 0,5 N (Murcia & Ochoa 2008) puestos en un trípode metálico de 2 a 3 cm sobre el suelo, cubiertos con cilindros de acero inoxidable de 30 cm de longitud y 15 cm de diámetro sellados con suelo alrededor del margen más bajo; existiendo una relación de 15:1 entre el área de emisión del suelo y el área de absorción de la solución (Cavelier & Peñuela 1990). Se distribuyeron cinco cilindros al azar y cercanos a los recolectores de hojarasca (Murcia 2010). Los cilindros invertidos se dejaron expuestos durante el día (desde las 6:00 hasta las 18:00 h) y la noche (desde las 18:00 hasta las 6:00 h) para determinar el comportamiento de la concentración de CO2. Después de la exposición, el CO2 fijado por el KOH se determinó por titulación con solución de H2SO4 0,1 N, usando un titulador automático 702 SM Tritino. Se muestreó una vez por mes durante el año 2006 para un total de 360 titulaciones. Los valores obtenidos de CO2 se multiplicaron por 4/3 para nivelarlos con los que se habrían detectado mediante análisis de gases en el infrarrojo (Haber 1958, Medina & Zelwer 1972, Medina et al. 1980)
La caída de hojarasca fina (hojas, ramas, troncos, estructuras reproductivas, líquenes y detritus) se determinó según lo propuesto por Vitousek (1984), Arenas (1995), Hernández & Murcia (1995) y Murcia (2010): se ubicaron aleatoriamente veinte recolectores de hojarasca a lo largo de un transecto de 100 m x 20 m sujetos a los arbustos a 70 cm del suelo. Estos fueron fabricados en lona plástica doble capaz de retener material vegetal de 0,1 mm y permitir drenar el agua lluvia. Las lonas se cosieron y se fijaron con un anillo de alambre dulce formando una trampa de 50 cm de profundidad, 50 cm de diámetro y 0,2 m2 de área de colección. El material recogido se pesó en fresco y seco en balanza con precisión de 0,01mg.
Análisis estadísticos
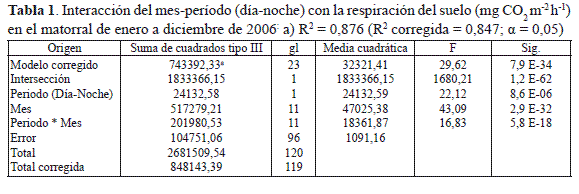
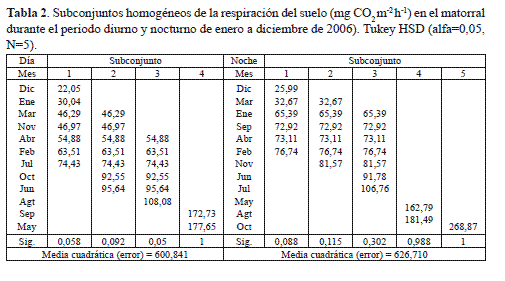
Se usó un modelo lineal general multivariante (GLM-M por su acrónimo en inglés) para determinar el efecto de la interacción temporal mes-período (día-noche) sobre la respiración del suelo (RS) en la fase sucesional de matorral (Zuur et al. 2007). Se hicieron correlaciones paramétrica (Pearson) y no paramétricas (Kendall y Spearman) entre la RS media mensual y las variables meteorológicas, y una regresión lineal múltiple para determinar la relación entre éstas y la respiración del suelo diurna (RSD) y nocturna (RSN), seleccionando las variables independientes (meteoros y componentes de la caída de hojarasca) por pasos sucesivos (Hair et al. 1998, Vittinghoff et al. 2005). La tasa anual de la RS se estableció con base en un modelo de regresión lineal entre la respiración del suelo acumulada (RSA) en mg CO2 m-2 h-1 (y) y el tiempo medido en días (x) con un intervalo de confianza del 95%. La variable acumulada (y) se creó con el fin de establecer si la razón de cambio de la RS aumenta constantemente a lo largo del año (Hernández & Murcia 1995, Murcia & Ochoa 2008). La producción total de Carbono se estimó multiplicando la tasa anual de la respiración del suelo por el área que cubre la fase sucesional del matorral altoandino (Murcia 2010).
Se utilizó el programa estadístico SPSS versión 19.0 (IBM 2011) para los análisis de correlación (r de Pearson, τ de Kendall y ρ de Spearman), varianza univariante (GLM-G), estimación curvilínea (modelos: logarítmico, exponencial, multiplicativo, inverso y polinómico), regresión lineal univariante y multivariante, y de residuos para validar los modelos (prueba de Rachas, Normalidad: Kolmogorov-Smirnov y Heterocedasticidad: Levene). En las gráficas se usaron barras de error para representar la media ± una unidad de error típico y los intervalos de confianza del 95%. Para comparar las líneas de tendencia de las tasas de respiración del suelo acumuladas (diurna y nocturna), se programó en R (2011) un modelo de regresión lineal simple en dos grupos con base en la definición de una variable indicadora (z) o variable "dummy" para una de las categorías de los dos grupos y ajustar el siguiente modelo:
Y = β0 + β1x + β2z + β3x z + ε,
donde z = 1 para los datos tomados en el día, z = 0 para los datos tomados en la noche (Kleinbaum et al. 2008). Al construir una variable dummy de esa manera se obtienen dos modelos a saber:
Grupo 1 (z = 1): Y = (β0 + β2) + (β1 + β3)x + ε,
Grupo 2 (z = 0): Y = β0 + β1x + ε.
RESULTADOS
Vegetación
El matorral altoandino es una comunidad vegetal transitoria dominada por especies precursoras, como Hypericum phellos y Monochaetum strigosum, de crecimiento simpodial (Font-Quer 1993), porte leñoso, copas ralas, tallos erguidos delgados y densos con fustes menores de 5 cm de DAP, ramificados a menos de la mitad de su altura, entre 2 y 4 m de altura, en un estrato arbustivo y subarbóreo de Miconia ligustrina, M. elaeoides y Gaultheria anastomosans, poco definido, más bien denso (Cortés 2003) con cobertura continua del 80 % (Sánchez et al. 2007), en medio del cual hay arbolitos dispersos de Weinmannia fagaroides, W. tomentosa, Ternstroemia meridionalis y Schefflera sp que emergen hasta 6 m (Murcia 2010). Esta comunidad arbustiva, con 20 años de regeneración natural, es la segunda etapa sucesional, subsere o segunda parte de la serie ecológica de desarrollo del bosque altoandino en la cuenca del río Pamplonita, ubicada entre 3060 y 3050 m de altitud.
Clima
El régimen de distribución de las lluvias es de tipo bimodal con valores máximos en octubre y abril (136,84 - 115,47 mm) y mínimos en febrero y enero (34,53 – 41,82 mm), con un monto promedio anual de 916,3 ± 213,3 mm. La evaporación es relativamente constante: mayor en agosto ( 104,66 mm) y menor en abril ( 77,36 mm), con un valor medio anual de 1125,6 ± 104,6 mm. La humedad relativa (HR%) guarda relación inversa con la evaporación (r=-0,76; p=0,004): a medida que la evaporación aumenta entre junio y agosto, la HR% tiende a disminuir en promedio entre el 72 y 74% (figura 1a). La temperatura media del aire (TMEDIA) es de 15 ± 0,5 °C; sin embargo, la marcha mensual de la TMEDIA es diferencial (Anova p<0,0001, N=37) con valores máximos en mayo y septiembre (15,79 - 15,58 °C) y mínimos en enero, diciembre y febrero (13,71 – 14,17 – 14,25 °C).
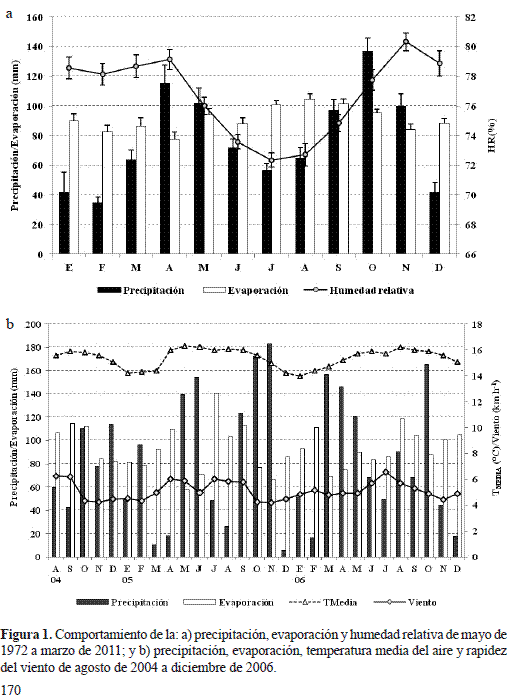
Variables meteorológicas
El comportamiento de la marcha anual de la precipitación y de la evaporación fue bimodal y altamente contrastante (r=-0,553, p=0,002, n=29, la relación entre estas dos variables es lineal e inversamente proporcional, si la precipitación aumenta en una unidad, entonces se espera que la evaporación disminuya en 0,2 mm). Los valores extremos de la precipitación se presentaron en el 2005: noviembre y octubre con los máximos 182,9- 172,5 mm; diciembre y marzo con los mínimos 5,3- 10,5 mm; mientras la evaporación más alta ocurrió en julio de 2005, agosto de 2006 y septiembre de 2004 con 140,7-118,6- 114,1 mm y las más bajas en mayo y noviembre de 2005 con 57,7- 65,9 mm (figura 1b). La HR% se correlacionó inversamente con la evaporación y la velocidad del viento (r=-0,703, p<0,0001; r=-0,602, p=0,001, respectivamente). El brillo solar mostró el mayor grado de asociación negativo con la precipitación (r=-0,616 p<0,0004). En general, la dinámica de las variables meteorológicas configuraron un periodo de marcada estacionalidad en lo referente a la precipitación y a la evaporación, lo cual podría conducir a un posible déficit hídrico de ( -273 mm) entre la entrada por lluvia y la pérdida por evaporación, relativamente superior al calculado para el periodo de 1973 al 2010 ( -209,3 mm).
Variación de la temperatura
La variación interanual de la temperatura media del aire exhibe una tendencia a incrementarse linealmente con respecto al tiempo (R2=0,43; p<0,00001) con una razón de cambio anual cercana a los 0,03 °C (figura 2a), lo cual implicaría que para el 2020, la temperatura promedio alcanzaría los 15,83 °C o un aumento de 0,83 °C con respecto al promedio entre 1973 y 2010. Este incremento de temperatura podría conducir a una disminución de la HR cercana al 74,8%, ya que ésta decrece linealmente a razón de (-2,48%) por cada °C que aumenta la temperatura media (figura 2b).
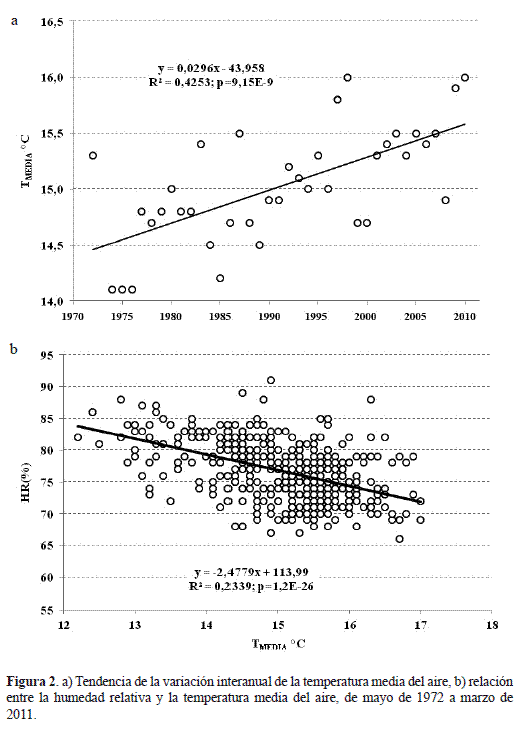
Variación temporal de la respiración del suelo
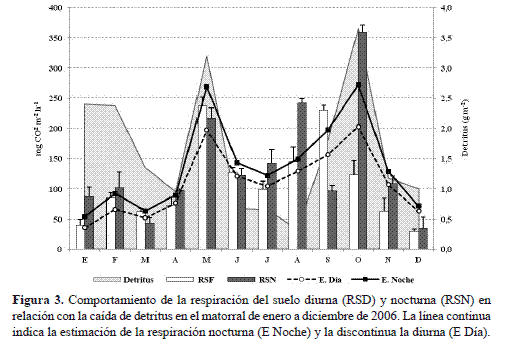
La dinámica de la respiración del suelo (RS) en el matorral mostró un comportamiento altamente diferencial en el ámbito circadiano y mensual (tabla 1):
la RS durante el período diurno fue bimodal; mientras que en el nocturno, la RS fue mucho más fluctuante con cuatro picos de flujo de CO2 durante el año de estudio (figura 3). En los meses de mayo y septiembre se presentaron las mayores tasas de respiración diurnas, con valores de 177,65 y 172,72 mg CO2 m-2 h-1. En tanto, en la noche, la máxima actividad metabólica del suelo se observó en octubre con 268,87 mg CO2 m-2 h-1 (tabla 2) periodo en el cual se registraron los picos máximos de precipitación ( 165,2 mm) y de caída de hojarasca ( 3,65 g m-2).
A pesar de no haber relación estadística entre la RS y la caída de hojarasca en el matorral altoandino, el pico de mayor de producción de hojarasca ( 63 g m-2) coincidió con la mayor tasa de RS diurna en mayo del 2005. Así mismo, las menores tasas de RS diurna y nocturna, que se presentaron en diciembre de 2005, coinciden con uno de los menores valores de precipitación ( 17,6 mm) y de caída de hojarasca ( 22,9 g m-2)
Efecto del clima sobre la RS
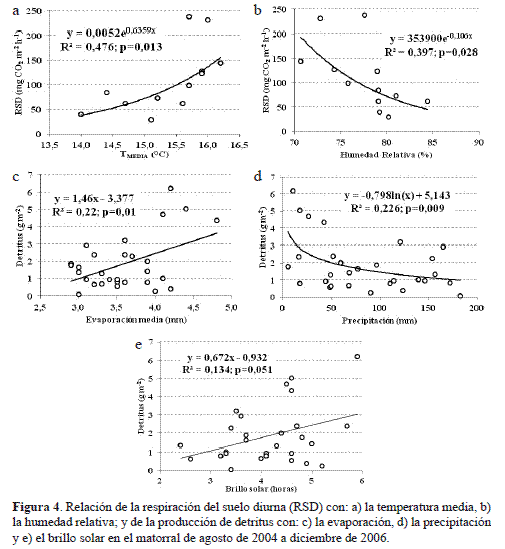
La respiración del suelo diurna (RSD) se correlacionó directa (r=0,637, p=0,026) e inversamente (r=-0,608, p=0,036) con la temperatura media del aire (TMEDIA) y la humedad relativa del aire (HR%): por cada unidad de aumento que exhibe la Tmed y la HR%, la RSD se incrementa en 46,6 mg CO2 m-2 h-1 y se ve atenuada en 8,14 mg CO2 m-2 h-1 respectivamente. Sin embargo, la relación causal más estrecha entre los factores térmico e higrométrico y la RSD fue de tipo exponencial (figura 4 a,b), lo cual equivale a que, bajo condiciones ambientales hipotéticas de alta temperatura (> 17 °C) y baja humedad relativa (<70%), la RSD alcanzaría, en promedio y univariadamente, valores superiores a 258 y 212 mg CO2 m-2 h-1. Estos resultados e inferencias permiten plantear que los cambios en el comportamiento de la TMEDIA pueden afectar en mayor medida el incremento de las tasas de respiración diurnas del suelo más que los descensos de la HR%. No obstante, en los periodos de enero-abril, y noviembre-diciembre, la TMEDIA se situó entre los 14,0 y 15,6 °C y la HR entre 79,1 y 84,4% siendo valores relativamente altos que posibilitan el incremento de las tasas de evaporación (figura 1b) y por ende el aumento de las emisiones de CO2, la RSD, por el contrario, presentó las tasas más bajas (figura 3). Es probable que las bajas precipitaciones aunadas con el efecto de la pendiente, en el sentido de favorecer la escorrentía superficial, expliquen el descenso abrupto de las tasas de respiración en los meses más secos del año.
Tasas de cambio
El comportamiento de la respiración del suelo acumulada (RSA) del matorral se relacionó directamente con el transcurso del tiempo (figura 5), cuyas ecuaciones de regresión son:
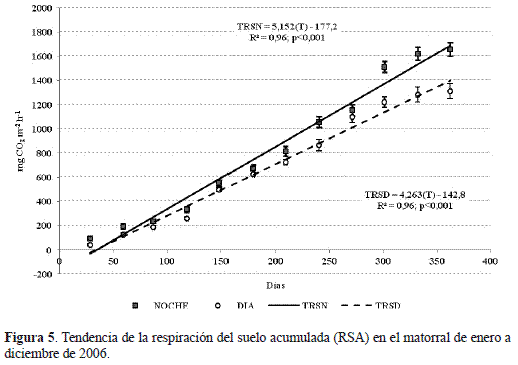
(1) TRSD = 4,263T – 142,7
(2) TRSN = 5,152T – 177,2
Donde TRS, es la tasa de respiración del suelo (D=diurna, N=nocturna) expresada en mg CO2 m-2 h-1, y T, el tiempo (número de días). El intercepto para los períodos fueron significativos (t=-5.608; t=-6,138, p<0,001, n=60).
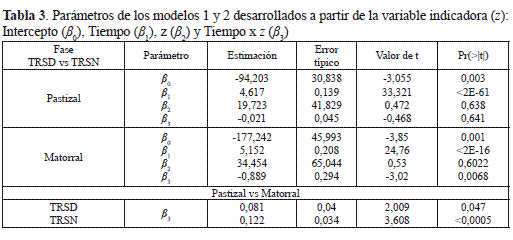
El análisis de las variables indicadoras de la TRED y TREN mostró que la velocidad promedio anual con que se libera el CO2 nocturno en el matorral es significativamente mayor que el diurno, ya que el coeficiente tipificado (-3,02) asociado al parámetro β3 del modelo propuesto, que compara las pendientes de las ecuaciones de regresión 1 y 2 (Tiempo por z), es estadísticamente diferente de cero (tabla 3). Por lo tanto, el metabolismo edáfico de la primera fase sucesional arbustiva del bosque altoandino en la cuenca del rio Pamplonita, se considera altamente diferencial y permitiría una caracterización funcional más precisa del papel que desempeñan las primeras fases sucesionales en el balance de carbono en el ámbito del cambio climático.
Con base en las ecuaciones 1 y 2, la tasa anual de respiración del suelo, para el periodo diurno, se calculó entre 35,14 y 39,28 g C m-2 año-1, y para el nocturno entre 42,48 y 47,42 g C m-2 año-1. Estos estimativos son similares a los encontrados en la fase sucesional de Pastizal (tabla 4) del bosque altoandino (Murcia y Ochoa 2008), pero con límites de variación más amplios, particularmente en el periodo nocturno, el cual se diferenció del periodo diurno al final del estudio posiblemente debido a una mayor acumulación de materia orgánica y de biomasa radicular de arbustos y arbolitos de Hypericum phellos y Miconia ligustrina característicos de la fase de matorral y dominantes en la producción foliar promedio multianual con 7,63 y 9,63 g m-2 año-1 (Murcia 2010).
Teniendo en cuenta que el área de estudio cubierta por la comunidad de matorral es de aproximadamente 9,1 hectáreas, la producción de carbono edáfico podría calcularse entre 3,084 y 3,72 Mg C año-1 para el periodo diurno y nocturno. En relación con la fase de pastizal, el matorral retiene entre 7 y 6 veces más carbono en el suelo, ya que guarda una relación de superficie de 1:6. Esta relación muestra la importancia de incrementar la productividad primaria neta del pastizal para inducir la aceleración de los procesos de la caída de hojarasca y reducir las tasas de descomposición con el fin de aumentar las tasas de acumulación de materia orgánica en los suelos de los diferentes núcleos de expansión que existen en la cuenca alta del río Pamplonita y así reducir significativamente las emisiones de CO2 edáfico.
Modelación de la RS
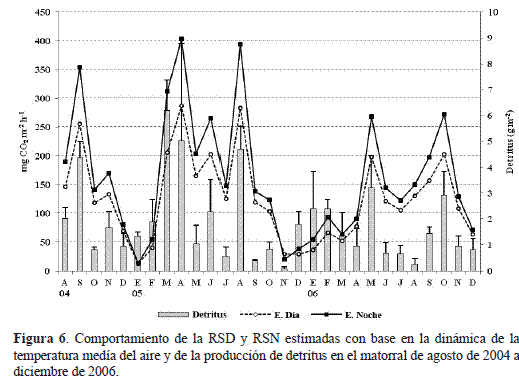
La capacidad de respiración del suelo del matorral está determinada por la dinámica de los aportes del material particulado (detritus) procedente de la hojarasca fina (figura 3) y por las fluctuaciones promedio mensuales de la temperatura media del aire TMEDIA (figura 1b). De tal forma que, la respiración del suelo estimada diurna (RSD) y la nocturna (RSN) se ajustaron a un modelo de regresión lineal múltiple (figura 6), cuyas ecuaciones son:
(3): RSD = 77,96(TMEDIA) + 36,43(Dt) – 1143,09
(4): RSN = 99,1(TMEDIA) + 58,94(Dt) – 1471,06
Donde RSD y RSN, se expresan en mg CO2 m-2 h-1; y Dt es la producción de detritus en g m-2.
La significancia de los parámetros y los estadísticos de prueba para comprobar la idoneidad de las ecuaciones 3 y 4 con el análisis de residuos indican que todos los supuestos se cumplen satisfactoriamente (tabla 5) y, por lo tanto, cerca de 66 % de la variación de la RSD y RSN se debe a los cambios de la temperatura media y de los aportes del detritus. El porcentaje restante podría explicarse por las fluctuaciones de la HR (figura 4a) y del recorrido del viento (ρ = 0,634, p<0,05), pero también con otras variables de tipo endógeno como el desarrollo y la morfofisiología de las especies vegetales e igualmente por las propiedades fisicoquímicas y biológicas del suelo y de la hojarasca.
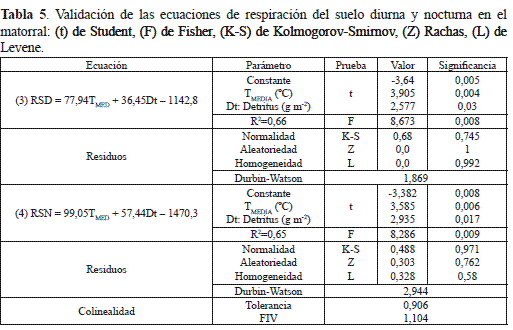
Retro-Inferencia de la RS
Con base en las variaciones simultáneas de la temperatura media del aíre (figura 1b) y de la caída de detritus (figura 3) implícitas en las ecuaciones 3 y 4, se logró retroinferir el comportamiento hipotético de las medias mensuales de la RSD y RSN entre agosto de 2004 y diciembre de 2005 (figura 6). El comportamiento simulado de la RS muestra como los picos de mayor flujo de CO2 están asociados a los meses con los registros promedios más altos de temperatura y producción de material particulado: en abril de 2005, con una temperatura de 16°C y una producción de 5,03 g m-2 de detritus, la RSD y RSN simuladas fueron máximas con 287,4 y 403,2 mg CO2 m-2 h-1. Sin embargo, en marzo del mismo año, cuando la caída de detritus fue la máxima registrada en el matorral ( 6,2 g m-2), la RSD y RSN calculadas alcanzaron los 205,6 y 312,2 mg CO2 m-2 h-1, debido a que la temperatura media del aire ( 14,4°C) estuvo 1,6°C por debajo de la registrada en abril (figura 6). Algo similar ocurre con la simulación de la RS en agosto, cuando la producción de detritus presentó el tercer valor en importancia ( 4,7 g m-2) y una temperatura de 16,1°C, lo cual determinó que la RSD y RSN se estimaran como las segundas mayores tasas de liberación de CO2 de todo el periodo de estudio, configurando el 2005 como un año con régimen bimodal bien definido y de máxima actividad metabólica.
DISCUSIÓN
Pese a las diferencias florísticas y estructurales encontradas en las dos primeras fases sucesionales del bosque altoandino (Sánchez et al. 2007, Murcia 2010), las medias mensuales de la RSD y RSN en el matorral fueron ligeramente menores que las halladas en una comunidad sucesional de pastizal de Holcus lanatus y Anthoxanthum odoratum (Murcia & Ochoa 2008) con un periodo de regeneración natural de 10 años (figura 7a). Sin embargo, la tasa de la RSN del matorral con 1703,3 mg CO2 m-2 año-1 (figura 7b) supera la del pastizal (1638,8 mg CO2 m-2 año-1) debido a que la velocidad promedio con que se libera el CO2 edáfico en el matorral es mayor (5,152 mg CO2 m-2 día-1) que en el pastizal (4,897 mg CO2.m-2día-1).

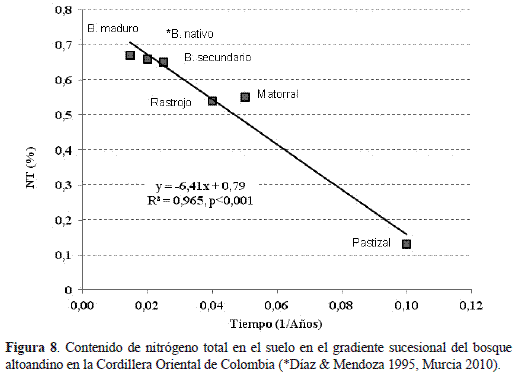
Esta diferencia metabólica coincide con el aumento porcentual del contenido edáfico de carbono orgánico y, en particular, del nitrógeno total encontrado en la fase de matorral, el cual se relacionó con respecto al inverso del gradiente sucesional del bosque altoandino en la cordillera oriental de Colombia (Murcia 2010) de tal forma que la fase priseral de pastizal queda segregada notablemente de las tardiserales (figura 8). Este enriquecimiento diferencial de nitrógeno edáfico en el matorral podría explicarse con base en los aportes de hojarasca (9,04 - 7,63 g m-2) y las bajas tasas de retención de nitrógeno foliar (0 - 35%) de Miconia ligustrina e Hypericum phellos permitiendo que el 100% y el 65% del nitrógeno remanente pase directamente a la superficie del suelo y se acumule en el mantillo (Murcia 2010).
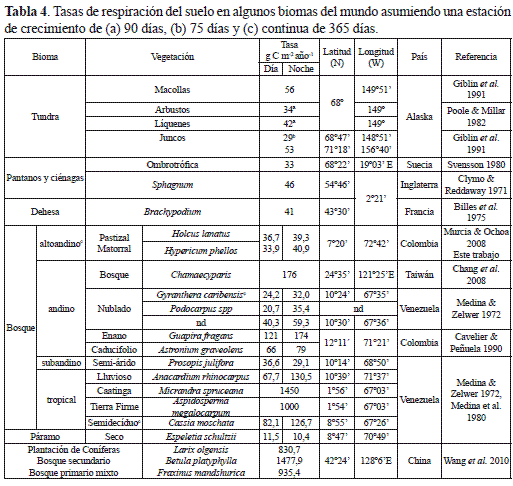
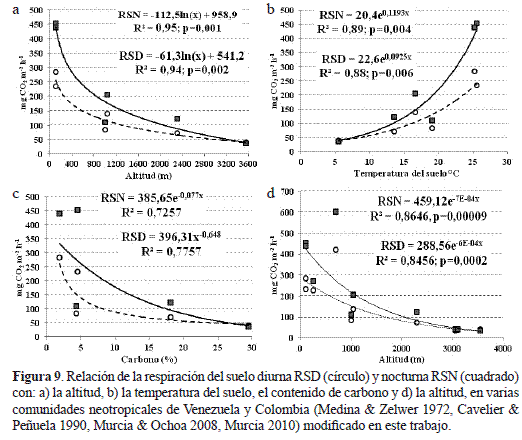
En el ámbito neotropical, las tasas de producción de carbono estimadas para las dos primeras fases sucesionales del bosque altoandino (BAA) están dentro del rango calculado por nosotros para comunidades de bosque nublado en Venezuela entre 1126 y 2300 m dominados por Gyranthera caribensis y Podocarpus spp. con precipitaciones entre 1795 y 3000 mm, y de bosque subandino semi-árido (850 msnm) de Prosopis julifora con lluvias entre 500 y 600 mm (Medina & Zelwer 1972). Sin embargo, en relictos de bosque tropical lluvioso siempreverde de Anacardium rhinocarpus, y semicaducifolios de Cassia moschata, en los llanos centrales de Venezuela, la producción de carbono triplica las del BAA (tabla 4). Mientras que, en la franja de transición del bosque seco caducifolio y del bosque nublado achaparrado (500- 865 m) en la Serranía de Macuira-Colombia, la producción de carbono duplicó y cuadriplicó las emisiones de carbono del BAA (Cavelier & Peñuela 1990). En contraste, en una comunidad de Espeletia schultzii e Hypericum brathys, en el Páramo de Mucubají a 3550 m con precipitaciones de 500 mm y a una temperatura media de 5°C, la emisión anual de carbono diurna fue superior a la nocturna (Medina & Zelwer 1972) y corresponden a una cuarta parte de las emisiones en el matorral. Con base en los resultados de Medina y Zelwer (1972), la respiración del suelo diurna y nocturna (RSD y RSN) decrecen de forma logarítmica a lo largo del gradiente altitudinal y de carbono; mientras que, en el gradiente térmico, éstas se aceleran exponencialmente, de forma tal que las emisiones de carbono tienden a converger a medida que se avanza en altitud y a segregarse a medida que la temperatura del suelo aumenta (figura 9 a-c). Con la adición de las emisiones de los bosques estudiados en Colombia, el patrón convergente de la RSD y RSN, se mantiene aunque de forma exponencial debido a que los registros del bosque nublado de la Serranía de Macuira se alejan considerablemente de la curva de estimación (figura 9d), posiblemente por ser un sistema montañoso aislado de la cordillera de los Andes.
En el ámbito global, las tasas anuales de la respiración del suelo del matorral son equivalentes a las reportadas en comunidades de líquenes, juncos y arbustos de la tundra ártica en Alaska (Poole & Millar 1982, Giblin et al. 1991), pantanos ombrotróficos en Suecia (Svensson 1980), áreas dominadas por Sphagnum en Inglaterra (Clymo & Reddaway 1971) y pastizales de Brachypodium en Francia (Billes et al. 1975). Estas comunidades crecen en planicies bajas con escasas precipitaciones y bajas temperaturas; según la latitud, configuran suelos permanentemente congelados, que por solifluxión estival originan pantanos y ciénagas con altos contenidos de carbono (Sonesson 1980, Bliss et al. 1981). Según Svensson (1980), las variaciones del flujo de CO2 en estos pantanos, se explica en un 69% por fluctuaciones térmicas e hídricas del suelo en una estación de crecimiento de 145 días. Por otra parte, en un gradiente sucesional de bosque templado (15-60-180 años) en la región nororiental de China entre 674 y 748 m, con una temperatura del aire media multianual de 3,6°C, una precipitación entre 600- 810 mm, y suelos derivados de cenizas volcánicas con una temperatura edáfica media de 13,1°C, Wang y colaboradores (2010) registraron tasas de 831, 1478 y 935 g de C m-2 año-1, lo cual implica que para que la tasa de respiración en el bosque secundario de Betula platyphylla se duplique, se requiere que el periodo de tiempo transcurrido entre las dos primeras fases serales se cuadruplique; mientras que, en el BAA el tiempo transcurrido entre las fases priserales se duplica, la velocidad promedio solo se incrementa en 0,3 unidades. En contraste, en bosques maduros tropicales esclerófilos y de tierra firme de la Amazonia, con precipitaciones entre 2000 y 3565 mm, las tasas anuales de la respiración del suelo (1450- 1000 g de C) se equiparan con la del bosque templado secundario de China (tabla 4), lo cual pone de manifiesto el efecto de los factores y elementos climáticos sobre la regulación de las tasas de respiración del suelo en el ámbito altitudinal y latitudinal.
El uso de la variable indicadora (z) en el análisis comparativo de las tendencias acumuladas de la respiración del suelo, en las dos primeras fases sucesionales del BAA, nos han permitido establecer no solo que las velocidades de las tasas de respiración del suelos diurnas y nocturnas del matorral sean significativamente superiores a las del pastizal (tabla 3) sino que éstas tienden a segregarse en la medida en que la sucesión vegetal avanza (Murcia 2010). Este comportamiento segregacional sucesional es similar al exhibido en nuestros análisis de las tasas de respiración de las comunidades vegetales estudiadas por Medina & Zelwer (1972): en la medida en que la temperatura del suelo aumenta, las diferencias entre las tasas diurnas y nocturnas se hacen mayores según se desciende en el gradiente altitudinal (figura 9a,b).
Dado que las relaciones causales univariantes más importantes que se lograron establecer entre los procesos ecológicos de la respiración del suelo y la dinámica de la caída de hojarasca con respecto a las fluctuaciones de algunas variables meteorológicas fueron de tipo no lineal y con una relativa baja capacidad explicativa (figura 4) hacen que nuestros modelos lineales múltiples (E3 y E4) expliquen, por primera vez y de forma razonable, el comportamiento observado de la respiración del suelo en una fase sucesional arbustiva de bosque altoandino en Colombia (tabla 5). Debido a la alta complejidad intrínseca e interactiva que se establece entre el proceso anabólico de la producción de hojarasca asociado al flujo y ciclado de nutrientes (George et al. 2010, Cusack et al. 2011, Turner & Engelbrecht 2011) y catabólico de la respiración del suelo autótrofa y heterótrofa (Ryan & Law 2005, Murcia & Ochoa 2008, Wang et al. 2010) y su relación con el clima en el ámbito sucesional (Murcia 2010) pone de manifiesto la urgente necesidad de estimar el comportamiento de la RS en escenarios de cambio climático. Por retroinferencia estadística, nuestros modelos establecen de manera hipotética que el aumento concomitante de la temperatura media del aire y de la caída de detritus, en proporción aproximada de 2:1, podrían haber inducido, durante el 2005, un incremento cercano al 50% en las tasas de respiración del suelo diurnas y nocturnas en relación con lo observado en el año 2006 (figura 6). Durante el 2005, extensas áreas de la Amazonia, desde Perú hasta el oriente de Brasil, experimentaron los efectos de una de las sequías más severas e intensas que se hayan presentado en los últimos 40 años (Marengo et al. 2008ab, 2011b). Esta sequía extrema, aunque no se relacionó con el fenómeno del Niño (Tomasella et al. 2011), se caracterizó por el descenso histórico del caudal del Amazonas y sus principales tributarios causado por una reducción substancial de las precipitaciones (25% - 40%) y un aumento significativo de las temperaturas ( 3 a 5°C) que condujeron a un incremento del 33% en la tasa de incendios forestales. Estos hechos avalan la importancia de haber retroinferido el comportamiento de la RS en condiciones en que la temperatura media del aire exhibió un abrupto ascenso que se sostuvo por espacio de seis meses durante el 2005 (figura 1b), poniendo en evidencia que las fases sucesionales arbustivas son tan susceptibles a los cambios en los patrones pluvio-térmicos como lo pueden ser los bosques lluviosos neotropicales (Marengo et al. 2011a) y los arrecifes de coral (Ballentine et al. 2008), máxime cuando estas fases regenerativas son las de mayor extensión, después de los potreros, en la alta montaña neotropical de Colombia.
CONCLUSIONES
Las tasas de la respiración del suelo, durante el día y la noche, en la fase priseral arbustiva del bosque altoandino, son constantes y sus velocidades difieren significativamente a lo largo del año. La temperatura del aire y la caída de detritus determinan la variabilidad de la respiración del suelo y permiten retroinferir su comportamiento hipotético en el ámbito de un desfase pluvio-térmico con implicaciones globales. En relación con la fase sucesional de pastizal, el catabolismo edáfico del matorral altoandino es menos dependiente de las oscilaciones de las variables meteorológicas.
AGRADECIMIENTOS
Queremos expresar nuestro agradecimiento a COLCIENCIAS y a la Universidad de Pamplona por el apoyo financiero que brindó al proyecto de investigación "Restauración ecológica de la selva altoandina en la cuenca del río Pamplonita". Al IDEAM por las bases de datos de la estación climatológica principal del ISER, municipio de Pamplona. Al Biólogo MSc. Luis Roberto Sánchez Montaño director del herbario HECASA de la Universidad de Pamplona por la determinación del material vegetal y por su laborioso trabajo en campo. Al Profesor Dr. Orlando Rangel por la dirección de la tesis doctoral del primer autor, y la corrección crítica de este manuscrito. Al estadístico MSc José Fernando Zea Castro por la asesoría en los análisis Dummy. A los profesores Dr. Víctor Barradas, Mario Fariñas y Arnoud Boom por los comentarios y aportes a este manuscrito.
LITERATURA CITADA
1. ARENAS, H. 1995. Dinámica de la hojarasca en un bosque nativo altoandino y en un bosque de eucaliptos en la Región de Monserrate, Colombia. En: Mora L.E. & H. Sturm (editores). Estudios ecológicos del páramo y del bosque altoandino cordillera Oriental de Colombia, Tomo II. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, Colección Jorge Álvarez Lleras 6:457-484. [ Links ]
2. BALLANTINE, D.L., R. S. APPELDOORN, P. YOSHIOKA, E. WEIL, R. ARMSTRONG, J.R. GARCIA, E. OTERO, F. PAGAN, C. SHERMAN, E.A. HERNANDEZ-DELGADO, A. BRUCKNER & C. LILYESTROM. 2008. Biology and Ecology of Puerto Rican Coral Reefs. En: Riegl, B. M. & R. E. Dodge (editores). Coral Reefs of the USA. p 375-405. [ Links ]
3. BILLES, G., J. CORTEZ, P. LOSSAINT, F. LAFONT & J. PRIOTON. 1975. Etude comparative de l'activité biologique des sols sous peuplements arbustifs et herbacés de la garrigue méditerranéenne. (I). Minéralisation du carbone et de l'azote. Rev. Ecol. Biol. Sol. 12: 115-139. [ Links ]
4. BLISS, L.C., O.W. HEAL & J.J. MOORE. 1981. Tundra Ecosystems: A Comparative Analysis (International Biological Programme Synthesis Series 25). Cambridge University Press. 852 p. [ Links ]
5. CAVELIER, J. & M.C. PEÑUELA. 1990. Soil respiration in the cloud forest and dry deciduous forest of Serranía de Macuira, Colombia. Biotropica 22(4): 346-352. [ Links ]
6. CLYMO, R.S. & E.J.F. REDDAWAY. 1971. Productivity of Sphagnum (bog-moss) and peat accumulation. Hidrobiologia 12: 181-192. [ Links ]
7. CORTÉS, S.P. 2003. Estructura de la vegetación arbórea y arbustiva en el costado oriental de la serranía de Chía ( Cundinamarca, Colombia ). Caldasia 25(1):119-37. [ Links ]
8. CUSACK D.F., W.L. SILVER, M.S. TORN & W.H. MCDOWELL. 2011. Effects of nitrogen additions on above- and belowground carbon dynamics in two tropical forests. Biogeochemistry 104: 203–225. [ Links ]
9. DIAS, A.T.C., J. RUIJVEN & F. BERENDSE. 2010. Plant species richness regulates soil respiration through changes in productivity. Oecologia 163: 805-813. [ Links ]
10. DÍAZ, L. & M. MENDOZA. 1989. Flujo de biogeoelementos en un ecosistema de bosque altoandino, Cundinamarca, Colombia. Universidad Nacional de Colombia. Tesis de biología. Bogotá D.C. 265 pp. [ Links ]
11. DIXON, R.K., S. BROWN, R.A. HOUGHTON, A.M. SOLOMON, M.C. TREXLER & J. WISNIEWSKI. 1994. C pools and flux of global forest ecosystems. Science 263: 185-190. [ Links ]
12. ESLAVA, J.A. 1986. Climatología y diversidad climática de Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. 18(57):507-538. [ Links ]
13. FANG, C. & J.B. MONCRIEFF. 2001. Dependence of soil CO2 efflux on temperature. Soil Biol. Biochem 33(2): 155-165. [ Links ]
14. FONT-QUER, P. 1993. Diccionario de Botánica. Ed.Labor, Barcelona. 1244 p. [ Links ]
15. GEORGE, S.J., R.N. KELLY, P.F. GREENWOOD & M. TIBBETT. 2010. Soil carbon and litter development along a reconstructed biodiverse forest chronosequence of South-Western Australia. Biogeochemistry 101:197–209. [ Links ]
16. GIARDINA, C.P. & M.G. RYAN. 2000. Evidence that decomposition rates of organic carbon in mineral soil do not vary with temperature. Nature 404: 858. [ Links ]
17. GIBLIN, A.E., K.J. NADELHOFFER, G.R. SHAVER, J.A. LAUNDRE & A.J. MCKERROW. 1991. Biogeochemical diversity along a riverside toposequence in arctic Alaska. Ecol. Monogr. 61: 415-435. [ Links ]
18. HABER, W. 1958. Ökologische untersuchugen der bodenatmung. Flora 146: 109-157. [ Links ]
19. HAIR, J.F., R.E. ANDERSON, L. TATHAM, & C. BLACK. 1998. Multivariate data analysis. Prentice Hall, Nueva Jersey. 730 p. [ Links ]
20. HANSON P.J., N.T. EDWARDS, C.T. GARTEN & J.A. ANDREWS. 2000. Separating root and soil microbial contributions to soil respiration: a review of methods and observations. Biogeochemistry 48(1): 115-146. [ Links ]
21. HERNÁNDEZ, M. & M.A. MURCIA. 1995. Estimación de la productividad primaria de Espeletia grandiflora H & B y Pinus patula Schl & Cham en el páramo "El Granizo" Cundinamarca, Colombia. En: L.E. Mora & H. Sturm (eds). Estudios ecológicos del páramo y del bosque altoandino cordillera oriental de Colombia. Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Colección Jorge Álvarez Lleras 6: 503-520. [ Links ]
22. HÖGBERG P., A. NORDGREN, N. BUCHMANN, A.F.S. TAYLOR, A. EKBLAD, M.N. HÖGBERG, G. NYBERG, M. OTTOSSON-LOFVENIUS & D.J. READ. 2001. Large-scale forest girdling shows that current photosynthesis drives soil respiration. Nature 411: 789–792. [ Links ]
23. HOUGHTON, R.A. & J.L. HACKLER. 1999. Emissions of carbon from forestry and land-use change in tropical Asia. Glob. Change Biol. 5(4): 481–492. [ Links ]
24. IBM ® SPSS ®. 2011. Advanced Statistic 19.0 For Windows. [ Links ]
25. JASSAL, R.S., T.A. BLACK, T. CAI, K. MORGENSTERN, Z. LI, D. GAUYMONT-GUAY & Z. NESIC. 2007. Components of ecosystems respiration and an estimate of net primary productivity of an intermediate-aged Douglas-Fir stand. Agric. For. Meteorol. 144: 44-57. [ Links ]
26. KANE, E.S., D.W. VALENTINE, E.A.G. SCHUUR, & K. DUTTA. 2005. Soil carbon stabilization along climate and stand productivity gradients in black spruce forests of interior Alaska. Can. J. Forest Res. 35: 2118-2119. [ Links ]
27. KLEINBAUM D.G., L.L. KUPPER & K.E. MULLER. 2008. Applied Regression Analysis and Other Multivariate Methods. 4 edition. Duxbury Applied Series. 906 p. [ Links ]
28. LAW, B.E., P.E. THORNTON, J. IRVINE, P.M. ANTHONI & S. VAN TUYL. 2001. Carbon storage and fluxes in ponderosa pine forests at different developmental stages. Glob. Change Biol. 7(7): 755–777. [ Links ]
29. LAW B. E., E. FALGE, L. GU, D. D. BALDOCCHI, P. BAKWIN, P. BERBIGIER, K DAVIS, A. J. DOLMAN, M FALK, J. D. FUENTES, A. GOLDSTAIN, A. GRANIER, A. GGRELLE, D. HOLLINGER, I. A. JANSSENS, P. JARVIS, N. O. JENSEN, G. KATUL, Y. MAHLI, G. MATEUCCI, T. MEYER, R. MONSON, W MUNGER, W. OECHEL, R. OLSON, K. PILEGAARD, U. K. T. PAW, H. THORGEIRSSON, R. VALENTINI, S. VERMA, T. VESALA, K. WILSON & S. WOFSY. 2002. Environmental controls over carbon dioxide and water vapor exchange of terrestrial vegetation. Agric. For. Meteorol. 113(1-4): 97-120. [ Links ]
30. LLOYD, J. & A. TAYLOR. 1994. On the temperature dependence of soil respiration. Functional Ecology 8: 315-323. [ Links ]
31. MAIER, C.A. & L.W. KRESS. 2000. Soil CO2 evolution and root respiration in 11 year-old loblolly pine (Pinus taeda) plantations as affected by moisture and nutrient availability. Can. J. For. Res. 30(3): 347–359. [ Links ]
32. MARENGO J. A., C. A. NOBRE, J. TOMASELLA, M. CARDOSO & M. OYAMA. 2008a. Hydro-climatic and ecological behavior of the drought of Amazonia in 2005. Philos. Trans. R. Soc. Lond. Biol. Sci. 21:1–6. [ Links ]
33. MARENGO, J.A., C.A. NOBRE, J. TOMASELLA, M. OYAMA, G. SAMPAIO, H. CAMARGO & L.M. ALVES. 2008b. The drought of Amazonia in 2005. J. Clim. 21:495–516 [ Links ]
34. MARENGO, J.A., J. TOMASELLA, W.R. SOARES, L.M. ALVES & C. A. NOBRE. 2011a. Extreme climatic events in the Amazon basin. Climatological and hydrological context of recent floods. Theor Appl Climatol. DOI 10.1007/s00704-011-0465-1. [ Links ]
35. MARENGO, J.A., J. TOMASELLA, L.M. ALVES, W.R. SOARES & D.A. RODRIGUEZ. 2011b. The drought of 2010 in the context of historical droughts in the Amazon region. Geophys Res Lett., 38, L12703, DOI: 10.1029/2011GL047436. [ Links ]
36. MEDINA, E. 1966. Producción de hojarasca, respiración edáfica y productividad vegetal en bosques deciduos de los llanos altos centrales. En: Rapport E A. (editor). Programa Biología del suelo. Monografía I. Centro Coop. Cient. UNESCO Amer. Lat. Montevideo. p. 97-108. [ Links ]
37. MEDINA, E., H. KLINGE, H.C. JORDAN & R. HERRERA. 1980. Soil respiration in Amazonian rain forest in the Rio Negro basin. Flora 170: 240-250. [ Links ]
38. MEDINA, E. & M. ZELWER. 1972. Soil respiration in tropical plants communities. En: Golley P.M. & F.B. Golley (editores). Proceedings of the second international symposium of tropical ecology, Athens, Georgia, pp 245-269. University of Georgia. Athens, Georgia. [ Links ]
39. MURCIA M. A. & M. P. OCHOA. 2008. Respiración edáfica en una comunidad sucesional de pastizal del bosque altoandino en la cuenca del río Pamplonita, Colombia. Caldasia 30(2): 323-339. [ Links ]
40. MURCIA-RODRÍGUEZ, M.A. 2010. Productividad primaria neta del bosque altoandino en la cuenca del río Pamplonita Norte de Santander - Colombia ). Sucesión regenerativa del bosque altoandino. Tesis Doctoral. Universidad Nacional de Colombia, Instituto de Ciencias Naturales, Departamento de Biología, Bogotá D.C. 185 p. [ Links ]
41. O'NEILL, K.P., E.S. KASISCHKE & D.D. RICHTER. 2002. Enviromental control on soil CO2 flux following fire in black spruce, white spruce, and aspen stands of interior Alaska. Can. J. For. Res. 32(9): 1525-1541. [ Links ]
42. POOLE, D.K. & P.C. MILLAR. 1982. Carbon dioxide flux from three arctic tundra types in north-central Alaska, U.S.A. Arctic Alpine Res. 14: 27-32. [ Links ]
43. R. 2011. The R Project for Statistical Computing. 2.13.2 release version. [ Links ]
44. RAICH, J.W. & W.H. SCHLESINGER. 1992. The global carbon dioxide flux in soil respiration and its relation to vegetation and climate. Tellus 44B: 81-99. [ Links ]
45. RAICH, J.W. & A. TUFEKCIOGLU. 2000. Vegetation and soil respiration: correlations and controls. Biogeochemistry 48(1): 71-90. [ Links ]
46. RAICH, J.W., C.S. POTTER & D. BHAGAWATI. 2002. Interannual variability in global soil respiration. Global Change Biol. 8: 800-812. [ Links ]
47. RYAN M.G. & B.E. LAW. Interpreting, measuring, and modeling soil respiration. 2005. Biogeochemistry 73: 3-27. [ Links ]
48. SÁNCHEZ, L.R., S.M. GÉLVIZ & F. SOLANO. 2007. Plantas con Flores de la Reserva El Volcán, Pamplona, Norte de Santander. Bistua 5(2): 27-34. [ Links ]
49. SCHELESINGER, W.H. & J.A. ANDREWS. 2000. Soil respiration and the global carbon cycle. Biochemistry 48: 7-20. [ Links ]
50. SONESSON, M. 1980. Ecology of a Subarctic Mire (Ecological Bulletins 30) Swedish Natural Science Research Council. 313 p. [ Links ]
51. SVENSSON, B.H. 1980. Carbon dioxide and methane fluxes from the ombrotrophic parts of a subarctic mire. Ecological Bulletin 30: 235-250. [ Links ]
52. TEDESCHI, V.A., REY, G. MANCA, R. VALENTINI, P.J. JARVIS & M. BORGHETTI. 2006. Soil respiration in a Mediterranean oak forest at different developmental stage after coppicing. Glob. Change Biol. 12(1): 110-121. [ Links ]
53. TOMASELLA, J., L.S. BORMA, J.A. MARENGO, D.A. RODRIGUEZ, L.A. CUARTAS, C.A. NOBRE & M.C.R. PRADO. 2011. The droughts of 1996 1997 and 2004 2005 in Amazonia: hydrological response in the river main stem. Hydrol. Processes 25:1228-1242. [ Links ]
54. TURNER, B.L. & B.M.J. ENGELBRECHT. 2011. Soil organic phosphorus in lowland tropical rain forests. Biogeochemistry 103: 297–315. [ Links ]
55. VEENENDAAL, E.M., O. KOLLE & J. LLOYD. 2004. Seasonal variation in energy fluxes and carbon dioxide exchange for a broad - leaved semi - arid savanna - Mopane woodland- in Southern Africa. Global Change Biol. 10: 318-328. [ Links ]
56. VITOUSEK, P.M. 1984. Litterfall, nutrient cycling, and nutrient limitation in tropical forests. Ecology 65: 285-98. [ Links ]
57. VITTINGHOFF, E., D.V. GLIDDEN, S.C. SHIBOSKI & C.E. MCCULLOCH. 2005. Regression Methods in Biostatistics. Linear, Logistic, Survival, and Repeated Measures Models. Springer Science+Business Media, Inc., Nueva York. [ Links ]
58. Walter, H. & W. Haber. 1957. Uber die Intensitat der Bodenatmung mit Bemerkungen zu den Lundegardhschen. Werten. Ber. Dtsch. Bot. Ges. 70: 275-282. [ Links ]
59. WANG, X., Y. JIANG, B. JIA., F. WANG & G. ZHOU. 2010. Comparison of soil respiration among three temperate forests in Changbai Mountains, China. Can. J. For. Res. 40: 788-795. [ Links ]
60. YI, Z., S. FU, W. YI, G. ZHOU, J. MO, D. ZHANG, M. DING, X. WANG & L. ZHOU. 2007. Partitioning soil respiration of subtropical forests with different successional stages in south China. Forests Ecology and Management 243: 178-186. [ Links ]
61. ZUUR, A.F., E.N. IENO & G.M. SMITH. 2007. Analysing Ecological Data. Statistics for Biology and Health. Springer. 672 p. Nueva York. [ Links ]














