Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232
Caldasia vol.34 no.2 Bogotá July/Dec. 2012
ANA MARÍA MEZA-S.
JULIANA RUBIO-M.
LUCIMAR G-DIAS
JEYMMY M-WALTEROS
Universidad de Caldas, Manizales, Colombia. ana1668@hotmail.com, julirubio87@hotmail.com
Departamento de Ciencias Biológicas,Universidad de Caldas, Manizales, Colombia. lucimar.dias@ucaldas.edu.co
Universidad de Caldas, Manizales, Colombia. jeymmywalteros@gmail.com
RESUMEN
Con el objetivo de evaluar la composición de macroinvertebrados y la calidad de agua en zonas de río provistas de vegetación ribereña nativa y exótica y zonas sin vegetación fueron muestreadas las quebradas: El Diamante, La Oliva y el río Chinchiná, ubicadas en la cuenca alta del río Chinchiná. La primera estación presenta como vegetación ribereña un bosque nativo, la segunda está influenciada por plantaciones de Eucalyptus sp. y la tercera no presenta vegetación ribereña. Se realizaron tres muestreos de macroinvertebrados, en tres periodos (seco, intermedio y lluvioso) entre febrero y mayo de 2010. Para la recolección de los macroinvertebrados se utilizó la Red Surber, y se hicieron tres repeticiones por sustrato (hojarasca, roca y sedimento fino). En cada punto de muestreo también se registraron variables físico-químicas. En total se colectaron 7486 macroinvertebrados distribuidos en 13 órdenes, 37 familias y 74 géneros. Los resultados de este estudio indican que existen diferencias significativas en cuanto a riqueza de macroinvertebrados entre las estaciones con vegetación ribereña y sin vegetación. Con respecto a la composición, la estación 1 es la que presenta mayor número de géneros exclusivos. Se obtuvo que 26 géneros de macroinvertebrados son compartidos por las tres estaciones, 18 géneros son exclusivos para la estación 1, ocho géneros exclusivos para la 2 y en la tercera estación solamente cuatro géneros son propios. Las variables fisicoquímicas evaluadas y los resultados obtenidos con los índices bióticos BMWP y EPT indican que existen diferencias entre la calidad de agua de las estaciones 1 y 2 con respecto a la estación 3. Los resultados de este estudio indican que la vegetación ribereña es un factor determinante para el establecimiento de la comunidad de macroinvertebrados.
Palabras clave. Bioindicadores, Calidad de agua, Composición, Macroinvertebrados acuáticos, Vegetación ribereña.
ABSTRACT
With the goal of evaluate the composition of macroinvertebrates and water quality in streams with and without riparian vegetation, the following streams were sampled: El Diamante, La Oliva and Río Chinchiná, all located in the upper basin of Chinchiná river. The first station, El Diamante, has a forest with native riparian vegetation, the second, La Olivia, is influenced by Eucalyptus sp. plantations and the third, Río Chinchiná, lack riparian vegetation. Between February and May of 2010, three samples of macroinvertebrates were evaluated during the dry, intermediate and rainy seasons. For the collection of macroinvertebrates, the Surber Net was used and 3 substrate replicates (leaf litter, rock and fine sediment) were done. Physical and chemical variables were recorded for each station. A total of 7486 macroinvertebrates belonging to 13 orders, 37 families and 74 genera were collected. The results indicate significant differences in macroinvertebrate richness between stations with and without riparian vegetation. Regarding the composition, 26 genera of macroinvertebrates are shared by the three stations, 18 genera are unique for station 1, 8 genera are exclusive for the second and 4 genera for the third. Physicochemical variables and BMWP and EPT results indicate there are differences between the water quality in stations 1 and 2 in comparison to station 3. The results of this study indicate that the riparian vegetation is a factor that determine the establishment of the macroinvertebrate community.
Key words. Bioindicators, water quality, composition, aquatic macroinvertebrates, riparian vegetation.
Recibido: 21/07/2011
Aceptado: 13/09/2012
INTRODUCCIÓN
Los ecosistemas dulceacuícolas son considerados uno de los recursos naturales renovables más importantes para la vida. En términos de su valor biológico, estos ecosistemas también se destacan por contener una biota rica y variada, incluyendo una alta diversidad de peces y otros vertebrados, y una mayor diversidad de invertebrados, plantas y algas (Jonsson et al. 2001). El transporte de partículas disueltas y materia orgánica producida desde la cabecera hasta la desembocadura de los ecosistemas hídricos, genera una estrecha relación entre el río y el ecosistema terrestre (Giller & Malmqvist 1998). De hecho la vegetación ribereña se encuentra más conectada a la vida que sucede dentro del río que a la que sucede fuera de él, ejerciendo un papel fundamental en la cadena trófica de estos ambientes (Corbacho et al. 2003).
A pesar de su destacada importancia, los ecosistemas dulceacuícolas vienen sufriendo grandes impactos por factores antropogénicos, como el represamiento y remoción de la vegetación ribereña, que ocasionan cambios drásticos en el flujo natural de la materia y la energía y modificaciones en el ciclo de nutrientes, especialmente del nitrógeno y fósforo, y en la disponibilidad de sustratos orgánicos (Jorcin & Nogueira 2008). Asimismo, los cambios en el uso del suelo hacen que los recursos hídricos sufran degradación de la calidad a través de la contaminación agroquímica, incremento de la carga orgánica y aumento de la sedimentación (Hayward 2005, Coutinho et al. 2009).
En la actualidad, se han implementado planes para mitigar los efectos degradantes sobre los ecosistemas dulceacuícolas, siendo un ejemplo de estas medidas los modelos de reforestación para la protección del suelo y de estos sistemas. Sin embargo, la reforestación tiene diferentes efectos sobre el balance hídrico, pues se han demostrado pérdidas graduales en la calidad de los suelos y en los caudales de las quebradas (ASB-ICRAF 2008). Además hay poca evidencia de que estos planes logren realmente sus objetivos, principalmente el de restablecer las funciones de las cuencas atribuidas a la cubierta forestal natural, por lo menos no en un plazo de una o dos décadas (Farley et al. 2005, Jackson et al. 2007).
Como alternativa para contrarrestar los impactos de la reforestación, Molinero & Pozo (2003) proponen la regeneración de la vegetación natural, asociada complementariamente a plantaciones de especies exóticas, de forma que los aportes de origen terrestre al ecosistema lótico no sean limitados, y así puedan contribuir a la dinámica, estructura y estado de las comunidades bióticas que estos soportan. Entretanto, es importante resaltar que la reducción de la cobertura vegetal y la introducción de especies exóticas generan cambios sobre los cauces, lo que aumenta la vulnerabilidad de los recursos hídricos y los deja expuestos a potenciales disturbios, que se reflejan directamente sobre la calidad del agua (Gordon et al. 2004).
Para evaluar la calidad de los ecosistemas acuáticos, han sido utilizadas las comunidades biológicas como indicadoras de las condiciones ambientales, esto porque reflejan las condiciones físicas, químicas y bióticas e integran y acumulan los efectos de diferentes presiones sobre los ecosistemas naturales (Barbour et al. 1999). Estas valoraciones presentan ventajas en relación a otros tipos de medidas de calidad de agua, porque se realizan con organismos indicadores del medio en que habitan, los cuales están integrados al recurso durante toda su vida, y de esta forma pueden reflejar las fluctuaciones de contaminación (Alba-Tercedor 1996, Roldán 2003).
Uno de los grupos que cada vez es más usado y aceptado como herramienta importante en la evaluación de la calidad del agua es el de los macroinvertebrados, ya que responde a las alteraciones ocasionadas por actividades humanas en ecosistemas fluviales (Añón 1991 en Muñoz et al. 2001, Silveira et al. 2004), los integrantes de esta comunidad son sensibles a la contaminación orgánica y la degradación del hábitat, por tal razón, en la evaluación ambiental del recurso hídrico es valioso su potencial como biondicadores de calidad de agua (Merritt & Cummins 1996).
Dado el papel fundamental que desempeñan los macroinvertebrados en los sistemas dulceacuícolas, este estudio tiene como objetivo comparar la composición y la estructura trófica de estos en zonas de río provistas de vegetación nativa, reforestada y sin vegetación y utilizar los macroinvertebrados acuáticos como bioindicadores para evaluar la calidad del agua.
MATERIALES Y MÉTODOS
Área de estudio. Se encuentra localizada en los municipios de Villamaría y Manizales, Caldas; en la subcuenca alta del río Chinchiná, en la quebrada El Diamante, La Oliva y el río Chinchiná.
Quebrada El Diamante. Corresponde a la estación uno, con coordenadas 05°06´668" Norte, 75°23´501" Oeste, pertenece a la Reserva Forestal Torre Cuatro y se encuentra a 2810 metros sobre el nivel del mar (msnm). En el periodo seco, esta estación presenta un ancho promedio de 2.9 m, una profundidad promedio de 0.24 m y un área transversal de 0.48 m2. Durante el muestreo la temperatura del agua fue de 10.1°C, la velocidad fue de 0.77 m/s y el caudal de 0.307 m3/s. Para el periodo intermedio, la estación presenta un ancho promedio de 2.4 m, una profundidad de 0.22 m y un área transversal de 0.48 m2. La temperatura del agua registrada durante del muestreo fue de 10.1°C, la velocidad de corriente de 0.68 m/s y el caudal de 0.25 m3/s. En el periodo lluvioso la quebrada presenta un ancho promedio de 2.29 m, una profundidad promedio de 0.21 m y un área transversal de 0.48 m2. La temperatura del agua durante el muestreo fue de 10.2 °C, una velocidad de 0.65 m/s y caudal de 0.23 m3/s. La vegetación ribereña para la estación uno está compuesta por un bosque nativo cuyas especies predominantes son: Erato vulcanica (Asteraceae), Miconia sp. (Melastomataceae), y Sauraruia brachybotrys (Actinidiaceae) principalmente.
Quebrada La Oliva. Corresponde a la estación dos, es reconocida localmente como el río Chinchiná pero adquiere este nombre al unirse con la quebrada Cajones. Está dentro de la Reserva Forestal Bosques de la CHEC (Central Hidroeléctrica de Caldas S.A. E.S.P.), con coordenadas 05°01´286" Norte, 75°25´293" Oeste, ubicada a 2314 msnm. Para el periodo seco el cauce de la estación dos presenta un ancho promedio de 3.37 m, una profundidad promedio de 0.28 m y un área transversal de 0.89 m2. La temperatura del agua durante el muestreo fue de 12.1°C, la velocidad de 0.21 m/s y el caudal de 0.156 m3/s. En el periodo intermedio la quebrada Oliva presenta un ancho promedio de 3.75 m, una profundidad promedio de 0.19 m y un área transversal de 0.83 m2. Durante el muestreo la temperatura fue de 12.2°C, la velocidad de 0.31 m/s y el caudal 0.173 de m3/s. El cauce en el periodo lluvioso tiene un ancho promedio de 4.35 m, una profundidad promedio de 0.15 m y un área transversal de 0.66 m2. La temperatura registrada en el muestreo fue de 12.4°C, la velocidad de 0.39 m/s y el caudal 0.21 de m3/s. La estación está influenciada por una plantación de Eucalyptus sp. y su vegetación ribereña está compuesta predominantemente por la especie Chusquea scandens.
Río Chinchiná. En este, está ubicada la estación tres a 2206 msnm, con coordenadas 05°01´301" Norte y 75°26´185" Oeste. En esta estación no hay presencia de un bosque ribereño, su ribera está compuesta por pastizales y potrero. En el periodo seco este cauce presentó un ancho promedio de 5.58 m, una profundidad promedio de 0.29 m y un área transversal de 1.59 m2. La temperatura del agua durante el muestreo fue de 13.4°C, la velocidad de 0.23 m/s y el caudal de 0.303 m3/s. En el periodo intermedio el ancho promedio del cauce fue de 6.03 m, la profundidad promedio fue de 0.27 m y el área transversal de 1.75 m2. Durante el muestreo la temperatura del agua fue de 14.3°C, la velocidad de 0.48 m/s y el caudal de 0.72 m3/s. Para el periodo lluvioso el ancho promedio del cauce fue de 6.58 m, la profundidad promedio fue de 0.26 m y el área transversal de 1.68 m2.En el muestreo la temperatura del agua fue de 14.8°C, la velocidad de 0.78 m/s y el caudal de 1.09 m3/s.
Composición de macroinvertebrados
Se realizaron tres muestreos utilizando Red Surber con área de 930.25 cm2, con ojo de malla de 560 μm, en cada una de las estaciones en tres períodos (seco, intermedio y lluvioso). Para cada estación se hicieron tres repeticiones por sustrato (Hojarasca, Roca y Sedimento Fino).
Las muestras se fijaron en alcohol al 96% y se llevaron al laboratorio de Zoología de la Universidad de Caldas, donde se separaron todos los macroinvertebrados acuáticos presentes, para su posterior identificación. Para la determinación taxonómica de los especímenes hasta género y/o morfotipo se emplearon las claves de Domínguez & Fernández (2009), Machado & Rincón (1989), Merritt & Cummins (1996), Prat et al. (2009), Roldán (1996), Spangler & Fragoso (1992).
Para la determinación de las categorías funcionales de alimentación de los macroinvertebrados colectados se utilizó la clasificación propuesta por Chará-Serna et al. (2010) y Cummins et al. (2005).
Evaluación de calidad de agua
Para la evaluación de calidad del agua en cada una de las tres estaciones de muestreo, se utilizó la metodología de muestreo de macroinvertebrados mencionada anteriormente (Red Surber).
En cada punto de muestreo se registraron variables físico-químicas in situ como temperatura, pH, conductividad y oxígeno disuelto; además se tomaron muestras de agua en cada estación para ser analizadas en el laboratorio y determinar sólidos totales, demanda biológica de oxígeno y demanda química de oxígeno.
Análisis de datos
Para estimar la diversidad de los macroinvertebrados asociados a todos los sustratos, se calcularon índices de dominancia de Simpson, de diversidad de Margalef y de equidad de Shannon – Wienner según Moreno (2001).
Para comparar la composición de macroinvertebrados en las tres estaciones de muestreo se realizó un análisis de Cluster, para el que se utilizó el índice de similitud de Jaccard. Las diferencias de la riqueza taxonómica en los tres cuerpos de agua fueron comparadas por medio de un análisis de varianza (ANOVA una vía) en el que se usó como factor las estaciones muestreadas seguida por una prueba de Tukey con probabilidad de p= 0.05.
El análisis de los grupos tróficos se hizo mediante una prueba de Chi-cuadrado para muestras independientes y por medio de tablas de frecuencia, los contrastes se realizaron con un umbral de significación Alpha de 0.05. Todos los análisis estadísticos mencionados fueron realizados mediante el programa StatGraphics versión 5.1
Se calculó el índice biótico BMWP "Biological Monitoring Working Party" modificado por Zúñiga (2009) para evaluar la calidad del agua, además se calculó un índice de riqueza total de EPT (Ephemeroptera, Plecoptera y Trichoptera), según lo propuesto por Chará (2003).
RESULTADOS
Composición de macroinvertebrados
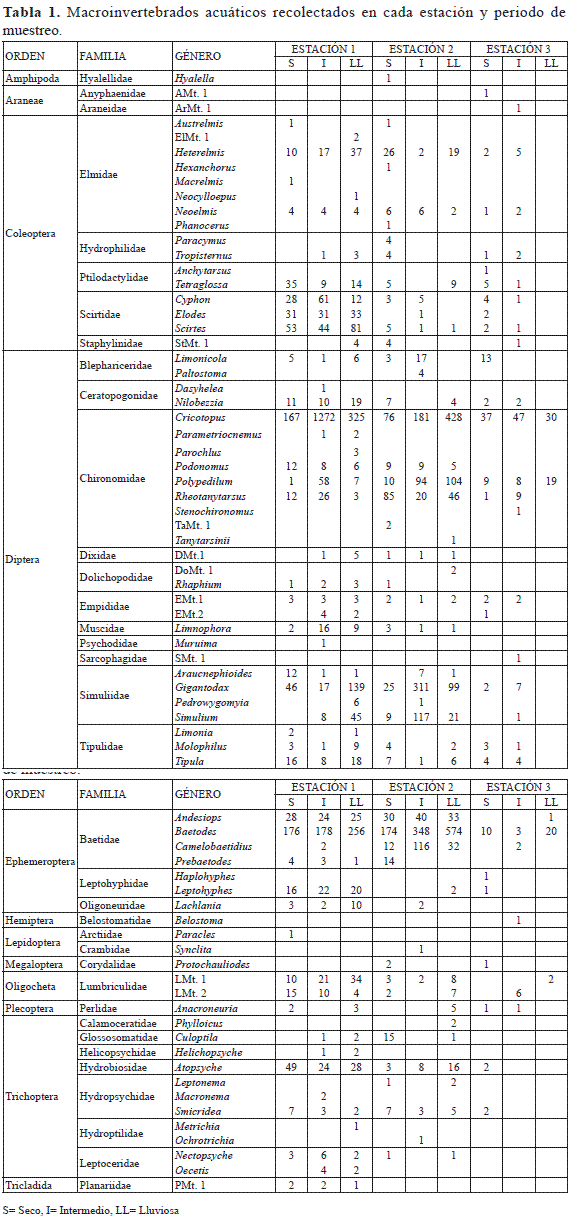
Se encontraron 7486 macroinvertebrados distribuidos en trece órdenes, 37 familias y 74 géneros (Tabla 1). En la estación uno se colectaron 3879 individuos en 53 géneros y/o morfotipos, de los cuáles 47 se encontraron en hojarasca, 36 en roca y 23 en sedimento fino. En la estación dos se colectaron 3313 individuos en 51 géneros y/o morfotipos, 46 en hojarasca, 34 en roca y 20 en sedimento fino. En la estación tres se registraron 294 macroinvertebrados en 36 géneros y/o morfotipos 25 en hojarasca, 19 en roca, 14 en sedimento fino. En total, se capturaron en hojarasca 61 géneros y/o morfotipos (43%), en roca 48 géneros y/o morfotipos (34%) y en sedimento fino 33 géneros y/o morfotipos (23%).
En cuanto a composición, se obtuvo que 26 géneros de macroinvertebrados son compartidos por las tres estaciones, entre ellos Cricotopus, Andesiops, Baetodes, Heterelmis y Anacroneuria. Se presentaron 18 géneros exclusivos para la estación uno, incluyendo a Oecetis, Protochauliodes, y Macrelmis. La estación dos presenta ocho géneros exclusivos, como Haplohyphes, Leptonema y Ochrotrichia. En la tercera estación, cuatro géneros son propios, entre ellos Metrichia y Belostoma. Las estaciones uno y dos comparten la presencia de catorce géneros como lo son Macronema, Phylloicus y Leptohyphes entre otros. Las estaciones uno y tres comparten tres géneros Parochlus, Rhaphiumy Pedrowygomyia. Las estaciones dos y tres no comparten ningún género.
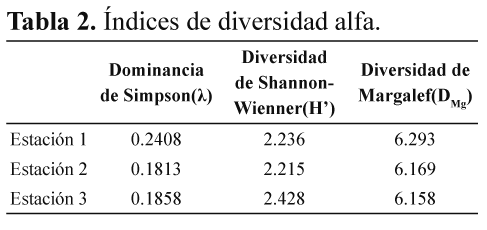
Los resultados de los índices ecológicos fueron muy similares en todas las estaciones (Tabla 2). El índice de riqueza de Margalef se encontró entre las unidades 6.15 y 6.29, la dominancia de Simpson estuvo en los rangos de 0.18 y 0.24, encontrando un valor mayor para la estación uno. Entre tanto el índice de diversidad de Shannon-Weaver se mantuvo entre 2.21 y 2.42 siendo mayor en la estación tres.
Para los valores de riqueza, la estación uno y dos no presentan diferencias significativas entre sí (p= 0.1798), sin embargo existen diferencias entre las estaciones uno y tres (p= 0.0027) y las estaciones dos y tres (p= 0.015).
De los macroinvertebrados colectados 1454 individuos se capturaron en el periodo seco, 3322 en un periodo intermedio y 2710 en periodo de lluvias. En cuanto a riqueza, del total de géneros encontrados, se colectaron 52 géneros de macroinvertebrados para el periodo seco, 52 en el periodo intermedio y para el periodo de lluvias se capturaron 51 géneros.
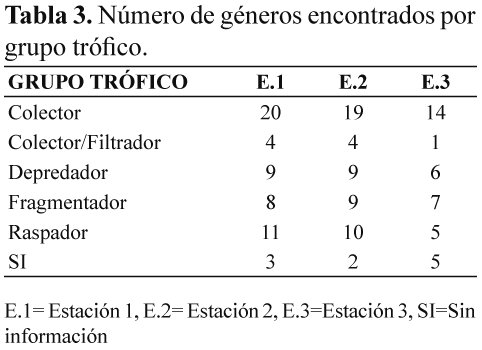
Al realizar el análisis de los grupos tróficos por medio de la tabla de contingencia y chi2 se observó que con un alpha de 0.05 y 896 GDL la dependencia entre los grupos tróficos y las estaciones no es significativa (Tabla 3).
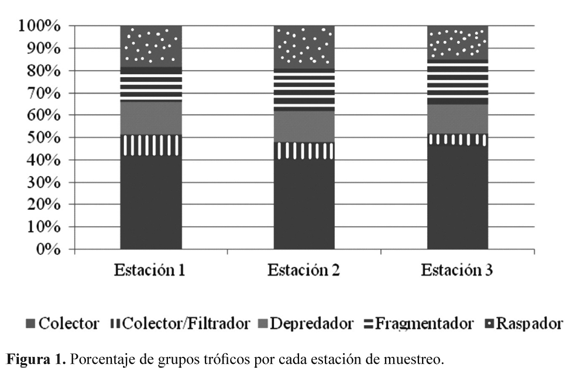
Se observó que el grupo trófico de los colectores generalistas dominó en las tres estaciones (42.02%), seguido por los fragmentadores (17.90%), raspadores (17.90%), depredadores (14.01%) y colectores/filtradores (8.17%). Así mismo, al evaluar cada estación el grupo de los colectores generalistas obtuvo mayor porcentaje de riqueza y por último el grupo de los colectores/filtradores (Figura 1).
Calidad de Agua
Para evaluar la calidad del agua de las tres estaciones, se calculó el índice biótico BMWP (Biological Monitoring Working Party), donde se encontró que la estación uno y dos presentan aguas muy limpias con puntajes de 155 y 157 respectivamente y la estación tres aguas no contaminadas o no alteradas de modo sensible, con un valor de 109.
Al calcular el índice biótico EPT para cada una de las estaciones se encontró que en las estaciones uno y dos la calidad del agua es regular con puntajes de 28.30 y 26.92 respectivamente, para la tercera estación la calidad de agua es mala con un puntaje de 21.62.
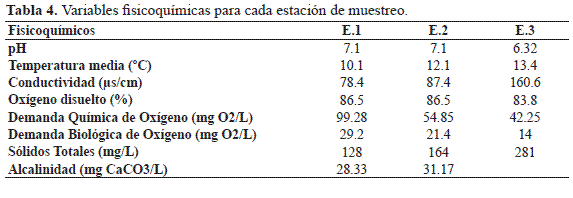
En cuanto a las variables físico-químicas del agua para las tres estaciones, se encontró que la demanda biológica de oxígeno en la estación uno presenta valores más altos (29.5 mg O2), en comparación con las estaciones dos (21.1mg O2) y tres (14 mg O2). Igualmente, se presentaron valores decrecientes para la demanda química de oxígeno donde la estación uno presentó una demanda de 99.28 mg O2 seguida por la estación dos con 54.85 mg O2 y por último la estación tres con 42.25 mg O2. Las estaciones uno y dos registraron valores iguales para las variables pH (7.1) y oxígeno disuelto (86.5%), mientras que la estación tres tuvo valores de 6.32 para pH y 83.8 para oxígeno disuelto. En cuanto a las variables conductividad y sólidos totales, la tercera estación presentó los valores más altos con 160.6 µs/cm y 281 mg/L, respectivamente (Tabla 4).
DISCUSIÓN
Composición de macroinvertebrados
Según Rivera (2004) los fondos arenosos albergan pocas especies, con pocos individuos por especie. Los fondos pedregosos suelen ser más ricos, en especial cuando las rocas son grandes y finalmente cuando hay vegetación la fauna es aún más diversa y difiere considerablemente de la fauna de otros sustratos. Además, Burdet & Watts (2009) argumentan que los sustratos dominados por hojarasca brindan una mayor disponibilidad de recursos, por lo que además de presentar una alta riqueza de especies permiten sostener una mayor densidad de organismos. Estos resultados son apoyados por lo encontrado en este estudio, donde los macroinvertebrados acuáticos presentan mayor riqueza y abundancia en hojarasca, seguido por el sustrato roca y por último, sedimento fino.
La estación uno presentó la mayor cantidad de géneros exclusivos, posiblemente porque la vegetación ribereña en esta zona es bosque nativo, se encuentra dentro de una reserva y su acceso es restringido, lo que hace que esté más conservada con respecto a las otras dos estaciones. Adicionalmente se encontró que en zonas provistas por vegetación ribereña, la riqueza y abundancia de macroinvertebrados fue mayor en comparación a sitios donde esta se encuentra ausente. Estos resultados son apoyados por autores como Arcos (2005), quien propuso en su trabajo, que entre las principales consecuencias provocadas por la deforestación de los bosques riparios tropicales, se encuentra la pérdida de biodiversidad. Alonso (2006) también explica que la ausencia de la vegetación ribereña empobrece la composición de macroinvertebrados bentónicos.
La exclusividad de algunos géneros como Oecetis y Macrelmis en la estación uno se debe a que esta zona es altamente conservada y estos organismos son poco tolerantes a la contaminación (Domínguez & Fernández, 2009). Algunos organismos como Cricotopus, Andesiops, Baetodes y Heterelimis se encontraron en las tres estaciones. Esto posiblemente se deba a que estos organismos son euritópicos, es decir que ocupan un amplio espectro de condiciones ambientales (Domínguez & Fernández 2009).
Con respecto al comportamiento de los índices ecológicos, la dominancia de Simpson mostró un mayor valor para la estación uno en comparación a las estaciones restantes. Esto posiblemente se deba a la abundancia de la familia Chironomidae particularmente del género Cricotopus, considerada una taxa muy frecuente y de amplia distribución en los Andes (Acosta 2009).
Al contrario, la diversidad de Shannon fue superior en la estación tres (2.42), autores como Vannote et al. (1980) explican que un alto grado de variación ambiental lleva a un aumento de la diversidad de taxones o la complejidad funcional. Además, argumentan que como consecuencia de las variaciones en los patrones espaciales y longitudinales, la composición de macroinvertebrados puede ser diferente en las cabeceras en comparación a la corriente media. Esto es apoyado por los resultados de este estudio, donde la diversidad fue diferente en las estaciones uno y dos ubicadas en la cabecera comparadas con la estación tres, localizada en la corriente media. Adicionalmente, esta alta diversidad en la estación tres puede deberse a la presencia de especies raras como son los morfotipos de las familias Anyphaenidae y Araneidae, las cuales pueden contribuir en el valor de la diversidad beta (Clarke et al. 2008)
La composición de macroinvertebrados en los diferentes períodos (seco, intermedio y lluvioso) no presentó diferencias significativas, esto puede estar relacionado al hecho de que en la región tropical las estaciones climáticas no son muy marcadas. Sin embargo, en estudios realizados en Ecuador por Giacometti & Bersosa (2006), el número de individuos y especies fue significativamente más alto en la estación seca que en la estación lluviosa. Posiblemente estos resultados difieren con los de este estudio debido a la falta de réplicas que permitan hacer comparaciones entre periodos climáticos.
Asimismo, no existieron diferencias significativas entre los grupos tróficos encontrados en las tres estaciones muestreadas. Esto refleja que a pesar de las diferencias en la integridad ecológica de las estaciones, estas posiblemente presentan una disponibilidad de mesohábitats suficiente para la permanencia de los diferentes grupos tróficos. Esto también puede explicarse porque los macroinvertebrados presentan flexibilidad en su modo de alimentación tal como lo enfatizan Henriques-Oliveira et al. (2003) para la familia Chironomidae y Merritt & Cummins (1996) para todos los insectos acuáticos.
El grupo de los colectores generalistas fue el de mayor representación en las tres estaciones de muestreo, esto es apoyado por autores como Rivera et al. (2009) y Moretti et al. (2005), quienes argumentan que el gremio de los colectores es dominante en los sistemas tropicales. Adicionalmente, Rivera (2004) explica que la alta representatividad de este grupo se debe a que el aporte de materia orgánica aloctona que reciben estos tipos de ríos, se convierte en la fuente de alimento de mayor disponibilidad, lo que afecta positivamente a los organismos de este grupo funcional.
Calidad de Agua
Según los resultados de los índices BMWP y EPT la calidad del agua de las tres estaciones, las estaciones uno y dos presentan similar calidad de agua, diferentemente de la tres. Posiblemente, esto se deba a que esta última estación es la única donde la vegetación ribereña está compuesta por potrero. Diversos autores, mencionan en sus trabajos la importancia del bosque ribereño como área de amortiguamiento, tras los impactos que pueden tener la agricultura y la ganadería sobre la calidad de agua en la cuenca y en la estabilización del suelo de las quebradas (Robins & Cain 2002). Además, juega un papel importante al retardar y reducir la escorrentía superficial, utilizar el exceso de nutrientes, atrapar los sedimentos y otros contaminantes que se desprenden de los suelos descubiertos o suelos de cultivos y proteger los cuerpos de agua (Blinn & Kilgore 2001).
Según este estudio los índices BMWP y EPT se pueden utilizar simultáneamente para evaluar la calidad de agua, ya que el EPT mide la riqueza de Ephemeroptera, Plecóptera y Trichoptera, y el BMWP se basa en la presencia y ausencia de familias. Estos resultados son apoyados por autores como Fernández et al. (2000), Fernández et al. (2002), Álvarez & Pérez (2007), Barrionuevo et al. (2007). Adicionalmente Alba-Tercedor (1996) sugiere que aunque con el índice BMWP es posible obtener puntuaciones para comparar situaciones entre estaciones, este índice no permite emitir juicios sobre la situación de la calidad del agua.
Algunos investigadores como Quinn & Hickey (1990), Roldán (1996), Domínguez & Fernández (2009), se refieren a la influencia de los factores fisicoquímicos sobre la comunidad de macroinvertebrados acuáticos. Enfatizan que la velocidad de la corriente, la temperatura del agua y la disponibilidad de oxígeno son factores determinantes en la distribución de estos organismos. En este trabajo se encontró que los valores más altos en cuanto a velocidad y más bajos en temperatura se presentaron en la estación uno. Esta a su vez fue la que obtuvo mayor riqueza y abundancia de macroinvertebrados.
Según Rivera (2004), la concentración de oxígeno generalmente es alta y constante en ríos andinos, por lo que éste no suele ser un factor limitante para las comunidades acuáticas. Los resultados del presente estudio coinciden con lo anterior ya que los valores para las tres estaciones fueron similares. Los valores más altos de demanda de oxígeno y la baja conductividad en la estación uno con relación a la estación tres, pueden estar relacionados a la falta de cobertura vegetal en esta última estación.
Según este estudio, las zonas de la subcuenca alta del río Chinchiná en áreas protegidas y provistas de vegetación ribereña presentan mejor estado de calidad del agua que las zonas sin vegetación. Sin embargo, es necesario avanzar en investigaciones que busquen analizar la influencia del bosque ribereño como amortiguador de impactos de la ganadería y agricultura en la región.
AGRADECIMIENTOS
Agradecemos a Héctor Chica y Bedir Martínez por el apoyo en los análisis estadísticos. A Luis Eduardo Robledo, José Luis Benavides, Camilo Andrés Llano, Patricia Jiménez, Ximena Villada, Mauricio Escobar, Juan Pablo Jaramillo, Dr. Tito Bacca, Mario López y Don Jairo por su colaboración en el trabajo de campo. A la Universidad de Caldas por facilitar la infraestructura de laboratorios.
LITERATURA CITADA
1. Acosta, C.R. 2009. Estudio de la Cuenca Altoandina del río Cañete (Perú): Distribución altitudinal de la comunidad de Macroinvertebrados Bentónicos y caracterización hidroquímica de sus cabeceras cársticas. Tesis de Doctorado, Universidad de Barcelona, Facultad de Biología, Barcelona. 153 p. [ Links ]
2. Alba-Tercedor, J. 1996. Macroinvertebrados acuáticos y calidad de las aguas de los ríos. Memorias del IV Simposio el agua en Andalucía. Siaga, Almeria, 2: 202-213. [ Links ]
3. Alonso, A. 2006. Valoración del efecto de la degradación ambiental sobre los macroinvertebrados bentónicos en la cabecera del río Henares. Ecosistemas, Asociación española de ecología terrestre, 15(2): 1-5. [ Links ]
4. Álvarez, S.M. & L. Pérez. 2007. Evaluación de la calidad de agua mediante la utilización de macroinvertebrados acuáticos en la subcuenca del Yeguare, Honduras: Tesis, Escuela Agrícola Panamericana, Zamorano. 69 p. [ Links ]
5. Arcos, I. 2005. Efecto del ancho los ecosistemas riparios en la conservación de la calidad del agua y la biodiversidad en la microcuenca del río Sesesmiles, Copán, Honduras: Tesis de Maestría, Programa de Educación para el Desarrollo y la Conservación del Centro Agronómico Tropical de Investigación y Enseñanza, Turrialba. 104 p. [ Links ]
6. Anónimo. 2008. La deforestación y las múltiples funciones de las cuencas Hidrográficas tropicales. Serie especial sobre bosques tropicales y el agua 8: 4 p. [ Links ]
7. Barbour, M.T., J. Gerritsen, B.D. Snyder & J.B. Stribling. 1999. Rapid Bioassessment Protocols for Use in streams and wadeable rivers: periphyton, Benthic Macroinvertebrates and Fish. Second Edition. EPA 841-B-99-002.US Environmental Protection Agency. Washington D.C. [ Links ]
8. Barrionuevo, M.A., F. Romero, M.G. Navarro, G.S. Meoni & H.R. Fernandez. 2007. Monitoreo de la calidad del agua en un río subtropical de montaña: el río Lules (Tucumán, Argentina). Conagua. Consultado el 20 de julio, 2010. En: http://hydriaweb.com.ar/kb/entry/12/ [ Links ]
9. Blinn, R. & A. Kilgore. 2001. Riparian Management Practices. Journal of Forestry (University of Minnesota) 8: 11-17. [ Links ]
10. Burdet, A. & R.J. Watts. 2009. Modifying living space: an experimental study of the influences of vegetation on aquatic invertebrate community structure. Hydrobiologia 618: 161–173. [ Links ]
11. Chará, J. 2003. Manual para la evaluación biológica de ambientes acuáticos en microcuencas ganaderas. Fundación Centro para la Investigación en Sistemas Sostenibles de Producción Agropecuaria. CIPAV. Colombia, Bogotá D.C. 52 p. [ Links ]
12. Chará-Serna, A.M., J.D. Chará, M.C. Zúñiga, G.X. Pedraza & L.P. Giraldo. 2010. Clasificación trófica de insectos acuáticos en ocho quebradas protegidas de la ecorregión cafetera colombiana. Universitas Scientiarum 15(1): 27-36. [ Links ]
13. Clarke, A., R. Macnally, N. Bond & P.S. Lake. 2008. Macroinvertebrate diversity in headwater streams: a review. Freshwater Biology. Australia 53: 1707–1721. [ Links ]
14. Corbacho, C., J.M. Sánchez & E. Costillo. 2003. Patterns of structural complexity and human disturbance of riparian vegetation in agriculture landscapes of a Mediterranean area. Agriculture, Ecosystems and Environment. Universidad de Extremadura. Extremadura, 13: 495-507. [ Links ]
15. Coutinho, H., E. Noellemeyer, E. Jobbagy, M. Jonathan & J. Paruelo. 2009. Impacts of land use change on ecosystems and society in the Rio de la Plata basin. En: H. Tiessen & J.W.B. Stewart. (eds.) Applying Ecological Knowledge to Landuse Decisions 56 – 65. InterAmerican Agency for Global Change Research. [ Links ]
16. Cummins, K.W., R.W. Merrit & P. Andrade. 2005. The use of invertebrate functional groups to characterize ecosystem attributes in selected streams and rivers in southeast Brazil. Studies on Neotropical Fauna and Environment 40(1): 71-90. [ Links ]
17. Domínguez, E. & H.R. Fernández. 2009. Macroinvertebrados bentónicos sudamericanos: Sistemática y biología. Fundación Miguel Lillo, Tucumán, 656 p. [ Links ]
18. Farley, K., E. Jobbágy & R. Jackson. 2005. Effects of a forestation on water yield: a global synthesis with implications for policy. Global Change Biology 11: 1565-1576. [ Links ]
19. Fernández, H., E. Domínguez & M.B. Vece. 2000. Estudio de base en un río subtropical: El tramo medio del río Lules, provincia de Tucumán, Argentina. Fundación Miguel Lillo. Consultado el 20 de julio, 2010. En: http://libnet.unse.edu.ar/5Con/Rhid/T/01042.PDF [ Links ]
20. Fernández, H.R., F. Romero, M.B. Vece, V. Manzo, C. Nieto & M. Orce. 2002. Evaluación de tres índices bióticos en un río subtropical de montaña (Tucumán- Argentina). Limnética 21(1-2): 1-13. [ Links ]
21. Giacometti, J.C. & F. Bersosa. 2006. Macroinvertebrados acuáticos y su importancia como bioindicadores de calidad del agua en el río Alambi. Boletín Técnico 6, Serie Zoológica 2: 17-32. [ Links ]
22. Giller, P.S. & B. Malmqvist. 1998. The Biology of Streams and Rivers. Oxford University Press (eds). Oxford, 308 p. [ Links ]
23. Gordon, N., T. McMahon, B. Finlayson, C. Gippel & R. Nathan. 2004. Stream hydrology: an introduction for ecologists. Second edition. Editorial Willey. 423 p. [ Links ]
24. Hayward, B. 2005.-From the Mountain to the Tap: How Land-Use and Management Can Work for the Rural Poor. Natural Resources International Ltd, East Malling, 64 p. [ Links ]
25. Henriques-Oliveira, A.L., J.L. Nessimian & L.F.M. Dorvillé. 2003. Feeding habits of Chironomid larvae (Insecta: Diptera) from a stream in the Floresta da Tijuca, Rio de Janeiro, Brazil. Brazilian Journal of Biology 63(2): 269-281. [ Links ]
26. Jackson, R., K. Farley, W. Hoffman, E. Jobbágy & R. McCulley, R. 2007. Carbon and water tradeoffs in conversions to forests and shrublands. En: J.G. Canadell, D.E. Pataki & L.F. Pitelka. (eds.) Terrestrial Ecosystems in a Changing World 237-246. Springer, Berlín. [ Links ]
27. Jonsson, M., B. Malmqvist & P.E. Hoffsten 2001. ¿Leaf litter breakdown rates in boreal streams: does shredder species richness matter? Freshwater Biology 46: 161-171. [ Links ] [ Links ]
29. Machado, T.A. & J. Rincón. 1989. Distribución ecológica e identificación de los coleópteros acuáticos en diferentes pisos altitudinales del departamento de Antioquia. Universidad de Antioquia, Facultad de Ciencias Exactas y Naturales, Departamento de Biología, Medellín, 228 p. [ Links ]
30. Merritt, R.W. & K.W. Cummins. 1996. An Introduction to the Aquatic Insects of North America. 3 ed. Kendall /Hunt Publishing, Iowa, 862 p. [ Links ]
31. Molinero, J. & J. Pozo. 2003. Balances de hojarasca en dos arroyos forestados: impacto de las plantaciones de eucalipto en el funcionamiento ecológico de un sistema lótico. Limnetica 22(3-4): 63-70. [ Links ]
32. Moreno, C.E. 2001.-Métodos para medir la biodiversidad. M&T–Manuales y Tesis SEA, (1), Zaragoza, 84 p. [ Links ]
33. Moretti, M.S. 2005. Decomposição de detritos foliares e sua colonização por invertebrados aquáticos em dois córregos na Cadeia do Espinhaço (MG). Dissertação de Mestrado. Universidade Federal de Minas Gerais, Belo Horizonte, 71 p. [ Links ]
34. Muñoz, E., G. Mendoza & C. Valdovinos. 2001. Evaluación rápida de la biodiversidad en cinco sistemas lénticos de Chile central: macroinvertebrados bentónicos. Gayana 65(2): 173-180. [ Links ]
35. Prat, N., R. Acosta, C. Villamarín & M. Rieradevall. 2009. Guía para el reconocimiento de las larvas de Chironomidae (Diptera) de los ríos altoandinos de Ecuador y Perú. Clave para la determinación de los géneros. Grupo de Investigación F.E.M. Departamento de Ecología, Universidad de Barcelona, Barcelona, 75 p. [ Links ]
36. Quinn, J.M. & C. Hickey. 1990. Characterization and classification of benthic invertebrate communities in 88 New Zealand rivers in relation to environmental factors. New Zealand Journal of Marine and Freshwater Research 24(3): 387-409. [ Links ]
37. Rivera, R. 2004. Estructura y composición de la comunidad de macroinvertebrados bentónicos en ríos de páramo y zonas boscosas, en los andes venezolanos: Tesis, Universidad de los Andes, Mérida. [ Links ]
38. Rivera, C.A., A.M. Zapata, D. Pérez, Y. Morales, H. Ovalle & J.P. Alvarez. 2009. Caracterización limnológica de humedales de la planicie de inundación del río Orinoco (Orinoquía, Colombia). Acta Biológica Colombiana, 15 (1). Consultado el 01 de agosto, 2010. En: http://www.revistas.unal.edu.co/index.php/actabiol/article/view/9575/14645. [ Links ]
39. Robins, J.D. & J.R. Cain. 2002. The past and present condition of the Marsh Creek watershed. Natural Heritage Institute, Berkeley, 71 p. [ Links ]
40. Roldán, G.A. 1996.-Guía para el Estudio de los macroinvertebrados acuáticos del departamento de Antioquia. Fondo FEN Colombia. Colciencias. Universidad de Antioquia, Medellín, 217 p. [ Links ]
41. Roldán, G.A., 2003.-Bioindicación de la calidad del agua en Colombia. Primera edición. Editorial Universidad de Antioquia, Medellín, 170 p. [ Links ]
42. Silveira, M.P, J.F. Queiroz & R.C. Boeira. 2004. Protocolo de Coleta e Preparação de Amostras de Macroinvertebrados Bentônicos em Riachos. Comunicado Técnico 19 da Embrapa SP 7 p. [ Links ]
43. Spangler, P.J. & S.S. Fragoso. 1992. The aquatic beetle subfamily Laraine (Coleoptera: Elmidae) in México, Central America and the West Indies. Smithsonian Contributions to Zoology 528:1-72. [ Links ]
44. Vannote, R.L, G.W. Minshall, K.W. Cummins, J.R. Senadell & C.E. Cushing. 1980. The River Continuum Concept. Canadian Journal of Fisheries and Aquatic Sciences 37: 130-137. [ Links ]
45. Zuñiga, M.C. 2009. Bioindicadores de calidad de agua y caudal ambiental. En: J.R.K. Cantera, Y.E. Carvajal & L.M.H. Castro. (eds). El caudal ambiental: conceptos, experiencias y desafíos. 167-197. Programa Editorial Universidad del Valle, Cali. [ Links ]