Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232
Caldasia vol.34 no.2 Bogotá July/Dec. 2012
MANUEL GILBERTO GUAYARA-BARRAGÁN
MANUEL HERNANDO BERNAL
Grupo de Herpetología, Eco-fisiología & Etología. Departamento de Biología. Universidad del Tolima. Ibagué, Colombia. jaimar74@gmail.com; mhbernal@ut.edu.co.
RESUMEN
Los anuros son uno de los grupos de vertebrados más destacados por la diversidad de sus estrategias reproductivas, que reflejan las presiones de selección sobre las variadas condiciones ambientales de sus hábitats. En este trabajo se reportan como parámetros de estas estrategias reproductivas, la fecundidad (número de huevos por postura) y la fertilidad (porcentaje de embriones por postura), en once especies de anuros con seis modos reproductivos, y se analizan en relación con el tamaño de las hembras, el tamaño de los huevos y con las características temporales o permanentes de su hábitat reproductivo. Se encontró que la fecundidad presentó una alta variación intra e inter-específica, ya que hubo especies con un solo huevo por postura (Dendrobates truncatus) hasta especies con 20 000 huevos por postura (Rhinella marina). Inter-específicamente, la fecundidad se relacionó positivamente con el tamaño corporal de las hembras, e inversamente con el tamaño de los huevos, el cual varió entre 0.98 mm y 4.54 mm y fue mayor para las especies con embriones de hábitat terrestres. Con respecto de la fertilidad, el promedio fue mayor que el 74.93% para todas las especies de estudio, sin diferencias estadísticamente significativas, aunque se registró un mayor porcentaje en las especies con posturas acuáticas. Este trabajo muestra como tendencia general que las especies con reproducción en cuerpos de agua temporales presentan un mayor número de huevos por postura, de menor tamaño y probablemente con una mayor fertilidad en comparación con las especies con una reproducción terrestre.
Palabras clave. Fecundidad, Fertilidad, Anuros, Tamaño de Huevo, Estrategias Reproductivas, Hábitat.
ABSTRACT
Anurans are a group of vertebrates very conspicuous for their reproductive strategies, which reflect the selective pressures on the fluctuating conditions of their habitats. Herein, we report as parameters of these reproductive strategies the fecundity (number of eggs per clutch) and fertility (percent of embryos per clutch) of eleven anuran species with six reproductive modes and we correlate them to the female body length, egg size, and their temporal or permanent reproductive habitats. Fecundity showed a high intra and inter-specific variation, with species from one egg per clutch (Dendrobates truncatus) to 20 000 eggs per clutch (Rhinella marina). Fecundity was positively correlated with female body size and inversely with the egg size, which varied between 0.98 mm and 4.54 mm. Fecundity was also higher for species with terrestrial embryos than those with aquatic temporal embryos. Fertility was higher than 74.93% for all species, and there was not a significant difference among them, although the species with aquatic clutches had a slight higher percent of fertility. This work reports data on the fecundity and fertility for eleven Colombian anuran species, but also shows the generality that species breeding in temporal water bodies have higher number of eggs per clutch, a smaller egg size and probably a higher percentage of fertility than terrestrial breeding species.
Key words. Fecundity, Fertility, Anurans, Egg Size, Reproductive Strategies, Habitat.
Recibido: 12/10/2010
Aceptado: 29/10/2012
INTRODUCCIÓN
Una característica esencial para la sobrevivencia de cualquier especie es su capacidad para reproducirse de forma exitosa. Particularmente, la reproducción en los anfibios es uno de los aspectos más conspicuos de su biología, a tal punto que muchas especies sólo se pueden observar durante su época reproductiva (Wells 2007). Los anfibios han sido considerados como un modelo biológico idóneo para estudiar el esfuerzo reproductivo puesto que mucha de su energía es invertida principalmente en el tamaño de los huevos y el número de huevos que depositan en cada postura (Camargo et al. 2008). Además, es el grupo de vertebrados con la mayor diversidad de estrategias reproductivas (Duellman & Trueb 1994, Caldwell 1997, Wells 2007).
Las estrategias reproductivas son entendidas como una combinación de atributos morfológicos, fisiológicos y comportamentales que actúan en conjunto para aumentar el éxito reproductivo bajo condiciones ambientales particulares (Duellman & Trueb 1994), o en respuesta a la presión ejercida por la disponibilidad de recursos, el riesgo de depredación y la competencia inter e intra-específica (Crump 1974, Crump 1981, Duellman & Trueb 1994). Se ha demostrado que rasgos como el tamaño corporal, la edad y las reservas de energía de las hembras, principalmente en anfibios, alteran el esfuerzo reproductivo (Lips 2001) y ante estas condiciones las especies ovíparas muestran ajustes en el número de huevos y posturas por cada período reproductivo, tiempo máximo de ovoposición y el tamaño de éstos (Sinervo & Licht 1991, Sinervo et al. 1992). En general, Duellman & Trueb (1994) mencionan que los patrones de reproducción están sujetos a la selección natural de manera tal que se han generado diferentes estrategias con una alta idoneidad que reflejan el compromiso entre muchas presiones selectivas. Para el caso de los anuros, esta variedad en las estrategias reproductivas se puede ver reflejada en sus modos reproductivos (Duellman & Trueb 1994, Wells 2007). Los modos reproductivos, según Salthe (1969) y Salthe & Duellman (1973), representan una combinación de varios factores en referencia al microhábitat de ovoposición y desarrollo de los embriones. Duellman (1985) y Duellman & Trueb (1994) determinaron inicialmente 29 modos reproductivos en anuros, desde especies con una reproducción totalmente acuática hasta una totalmente terrestre, pasando por modos intermedios que incluyen huevos retenidos en los oviductos sin pasar por una etapa de renacuajo. Sin embargo, trabajos posteriores han descrito nuevos modos reproductivos en ranas del neotrópico (Juncá et al. 1994, De La Riva 1995, Caldwell 1997, Prado et al. 2002), a tal punto que Haddad & Prado (2005) reportan 39 y Wells (2007) menciona la posibilidad de encontrar más de 40 modos de reproducción en los anfibios si se diferenciara con claridad entre los diversos sitios de ovoposición, desarrollo larvario y grado de cuidado parental (Wells 2007, pág 465).
Entre los parámetros cuantificables asociados a las estrategias reproductivas se encuentra la fecundidad, definida como el número de huevos puestos por una hembra o el tamaño de su nidada (Duellman & Trueb 1994, Hartmann et al. 2010). Varios trabajos han compilado datos sobre la fecundidad para especies de anfibios de zonas templadas y tropicales y su relación con el tamaño corporal de las hembras (Duellman & Trueb 1994, Bernardo 1996, Camargo et al. 2005, Wells 2007, Hartmann et al. 2010). En estos trabajos se ha reportado que los niveles de fecundidad son altamente variables entre los anfibios, pero que las especies de mayor tamaño, en general, ponen un mayor número de huevos que las pequeñas (Salthe & Duellman 1973). Particularmente, se considera que la fecundidad en los anuros está estrechamente asociada con los modos reproductivos, y que el tamaño de las hembras, de la descendencia y de los huevos, son rasgos de los linajes que han evolucionado como respuesta a las condiciones del ambiente y el nicho ecológico (Salthe & Duellman 1973, Crump 1974, Crump 1981, Barbault 1984, Fitch 1985, Gómez-Mestre et al. 2012). Otro parámetro que puede ser muy importante para medir el éxito reproductivo de una especie es la fertilidad, aunque este parámetro no es considerado uno de los componentes de las estrategias reproductivas propuestas para los anfibios. La fertilidad es definida como la capacidad de reproducción de una especie (Zug & Zug 1979), o como la viabilidad de los embriones después de la fusión del huevo y el esperma (Goin et al. 1979). En este trabajo nosotros la cuantificamos como el porcentaje de huevos que han sido fertilizados en relación con el total de huevos puestos por una hembra.
Diversas investigaciones se han realizado en aspectos reproductivos de anuros del neotrópico (Wake 1978, Townsend & Stewart 1986, Ovaska 1991, Ovaska & Hunte 1992, Bourne 1997, Donnelly 1999, Diesel et al. 1995). Sin embargo, pocos trabajos han sido efectuados con fines de cuantificar parámetros reproductivos de especies de anuros con distribución en Colombia, entre estos están los de Ortega (2005) para E. johnstonei, Corredor & Tovar (2008) para Dendrobates truncatus, y Zug & Zug (1979) para Rhinella marina. En vista de la importancia que tienen las estrategias reproductivas para entender las respuestas de los anfibios ante las presiones de selección natural ejercidas por las fluctuantes condiciones ambientales de su hábitat, este trabajo reporta por primera vez información sobre la fecundidad y fertilidad de once especies de anuros colombianos con seis modos reproductivos, y analiza el grado en que estos parámetros reproductivos se relacionan con el tamaño corporal de las hembras, el tamaño de los huevos y las características del hábitat temporal o permanente de estas especies.
MATERIALES Y MÉTODOS
Este trabajo se desarrolló con once especies agrupadas en seis modos reproductivos. Estas especies se escogieron por la fácil identificación en campo de sus posturas, por presentar diferentes modos reproductivos, hábitats temporales y permanentes, y porque según nuestro conocimiento sólo se tienen unos pocos reportes en Colombia sobre sus índices de fecundidad y ninguno de fertilidad. Los modos reproductivos siguieron la descripción hecha por Duellman & Trueb (1994) y Wells (2007), pero para este estudio fueron categorizados desde el número I al VI como se menciona a continuación. Modo reproductivo I: huevos acuáticos puestos a manera de cadena con desarrollo de larvas en aguas lóticas (Rhinella marina Linnaeus 1758, Rhinella granulosa Spix 1824). Modo reproductivo II: huevos acuáticos puestos a manera de película con desarrollo de larvas en aguas lénticas (Hypsiboas crepitans Wied-Neuwied 1824, Dendropsophus microcephalus Cope 1866). Modo reproductivo III: huevos puestos en nidos de espuma sobre el agua con desarrollo de larvas en aguas lénticas (Leptodactylus insularum Boulenger 1898, Engystomops pustulosus Cope 1864). Modo reproductivo IV: huevos arborícolas con desarrollo de larvas en aguas lóticas (Ikakogi tayrona Ruiz & Lynch 1991, Espadarana prosoblepon Boettger 1892). Modo reproductivo V: huevos terrestres con desarrollo de larvas acuáticas (Dendrobates truncatus Cope 1861). Modo reproductivo VI: huevos terrestres con desarrollo directo (Eleutherodactylus johnstonei Barbour 1914, Pristimantis uranobates Lynch 1991). En la Figura 1 se muestran fotos de algunas de estas especies y las posturas representantes de estos seis modos reproductivos.
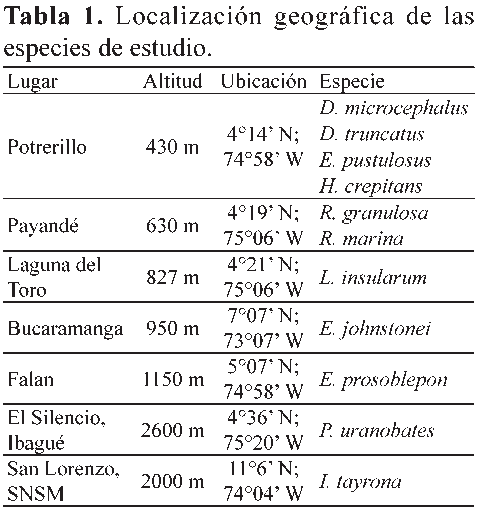
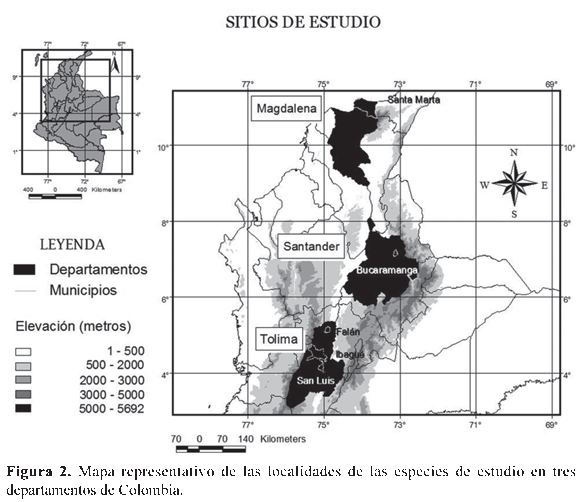
Para la obtención de los datos se realizaron salidas de campo entre noviembre de 2006 y junio de 2008, en diferentes lugares del municipio de Coello, Falan e Ibagué, en el departamento del Tolima, en Bucaramanga, en el departamento de Santander, y la Sierra Nevada de Santa Marta, departamento del Magdalena, en un rango altitudinal desde los 430 m hasta los 2600 m (Tabla 1, Fig. 2). La fecundidad fue registrada como el número total de huevos por cada postura, en tanto que la fertilidad se midió porcentualmente de acuerdo con el número de huevos fértiles, verificado por la presencia de embriones en estadios tempranos de desarrollo, 6 a 10 según Gosner (1960), en comparación con el número total de huevos por cada postura. Para el registro de la fecundidad en especies con un alto número de huevos (R. marina y R. granulosa) se hizo su estimación de acuerdo con el número de huevos contados en un metro lineal de la postura, multiplicado por la longitud total de la postura, la cual fue medida directamente en campo. Para el caso de la especie L. insularum, la estimación se realizó contando el número de huevos presentes en una de cinco divisiones hechas de manera proporcional al nido de espuma colectado. La realización de estas estimaciones las llevó a cabo un sólo investigador para evitar sesgos en la divisiones hechas al nido de espuma y error en el proceso de conteo. Para la especie E. pustulosus, se realizó el conteo de todos los huevos presentes en cada nido de espuma colectado. Las posturas de H. crepitans y D. microcephalus fueron transportadas al laboratorio donde se contaron uno a uno los huevos por postura. Para I. tayrona y E. prosoblepon las masas de huevos fueron recolectadas y contadas tanto en campo como en el laboratorio. Finalmente, en D. truncatus, P. uranobates y E. johnstonei, el registro sobre la fecundidad y fertilidad se realizó de acuerdo con las posturas depositadas en terrarios dispuestos en el laboratorio para estas especies. Además del conteo hecho en campo y laboratorio, también se tomaron fotografías de las posturas de las especies H. crepitans, D. microcephalus, I. tayrona, E. prosoblepon, D. truncatus, P. uranobates y E. johnstonei, para el posterior reconteo en el laboratorio del número total de huevos y embriones por postura, según la metodología sugerida por Paton & Harris (2010). Para las especies P. uranobates y L. insularum se disectaron hembras grávidas, (N=10) y (N=6), respectivamente, obtenidas de la Colección Herpetológica de la Universidad del Tolima
Las medidas sobre el tamaño de los huevos se realizaron tomando como referencia el diámetro de cada huevo, o de los embriones en estadío menor que 10 (Gosner 1960), de las posturas obtenidas en campo y laboratorio. La longitud rostro cloaca (LRC) de las hembras y el diámetro de los huevos fueron medidos con un calibrador Mytutoyo de precisión 0.01 mm. En los casos en donde no fue posible medir las hembras de las cuales se recolectaron las posturas, su tamaño corporal se tomó como un promedio de la longitud rostro cloaca de varias hembras recolectadas en campo, el número de hembras medidas por especie se muestra en la Tabla 2. A pesar de la variabilidad que puede haber en el tamaño corporal entre las hembras de una misma especie, en este estudio sólo se realizaron comparaciones inter-específicas por las claras diferencias significativas que se presentaron entre los tamaños corporales de las hembras (Kruskal-Wallis, P < 0.05).
En el análisis de los datos se tuvieron en cuenta parámetros estadísticos como el promedio, el coeficiente de variación y el rango de los datos. Para establecer la asociación entre dos de las variables de estudio, fecundidad, fertilidad, tamaño de huevo y longitud rostro cloaca de las hembras, se utilizó la prueba no paramétrica de correlación de Spearman (Zar 1996). También se realizó una prueba de Kruskal-Wallis con el fin de comparar la fertilidad entre especies. Los análisis estadísticos fueron realizados con el programa STATISTICA versión 7.0.
RESULTADOS
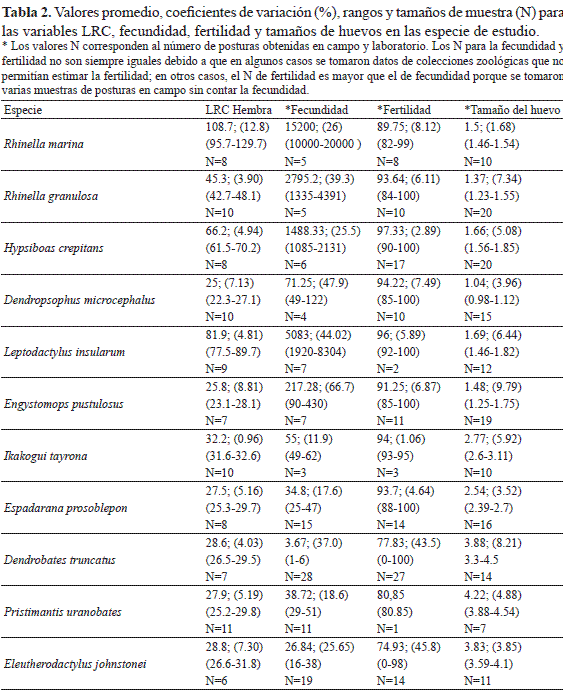
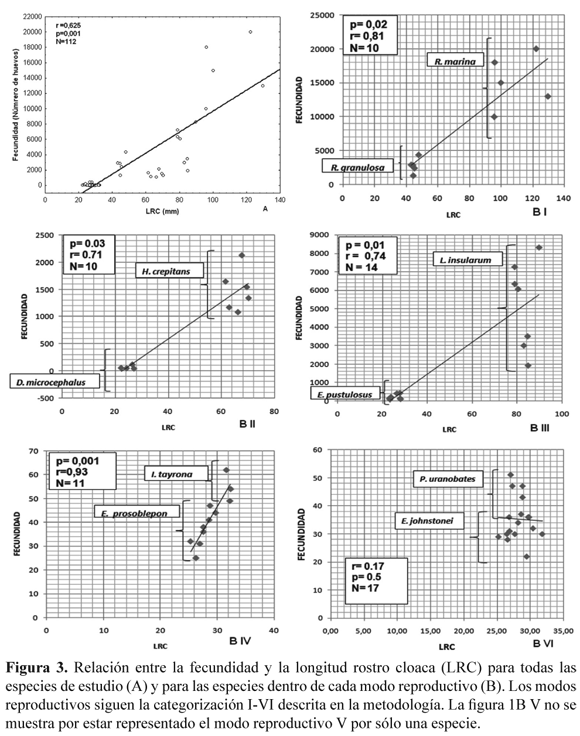
Los valores de los promedios, el coeficiente de variación, el rango de los datos y el tamaño de la muestra, para el tamaño corporal (LRC) de las hembras en las especies estudiadas y para las variables fecundidad, tamaño de huevo y fertilidad son presentados en la Tabla 2. La fecundidad fue el rasgo reproductivo que presentó la mayor variación inter e intra-específica (Tabla 2). De acuerdo con la Figura 3A se puede apreciar que hay una correlación positiva entre la fecundidad y la LRC (Spearman r = 0.625; P< 0.001; N= 112). R. marina fue la especie que presentó la fecundidad más alta con un promedio de 15 200 huevos por postura y la de una mayor LRC. En contraste D. truncatus presentó un promedio de 3.67 huevos por postura mientras que E. johnstonei y P. uranobates tuvieron la menor fecundidad y los valores más bajos de LRC (Tabla 2). El análisis de correlación entre la LRC y la fecundidad para las especies de cada modo reproductivo también mostró una asociación positiva significativa, con excepción de las especies del modo reproductivo VI (Fig. 3B).
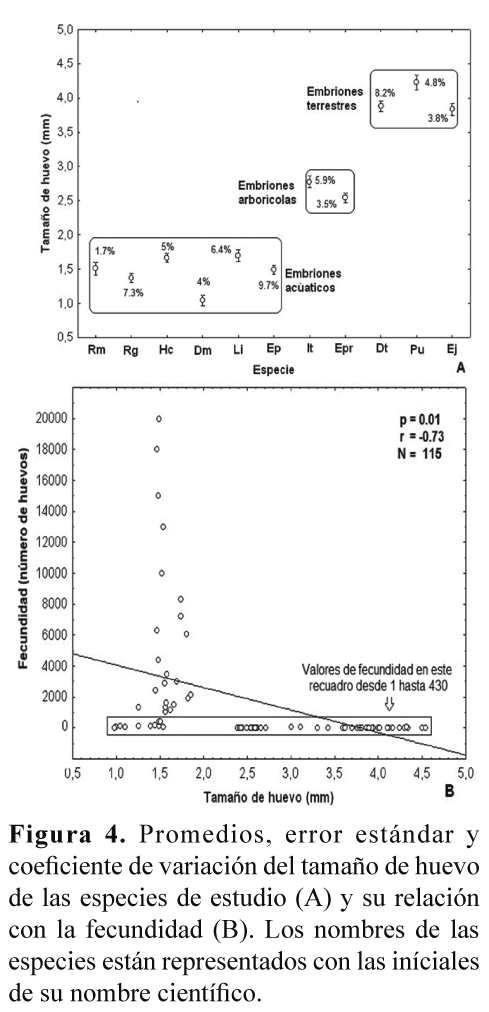
El tamaño del huevo fue el parámetro que presentó la menor variación intra-específica (Tabla 2, Fig. 4A), pero hubo una clara diferencia entre las especies con embriones de hábitat acuáticos (más pequeños), arborícolas y terrestres (Fig. 4A). También, se encontró una correlación negativa (Spearman r = -0.728; P < 0.001; N= 112) entre el tamaño de los huevos y la fecundidad (Fig. 4B).
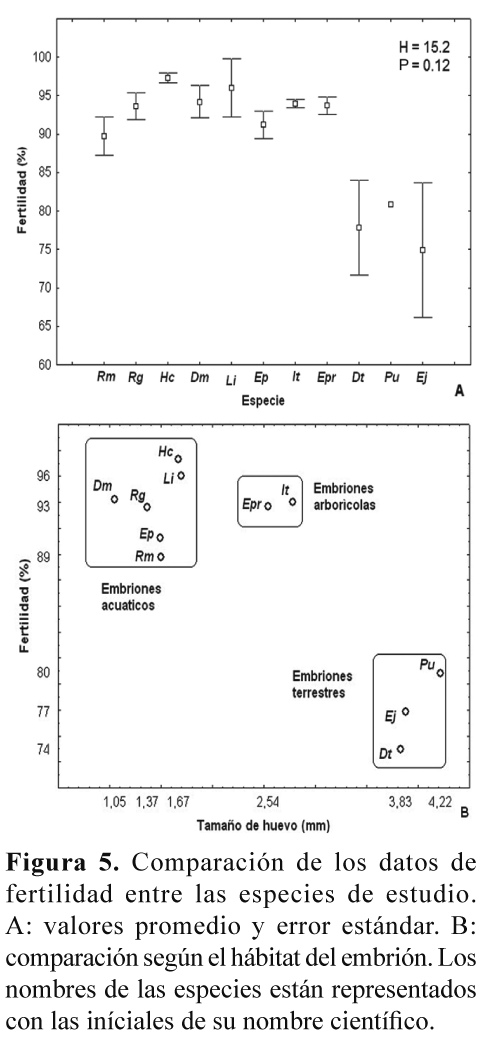
La fertilidad no presentó diferencias estadísticamente significativas entre las especies (Kruskal-Wallis H= 15.2; P= 0.12, Fig. 5A), aunque las especies con posturas acuáticas presentaron promedios de fertilidad más altos que las especies con posturas terrestres (Fig. 5B).
DISCUSIÓN
Las estrategias reproductivas son tan importantes para la sobrevivencia de una especie como lo pueden ser las adaptaciones fisiológicas y morfológicas a su ambiente (Duellman & Trueb 1994). Entre los componentes de las estrategias reproductivas, Duellman & Trueb (1994) mencionan los controles endógenos y extrínsecos de los ciclos gametogénicos, la fecundidad, la duración del desarrollo, la edad de la primera reproducción y el esfuerzo reproductivo. En este trabajo se estudia la fecundidad y la fertilidad como parámetros cuantitativos de estos componentes de las estrategias reproductivas.
En los resultados obtenidos se encontró que hay una alta variabilidad intra e inter-específica en la fecundidad (Fig. 3), y una menor variación en el tamaño del huevo (Fig. 4) y la fertilidad (Fig. 5). Los resultados de estas amplias variaciones en la fecundidad, al parecer, son una característica general en los anfibios, ya que concuerda con otros reportes para especies de zonas templadas y tropicales (Salthe & Duellman 1973, Kaplan & Cooper 1984). Particularmente, esta alta variación en la fecundidad de los anfibios ha sido atribuida a factores tales como: 1) la edad de las hembras, ya que se ha encontrado que hembras de mayor edad ponen un mayor número de huevos y de mayor tamaño que las hembras más jóvenes (Gibbons & Mcarthy 1983, Elmberg 1991); 2) al número de posturas que pueda haber tenido la hembra durante su época de reproducción, por ejemplo, se ha reportado que las segundas posturas de una hembra pueden tener un menor número de huevos y más pequeños que la primera postura (Howard 1978), aunque también hay resultados contrarios (Lemckert & Shine 1993); y 3) a la variación en el tamaño corporal de las hembras, ya que estudios previos han registrado una correlación positiva con la fecundidad (Salthe & Duellam 1973, Crump 1974, Duellman 1989, Haddad & Prado 2005), y al parecer es una expresión fenotípica de adaptación en especies que se reproducen en hábitats temporales o impredecibles (Kaplan & Salthe 1979, Kaplan & Cooper 1984).
Un factor que podría incidir sobre los datos de fecundidad reportados podría atribuirse a la posibilidad de recolectar posturas comunales, como ha sido descrito para especies particularmente con nidos de espuma (Duellman & Trueb 1994, Wells 2007). Sin embargo, los datos de algunas posturas provenientes directamente de parejas en amplexus (E. prosoblepon, P. uranobates y R. marina), y de las disecciones hechas a hembras grávidas (en L. insularum y P. uranobates), estuvieron dentro del rango de los datos de fecundidad registrados para las otras posturas obtenidas en campo. También, estos registros concuerdan con reportes previos de fecundidad para especies como D. truncatus (Corredor & Uribe 2008), donde se registró un promedio de 3.6 huevos por postura, con un rango entre 1 y 8 huevos, y para R. marina de Centroamérica, en donde se estimó entre 10 000 a 30 000 huevos por postura, de acuerdo con la curva de regresión propuesta por Zug & Zug (1979) para el tamaño corporal de las hembras. Ortega et. al. (2005), en su estudio con E. johnstonei, reportaron que a mayor tamaño de la hembra mayor era el tamaño de la postura, aunque no indicaron el número de huevos por postura. Por lo tanto, consideramos que los datos aquí reportados son un buen estimativo del parámetro de fecundidad para las once especies de estudio.
A nivel inter-específico se encontró una clara correlación entre la fecundidad y el tamaño corporal de las hembras (Tabla 2, Fig. 3A). Sin embargo, un aspecto altamente asociado con las variaciones inter-específicas en la fecundidad de los anuros tiene que ver con sus modos reproductivos, en donde las especies con posturas acuáticas ponen una mayor cantidad de huevos, de tamaño menor, que las especies con posturas terrestres (Salthe & Duellman 1973, Hartmann et. al. 2010). Los resultados de este trabajo concuerdan con esta generalidad, ya que las especies con posturas acuáticas presentaron unos valores de fecundidad considerablemente más altos, y con un tamaño de huevo menor, que las especies con posturas terrestres y particularmente con desarrollo directo (Fig. 4B). Es probable que el rango de variación en el tamaño de los huevos producidos por un individuo, e incluso para una especie, pueda estar sujeto al estricto control genético en respuesta adaptativa a los cambios en ambientes fluctuantes, como ha sido reportado para otros grupos de animales ectotérmicos (Robertson 1971).
Con respecto de la fertilidad, evaluada de acuerdo a la definición establecida en la metodología, en el presente estudio se encontraron porcentajes relativamente altos para todas las especies, mayores que el 74%, y no hubo una diferencia estadísticamente significativa entre estas (Fig. 5A). No obstante, se notó que las especies con posturas acuáticas presentaron un porcentaje de fertilidad mayor que las especies con posturas terrestres (Fig. 5B). Esta es sólo una tendencia que sería interesante poner a prueba con un mayor número de datos, y en particular entre especies con diferentes modos reproductivos y hábitats. Una hipótesis que se podría evaluar es si las especies con reproducción acuática, en donde ocurre la unión del esperma con el óvulo dentro de un cuerpo de agua, podrían presentar una mayor fertilidad, o índice de fertilidad, que las especies con reproducción terrestre, en donde no hay un medio acuático que facilite la unión del esperma con el óvulo. Un resultado en este sentido podría sugerir un proceso de selección natural que ha maximizando la eficiencia reproductiva, ahora en términos de fertilidad, en las especies que dependen de fuentes de agua para su reproducción, y particularmente de aquellas de hábitat temporales. La variación intra e inter-especifica en la fertilidad fue mucho menor que la encontrada para la fecundidad, pero también podría ser atribuida a factores como la edad reproductiva del macho y la hembra y a su capacidad de producción de gametos viables, así como al número de veces que pueda aparearse durante su época reproductiva.
En general, una alta fecundidad parece estar fuertemente asociada a especies de tamaños grandes y a huevos pequeños. A su vez, esta parece ser una buena estrategia reproductiva para las especies con embriones de hábitat acuáticos, modos reproductivos I, II y III, en respuesta a la temporalidad de sus charcas de reproducción, debido a que embriones de huevos pequeños presentan unas tasas de desarrollo mayores que los embriones de huevos grandes y particularmente que los terrestres, modos reproductivos IV, V, y VI (Bradford 1990, Bernal & Lynch 2009). También, podría ser considerada como una estrategia reproductiva que disminuye la probabilidad individual de depredación (Salthe & Duellman 1973, Camargo et al. 2008), ya que los embriones y renacuajos de estas especies con reproducción acuática y temporal principalmente se desarrollan en áreas abiertas expuestas a múltiples predadores.
Los datos sobre la fecundidad, incluido el tamaño de los huevos, se han considerado como una fuente importante de información sobre la contribución del genotipo y el ambiente a la variación en los caracteres de las historias de vida de los anfibios y sobre las respuestas adaptativas a sus condiciones locales (Wells 2007). La fertilidad, en cambio, ha sido menos estudiada como un parámetro dentro de las estrategias reproductivas de los anfibios. En este trabajo se presentan por primera vez este tipo de datos para especies de anuros colombianos y se sugiere que además de la fecundidad se incluyan registros sobre la fertilidad para una comprensión más integral de cómo están modeladas las respuestas de los anuros en relación con sus modos reproductivos y ante las variadas condiciones ambientales impuestas por su hábitat.
AGRADECIMIENTOS
Este trabajo fue financiado parcialmente por el Fondo de Investigación de la Universidad del Tolima, dentro del marco del proyecto 310105. Agradecemos a los integrantes del grupo de Herpetología de la Universidad del Tolima que colaboraron con el desarrollo del trabajo de campo y laboratorio, particularmente a Sandra Díaz, Mónica Gutiérrez, Gloria Palma y Víctor Luna.
LITERATURA CITADA
1. Barbault, R. 1984. Strategies de reproduction et démographie de quelques amphibiens tropicaux. Oikos 43: 77-87. [ Links ]
2. Bernal, M.H. & J.D. Lynch. 2009. Temperatura y tasa de desarrollo embrionario en anuros: relación con su modo reproductivo, microhábitat y distribución altitudinal. Revista de la Asociación Colombiana de Ciencias Biológicas 21: 20-30. [ Links ]
3. Bernardo, J. 1996. The Particular Maternal Effect of Propagule Size, Especially Egg Size: Patterns, Models, Quality of Evidence and Interpretations. American Zoology 36: 216-236. [ Links ]
4. Bourne, G.R. 1997. Reproductive behavior of terrestrial breeding frogs Eleutherodactylus johnstonei in Guyana. Journal of Herpetology 31: 221-229. [ Links ]
5. Bradford, D.F. 1990. Incubation time and rate of embryonic development of amphibians: the influence of ovum size, temperature, and reproductive mode. Physiological Zoology 63:1157-1180. [ Links ]
6. Caldwell, J.P. 1997. Pair bonding in spotted poison frogs. Nature 385: 211. [ Links ]
7. Camargo, A., E.D. Naya, A. Canavero, I. Rosa & R. Maneyro. 2005. Seasonal activity and the body size-fecundity relationship in a population of Physalaemus gracilis (Boulenger 1883) (Anura, Leptodactylidae) from Uruguay. Annales Zoologici Fennici 42: 513-521. [ Links ]
8. Camargo, A., M. Sarroca & R. Maneyro. 2008. Reproductive effort and the egg number vs. size trade-off in Physalaemus frogs (Anura: Leiuperidae). Acta Oecológica 34: 163-171. [ Links ]
9. Corredor-L., G. & N. Uribe-T. 2008. Management and reproduction of the Colombian Magdalena River poison-dart frog Dendrobates truncatus at Cali Zoo. International Zoo Yearbook 42: 71-77. [ Links ]
10. Crump, M.L. 1974. Reproductive strategies in a tropical anuran community. University of Kansas Museum of Natural History Miscellaneous Publications 61: 1-66. [ Links ]
11. Crump, M L. 1981.Variation in propagule size as a function of environmental uncertainty for tree frogs. The American Naturalist 117: 724-737. [ Links ]
12. Crump, M.L. 1984. Intraclutch egg size variability in Hyla crucifer (Anura: Hylidae). Copeia 1984: 302-308. [ Links ]
13. De La Riva, I. 1995. A new reproductive mode for the genus Adenomera (Amphibia: Anura: Leptodactylidae): Taxonomic implications for certain Bolivian and Paraguayan populations. Studies on Neotropical Fauna and Environment 30: 15-29. [ Links ]
14. Diesel, R., G. Baurle & P. Vogel. 1995. Cave breeding and froglet transport: a novel pattern of anuran brood care in the Jamaican frog, Eleutherodactylus cundalli. Copeia 1995: 354-360. [ Links ]
15. Donnelly, M.A. 1999. Reproductive phenology of Eleutherodactylus bransfordii in northeastern Costa Rica. Journal of Herpetology 33: 624-631. [ Links ]
16. Duellman, W.E. 1985. Reproductive modes in anuran amphibians: phylogenetic significance of adaptive strategies. South African Journal of Science 81:174-178. [ Links ]
17. Duellman, W.E. 1989. Alternative life-history styles in anuran amphibians: evolutionary and ecological implications. Págs 101-126. En: M.N. Burton. (eds), Alternative Life-History Styles of Animals. Kluwer Academic Publishers, Dordrecht. [ Links ]
18. Duellman, W.E. & L. Trueb. 1994. Biology of amphibians. The Johns Hopkins University Press, Baltimore. [ Links ]
19. Elmberg, J. 1991. Ovarian cyclicity and fecundity in boreal commong frogs Rana temporaria along climatic gradient. Functional Ecology 5: 340-350. [ Links ]
20. Fitch, H.S. 1985. Variation clutch and litter sizes in new world reptiles. University of Kansas Museum of Natural History Miscellaneous Publications 76: 1-70 [ Links ]
21. Gibbons, M.M. & T.K. Mcarthy. 1983. Age determination of frogs and toads (Amphibia, Anura) from north-western Europe. Zoologica Scripta 12: 145-151. [ Links ]
22. Goin, C.J., O.B. Goin & G. Zug. 1979. Introduction to Herpetology. W.H. Freeman & Company, Nueva York. [ Links ]
23. Gomez-Mestre, I., R.A. Pyron & J.J. Wiens. 2012. Phylogenetic analyses reveal unexpected patterns in the evolution of reproductive modes in frogs. Evolution doi:10.1111/j.1558-5646.2012.01715.x [ Links ]
24. Haddad, C.F. & C.P. Prado. 2005. Reproductive modes in frogs and their unexpected diversity in the Atlantic forest of Brazil. BioScience 55: 207-217. [ Links ]
25. Hartman, M.T., P.A. Hartman & C.B.F. Haddad. 2010. Reproductive modes and fecundity of an assemblage of anuran amphibians in the Atlantic rainforest, Brazil. Iheringia Série Zoologia 100: 207-215 [ Links ]
26. Howard, R.D. 1978. The influence of male-defended oviposition sites on early embryo mortality in bullfrogs. Ecology 59: 789-798. [ Links ]
27. Juncá, F.A., R. Altig & C. Gascon. 1994. Breeding biology of Colostethus stepheni, a dendrobatid frog with a nontransported nidicolous tadpole. Copeia 1994: 747-750. [ Links ]
28. Kaplan, R.H. & W.S. Cooper. 1984. The evolution of developmental plasticity in reproductive characteristics: an application of the "adaptive coin-flipping" principle. The American Naturalist 123 (3): 393-410. [ Links ]
29. Kaplan, R. H., & S.N. Salthe. 1979. The allometry of reproduction: an empirical view in salamanders. The American Naturalist. 113:671-689. [ Links ]
30. Lemckert, F.L. & R. Shine. 1993. Cost of reproduction in a population of the frog Crinia signifera from southeastern Australia. Journal of Herpetology 27: 420-425. [ Links ]
31. Lips, K.R. 2001. Reproductive trade-offs and bet-hedging in Hyla calypsa, a Neotropical treefrog. Oecologia 128: 509-518. [ Links ]
32. Ortega, J.E., V.H. Serrano & M.P. Ramírez-P. 2005. Reproduction of an introduced population of Eleutherodactylus johnstonei at Bucaramanga, Colombia. Copeia 2005: 642-648. [ Links ]
33. Ovaska, K. 1991. Reproductive phenology, population structure and habitat use of the frog Eleutherodactylus johnstonei in Barbados, West Indies. Journal of Herpetology 25: 424-430. [ Links ]
34. Ovaska, K. & W. Hunte. 1992. Male mating tactics of the frog Eleutherodactylus johnstonei (Leptodactylidae) in Barbados, West Indies. Herpetologica 48: 40-49. [ Links ]
35. Paton, P.W.C. & R. N. Harris. 2010. Egg mass and nest counts. Cap. 9, págs. 143-165 en: C. K. Dodd (eds), Amphibian ecology and conservation. A Handbook of Techniques. Oxford University Press, Nueva York. [ Links ]
36. Prado, C.P.A., M. Uetanabaro & C.F.B. Haddad. 2002. Description of a new reproductive mode in Leptodactylus (Anura, Leptodactylidae), with a review of the reproductive specialization towards terrestriality in the genus. Copeia 2002: 1128-1133. [ Links ]
37. Robertson, R. 1971. Lepidoptera genetics. Pergamon Press, Oxford. [ Links ]
38. Salthe, S.N. 1969. Evolutionary relationships in the reproductive modes and the numbers and sizes of ova in the urodeles. The American Midland Naturalist 81: 467-490. [ Links ]
39. Salthe, S.N. & W.E. Duellman. 1973. Quantitative constraints associated with reproductive mode in anurans. Págs. 229-249 en: J.L. Vial (eds), Evolutionary Biology of the Anurans. University of Missouri Press, Columbia. [ Links ]
40. Sinervo, B. & P. Licht. 1991. Proximate constraints on the evolution of egg size, number, and total clutch mass in lizards. Science 252: 1300-1302. [ Links ]
41. Sinervo, B., P. Doughty & R.B. Huey. 1992. Allometric engineering: a causal analysis of natural selection on offspring size. Science 258: 1927-1929. [ Links ]
42. Townsend, D.S. & M.M. Stewart. 1986. Courtship and mating behavior of a Puerto Rican frog, Eleutherodactylus coqui. Herpetologica 42:165-170. [ Links ]
43. Wake, M.H. 1978. The reproductive biology of Eleutherodactylus jasperi (Amphibia: Anura: Leptodactylidae), with comments on the evolution of live-bearing systems. Journal of Herpetology. 12:121-133. [ Links ]
44. Wells, K.D. 2007. The ecology and behavior of amphibians. The University of Chicago Press, Chicago. [ Links ]
45. Zar, J.H. 1996. Biostatistical analysis. Prentice Hall, Nueva Jersey. [ Links ]
46. Zug, G.R. & P.B. Zug. 1979. The marine toad, Bufo marinus. A natural history resume of native populations. Smithsonian Institution Press, Washington D.C. [ Links ]