Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232
Caldasia vol.35 no.1 Bogotá Jan./June 2013
A new species of Andropogon (Poaceae: Panicoideae: Andropogoneae) from Colombia
DIEGO GIRALDO-CAÑAS
Instituto de Ciencias Naturales, Facultad de Ciencias, Universidad Nacional de Colombia, Apartado 7495, Bogotá D. C., Colombia.dagiraldoc@unal.edu.co
RESUMEN
Se describe e ilustra una nueva especie de Andropogon. La nueva especie sólo se conoce del departamento de Norte de Santander (región andina colombiana). Con esta nueva especie, el género Andropogon queda representado en la flora de Colombia por 18 especies.
Palabras clave. Andropogon, Flora de Colombia, Gramíneas de los Andes, Gramíneas neotropicales.
ABSTRACT
A new species of Andropogon is described and illustrated. The new species is known only from Departament of Norte de Santander (Colombian Andes). Thus, a total of 18 species of this genus occur in Colombia.
Key words. Andropogon, Flora of Colombia, Andean grasses, Neotropical grasses.
Recibido: 30/01/2013
Aceptado: 16/05/2013
INTRODUCCIÓN
Andropogon L. es el género más diversificado de la tribu Andropogoneae, del que se conocen cerca de 100 especies (Clayton & Renvoize 1999, Renvoize et al. 2006, Zanin & Longhi-Wagner 2006), de distribución pantropical, con centros de diversificación en las sabanas africanas, así como en las sabanas, los cerrados y los campos sudamericanos (Zanin & Longhi-Wagner 2006, Nagahama & Norrmann 2012). En el continente americano se encuentran entre 57 y 60 especies (Zuloaga et al. 2003, Nagahama & Norrmann 2012), donde Brasil es el país con la mayor riqueza específica (28 especies) (Zanin & Longhi-Wagner 2006, Zanin 2010), seguido por Colombia (18 especies) (Giraldo-Cañas, este estudio), Bolivia (16 especies) (Renvoize 1998) y Venezuela (16 especies) (Zuloaga et al. 2008).
Andropogon se caracteriza por presentar inflorescencias espatáceas, generalmente con con un par de racimos (raramente un racimo solitario o tres o más racimos digitados), con raquis articulado, espiguillas pareadas –destacándose que las dos espiguillas y un entrenudo del raquis se desprenden como una unidad de dispersión–, los entrenudos del raquis y los pedicelos son filiformes a claviformes, a menudo levemente aplanados, ciliados y cupuliformes en el ápice; sus espiguillas son dimorfas, lanceoladas, con glumas subiguales, las que ocultan los antecios; la espiguilla sésil es biflora, comprimida dorsal o lateralmente, el antecio inferior es neutro (reducido a una lema), el superior es perfecto aunque raramente puede ser pistilado por reducción de los estambres (3) a estaminodios (Zanin & Longhi-Wagner 2006, Norrmann & Caponio 2012); mientras que la espiguilla pedicelada a pesar de ser biflora, su antecio inferior es neutro (reducido a una lema), y su antecio superior puede ser estaminado, rudimentario o estéril, aunque según Zanin & Longhi-Wagner (2006) y Norrmann & Caponio (2012), éste puede ser algunas veces perfecto. Cabe destacar que la principal fuente de variación en el género la constituye la forma de la gluma inferior de la espiguilla sésil (Clayton & Renvoize 1999).
Este género se confunde con Schizachyrium Nees, un género frecuentemente incluido y considerado como categoría infragenérica de Andropogon, ya bien sea como subgénero, sección o grupo (Gould 1967, Peichoto 2010). Al respecto, Clayton (1964) presentó las diferencias entre ambos géneros, y destacó los siguientes caracteres diferenciales para Schizachyrium: presencia de racimos unitarios, artejos y pedicelos de ápice dilatado y fimbriado y el dorso de la espiguilla sésil convexo con nervios intracarinales (véanse además Gould 1967, Türpe 1984, Renvoize 1998, Clayton & Renvoize 1999, Renvoize et al. 2006, Peichoto 2010).
Aquí se documenta un nuevo hallazgo de la región andina de Colombia, el cual es producto de recientes exploraciones del autor en esta interesante región biogeográfica. Así, se contribuye con el inventario de la flora de Colombia, considerada la segunda a nivel mundial después de la de Brasil (Rangel-Ch. 2006).
MATERIALES Y MÉTODOS
Estudios exomorfológicos. Las técnicas usadas corresponden a las empleadas clásicamente en taxonomía y sistemática biológicas (Giraldo-Cañas et al. 2012). Se siguió el concepto morfológico de especie, con base en los postulados de Crisci (1994), Uribe Meléndez (2008) y Giraldo-Cañas et al. (2012), esto es "una especie se define como un conjunto de individuos que presenta un espectro continuo de variación fenotípica y separado de otros conjuntos por discontinuidades morfológicas; en otras palabras, las especies son hipótesis acerca de la discontinuidad de la naturaleza".
La denominación de las estructuras morfológicas planas y tridimensionales está basada en la terminología clásica agrostológica, excepto en lo que tiene que ver con los términos caña (= culmo), entrenudo (= internodio, internodo), estolonífero (= cundidor), nervios (= venas), aparatos estomáticos (al describir los estomas, se utilizó el término aparatos estomáticos, que incluye las células oclusivas, las células subsidiarias, el ostíolo o estoma, así como la cámara subestomática), tricomas (= pelos), asperezas (término empleado para referirse en forma conjunta a aguijones y ganchos), fitolitos (= biolitos, microfitolitos o silicofitolitos), panoja (= panícula o paniculodio), espiguilla (= espícula o florescencia), lema (= lemma), lema inferior (= lema estéril, lemma estéril), lema superior (= lema fértil, lemma fértil), antecio (= flósculo) y cariopsis (= cariopse o cariópside) (Giraldo-Cañas 2012). Así, se pretende contribuir con la estandarización de términos agrostológicos, dado que hay una proliferación de palabras para la morfología de gramíneas, las cuales, en muchos casos, no son homólogas. Con esto se quiere contribuir a la imperiosa necesidad de la unificación de términos morfológicos y anatómicos en el contexto de Mayo et al. (2008), Assis (2009), Vogt et al. (2010) y Schönenberger & von Balthazar (2012). Los términos escritos en negrita corresponden a las formas castellanas adoptadas en la agrostología moderna.
Observaciones micromorfológicas de la lámina foliar, los racimos y las espiguillas. Las muestras de láminas foliares, racimos, espiguillas y antecios –para las observaciones con los microscopios ópticos "MO" (Instituto de Ciencias Naturales, Bogotá D. C.)– se obtuvieron de material seco de herbario. Cabe destacar que las láminas foliares seleccionadas para la observación de fitolitos corresponden a la antepenúltima hoja de una innovación fértil, mientras que las estructuras reproductivas corresponden a panojas maduras.
Fitolitos. Las láminas se limpiaron con agua destilada y detergente comercial, con el fin de eliminar materiales ajenos a las muestras foliares. La obtención de los fitolitos se hizo con base en la calcinación de láminas foliares, la que consiste en una carbonización del material vegetal en una mufla a 500°C y durante tres horas. Las cenizas se dejaron enfriar en el interior de la mufla por espacio de 12 horas, con el fin de evitar que los cristales obtenidos se rompieran si se llegasen a sacar inmediatamente después de la calcinación. Luego, las cenizas así obtenidas se lavaron con ácido clorídrico (HCl) al 10% y se sometieron al "baño maría" a 70°C por espacio de 20 minutos; después las muestras se centrifugaron a 3500 rpm por espacio de cinco minutos. Los decantados obtenidos se lavaron con agua destilada y luego se centrifugaron nuevamente con las mismas condiciones antes descritas. A los nuevos decantados se les agregó 10 ml de peróxido de hidrógeno (H2O2) al 25%, los que se sometieron nuevamente al "baño maría" y a una nueva centrifugación en las mismas condiciones antes mencionadas. Posteriormente, a los decantados se les adicionó 10 ml de alcohol al 90% con el fin de eliminar rastros del peróxido y éstos se centrifugaron nuevamente en las mismas condiciones. Los decantados así obtenidos se montaron en laminillas permanentes por medio de "Entellan New", el cual permite que las muestras puedan ser observadas en forma nítida y además, este medio permite conservar las muestras por muchos años; dichas laminillas son la base de las observaciones con el MO. En algunos casos no sólo se obtuvieron muestras separadas de fitolitos, sino también fragmentos de tejido foliar con conservación de la estructura hística, estos últimos corresponden a espodogramas, toda vez que son residuos estructurales que resultan de incinerar tejidos vegetales. La terminología para los fitolitos está basada en Zucol (1996).
Resultados y discusión
Andropogon columbiensis Gir.-Cañas, sp. nov. Tipo: COLOMBIA. Norte de Santander: Cordillera Oriental andina, municipio de Ocaña, carretera Ocaña-ábrego, a unos dos km del casco urbano de Ocaña, en sustratos rocosos y arenosos de material coluvial, pendientes pronunciadas, fuerte erosión a manera de cárcavas, en medio de una matriz de gramíneas, ca. 1200 m alt., ca. 08°14'10'' N - 73°21'22'' O, 3 de abril de 2010, D. Giraldo-Cañas et al. 4542 (holotipo COL, isotipos COL). Figuras 1, 2, 3, 4 y 5.
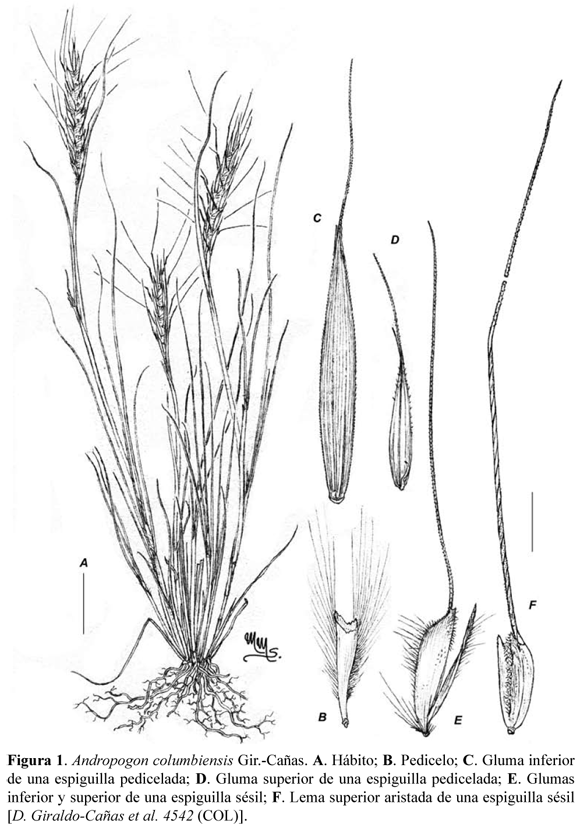

Diagnosis. Radix fibrosa, flexuosa, pallida; culmi caespitosi, paucinodes, nodis angustis fuseis glabris; rhachis eximie articulata, articulis cuneiformibus apice oblique excavatis margine ciliatis; spiculae in axi articulato barbato geminae, terminales ternae; altera subbiflora hermaphrodita sessili, altera neutra pedicellata; glumae duae, inferior mutica, superior setigera.
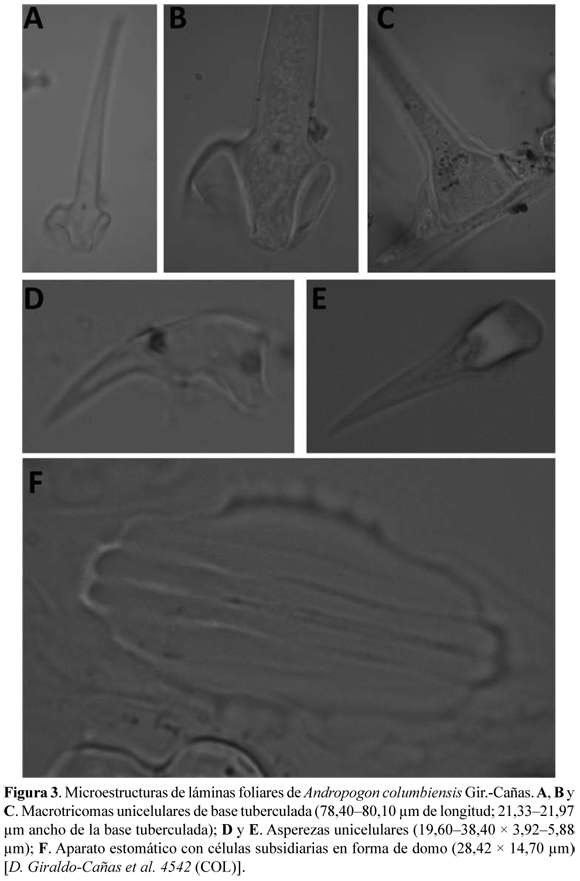
Descripción. Plantas anuales, cespitosas, densamente macolladas, 14–27 cm de altura (incluidas las inflorescencias), de aspecto delicado, sistema radicular denso, raíces fibrosas, flexuosas, blanquecinas, pálidas, con varios órdenes de ramificación. Cañas simples, paucinodes, capilares, ca. 0,5 mm de diámetro, ligeramente más engrosadas hacia los nudos, pajizas, lustrosas; nudos glabros, los proximales castaño oscuros, los distales verde oscuros a grisáceos; entrenudos muy cortos, 0,1–0,6 cm long., excepto los entrenudos distales de las cañas floríferas, los cuales pueden alcanzar los 0,7–3,5 cm long.; follaje principalmente basal, denso. Hojas con vainas de 1,8–5,6 cm long., envolventes, estriadas, pilosas, los tricomas hialinos, brillantes, unicelulares, de base tuberculada, sinuosos, hasta de 4 mm long., irregularmente distribuidos, principalmente marginales a submarginales, más numerosos en la porción proximal, algunas vainas con márgenes escariosas e hialinas; lígulas conspicuamente proyectadas a manera de aurícula vaginal, largamente agudas, 3,2–4,3 mm long., notoriamente nervadas, herbáceas a membranáceas, de márgenes escariosas e hialinas, o toda la superficie escariosa, de ápice levemente eroso, estriadas, glabrescentes o pilosas, los tricomas hialinos, brillantes, unicelulares, de base tuberculada, sinuosos, hasta de 4 mm long., escasos o numerosos, principal e irregularmente dispuestos en la porción proximal; láminas lineares a aciculares, 4,5–15,3 × ca. 0,1cm, conduplicadas, glabrescentes (muy raramente con escasos tricomas hialinos, brillantes, unicelulares, de base tuberculada, sinuosos, hasta de 4 mm long., irregularmente distribuidos principalmente hacia su porción proximal), con numerosas asperezas, tanto marginales como uniformemente distribuidas a lo largo y a lo ancho de las láminas, ápice largamente acuminado. Inflorescencias terminales, espatáceas, subincluidas en el follaje a más comúnmente exertas; espatéolas de igual naturaleza a la de las hojas distales, con vainas, lígulas y láminas desarrolladas; pedúnculos cubiertos en su totalidad por las espatéolas, erectos, rectos, verdes, con numerosas asperezas unicelulares hialinas, brillantes, uniformemente distribuidas; panojas una por caña, constituidas por un único racimo; racimos (2,5) 3,5–4,0 cm long., rectos, espiciformes, sedoso-vellosos, los tricomas de color blanco-amarillento; raquis articulado, artejos frágiles, cuneiformes, amarillentos, vellosos, los tricomas unicelulares, hialinos, brillantes, hasta de 4 mm long. Espiguillas pareadas, dimorfas, una sésil y la otra pedicelada, las dos espiguillas y un entrenudo del raquis caedizos como una unidad de dispersión. Espiguillas sésiles largamente aristadas; callo conspicuamente oblicuo; gluma inferior lanceolada, 4,5–4,8 mm long., mútica, membranácea, pilosa, los tricomas hialinos, brillantes, unicelulares, hasta de 1,6 mm long., 3-nervia, nervios conspicuos, próximos entre si; gluma superior navicular, (3,8) 4,4–4,8 mm long. (sin incluir la arista), aristada, membranácea, glabrescente a cortamente pilosa en la porción distal de la cara abaxial, los tricomas hialinos, brillantes, unicelulares, hasta de 0,2 mm long., uni-nervia, el nervio medio conspicuo y piloso en la cara abaxial, con numerosos tricomas hialinos, brillantes, unicelulares, hasta de 0,5 mm long., arista dorada, 5,8–17,2 mm long.; antecio inferior neutro; lema inferior lanceolada, 3,4–3,7 mm long., escariosa, hialina, brillante, leve y cortamente pilosa hacia la porción distal de la cara abaxial, los tricomas hialinos, brillantes, unicelulares, hasta de 0,2 mm long; pálea inferior ausente; antecio superior perfecto; lema superior lanceolada, 3,0–3,2 mm long. (sin incluir la arista), escariosa, hialina, brillante, ligera y cortamente ciliada, los tricomas hialinos, brillantes, unicelulares, 3-nervia, los nervios laterales tenues, el nervio medio conspicuo, aristada, arista cobriza, retorcida, de 23–40 mm long.; pálea superior lanceolada, 2,0–2,2 mm long., glabra en casi toda su extensión, glabrescente en su extremo distal abaxial, hialina, escariosa, enervia; estigmas plumosos, rosados o cobrizos, ramas estigmáticas muy cortas, de menos de 0,2 mm long.; lodículas 2; estambres 3, filamentos hialinos a dorados, opacos, anteras castaño-rojizas, ca. 1,2 mm long. Cariopsis no vista. Espiguillas pediceladas lanceoladas, cortamente aristadas; pedicelos cuneiformes, amarillentos, 3,1–3,6 mm long., vellosos, los tricomas unicelulares, hialinos, brillantes, hasta de 4 mm long.; callo conspicuamente oblicuo; gluma inferior lanceolada, cobriza o rojiza, opaca, ligeramente asimétrica (nervio medio levemente desplazado hacia un costado), aristada, 5,5–9,2 mm long. (sin incluir la arista), glabrescente, márgenes escariosas y ligeramente plegadas hacia la cara adaxial, con numerosas y diminutas asperezas marginales, hialinas y brillantes, 11–19-nervia, nervios conspicuos y con numerosas y diminutas asperezas hialinas brillantes, nervio medio más prominente que los laterales, arista 5–9 mm long., los bordes inferiores de la gluma inferior abrazan parcialmente la gluma superior; gluma superior lanceolada, hialina, brillante, escariosa, simétrica, cortamente aristada, 3,9–4,5 mm long. (sin incluir la arista), 3-nervia, nervio medio conspicuo, nervios laterales débiles, arista ca. 1 mm long.; antecio inferior neutro; lema inferior lanceolada, hialina, brillante, escariosa, simétrica, (2) 3,8–4,0 mm long., 1–3-nervia, nervios tenues, cortamente pilosa en la cara adaxial, los tricomas hialinos y brillantes, ca. 0,2 mm long.; pálea inferior ausente; antecio superior neutro; lema superior ausente; pálea superior ausente; lodículas ausentes.
Etimología. El epíteto específico hace referencia a Colombia, país neotropical con una rica flora que aún sigue sorprendiéndonos con numerosas novedades taxonómicas y corológicas.
Distribución geográfica y ecológica. Andropogon columbiensis sólo se conoce de la localidad tipo; esta especie crece en sustratos rocosos y arenosos derivados de material coluvial, en áreas con pendientes pronunciadas y fuerte erosión manifestada principalmente como cárcavas; la región tiene una precipitación promedio de 1030 mm/año. A Andropogon columbiensis se le encuentra en matas dispersas y mezclada con otras gramíneas –con las que constituye pastizales muy diversificados–, como Arundinella hispida (Humb. & Bonpl. ex Willd.) Kuntze, Axonopus aureus P. Beauv., Cenchrus echinatus L., Chloris spp., Digitaria insularis (L.) Fedde, Eragrostis airoides Nees, Eragrostis pectinacea (Michx.) Nees, Eragrostis pilosa (L.) P. Beauv., Eragrostis tenuifolia (A. Rich.) Hochst. ex Steud., Hyparrhenia rufa (Nees) Stapf, Melinis repens (Willd.) Zizka, Paspalum spp. y Sporobolus jacquemontii Kunth.
Observaciones. Andropogon columbiensis es única en el género por la combinación de las siguientes características: su tipo de lígula (la cual se proyecta conspicuamente a manera de aurícula vaginal, largamente aguda, de 3,2–4,3 mm long.), su hábito anual y cespitoso, por su aspecto delicado, por sus inflorescencias constituidas por un único racimo, por sus espatéolas de igual naturaleza a la de las hojas distales (con vainas, lígulas y láminas desarrolladas), por sus pedúnculos cubiertos en su totalidad por las espatéolas y por sus espiguillas pediceladas, las que presentan lema inferior cortamente pilosa en la cara adaxial y sus dos antecios son neutros. No obstante, sus espiguillas (mas no su hábito e inflorescencias) son muy similares a las de Andropogon fastigiatus Sw., una especie de amplia distribución en el neotrópico, la cual presenta, al igual que A. columbiensis, espiguillas pediceladas con la gluma inferior asimétrica (véase Zanin & Longhi-Wagner 2006). éstas se diferencian fácilmente por las siguientes características: plantas delicadas hasta de 27 cm de altura en A. columbiensis (plantas vigorosas hasta de 200 cm de altura en A. fastigiatus), lígulas de 3,2–4,3 mm long. en A. columbiensis (5–11 mm long. en A. fastigiatus), láminas foliares lineares a aciculares y conduplicadas en A. columbiensis (lineares acuminadas y planas en A. fastigiatus), panojas escasas en A. columbiensis (numerosas en A. fastigiatus), racimos sólo terminales en A. columbiensis (terminales y axilares en A. fastigiatus), espiguillas sésiles con la lema inferior leve y cortamente pilosa hacia la porción distal de la cara abaxial en A. columbiensis (lema inferior ciliada en A. fastigiatus), espiguillas pediceladas sin páleas en A. columbiensis (con páleas en A. fastigiatus) y espiguillas sésiles con anteras ca. 1,2 mm long. en A. columbiensis (1,5–1,8 mm long. en A. fastigiatus).
Con esta nueva especie, el género Andropogon queda representado en la flora de Colombia por 18 especies [A. angustatus (J. Presl) Steud., A. bicornis L., A. bogotensis (Hack.) A. Zanin, A. columbiensis Gir.-Cañas, A. fastigiatus Sw., A. gayanus Kunth, A. glaucescens Kunth, A. glomeratus (Walter) Britton, Sterns & Poggenb., A. hypogynus Hack., A. lateralis Nees, A. lehmannii Pilg., A. leucostachyus Kunth, A. multiflorus Renvoize, A. selloanus (Hack.) Hack., A. tolimensis Pilg., A. vetus Sohns, A. virgatus Desv. ex Ham., y A. cf. aequatoriensis Hitchc.]. De éstas, cuatro especies son endémicas de Colombia (A. bogotensis, A. columbiensis, A. lehmannii, A. tolimensis), una es introducida de áfrica y ahora se le encuentra naturalizada en el neotrópico (A. gayanus), mientras que las restantes son especies nativas.
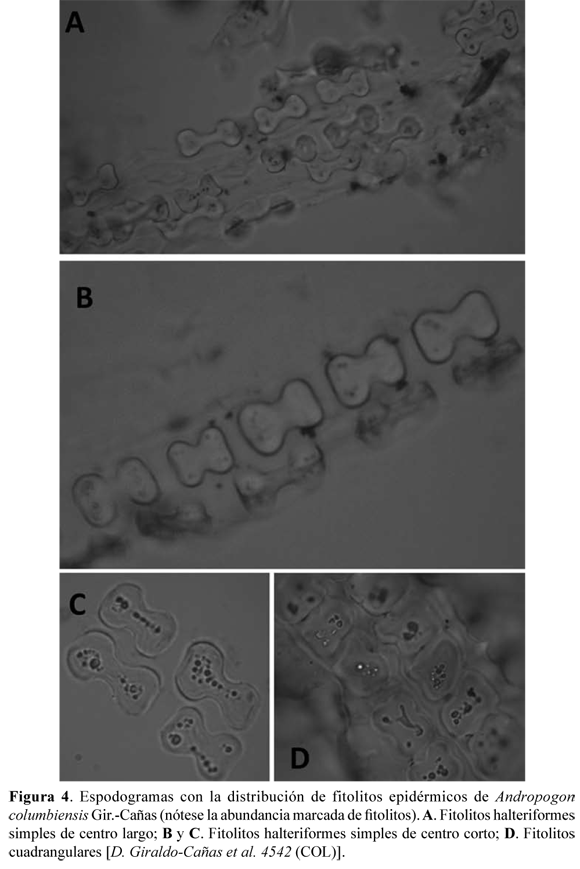
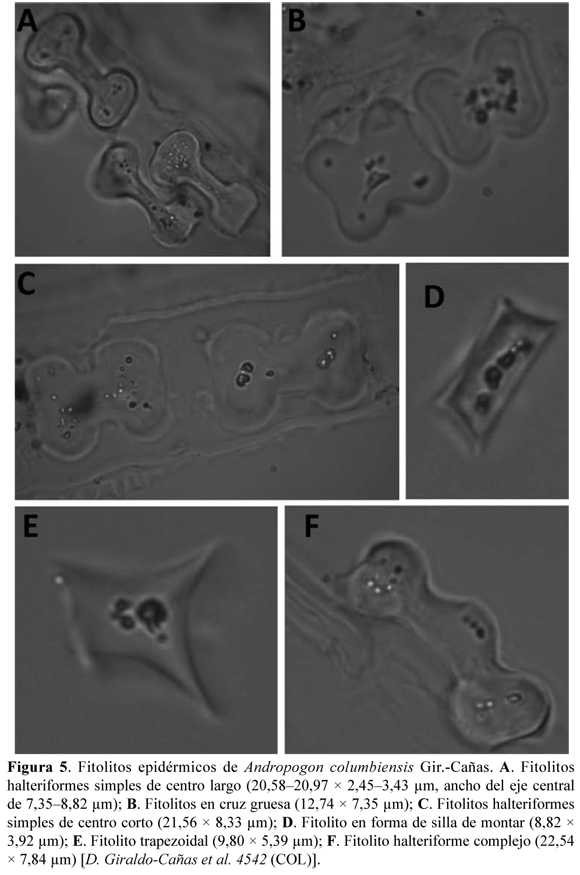
Fitolitos foliares. Los fitolitos –también conocidos como microfitolitos– son cuerpos líticos que se componen de un gel de sílice, una forma de sílice amorfo hidratado o ácido silícico polimerizado, impurificado por la presencia de diversos elementos químicos, tales como hierro, potasio, etc., y son consecuencia de un proceso de mineralización (Zucol 1996, Erra 2010). Su composición, además de ser silícea (silicofitolitos o cuerpos silíceos), puede corresponder a carbonato de calcio (cristales de carbonato, o impregnaciones sobre membranas: cistolitos), como también oxalato de calcio (cristales). Los fitolitos de las gramíneas se originan mayoritariamente en los tejidos epidérmicos, subepidérmicos y esclerenquimáticos, y poseen características morfológicas que los diferencian del resto del reino vegetal (Zucol 1996).
Se observaron siete clases de fitolitos (cuerpos silíceos), tales como halteriformes simples de centro largo (20,58–20,97 × 2,45–3,43 µm, ancho del eje central de 7,35–8,82 µm), halteriformes simples de centro corto (21,56 × 8,33 µm), halteriformes complejos (22,54 × 7,84 µm), cuadrangulares, fitolitos en cruz gruesa (12,74 × 7,35 µm), fitolitos en forma de silla de montar (8,82 × 3,92 µm) y fitolitos trapezoidales (9,80 × 5,39 µm) (Fig. 4 y 5). Los fitolitos en forma de silla de montar corresponden a la clase chloridoide, los cuadrangulares y los trapezoidales corresponden a la clase pooide, mientras que los fitolitos en cruz gruesa y los halteriformes (simples y complejos) corresponden a la clase panicoide (véase Zucol 1996: 152). Cabe destacar que a pesar de la gran diversidad de fitolitos, los más frecuentes corresponden a los halteriformes simples, tanto de centro largo como de centro corto, una característica común entre las especies de la subfamilia Panicoideae.
Conservación. Esta especie sólo se conoce de una pequeña población de la localidad tipo (holotipo e isotipo), la cual no supera las tres hectáreas de extensión, y a pesar de que el autor ha adelantado varias exploraciones en toda la región andina así como en el resto de Colombia, nunca se han encontrado nuevos especímenes. A esto se le suma la condición de alteración antrópica de la región, toda vez que ésta está siendo reducida y modificada drásticamente para la urbanización de la población de Ocaña. Por otra parte, a pesar de haber revisado colecciones de los herbarios COAH, COL, HUA, JAUM, MEDEL, MEXU, MO, RSA, SI, US y VEN, nunca se encontraron más especímenes de esta especie. Lo anterior permite ubicar a Andropogon columbiensis en la categoría "en peligro crítico" (véase IUCN 2001).
AGRADECIMIENTOS
Al Instituto de Ciencias Naturales y a la Universidad Nacional de Colombia por las facilidades brindadas para la preparación de este trabajo. Al Prof. Gaspar Morcote (COL) por su valiosa colaboración en la obtención de las muestras de los fitolitos. Al Dr. Paul M. Peterson (US) y Dr. Robert Soreng (US) por su valiosa colaboración, información y enriquecedores comentarios. A Juan Camilo Ospina González (SI) por el obsequio de valiosa bibliografía. A Marcela Morales (COL) por la elaboración de la ilustración. Este artículo es una contribución derivada del proyecto "Estudios morfológicos, anatómicos y taxonómicos en gramíneas neotropicales (Fase II)", de la Universidad Nacional de Colombia, sede Bogotá D. C.
LITERATURA CITADA
1. Assis, L. C. S. 2009. Coherence, correspondence, and the renaissance of morphology in phylogenetic systematics. Cladistics 25: 528-544. [ Links ]
2. Clayton, W. D. 1964. Studies in the Gramineae: V. New species of Andropogon. Kew Bull. 17: 465-470. [ Links ]
3. Clayton, W. D. & S. A. Renvoize. 1999. Genera Graminum: Grasses of the World. Kew Bull., Additional series 13: 1-389. Royal Botanic Gardens, Kew, 3era. edición. [ Links ]
4. Crisci, J. 1994. La especie: realidad y conceptos. En: J. Llorente Bousquets & I. Luna (compiladores), Taxonomía biológica: 53–64. Universidad Autónoma de México-Fondo de Cultura Económica, México D. F. [ Links ]
5. Erra, G. 2010. Asignación sistemática y paleocomunidades inferidas a partir del estudio fitolítico de sedimentos cuaternarios de Entre Ríos, Argentina. Bol. Soc. Argent. Bot. 45: 309-319. [ Links ]
6. Giraldo-Cañas, D. 2012. Las especies del género Axonopus (Poaceae: Panicoideae: Paspaleae) en Brasil. Revista Acad. Colomb. Ci. Exact.: 36 (140): 317–364. [ Links ]
7. Giraldo-Cañas, D., P. M. Peterson & I. Sánchez Vega. 2012. The genus Eragrostis (Poaceae: Chloridoideae) in northwestern South America (Colombia, Ecuador, and Peru): Morphological and taxonomic studies. Biblioteca José Jerónimo Triana 24: 1–195. Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Bogotá D. C. [ Links ]
8. Gould, F. W. 1967. The grass genus Andropogon in the United States. Brittonia 19: 70–76. [ Links ]
9. IUCN. 2001. Red list categories. Version 3.1. IUCN Species Survival Comission, IUCN, Gland. [ Links ]
10. Mayo, S. J., R. Allkin, W. Baker, V. Blagoderov, I. Brake, B. Clark, R. Govaerts, C. Godfray, A. Haigh, R. Hand, K. Harman, M. Jackson, N. Kilian, D. W. Kirkup, I. Kitching, S. Knapp, G. P. Lewis, P. Malcolm, E. von Raab-Straube, D. M. Roberts, M. Scoble, D. A. Simpson, C. Smith, V. Smith, S. Villalba, L. Walley & P. Wilkin. 2008. Alpha E-Taxonomy: Responses from the systematics community to the biodiversity crisis. Kew Bull. 63: 1–16. [ Links ]
11. Nagahama, N. & G. A. Norrmann. 2012. Review of the genus Andropogon (Poaceae: Andropogoneae) in America based on cytogenetic studies. J. Bot. 2012: 1–9. [ Links ]
12. Norrmann, G. & I. Caponio. 2012. Andropogon L. En: F. O. Zuloaga, Z. E. Rúgolo & A. M. Anton (eds.), Flora Argentina. Flora Vascular de la República Argentina, Volumen 3 - Tomo 1: 494–501, Monocotyledoneae-Poaceae: Aristidoideae a Pharoideae. Instituto Nacional de Tecnología Agropecuaria INTA - IMBIV CONICET - Instituto de Botánica Darwinion IBODA, Córdoba (Argentina). [ Links ]
13. Peichoto, M. C. 2010. Revisión taxonómica de las especies del género Schizachyrium (Poaceae: Andropogoneae) de Sudamérica. Candollea 65: 301–346. [ Links ]
14. Rangel-Ch., J. O. 2006. La biodiversidad de Colombia. Palimpsesto 5: 292–304. [ Links ]
15. Renvoize, S. A. 1998. Gramíneas de Bolivia. The Royal Botanic Gardens, Kew. [ Links ]
16. Renvoize, S. A., A. S. Vega & Z. E. Rúgolo de Agrasar. 2006. Gramineae (part 3). Subfam. Panicoideae. Flora of Ecuador 78: 1–218. [ Links ]
17. Schönenberger, J. & M. von Balthazar. 2012. Modern plant morphological studies. Bot. J. Linnean Soc. 169: 565–568. [ Links ]
18. Türpe, A. M. 1984. Revision of the South American Species of Schizachyrium (Gramineae). Kew Bull. 39: 169–178. [ Links ]
19. Uribe Meléndez, J. 2008. Monografía de Frullania subgénero Meteoriopsis (Frullaniaceae, Marchantiophyta). Caldasia 30: 49–94. [ Links ]
20. Vogt, L., T. Bartolomaeus & G. Giribet. 2010. The linguistic problem of morphology: structure versus homology and the standardization of morphological data. Cladistics 26: 301–325. [ Links ]
21. Zanin, A. 2010. Andropogon L. En: R. Campostrini Forzza & P. Leitman (coordinadoras), Catálogo de Plantas e Fungos do Brasil 2: 1465–1466. Instituto de Pesquisas Jardim Botânico do Rio de Janeiro, Rio de Janeiro. [ Links ]
22. Zanin, A. & H. M. Longhi-Wagner. 2006. Sinopse do gênero Andropogon L. (Poaceae - Andropogoneae) no Brasil. Revista Brasil. Bot. 29: 289–299. [ Links ]
23. Zucol, A. F. 1996. Microfitolitos de las Poaceae argentinas: I. Microfitolitos foliares de algunas especies del género Stipa (Stipeae: Arundinoideae) de la provincia de Entre Ríos. Darwiniana 34: 151–172. [ Links ]
24. Zuloaga, F. O., O. Morrone, G. Davidse, T. S. Filgueiras, P. M. Peterson, R. J. Soreng & E. J. Judziewicz. 2003. Catalogue of New World grasses (Poaceae): III. Subfamilies Panicoideae, Aristoideae, Arundinoideae, and Danthonioideae. Contr. U.S. Natl. Herb. 46: 1–662. [ Links ]
25. Zuloaga, F. O., O. Morrone, S. Nozawa & M. Ramia. 2008. Poaceae. En: O. Hokche, P. E. Berry & O. Huber (eds.), Nuevo catálogo de la flora vascular de Venezuela: 789–818. Fundación Instituto Botánico de Venezuela "Dr. Tobías Lasser", Caracas. [ Links ]













