Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232
Caldasia vol.35 no.1 Bogotá Jan./June 2013
Seasonal change in the use of resources of the Reptilian assemblages in the Zapatosa’s wetland complex, departamento del Cesar (Colombia)
Guido Fabián Medina-Rangel
Grupo de Biodiversidad y Conservación - Reptiles, Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Avenida 30 calle 53, Apartado 7495, Bogotá D. C., Colombia.gfmedinar@unal.edu.co, guidofabianmedina@gmail.com
RESUMEN
Para estudiar cómo los ciclos estacionales influyen en el uso y la agregación de las especies de reptiles en los diferentes hábitats, microhábitats y horas de actividad diaria. Se realizaron cuatro salidas de campo en áreas circundantes al complejo cenagoso de Zapatosa, entre noviembre de 2006 y octubre de 2007, abarcando la época de lluvias (noviembre de 2006 y octubre de 2007) y la época seca (enero de 2007 y julio de 2007). En total se invirtieron 640 horas/hombre de muestreo, repartidas en cinco hábitats: bosque casmófito, bosque seco, bosque de ribera, palmar y sabana arbolada. Se encontraron 468 individuos distribuidos en 36 especies en época de lluvias y en época seca se hallaron 344 individuos repartidos en 35 especies. En época de lluvias el hábitat más rico en especies fue el bosque casmófito y el más abundante en individuos fue el bosque seco; en época seca el bosque de ribera fue el que presentó el mayor número de especies e individuos. El mayor recambio temporal de especies dentro del mismo hábitat lo presentó la sabana arbolada. Las especies que dominaron la comunidad en ambos periodos climáticos fueron Gonatodes albogularis, Anolis tropidogaster y Anolis auratus. La disimilitud en cuanto a las abundancias y la composición de las especies que se presentó entre épocas climáticas fue del 34% y las especies que más contribuyeron a esto fueron Ameiva praesignis, Mabuya sp. y Holcosus festivus. Las horas de actividad de un período climático a otro fueron similares. Los lagartos mostraron mayor amplitud y las serpientes más alta superposición en el uso del tiempo de actividad en los dos periodos climático. La amplitud en el uso de los recursos no presentó un patrón generalizado por grupos de reptiles de un periodo a otro, ni resultó diferente estadísticamente entre época climática. La superposición en el uso de los recursos fue mayor en la época seca frente a la de lluvias.
Palabras clave: Amplitud y superposición de nicho, dimensiones del nicho espacial, tiempo de actividad diaria.
ABSTRACT
To study how the seasonal cycles influence the use and aggregation of the reptiles species in the different habitats, microhabitats and hours of daily activity, I made four field trip in surrounding areas of the Zapatosa's wetland complex, between November of 2006 and October of 2007, embracing both the rainy (November of 2006 and October of 2007) and the dry season (January of 2007 and July of 2007). In total 640 sampling hours/man analyzed distributed in five habitats types chasmophyte forest, dry forest, riparian forest, palm-grove and tree-lined savanna. I found 468 individuals that were distributed in 36 species in the rainy season and 344 individuals of 35 species in the dry season. In the rainy season the richest habitat was the chasmophyte forest and the most abundant was the dry forest; in dry season the riparian forest was the one that presented the higher number of species and individuals. The major period replacement of species in the same habitat was found in the tree-lined savanna. The species that dominated the assembling climate in both periods were Gonatodes albogularis, Anolis tropidogaster and Anolis auratus. The dissimilarity as for the abundances and composition of the species that were present among climatic times was of 34% and the species that contributed more to that were Ameiva praesignis, Mabuya sp., and Holcosus festivus. The daily activity among the different climatic periods was similar. The lizards showed bigger width and the snakes showed higher overlap in the use of time of activity among the different climatic periods. The width in the use of the resources did not follow a generalized pattern among the groups of reptiles from one period to the other, neither it was different statistically among climatic time.
Keywords: Width and niche overlap, dimensions of the space niche, time of daily activity.
Recibido: 31/01/2011
Aceptado: 30/04/2013
INTRODUCCIÓN
Los recursos en la naturaleza están a disposición de las especies para poder subsistir, por ejemplo alimento (presas), pareja, refugio, condiciones térmicas adecuadas, entre otros (Huey 1991). Si se tiene en cuenta que los recursos cambian constantemente en el espacio y en el tiempo, afectando los patrones de uso a lo largo del año (Gregory et al. 1987, Rahbek 2005), las especies tienen que ser capaces de acomodarse al cambio, para lo cual delimitan su actividad en las dimensiones del nicho, adaptando las estrategias de comportamiento y la distribución de la actividad a lo largo del día, para usar efectivamente los recursos y reducir la competencia intra e inter específica (Melville & Schulte 2001, Huey et al. 2009); estas situaciones modelan la distribución a nivel micro y macro ambiental, facilitando la ocupación de todos los potenciales nichos que ofrece un hábitat y permitiendo que las especies se adecuen a su permutación en el tiempo.
Las variaciones temporales en los recursos que ofrece el medio condicionan en muchos casos la actividad de postura y eclosión de las especies (Sexton et al. 1972, Nemes et al. 2006). Asimismo, la temperatura corporal es un factor importante que influye en la selección de los recursos espaciales en los animales (Chruszcz & Barclay 2002, Quirt et al. 2006), especialmente en los ectotermos, quienes ajustan el uso del espacio para mantener la temperatura de cuerpo dentro de un intervalo óptimo (Huey 1991, Kearney & Predavec 2000).
La mayor parte de los reptiles presentan pequeñas dominios vitales, lo cual puede llevar a una marcada superposición espacial y temporal entre individuos y especies (Huey et al. 2009), aumentando la competencia en cada uno de los aspectos del uso de su hábitat y periodos de actividad.
La coexistencia viene definida por variables ambientales, temporales y espaciales que facilitan la repartición del recurso de forma óptima (Crump 1971, Nemes et al. 2006); sin embargo, en apariencia, la competencia está ahí y seguramente constituye una presión selectiva. Entender cómo se reparten los recursos, cómo los usan diferencialmente, permite comprender aspectos fundamentales de la ecología y la coexistencia de los reptiles (Crump 1971, Duellman 2005 González-Megías et al. 2007).
El objetivo de este trabajo fue describir cómo los ciclos estacionales influyen en el uso y la agregación de las especies de reptiles en los diferentes hábitats, microhábitats y las relaciones temporales diarias en los alrededores del complejo cenagoso de Zapatosa, departamento del Cesar, Colombia. Se analizó la manera en que las especies en épocas climáticas distintas distribuyen los periodos de actividad en el día, si cambia la riqueza, abundancia, composición y patrones de preferencia entre hábitats y dentro de los mismos.
MATERIALES Y MÉTODOSÁrea de estudio
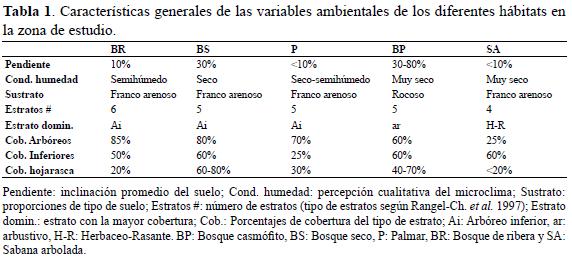
El trabajo se desarrolló en el departamento del Cesar, en cinco tipos de hábitat alrededor de tres ciénagas pertenecientes al gran complejo cenagoso de Zapatosa, entre 40 y 180 metros de altitud (Figura 2). La ciénaga de Zapatosa (9º14'N 73º46'W--9º21'N 73º49'W) pertenece a los municipios de Chimichagua, el Banco y Chiriguana. La ciénaga Mata de Palma (9°32'N 73°39'W) ubicada en el corregimiento de Potrerillo y la ciénaga la Pachita (9°32'N 73°41'W), en el corregimiento La Loma, ambas pertenecen al municipio de El Paso (Figura 1).
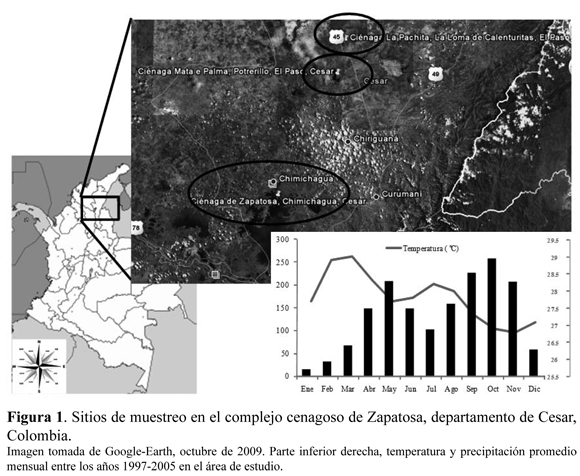

El régimen de las lluvias de la zona es bimodal tetraestacional, la precipitación media anual oscila entre 1000-2600 mm, los periodos de lluvias (invierno) comprenden los meses de abril a junio y agosto a noviembre, con un máximo en el mes de octubre (160-300 mm) y un promedio de temperatura de 28 ºC y evapotranspiración potencial de 162.3 mm; mientras que los periodos secos (verano) se presentan entre diciembre a marzo y julio a principios de agosto, con un mínimo en el mes de enero (9-21 mm) y un promedio de temperatura de 26 ºC y evapotranspiración potencial de 135.7 mm (Rangel-Ch. et al. 1997, Medina-R., 2011; Figura 1).
De acuerdo con Rangel-Ch. et al. (1997), el área forma parte de la formación Bosque Seco Tropical (BsT), la cual se caracteriza por tener terrenos con pendientes en general suaves (oscilan entre 2-5 %, pero algunos sitios alcanzan entre 30% y 80%); con la cobertura vegetal actualmente dominada por una matriz de pastizales con algunos fragmentos de bosque seco tropical muy aislados, bosques de ribera en un estado de conservación intermedio, rastrojo alto y bajo, palmares formados por la fuerte entresaca de madera a la cual fueron sometidos los bosques relictuales y potreros con algunos árboles dispersos integrando cercas vivas y sombrío para el ganado (Rangel-Ch. et al. 2008b). Entre las presiones más fuertes sobre los remanentes de vegetación y la fauna asociada a la misma, se encuentra la ganadería intensiva, la roza y quema frecuente para cultivo, la degradación y contaminación del suelo y el agua por basuras en los alrededores de zonas pobladas y finalmente la tala del bosque y la entresaca de madera para venta y uso doméstico.
Hábitats estudiadosDe acuerdo con la fisionomía vegetal en la zona de estudio, que suministra un conjunto particular de recursos y condiciones ambientales, se definieron cinco tipos de hábitat (Rangel-Ch. et al. 2008b) (Tabla 1): bosque casmófito (bosque seco de pendiente), bosque seco (fragmentos de bosque seco en zonas planas), bosque de ribera, palmares y sabanas arboladas (pastizales naturales y sembrados). Para mayores detalles de las características de cada uno de los hábitats remitirse a Medina-Rangel (2011).
Diseño del estudio
Muestreo
Se efectuaron cuatro salidas de 10 días efectivos de muestreo cada una (réplicas temporales), por dos investigadores, en los cinco hábitats (dos días por sitio en cada hábitat ya definidos en cada salida-réplica espacial), en noviembre de 2006 y octubre de 2007 (época de lluvias) y enero y julio de 2007 (época seca); se buscó abarcar equitativamente el periodo seco (dos salidas) y el periodo de lluvias (dos salidas). Para un total de 40 días de muestreo efectivo.
Hábitat: para desarrollar las comparaciones, se definieron los cinco hábitats básicos previamente descritos como unidad de muestreo, se muestrearon en cada salida dos sitios (unidad de muestreo) separados espacialmente que representaban cada hábitat.
Reptiles: mediante un diseño aleatorio de caminatas, se realizaron búsquedas por encuentro visual cronometradas (Crump & Scott 1994), es decir un muestreo aleatorio estratificado por hábitats; se efectuaron diariamente recorridos de aproximadamente 400 m en el día y 400 m en la noche en el mismo sitio, con el fin de observar y/o capturar la mayor cantidad de individuos e identificarlos utilizando claves especializadas (para mayores detalles de la literatura usada para la identificación de especies revisar Medina-R., 2011); todos los ejemplares fueron liberados posteriormente. La captura de los individuos fue manual y/o con gancho, explorando a un metro a cada lado dentro de los potenciales microhábitats donde se podían encontrar los reptiles.
Cada hábitat fue recorrido por dos investigadores durante ocho horas efectivas realizando búsquedas libres (cuatro horas en el día 9 - 13 h y cuatro horas en la noche 18 – 22 h, hora local), para un esfuerzo diario de 16 horas de trabajo/ hombre, 128 horas / hombre para cada hábitat y un total de 640 horas / hombre durante todo el estudio.
La ventaja de este diseño y método es que permiten el cubrimiento de todos los hábitats establecidos y la obtención de una lista de especies con su abundancia relativa (frecuencia de aparición) sin violar los supuestos de aleatoriedad de muestreo, necesario para hacer comparaciones entre áreas con y sin vegetación cerrada (Heyer et al. 1994).
Medición de las diferentes variablesCon el fin de calificar y cuantificar parámetros ecológicos relacionados con las especies de reptiles del sotobosque y usarlos como variables para comparaciones con la estructura del hábitat, a cada individuo capturado se le registraron los siguientes datos:
o Actividad (D: diurno, N: nocturno) y hora de captura.
o Microhábitat definido como el sitio específico entre los límites de subsistencia de los organismos, donde hacen uso de recursos particulares dentro de cada uno de los hábitats (Begon et al. 1999). Los microhábitat se agruparon en nueve categorías que fueron: 1) aguas lóticas (dentro del agua de caños temporales o permanentes), 2) aguas lénticas (dentro del agua de ciénagas y jagüeyes temporales o permanentes), 3) borde u orilla de ciénaga o sobre vegetación flotante, 4) borde u orilla de quebrada, 5) suelo y oquedades (hojarasca, bajo roca, bajo o entre tronco caído, bajo o entre raíces, sobre hojarasca, sobre roca, suelo desnudo y suelo con vegetación), 6) poste (cercas del alambrado o madero aislado erguido), 7) tronco (tronco de árbol - alturas >3m, registrado en el tronco de árbol-, tronco de arbusto -leñoso y de altura <3m-, tronco de palma, o entre huecos del tronco), 8) hierba-rasante-matorral (hierba-rasante - no leñoso y < 50 cm-, matorral rasante -conjunto de hierbas y arbustos espesos e intrincados, altura <2m-), 9) ramas (de árbol, arbusto o fuste de hojas de palma). Es necesario aclarar que no todos los hábitats tienen y/o comparten los mismos microhábitats.
o Grado de exposición solar del microhábitat, medida categórica, definido como alto (A) exposición directa a los rayos solares donde la cobertura vegetal fue nula (sin vegetación rasante, ni herbácea, ni arbustiva, ni arbórea), medio (M) exposición parcial a los rayos solares donde exista cobertura vegetal parcial o total (vegetación herbácea o vegetación arbustiva de bajo o mediano porte, arbustiva que permite la entrada de rayos solares filtrados) y bajo/nulo (B) cuando el individuo se encontró completamente oculto debajo de troncos, rocas, en raíces, hendiduras, etc., sin importar los estratos de la vegetación.
Análisis de datos
Con el fin de contrastar y aproximarse a la riqueza de especies que se puede encontrar en cada época climática –seca y de lluvias- en los alrededores del complejo cenagoso de Zapatosa, se realizó una curva de acumulación de especies (Colwell & Coddington 1994), a partir de los estimadores de riqueza no paramétricos Jacknife 1, Jacknife 2 y Bootstrap, usados cuando no se asume homogeneidad ambiental en las muestras -distintos hábitats- (Magurran 2004). Con los valores máximos calculados de riqueza, se determinó el porcentaje de representatividad en cada época climática (Soberón & Llorente 1993). Todos los estimadores se corrieron con 999 permutaciones, se calcularon las especies raras: únicas (singletons) y duplicadas (doubletons), para determinar si se redujeron a medida que el muestreo avanzó; estas pruebas se realizaron mediante el programa EstimateS Win 7.5.0 (Colwell 2005).
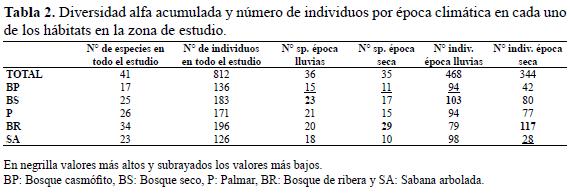
Con el fin de observar si de una estación a otra cambia la composición de especies, se calculó la diversidad alfa acumulada que se considera como el número de especies que se colectó en cada hábitat para cada época climática –seca y de lluvias- en la que se trabajó y se relacionó con la diversidad alfa puntual para ver el grado de permeabilidad de la comunidad en el tiempo (Halffter & Moreno 2005).
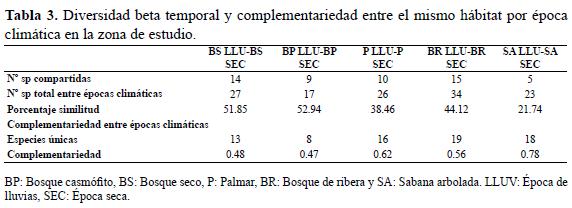
Con el propósito de ver el recambio de especies de un periodo a otro, se calculó la diversidad beta temporal mediante la complementariedad de especies entre el mismo hábitat en épocas climáticas diferentes. La complementariedad temporal hace referencia al grado de disimilitud en la composición de especies de un mismo hábitat entre épocas climáticas distintas (Colwell & Coddington 1994, Magurran 2004, Halffter & Moreno 2005). La variación de los valores oscila entre 0 y 1; a medida que aumenta este valor también aumenta la diferencia entre épocas climáticas. De igual forma, se calculó el porcentaje de complementariedad a partir del número de especies compartidas en épocas climáticas diferentes sobre el número total de especies entre el mismo hábitat por cien; a partir de las especies únicas sobre la riqueza total del ambiente se calculó el grado de disimilitud entre los hábitats en cada época climática (Magurran 2004).
Se analizó la composición, la abundancia y la uniformidad de especies entre épocas climáticas utilizando curvas representativas de diversidad-dominancia (May 1975, Gardner et al. 2007), se comparó la distribución de las curvas mediante una prueba de Kolmogorov-Smirnov (Zar 1998, Magurran 2004), para identificar si los parámetros descriptores que muestran las gráficas son diferentes entre estaciones; se utilizó el programa PAST versión 2.17c-2013 (Hammer et al. 2001).
Para detectar las diferencias en la composición de las especies por hábitat anidado en las épocas climáticas, se realizó un análisis de similitud de dos vías (ANOSIM-2), prueba no paramétrica basada en una medida de distancia, partiendo de una matriz de similitud (en este caso Bray-Curtis, con 10000 iteraciones), entre dos o más grupos, anidados dentro de otro conjunto de datos (Clarke 1993), la cual se calcula inicialmente a partir de la matriz de abundancias por hábitat, haciendo las respectivas asociaciones por época climática; la prueba permite comparar y encontrar la diferencia entre pares de hábitats y periodos de tiempo.
Se calculó la proporción que aporta cada especie de reptil a la diferencia entre épocas climáticas, determinada por el porcentaje de disimilitud de especies de reptiles mediante la subrutina SIMPER del programa estadístico PRIMER versión 5 (Clarke & Gorley 2001).
Se realizaron histogramas de frecuencia usando las horas día-noche de actividad total por hábitat de las especies registradas, teniendo en cuenta solamente si se encontraban activas en cada uno de los hábitats, para mirar si dentro de las horas de actividad diaria se presentan picos de actividad en las especies. También se efectuaron histogramas de frecuencia usando las horas día-noche de actividad en cada época climática para compararlas.
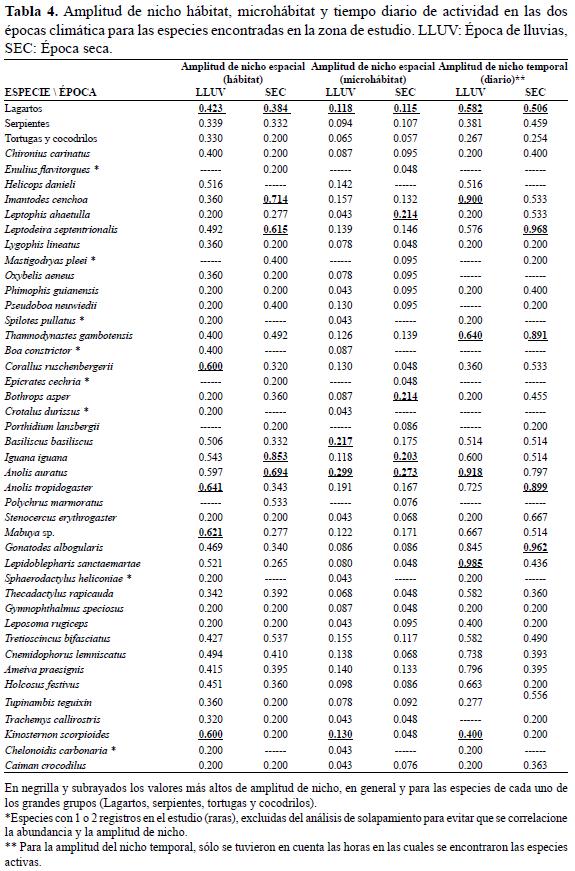
Para saber la manera en el cual las especies utilizan y agregan el uso de los recursos espaciales y temporales, se calculó la amplitud y solapamiento de nicho, es decir: la hora de actividad diaria general para toda la salida y hábitat y microhábitat utilizados por épocas climáticas. Se calcularon los índices sugeridos por Pianka (1973), usando el programa Ecosim versión 7.72 (Gotelli & Entsminger 2009), los algoritmos re-muestrean los datos originales con 1000 iteraciones y a partir de estos datos calculan los índices de amplitud y solapamiento de nicho, reteniendo la estructura de ceros en la matriz para hacer los cálculos más ajustados a la realidad como lo sugieren Winemiller & Pianka (1990). En la estimación del solapamiento de nicho, se utilizaron las especies más comunes (n>5). Se construyeron dendrogramas de similitud para los datos de superposición de hábitat y microhábitat con el programa versión 2.17c-2013 (Hammer et al. 2001). Se compararon las amplitudes de nicho entre épocas climáticas por medio de una prueba de Mann-Whitney (U), para evidenciar si cambian de un periodo a otro con el programa Past versión 2.17c-2013 (Hammer et al. 2001).
Resultados
Riqueza por época climática
En época de lluvias se registraron 468 individuos de reptiles distribuidas en 36 especies, en la época seca fueron 344 individuos de 35 especies. En ambas épocas la familia más rica en especies fue Colubridae con once especies en cada periodo.
Según los estimadores de riqueza Bootstrap, Jacknife 1 y 2, la representatividad del muestreo en época de lluvias osciló entre el 74% y el 90% de las especies esperadas para el estudio (Figura 2), el número de especies observadas no se estabiliza si se le compara con las curvas Jacknife 1 y 2 y Bootstrap (Figura 2). En la medida en que avanzó el muestreo, las especies únicas mostraron una clara reducción en número, mientras que el número de especies duplicadas no bajó, lo cual prueba que faltó mayor eficiencia del muestreo en invierno (Figura 2).
Para la época seca los estimadores de riqueza Bootstrap, Jacknife 1 y 2 mostraron una representatividad del muestreo entre el 84% y el 90% de las especies esperadas para el estudio (Figura 2), el número de especies observadas no se estabiliza si se le compara con las curvas Jacknife 1 y Bootstrap (Figura 2). En la medida en que avanzó el muestreo, las especies únicas y duplicadas no mostraron reducción en número, lo que indica prueba que faltó mayor eficiencia del muestreo en verano (Figura 2).
Diversidad alfa acumulada por hábitat en cada época climática
En la época de lluvias se registró un mayor número de especies e individuos que en verano (Tabla 2). En la época de lluvias el bosque casmófito mostró la mayor riqueza de especies, mientras que en la época seca fue el bosque de ribera (Tabla 2). En cuanto a número de individuos en invierno el bosque seco exhibió una mayor cantidad, mientras que en el verano el bosque de ribera fue el más abundante en individuos (Tabla 2).
La sabana arbolada es el hábitat donde se presentó el mayor cambio en el número de especies e individuos de un periodo climático a otro (Tabla 2). El bosque de ribera fue el único hábitat donde aumentó el número de especies e individuos en la época seca (Tabla 2). El bosque seco conservó en comparación a los demás hábitats la más alta proporción de especies en ambas épocas climáticas frente al total de especies encontradas en todo el muestreo para este hábitat (Tabla 2).
Diversidad beta temporal entre hábitats
El recambio promedio de especies entre épocas climáticas fue de 0.58; el bosque casmófito mostró la mayor similitud y la sabana arbolada presentó la menor (Tabla 3). El mayor número de especies que permanecen de una época a otra se encontró en el bosque de ribera, sin embargo este presentó un alto recambio de especies en proporción de una época a otra (Tabla 3). El bosque de ribera mostró la más alta cantidad de especies únicas que permanecen sin importar el cambio de periodo climático, mientras que el bosque casmófito la más baja cantidad (Tabla 3).
Composición de especies entre épocas climáticas
En composición de especies de reptiles, las épocas climáticas presentaron una alta uniformidad, reflejada en las curvas de diversidad abundancia (Figura 3). Cuando se compararon las curvas entre los periodos climáticos, no se encontró diferencia significativa entre los patrones de distribución (D (m=36, n=35; 0,05)=0.1897; P=0.501).
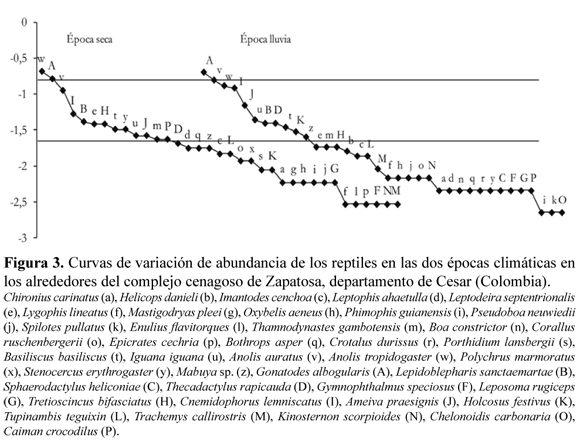
Las especies que dominaron el ensamble fueron Gonatodes albogularis, Anolis tropidogaster y Anolis auratus que se mantuvieron en las posiciones jerárquicas más altas en ambas épocas climáticas (Figura 3). En el periodo seco casi el 80% de las especies raras fueron serpientes, mientras que en la temporada de lluvias este porcentaje descendió hasta un 50% entre lagartos y serpientes; en este último periodo se encontró un mayor número de especies poco comunes a raras (Figura 3).
Como se vio en el capítulo anterior la estructura y la composición de especies de reptiles fue diferente entre hábitats (ANOSIM, R=0.1795; P=0.0057), mientras que no mostró diferencias estadísticamente significativa entre épocas climáticas (ANOSIM, R = 0.092; P = 0.1430). La disimilitud en cuanto a la abundancias y tipo de especies que se presentó entre épocas climáticas fue 34% y las especies que más contribuyeron a esto fueron Ameiva praesignis (SIMPER 6%), Mabuya sp. (SIMPER 5%) y Holcosus festivus (SIMPER 4,9%).
Interacciones dentro de hábitats, microhábitats y tiempo de actividad diario por época climática
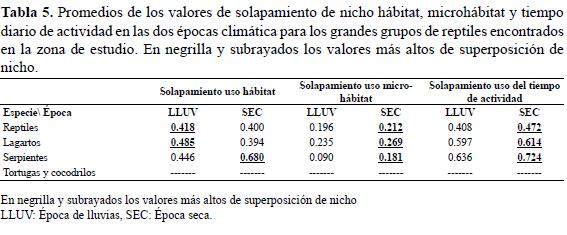
La tendencia en la amplitud del nicho espacial (hábitat y microhábitat) y temporal no se mantuvo de una época a otra, fluctuó entre grupos que aumentaban o disminuían su amplitud de una época a otra (Tabla 4); sin embargo no se presentó diferencia estadísticamente significativa entre periodos climáticos en las dimensiones del nicho espacial y temporal (Hábitat: U(Llu=41,Sec=41; ∞=0,05)=718; P=0.258 / Microhábitat: U(Llu=41,Sec=41; ∞=0,05)=803; P=0.732 / Tiempo diario de actividad: U(Llu=31,Sec=31; ∞=0,05)=455; P=0.725).
Los lagartos mostraron en promedio las mayores amplitudes de nicho en el hábitat, microhábitat y tiempo diario de actividad en época seca y de lluvias. Las especies con la mayor amplitud en el uso de hábitat en invierno fueron los lagartos A. tropidogaster y Mabuya sp. y la serpiente Corallus ruschenbergerii (Tabla 4), en verano fueron la serpiente Imantodes cenchoa y el lagarto Iguana iguana (Tabla 4). La amplitud del uso del microhábitat fue pequeña en comparación a la del hábitat para todas las especies, para la época de lluvias A. auratus y Basiliscus basiliscus presentaron los valores más altos de amplitud (Tabla 4) y para la época seca las serpientes Bothrops asper y Leptophis ahaetulla y de nuevo el lagarto A. auratus fueron las especies con más amplio uso de los microhábitats (Tabla 4). Las especies con la mayor amplitud en el uso del tiempo diario de actividad en invierno fueron los lagartos Lepidoblepharis sanctaemartae y A. auratus y la serpiente I. cenchoa (Tabla 4), en verano fueron la serpiente Leptodeira septentrionalis y el lagarto Gonatodes albogularis (Tabla 4).
La superposición de hábitat entre especies por época climática fue mayor en la temporada seca (verano), prueba de ello es que se agregaron un mayor número de subgrupos con alto grado de coexistencia (>70%) (Figura 4a); por otro lado las especies de reptiles que utilizaron casi el mismo hábitat cambiaron totalmente de una época a otra, por ejemplo en el periodo de lluvias las especies que más se solaparon en utilización de hábitats fueron A. praesignis y H. festivus, A. auratus y Lepidoblepharis sanctaemartae y Thamnodynastes gambotensis y B. basiliscus (Figura 5); mientras que en el periodo seco las especies que más se sobrepusieron en el uso de hábitat fueron L. sanctaemartae y Caiman crocodilus, A. tropidogaster y Tupinambis teguixin y L. ahaetulla y Mabuya sp. (Figura 4a).
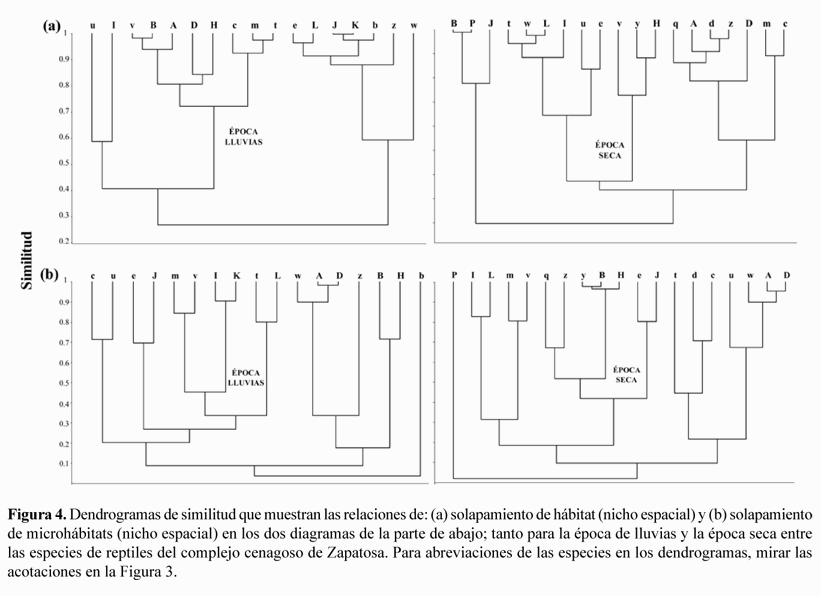
Entre los microhábitats, la superposición al igual que entre hábitats fue mayor en la época seca, donde hay un mayor número de subgrupos con alto solapamiento (>70%) (Figura 4b); las especies de reptiles que usaron el mismo microhábitat se mantienen de un periodo a otro o por lo menos la relación en la superposición permanece muy similar entre épocas. Pero no en todos los casos aumenta la superposición en el uso del microhábitat del periodo de lluvias al seco por ejemplo G. albogularis y T. rapicauda o T. gambotensis y A. auratus grupos de especies que se encontraron muy relacionados en ambos periodos climáticos, en la época seca se solaparon menos que en la época de lluvias (Figura 4b).
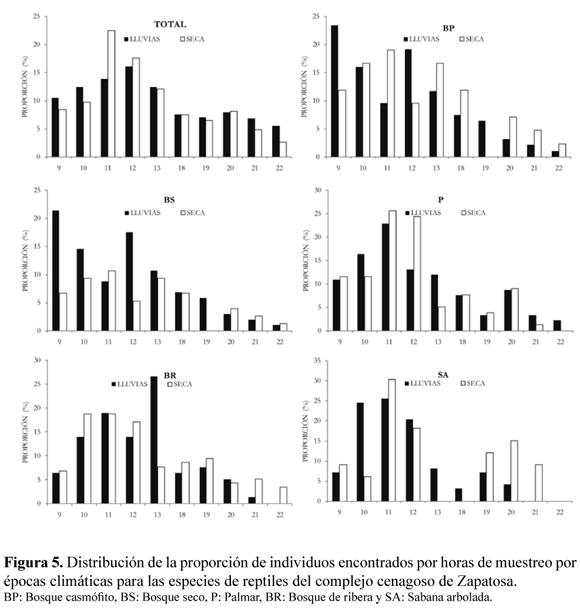
Las horas de actividad mantuvieron una tendencia general igual entre épocas climáticas diferentes (Figura 5). En el día la actividad se concentró entre las 11 y 12 h, mientras que en la noche se agrupó a las 20 h. El uso de las horas a lo largo del día en el palmar, el bosque de ribera y la sabana arbolada presentaron un patrón similar a la tendencia general y por época climática, mientras que en el bosque casmófito y el bosque seco se concentra la mayor actividad de reptiles en las primeras horas de muestreo (Figura 5).
Para cada uno de los hábitats sucedió algo diferente, el bosque casmófito y el bosque seco presentaron dos picos de actividad a las 9 h y a las 12 h en la temporada de lluvias mientras que en la temporada seca la mayor actividad la mostraron a las 11 y 13 h; el bosque de ribera expresó los mismos dos picos de actividad pero en época de lluvias mientras que en época seca se comportó de igual forma que el patrón general; la sabana arbolada presentó un comportamiento parecido al general, sin embargo tanto en invierno como en verano la mayor actividad se dio alrededor de las 11 h; el palmar siguió exactamente el mismo comportamiento general en ambas épocas climáticas (Figura 5).
La superposición en el uso del hábitat en general para los reptiles y los lagartos fue mayor en época de lluvias y para las serpientes fue más alta en época seca (Tabla 5). El uso del microhábitat presentó mayor superposición en la época seca (Tabla 5). Los lagartos usan en mayor proporción entre especies de forma similar el tiempo (Tabla 5).
DISCUSIÓN
Los reptiles que habitan los bosques son más sensibles a las altas temperaturas en las épocas secas de tierras bajas en los trópicos (Huey et al. 2009), lo cual pudo influir en que en la época seca se encontraran menos especies e individuos, al ser menos conspicuas las especies que, en busca de refugio, estivaron o adoptan otras estrategias para poder termorregular adecuadamente; la temperatura ambiente parece ser el factor limitante más importante en periodos secos, donde la ausencia de agua y menor evapotranspiración favorecen temperaturas más alta (Brown & Shine 2002, Huey et al. 2009).
Contrariamente a lo habitual en regiones subtropicales, en esta investigación se encontró una mayor diversidad de reptiles en el invierno frente al verano, esto se puede explicar principalmente por fenómenos como la estabilidad media en los recursos, persistencia en general de las condiciones ambientales, temperaturas que no descienden drásticamente, y a la explosión demográfica que se presenta al principio de las lluvias, asociadas con la abundancia de presas para los neonatos (Villavicencio et al. 2002, Duellman 2005, Nemes et al. 2006).
La composición y estructura de la comunidad de reptiles cambió poco de una época climática a otra y como tendencia general parecen permanecer estables en el tiempo; sin embargo algunas especies cambian notablemente su abundancia, especies como Ameiva praesignis, H. festivus y Mabuya sp. pasaron de ser más conspicuas y con mayores amplitudes en el uso del hábitat y el microhábitat en invierno, a reducir notablemente su actividad y abundancia en época seca. Parecería que por ser una especie más de interior de bosque A. festiva, no debiera verse afectada por los cambios de temperatura media ambiental de una época climática a otra, sin embargo como señalan Huey et al. (2009), algunas especies de bosque responden marcadamente a los veranos contrayendo sus poblaciones como una tendencia generalizada para el trópico.
Este comportamiento es extraño para las otras dos especies, si se tiene en cuenta que por ejemplo Mabuya sp. es considerada una especie generalista, de amplia tolerancia a los cambios ambientales y amplio uso de hábitats y microhábitats (Medina-Rangel 2011) y sin embargo redujo la frecuencia de aparición y uso espacial entre épocas climáticas, tendencia que muestra que aun especies con aparente amplia tolerancia ecológica, fluctúan al azar ante los cambios climáticos que se presentan de una época a otra.
En el caso de A. praesignis, redujo su frecuencia de aparición y la amplitud en el uso del hábitat y el microhábitat de un periodo en apariencia más frio a uno más cálido; tendencia que se puede explicar porque a pesar de ser una especie heliotérmica con amplio uso de ambientes abiertos y bordes de bosques, que muestra una fuerte restricción térmica a ambientes cerrados y necesidades de altas temperaturas (Sartorius et al. 1999), presenta límites ecomorfológicos para termorregular adecuadamente, por lo cual como en otras localidades estudiadas (Blázquez 1996, Sartorius et al. 1999), pudo haber cambiado las horas de actividad a media tarde en época seca donde la intensidad lumínica y la temperatura a medio día le son más desfavorables; y si se tiene en cuenta que en las horas de media tarde no se muestreó, se entiende por qué su frecuencia de aparición es aparentemente baja en la época seca.
Las especies de reptiles usaron hábitats más favorables para su permanencia cuando las condiciones climáticas cambiaron, los bosques de ribera mostraron estabilidad climática o por lo menos microclimática; evidencia de ello es que en épocas de sequía fueron los únicos sitios que permanecieron con elementos verdes en la vegetación y presentaron la mayor diversidad de reptiles; puede ser que la continuidad y la presencia constante de agua en el bosque de ribera, favorezca que en periodos más cálidos los reptiles provenientes de otros ambientes ocupen este hábitat y aprovechen los recursos que se mantienen dentro del mismo para termorregular y forrajear de forma óptima; además, la continuidad en el espacio y tiempo del bosque de ribera permite un intercambio de especies constante con los hábitats contiguos, ya que las corrientes permanentes de agua que sustentan bosques con buen follaje a su alrededor, presentan la mayoría del tiempo una alta cantidad de especies en términos generales (Paton 2005, Bauer & Jackman 2008, Pauwells et al. 2008).
Los reptiles en general, mostraron una mayor amplitud en el uso del tiempo y el espacio en época de lluvias, los recursos y las condiciones ambientales de esta temporada deben beneficiar un mayor despliegue por parte de las especies, en búsqueda de explotarlos y usarlos de forma eficiente cuando les son favorables los factores ambientales. El uso y la superposición espacial de hábitats exhibieron un mayor cambio de una época climática a otra y una tendencia diferente entre lagartos y serpientes. Debido a las variaciones que se presentan en la gama de recursos, aumenta la amplitud en el uso de los hábitats para los lagartos en la época seca y lo contrario pasa con las serpientes, generando la tendencia observada de mayor superposición en la época de lluvias para los lagartos y menor para las serpientes en el mismo periodo. Para los microhábitats fue más baja la variabilidad y similar para todos los grupos, condición que refleja la alta fidelidad de los reptiles por los espacios específicos de subsistencia. No obstante, puede que reemplacen los microhábitats en periodos de tiempo diferente dentro de distintos hábitats; si se piensa que las especies de reptiles presentan bajos rangos de acción, el cambio y uso de una mayor gama de recursos seguramente les obliga a cambiar de espacio, para aprovechar de forma más eficiente la variación de los recursos dentro de los diferentes hábitats.
Las serpientes responden de forma diferente a los demás grupos de reptiles ante los cambios de época climática, reducen su frecuencia de aparición y amplitud en el uso del macro-espacio (hábitat), mientras que aumentan la amplitud en el uso del micro-espacio (microhábitat) y el tiempo en época seca. Se observa que los periodos más secos les son desfavorables en el uso y ocupación de algunos hábitats; puede ser que el paso de un sitio a otro resulte más difícil, ya que expone a mayor riesgo a los individuos al convertirse en presas de otras especies que también ven reducidos sus recursos (Carfagno & Weatherhead 2006, Plummer 2010). Además, la explosión en las poblaciones que son potenciales presas de las serpientes en época de lluvias y dada la fuerte relación del grupo de serpientes con la dinámica poblacional de sus presas (Brown & Shine 2002, Duellman 2005, Brischoux et al. 2009), permite al grupo un mayor uso de ambientes distintos, menor tiempo de forrajeo con mejores resultados en la obtención del recurso alimenticio y por ende una más baja superposición del uso en los diferentes hábitats en este periodo climático.
Las tendencias en el uso y la superposición del tiempo de actividad diaria fueron similares a las encontradas en otros estudios en el trópico (Duellman 2005, Vitt & Vangilder 1983, Vitt et al. 1997, Vitt et al. 2003, Wasko & Sasa 2009), donde los picos de actividad se encuentran entre las 10 y 13 horas. Los lagartos son las especies más abundantes en estos periodos de tiempo, mientras que en las horas de la noche entre las 19 y 21 horas las especies de serpientes son más frecuentes; las especies similares morfológicamente y cercanas filogenéticamente utilizan periodos de tiempo diarios muy similares, sin embargo se distribuyen diferencialmente en el espacio, reduciendo así la competencia entre ellos (Pianka 1973, Vitt & Pianka 2004, 2005). En épocas climáticas distintas, la disposición en el uso del tiempo de actividad diario de las especies entre los hábitats parece ser afectada por las nuevas condiciones climáticas que se imponen, por lo cual en la época de mayor radiación solar en los sitios más abiertos, la actividad se concentró hacia horas más tempranas de la mañana, pero permaneció con el mismo patrón general por las noches.
Para concluir, podemos afirmar que los bosques de ribera del complejo cenagoso de Zapatosa están sirviendo de reservorios para especies de reptiles que buscan condiciones favorables para termorregular, desarrollar sus actividades diarias, refugiarse y alimentarse, entre otras. Además, la tendencia general en la composición y la estructura de la comunidad de reptiles poco cambia entre épocas climáticas (época seca y época de lluvias); sin embargo se presenta una mayor diversidad en el periodo de lluvias donde la abundancia de algunas especies aumenta claramente (p.e. A. praesignis, Mabuya sp. y H. festivus).
Los reptiles del complejo cenagoso de Zapatosa, mostraron en general una mayor amplitud en el uso del tiempo y el espacio en época de lluvias; el uso y la superposición temporal y espacial en los hábitats presentaron un mayor cambio de una época climática a otra, mientras que en los microhábitat fue muy baja la variabilidad en el uso y superposición. Finalmente, las serpientes reaccionan de modo diferente a los demás grupos de reptiles en cuanto a la amplitud de uso del microhábitat y el tiempo.
AGRADECIMIENTOS
Al grupo de Biodiversidad y Conservación del Instituto de Ciencias Naturales y CORPOCESAR por el apoyo y financiación del presente estudio. A J. Orlando Rangel-Ch., Olga Victoria Castaño y Gladys Cárdenas por su apoyo y valiosas sugerencias durante el desarrollo del presente estudio. A Jimena Cortés y Juan Carvajal por su apoyo en campo durante el muestreo. Al grupo de reptiles del ICN por sus oportunas y valiosas sugerencias. A las personas de Chimichagua, Saloa, Potrerillo y La Loma que me apoyaron y recibieron con cariño durante mi fase de campo en la zona; en especial al señor Saúl Reyes y su familia, Germán Payán e hijo, señora Kelly y su familia, Juan Carlos Moreno, Luis Pérez, Elizabeth Reales y Rodolfo Cabrales que con su hospitalidad y cariño hicieron mejor la estadía. A los evaluadores anónimos por sus valiosos comentarios y sugerencias al texto.
LITERATURA CITADA
1. Bauer, A. M & T. Jackman. 2008. Global diversity of lizards in freshwater (Reptilia: Lacertilia). Hydrobiologia 595:581–586. [ Links ]
2. Begon, M. & J. L. Harper. 1999. Ecología. Mac Graw-Hill. México. 1148 pp. [ Links ]
3. Blázquez, M. C. 1996. Activity and habitat use in a population of Ameiva ameiva in southeastern Colombia. Biotrópica 28 (4b): 714-719. [ Links ]
4. Brischoux, F., X. Bonnet & R. Shine. 2009. Determinants of dietary specialization: a comparison of two sympatric species of sea snakes. Oikos 118: 145-151. [ Links ]
5. Brown, G. P. & R. Shine. 2002. Influence of weather conditions on activity of tropical snakes. Austral Ecology 27: 596–605 [ Links ]
6. Carfagno, G. L.F. & P. J. Weatherhead. 2006. Intraspecific and interspecific variation in use of forest-edge habitat by snakes. Canadian Journal of Zoology 84 (10): 1440–1452. [ Links ]
7. Chruszcz, B. J. & R. M. R. Barclay. 2002. Thermoregulatory ecology of a solitary bat, Myotis evotis, roosting in rock crevices. Functional Ecology 16:18–26. [ Links ]
8. Clarke, K. R. 1993. Non-parametric multivariate analysis of changes in community structure. Australian Journal of Ecology 18:117-143. [ Links ]
9. Clarke, K. R. & Gorley, R. N. 2001. Primer v5: user manual/tutorial. Primer-E Ltd., Plymouth. [ Links ]
10. Colwell, R. K. 2005. EstimateS: Statistical estimation of species richness and shared species from samples. User's guide and application. Version 7.5. Department of Ecology and Evolutionary Biology, University of Connecticut, Storrs. Available from: http://purl.oclc.org/estimates. [ Links ]
11. Colwell, R. K. & J. A. Coddington. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of the Royal Society of London - Series B: Biological Sciences 345:101-118. [ Links ]
12. Crump, M. L. 1971. Quantitative analysis of the ecological distribution of tropical herpetofauna. Occasional Papers of the Museum of Natural History University of Kansas 3: 1-62. [ Links ]
13. Crump, M. L. & N. J. Scott. 1994. Visual encounters surveys. Págs. 354-352, en: W. Heyer, M. Donelly, R. McDiarmid, L. Hayek & M. Foster (eds.). 1994. Measuring and monitoring biological diversity, standard methods for amphibians. Smithsonian Institution Press, Washington D.C. y Londres. [ Links ]
14. Duellman, W. E. 2005. Cuzco Amazonico, the lives of amphibians and reptiles in an Amazonian rainforest. Comstock publishing associates, Cornell University Press, Ithaca y Londres. 433 pp. [ Links ]
15. Gardner, T. A., M. A. Ribeiro-Junior, J. Barlow, T. C. S. Ávila-Pires. M. S. Hoogmoed & C. A. Pérez. 2007. The value of primary, secondary, and plantation forests for a Neotropical herpetofauna. Conservation Biology 21 (3): 775-787. [ Links ]
16. González-Megías, A., J. M. Gómez & F. Sánchez-Piñero. 2007. Diversity-habitat heterogeneity relationship at different spatial and temporal scales. Ecography 30: 31-41. [ Links ]
17. Gotelli, N. J. & G. L. Entsminger. 2009. EcoSim: Null models software for ecology. Version 7. Acquired Intelligence Inc. & Kesey-Bear. Jericho, VT 05465. http://garyentsminger.com/ecosim.htm. [ Links ]
18. Gregory, P. T., J. M. MaCartney & K. W. Larsen. 1987. Spatial patterns and movements, Págs.. 366–395, en: R. A. Seigel, J. T. Collins & S. S. Novak (eds.).Snakes: Ecology and Evolutionary Biology. Macmillan, Nueva York. [ Links ]
19. Halffter, G. & C. E. Moreno. 2005. Significado biológico de las diversidades Alfa, Beta y Gamma. Págs. 5-18, en: G. Halffter, J. Soberón, P. Koleff & A. Meliá (eds.), Sobre Diversidad Biológica: el significado de las diversidades Alfa, Beta y Gamma. Volumen 4. Monografías tercer milenio, Zaragoza. [ Links ]
20. Hammer, O., D. T. A. Harper & P. D. Ryan. 2001. Past: Paleontological statistics software package for education and data analysis. Paleontologia Electronica 4 (1): 1-9. Past version 1.90, abril 2009. [ Links ]
21. Heyer, W, M. Donelly, R. McDiarmid, L. Hayek & M. Foster (eds.). 1994. Measuring and monitoring biological diversity, standard methods for amphibians. Smithsonian Institution Press. Washington D.C. y Londres. 349 pp. [ Links ]
22. Huey, R. B. 1991. Physiological consequences of habitat selection. The American Naturalist 137: 91–115. [ Links ]
23. Huey, R. B., C. A. Deutsch, J. J. Tewksbury, L. J. Vitt, P. E. Hertz, H. J. Álvarez-Pérez & T.Garland Jr. 2009. Why tropical forest lizards are vulnerable to climate warming? Proceedings of the Royal Society B: Biological Sciences 276: 1939–1948. [ Links ]
24. Kearney, M. & M. Predavec. 2000. Do nocturnal ectotherms thermoregulate? A study of the temperate gecko Christinus marmoratus. Ecology 81:2984–2996. [ Links ]
25. Magurran, A. E. 2004. Measuring biological diversity. Blackwell Publishing. 257 pp. [ Links ]
26. May, R. M. 1975. Patterns of species abundance and Diversity. Págs. 81-120, en: M. L. Cody & J. M. Diamond (eds.), Ecology and evolution of communities. Belknaps Press, Harvard, Massachusetts. [ Links ]
27. Medina-Rangel, G. F. 2011. Diversidad alfa y beta de la comunidad de reptiles en el complejo cenagoso de Zapatosa, Colombia. Revista de Biología Tropical 59 (2): 935-968. [ Links ]
28. Melville, J., & J. A. Schulte II. 2001. Correlates of active body temperatures and microhabitat occupation in nine species of central Australian agamid lizards. Austral Ecology 26: 660-669. [ Links ]
29. Nemes, S., M. Vogrin, T. Hartel & K. Öllerer. 2006. Habitat selection at the sand lizard (Lacerta agilis): ontogenetic shifts. North-Western J. Zoology 2 (1): 17-26. [ Links ]
30. Paton, P. W. C. 2005. A review of vertebrate community composition in seasonal forest pools of the northeastern United States. Wetlands Ecology and Management 13: 235–246 [ Links ]
31. Pauwells, O. S. G., Van Wallach & P. David. 2008. Global diversity of snakes (Serpentes; Reptilia) in freshwater. Hydrobiologia 595: 599–605. [ Links ]
32. Pianka, E. R. 1973. The structure of lizard communities. Annu. Rev. Ecol. Syst. 4: 53-74. [ Links ]
33. Plummer, M. V. 2010. Habitat use and movements of Kingsnakes (Lampropeltis getula holbrooki) in a partially abandoned and reforested agricultural landscape. Herpetological Conservation and Biology 5 (2): 214-222. [ Links ]
34. Quirt, K. C., G. Blouin-Demers, B. J. Howes & S. C. Lougheed. 2006. Microhabitat Selection of Five-Lined Skinks in Northern Peripheral Populations. Journal of Herpetology 40 (3): 335–342. [ Links ]
35. Rahbek, C. 2005. The role of spatial scale and the perception of large-scale species-richness patterns. Ecology Letters 8: 224-239. [ Links ]
36. Rangel-Ch., J. O., P. Lowy-C. & M. Aguilar. 1997. Colombia Diversidad Biótica II. Tipos de Vegetación de Colombia. Instituto de Ciencias Naturales. Universidad Nacional de Colombia-IDEAM. Bogotá D. C. 436 pp. [ Links ]
37. Rangel-Ch., J. O., H. Garay-Púlido, E. Herrera & A. Avella-Muñoz. 2008b. Bosques húmedos y secos circundantes a los complejos de humedales de la ciénaga de Zapatosa, departamento del Cesar, Colombia, en: J. O. Rangel-Ch. (ed.). Estudio de inventario de fauna y flora, descripción biofísica y línea base ambiental Ciénaga de Zapatosa. Convenio interadministrativo CORPOCESAR-Universidad Nacional de Colombia. Facultad de Ciencias. Instituto de Ciencias Naturales. Grupo de Biodiversidad y Conservación. Bogotá D. C. (Documento inédito). 500 pp. [ Links ]
38. Sartorius, S. S., L. J. Vitt & G. R. Colli. 1999. Use of naturally and antropogenically disturbed habitats in Amazonian rainforest by the teiid lizard Ameiva ameiva. Biological Conservation 90: 91-101. [ Links ]
39. Sexton, O. J., J. Bauman & E. Ortleb. 1972. Seasonal food habits of Anolis limifrons. Ecology 53: 182-186. [ Links ]
40. Soberón, J. M. & J. Llorente. 1993. The use of species accumulation functions for the prediction of species richness. Conservation Biology 7: 480–488. [ Links ]
41. Villavicencio, J., J. C. Acosta, M. C. Cánovas & J. A. Marinero. 2002. Patrones de actividad diaria y estacional de Liolaemus pseudoaniomalus (Squamata: Tropiduridae) en el centro-oeste de Argentina. Multequina (11): 51-60. [ Links ]
42. Vitt, L. J. & L. D. Vangilder. 1983. Ecology of a snake community in north-eastern Brazil. Amphibia- Reptilia 4: 273-296. [ Links ]
43. Vitt, L. J., Caldwell, J. P. Zani, P. A. & T. A. Titus. 1997. The role of habitat shifts in the evolution of lizards morphology: Evidence from tropical Tropidurus. Proceedings of the National Academy of Sciences of the United States of America 94: 3828-3832. [ Links ]
44. Vitt, L. J., T. C. S. Avila-Pires, P. A. Zani, Shawn S. Sartorius, & M. C. Espósito. 2003. Life above ground: ecology of Anolis fuscoauratus in the Amazon rain forest, and comparisons with its nearest relatives. Canadian Journal of Zoology 81: 142–156. [ Links ]
45. Vitt, L. J. & E. R. Pianka. 2004 Historical Patterns in Lizard Ecology: What teiids can tell us about lacertids. Págs. 139-157, en: V. Pérez-Mellado, N. Riera & A. Perera (eds.) The Biology of lacertid lizards. evolutionary and ecological perspectives. Institut Menorqui' d'Estudis, Recerca, 8. [ Links ]
46. Vitt, L. J. & E. R. Pianka. 2005. Deep history impacts present-day ecology and biodiversity. Proceedings of the National Academy of Sciences of the United States of America 102 (22): 7877–7881. [ Links ]
47. Wasko, D. K. & M. Sasa. 2009. Activity Patterns of a neotropical ambush predator: spatial ecology of the Fer-de-lance (Bothrops asper, Serpentes: Viperidae) in Costa Rica. Biotropica 41(2): 241–249. [ Links ]
48. Winemiller, K. O. & E. R. Pianka. 1990. Organization in natural assemblages of desert lizards and tropical fishes. Ecological Monographs 60: 27-55. [ Links ]
49. Zar, J. H. 1998. Bioestatistical analysis. 4th edition. Prentice Hall, New Jersey, 929p. [ Links ]