Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232
Caldasia vol.35 no.2 Bogotá July/Dec. 2013
DIANA GÓMEZ-FERNÁNDEZ
SANTIAGO CASTAÑO
LEONARDO FIERRO
INGE ARMBRECHT
HELBERG ASENCIO-SANTOFIMIO
Grupo de Farmacología Univalle, Escuela de Ciencias Básicas, Facultad de Salud, Universidad del Valle, Cali, Colombia.
Grupo de Farmacología Univalle, Escuela de Ciencias Básicas, Facultad de Salud, Universidad del Valle, Cali, Colombia. Facultad de Ciencias de la Salud, Grupo de Investigación Biomédica, Universidad ICESI, Cali, Colombia.
Grupo de Farmacología Univalle, Escuela de Ciencias Básicas, Facultad de Salud, Universidad del Valle, Cali, Colombia.
Departamento de Biología, Facultad de Ciencias Naturales y Exactas, Universidad del Valle, Cali, Colombia.
Grupo de Farmacología Univalle, Escuela de Ciencias Básicas, Facultad de Salud, Universidad del Valle, Cali, Colombia. Grupo de Investigación en Ciencias Básicas y Clínicas, Departamento de Ciencias Básicas de la Salud, Facultad de Ciencias de la Salud, Pontificia Universidad Javeriana, Cali, Colombia. hasantofimio@javerianacali.edu.co
RESUMEN
Andinobates minutus es una especie de la familia Dendrobatidae con una amplia distribución en Colombia, presenta algunos tipos de alcaloides lipofílicos y su dieta no ha sido caracterizada. En este estudio se describe la dieta de una población de A. minutus proveniente de la isla La Palma (Buenaventura, Colombia). El estudio de 59 contenidos estomacales muestra que la dieta está compuesta por artrópodos de las clases Crustacea, Arachnida e Insecta. En los contenidos estomacales se encontraron 1336 presas enteras pertenecientes a 29 categorías de presa. Los individuos se contaron y midieron en ancho y largo para calcular su volumen con la fórmula del elipsoide; además, se estimó la frecuencia. Las categorías de presa más importantes, de acuerdo con el Índice de importancia (I) fueron: Acari (I= 86,31), larvas de Insecta (I= 30,97) y Formicidae (I= 26,52).
Palabras clave. Andinobates minutus, Dendrobatidae, dieta, artrópodos, Costa Pacífica colombiana.
ABSTRACT
Andinobates minutus is a species belonging to the Dendrobatidae family with a relatively widespread distribution in Colombia. It has some classes of lipophilic alkaloids in its skin and its diet is completely unknown. In this work, the diet of a population of this amphibian, found in La Palma Island ( Buenaventura, Colombia), was studied. Based on the analysis of 59 gut contents, the diet of this tropical frog seems to be composed mainly of small preys. The main classes of arthropods were Crustacea, Arachnida and Insecta. A total of 1336 prey gut contents belonging to 29 prey categories were found. All individuals were counted and measured in length and width to obtain their volume using the ellipsoid equation; also, the frequency of occurrence was estimated. According to the index of importance (I), the most important prey categories were Acari (I= 86,31), Insect larvae (I= 30,97) and Formicidae (I= 26,52).
Key words. Andinobates minutus, Dendrobatidae, diet, arthropods, Colombian Pacific Coast.
Recibido: 11/02/2012
Aceptado: 15/08/2013
INTRODUCCIÓN
La dieta, además de aportar los requerimientos energéticos para las diferentes actividades de los individuos (Menéndez-Guerrero 2001), está involucrada en algunos mecanismos de defensa a través de la síntesis o la bioacumulación de metabolitos (Summers & Clough 2001). La defensa de algunos anfibios se relaciona con la presencia de sustancias tóxicas (Daly et al. 1987, Duellman & Trueb 1994), las cuales pueden ser producidas por el organismo (fuente endógena) o ser obtenidas por otros organismos y acumuladas en la piel (fuente exógena) (Darst et al. 2005). Existe evidencia de que algunos tipos de alcaloides presentes en ranas venenosas Neotropicales provienen de fuentes exógenas, tal y como se ha demostrado en ciertas especies de dendrobátidos, en las que no existen enzimas asociadas con la síntesis o metabolismo de alcaloides pero en cambio, presentan un sistema altamente eficiente en la acumulación de alcaloides obtenidos a través de la alimentación (Daly et al. 1994a, 1994b, 2000, 2002, 2003; Spande et al. 1999; Saporito et al. 2004).
Las ranas de la familia Dendrobatidae son llamadas venenosas o de colores, debido a su coloración aposemática o de advertencia. Esta familia consta de 177 especies (Frost 2013) y se distribuye desde Nicaragua hasta Brasil y el norte de Perú y Bolivia (Duellman 1978, 1992). Son anfibios por lo general diurnos, existiendo una relación entre su condición aposemática y la capacidad para almacenar potentes toxinas en la piel como estrategia defensiva contra agresores potenciales o depredadores (Summers & Clough 2001).
Andinobates minutus Shreve 1935 es una de las especies más pequeñas de la familia Dendrobatidae, la longitud de los adultos se encuentra entre 12 y 15.5 mm. Poseen la piel del dorso algo granulosa y no tienen tubérculo tarsal. Su color es dorsolateralmente negro o café con naranja, oro o amarillo y con una franja incompleta lateral; usualmente sin franja media dorsal, granos ventrales azules o blancos, sin amarillo en el vientre y con homosterno presente (Silverstone 1975). Su distribución incluye la vertiente occidental de la Cordillera Occidental de Colombia (departamentos del Valle del Cauca, Antioquia, Cauca y Chocó), por debajo de los 1000 m (Ruiz et al. 1996), encontrándose en zonas como bosque húmedo tropical, bosque muy húmedo tropical y bosque pluvial tropical (Silverstone 1975). Presenta toxinas cutáneas compuestas por alcaloides con base de piperidina, principalmente de los tipos pumiliotoxina (PTX) A y decahidroquinolina (DHQ) (Daly et al. 1987). De acuerdo al Libro Rojo de los Anfibios del Valle del Cauca (Castro-Herrera & Bolívar-Garcia 2010) A. minutus no aparece en las listas de especies en peligro o amenazadas. El presente trabajo pretende conocer la dieta de A. minutus en un bosque húmedo tropical de la isla La Palma, Colombia.
MATERIALES Y MÉTODOS
Área de estudio
El estudio fue realizado en un bosque de la isla La Palma (3º 53'N, 77º 21'O). Esta isla pertenece a la Bahía de Málaga, departamento del Valle del Cauca, Colombia. El relieve de la isla es poco pronunciado y presenta bosque húmedo tropical (Cantera & Blanco-Libreros 1995), con una humedad relativa alta (90%). El patrón anual de pluviosidad es bimodal y se distinguen dos períodos de abundantes lluvias: de abril a mayo y de octubre a diciembre con un promedio de precipitación anual de 6000 mm3/año (Cantera et al. 1998). Entre las familias de plantas más abundantes en el bosque se encuentran Bromeliaceae, Melastomataceae, Fabaceae y Araceae, además de Cyclanthaceae, Crysobalanaceae, Maranthaceae, Arecaceae, Moraceae, Rubiaceae y algunos helechos (Vásquez, Ana, com. pers.). El bosque presenta suelo cubierto con una abundante capa de hojarasca proveniente de desechos de árboles, hojas, ramas y frutos.
Captura de animales
Los individuos de A. minutus fueron recolectados manualmente entre las 09:00 y las 11:00 h, luego de su tiempo de mayor actividad de alimentación (Osorio 2003) a través de transectos para inspección por encuentro visual (IEV, Pearman et al. 1995). Se hicieron dos muestreos: el 13 de agosto de 2005 y el 1 de marzo de 2006. Un total de 60 individuos de A. minutus sin distinción entre machos y hembras fueron recolectados en los dos días de muestreo. Los especímenes capturados fueron eutanizados en hielo seco en el menor tiempo posible después de su captura (entre 30-60 minutos) ya que las bajas temperaturas disminuyen la tasa metabólica e inactivan los sistemas homeostáticos deteniendo el proceso de digestión (Daly et al. 1987).
Análisis del contenido estomacal e identificación de artrópodos
En el campo, cada individuo fue diseccionado a través de una incisión desde la cintura escapular hasta la porción terminal del abdomen, luego todo el tracto digestivo fue depositado en tubos Eppendorf de 1,5 mL con etanol absoluto. En el laboratorio, los contenidos fueron dispersados sobre cajas de Petri con etanol absoluto y su posterior identificación y clasificación se hizo empleando un microscopio de disección marca Nikon. La identificación taxonómica se realizó siguiendo a Borror et al. (1992) y Fernández (2003). Las presas fueron identificadas hasta la menor categoría taxonómica posible, usualmente orden aunque algunos ítems, particularmente Hymenoptera, Diptera, Hemiptera, Thysanoptera y Coleoptera fueron identificados hasta familia. En el caso de Formicidae la identificación se hizo hasta género. Presas incompletas o parcialmente digeridas no fueron tomadas en cuenta para la identificación. Para conocer la contribución de cada categoría de presa a la dieta total se calculó el Índice de Importancia (I) (Biavati et al. 2004):
I = (FO% + N% + V%) / 3
donde, FO% = Porcentaje de Ocurrencia
N% = Porcentaje Numérico
V% = Porcentaje Volumétrico
La frecuencia de ocurrencia (FO) de las diferentes categorías de la dieta corresponde al número de estómagos que contienen cada tipo de categoría de presa, N es el número total de las presas de cada categoría y V es el volumen total de las presas de cada categoría. El volumen de cada presa fue estimado usando la fórmula volumétrica del elipsoide, de acuerdo con Dunham (1983):
V = 4/3 π (a / 2) x (b / 2) 2
donde, a = Largo de la presa
b = Ancho de la presa
Las presas fueron medidas con un micrómetro ocular (aproximación de 0,01 mm), para el largo de cada presa no se tuvieron en cuenta antenas, mandíbulas, patas u ovipositores y el ancho se midió en el punto medio del cuerpo (Darst et al. 2005)
RESULTADOS
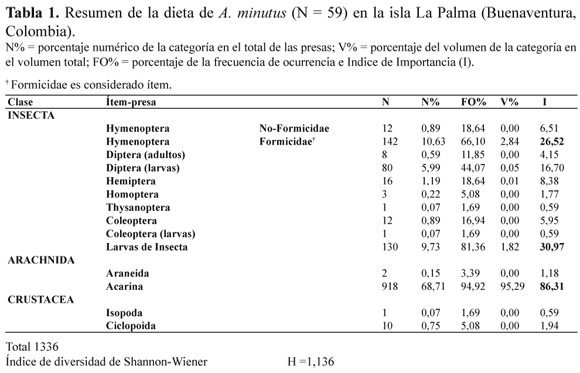
Un total de 60 individuos de A. minutus fueron recolectados en los dos días de muestreo. En la disección de los estómagos solo uno se encontró vacío por lo cual fue excluido del análisis de la dieta. El espectro trófico de A. minutus está integrado por 1336 ítems presa, con un promedio de presas de 22.6 por estómago, pertenecientes a los ordenes Crustacea, Arachnida e Insecta. Se observó un dominio numérico y volumétrico de Acarina (68 % y 95,29 %, respectivamente), seguido en importancia por Formicidae (10,63% y 2,84 %, respectivamente ) y Larvas de insecta (9.73% y 1,82 %, respectivamente) (Tabla 1) Teniendo en cuenta el Índice de Importancia, las presas que más aportan a la dieta de A. minutus son: Acarina (86.31), Larvas de Insecta (30.97) y Formicidae (26.52) debido a que son las que presentan mayor número de individuos, mayor frecuencia de aparición y también mayor volumen.
DISCUSIÓN
Los resultados muestran que A. minutus posee un consumo mayoritario de Acarina, larvas de Insecta y Formicidae en relación a los otros ítems. En este sentido, Valderrama-Vernaza et al. (2009) y Toft (1980, 1981) identifican dos patrones principales de alimentación en anuros tropicales: los "especialistas en hormigas" y los "no-especialistas. En cambio, Caldwell (1996) demuestra que los dendrobátidos de los géneros Dendrobates y Epipedobates consumen principalmente ácaros después de hormigas. Los ácaros hallados son sumamente pequeños y en cada estómago en particular fueron encontrados en grandes cantidades. Los ácaros están entre los artrópodos más comunes encontrados en el suelo y hojarasca de muchas áreas tropicales (Simon & Toft 1991), por lo tanto, el alto consumo de esta puede estar ligado a la abundancia del recurso en el medio y el hecho de que estén disponibles para depredadores de cualquier tamaño puede explicar su ubicuidad en los estómagos, lo que pudiera explicar este resultado. De esta manera, si se consideran los hábitos terrestres y el pequeño tamaño corporal de A. minutus, el grado de acarifagia en la rana no resulta inesperado. Formicidae fue la segunda categoría de presa más importante para este anfibio, lo que puede estar determinado por su alta diversidad y abundancia en casi todo tipo de ambientes (Hölldobler & Wilson 1990), con cerca de 14 000 especies conocidas en el mundo. Muchas de estas especies están presentes en casi todos los ecosistemas de la región Neotropical (Fernández 2003) y junto con las termitas, pueden llegar a constituir un tercio de la biomasa animal de estas áreas (Fittkau & Klinge 1973). El pequeño tamaño de las hormigas también debió repercutir en los datos obtenidos, pues esta característica les permite entrar en hendiduras o microambientes como corteza y raíces de árboles o entre partículas de la hojarasca, que se corresponden con los lugares en donde se encontró forrajeando a las ranas. También podría ser consecuencia de una correlación positiva entre el tamaño del cuerpo de la rana y el tamaño de la presa pues se ha visto que el volumen de Formicidae incrementa con el incremento del tamaño del individuo (Lima & Moreira 1992). Por otra parte, las hormigas pueden convertirse en un recurso predecible ya que concentran y coleccionan recursos en el medio y la mayoría de las colonias de suelo no se desplazan o son relativamente sésiles (Smalwood 1982). Toft (1981) considera que una de las razones por las cuales resulta probable que las ranas consuman hormigas en grandes cantidades podría ser el bajo contenido nutricional que poseen estos insectos. Algunos autores como Taigen & Pough (1983) encuentran que la depredación de hormigas y termitas por parte de anuros tropicales también puede estar relacionada con aspectos fisiológicos de las ranas, como su alta capacidad aeróbica, baja capacidad anaeróbica y alto metabolismo de respuesta.
Después de Acarina y Formicidae, las larvas de Insecta fueron la categoría de presa más importante. Según Menéndez-Guerrero (2001), los dendrobátidos son considerados especies terrestres o de hojarasca, por tal razón pueden encontrar un alto número y variedad de artrópodos e insectos en este microhábitat (Stork & Blackburn 1993). Esto puede explicar la importancia de las Larvas de Insecta como la tercera categoría de presa más representativa en la dieta de A. minutus, debido a que los artrópodos en ciertos estadios larvales se encuentran en la hojarasca facilitando el ser hallados. Además, es probable que las larvas satisfagan los requerimientos energéticos que las presas más quitinosas no les proporcionan, a causa de que poseen cuerpos más blandos y de alto contenido nutricional.
Como se mencionó arriba, diferentes trabajos aportan evidencia de que los dendrobátidos no pueden sintetizar alcaloides pero poseen rutas metabólicas que les permiten acumularlos a partir de fuentes externas (dieta). Daly et al. (2002) en extractos combinados de artrópodos de la hojarasca detectaron alcaloides del tipo de las PTXs, DHQs, aPTXs e indolizidinas en varios grupos como: hormigas, ácaros, coleópteros, dípteros, dipluros, ortópteros, pseudoescorpiones, hemípteros, isopodos, arañas, entre otros. Todos estos grupos de artrópodos (excepto dipluros y pseudoescorpiones ) hacen parte de la dieta de la especie de rana estudiada y, además, todas las cromatografías realizadas a los extractos de piel de la rana y a los artrópodos mostraron espectros de masas similares o iguales. El orden Acarina, por ejemplo, podría estar relacionado con la producción de alcaloides en A. minutus, ya que se ha encontrado a estos individuos como fuente de PTXs en dendrobátidos (Takada et al. 2005) y la familia Formicidae también podría estarlo, teniendo en cuenta que se ha encontrado que individuos de la subfamilia Myrmicinae son fuente de DHQs (Jones et al. 1999, Daly et al. 2000).
En conclusión, A. minutus puede considerarse como una rana carnívora que se alimenta principalmente de ácaros, hormigas y larvas de insectos, lo que representa una dieta especialista, consistente con otros estudios de dendrobátidos. Los resultados aquí presentados no garantizan que la dieta esté estrechamente relacionada con la producción de toxinas, pero tomando en cuenta el alto consumo de ácaros es probable que este grupo de artrópodos esté aportando toxinas como se ha reportado para otras especies de ranas de esta familia.
AGRADECIMIENTOS
Los autores agradecen a la Armada Nacional por autorizar el ingreso para la realización de los muestreos en la isla La Palma, a la Corporación Autónoma Regional del Valle del Cauca (CVC) por el permiso de investigación científica en diversidad biológica (Resolución 0750 No. 0751-1181-2013), a Violeta Molina del Centro de Escritura Javeriano por la revisión del manuscrito y a Ximara Peckham por la traducción del resumen. También agradecemos a los evaluadores anónimos por sus sugerencias al manuscrito. Este trabajo fue financiado parcialmente por COLCIENCIAS proyecto No. 1106-12-13836.
LITERATURA CITADA
1. Biavati, G.M., H.C. Wiederhecker & G.R. Colli. 2004. Diet of Epipedobates flavopictus (Anura: Dendrobatidae) in a Neotropical Savanna. Journal of Herpetology 38: 510–518. [ Links ]
2. Borror, D.J., A. Triplehorn & N.F. Johnson. 1992. An introduction to the study of insects 6th Ed. New York, Saunders College Publishing. [ Links ]
3. Caldwell, J.P. 1996. The evolution of myrmecophagy and its correlates in poison frogs (Family Dendrobatidae). Journal of the Zoological Society of London 240: 75-101. [ Links ]
4. Cantera, J.R. & J. Blanco-Libreros. 1995. Discusión taxonómica sobre las especies de Litophaga perforadoras de acantilados terciarios en la costa pacífica Colombiana. Págs. 109-126 En: J. R. Cantera & D. Restrepo. Delta del río San Juan, Bahía de Málaga y Buenaventura, Pacífico Colombiano. Universidad del Valle, Facultad de Ciencias, 344p. [ Links ]
5. Cantera, J. R., R Neira & C. Ricaurte. 1998. Bioerosión en la costa pacífica Colombiana. Colombia, Fondo FEN. 96p. [ Links ]
6. Castro-Herrera, F. & W. Bolívar-Garcia. 2010. Libro rojo de los anfibios del Valle del Cauca. Feriva Impresores S.A. Cali, Colombia. 200 p. [ Links ]
7. Daly, J.W., C.W. Myers & N. Whittaker. 1987. Further classification of skin from Neotropical poison frogs (Dendrobatidae), with a general survey of toxic/noxious substances in the Amphibia. Toxicon 25:1023-1095. [ Links ]
8. Daly, J.W., H.M. Garrafo, T.F. Spande, C. Jaramillo & A.S. Rand. 1994a. Dietary source for skin alkaloids of poison frogs (Dendrobatidae)? Journal of Chemical Ecology 20:943–955. [ Links ]
9. Daly, J. W., S.I. Secunda, H.M. Garrafo, T.F. Spande, A. Wisnieski & J.F. Cover Jr. 1994b. An uptake system for dietary alkaloids in poison frogs (Dendrobatidae). Toxicon 36: 657-663. [ Links ]
10. Daly, W., H.M. Garrafo, P. Jain, T.F. Spande, R.R. Snelling, G. Jaramillo & A.S. Rand. 2000. Arthropod-Frog Connection: Decahydroquinoline and Pyrrolizidine Alkaloids Common to Microsympatric Myrmicine Ants and Dendrobatid Frogs. Journal of Chemical Ecology 26:73-85. [ Links ]
11. Daly, J.W., T. Kaneko, J. Wilham, H.M. Garrafo, T. Spande, A. Espinoza & M.A. Donelly. 2002. Bioactive alkaloids of frog skin: Combinatorial bioprospecting reveals that pumiliotoxins have an arthropod source. The National Academy of Sciences of the USA 99(22): 13996-14001. [ Links ]
12. Daly, J.W., H.M. Garrafo, T.F. Spande, V.C. Clark, J. Ma, H. Ziffer & J.F. Cover Jr. 2003. Evidence for an enantioselective pumiliotoxin 7-hydroxylase in dendrobatid poison frogs of the genus Dendrobates. The National Academy of Sciences of the USA 100(22):11092-11097. [ Links ]
13. Darst, C.R., P.A. Menéndez-Guerrero, L.A. Coloma & D.C. Cannatella. 2005. Evolution of Dietary Specialization and chemical Defense in Poison Frogs (Dendrobatidae): A Comparative Analysis. The American Naturalist 165(1): 56-69. [ Links ]
14. Duellman, W.E. 1978. The Biology of an equatorial herpetofauna in Amazonian Ecuador. Misc. Publ. Nat. His. Univ. Kans. 65:1-352. [ Links ]
15. Duellman, W.E. 1992. Amphibian species of the world: additions and corrections. Spec. Publ. Mus. Nat. Hist. Univ. Kans. 21:1-372. [ Links ]
16. Duellman, W. & L. Trueb. 1994. Biology of Amphibians. Jhons Hopkins. London. 670 p. [ Links ]
17. Dunham, A. E. 1983. Realized niche overlap, resource abundance and intensity of interspecific competition. En: R.D. Huey, E.R. Pianka & T. W. Schoener (eds.) Lizards Ecology. Harvard University Press. Cambridge, Massachusetts. 261-280. [ Links ]
18. Fernández, F. 2003. (ed.). Introducción a las hormigas de la región neotropical. Instituto Alexander von Humboldt, Bogotá, D.C. XXV+424p. [ Links ]
19. Fittkau, E.J. & H. Klinge. 1973. On biomass and trophic structure of the Central Amazonian rain forest ecosystem. Biotropica 5:2-14. [ Links ]
20. Frost, D. 2013. Amphibian Species of the World: an Online Reference. Version 5.6. American Museum of Natural History, New York, USA. Electronic Database accessible at http://research.amnh.org/herpetology/amphibia/index.html. 09/01/2013. [ Links ]
21. Hölldobler, B. & E.O. Wilson. 1990. The ants. Cambridge. Massachusetts. Harvard University Press. 732 p. [ Links ]
22. Jones, T., J. Gorman, R. Snelling, J. Delabie, M. Blum, H.M. Garrafo, P. Jain, J.W. Daly & T. Spande. 1999. Further alkaloids common to ants and frogs: decahydroquinolines and quinolizidines. Journal of Chemical Ecology 25: 1179-1193. [ Links ]
23. Lima, A.P., & G. Moreira. 1993. Effects of prey size and foraging mode on the ontogenetic change in feeding niche of Colostethus stepheni (Anura: Dendrobatidae). Oecologia 95:93–102. [ Links ]
24. Menéndez-Guerrero, P.A. 2001. Ecología trófica de la comunidad de Anuros del parque Nacional Yasuní en la Amazonía Ecuatoriana. Disertación previa a la obtención del título de licenciado en ciencias biológicas. Quito-Ecuador. Pontificia Universidad Católica del Ecuador, Facultad de Ciencias Naturales y Exactas. 164p. [ Links ]
25. Osorio, D. 2003. Caracterización de la dieta de Dendrobates histrionicus (Anura: Dendrobatidae) y su relación con la producción de toxinas. Trabajo de grado para optar al título de Biólogo con énfasis en Zoología. Santiago de Cali, Universidad del Valle, Facultad de Ciencias Naturales y Exactas. 43p. [ Links ]
26. Pearman, P.B., A.M. Velasco & A. López. 1985. Tropical amphibian monitoring: a comparison of methods for detecting inter-site variation in species composition. Herpetologica 51: 325-337. [ Links ]
27. Ruiz, P., M. Ardila & J. Lynch. 1996. Lista actualizada de la fauna de ANFIBIA de Colombia. Revista de la Academia Colombiana de Ciencias 20: 365-415. [ Links ]
28. Saporito, R.A., H.M. Garrafo, M.A. Donelly, A.L. Edwards, J.T. Longino & J.W. Daly. 2004. Formicinae ants: an arthropod source for the pumiliotoxin alkaloids of dendrobatid poison frogs. The National Academy of Sciences of the USA 101(21):8045-8050. [ Links ]
29. Silverstone, P.A. 1975. A revision of the poison-arrow frogs of the genus Dendrobates Wagler. Scientific Bulletin of Natural History Museum Los Angeles Co. No 21. [ Links ]
30. Simon, M. P., & C.A. Toft. 1991. Diet specialization in small vertebrates: mite-eating in frogs. Oikos, Stockholm 61:263-278. [ Links ]
31. Smalwood, J. 1982. Nest relocation in ants. Insectes Sociaux 29:138-147 [ Links ]
32. Spande, T.F., P. Jaim, H.M. Garrafo, L.K. Panell, J.C. Yeh, J.W. Daly, S. Fukumoto, K. Imamura, T. Tokuyama, J.A. Torres, R.R. Snelling & T.H. Jones. 1999. Ocurrence and Significance of Decahydroquinolines from Dendrobatid Poison Frogs and a Myrmicine Ant: Use of 1H and 13C NMR in Their conformational Analysis. Journal of Natural Products 62(1): 5-21. [ Links ]
33. Stork, N.E. & T.M. Blackburn. 1993. Abundance, body size and biomass of arthropods in tropical forest. Oikos 67: 483-489. [ Links ]
34. Summers, K. & M.E. Clough. 2001. The evolution of coloration and toxicity in the poison frog familiy (Dendrobatiae). The National Academy of Sciences of the USA 98: 6227-6232. [ Links ]
35. Taigen, T.L & F.H. Pough. 1983. Prey preference, Foraging behavior and Metabolic characteristics of frogs. The American Naturalist 122(4): 509-520. [ Links ]
36. Takada, W., T. Sakata, S. Shimano, Y. Enami, N. Mori, R. Nishida & Y. Kuwahara. 2005. Scheloribatid mites as the source of pumiliotoxins in dendrobatid frogs. J. Chem. Ecol. 31: 2403-2415. [ Links ]
37. Toft, C. A. 1980. Feeding ecology of thirteen syntopic species of anurans in a seasonal tropical environment. Oecologia, Berlin 45:131-141. [ Links ]
38. Toft, C.A. 1981. Feeding ecology of Panamanian litter anurans: patterns in diet and foraging mode. Journal of Herpetology, Athens 15:139-144. [ Links ]
39. Valderrama-Vernaza, M., M. Ramírez-Pinilla & V. Serrano-Cardozo. 2009. Diet of the Andean frog Ranitomeya virolinensis (Athesphatanura: Dendrobatidae). Journal of Herpetology 43: 114-123. [ Links ]













