Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232
Caldasia vol.36 no.1 Bogotá Jan./June 2014
https://doi.org/10.15446/caldasia.v36n1.43896
http://dx.doi.org/10.15446/caldasia.v36n1.43896
JOSÉ ERNESTO MANCERA-PINEDA
MARCIAL MONTALVO-TALAIGUA
BRIGITTE GAVIO
Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Carrera 45 No 26-85, Bogotá D.C. Colombia. Universidad Nacional de Colombia, sede Caribe, Carretera Circunvalar San Luis Sector Free Town 52-44, San Andrés, Isla - Colombia. jemancerap@unal.edu.co, bgavio@unal.edu.co
Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Carrera 45 No 26-85, Bogotá D.C. Colombia. marcialmontalvo@gmail.com
RESUMEN
Con el propósito de evaluar la abundancia y la composición de dinoflagelados potencialmente tóxicos asociados al material orgánico flotante (drift) en la isla de San Andrés, se seleccionaron siete sitios de muestreo a lo largo de la margen Norte y Este, paralelos a la barrera arrecifal y a las principales praderas de fanerógamas marinas y macroalgas de la isla. Durante la época de mayor intensidad de vientos, se recolectaron muestras de drift; se identificaron los sustratos a especie y posteriormente se sumergieron en solución 1:1 agua de mar filtrada y solución de Transeau. Luego de agitar vigorosamente las muestras para remover los dinoflagelados, se tamizo la suspensión con una malla de 80 µm y el filtrado se observó al microscopio óptico. Se encontraron cinco sustratos, dos especies de pastos marinos y tres de macroalgas. Sobre los sustratos se identificaron doce especies de dinoflagelados, diez reportadas como tóxicas, causantes de diarrea, parálisis y ciguatera. La abundancia de dinoflagelados varió ampliamente con promedios máximos (±DE) de 15 354±15 749 células/g peso seco de sustrato. De las especies de dinoflagelados, cinco son nuevos registros para San Andrés. No se encontraron diferencias significativas en los valores de diversidad de dinoflagelados entre drift y praderas de pastos y macroalgas, no obstante, la abundancia fue mucho mayor en el drift. Los resultados indican que el drift es un importante sustrato para dinoflagelados y dada su naturaleza flotante, representa tal vez el vector más importante para la dispersión de estos agentes de toxicidad en la isla. Para mitigar el efecto de eventos tóxicos asociados a dinoflagelados en salud pública, pesca y turismo, es necesario diseñar un plan de manejo del material orgánico flotante, que permita mejorar el entendimiento de su composición y dinámica temporal, monitorear las toxinas asociadas e implementar mecanismos de recolección y tratamiento.
Palabras clave. Dinoflagelados potencialmente tóxicos, drift, ciguatera, San Andrés isla, Caribe
ABSTRACT
To assess the composition and abundance of potentially toxic dinoflagellates associated to drift on San Andres island, we selected seven sampling sites along the northern and eastern side of the island. During the wind season, we collected drift samples, identified the main substrates to species, and submerged them in 1:1 filtered seawater and Transeau solution. After shaking to remove the dinoflagellates, we sieved through an 80 µm screen and analyzed the detached dinoflagellates under an optical microscope. We found five substrates, two seagrass species and three macroalgae. Associated to these substrates, we identified twelve dinoflagellates species, ten of which are reported as toxic and are known to produce diarrhea, paralysis and ciguatera, syndromes reported in San Andrés and other Caribbean places where their frequency is apparently increasing. The dinoflagellate abundance presented strong variation with maximum average values (±SD) of 15354±15749 cel. /g of substrate dry weight. Five of the dinoflagellates associated to drift are new records for the island. We did not found significant differences in diversity of benthic dinoflagellates between drift and seagrass and macroalgae beds; however, the abundance was much higher in drift. The results showed that drift is a very important substrate for potentially toxic dinoflagellates and, considering its buoyant nature, it may represent one of the main dispersion vectors for these species on the island. To mitigate the effect of intoxication events on public health, fisheries and tourism, it is necessary to design a floating organic material management plan, improve the understanding of drift composition and its temporal dynamics, as well as to monitor associated toxins and pursue collection and treatment mechanisms of the floating biomass.
Key words. Potentially toxic dinoflagellates, drift, ciguatera, San Andrés Island, Caribbean.
Recibido: 10/03/2013
Aceptado: 01/04/2014
INTRODUCCIÓN
Las macroalgas y pastos marinos sirven de sustrato a una gran cantidad de organismos (Hinojosa et al. 2007, González & Díaz 2008, Rodríguez et al. 2010). Estos sustratos pueden ser desgarrados de su base debido a la acción de procesos físicos como vientos, corrientes, oleaje y/o a procesos biológicos como la herbivoría, y permanecen flotando a la deriva por un período de tiempo relativamente largo (Hinojosa et al. 2007). Este material así como el detritus flotante se conoce como "drift" (Macıá 2000, Nordström & Booth 2007, Ortiz & Gavio 2012). Se ha encontrado que estos restos flotantes pueden ser además colonizados por una amplia variedad de organismos (Orav-Kotta 2004, Buskey 2008), sirviendo en el medio marino de importantes vectores para la dispersión de organismos como los dinoflagelados (Hinojosa et al. 2007).
Los dinoflagelados corresponden a un grupo de microalgas marinas con distribución cosmopolita y dividida en dos subgrupos, tecados y atecados (Balech 1988), pudiendo ser plantónicos o bentónicos comúnmente asociados con macroalgas, pastos marinos, sedimentos y arrecifes de coral (Faust et al. 2005). Se conocen cerca de 50 especies de dinoflagelados productores de toxinas, las cuales pueden llegar al ser humano a través de las redes tróficas (Delgado et al. 2002). Uno de los principales problemas generados por dinoflagelados en regiones tropicales y subtropicales es la ciguatera (Ballantine et al. 1985, Arencibia et al. 2009), intoxicación que si bien es sub-diagnosticada, estimándose que menos del 10% de los casos son reportados (Friedman et al. 2008), afecta anualmente entre 25 000 y 500 000 (Lewis & Stelin 1992) personas en el mundo. Aunque se considera que el principal causante de la ciguatera es el dinoflagelado Gambierdiscus toxicus (Adachi & Fukuyo 1979) que vive como epífito de fanerógamas y macroalgas colonizadoras de arrecifes de coral (Lehane & Lewis 2000), los géneros de dinoflagelados bénticos Amphidinium, Coolia, Ostreopsis y Prorocentrum (Besada et al. 1982, Ballantine et al. 1985, Hurbungs 2001, Ashton et al. 2003), y algunos géneros de cianobacterias (Laurent et al. 2008), han sido asociados con G. toxicus en la producción de toxinas relacionadas con la ciguatera. El género Prorocentrum es uno de los más importantes, por el número de especies identificadas como tóxicas o potencialmente tóxicas y por su abundancia en el medio natural (Delgado et al. 2002). La sintomatología reportada para la ciguatera es variable, incluye trastornos gastrointestinales, neurológicos, cardiovasculares y neuropsicológicos, desde leves y de corta duración hasta severos y de largo plazo, y en algunos casos puede conducir a la muerte (Arencibia et al. 2009, Faust 2009).
Las biotoxinas marinas amenazan tanto la salud humana como la seguridad alimentaria y nutricional (FAO 2005). Además de la ciguatera se han identificado otras formas de intoxicación originadas por dinoflagelados, cuyas toxinas pueden ingresar a las redes tróficas afectando la salud humana por ingesta de productos pesqueros. Las toxinas más conocidas son la paralítica (PSP), diarreica (DSP) y neurotóxica (NSP) (Lagos 2002, Hernández-Becerril & Almazán-Becerril 2004). La preocupación actual sobre el impacto generado por microalgas potencialmente tóxicas en la sociedad es grande, dado que en los últimos años los eventos de intoxicación parecen haber incrementado en frecuencia, intensidad y distribución geográfica (Hallegraeff et al. 2003). Autores de diferentes partes del mundo han encontrado incrementos significativos en la incidencia de ciguatera. Skinner et al. (2011) encontraron que durante las últimas tres décadas la incidencia de ciguatera en el Pacifico sur incrementó en un 60%, mientras Tester et al. (2010) y Celis (2013) detectaron un aumento del 32% entre los países miembros del Caribbean Epidemiology Centre - CAREC. Estos incrementos podrían ser aún mayores en el futuro debido a cambios en los patrones climáticos globales, sobre-pesca y degradación de los ecosistemas marinos (Stinn et al. 2000, Tester et al. 2010).
En el mar Caribe se han encontrado numerosas especies de dinoflagelados asociados a praderas de Thalassia testudinum, macroalgas y detritos provenientes de arrecifes de coral y bosques de manglar (Ballantine et al. 1985, Faust 1993a, Faust 1993b, Faust et al. 1999, Faust 2000, Faust et al. 2005, González & Díaz 2008, Faust 2009, Rodríguez et al. 2010). Teniendo en cuenta el incremento de ciguatera en el Caribe (Mancera-Pineda et al. 2010a, Celis 2013), la presencia de dinoflagelados potencialmente tóxicos asociados a pastos y macroalgas (Rodríguez et al. 2010) y la amplia diversidad de macroalgas y otros sustratos que componen el drift en la isla de San Andrés (Ortiz & Gavio 2012), se planteó como objetivo del presente trabajo, evaluar la abundancia y composición de dinoflagelados en el drift de la isla de San Andrés, Caribe insular colombiano, como insumo para una posterior evaluación del drift como vector de ciguatera.
MATERIALES Y MÉTODOS
Área de Estudio. La isla de San Andrés está situada en el Caribe suroccidental entre los 12°28' y 12°36' N y los 81°40' y 81°44' W (Fig. 1); hace parte del archipiélago San Andrés, Providencia y Santa Catalina, declarado Reserva Internacional de la Biosfera Seaflower. Por su tamaño, 27 km2 (IGAC 1986), San Andrés es catalogada como pequeña isla (Nunn 1987, Mimura et al. 2007), lo cual sumado a su localización ( 720 km al noroeste de la costa colombiana y a 240 km de la costa centroamericana), la hacen altamente vulnerable tanto a los impactos generados por el cambio climático como a algunas actividades antrópicas. La isla se encuentra en la zona de transición entre clima húmedo y clima seco tropical, con una temperatura media anual de 27.4 °C y una precipitación total anual promedio de 1900 mm, distribuida irregularmente en dos periodos: una época seca (febrero a abril) y una época lluviosa (junio a diciembre). El patrón de velocidad de vientos muestra tres periodos en el ciclo anual, vientos de mayor intensidad con promedio de 30 km/h de diciembre a mayo; vientos de intensidad media de junio a julio y vientos de menor intensidad con promedio de 20 km/h de agosto a noviembre. Mientras que la dirección del viento a lo largo del año muestra tendencias predominantes del norte, noreste y este, con porcentajes de ocurrencia de 10%, 50% y 40% respectivamente (Albis-Salas 2010).
La plataforma marina en el lado oriental de la isla es poco profunda, y llega hasta los arrecifes de coral en el océano abierto, que mitigan las olas. En esta terraza submarina existen depósitos de corales, algas coralinas, erizos y otros animales que producen arena calcárea. En la parte occidental de la isla, la transición es mucho más abrupta (IGAC 1986).
Las praderas de fanerógamas marinas y macroalgas de San Andrés están distribuidas principalmente en la zona norte y oriental de la isla, ocupando un área aproximada de 506 ha (Ángel & Polania 2001). Florísticamente estos ecosistemas están compuestos principalmente por dos especies de fanerógamas (Thalassia testudinum y Siringodium filiforme) y múltiples especies de macroalgas con la predominancia de los géneros Halimeda, Penicillus, Caulerpa, Avrainvillea y Dictyota (Díaz et al. 2003, Galeano 2012).
Diseño Muestral. Teniendo en cuenta que en San Andrés la gran mayoría de praderas donde se asocian pastos marinos y macroalgas se encuentran en la margen oriental de la isla, las siete estaciones muestreadas se localizaron en dicha margen (Fig. 1), donde la acción del viento y las corrientes favorecen la acumulación y el depósito de drift. Los muestreos se realizaron en enero de 2010 en las siguientes estaciones localizadas en la zona costera.
1. Playa Isleño: Es la playa arenosa más ancha de la isla, con amplia exposición al oleaje.
2. Frente a Cotton Cay: Estación somera, con gran tránsito de embarcaciones. La pradera de pastos marinos presenta poca cobertura vegetal.
3. Puerto: Sitio con gran tránsito de embarcaciones y acumulación de materiales de diverso tipo.
4. Bahía Honda: Bahía somera, relativamente cerrada, rodeada de manglar en cuyo borde domina Rhizophora mangle (Sánchez-Núñez & Mancera-Pineda 2011). Las aguas de la bahía presentan problemas de nutrificación (Gavio et al. 2010).
5. Mar Azul: La costa está bordeada por manglar, la pradera en frente es amplia a más de 7 m de profundidad. Hay importante tránsito de embarcaciones y acumulación de diverso tipo de material.
6. Playa Universidad Nacional de Colombia: Playa de menos de 3 m de ancho dominada por rocas, con relativamente alto nivel de exposición al oleaje y por tanto gran cantidad de acumulación de drift.
7. Sound Bay: Playa arenosa relativamente ancha, con praderas de pastos marinos y algas.
La toma de muestras se realizó manualmente por triplicado, introduciendo en el agua un recipiente plástico de 30 cm de diámetro de boca y fondo de tamiz. Se recolectó el material flotante fresco, evitando aquel que por sus características pudiera haber sido depositado en la arena y posteriormente arrastrado y puesto nuevamente en la superficie de la columna de agua. Posteriormente el material fue colocado en bolsas plásticas y transportando en frio al laboratorio. Las coordenadas de cada estación de muestreo fueron registradas con un GPS Garmin map 76 (Olathe, KS, USA).
El drift fue separado en sus principales componentes, macroalgas y pastos marinos. Cada sustrato biológico o morfoespecie fue separada y colocada en una bolsa plástica con 250 mL de solución compuesta de 50% de agua de mar filtrada y 50% solución de Transeau (6 partes de agua, 3 partes de etanol al 90% y una parte de formol al 100%). Cada bolsa fue agitada vigorosamente por 5 minutos para separar los dinoflagelados epifitos adheridos al sustrato. El agua de cada bolsa fue filtrada con un tamiz de 80µm de tamaño de poro y recogida en un embudo con un tubo Falcon® para concentrar las muestras en 10 mL de solución de Transeau, dejándolas sedimentar durante tres días. Cada componente del drift fue secado a temperatura constante de 60°C por tres días, se registró tanto el peso en fresco como en seco de cada sustrato empleando una balanza analítica ML204 Mettler Toledo (México, D.F.) (Ballantine et al. 1985, Rodríguez et al. 2010). La densidad poblacional de dinoflagelados se calculó con base en peso húmedo y seco del sustrato. Para los cálculos de diversidad y la comparación entre estaciones y sustratos se utilizó el número de dinoflagelados por peso seco, no obstante, los valores calculados en peso húmedo se incluyeron en la tabla 1 y tabla 3 para permitir futuras comparaciones.
La identificación de los dinoflagelados se hizo con base en la literatura disponible (Ballantine et al. 1985, Faust 1993a, 1993b, Faust et al. 1999, Hernández-Becerril et al. 2000, Faust & Gulledge 2002, Morton et al. 2002, Cortés-Altamirano & Sierra-Beltrán, 2003, Hernández-Becerril & Almazán-Becerril 2004) bajo un microscopio óptico (OLYMPUS BX51, Tokyo, Japón) a 100x. Para el conteo se utilizó el mismo microscopio a 10x. Las fotografías de algunas especies se obtuvieron en un microscopio electrónico de barrido (PHILIPS FEI QUANTA 200, Ámsterdam, Holanda). La abundancia total de dinoflagelados fue calculada multiplicando el número de microalgas contenidas en 0.2 mL del volumen total de solución previamente concentrada (250 mL) y dividida por el peso de sustrato expresado en gramos de material vegetal de cada estación muestreada. Los datos fueron extrapolados a 250 mL, que corresponde al volumen de extracción, reportando para cada estación y tipo de sustrato, la media y la desviación estándar de la densidad de especies de dinoflagelados encontrados.
En el procesamiento de datos se utilizó un análisis de varianza no paramétrico para determinar diferencias en la abundancia de especies de dinoflagelados entre estaciones muestreadas y sustratos o componentes del drift. Se calcularon índices de diversidad de Shannon y Wiener, así como el índice de similitud de Jaccard. Los análisis estadísticos se realizaron con el programa STATGRAPHICS Centurion XIX (Warrenton, Virginia, USA).
RESULTADOS
Composicion del drift. Se encontraron en total cinco especies de sustrato flotante: dos pastos marinos, Syringodium filiforme y Thalassia testudinum y tres algas pardas, Canistrocarpus cervicornis, Sargassum polyceratium y Turbinaria turbinata. S. filiforme estuvo presente en todas las estaciones, Thalassia testudinum estuvo ausente solamente en Sound Bay, mientras las algas pardas se encontraron cada una solamente en un sitio: Sargassum polyceratium en Playa el Isleño, donde representaba un proporción muy pequeña comparada con la biomasa de los pastos; Turbinaria turbinata fue hallada en la playa de la Universidad Nacional de Colombia, en donde su biomasa también fue limitada; Canistrocarpus cervicornis fue el sustrato dominante en Sound Bay, acompañada por S. filiforme en menor cantidad. Estas especies de macroalgas, no son comunes en las praderas de pastos marinos de la isla de San Andrés; sin embargo, hacen parte de la flora marina cerca de la barrera arrecifal y del litoral rocoso aledaño a las playas.
Comunidad de Dinoflagelados. En todas las estaciones muestreadas se encontraron especies de dinoflagelados potencialmente tóxicos. De las 12 especies encontradas (Tabla 1), diez están relacionadas con la producción de toxinas, solo dos especies no han sido reportadas como tóxicas, Prorocentrum emarginatum Fukuyo 1981 (Faust et al. 1999) y Sinophysis microcephala Nie & Wang 1944 (Fig. 2) (Faust 1993b). Se encontraron diferencias significativas en el número de células entre estaciones (p>0.05). Las mayores abundancias se presentaron en Sound Bay y Cotton Cay, con valores promedio (±DE) de 4 858±8 972 y 4 333±5 276 células/g peso seco de sustrato, respectivamente. La abundancia más baja de dinoflagelados se encontró en Bahía Honda con concentración promedio (±DE) de 645±887 células/g peso seco (Tabla 1). De las especies reportadas en el presente trabajo, cinco son nuevos registros para el archipiélago: Amphidinium cartera Hulburt 1957, Alexandrium sp1, Alexandrium sp2, Gambierdiscus toxicus Adachi & Fukuyo 1979 (Fig. 2) y Prorocentrum concavum Fukuyo 1981.
Amphidinium carterae fue encontrado en Bahía Honda y Sound Bay con abundancias promedio (±DE) de 194±336 y 4 295 ±3 619 células/g peso seco de sustrato, respectivamente. Alexandrium sp1, Alexandrium sp2 y Gambierdiscus toxicus, fueron encontradas únicamente en Sound Bay con abundancias promedio (±DE) de 2 321±2 059; 3 416±4 266 y 1 190±1 650 células/g peso seco, respectivamente. P. concavum Fukuyo 1981 fue encontrada en Playa Isleño, Cotton Cay, Universidad Nacional y Sound Bay con abundancias promedio (±DE) de 1 333±3 147, 7 862±5 072, 87±150 y 2 243±2 576 células/g peso seco, respectivamente.
Tres de las especies de Prorocentrum reportadas en el presente estudio presentaron amplia distribución en el drift de San Andrés, dado que fueron encontradas en todas las estaciones muestreadas. P. emarginatum fue la especie más abundante con promedios (±DE) entre 244±424 y 15 354±15 749 células/g peso seco. P. belizeanum Faust 1993 le siguió en abundancia con valores promedio (±DE) entre 323±288 y 12 036±21 308 células/g peso seco. P. lima (Ehrenberg) Stein 1878 con promedios (±DE) entre 699±829 y 6622±8864 células/g peso seco fue la tercera especie con mayor abundancia (Tabla 1). Las otras especies de Prorocentrum encontradas fueron: P. concavum, P. maculosum Faust 1993, P. hoffmannianum Faust 1990 y P. rhathymum Loeblich, Shereley & Schimidt 1979. En general las especies de este género fueron las únicas que se encontraron en todas las estaciones mostrando su importancia como potenciales agentes tóxicos. S. microcephala especie para la cual no hay reportada ninguna toxina, fue registrada en cinco de las siete estaciones con abundancias promedio (±DE) entre 315±546 y 1 834±1 225 células/g peso seco (Tabla 1).
De acuerdo con el índice de Shannon y Wiener, los valores de diversidad encontrados a lo largo de las siete estaciones muestreadas para las comunidades de dinoflagelados asociados a drift en San Andrés isla oscilaron entre 1.31 en Mar Azul y 2.1 en Sound Bay (Tabla 2).
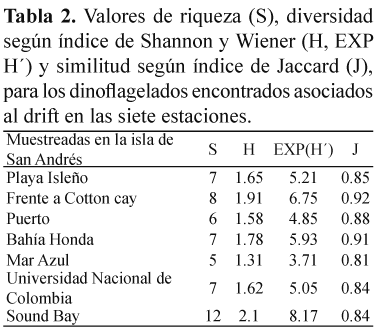
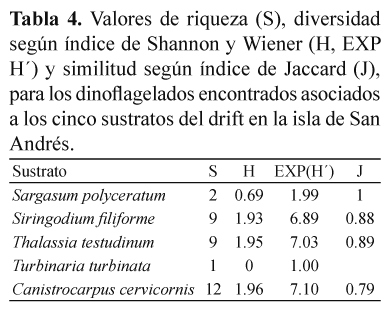
Preferencia por sustratos. Solamente sobre C. cervicornis, en Sound Bay, fueron halladas las 12 especies de dinoflagelados reportadas en el presente trabajo. Turbinaria turbinata fue elegida como sustrato solamente para la especie P. hoffmanianum, mientras que Sargassum polyceratium hospedó a P. emarginatum y P. lima. Las dos especies de pasto marino fueron sustrato para 9 especies de dinoflagelados cada una (Tabla 3). El número de dinoflagelados encontrados en cada sustrato fue muy variable, con valores promedio (±DE) de 194±336 células/g peso seco para A. carterae sobre T. testudinum y 7 493±1 196 células/g peso seco para la misma especie de microalga sobre S. filiforme. Los análisis estadísticos mostraron diferencias significativas (p>0.05) en la preferencia de los dinoflagelados por sustrato flotante. Sobre C. cervicornis, las abundancias promedio (±DE) variaron de 252±254 células/g peso seco para P. maculosum hasta 5 930±3 748 células/g peso seco para P. emarginatum. S. filiforme, presentó abundancias promedio (±DE) de 683±753 células/g peso seco para S. microcephala y 7 493±1 196 células/g peso seco para A. carterae. Sobre T. testudinum se registraron abundancias promedio (±DE) de 194±336 células/ g peso seco para A. carterae, hasta 6821±7861 células/g peso seco para P. lima. Según el índice de Shannon y Wiener la diversidad (H) de dinoflagelados asociados a los cinco sustratos que conformaron el drift, varió entre valores de 0 para T. turbinata, con una sola especies encontrada y 1.96 para C. cervicornis, donde se hallaron todas las doce especies (Tabla 4).
DISCUSIÓN
El primer estudio sobre dinoflagelados tóxicos en San Andrés fue llevado a cabo en el 2007, estudiando como sustrato las praderas de Thalassia y macroalgas asociadas (Rodriguez et al. 2010). Los autores reportaron ocho especies de dinoflagelados bénticos, siete de los cuales potencialmente tóxicos. Con el presente trabajo, el segundo hasta la fecha en San Andrés, se aumenta la diversidad de estos organismos, ya que cinco de las especies aquí reportadas son nuevos registros. Solamente Ostreopsis ovata, reportado en 2007, no fue encontrado sobre el material flotante.
La mayoría de las especies encontradas producen toxinas causantes de diarrea, parálisis o ciguatera, síndromes reportados en la isla (Mancera-Pineda et al. 2010a). Todas estas especies presentan una amplia distribución en el Caribe y han sido reportadas en muestras de agua, sedimentos o como epifitos en diversos ecosistemas (Besada et al. 1982, Ballantine et al. 1985, Balech 1988, Bomber et al. 1988, Faust 1993a, 1993b, Delgado et al. 2006, González & Díaz 2008, Faust 2009, Rodríguez et al. 2010), generalmente en abundancias muy variadas, debido a que las células, aún en pequeñas distancias, presentan una distribución por parches (Ballantine et al. 1985, 1988). Esto explica los altos coeficientes de variación que van entre 50 y más de 150% (GEOHAB 2012).
Cinco de las siete especies de Prorocentrum encontradas producen ácido okadaico (OA) (Faust & Gulledge 2002). Esta toxina actúa como promotor tumoral, ya que al inhibir la acción de las fosfatasas produce una hiperfosforilación de proteínas celulares, incluyendo las responsables de la supresión tumoral (FAO 2005). P. belizeanum fue encontrado en todas las estaciones, es una de las especies más abundantes del género y es común en sedimentos y aguas costeras tropicales. Tanto en el drift como en los pastos esta especie fue principalmente encontrada sobre S. filiforme.
P. lima, una de las especies más abundantes en el drift estudiado, es una especie cosmopolita, béntica y epifita, productora de gran cantidad de substancias toxicas. Mientras en el drift Thalassia fue su sustrato favorido, en las praderas fue encontrado, en mucha menor densidad, como epifita de las macroalgas Aglaothamnion sp. y Wrangelia sp. y, en menor abundancia, en T. testudinum (Rodríguez et al. 2010).
P. hoffmannianum, ausente solamente sobre S. polyceratium, ha sido encontrado también en sedimentos, detritus flotante y macroalgas (Faust et al. 1999). El sustrato sobre el que abundó más fue T. testudinium, tanto en el drift, como en las praderas (Rodríguez et al. 2010). P. rhathymum, encontrada en todas las estaciones, excepto en Mar Azul, sintetiza FAT (Faust & Gulledge 2002). En las praderas de San Andrés fue encontrada asociada a Caulerpa sertularioides y a T. testudinium (Rodríguez et al. 2010), mientras en el drift Thalassia fue su sustrato favorido.
P. emarginatum no parece producir toxinas (Faust et al. 1999); esta especie ha sido reportada en arrecifes tropicales del Pacifico (Fukuyo 1981), en el Caribe y en hábitats de manglar (Faust 2004). En el drift fue encontrado principalmente sobre C. cervicornis, Thalassia, Syringodium y, en menores densidades, Sargassum. Sin embargo, el único sustrato utilizado en las praderas fue Thalassia (Rodríguez et al. 2010). Alexandrium es uno de los géneros de dinoflagelados con mayor potencial tóxico (Balech 1988), produce intoxicación paralitica por consumo de mariscos (PSP), a través de la síntesis de toxinas que inhiben la transmisión de los impulsos nerviosos, causando en algunos casos la muerte (Arencibia et al. 2009). Especies de este género causan florecimientos algales nocivos (FAN) debido a su crecimiento masivo y fueron reportados como responsables de varios eventos tóxicos en costas del Pacífico de Costa Rica entre 2002 y 2004 (Mancera-Pineda et al. 2010a). Especies de Alexandrium no han sido observadas antes en San Andrés, constituyendo un nuevo registro para el Archipiélago. En el drift fueron encontradas únicamente en la estación localizada más al sur.
G. toxicus es conocida por producir ciguatoxinas, ácido gambierico y maitotoxina, es frecuentemente encontrada como epifita en macroalgas y en corales muertos (Faust & Gulledge 2002). Asociada al material flotante en la isla de San Andrés, esta especie fue encontrada exclusivamente sobre C. cervicornis en Sound Bay y constituye también un nuevo registro para la isla. Las densidades celulares encontradas corresponden a valores intermedios de acuerdo con lo reportado por GEOHAB (2012).
A. carterae, es una especie cosmopolita, encontrada tanto en aguas templadas como tropicales, así como en estuarios. Predominantemente béntica ha sido reportada como tóxica (Tomas 1996). Para San Andrés es un nuevo registro y fue encontrada solamente en Bahía Honda y Sound Bay, asociada a pastos marinos y a C. cervicornis (Tabla 1 y Tabla 3).
S. microcephala, de la que no se conoce toxina, es una especie pantropical reportada en aguas de los mares Caribe y Pacifico (Faust 1993b). Esta especie fue encontrada en muy bajas densidades poblacionales en todas las praderas de pastos y macroalgas evaluadas por Rodríguez et al. (2010) en San Andrés, asociada a la mayoría de sustratos encontrados, tales como pastos y macroalgas de los géneros Aglaothamnion, Halimeda, Pernicillusy Wrangelia. En el drift también se encontró en la mayoría de estaciones en concentraciones poblacionales relativamente bajas (Tabla 1).
Rodríguez et al. (2010) reportaron Ostreopsis ovata asociada a varios sustratos. Sin embargo, esta especie no fue observada en ninguna de las muestras de drift analizadas.
C. cervicornis fue el sustrato en donde se encontraron todas las especies de dinoflagelados reportadas en este trabajo. Esta especie fue encontrada por Ortiz & Gavio (2012) como parte del drift en San Andrés, pero no fue encontrada por Rodríguez et al. (2010) entre las praderas de pastos, pues es poco frecuente en estos ecosistemas (Gavio, com. pers.), sugiriendo que su procedencia podría ser la barrera arrecifal, donde es más común. Thalassiatestudinum, por el contrario, es el sustrato que hospeda a la mitad de los taxas identificados, reportando las mayores densidades de células para seis de las nueve especies de dinoflagelados que alberga. De acuerdo con los resultados del presente estudio, las especies de Prorocentrum parecen no tener preferencias por algún sustrato, lo que coincide con los resultados obtenidos por Faust (2004), Delgado et al. (2006) y Faust (2009).
La diversidad de dinoflagelados encontrados en el drift en San Andrés isla, no difiere estadísticamente de la diversidad de dinoflagelados epifitos de fanerógamas y macroalgas de la misma isla (Fig. 3), reportados en estudios previos (Rodríguez et al. 2010), sin embargo, su abundancia es muy superior, comparable en algunos casos con las abundancias obtenidas por Delgado et al. (2006) en estudios realizados en la costa noroccidental cubana. Estos resultados sugieren que el drift puede ser un buen vector para la dispersión de dinoflagelados potencialmente tóxicos en San Andrés (Fig. 4).
El incremento en el drift de la abundancia de dinoflagelados epifitos, probablemente depende de varios factores ambientales actuando al mismo tiempo (Delgado et al. 2006). En San Andrés las diferencias de temperatura tanto entre agua superficial y de fondo (profundidad entre 5 y 16 m), como entre diferentes estaciones son mínimas. Durante los meses secos, se registraron promedios de 27.96 °C en superficie y 27.93 °C en fondo; mientras que en meses lluviosos los promedios fueron de 28.76 °C en superficie y 28.68 °C en fondo (Mancera et al. 2010b). Estos rangos están dentro de los óptimos para algunas especies de dinoflagelados tropicales, como las del género Gambierdiscus (25- 29 °C, GEOHAB 2012). Por lo menos para el caso de San Andrés, la gran abundancia de dinoflagelados sobre drift no parece estar relacionada con cambios de temperatura, como varios autores sugieren (Herndl 1991, Schofield et al. 1998, Chinain et al. 1999, Ashton et al. 2003). Otros estudios han encontrado que el aumento en nutrientes inorgánicos disueltos se correlaciona positivamente con el aumento en las poblaciones de dinoflagelados (Buskey 2008, Heisler et al. 2008). Gavio et al. (2010) encontraron signos de nutrificación, con concentraciones de nitrógeno y fósforo muy arriba del límite establecido para aguas oligotróficas no contaminadas en las aguas costeras de San Andrés. No obstante, es de esperar que la disponibilidad de nutrientes inorgánicos disueltos afecte por igual a los dinoflagelados epífitos de pastos y macroalgas y a los asociados al drift.
Es posible que el aumento de irradiación lumínica en la superficie del agua tenga un papel importante en el aumento de las poblaciones de dinoflagelados (Peña-Manjarrez et al. 2005), en forma directa o a través de la producción de sustancias alelopáticas que inhiben el crecimiento de otras especies o causen la muerte de sus competidores (Graneli et al. 2008). El coeficiente de extinción lumínica en aguas costeras de San Andrés está alrededor de 0,26 (Mancera-Pineda, datos no publ.), lo cual implica que la energía lumínica recibida por los dinoflagelados en el drift es superior a la de aquellos que se encuentran como epífitos de pastos o macroalgas. De esta forma, la mayor disponibilidad de energía lumínica para la fotosíntesis o producción de dinoflagelados asociados al drift, podría ser una buena hipótesis de trabajo para explicar los incrementos en abundancias de dinoflagelados.
La radiación UV que se presenta en la superficie del agua puede inhibir el crecimiento de microalgas (Taylor 1985), sin embargo, se ha encontrado que especies del género Gambierdiscus poseen estructuras tridimensionales que le sirven de protector solar y vivir en ambientes con mucha luz (GEOHAB 2012).
El drift es un sustrato apetecido por una gran cantidad de organismos oportunistas poco tiempo después de que este se desprende de su base (Orav-Kotta 2004, Hinojosa et al. 2007). Un desfase entre el crecimiento de las poblaciones de microalgas y zooplancton, o algún otro factor que incida negativamente en la abundancia de herbívoros, puede conducir a altas densidades de microalgas. Una vez las poblaciones de microalgas alcanzan altas densidades, su control puede resultar difícil para las poblaciones de herbívoros, más aun si hay inhibidores de herbivoría. La alta densidad en las poblaciones de microalgas toxicas puede liberar toxinas o polisacáridos extracelulares que inhiben el crecimiento de herbívoros (Orav-Kotta 2004).
El aparente incremento en la ocurrencia de las toxinas marinas durante las últimas tres décadas ha despertado alarma general en el mundo. Las condiciones ambientales que favorecen los episodios tóxicos no son bien conocidos y difieren entre especies (van Dolah 2000), no obstante, se ha planteado que cambios globales como el aumento de la temperatura benefician el crecimiento de algunas especies tóxicas (Hallegraeff 1993), así como la eutrofización de las aguas marinas (Pearl & Whitall 1999). Se sabe también que el transporte de aguas de lastre, es un mecanismo muy eficiente para la introducción de especies aloctonas, pues por esa vía se transfieren cerca de 10 billones de toneladas de agua cada año entre diferentes mares (Carlton & Geller 1993). Sin embargo, otros medios de difusión como el del drift, han sido mucho menos explorados, pudiendo tener efectos muy importantes principalmente a nivel local, como en el caso de la isla de San Andrés.
En el Caribe la ocurrencia de eventos tóxicos producidos por microalgas, como es la ciguatera, ha incrementado en las últimas décadas (Celis 2013). Dentro de las posibles causas de este aumento, además del ascenso de temperatura, se sugiere el cambio de fase coral-alga, con lo cual se ha incrementado la disponibilidad de sustratos para los dinoflagelados bentónicos.
CONCLUSIONES
Los resultados del presente estudio muestran que las poblaciones de dinoflagelados asociados a sustratos orgánicos flotantes, comparadas con las encontradas en estudios previos en praderas de pastos marinos y macroalgas en la isla de San Andrés (Rodríguez et al. 2010), no difieren en diversidad (Fig. 3) pero si en abundancia de individuos, siendo mucho mayor en el material flotante (Fig. 4). Esto sugiere que el drift es un importante sustrato para dinoflagelados potencialmente tóxicos y dada su naturaleza flotante, representa tal vez, el vector más importante para la dispersión de estos agentes de toxicidad en la isla.
Las razones por las cuales los dinoflagelados son más abundantes en el drift, rebasan los alcances de este estudio, siendo necesario evaluar en el futuro la influencia de variables como la herbivoría y la luz.
Con miras a mitigar el efecto en salud pública, pesca y turismo de potenciales eventos tóxicos asociados a dinoflagelados, es necesario diseñar un plan de manejo del material orgánico flotante. Dicho plan debe considerar profundizar en el entendimiento de su dinámica temporal, monitoreo de toxinas, mecanismos de colecta y tratamiento del drift en la isla de San Andrés.
AGRADECIMIENTOS
Este estudio fue financiado por la Universidad Nacional de Colombia, recibiendo apoyo de los proyectos Ensamblages de Dinoflagelados Bénticos Asociados a Praderas de Thalassia testudinum y Macroalgas en la isla de San Andrés (código Hermes 10584, Quipú 20101003380); Evaluación de la Calidad del Hábitat como Función del Análisis Metapoblacional en Organismos Marinos Bentónicos del Caribe (códigos Quipú 20101004480 y Hérmes 12395) y Biodiversidad Marina de la reserva Internacional de Biosfera Seaflower (Códigos Quipú 20101004940 y Hérmes 12921). Agradecemos al Programa de pasantías intersedes de la sede Caribe por financiar la estadía de uno de los coautores del artículo en la isla de San Andrés; al Jardín Botánico de la Universidad Nacional de Colombia - sede Caribe, por facilitar los equipos de laboratorio.
LITERATURA CITADA
1. Adachi, R. & Y. Fukuyo. 1979. The thecal structure of a marine toxic dinoflagellates Gambierdiscus toxicus gen. et sp. nov. collected in a ciguatera-endemic area. Bulletin of the Japanese Society of Scientific Fishery 45(1): 67-71. [ Links ]
2. Albis-Salas, M.R. 2010. Características estructurales y fisiológicas de las praderas de Thalassia testudinum. Tesis de Maestría en Ciencias Biología – línea Biología Marina. Univ. Nacional de Colombia, Santa Marta, Colombia. 128 p. [ Links ]
3. Angel, F. & J. Polania. 2001. Estructura y distribución de pastos marinos en San Andrés Isla, Caribe colombiano. Boletín Ecotropica Ecosistemas Tropicales 35:1-24. [ Links ]
4. Arencibia, G., J.E. Mancera-Pineda & G. Delgado. 2009. La ciguatera: Un riesgo potencial para la salud humana: Preguntas frecuentes. Universidad Nacional Colombia, Sede Caribe. 64 p. [ Links ]
5. Ashton, M., T. Tosteson, & C. Tosteson. 2003. The effect of elevated temperature on the toxicity of the laboratory cultured dinoflagellate Ostreopsis lenticularis (Dinophyceae). Revista de Biología Tropical 51(4): 1-6. [ Links ]
6. Balech, E. 1988. Los dinoflagelados del Atlántico Sudoccidental. Instituto Español de Oceanografía 1-299. [ Links ]
7. Ballantine, D.L., A.T. Bardales, T.R. Tosteson & H. Dupont. 1985. Seasonal abundance of Gambierdiscus toxicus and Ostreopsis sp. in coastal waters of Southwest Puerto Rico. Proceedings of the Fifth International Coral Reef Congress, Tahiti 4: 1-6. [ Links ]
8. Ballantine, J.W., T.R. Tosteson, & A.T. Bardales. 1988. Population dynamics and toxicity of natural populations of benthic dinoflagellates in southwestern Puerto Rico. Journal of Experimental Marine Biology and Ecology 119: 201-212. [ Links ]
9. Besada, E.G., L.A. Loeblich & A.R, Loeblich. 1982. Observations on tropical, benthic dinoflagellates from ciguatera-endemic areas: Coolia, Gambierdiscus, and Ostreopsis. Bulletin of Marine Science 32(3): 723-735. [ Links ]
10. Bomber, J.W, S.L. Morton, J.A. Babinchak, D.R. Norris & J.G. Morton. 1988. Epiphytic dinoflagellates of drift algae-another toxigenic community in the ciguatera food chain. Bulletin of Marine Science 43(2): 204-214. [ Links ]
11. Buskey, E.J. 2008. How does eutrophication affect the role of grazers in harmful algal bloom dynamics?. Harmful Algae 8: 152-157. [ Links ]
12. Carlton, J.T. & J.B. Geller. 1993. Ecological roulette: the global transport of nonindigenous marine organisms. Science 261:78-82. [ Links ]
13. Celis, J.S. 2013. Evaluación del efecto de las intoxicaciones alimentarias de origen marino sobre el turismo y la salud pública en la isla de San Andrés. Tesis de Maestría en Estudios del Caribe. Univ. Nacional de Colombia, San Andrés, Colombia. 102 p. [ Links ]
14. Chinain, M., M. Germain, X. Deparis, S. Pauillac & A.M., Legrand. 1999. Seasonal abundance and toxicity of the dinoflagellate Gambierdiscus spp. (Dinophyceae), the causative agent of ciguatera in Tahiti, French Polynesia. Marine Biology 135: 259-267. [ Links ]
15. Cortés-Altamirano, R. & A. Sierra-Beltrán. 2003. Morphology and taxonomy of Prorocentrum mexicanum and reinstatement of Prorocentrum rhathymum (Dinophyceae). Journal of Phycology 39: 221-225. [ Links ]
16. Delgado, G., G. Popowski & M.C. Pombo. 2002. Nuevos registros de dinoflagelados tóxicos epibenticos en Cuba. Nota Científica. Revista de Investigaciones Marinas 23(3): 229-232. [ Links ]
17. Delgado, G., C.H. Lechuga, G. Popowski, L. Troccoli & C.A. Salinas. 2006. Epiphytic dinoflagellates associated with Ciguatera in the northwestern coast of Cuba. Revista de Biología Tropical 54(2): 299-310. [ Links ]
18. Díaz, J.M., L.M. Barrios & D.I. Gómez-López (eds.). 2003. Praderas de pastos marinos en Colombia: Estructura y distribución de un ecosistema estratégico. INVEMAR, series publicaciones especiales No. 10, Santa Marta, 160 p. [ Links ]
19. FAO. 2005. Biotoxinas marinas. Organización de las Naciones Unidas para la Agricultura y la Alimentación. 52 p. [ Links ]
20. Faust, M.A. 1993a. Tree new benthic species of Prorocentrum (Dinophyceae) from Twin Cays, Belize: P. maculosum sp. nov., P. foraminosum sp. nov and P. formosum sp. nov. Phycologia 32(6): 410-418. [ Links ]
21. Faust, M.A. 1993b. Surface morphology of the marine dinoflagellate Sinophysis microcephalus (Dinophyceae) from a mangrove island, Twin Cays, Belize . Journal of Phycology 29: 355-363. [ Links ]
22. Faust, M.A. 2000. Dinoflagellate associations in a coral reef-mangrove ecosystem: Pelican and associated cays, Belize . Atoll Research Bulletin 473: 133-149. [ Links ]
23. Faust, M.A. 2004. The dinoflagellates of Twin Cays: biodiversity, distribution, and vulnerability. Atoll Research Bulletin 514: 1-22 [ Links ]
24. Faust, M.A. 2009. Ciguatera-causing dinoflagellates in a coral-reef-mangrove ecosystem, Belize . Atoll Research Bulletin 569: 1-32. [ Links ]
25. Faust, M.A., J. Larsen & O. Moestrup. 1999. Ices Identification leaflets for plankton. Potentially toxic phytoplankton. Inter Council for the Exploration of the Sea 184: 1-24. [ Links ]
26. Faust, M.A. & R. Gulledge. 2002. Identifying Harmful Marine Dinoflagellates. Contributions from the United States National Herbarium 42: 1-144. [ Links ]
27. Faust, M.A., R. Litaker, M. Vandersea, S.R. Kibler & P.A. Tester. 2005. Dinoflagellates diversity and abundance in two belizean coral-reef mangrove lagoons: a test of Margalef's Mandala. Atoll Research Bulletin. 534: 103-131. [ Links ]
28. Friedman, M., E. Lora, E. Fleming, M. Fernandez, P. Bienfang, K. Schrank, R. Dickey, M.Y. Bottein, L. Backer, R. Ayyar, R. Weisman, S. Watkins, R. Granade & A. Reich. 2008. Ciguatera Fish Poisoning: Treatment, Prevention and Management. Review of Marine Drugs 6: 456-479. [ Links ]
29. Fukuyo, Y. 1981. Taxonomical study on benthic dinoflagellates collected in coral reefs. Bulletin of the Japanese Society of Scientific Fishery 47(8): 967-978. [ Links ]
30. Galeano, E. 2012. Fenología reproductiva y diversidad genética de Thalassia testudinum Banks ex Köning (Hydrocharitaceae) en la isla de San Andrés. Tesis de Maestría en Ciencias Biología – línea Biología Marina. Univ. Nacional de Colombia, San Andrés, Colombia. 105 p. [ Links ]
31. Gavio, B., S. Palmer-Cantillo & J.E. Mancera-Pineda. 2010. Historical analysis (2000–2005) of the coastal water quality in San Andrés Island, SeaFlower Biosphere Reserve, Caribbean Colombia. Marine Pollution Bulletin 60:1018–1030. [ Links ]
32. GEOHAB 2012. Global Ecology and Oceanography of Harmful Algal Blooms, GEOHAB Core Research Project: HABs in Benthic Systems. E. Berdalet, P. Tester, A. Zingone (Eds.) IOC of UNESCO and SCOR, Paris y Newark, 64 pp. [ Links ]
33. Gonzáles, L. & J. Díaz. 2008. Distribución de dinoflagelados epifitos potencialmente tóxicos asociados a praderas de Thalassia testudinum en la isla La Tortuga, la Bahía de Mochima y el Golfo de Cariaco, Venezuela. Boletín Instituto Oceanografico de Venezuela 47(1):47-58. [ Links ]
34. Granéli, E., M. Weberg, P.S. Salomon. 2008. Harmful algal blooms of allelopathic microalgal species: The role of eutrophication. Harmful Algae 8: 94-102. [ Links ]
35. Hallegraeff, G.M. 1993. A review of harmful algal blooms and their apparent global increase. Phycologia 32:7 9-99. [ Links ]
36. Hallegraeff, G., D.M. Anderson, Ai.D. Cembella & H.O. Enevoldsen. 2003. Manual on harmful marine microalgae. UNESCO Publishing, 793 pp. [ Links ]
37. Heisler, J., P.M. Glibert, J.M. Burkholder, D.M. Anderson, W. Cochlan & W.C. Dennison. 2008. Eutrophication and harmful algal blooms: A scientific consensus. Harmful Algae 8:3-13 [ Links ]
38. Hernández-Becerril, D.U., R. Cortés-Altamirano & R. Alonso. 2000. The dinoflagellates genus Prorocentrum along the coasts of the Mexican Pacific. Hydrobiologia 418: 111-121. [ Links ]
39. Hernández-Becerril, D.U. & A. Almazán-Becerril. 2004. Especies de dinoflagelados del género Gambierdiscus (Dinophyceae) del Mar Caribe mexicano. Revista de Biología Tropical 52(1): 77-87. [ Links ]
40. Herndl, G.J. 1991. Microbial biomass dynamics along a trophic gradient at the Atlantic Barrier Reef off Belize ( Central America). Marine Ecology 12(1):41-51. [ Links ]
41. Hinojosa, I., E. Gonzales, P. Ugalde, N. Valdivia & E. Macaya. 2007. Thiel M. Distribution and abundance of floating seaweeds and their associated peracarid fauna in the Fjords and channels of the XI region Chile . Ciencia y Tecnología Marina 30(2): 37-50. [ Links ]
42. Hurbungs, M.D., N. Jayabalan & V. Chineah. 2001. Seasonal distribution of potentially toxic benthic dinoflagellates in the lagoon of Trou aux Biches, Mauritius . Food and Agricultural Research Council, Réduit, Mauritius 211-217. [ Links ]
43. IGAC. 1986. San Andrés y Providencia: Aspectos geográficos. Instituto Geográfico Agustín Codazzi. Bogotá D.E. 156. [ Links ]
44. Lagos, N. 2002. Principales toxinas de origen fitoplanctónico: identificación y cuantificación mediante cromatografía líquida de alta resolución (hplc). En: Sar, E.A, M.E. Ferrairo and B. Reguera. Floraciones algales nocivas en el cono Sur Americano. Instituto Español de Oceanografia 21-52. [ Links ]
45. Laurent, D., A. Kerbrat, T. Darius, C. Peyraud-Thomas, A. Mejean, J. Molgo, L. Llewellyn, N. Tandeau de Marsac, R. Lewis, S. Golubic. 2008. A new ecotoxicological phenomenon related to marine benthic Oscillatoriales (cyanobacteria) blooms. Ciguatera and Related Biotoxins Workshop, Noumea, New Caledonia, 27-31 October 2008. Secretariat for the Pacific Community, Noumea, New Caledonia 17-22. [ Links ]
46. Lehane, L. & R.J. Lewis. 2000. Ciguatera: recent advances but the risk remains. International Journal of Food Microbiology 61:91-125. [ Links ]
47. Lewis, R.J. & M. Stelin. 1992. Multiple ciguatoxins in the flesh of fish. Toxicon 30(8):915-919. [ Links ]
48. Maciá, S. 2000. The effects of sea urchin grazing and drift algal blooms on a subtropical seagrass bed community. Journal of Experimental Marine Biology and Ecology 246:53-67. [ Links ]
49. Mancera-Pineda, J.E., B. Gavio & G. Arencibia. 2010a. Floraciones algales nocivas, intoxicación por microalgas e impactos en el desarrollo regional: El caso de San Andrés Isla, Caribe Colombiano. Cuadernos del Caribe 13: 46-62. [ Links ]
50. Mancera-Pineda, J.E., L. Guerra, S.C. Ruiz, M.A. Malo, S.P. Pérez, A. León, E. Herrera-Guisao & A.M. Cadavid. 2010b. Evaluación Preliminar del Impacto de las descargas del Emisario Submarino de San Andrés en Agua y Bentos. Informe Final. Universidad Nacional de Colombia, sede caribe. San Andrés isla. 172 pp. [ Links ]
51. Mimura, N., L. Nurse, R.F. McLean, J. Agard, L. Briguglio, P. Lefale, R. Payet & G. Sem. 2007. Small islands. Climate Change 2007: Impacts, Adaptation and Vulnerability. Contribution of Working Group II to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change, M.L. Parry, O.F. Canziani, J.P. Palutikof, P.J. van der Linden and C.E. Hanson, Eds., Cambridge University Press, Cambridge, Reino Unido, 687-716. [ Links ]
52. Morton, S. L., M.A. Faust, E.A. Fairey & P.D. Moeller. 2002. Morphology and toxicology of Prorocentrum arabianum sp. nov., (dinophiceae) a toxic planktonic dinoflagellate from the Gulf of Oman, Arabian Sea. Harmful Algae 1: 393-400. [ Links ]
53. Nordström, M. & D. Booth. 2007. Drift algae reduce foraging efficiency of juvenile flatfish. Journal of Sea Research 58:335-341. [ Links ]
54. Nunn, P. 1987. Small islands and geomorphology: review and prospect in the context of historical geomorphology. Transactions of the Institute of British Geographers 12: 227-239. [ Links ]
55. Orav-Kotta, H. 2004. Habitat choice and feeding activity of benthic suspension feeders and mesograzers in the Northern Baltic Sea. Dissertation Biology University Tart 89: 1-52. [ Links ]
56. Ortiz, J.F. & B. Gavio. 2012. Notes on the marine algae of the International Biosphere Reserve Seaflower, Caribbean Colombia II: diversity of drift algae in San Andres island, Caribbean Colombia. Caribbean Journal of Science 46(2-3):313-321. [ Links ]
57. Pear, H.W. & D.R. Whital. 1999. Anthropogenically-driven atmospheric nitrogen deposition, marine eutrophication and harmful algal bloom expansion: is there a link? Ambio 28:307-311. [ Links ]
58. Peña-Manjarrez, J. L., J. Helenes, G. Gaxiola-Castro & E. Orellana-Cepeda. 2005. Dinoflagellate cysts and bloom events at Todos Santos Bay, Baja California, México, 1999-2000. Continental Shelf Research 25: 1375-1393. [ Links ]
59. Rodríguez, A., J.E. Mancera-Pineda & B. Gavio. 2010. Preliminary Survey of Benthic Dinoflagellates Associated to Beds of Thalassia testudinum in San Andrés Island, Seaflower Biosphere Reserve, Caribbean Colombia. 2010. Acta Biológica Colombiana 15(2):231-248. [ Links ]
60. Sánchez-Núñez, D.A. & J.E. Mancera-Pineda. 2011. Flowering patterns in three neotropical mangrove species: Evidence from a Caribbean island. Aquatic Botany 94: 177-182. [ Links ]
61. Schofield, O., J. Grzymski, M. Moline & R. Jovine. 1998. Impact of temperature acclimation on photosynthesis in the toxic red-tide dinoflagellate Alexamdrium fundyense (Ca28). Journal of Plankton Research 20(7): 1241-1258. [ Links ]
62. Skinner, M., T. Brewer, R. Johnstone, L. Fleming & R. Lewis. 2011. Ciguatera Fish Poisoning in the Pacific Islands (1998 to 2008). PLoS Negl Trop Dis 5(12): e1416. doi:10.1371/journal.pntd.0001416. [ Links ]
63. Stinn, J.F, D.P. De Sylva, L.E. Fleming & E. Hack. 2000. Geographic information systems and ciguatera fish poisonings in the tropical western Atlantic region. In: Williams RC, Howie MM, Lee CV, Henriques WD, eds. Proceedings of the 1998 Geographic Information Systems in Public Health, Third National Conference, San Diego, CA. pp 223–233. [ Links ]
64. Taylor, F.J.R. 1985. The distribution of the dinoflagellates Gambierdiscus toxicus in the eastern Caribbean. Pp. 423–428 in Proceedings of the 5th International Coral Reef Congress, vol. 4. Antenne Museum-EPHE, Tahiti. [ Links ]
65. Tester, P.A., R. L. Feldman, A.W. Nau, S.R. Kibler & R.W. Litaker. 2010. Ciguatera fish poisoning and sea surface temperatures in the Caribbean Sea and the West Indies. Toxicon 56: 698–710. [ Links ]
66. Tomas, C. R. 1996. Identifying marine diatoms and dinoflagellates. Editorial Academic Press, Inc. Londres. [ Links ]
67. Van Dolah, F.M. 2000. Marine Algal Toxins: Origins, Health Effects, and Their Increased Occurrence. Environmental Health Perspectives 108(1): 133-141. [ Links ]













