Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232
Caldasia vol.37 no.2 Bogotá July/Dec. 2015
https://doi.org/10.15446/caldasia.v37n2.53986
FRANGER J. GARCÍA
DAYANA ARAUJO-REYES
ORIANA VÁSQUEZ-PARRA
HENDRIX BRITO
MARJORIE MACHADO
RESUMEN
Las cuevas constituyen un recurso importante para murciélagos en los bosques, ya que ofrecen protección y condiciones climáticas que favorecen la reproducción, especialmente para aquellas especies con hábitos cavernícolas. Durante 12 meses (2013-2014), se llevó a cabo un estudio sobre el uso de una cueva por parte de murciélagos en el Parque Nacional Yurubí-Sierra de Aroa, Estado Yaracuy, Venezuela. Se colocó una trampa de arpa una vez por mes y estuvo activa antes de que los murciélagos emergieran del refugio. Después de tomar datos sobre abundancia, los individuos se marcaron y se liberaron en el sitio. Se registraron seis especies pertenecientes a las familias Mormoopidae y Phyllostomidae. Pteronotus parnellii, Anoura geoffroyi y Carollia perspicillata fueron capturados todos los meses y en los tres se observó indicios reproductivos. Pteronotus parnellii y Anoura geoffroyi fueron los más abundantes con una mayor presencia para el primero. Por otro lado, Phyllostomus hastatus, Lonchorhina aurita y Desmodus rotundus usaron el refugio temporalmente, sin evidenciar alguna condición reproductiva. Se observaron cambios en el tamaño de las colonias y la composición de especies, evidencia de que el refugio es usado permanentemente por algunas especies durante la reproducción y de forma temporal por otras, que aparentemente se estarían favoreciendo sólo del resguardo que ofrece.
Palabras clave. Mormoopidae, Phyllostomidae, refugios, uso de cuevas.
ABSTRACT
For bats, caves represent an important resource within forests because they offer protection and favorable microclimatic conditions for reproduction, especially for cave-dwelling bats. Over 12 months (2013-2014), we studied a cave used by bats in an evergreen forest in the Yurubí National Park-Sierra de Aroa, Yaracuy State, Venezuela. For one night each month, we placed one harp trap in the entrance to the cave and activated it before the bats emerged from the cave. We captured six species from the families Mormoopidae and Phyllostomidae. Pteronotus parnellii, Anoura geoffroyi and Carollia perspicillata were recorded in every month, occasionally with signs of reproductive activity for some individuals. In every month, P. parnellii and A. geoffroyi showed the highest number of individuals. On the other hand, Phyllostomus hastatus, Lonchorhina aurita and Desmodus rotundus used the roost only in some months, without any evidence of reproductive activity. Overall, in the cave there were substantial changes in species composition and size of the colonies over time, indicating that it was a permanent roost for some species (which might use it for reproduction) but only an occasional shelter for other species.
Key words. Mormoopidae, Phyllostomidae, roosts, cave use.
Recibido: 04/04/2014
Aceptado: 28/09/2015
INTRODUCCIÓN
Los refugios para murciélagos constituyen un recurso físico importante, ya que ofrecen entre otros aspectos, protección de la luz del día, condiciones climáticas internas favorables en la época de la reproducción y resguardo ante potenciales depredadores (Kunz 1982). Se ha documentado una amplia lista de sitios utilizados como refugios por murciélagos, siendo considerados los siguientes como algunos de los más comunes: cuevas, grietas en rocas, huecos en árboles y en troncos caídos, sobre y dentro de la corteza de árboles, en raíces, sobre el dosel, entre el follaje y en infraestructuras realizadas por el hombre (Kunz 1982, Lewis 1995, Wilson 1997).
Particularmente, las cuevas o cavernas ofrecen condiciones de microclima y protección que favorecen a un grupo importante de murciélagos, llamados "murciélagos cavernícolas" (Kunz 1982, Martino et al. 1997, Brunet & Medellín 2001). Comúnmente las especies habitantes de este tipo de refugio tienen un comportamiento gregario, formando grupos o colonias de miles de individuos (e. g., Pteronotus davyi; Matson & Brown 1974) o en otros casos refugiándose de manera solitaria, en harenes o pequeños grupos que pueden alcanzar cientos de ellos (e. g., Anoura geoffroyi; Ortega & Alarcón-D 2008).
En ocasiones, estos refugios sólo son utilizados para protección, cópula e interacciones sociales y luego son abandonados (Torres-Flores et al. 2012); en otros casos pueden ser sitios permanentes que involucran protección, reproducción, desarrollo de la gestación y levantamiento de las crías hasta que las mismas se hacen independientes (Kunz 1982).
La disponibilidad de cuevas que puedan ser utilizada como un refugio permanente y que reúna las condiciones climáticas, de protección y ecológicas para una especie en particular, permitiría reducir los costos energéticos que ocasiona moverse continuamente en refugios alternos en búsqueda de áreas óptimas, además de que se disminuye los posibles riesgos de depredación (Lewis 1995). Debido a esto en la mayoría de los casos, es común observar a varias especies de murciélagos con diferentes requerimientos ecológicos compartiendo una misma cavidad pero utilizando distintos microambientes dentro del mismo refugio (Torres-Flores et al. 2012, Brunet & Medellín 2001).
En Venezuela existe una modesta diversidad de murciélagos con preferencias por utilizar cuevas como refugios en alguna etapa de su vida (38% del total nacional) (Linares 1998). Están incluidos en seis de las nueves familias presentes en el país (Emballonuridae, Mormoopidae, Phyllostomidae, Natalidae, Vespertilionidae y Molossidae) y para la mayoría su supervivencia podría depender de la disponibilidad y el acceso a este tipo de refugios en los diferentes hábitats.
Aunque se ha mencionado un considerable número de especies de murciélagos cavernícolas en el país, existen muy pocas investigaciones (e. g., Martino et al. 1997, Ochoa et al. 2005, Ruíz & Soriano 2005) en donde se documenten y estudien por periodos prolongados (≥ 1 año) las colonias de murciélagos asociados con cuevas. El siguiente trabajo tuvo como objetivo documentar el uso de una cueva por parte de una comunidad de murciélagos cavernícolas, en un bosque de la Sierra de Aroa, y a su vez, caracterizar el espacio físico del refugio, como un aporte a la información biológica de las especies en estudio.
MATERIALES Y MÉTODOS
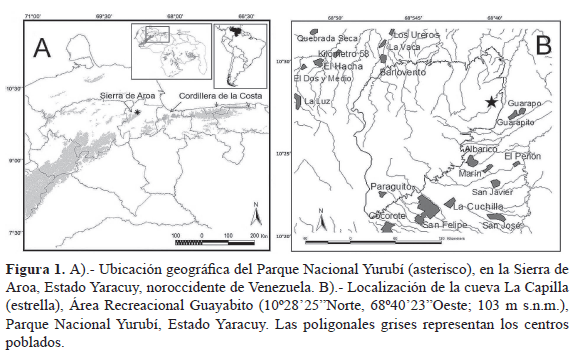
Área de estudio: El trabajo se realizó en una cueva localizada en el Parque Nacional Yurubí, Sierra de Aroa (Estado Yaracuy, noroccidente de Venezuela; Fig. 1). La cueva "La Capilla", conocida con ese nombre por los pobladores locales, se encuentra ubicada en la quebrada "La Mona", del Área Recreacional Guayabito. Es un área dominada por un bosque siempreverde (Hubber & Alarcón 1988). La temperatura promedio para la zona oscila entre 10-26.5 °C y la precipitación anual varía de 800-1580 mm (Delgado-Jaramillo et al. 2011).
Caracterización física de la cueva. Se tomaron las medidas de largo, ancho y alto máximo de cada una de las cámaras que conforman esta cavidad con el uso de una cinta métrica de 50 m de longitud. Se utilizó un GPS (marca Garmin), para la obtención del norte magnético con respecto a la cueva, coordenadas geoespaciales y altitud; estos datos se tomaron en la entrada de la cueva. La temperatura y humedad se registrarón mensualmente con un termo-higrómetro ubicado en la parte final de la cámara externa de la cueva sin la presencia de los murciélagos; estos datos se registraron aproximadamente a las 21:00 horas en todos los meses.
Muestreo de las colonias de murciélagos. El protocolo establecido para los registros de las diferentes especies presentes en la cueva sigue a Martino et al. (1997), Ochoa et al. (2005) y Ruíz & Soriano (2005). El trabajo de campo contempló la realización de una salida por mes, comenzando en febrero de 2013 y finalizando en enero de 2014, para un total de 12 meses de muestreo.
Para hacer observaciones sobre el uso del espacio por parte de las diferentes especies de murciélagos en la cueva, uno de los autores (FJG) con experiencia en la identificación de los taxones presentes allí estuvo encargado de entrar mensualmente a la caverna antes de la emergencia de los murciélagos y tomar notas sobre la distribución espacial y conformación de los grupos de animales en toda la cueva. La operación se realizó con el apoyo de una linterna de manos libre (uso frontal) y tratando de causar el menor impacto al momento de realizar las observaciones.
Para obtener los datos utilizados posteriormente en la evaluación de la dinámica poblacional se empleó una trampa de arpa (austrabat) de 4 m2 ubicada en la entrada de la cueva y cubierta con tres extensiones de plásticos de polietileno en los espacios periféricos que evitaba que los murciélagos evadieran la trampa. El período de actividad de la trampa fue desde las 17:30 hasta las 20:00 horas. S se colocó una vez por cada salida y antes de que los murciélagos emergieran. Luego al confirmar que no había más murciélagos dentro de la cueva, la trampa era desactivada una vez que se revisaba que todos los animales habían emergido de ambas cámaras.
Para evitar censar un individuo varias veces, los mismos fueron marcados, cortando el pelaje a nivel del hombro superior derecho (Delgado-Jaramillo et al. 2011); esto se realizó ya que en ocasiones al momento de liberar algún murciélago ocurrieron vuelos de retorno al refugio. Al final del estudio se colectó una serie de referencia para verificar las identidades taxonómicas, la cual fue depositada en el Museo de Zoología de la Universidad de Carabobo (MZUC-Valencia, Estado Carabobo, Venezuela).
Se tomaron los siguientes datos biológicos para las especies presentes en la cueva: composición de la comunidad, la abundancia de individuos de cada una de las especies, condición reproductiva, proporciones de sexos y clase etaria. La información analizada en este estudio considera sólo los primeros tres atributos. La condición reproductiva se documentó siguiendo a Martino et al. (1998): machos escrotados y no escrotados, evidenciado por el desarrollo y posición de los testículos. Las hembras se clasificaron como preñadas, no preñadas, lactantes y post-lactantes por palpación directa sobre el abdomen, desarrollo y observación de los pezones.
Por último, para probar si existían diferencias significativas mensualmente con respecto a la estructura (en este caso, abundancia) de cada una de las especies, se empleó la prueba no paramétrica de Kruskal-Wallis (Zar 1996), mediante el programa PAST, versión 1.90 (Hammer et al. 2001).
RESULTADOS
La cueva se encuentra ubicada en sentido noroeste (10°28'25"Norte, 68°40'23"Oeste), a una altitud de 103 m s.n.m. La constitución mineral es de carbonato de calcio (roca caliza), con abundantes formaciones de estalactitas y estalagmitas; posee una sola entrada muy amplia (altura 4.24 m y ancho 5.27 m), conformada por dos cámaras, denominadas aquí cámara interna y externa. La cámara interna tiene una pequeña entrada de 1.10 m de alto y 1.20 m de ancho; longitud total de 5.60 m; altura máxima de 2.40 m y ancho máximo de 2.20 m. Presenta una alta cantidad de pequeñas fisuras y grietas sobre la pared y techo, pero sin formaciones de avons (depresiones cónicas en el techo de las cuevas). La cámara externa mide 9.17 m de largo; tiene una altura máxima de 4.50 m y ancho máximo de 3.48 m. En esta cámara abundan los avons en casi toda la extensión del techo. El largo total de la cueva fue 14.77 m. La temperatura varió durante el año con la mínima en 21 °C (julio y agosto) y la máxima de 30 °C (octubre y noviembre), promediando 24 °C (s=2.42). La humedad relativa mínima fue 77 % (noviembre) y la máxima 89 % (marzo, junio, julio y agosto), promediando 86 % (s=3.44).
Se capturaron a lo largo del año 1470 individuos (Tabla 1), pertenecientes a seis especies de murciélagos incluidos en dos familias: Pteronotus parnellii (Mormoopidae), Anoura geoffroyi, Desmodus rotundus, Carollia perspicillata, Lonchorhina aurita y Phyllostomus hastatus (Phyllostomidae).
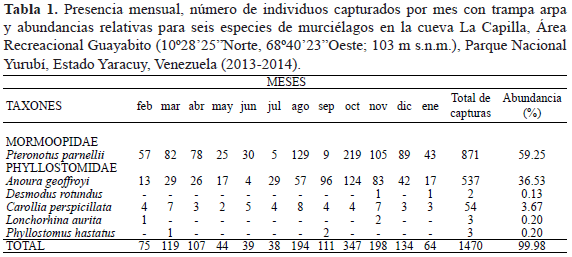
Tres especies estuvieron presentes de manera continua, al menos durante el transcurso del estudio: P. parnellii, A. geoffroyi y C. perspicillata. Por otro lado, P. hastatus, L. aurita y D. rotundus se registraron sólo en tres meses (Tabla 1). De acuerdo con la prueba de Kruskal-Wallis, hubo diferencias significativas de abundancia mensual entre las dos especies más frecuentes (P. parnellii y A. geoffroyi) con respecto al resto de las especies presentes en la cueva durante el año (p=2.782-12). Sin embargo, al comparar las abundancias mensuales entre éstas no hubo diferencias significativas (p=0.9987), a pesar de que la Tabla 1 muestra valores mensuales contrastantes.
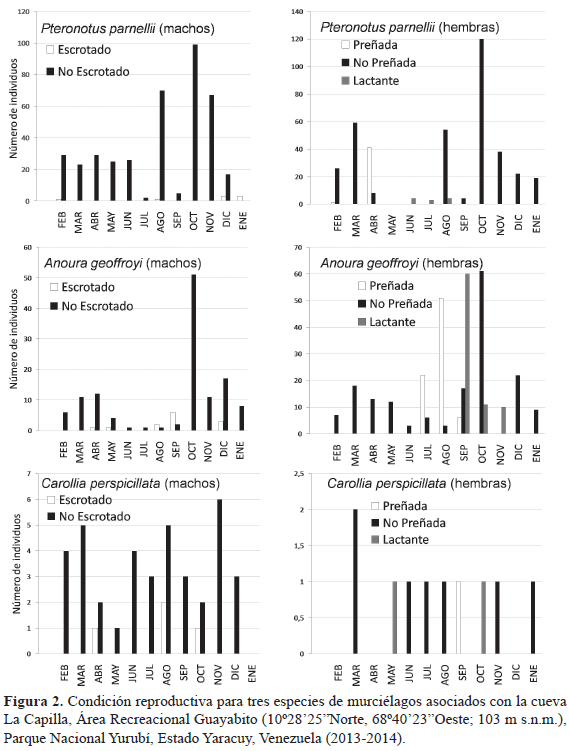
En cuanto a eventos reproductivos, en la figura 2, se detalla los individuos registrados con alguna condición de reproducción durante el transcurso del trabajo. Los resultados se pueden resumir de la siguiente manera: se observó una única hembra de P. parnellii con preñez incipiente en el primer mes de muestreo y una mayor cantidad en avanzado estado de preñez para el tercer mes; las pocas hembras en lactancia fueron registradas en tres meses de manera continua y los machos escrotados en tres meses no continuos. Se evidenció un periodo de gestación de tres meses para hembras de A. geoffroyi, mientras que las hembras en lactancia fueron observadas en tres meses continuos y los machos escrotados en cinco meses no continuos. Para C. perspicillata, hubo un registro de una hembra preñada en un único mes, así como la captura de una hembra con su cría en lactancia, pegada al pezón en el cuarto mes; los machos escrotados de esta especie se registraron en cinco meses no continuos. En las especies restantes no se logró evidenciar alguna condición reproductiva durante la investigación.
Con respecto al uso y la dinámica del espacio en la cueva, en el inicio del trabajo P. parnellii formó un grupo en ambas cámaras en los dos primeros meses (febrero y marzo); al mismo tiempo, individuos de A. geoffroyi se agruparon sólo en la cámara externa, compartiendo ese espacio pero ocupando microhábitats diferentes con respecto a P. parnellii y con los pocos individuos de C. perspicillata, P. hastatus y L. aurita.
Posteriormente, en abril cuando las hembras de P. parnellii evidenciaron una preñez avanzada (observado por palpación directa sobre los individuos capturados con la trampa de arpa), se formaron grupos sexualmente segregados con hembras ocupando el espacio de la cámara interna y machos refugiándose en la cámara externa en un grupo muy reducido. En los tres meses siguientes (mayo, junio y julio), la colonia estuvo conformada en su mayoría por machos, ya que las hembras en avanzado estado de preñez dejaron la cueva antes de que ocurrieran los partos (a partir de mayo). Después se registró nuevamente la presencia de hembras (sólo unas pocas lactando) y machos adultos, la mayoría sin evidenciar alguna condición reproductiva.
Cuando ocurrió el momento de gestación para las hembras de A. geoffroyi (evidenciado por palpación directa sobre los individuos capturados con la trampa de arpa), éstas ocuparon exclusivamente la cámara interna en una colonia conformada igualmente por una mayor cantidad de hembras en avanzado estado de preñez y algunas con crías aún en lactancia; al igual que P. parnellii, los machos de A. geoffroyi fueron desplazados a la cámara externa en un grupo reducido. Luego hubo un incremento de la población de A. geoffroyi en los meses siguientes, debido a la presencia de algunas crías ya comenzando a volar. En el tiempo de reproducción de A. geoffroyi, los individuos de P. parnellii fueron desplazados a la cámara exterior.
Después de acabar la fase reproductiva para las hembras de A. geoffroyi (aproximadamente seis meses; Fig. 2), en ambas cámaras volvieron a congregarse grupos sexualmente mixtos de las dos especies mencionadas y en ese tiempo se observó la presencia de L. aurita (dos individuos) y D. rotundus (dos), refugiados en la cámara interna con colonias de P. parnellii y A. geoffroyi; a su vez, varios individuos de C. perspicillata y dos P. hastatus, se refugiaron en la cámara externa.
DISCUSIÓN
Debido a su ubicación geográfica, unidad ecológica (bosque siempreverde), temperatura y geomorfología con una amplia entrada en sentido vertical que permite la circulación del aire, la cueva La Capilla podría ser considerada como una cueva cálida; aunque no se toma en cuenta en esta definición la influencia del calor generado por los murciélagos y las acumulaciones de grandes cantidades de guano, como se ha mencionado para cuevas ubicadas en islas (Rodríguez-Durán 2010, Ladle et al. 2012).
Si se considera sólo el promedio de temperatura registrada en la cueva (24 °C), para tratar de asignarla a una de las categorías propuestas por Rodríguez-Durán (2010), para refugios en las Antillas, entonces ésta puede ser clasificada como una "cueva con salones de cámaras calientes"; aunque no cumple con todas las premisas de este tipo de caverna (entrada o boca reducida, baja circulación del aire, acumulación de miles de individuos y grandes cantidades de guano).
Algunas de las cuevas en Venezuela donde se han registrado colonias importantes de murciélagos de las familias Phyllostomidae y Mormoopidae, son categorizadas como cuevas calientes (temperaturas ≥ 30 °C), efectivamente con entradas reducidas en sentido horizontal sobre el nivel del suelo y que restringen el flujo de aire, grandes colonias que sobrepasan los miles de individuos y grandes acumulaciones de guano; además que se encuentran ubicadas en la franja norte costera, en donde la vegetación semiárida y árida en conjunto con las temperaturas ambientales altas contribuyen con el microclima interno que presentan (Martino et al. 1997, Ochoa et al. 2005, Delfín et al. 2011).
Aunque todas las especies de murciélagos estudiadas en el presente trabajo están distribuidas en una amplia variedad de ecosistemas, hábitats y utilizan diferentes refugios en Venezuela (Handley 1976, Linares 1998), la mayoría prefieren cavidades o grietas como refugios principales (Linares 1998).
Tal como ha sido mencionadotanto para localidades venezolanas (e. g., Península de Paraguaná y Cordillera de Mérida) (Matson & Brown 1974, Martino et al. 1997, Ochoa et al. 2005, Ruíz & Soriano 2005, Delfín et al. 2011, Molinari et al. 2012), así como varios refugios en otras áreas del continente americano (e. g., Silva-Taboada 1979, Herd 1983, Lassieur & Wilson 1989, Baumgarten & Vieira 1994, Trajano & Gimenez 1998, Brunet & Medellín 2001, Santos et al. 2003, Ortega & Alarcón-D 2008, Sampedro Marín et al. 2008, Torres-Flores et al. 2012), la cueva evaluada fue compartida por diferentes especies y las mismas ocuparon espacios distintos en su interior. De igual manera como en la Península de Paraguaná (Bateman & Vaughan 1974, Martino et al. 1997), Cordillera de Mérida (Ruíz & Soriano 2005) y en dos localidades en México (Arroyos Charca, Sinaloa y la cueva El Salitre, Colima; Torres-Flores et al. 2012), ocurrieron fluctuaciones en cuanto al número de individuos de las especies presentes en los periodos de muestreos.
Los eventos reproductivos observados para P. parnellii y A. geoffroyi sugieren una concordancia con patrones de reproducción enunciados previamente para ambos en su área de distribución (Herd 1983, Ruíz & Soriano 2005, Ortega & Alarcón-D 2008). Pteronotus parnellii ha sido caracterizado por tener un patrón reproductivo de monoestro estacional, evidenciándose hembras preñadas y crías desde el mes de mayo hasta finales de julio, coincidiendo con la estación lluviosa y con el aumento de insectos (Herd 1983). En el presente trabajo, se registraron hembras con avanzada gestación al comienzo de las lluvias en el área (abril), pero debido al abandono del refugio (a partir de mayo) no fue posible documentar el periodo de lactancia y destete de las crías.
El comportamiento de desplazarse de un refugio a otro en la época de reproducción para ambos sexos de P. parnellii y otras especies de la familia Mormoopidae (e. g., Pteronotus quadridens y Mormoops megalophylla), también se ha registrado en otras localidades. Torres-Flores et al. (2012), mencionan que los machos de P. parnellii y hembras de M. megalophylla en la cueva El Salitre (México), utilizaron el refugio sólo para la cópula y luego lo abandonaron; en el caso de los mormópidos en Cuba, Silva-Taboada (1979), desconoce totalmente la razón de esos desplazamientos. Para los eventos de migraciones de las hembras preñadas de P. parnellii observadas en la cueva La Capilla, se estima que sucede algo similar a lo ocurrido en México, ya que en el área existe una abundancia alta de pequeñas cuevas y grietas, pero de muy difícil acceso con características similares a ésta, lo cual suponemos que las hembras las pueden usar para formar colonias maternales; estas cuevas podrían ser más seguras o reunir condiciones microclimáticas más favorables para el levantamiento de las crías (García obs. Pers.). Futuras exploraciones en algunas de esas cavidades podrán esclarecer esta interrogante.
En cuanto a los eventos de reproducción para la colonia de A. geoffroyi se observaron hembras preñadas en julio, agosto y septiembre; meses en los cuales comenzaron a disminuir gradualmente las precipitaciones en el área de estudio. A diferencia de P. parnellii, las hembras de A. geoffroyi utilizaron la cueva como un refugio maternal. Comportamientos similares fueron registrados para una colonia estudiada por dos años en México (Galindo-Galindo et al. 2000), otra en Brasil por un año (Baumgarten & Vieira 1994) y también para colonias de dos especies más de la subfamilia Glossophaginae (Glossophaga longirostris y Leptonycteris curasoe), en Venezuela (Martino et al. 1997, Ochoa et al. 2005). La tendencia de reproducción señalada para A. geoffroyi es monoestro estacional con ocurrencias de los partos para finales de la estación de lluvia (Ruíz & Soriano 2005, Ortega & Alarcón-D 2008).
El uso de cuevas por parte de integrantes de las familias Mormoopidae y Phyllostomidae en Venezuela, puede estar asociado, entre otros aspectos, con requerimientos fisiológicos y reproductivos, derivado de las temperaturas internas que ofrecen (Bonnaccorso et al. 1992, Martino et al. 1997, Ochoa et al. 2005, Delfín et al. 2011). Como un ejemplo de esto último, en el Estado Falcón, noroccidente de Venezuela hay un sistema cavernario decretado como "Santuario de Fauna Silvestre Cuevas de Paraguaná" (República Bolivariana de Venezuela 2008, Delfín et al. 2011, Molinari et al. 2011), en donde algunas especies de murciélagos residentes y migratorias de las familias Natalidae, Mormoopidae y Phyllostomidae ocupan las diferentes cuevas del sistema en un periodo establecido para reproducirse y levantar a las crías, favoreciéndose de las condiciones de temperaturas internas (Ochoa et al. 2005, Delfín et al. 2011, Molinari et al. 2011).
En la cueva La Capilla, tal vez se presenta una situación similar en cuanto al uso constante por parte de poblaciones de murciélagos de P. parnellii y A. geoffroyi; en este caso, los individuos de ambas especies forman poblaciones residentes en dicha cueva y otras poblaciones tal vez estarían llegando de diferentes áreas del Parque Nacional Yurubí a reproducirse, beneficiándose de las condiciones de temperaturas internas que en conjunto con el calor generado por sus cuerpos pueden estimular el desarrollo de los embriones y las crías, además de la protección que les garantiza. Esta cueva está siendo visitada desde el año 2003 por los autores (García et al. 2012) y desde ese entonces se han observados colonias de P. parnellii y A. geoffroyi. La evidencia de la permanencia por más de diez años de especies de hábitos gregarios y cavernícolas, con requerimientos de condiciones óptimas de temperatura y humedad demuestra que la cueva cumple con las exigencias fisiológicas y de reproducción para mantener poblaciones estables de murciélagos en el área de estudio.
La alta fidelidad de una o varias especies a un refugio en particular, garantizaría la supervivencia y éxito de sus poblaciones en un área dada (Lewis 1995). Lo anteriormente señalado puede dar una idea del papel ecológico y la importancia que tienen las cuevas en los bosques tropicales y en particular la cueva La Capilla en el Parque Nacional Yurubí. Este refugio evidentemente contribuye con la dinámica poblacional en la zona manteniendo colonias de murciélagos que utilizan el recurso para protección, reproducción y levantamiento de las crías como es el caso de P. parnellii y A. geoffroyi y a su vez, otras aprovecharían la cueva como un refugio temporal, favoreciéndose del resguardo que les garantiza.
AGRADECIMIENTOS
Agradecemos a Héctor Manuel Silva, Antonio Pérez Sarmiento, Andrés Gollo, Tomás Naranjo, Nashira Figueroa, Maríajose Rodríguez, María Pinto, Luis Aular Müsle, Fernando Rojas-Runjaic, Wendy Bolaños, Franddy Alexander García, Yoiber Mújica, Renny Pacheco y Anakarina Bello por su ayuda y apoyo para la realización de todo el trabajo de campo. A Hilda Siliet y Edward Camargo-Siliet por su colaboración en el hospedaje en la finca "Vista al Yurubí". A José Ochoa-G., por su valiosa colaboración en el préstamo de la trampa de arpa. A Elvira Sánchez-González por la realización de los mapas y Robert P. Anderson por la corrección del resumen en inglés. Al personal de INPARQUES-Yaracuy y en especial a Andrés Pacheco por los permisos y colaboración correspondiente para trabajar en el Parque Nacional Yurubí. Al personal de la Milicia Bolivariana destacado en el puesto de Guardaparques del sector Guayabito y finalmente a cuatro revisores anónimos por sus contribuciones y sugerencias para mejorar la primera versión del manuscrito.
LITERATURA CITADA
1. Bateman, G.C. & T.A. Vaughan. 1974. Nightly activities of mormoopid bats. Journal of Mammalogy 55: 45-65. [ Links ]
2. Baumgarten, J.E. & E.M. Vieira. 1994. Reproductive seasonality and development of Anoura geoffroyi (Chiroptera: Phyllostomidae) in Central Brazil. Mammalia 58: 415-422. [ Links ]
3. Bonnaccorso, F.J., A. Arends, M. Genoud, D. Cantoni & T. Morton. 1992. Thermal ecology of moustached and ghost-faced bats (Mormoopidae) in Venezuela. Journal of Mammalogy 73: 365-378. [ Links ]
4. Brunet, A.K. & R.A. Medellín. 2001. The species-area relationship in bat assemblages of tropical caves. Journal of Mammalogy 82: 1114-1122. [ Links ]
5. Delfín, P., J. Ochoa-G. & A. Castillo. 2011. Santuario de Fauna Silvestre Cuevas de Paraguaná, Venezuela: lineamientos técnicos para su diseño. Terra 27: 13-45. [ Links ]
6. Delgado-Jaramillo, M.I., M. Machado, F.J. García & J. Ochoa-G. 2011. Murciélagos (Chiroptera: Mammalia) del Parque Nacional Yurubí, Venezuela: listado taxonómico y estudio comunitario. Revista de Biología Tropical 59: 1757-1776. [ Links ]
7. Galindo-Galindo, C., A. Castro-Campillo, A. Salame-Méndez & J. Ramírez-Pulido. 2000. Reproductive events and social organization in a colony of Anoura geoffroyi (Chiroptera: Phyllostomidae) from a temperate Mexican cave. Acta Zoológica Mexicana 80: 51-68. [ Links ]
8. García, F.J., L. Aular, E. Camargo & Y. Mújica. 2012. Murciélagos de la Sierra de Aroa, Estado Yaracuy, Venezuela. Memoria de la Fundación La Salle de Ciencias Naturales 173-174: 135-154. [ Links ]
9. Hammer, O., D. Harper & P. Ryan. 2001. PAST: Paleontological software package for education and data analysis. Paleontologíaelectrónica 4: 1-9. [ Links ]
10. Handley, C.O.Jr. 1976. Mammals of the Smithsonian Venezuelan Project. Brigham Young University of Science Bulletin of the Biological Service 20: 1-90. [ Links ]
11. Herd, R.M. 1983. Pteronotus parnellii. Mammalian Species 209: 1-5. [ Links ]
12. Hubber, O. & C. Alarcón. 1988. Mapa de Vegetación de Venezuela: 1:2000.000. Ministerio del Ambiente y de los Recursos Naturales Renovables, Caracas, Venezuela. [ Links ]
13. Kunz, T.H. 1982. Roosting ecology of bats. En: T.H. Kunz (ed.). Ecology of bats:1-55. Plenum Press, Nueva York. [ Links ]
14. Ladle, R.J., J.V.L. Firmino, A.C.M. Malhado & A. Rodríguez-Durán. 2012. Unexplored diversity and conservation potential of Neotropical hot caves. Conservation Biology 26: 978-982. [ Links ]
15. Lassieur, S. & D.E. Wilson. 1989. Lonchorhina aurita. Mammalian Species. 347: 1-4. [ Links ]
16. Lewis, S.E. 1995. Roost fidelity of bats: a review. Journal of Mammalogy 76: 481-496. [ Links ]
17. Linares, O.J. 1998. Mamíferos de Venezuela. Sociedad Audobon de Venezuela, Caracas, Venezuela. 691 pp. [ Links ]
18. Martino, A., J. Aranguren & A. Arends. 1997. Los quirópteros asociados a la cueva de Piedra Honda (Península de Paraguaná, Venezuela): su importancia como reserva biológica. Acta CientíficaVenezolana 48: 182-187. [ Links ]
19. Martino, A., J. Aranguren & A. Arends. 1998. Reproductive pattern of the Leptonycteris curasoae Miller (Chiroptera: Phyllostomidae) in northern Venezuela. Mammalia 62: 69-76. [ Links ]
20. Matson, J.O. & F. Brown. 1974. Notes on some bats from a cave on Peninsula de Paraguaná, Venezuela. Bulletin Southern California Academy of Sciences 73: 52-53. [ Links ]
21. Molinari, J., J.M. Nassar, A. García-Rawlins & R.J. Márquez. 2012. Singularidad biológica e importancia socioeconómica de los murciélagos cavernícolas de la Península de Paraguaná, Venezuela, con propuestas para su conservación. Revista de Ecología Latinoamericana 17:1-40. [ Links ]
22. Ochoa-G., J., L. Colmenares, W. Irausquín, M. Toro, A. Martino & F.J. García. 2005. Conservación del sistema cavernario de la Península de Paraguaná (Estado Falcón) y su quiropterofauna asociada. Boletín de la Sociedad Venezolana de Espeleología 39: 64-64. [ Links ]
23. Ortega, J. & I. Alarcón-D. 2008. Anoura geoffroyi. Mammalian Species 818: 1-7. [ Links ]
24. Rodríguez-Durán, A. 2010. Bat Assemblages in the West Indies: the role of caves. En: T.H. Fleming & P.A. Racey (eds.). Island Bats: Evolution, ecology and conservation: 265-279. University of Chicago Press. Illinois. [ Links ]
25. Ruíz, A. & P.J. Soriano. 2005. Cuevas andinas como refugios para murciélagos nectarívoros y su importancia para la conservación. Boletín de la Sociedad Venezolana de Espeleología 39: 62-64. [ Links ]
26. Sampedro Marín, A.C., C.M. Martínez Bravo, A.M. Mercado Ricardo, S. C. Osorio Ozuna, Y.L. Otero Fuentes & L.M. Santos Espinosa. 2008. Refugios, periodos reproductivos y composición social de poblaciones de Desmodus rotundus (Geoffroy, 1810) (Chiroptera: Phyllostomidae) en zonas rurales del Departamento de Sucre, Colombia. Caldasia 30: 127-134. [ Links ]
27. Santos, M., L.F. Aguirre, L.B. Barquéz& J. Ortega. 2003. Phyllostomus hastatus. Mammalian Species 722: 1-6. [ Links ]
28. Silva-Taboada, G. 1979. Los murciélagos de Cuba. Editorial Academia. La Habana, Cuba. 423pp. [ Links ]
29. Torres-Flores, J.W., R. López-Wilchis & A. Soto-Castruita. 2012. Dinámica poblacional, selección de sitios de percha y patrones reproductivos de algunos murciélagos cavernícolas en el oeste de México. Revista de Biología Tropical 60: 1369-1389. [ Links ]
30. Trajano, E. & E.A. Giménez. 1998. Bat community in a cave from Eastern Brazil, including a new record of Lionycteris (Phyllostomidae, Glossophaginae). Studies on Neotropical Fauna and Environment 33: 69-75. [ Links ]
31. Venezuela, Presidencia de la República. 2008. Decreto creación del Santuario de Fauna Silvestre. Gaceta Oficial N° 38.946 05/06/2008. Decreto N° 6.138 del 05/06/2008. Caracas, Venezuela. [ Links ]
32. Wilson, D.E. 1997. Bats in question: The Smithsonian Answer Book. The Smithsonian Institution Press, Washington D.C. 168 pp. [ Links ]
33. Zar, H. 1996. Biostatistical Analysis. Prentice Hall, Nueva Jersey. 718 pp. [ Links ]













