Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232
Caldasia vol.38 no.1 Bogotá Jan./June 2016
https://doi.org/10.15446/caldasia.v38n1.57821
NATHALIA ANDREA RAMÍREZ-MORÁN
MIGUEL LEÓN-GÓMEZ
ROBERT LÜCKING
Unidad de Ecología y Sistemática, Departamento de Biología, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá, Colombia. naturamirez@gmail.com, miguel.leon@javeriana.edu.co
Botanischer Garten & Botanisches Museum, Königin-Luise-Str. 6-8, 14195 Berlin, Alemania. r.luecking@bgbm.org (Autor correspondencia)
RESUMEN
Se analizó la diversidad y la composición de las comunidades de líquenes en dos fragmentos, uno perturbado y otro conservado, de bosque altoandino en la Reserva Biológica "Encenillo", Colombia. Se muestrearon 32 árboles de encenillo (Weinmannia tomentosa), 16 en cada fragmento, colocando sobre cada árbol tres submuestras en tres alturas, para un total de 32 muestras (árboles) y 96 submuestras. Los 714 registros de líquenes, 261 para el bosque perturbado y 453 para el bosque conservado, correspondieron a 54 especies, siendo los géneros Parmotrema (161 registros, 5 especies), Usnea (141 registros, 7 especies), Hypotrachyna (79 registros, 7 especies), Phyllopsora (63 registros, 2 especies) y Sticta (49 registros, 6 especies) los más representativos. Usando caracteres morfológicos, se asignaron las 54 especies a 37 biotipos fácilmente reconocibles. Análisis de conglomerados y escala multidimensional no métrica de las 32 muestras (árboles) separaron los dos fragmentos por su composición de biotipos de líquenes. Mediante ánalisis de indicadores, usando los biotipos como unidades, se encontró que los biotipos "Yoshimuriella", "Usnea (apotecios)", "Usnea (pigmentado)", "Parmotrema (soredios)", "Lobariella (apotecios)", "Sticta (verde)", "Psiloparmelia" y "Hypotrachyna (soredios)" fueron estadísticamente indicativos para el bosque conservado, mientras que los biotipos "Hypotrachyna (isidios)", "Usnea (penduloso)", "Parmotrema (isidios)" y "Heterodermia (apotecios)" fueron representativos para el bosque perturbado. Como conclusión, un protocolo usando biotipos en vez de especies puede ser implementado por personas no especialistas para hacer monitoreo y evaluaciones rápidas del estado de conservación de bosques altoandinos.
Palabras clave. Lobariaceae, Graphidaceae, líquenes, biotipos, bioindicadores, continuidad ecológica.
ABSTRACT
We analyzed the diversity and composition of lichen communities in two fragments, one disturbed and one conserved, of high Andean forest in the "Encenillo" Biological Reserve, Colombia. We sampled 32 "encenillo" trees (Weinmannia tomentosa), 16 in each fragment, using three subsamples per tree at three height levels, for a total of 32 samples (trees) and 96 subsamples. The 714 lichen specimens sampled, 261 in the disturbed and 453 in the conserved forest, corresponded to 54 species, with the genera Parmotrema (161 specimens, 5 species), Usnea (141 specimens, 7 species), Hypotrachyna (79 specimens, 7 species), Phyllopsora (63 specimens, 2 species), and Sticta (49 samples, 6 species) most representative. Using morphological characters, we assigned the 54 species to 37 readily recognizable biotypes. Cluster analysis and non-metric multidimensional scaling of the 32 samples (trees) separated the two fragments based on lichen biotype composition. By means of indicator analysis, using the biotypes as units, we found that the biotypes "Yoshimuriella", "Usnea (apothecia)", "Usnea (pigmented)", "Parmotrema (soredia)", "Lobariella (apothecia)", "Sticta (green)", "Psiloparmelia", and "Hypotrachyna (soredia)" were statistically indicative of the conserved forest, whereas the biotypes "Hypotrachyna (isidia)", "Usnea (pendulous)", "Parmotrema (isidia)" and "Heterodermia (apothecia)" were representative of the disturbed forest. In conclusion, a protocol using biotypes instead of species can be implemented by non-specialists to monitor and quickly evaluate the conservation of these Andean forests.
Key words. Lobariaceae, Graphidaceae, lichens, biotypes, bioindicators, ecological continuity.
Recibido: 10/12/2014
Aceptado: 13/04/2016
INTRODUCCIÓN
La Reserva Biológica "Encenillo", ubicada en Guasca, Cundinamarca, Colombia, posee uno de los últimos bosques altoandinos primarios de la cordillera Oriental, en los que predomina el encenillo, Weinmannia tomentosa L. f. (Rangel-Ch. 2000, Martínez et al. 2005). La mayoría de esos bosques están altamente fragmentados, por causa de la construcción de vías de acceso a la región, la implementación de cultivos y la actividad minera (Cortés et al. 1999), aunque varias áreas alteradas se encuentran en proceso de recuperación (Martínez et al. 2005). La Reserva Biológica "Encenillo" representa uno de los bosques altoandinos mejor estudiados (Marín-Santamaría 2010, Amaya-Villarreal & Renjifo 2010); sin embargo, la información existente en cuanto a su composición florística está referida específicamente para plantas fanerógamas, mientras que para otros organismos, como los briófitos y los líquenes, existen pocos registros (Martínez et al. 2005).
Aunque generalmente menos visibles que otros grupos de organismos, los líquenes conforman una componente importante de la diversidad biológica en el trópico. En su mayoría, crecen epifíticos sobre árboles y arbustos y contribuyen al ciclo de agua y nutrientes de los ecosistemas (Green et al. 1985, Beckett 1995, Zotz et al. 1998). Los líquenes con cianobacterias funcionan como biofertilizadores ya que fijan nitrógeno atmosférico (Kelly & Becker 1975, Benner et al. 2007). Además de su papel ecológico y su potencial para elaborar productos farmacéuticos (Cocchietto et al. 2002, Legaz et al. 2006, Stocker-Wörgötteret al. 2013), con varios estudios en Colombia (Perico-Franco et al. 2015, Rojas et al. 2015), son utilizados como indicadores de la calidad del ambiente, frecuentemente para evaluar el nivel de polución del aire en zonas urbanas (LeBlanc & De Sloover 1970, Hawksworth & Rose 1976, Monge-Nájera et al. 2002, Nimis et al. 2002, Hawksworth et al. 2005, Canseco et al. 2006, Valencia-Islas et al. 2007), incluso en áreas urbanas de Colombia (Simijaca et al. 2011, 2014). También han sido implementados como bioindicadores para en el estudio de la continuidad ecológica (Rose 1976, 1992, Selva 1996, Nordén& Appelquist 2001, Rivas Plata et al. 2008, Ardila-Rios et al. 2015). Este concepto considera el ecosistema con respecto a su estado de equilibrio dinámico, asumiendo que después de una perturbación, el ecosistema requiere de un cierto periodo para volver a su estado "natural", lo cual está definido por su estado de equilibrio dinámico. Usando el Índice de Continuidad Ecológica (ICE), el desarrollo temporal de esta recuperación puede ser evaluado por medio de bioindicadores como los líquenes (Rose 1976, Rivas Plata et al. 2008), especialmente en ecosistemas de bosque. Al mismo tiempo, se puede evaluar el estado de conservación de estos mismos líquenes (Aguirre-C. & Rangel-Ch. 2007).
Sin embargo, para poder evaluar el estado de recuperación o conservación de un fragmento de bosque, utilizando líquenes como bioindicadores, se requiere del conocimiento previo de la diversidad presente en las comunidades de líquenes, el comportamiento de estos organismos en esos lugares y la historia de las zonas muestreadas frente a la perturbación (Rose 1992, Jentsch et al. 2002, Rivas Plata et al. 2008). Para regiones tropicales, existen pocos trabajos cuantitativos sobre la ecología de líquenes (Cornelissen & Ter Steege 1989, Coppins & Wolseley 2002, Boonpragob & Polyiam 2007, Holz & Gradstein 2005, Cáceres et al. 2007); sin embargo, varios se han enfocado en los Andes del Norte de Sudamérica y particularmente en Colombia (Sipman 1989, Wolf 1995, Nöske 2005, Soto-Medina et al. 2012, 2015, Moncada et al. 2014, Díaz-Escandón et al. 2016).
El uso de bioindicadores tiene varias ventajas, entre ellas la rapidez de la evaluación y el bajo costo en términos de inversión tecnológica (Nordén& Appelquist 2001). No obstante, generalmente requiere de especialistas con algún nivel de conocimiento taxonómico. Una solución a este problema es la aplicación de protocolos que no requieran la identificación directa de taxones sino que empleen aproximaciones, como por ejemplo biotipos basados en caracteres morfológicos que son fáciles de observar (Barreno & Rico 1984, Rivas Plata et al. 2008, Rosabal et al. 2012, Romero 2013). En este trabajo, se estudió la diversidad y la composicion de comunidades de líquenes epifíticos en dos fragmentos de bosque altoandino, uno conservado y el otro perturbado, y se identificaron biotipos indicadores del estado de conservación que servirían para un protocolo de monitoreo.
MATERIALES Y MÉTODOS
Área de estudio. La Reserva Biológica "Encenillo" se localiza en el municipio de Guasca, departamento de Cundinamarca, entre 73°54' y 73°55' Oeste y 4°47' y 4°48' Norte (Fig. 1), entre los 2800 y 3200 m (Martínez et al. 2005).

La reserva cuenta con un área de bosque altoandino de aproximadamente 52 hectáreas, compuesto por un estrato simple de árboles pequeños de hasta 10 m de altura, en lo cual domina el encenillo, Weinmannia tomentosa L. f. (Cunoniaceae), además de familias como Asteraceae, Ericaceae, Melastomataceae y Rubiaceae y helechos arborescentes (Martínez et al. 2005). Abundan los epífitos tanto vasculares (Bromeliaceae, Orchidaceae, Piperaceae, pteridófitas) como no vasculares (briófitas y líquenes) y el suelo generalmente esta cubierto por una capa de briófitas y algunos líquenes. Esta reserva cumple funciones de gran importancia, como la regulación hídrica de agua que abastece la represa de Tominé y las fincas de producción ganadera y de descanso en las veredas de los municipios de La Calera y Guasca (Martínez et al. 2005). Mientras la mayor parte de la reserva corresponde a bosque de encenillos que varían de porte medio a alto, también contiene zonas abiertas relacionadas con los bordes donde se puede encontrar tanto plantas pioneras y típicas de hábitats disturbados como elementos nativos del bosque cerrado (Martínez et al. 2005).
Bosque perturbado (B1). El parche de bosque perturbado se encuentra entre 3134 y 3167 m de altitud, entre 4°57' Norte y 73°54' Oeste y 04°47' Norte y 73°54' Oeste, en los costados del Sendero "Las Orquídeas", y se conecta con la carretera que dirige hacia el Mirador. Está rodeado por otra carretera que une a una vereda y varias fincas vecinas, en donde hay flujo de vehículos grandes y de animales. Este parche, además de contener suficiente árboles de encenillo para el muestreo, presenta una alta proporción de especies invasivas como Urtica urens L. y Ulex europaeus L. (retamo espinoso), un arbusto espinoso introducido desde Europa, clasificado como una de las cien peores especies invasivas a nivel global (Lowe et al. 2000, Baptiste et al. 2010, Camelo-Salamanca 2015); tambíen se evidencian elementos de regeneración natural como Cecropia (Urticaceae) y se characteriza por rastros de extracción de madera y parches de suelo expuesto sin cobertura vegetal.
Bosque conservado (B2). El área de bosque conservado se localizó sobre la pendiente de la montaña cercana al sendero "El Colibrí" hasta aproximadamente a unos 15 km de distancia del sendero que conecta con el camino "La Tingua", entre 3163 y 3216 m de altitud, con coordenadas desde 04°47' Norte y 73°55' Oeste hasta 04°47' Norte y 73°55' Oeste. No se halló notable presencia de U. europaeus u otros rastros de perturbación como tala y parches de suelo expuesto; los árboles de encenillo alcanzaron hasta 6 metros de altura (Martínez et al. 2005).
Muestreo. Para cada uno de los fragmentos se estableció un transecto de 100 m de largo por 20 m de ancho, dentro del cual se determinaron cuatro parcelas de 10 m de largo por 20 m de ancho, con 30 m de distancia entre los puntos centrales de cada parcela. Dentro de cada parcela se eligieron cuatro árboles de Weinmannia tomentosa como forófitos para los líquenes, con un DAP (diámetro a la altura del pecho) mayor a 20 cm, para guarantizar uniformidad en cuanto a los forófitos entre los dos fragmentos. El rango observado fue de 24-48 cm DAP en el bosque perdurbado (promedio de 30.8 cm) y de 22 a 51 cm DAP en el bosque conservado (promedio de 29.8 cm), sin diferencia significativa (prueba t de Student, p = 0.6789). Se realizaron submuestras de bandas de 20 cm de extensión vertical alrededor de la circumferencia del arbol en tres alturas sobre cada arbol: en la base del tronco, a 1 m de altura y a 2 m de altura, para un total de tres submuestras por forófito, 16 forófitos en cada fragmento y 32 forófitos total con 96 submuestras. De estas últimas, dos no contenían líquenes, así que 94 fueron tomados en cuenta para el análisis.
Identificación taxonómica de los líquenes y clasificación de biotipos. Los líquenes recolectados se determinaron a nivel de género y especie con la excepcion de 12 registros que no podian ser identificados por representar líquenes crustosos estériles. Para la identificación taxonómica, se usó primero los claves a nivel de género de Sipman & Aguirre (1982), Sipman (2005), además de claves y revisiones más especializadas para las familias Collemataceae, Graphidaceae y Lobariaceae (Rivas Plata et al. 2010, Moncada et al. 2013, Otálora et al. 2014). Para llegar a nivel de especie, se usó los claves pertinentes más recientes para cada genero (Sipman 1986, Esslinger 1989, Kashiwadani & Kalb 1993, Lumbsch et al. 1997, Herrera-Campos et al. 1998, Ahti 2000, Rivas Plata et al. 2006, 2010, Lücking& Rivas Plata 2008, Timdal 2008, 2011, Spielmann & Marcelli 2009, Lückinget al. 2009b, Sipman et al. 2009, Moberg 2011, Truong et al. 2011, 2013, Aptroot 2012, Moncada 2012, Moncada et al. 2013). Usando los cuatro caractéres principales crecimiento del talo, color (pigmentos), tipo de fotobionte y tipo de reproducción, las especies encontradas se clasificaron en biotipos (Tabla 1).
Análisis estadístico. Para visualizar si el muestreo fue exhaustivo, se hico una curva de "especies", usando como unidades los biotipos en vez de las especies, mediante muestreo randomizado de las muestras (McCune & Grace 2002). Para analizar y visualizar la composición de biotipos de líquenes según el estado de conservación del bosque, se realizó un análisis de escala multidimensional no métrica y un análisis de conglomerados de dos vias, ambos con el índice de similitud de Sørensen (McCune & Grace 2002). El análisis de escala multidimensional no métrica fue elaborado usando 1000 repeticiones con datos reales y 1000 permutaciones con datos randomizados, con un máximo de tres ejes, 500 iteraciones y 0.000010 como criterio para estabilidad. El análisis de especies indicadoras con base en una permutación "randomización" de Monte Carlo no paramétrica (McCune & Grace 2002) fue modificado usando los biotipos en vez de las especies como unidades, con el fin de identificar cuáles de los biotipos fueran indicadores estadisticamente significativos para los bosques conservados y perturbados. Las pruebas estadísticas fueron hechas en el programa PC-Ord 6.0 (McCune & Mefford 1999).
RESULTADOS
Se obtuvo un total de 714 registros de líquenes en el área de estudio, 261 de los cuales en el bosque perturbado (B1) y 453 en el bosque conservado (B2). Los géneros más frecuentes fueron Parmotrema con 161 registros (B1: 48; B2: 113), seguido de Usnea con 141 registros (B1: 36; B2: 105), Hypotrachyna con 79 registros (B1: 50; B2: 29), Phyllopsora con 63 registros (B1: 28; B2: 35) y Sticta con 49 registros (B1: 13; B2: 36). En total, se encontraron 54 especies de líquenes, correspondiendo a 28 géneros en 13 familias. Basado en su morfología, las 54 especies se clasificaron en 37 biotipos (Tabla 1). Mientras que 27 biotipos correspondían a exactamente un taxon cada uno, los 10 restantes se repetían de dos a cinco veces, por ejemplo los biotipos "Parmotrema (soredios)" (5), "Usnea (erecto)" (4) y "Hypotrachyna (isidios)" y "Sticta (apotecios)" (3); generalmente un biotipo correspondía a un género o grupos de especies del mismo género, con la excepción del biotipo "Myriotrema" que incluía especies de los dos géneros Myriotrema y Ocellularia (Tabla 1). Los biotipos se pueden distinguir mediante la clave al final de la sección de resultados y la guía fotográfica (Fig. 2).

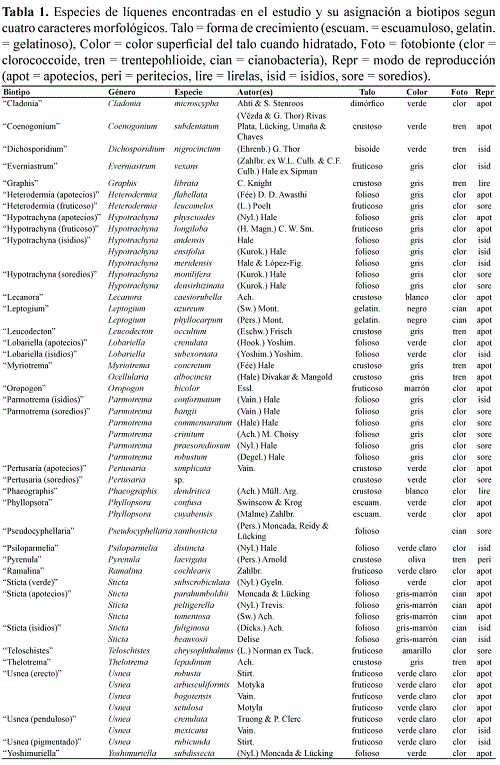
La curva de acumulación de biotipos indica que el muestreo fue relativamente exhaustivo en cuanto a los biotipos (Fig. 3).
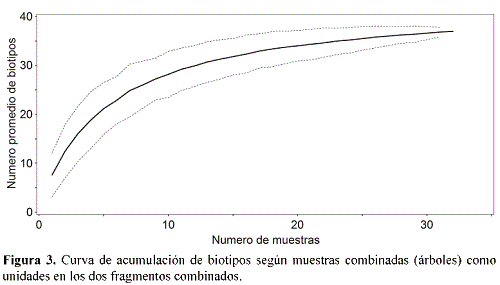
El análisis de escala multidimensional no métrica con base en las muestras (submuestras combinadas por cada árbol) resultó altamente significativo para una solución bidimensional (comparación de estrés entre datos reales y aleatorios; p = 0.0010), demonstrando una clara separación entre los dos estados de conservación dependiendo de la composición de biotipos (Fig. 4).
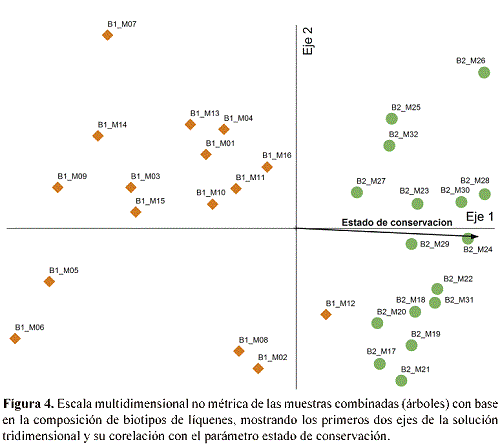
Mientras que la corelación del eje principal con el estado de conservación fue significativa, no hubo corelación con el parámetro DAP, lo que coincide con la observación anterior que el DAP no fue significativamente diferente entre los dos bosques. Un padrón correspondiente se observó en el análisis de conclomerados de ambas vias de las muestras, con la excepción de tres muestras del bosque perturbado (M08, M12, M16) que se agruparon con las muestras del bosque conservado (Fig. 5).
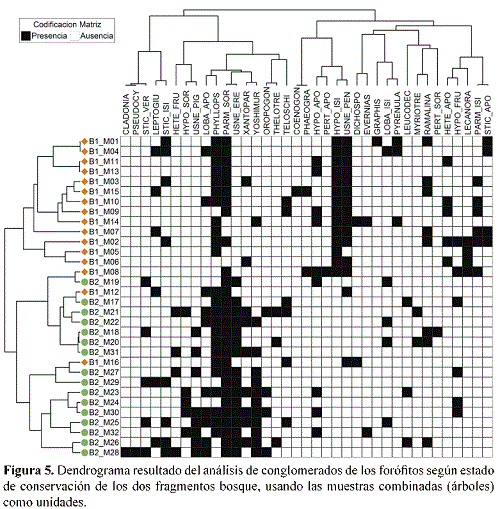
En este análisis, los biotipos también forman dos grupos, uno principalmente asociado con el bosque conservado a la izquierda, incluyendo por ejemplo los biotipos "Lobariella (apotecios)", "Sticta (verde)", "Yoshimuriella", "Usnea (erecto)" y "Usnea (pigmentado)", y el otro en su mayoría asociado al bosque perturbado a la derecha, incluyendo los biotipos «Graphis», "Phaeographis" y "Lecanora", entre otros (Fig. 5). La separación de los dos estados de conservación también se reflejó en la ordenación de las 94 submuestras (separadas por su altura en el árbol) por análisis de escala multidimensional no métrica, resultando altamente significativo para una solución bidimensional (comparación de estrés entre datos reales y aleatorios; p = 0.0020). En este análisis, igualmente había corelación con el estado de conservación pero no con el DAP o la altura en el árbol (Fig. 6).
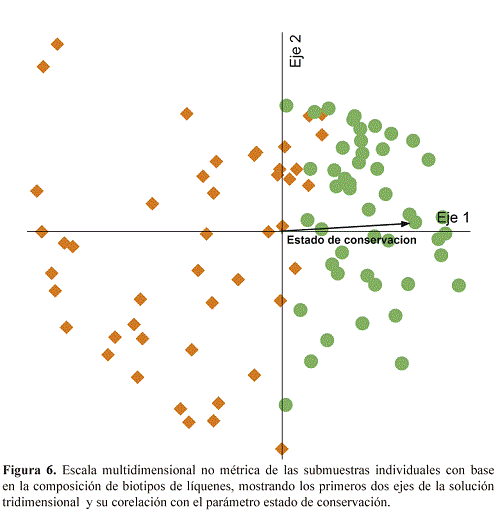
El análisis de biotipos indicadores mostró 22 biotipos más frecuentemente encontrados en el bosque conservado y 15 más frecuentemente en el bosque perturbado, de las cuales seis fueron estadisticamente significativos y uno marginalmente significativo para el bosque conservado y cuatro significativos y uno marginalmente significativos para el bosque perturbado (Tabla 2). Entre los biotipos indicadores de bosque conservado, además de "Usnea (erecto)" se destacan los biotipos "Yoshimuriella" y "Sticta (verde)", de la familia Lobariaceae con fotobionte verde.
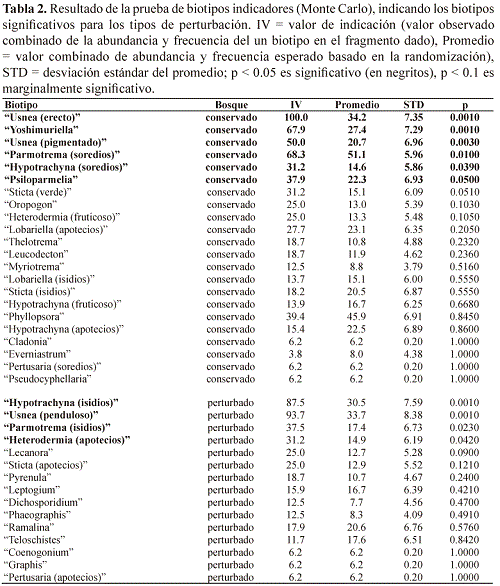
Además estaban restringidos al bosque conservado los biotipos "Lobariella (apotecios)" y "Lobariella (isidios)", también de la familia Lobariaceae con fotobionte verde, y los biotipos thelotremoides "Leucodecton", "Myriotrema" y "Thelotrema", de la familia Graphidaceae, con los géneros Leucodecton, Myriotrema, Ocellularia y Thelotrema, aunque estos resultados no fueron estadisticamente significativos. Para el bosque perturbado, destacaron los biotipos "Hypotrachyna (isidios)" y "Parmotrema (isidios)", entre otros; más frecuentemente encontradas en este fragmento fueron también los biotipos "Graphis" y "Phaeographis", los cuales corresponden a especies lireladas de la familia Graphidaceae (Tabla 2).
Clave para la clasificación de biotipos de líquenes encontrados en el área de estudio
1a Talo crustoso o escuamuloso, adherido al sustrato, sin lóbulos o ramas conspicuos ............................................................. 2
1b Talo folioso o fruticoso, levantado del sustrato, con lóbulos o ramas conspicuos
............................................................ 13
2a Talo escuamuloso, formado por lóbulos diminutos separados sobre un protalo continuo .......................................................... Biotipo "Phyllopsora" (Fig. 2-1)
2b Talo crustoso, compacto o formado por hifas más o menos sueltas ................... 3
3a Talo finamente bisoide, formado por hifas más o menos sueltas .................................... Biotipo "Dichosporidium" (Fig, 2-2)
3b Talo compacto ..................................... 4
4a Talo con soredios ....................................... Biotipo "Pertusaria (soredios)" (Fig. 2-3)
4b Talo con peritecios, lirelas o apotecios .. 5
5a Talo con peritecios o apotecios en forma de peritecios, abriendose con un poro .. 6
5b Talo con lirelas o apotecios en forma de disco .................................................... 8
6a Talo con peritecios negros con paredes carbonizados ......................................................... Biotipo "Pyrenula" (Fig. 2-4)
6b Talo con apotecios en forma de peritecios claros con paredes no carbonizados ...... 7
7a Poro formando un hueco, con el himenio inmerso profundamente .................................... Biotipo "Myriotrema" (Fig. 2-10)
7b Poro cerrado por el himenio llegando a la altura del margen del apotecio ........... Biotipo "Pertusaria (apotecios)" (Fig. 2-5)
8a Talo con lirelas ..................................... 9
8b Talo con apotecios .............................. 10
9a Lirelas con el disco expuesto y margen fina y pálida .....................................................Biotipo "Phaeographis" (Fig. 2-6)
9b Lirelas con el disco escondido y margen gruesa y negra ......................................................... Biotipo "Graphis" (Fig. 2-7)
10a Apotecios sésiles con el disco plenamente expuesto .............................................. 11
10b Apotecios con el disco lateralmente cubierto por la margen tálina, formando una margen doble ............................... 12
11a Apotecios amarillos-anaranjados sobre talo verde grisáceo .........................................Biotipo "Coenogonium" (Fig. 2-8)
11b Apotecios blancas o marrones con margen blanca sobre talo blanco ......................................... Biotipo "Lecanora" (Fig. 2-9)
12a Apotecios prominentes, grandes ..........Biotipo "Thelotrema" (Fig. 2-11)
12b Apotecios inmersos, pequeños ...................Biotipo "Leucodecton" (Fig. 2-12)
13a Talo dimórfico, con la parte basal escuamulosa y podecios erectos .................. Biotipo "Cladonia" (Fig. 2-13)
13b Talo con lóbulos o ramas distintas, sin base escuamulosa .............................. 14
14a Talo con lóbulos anchos orientados horizontalmente (folioso) ................... 15
14b Talo con ramas erectas o lóbulos finos orientados más o menos verticalmente o en varias direcciones (fruticoso) ........ 29
15a Talo gelatinoso cuando mojado .............. Biotipo "Leptogium" (Fig. 2-14)
15b Talo no gelatinoso cuando mojado ..... 16
16a Talo verde brillante cuando mojado .... 17
16b Talo gris, marrón o verde pálido cuando mojado ............................................... 20
17a Talo con isidios ............................. Biotipo "Lobariella (isidios)" (Fig. 2-15)
17b Talo con apotecios .............................. 18
18a Talo con poros redondos en la superficie ventral ............................................ Biotipo "Sticta (verde)" (Fig. 2-16)
18b Talo sin poros abajo ........................... 19
19a Talo con poros lineares arriba .......... Biotipo "Lobariella (apotecios)" (Fig. 2-17)
19b Talo sin poros arriba, pero con tomento marrón linear-reticulado abajo ................... Biotipo "Yoshimuriella" (Fig. 2-18)
20a Talo con cianobacterias, gris-marrón cuando mojado, con poros redondos en la superficie inferior ........................... 21
20b Talo con algas verdes, gris o verde pálido cuando mojado, sin poros en la superficie inferior ............................................... 23
21a Talos con soredios amarillos .................. Biotipo "Pseudocyphellaria" (Fig. 2-21)
21b Talos con apotecios o isidios .............. 23
22a Talo con apotecios .......................... Biotipo "Sticta (apotecios)" (Fig. 2-19)
22b Talo con isidios .......................................... Biotipo "Sticta (isidios)" (Fig. 2-20)
23a Talo verde amarillento pálido cuando seco ........................ Biotipo "Psiloparmelia"
23b Talo gris pálido cuando seco ............. 24
24a Talo con apotecios ............................. 25
24b Talo con isidios o soredios ................ 26
25a Talo blanco abajo, farinoso, sin cortex ... Biotipo "Heterodermia (apotecios)" (Fig. 2-22)
25b Talo oscuro abajo, liso, con cortex ........... Biotipo "Hypotrachyna (apotecios)" (Fig. 2-23)
26a Talo con isidios .................................. 27
26b Talo con soredios .............................. 28
27a Talo con lóbulos redondos, con una zona ancha en la margen de la superficie inferior sin rizinas .......................... Biotipo "Parmotrema (isidios)" (Fig. 2-24)
27b Talo con lóbulos lineares, con rizinas bifurcadas en toda la superficio inferior ...Biotipo "Hypotrachyna (isidios)" (Fig. 2-25)
28a Talo con lóbulos redondos, con una zona ancha en la margen de la superficie inferior sin rizinas .......................... Biotipo "Parmotrema (soredios)" (Fig. 2-26)
28b Talo con lóbulos lineares, con rizinas bifurcadas en toda la superficio inferior .... Biotipo "Hypotrachyna (soredios)" (Fig. 2-27)
29a Talo amarillo-naranja brillante, rojo o marrón oscuro .................................... 30
29b Talo gris o verde amarillento pálido .... 32
30a Talo marrón oscuro ........................................... Biotipo "Oropogon" (Fig. 2-28)
30b Talo amarillo-naranja brillante o rojo-anaranjado .......................................... 31
31a Talo amarillo-naranja brillante, sin cordón central elástico ...............................................Biotipo "Teloschistes" (Fig. 2-29)
31b Talo rojo-anaranjado, con cordón central elástico ........................................Biotipo "Usnea (pigmentado)" (Fig. 2-30)
32a Talo verde amarillento pálido ............ 33
32b Talo gris pálido .................................. 35
33a Ramas aplanadas, sin cordón central elástico ....Biotipo "Ramalina" (Fig. 2-31)
33b Ramas más o menos redondas a angulares, con cordón central elástico ................ 34
34a Talo penduloso .......................................... Biotipo "Usnea (penduloso)" (Fig. 2-32)
34b Talo erecto ...................................................... Biotipo "Usnea (erecto)" (Fig. 2-33)
35a Talo con rizinas bifurcadas en toda la superficio inferior ....................... Biotipo "Hypotrachyna (fruticoso)" (Fig. 2-34)
35b Talo con cilios largos (sub-)marginales ...36
36a Talo con cortex inferior .................................. Biotipo "Everniastrum" (Fig. 2-35)
36b Talo sin cortex inferior .................. Biotipo "Heterodermia (fruticoso)" (Fig. 2-36)
DISCUSIÓN
Los registros obtenidos del área de estudio para las familias, los géneros y las especies de líquenes coincide principalmente con Aguirre & Chaparro (2002) y Rangel-Ch. (2008). De acuerdo con esos autores, "para la Región Natural Andina en Colombia, la familia Parmeliaceae (con 27 géneros y 237 especies) es una de las familias que más presenta riqueza", y en este estudio también fue la familia mejor representada. Dicha familia es una de las más representativas en términos de géneros y especies en el mundo, además muestra un rango amplio de hábitats y distribución geográfica (Crespo et al. 2010, Leavitt et al. 2015, Lückinget al. 2016). Los registros a nivel de géneros también concordaron con los expuestos para familias, ya que de acuerdo a Aguirre & Chaparro (2002) "los géneros mejor representados para Colombia, entre otros son Hypotrachyna, Parmotrema y probablemente Usnea, también son los más diversificados para la Región Natural Andina". La segunda familia más representativa en el área de estudio es Lobariaceae, con los géneros Lobariella, Sticta y Yoshimuriella, seguida por Graphidaceae, con los géneros Graphis, Leucodecton, Myriotrema, Ocellularia, Phaeographis y Thelotrema. Ésta familia también es muy diversa en el trópico, aunque la mayoría de las especies prefiere los bosques tropicales y subandinos (Rivas Plata et al. 2012, Lückinget al. 2014).
Nuestro análisis demuestra que los áreas de bosque conservado y perturbado pueden ser distinguidos por la composición de biotipos de líquenes y que el factor principal de esta separación es el estado de conservación, ya que el factor del forófito fue constante por seleccionar solamente árboles de encenillo en ambos fragmentos, con DAP comparable. Considerando que la distribución de los talos liquénicos individuales sobre un árbol es algo heterogénea y estocástica (Gradstein et al. 1996, Cáceres et al. 2007), resulta mejor tomar cada forófito como unidad, en vez de partes del forófito en diferentes alturas y direcciones como submuestras separadas, ya que cada submuestra por su tamaño reducido solo puede contener pocos talos, aunque la separación de los dos bosques con base en las submuestras también fue bastante clara. El efecto de la estocasticidad se debe tomar en cuenta para el diseño de protocolos de monitoreo, donde se han establecido varias técnicas de muestreo (Marcelli 1992, Gradstein et al. 1996, Nimis et al. 2000, Koch et al. 2012, Käfferet al. 2015). Es notable que en el presente estudio, no hubo corelación entre la composición de biotipos y la altura de la submuestra en el árbol, indicando que la distribución de biotipos a lo largo de los troncos no demuestra un gradiente marcado.
Entre los taxones y biotipos que caracterizan al bosque conservado, se encuentran formas con fotobionte verde de la familia Lobariaceae (Lobariella, Sticta p.p., Yoshimuriella), tanto como formas thelotremoides de la familia Graphidaceae (Leucodecton, Myriotrema, Ocellularia, Thelotrema). Esto coincide con estudios anteriores que particularmente señalan esos grupos como buenos bioindicadores del estado de conservación del bosque (Rose 1976, 1992, Selva 1996, Rivas Plata et al. 2008). Al contrario, las formas lireladas de Graphidaceae (Graphis, Phaeographis) son más indicativas de bosques perturbados (Rivas Plata et al. 2008). Sin embargo, estos resultados requieren de estudios más detallados a nivel de especie; en un análisis de bosque de roble, se encontró que mientras Phaeographis dendritica, la misma especie que se identificó en el presente trabajo, indica perturbación, otras especies del mismo género con otro tipo de morfología (un biotipo no encontrado en el presente trabajo) fueron encontrados en bosque conservado (Ardila-Rios et al. 2015).
Notablemente, biotipos sorediados de los géneros Hypotrachyna y Parmotrema son más indicativas para bosque conservado y biotipos isidiados para bosque perturbado. Esto podría ser causado por el hecho que los isidios son propágulos mayores que los soredios y necesitan más fuerza mecánica para ser desplazados del talo (Nash 2008), así que podrían servir mejor en condiciones abiertas con lluvia directa. Para el bosque perturbado, destacan también los géneros y biotipos Dichosporidium, Lecanora y Teloschistes, que comúnmente se encuentran en bosques secundarios o vegetación abierta.
Los resultados de este estudio sugieren que ciertos biotipos de líquenes sirven como bioindicadores del estado de perturbación o conservación de parches de bosques altoandinos. Aparentemente, los biotipos, que corresponden a una identificación simplificada a nivel de géneros y grupos de especies, son comparables con las especies en su capacidad de discriminar estados de conservación de fragmentos de bosque altoandino. Esto coincide con los resultados de Rivas Plata et al. (2008), en donde también establecieron un protocolo usando biotipos, aún más detallados, de los especies thelotremoides de la familia Graphidaceae, para monitorear el estado de conservación de bosque tropicales en general. Por lo tanto, los biotipos podrían ser usados como una aproximación, así evitando la necesidad de la identificación de los líquenes hasta nivel de especies por parte de especialistas, lo cual permitiría un monitoreo bastante más amplio de ecosistemas amenazados que incluiría voluntarios e estudiantes, comparable con el inventario del USDA Forestry Service en Estados Unidos (Cleavitt et al. 2015, Nelson et al. 2015, Will-Wolf et al. 2015, Coyle & Hurbert 2016). Sin embargo, es necesario un cierto nivel de entrenamiento para obtener experiencia en determinar los biotipos correctamente, lo cual debe ser instruido por especialistas.
Es notable el número relativamente alto de biotipos comparado con el número de especies en este estudio, con una relación de 37 a 54 = 0.69, lo que suele ser específico para el ecosistema del bosque altoandino. En regiones tropicales los líquenes son más vistosos en bosques altoandinos y en el páramo, donde las condiciones son favorables para desarollar una alta biomasa, pero también soportan una alta diversidad morfológica, con dominancia de macrolíquenes foliosos y fruticosos y al mismo tiempo reteniendo nichos para microlíquenes de varios tipos (Sipman 1995, 1999, 2002). Por otro lado, la riqueza de especies es más alta en bosques tropicales húmedas de zonas bajas, con hasta 600 especies por hectarea (Lückinget al. 2011), aunque la diversidad morfológica es más baja, con una dominancia de microlíquenescrustosos. Esta limitación morfológica es aún más pronunciada en bosques secos. Como consecuencia, la relación entre diversidad de biotipos y riqueza de especies es más baja en bosques tropicales de zonas bajas, aumenta con la altitud hacia los bosques altoandinos, donde las condiciones favorecen una alta diversidad morfológica pero menos especies, y nuevamente baja en los páramos donde ciertos grupos de microlíquenes desaparecen (Sipman 1999, 2002). Por lo tanto, es necesario hacer un estudio de línea base enumerando los diferentes biotipos y su ocurrencia en cada ecosistema y ponerlos en relación con estimaciones adecuadas de la riqueza de especies de líquenes. En este momento, los datos existentes para Colombia son más completos para los páramos y los bosques andinos y altoandinos (Sipman 1995, 1999, 2002, Moncada 2012, Moncada et al. 2014, Ardila-Ríos et al. 2015), menos para los bosques subandinos y tropicales (Rincón-Espitia et al. 2011, Mateus et al. 2012, Soto-Medina et al. 2012) e incompletos para los bosques secos y sábanas (Pinzón & Linares 2006, Peláez et al. 2014).
Con base en eso, se podría establecer protocolos que evalúen cuantitativamente la diversidad y abundancia de biotipos discriminantes, como de las familias Lobariaceae y Graphidaceae para obtener puntajes que indiquen el estado de conservación de fragmentos de bosque. Con eso, sería posible hacer evaluaciones rápidas de áreas extensas y elaborar mapas para su manejo integral y protección (Villareal et al. 2006). Tales protocolos requerirían los siguientes elementos:
(1) Una guía visual para clasificar y determinar los biotipos de forma comparativa, modificado por ejemplo del guia aquí presentado (Fig. 2) o de la guia elaborada por Rivas Plata et al. (2008), en el formato de los reconocidos Rapid Field Guides del Field Museum de Chicago (http://fieldguides.fieldmuseum.org/guides?category=34), por ejemplo Moncada & Lücking (2011).
(2) Una estrategia de muestreo representativa que sea comparable entre sitios, siendo lo más practicable un transecto de 100 m, suficientemente largo para tomar en cuenta la diversidad de un sitio pero suficientemente corto para ajustarse a fragmentos más pequeños; tomando un número fijo de árboles representativos del ecosistema bajo consideración como muestras (aquí 16 pero podría ser incrementado a 25 o 30); y establecer la técnica de muestreo en cada árbol, para la cual se ofrece el método del minitransecto horizontal como aquí aplicado (Marcelli 1992, Koch et al. 2012) en tres alturas del árbol para balancear efectos de heterogeneidad y estocasticidad y capturar la diversidad adecuadamente.
(3) Elaborar un índice cuantitativo del estado de conservación basándose en el Índice de Continuidad Ecológica (ICE) originalmente propuesto por Rose (1976, 1992), lo cual fue modificado por Rivas Plata et al. (2008) para ajustarse a bosques tropicales; este índice se basaría en la proporción de biotipos discriminativos encontrados versus esperados en un ecosistema bajo consideración, lo cual requiere más estudios de linea base para establecer biotipos correspondientes para cada ecosistema, como serían los bosques altoandinos, bosque andinos, bosques subandinos, bosques tropicales, bosques secos interandinos y bosques secos de la costa.
(4) Elaborar mejor el concepto de biotipos de líquenes (Barreno & Rico 1984, Rivas Plata et al. 2008, Rosabal et al. 2012, Romero 2013) para su amplia aplicación estandarizada en los diferentes ecosistemas presentes en Colombia y otras partes del mundo.
AGRADECIMIENTOS
Agradecemos a María Victoria Vargas, PhD, y Jorge Jácome, PhD (ambos Pontifica Universidad Javeriana), por el acompañamiento en la ejecución de este trabajo. La Fundación Natura amablemente permitió realizar el estudio dentro de la Reserva Biológica "Encenillo" (Dorothea y Hermann Hoeck), dando los recursos necesarios para que este trabajo fuera un hecho; los administradores de la reserva, la familia Cumbalá, aportaron con conocimientos su experiencia en el campo y brindaron una buena estadía durante la fase de muestreo. Eimy Rivas Plata, fue una invaluable ayuda en la obtención de bibliografía y se empeño en la viabilidad de este estudio. Bibiana Moncada, Universidad Distrital Francisco José de Caldas, compartió su experiencia y logística en la parte taxonómica, especialmente de la familia Lobariaceae.
LITERATURA CITADA
1. Aguirre-C., J. & M. Chaparro. 2002. Hongos liquenizados. Universidad Nacional de Colombia, Editorial El Malpensante, Bogotá D. C. 220 pp. [ Links ]
2. Aguirre-C., J. & J.O. Rangel-Ch. 2007. Amenazas a la conservación de las especies de musgos y líquenes en Colombiauna aproximación inicial. Threats to conservation of mosses and lichens from Colombiaa preliminary approach. Caldasia 29: 235-262. [ Links ]
3. Ahti, T. 2000. Cladoniaceae. Flora Neotropica 78: 1-362. [ Links ]
4. Amaya-Villarreal, Á.M. & L.M. Renjifo. 2010. Efecto del retamo espinoso (Ulex europaeus) sobre las aves de borde en un bosque altoandino. Ornitología Colombiana 10: 11-25. [ Links ]
5. Aptroot, A. 2012. A world key to the species of Anthracothecium and Pyrenula. The Lichenologist 44: 5-53. [ Links ]
6. Ardila-Rios, A.I., B. Moncada & R. Lücking. 2015: Epiphyte homogenization and de-diversification on alien Eucalyptus versus native Quercus forest in the Colombian Andes: a case study using lirellate Graphidaceae lichens. Biodiversity and Conservation 24: 1239-1252. [ Links ]
7. Baptiste M.P., N. Castaño, D. Cárdenas, F.P. Gutiérrez, D.L. Gil & C.A. Lasso (eds). 2010. Análisis de riesgo y propuesta de categorización de especies introducidas para Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, D. C. [ Links ]
8. Barreno, E. & V.J. Rico. 1984. Sobre la biología de los líquenes. I. Anatomía, morfología y estructuras vegetativas. Anales de Biología 1: 161-195. [ Links ]
9. Beckett, R.P. 1995. Some aspects of the water relations of lichens from habitats of contrasting water status studied using thermocouple psychrometry. Annals of Botany 76: 211-217. [ Links ]
10. Benner, J.W., S. Conroy, C.K. Lunch, N. Toyoda & P.M. Vitousek. 2007. Phosphorus fertilization increases the abundance of nitrogenase activity of the cyanolichen Pseudocyphellaria crocata in Hawaiian montane forests. Biotropica 39: 400-405. [ Links ]
11. Boonpragob, K. & W. Polyiam. 2007. Ecological groups of lichens along environmental gradients an two different host tree species in the tropical rain forest at Khao Yai National Park, Thailand. Bibliotheca Lichenologica 96: 25-48. [ Links ]
12. Cáceres, M.E.S., R. Lücking& G. Rambold. 2007. Phorophyte specificity and environmental parameters versus stochasticity as determinants for species composition of corticolous lichen communities in the Atlantic rain forest of northeastern Brazil. Mycological Progress 6: 117-136. [ Links ]
13. Camelo-Salamanca, D. 2015. Evaluación del estado sucesional actual de las áreas restauradas y con invasión previa de Ulex europaeus L. en los Cerros Orientales de Bogotá. Trabajo de Grado, Universidad Javeriana, Bogotá D. C. [ Links ]
14. Canseco, A., R. Anze & M. Franken. 2006. Comunidades de líquenes: indicadores de la calidad del aire en la ciudad de La Paz, Bolivia. Acta Nova 3: 286-307. [ Links ]
15. Cleavitt, N.L., J.W., Hinds, R.L. Poirot, L.H. Geiser, A.C. Dibble, B. Leon, R. Perron, R. & L.H. Pardo. 2015. Epiphytic macrolichen communities correspond to patterns of sulfur and nitrogen deposition in the northeastern United States. The Bryologist 118: 304-324. [ Links ]
16. Cocchietto, M., N. Skert, P.L. Nimis & G. Sava. 2002. A review on usnic acid, an interesting natural compound. Die Naturwissenschaften 89: 137-146. [ Links ]
17. Coppins, B. J. & P. Wolseley. 2002. Lichens of tropical forests. In: R. Watling, J.C. Frankland, A.M. Ainsworth, S. Isaac & C.H. Robinson (eds). Tropical Mycology: Volume 2, Micromycetes. CABI Publishing, Wallingford, pp. 113-131. [ Links ]
18. Cornelissen, J.H.C. & H. Ter Steege. 1989. Distribution and ecology of epiphytic bryophytes and lichens in dry evergreen forest of Guyana. Journal of Tropical Ecology 5: 131-150. [ Links ]
19. Cortés, S., T. van der Hammen & O. Rangel-Ch. 1999. Comunidades vegetales y patrones de degradación y sucesión en la vegetación de los cerros occidentales de Chía-Cundinamarca-Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales 89: 529-554. [ Links ]
20. Coyle, J.R. & A.H. Hurlbert. 2016. Environmental optimality, not heterogeneity, drives regional and local species richness in lichen epiphytes. Global Ecology and Biogeography 25: 406-417. [ Links ]
21. Crespo, A., F. Kauff, P.K. Divakar, R. del Prado, S. Perez-Ortega, G.A. de Paz, Z. Ferencova, O. Blanco, B. Roca-Valiente, J. Nunez-Zapata & P. Cubas. 2010. Phylogenetic generic classification of parmelioid lichens (Parmeliaceae, Ascomycota) based on molecular, morphological and chemical evidence. Taxon 59: 1735-1753. [ Links ]
22. Díaz-Escandón, D., E. Soto-Medina, R. Lücking& P. A. Silverstone-Sopkin. 2016. Corticolous lichens as environmental indicators of natural sulphur emissions near the sulphur mine El Vinagre (Cauca, Colombia). The Lichenologist 48: 147-159. [ Links ]
23. Esslinger, T.L. 1989. Systematics of Oropogon (Alectoriaceae) in the New World. Systematic Botany Monographs 28: 1-111. [ Links ]
24. Gradstein, S.R., P. Hietz, R. Lücking, A. Lücking, H.J.M. Sipman, H.F.M. Vester, J.H.D. Wolf & E. Gardette. 1996. How to sample the epiphytic diversity of tropical rain forests. Ecotropica 2: 59-72. [ Links ]
25. Green, T.G.A., W.P. Snelgar & A.L. Wilkins. 1985. Photosynthesis, water relations and thallus structure of Stictaceae lichens. In: Brown, D. H. (ed.). Lichen Physiology and Cell Biology. Plenum Press, Nueva York & Londres, pp. 57-75. [ Links ]
26. Hawksworth, D.L. & F. Rose. 1976. Lichens as Pollution Monitors. Edward Arnold, Londres. 59 pp. [ Links ]
27. Hawksworth, D.L., T. Iturriaga & A. Crespo. 2005. Líquenes como bioindicadores inmediatos de contaminación y cambios medio-ambientales en los trópicos. Revista Iberoamericana de Micología 22: 71-82. [ Links ]
28. Herrera-Campos, M.A.P. Clerc & T.H. Nash III. 1998. Pendulous species of Usnea from the temperate forests in Mexico. The Bryologist 101: 303-329. [ Links ]
29. Holz, I. & S.R. Gradstein. 2005. Cryptogamic epiphytes in primary and recovering upper montane oak forests of Costa Rica – species richness, community composition and ecology. Plant Ecology 178: 89-109. [ Links ]
30. Jentsch, A., C. Beierkuhnlein & P. White. 2002. Scale, the dynamic stability of forest ecosystems, and the persistence of biodiversity. Silva Fennica 36: 393-400. [ Links ]
31. Käffer, M.I., S.M.A. Martins, R.V. Dantas & F. C. Maciel. 2015. Lichen community composition in riparian forest in the APA of Ibirapuitã, Rio Grande do Sul State, Brazil. Hoehnea 42: 273-288. [ Links ]
32. Kashiwadani, H. & K. Kalb. 1993. The genus Ramalina in Brazil. Lichenologist 25: 1-31. [ Links ]
33. Kelly, B.B. & V.E. Becker. 1975. Effects of light intensity and temperature on nitrogen fixation by Lobaria pulmonaria, Sticta weigelii, Leptogium cyanescens and Collema subfurvum. Bryologist 78: 350-355. [ Links ]
34. Koch, N.M., R.W. Maluf & S.M.A. Martins. 2012. Comunidade de liquens foliosos em Piptocarpha angustifolia Dusén ex Malme (Asteraceae) em área de Floresta Ombrófila Mista no estado do Rio Grande do Sul, Brasil. Iheringia SérieBotânica 67: 47-57. [ Links ]
35. Leavitt, S.D., E. Kraichak, M.P. Nelsen, S. Altermann, P.K. Divakar, D. Alors, T.L. Esslinger, A. Crespo & H.T. Lumbsch. 2015. Fungal specificity and selectivity for algae play a major role in determining lichen partnerships across diverse ecogeographic regions in the lichen-forming family Parmeliaceae (Ascomycota). Molecular Ecology 24: 3779-3797. [ Links ]
36. Leblanc, F. & J. de Sloover. 1970. Relation between industrialization and the distribution and growth of epiphytic lichens and mosses in Montreal. Canadian Journal of Botany 48: 1485-1496. [ Links ]
37. Legaz, M.E., C.V. Córdoba, E.C. Pereira, L. Xavier Filho & S.A. Rodrigues. 2006. Importânciaeconômica dos líquens para o homem. In: L. Xavier Filho, M.E. Legaz, C.V. Cordoba & E.C. Pereira (eds). Biologia de Líquens. Âmbito Cultural Edições, Ltda., Rio de Janeiro, pp. 579-619. [ Links ]
38. Lowe, S., M. Browne, S. Boudjelas & M. de Poorter. 2000. 100 of the World's Worst Invasive Alien Species. A selection from the Global Invasive Species Database. The Invasive Species Specialist Group (ISSG), Species Survival Commission (SSC), World Conservation Union (IUCN). [ Links ]
39. Lücking, R. & E. Rivas Plata. 2008. Clave y guía ilustrada para géneros de Graphidaceae. Glalia 1: 1-41. [ Links ]
40. Lücking, R., A.W. Archer & A. Aptroot. 2009b. A world-wide key to the genus Graphis (Ostropales: Graphidaceae). The Lichenologist 41: 363-452. [ Links ]
41. Lücking, R., F. Seavey, R.S. Common, S.Q. Beeching, O. Breuss, W.R. Buck, L. Crane, M. Hodges, B.P. Hodkinson, E. Lay, J.C. Lendemer, R.T. Mcmullin, J.A. Mercado-díaz, M.P. Nelsen, E. Rivas plata, W. Safranek, W.B. Sanders, H.P. Schaefer jr & J. Seavey. 2011. The lichens of Fakahatchee Strand Preserve State Park, Florida: Proceedings from the 18th Tuckerman Workshop. Bulletin of the Florida Museum of Natural History, Biological Sciences 49: 127-186. [ Links ]
42. Lücking, R., M.K. Johnston, A. Aptroot, E. Kraichak, J.C. Lendemer, K. Boonpragob, M.E.S. Cáceres, D. Ertz, L.I. Ferraro, Z.F. Jia, K. Kalb, A. Mangold, L. Manoch, J.A. Mercado-Díaz, B. Moncada, P. Mongkolsuk, K.B. Papong, S. Parnmen, R.N. Peláez, V. Poengsungnoen, E. Rivas Plata, W. Saipunkaew, H.J.M. Sipman, J. Sutjaritturakan, D. van den Broeck, M. von Konrat, G. Weerakoon & H.T. Lumbsch. 2014. One hundred and seventy five new species of Graphidaceae: closing the gap or a drop in the bucket? Phytotaxa 189: 7-38. [ Links ]
43. Lücking, R., J.L. Villaseñor, M.A. Herrera-Campos, R.E. Pérez-Pérez, R.S. Egan, T.L. Esslinger & T.H. Nash III. 2016. Phylogenetic structure of metacommunities in Mexican Parmeliaceae (lichenized Ascomycota: Lecanorales). Bibliotheca Lichenologica (in press). [ Links ]
44. Lumbsch, H.T., M. Plümper, R. Guderley & G.B. Feige. 1997. The corticolous species of Lecanora sensu stricto with pruinose apothecial discs. Symbolae Botanicae Upsalienses 32: 131-161. [ Links ]
45. Marcelli, M.P. 1992 Ecologia liquenica nos manguezais do sul-sudeste brasileiro. Bibliotheca Lichenologica 47: 1-310. [ Links ]
46. Marín-Santamaría, C.M. 2010. Potencial de aprovechamiento alimenticio para consumo humano de frutos silvestres en la Reserva Biológica Encenillo, Guasca, Colombia. Pontificia Universidad Javeriana, Facultad de Ciencias. Bogotá D. C. [ Links ]
47. Martínez, X., D. Rincón, P. Galvis & C. Monje. 2005. Valoración biofísica y planificación predial para la conformación de la Reserva Encenillo. Fundación Natura, Bogotá D. C. [ Links ]
48. Mateus, N., J. Aguirre & R. Lücking. 2012. Contribuciones a la biota liquénicafoliícola del Chocó (Colombia). Caldasia 34: 25-32. [ Links ]
49. McCune, B. & J.B. Grace. 2002. Analysis of Ecological Communities. MjM Software, Gleneden Beach, Oregon. [ Links ]
50. McCune, B. & M.J. Mefford. 1999. PC-ORD. Multivariate Analysis of Ecological Data, Version 4.0. MjM Software, Gleneden Beach, Oregon, USA. [ Links ]
51. Moberg, R. 2011. The lichen genus Heterodermia (Physciaceae) in South America - A contribution including five new species.Nordic Journal of Botany 29: 129-147. [ Links ]
52. Moncada, B. 2012. El género Sticta en Colombia, Taxonomía, Ecogeografía e Importancia. Universidad Nacional de Colombia, Bogotá D. C. [ Links ]
53. Moncada, B. & R. Lücking. 2011. Lichens of the Colombian Paramo. Rapid Field Guides #344, The Field Museum, Chicago, USA. http://fieldguides.fieldmuseum.org/guides/guide/344. [ Links ]
54. Moncada, B., R. Lücking& L. Betancourt-Macuase. 2013. Phylogeny of the Lobariaceae (lichenized Ascomycota: Peltigerales), with a reappraisal of the genus Lobariella. Lichenologist 45: 203-263. [ Links ]
55. Moncada, B., J. Aguirre & R. Lücking. 2014. Ecogeografía del género Sticta (Ascomycota liquenizados: Lobariaceae) en Colombia. Revista de Biologia Tropical 62: 257-272. [ Links ]
56. Monge-Nájera, J., M.I. González, M.R. Rossi & V.H. Méndez-Estrada. 2002. Twenty years of lichen cover change in a tropical habitat (Costa Rica) and its relation with air pollution. Revista de Biología Tropical 50: 309-319. [ Links ]
57. Nash, T.H. (ed.). 2008. Lichen Biology. Second Edition. Cambridge University Press, Cambridge. [ Links ]
58. Nelson, P.R., B. McCune, C. Roland & S. Stehn. 2015. Non-parametric methods reveal non-linear functional trait variation of lichens along environmental and fire age gradients. Journal of Vegetation Science 26: 848-865. [ Links ]
59. Nimis, P. L., C. Scheidegger & P. A. Wolseley (eds.). 2002. Monitoring with Lichens – Monitoring Lichens. Nato Science Series. IV. Earth and Environmental Sciences, Kluwer Academic Publishers, Dordrecht, The Netherlands. [ Links ]
60. Nordén, B. & T. Appelquist. 2001. Conceptual problems of ecological continuity and its bioindicators. Biodiversity and Conservation 10: 779-791. [ Links ]
61. Nöske, N.M. 2005. Effekte anthropogener Störung auf die Diversitätkryptogamischer Epiphyten (Flechten, Moose) in einem Bergregenwald in Südecuador. Staats- und UniversitätsbibliothekGöttingen. http://webdoc.sub.gwdg.de/diss/2005/noeske/noeske.pdf. [ Links ]
62. Otálora, M.A.G., P.M. Jørgensen& M. Wedin. 2014. A revised generic classification of the jelly lichens, Collemataceae. Fungal Diversity 64: 275-293. [ Links ]
63. Peláez, R.N., B. Moncada & R. Lücking. 2014. High diversity of Ocellularia (Ascomycota: Graphidaceae) in the Colombian Llanos, including two species new to science. Phytotaxa 189: 245-254. [ Links ]
64. Perico-Franco, L.S., J.L. Rojas, M.A. Cerbón, I. González-Sánchez & N.A. Valencia-Islas. 2015. Antioxidant activity and protective effect on cell and DNA oxidative damage of substances isolated from lichens of Colombian Páramo. UK Journal of Pharmaceutical and Biosciences 3: 9-17. [ Links ]
65. Pinzón, M. & E.L. Linares. 2006. Diversidad de líquenes y briofitos en la región subxerofitica de La Herrera, Mosquera (Cundinamarca-Colombia). I. Riqueza y estructura. Caldasia 28: 243-257. [ Links ]
66. Rangel-Ch., J.O. (ed.). 2000. Colombia Diversidad Biótica III. La Región de Vida Paramuna. Instituto de Ciencias Naturales y Instituto Alexander von Humboldt, Bogotá [ Links ].
67. Rangel-Ch., J.O. (ed.). 2008. Diversidad Biótica VI. Riqueza y diversidad de los musgos y líquenes en Colombia. Universidad Nacional de Colombia. Facultad de Ciencias, Instituto de Ciencias Naturales. Bogotá. 616 pp. [ Links ]
68. Rincón-Espitia, A., J. Aguirre-C. & R. Lücking. 2011. Corticolous lichens in the Caribbean region of Colombia. Caldasia 33: 331-347. [ Links ]
69. Rivas Plata, E., R. Lücking, A. Aptroot, H. J.M. Sipman, J.L. Chaves, L. Umaña & D. Lizano. 2006. A first assessment of the Ticolichen biodiversity inventory in Costa Rica: the genus Coenogonium (Ostropales: Coenogoniaceae), with a world-wide key and checklist and a phenotype-based cladistic analysis. Fungal Diversity 23: 255-321. [ Links ]
70. Rivas Plata, E., R. Lücking& H.T. Lumbsch. 2008. When family matters: an analysis of Thelotremataceae (Lichenized Ascomycota: Ostropales) as bioindicators of ecological continuity in tropical forests. Biodiversity and Conservation 17: 1319-1351. [ Links ]
71. Rivas Plata, E., R. Lücking, H.J.M. Sipman, A. Mangold, K. Kalb & H.T. Lumbsch. 2010. A world-wide key to the thelotremoid Graphidaceae, excluding the Ocellularia-Myriotrema-Stegobolus clade. The Lichenologist 42: 139-185. [ Links ]
72. Rivas Plata, E., H.T. Lumbsch & R. Lücking. 2012. A new classification for the lichen family Graphidaceae s.lat. (Ascomycota: Lecanoromycetes: Ostropales). Fungal Diversity 52: 107-121. [ Links ]
73. Rojas, J.L., M. Díaz-Santos & N.A. Valencia-Islas. 2015. Metabolites with antioxidant and photo-protective properties from Usnea roccellina Motyka, a lichen from Colombian Andes. UK Journal of Pharmaceutical and Biosciences 3: 18-26. [ Links ]
74. Romero, P. A. 2013. Líquenes cortícolas como indicadores atmosféricos en la localidad de Kennedy, Bogotá, Colombia. Boletín Semillas Ambientales 7(1). [ Links ]
75. Rosabal, D., A.R. Burgaz & O.J. Reyes. 2012. Diversidad y distribución vertical de líquenes corticícolas en la pluvisilva montana de la Gran Piedra, Cuba. Botanica Complutensis 36: 19-30. [ Links ]
76. Rose, F. 1976. Lichenological indicators of age and ecological continuity in Woodlands. In: D.H. Brown, D.L. Hawksworth & R.H. Bailey (eds). Lichenology: Progress and Problems. Academic Press, Londres, pp 279-307. [ Links ]
77. Rose, F. 1992. Temperate forest management: its effects on bryophyte and lichen floras and habitats. In: J.W. Bates, & A.M. Farmer (eds). Bryophytes and Lichens in a Changing Enviroment. Oxford Scientific Publications, Oxford, pp 211–233. [ Links ]
78. Selva, S. B. 1996. Using lichens to assess ecological continuity in northeastern forests. In: M. Byrd (ed.). Eastern Old-Growth Forests – Prospects for Rediscovery and Recovery. Island Press,Washington, DC, pp 35-48. [ Links ]
79. Simijaca, D., M. Morales & C. Díaz. 2011. Líquenes y contaminación atmosférica en la Universidad Pedagógica y Tecnológica de Colombia,Tunja-Boyacá-Colombia). Ciencia en Desarrollo 3: 19. [ Links ]
80. Simijaca-Salcedo, D.F., D.L. Vargas-Rojas & M.E. Morales-Puentes. 2014. Use of non-vascular plant organisms as indicators of urban air pollution (Tunja, Boyacá, Colombiano). Acta BiológicaColombiana 19: 221-231. [ Links ]
81. Sipman, H.J.M. 1986. Notes on the lichen genus Everniastrum (Parmeliaceae).Mycotaxon 26: 235-251. [ Links ]
82. Sipman, H.J.M. 1989. Lichen zonation in the Parque los Nevados transect. Studies on Tropical Andean Ecosystems 3: 461-483. [ Links ]
83. Sipman, H.J.M. 1995. Preliminary review of the lichen biodiversity of the Colombian montane forests. In: S.P. Churchill, H. Balslev, E. Forero & J.L. Luteyn (eds.). Biodiversity and Conservation of Neotropical Montane Forests. New York Botanical Garden, Bronx, Nueva York, pp. 313-320. [ Links ]
84. Sipman, H.J.M. 1999. Lichens. In: J.L. Luteyn (ed.). Páramos: a Checklist of Plant Diversity, Geographical Distribution, and Botanical Literature. Memoirs of The New York Botanical Garden, New York Botanical Garden, Bronx, Nueva York, pp. 41-53. [ Links ]
85. Sipman, H.J.M. 2002. The significance of the northern Andes for lichens. Botanical Review 68: 88-99. [ Links ]
86. Sipman, H.J.M. 2005. Identification key and literature guide to the genera of Lichenized Fungi (Lichens) in the Neotropics. Botanic Garden & Botanical Museum Berlin-Dahlem, Free University of Berlin. http://www.bgbm.org/sipman/keys/neokeyA.htm. [ Links ]
87. Sipman, H.J.M. & J. Aguirre-C. 1982. Contribucion al conocimiento de los líquenes de Colombia - 1. Clave genérica para los líquenes foliosos y fruticosos de los páramos colombianos. Cladasia 12: 603-634. [ Links ]
88. Sipman, H.J.M., J.A. Elix & T.H. Nash, III. 2009: Hypotrachyna (Parmeliaceae, Lichenized Fungi). Flora Neotropica Monograph 104: 1-176. [ Links ]
89. Soto-Medina, E., R. Lücking& A.B. Rojas. 2012. Especificidad de forófito y preferencias microambientales de los líquenes cortícolas en cinco forófitos del bosque premontano de finca Zíngara, Cali, Colombia. Revista de Biología Tropical 60: 843-856. [ Links ]
90. Soto-Medina, E., V. Londoño-Lemos & D. Díaz-Escandón. 2015. Epiphytes from a forest type transition zone in the Choco biogeographic region, Valle del Cauca, Colombia. Revista de Biología Tropical 63: 915-926. [ Links ]
91. Spielmann, A.A. & M.P. Marcelli. 2009. Parmotrema s. l. (Parmeliaceae, lichenized Ascomycota) from Serra Geral slopes in central Rio Grande do Sul State, Brazil. Hoehnea 36: 551-595. [ Links ]
92. Stocker-Wörgötter, E., L.M.C. Cordeiro & M. Iacomini. 2013. Accumulation of potential pharmaceutically relevant lichen metabolites in lichens and cultured lichen symbionts. Studies in Natural Products Chemistry 39: 337-380. [ Links ]
93. Timdal, E. 2008. Studies on Phyllopsora (Ramalinaceae) in Peru. Lichenologist 40: 337-362. [ Links ]
94. Timdal, E. 2011. The lichen genus Phyllopsora (Ramalinaceae) in the West Indies. Bibliotheca Lichenologica 106: 319-351. [ Links ]
95. Truong, C., F. Bungartz & P. Clerc. 2011. The lichen genus Usnea (Parmeliaceae) in the tropical Andes and the Galapagos: species with a red-orange cortical or subcortical pigmentation. The Bryologist 114: 477-503. [ Links ]
96. Truong, C., J.M. Rodridguez & P. Clerc. 2013. Pendulous Usnea species (Parmeliaceae, lichenized Ascomycota) in tropical South America and the Galapagos. The Lichenologist 45: 505-542. [ Links ]
97. Valencia-Islas, N., A. Zambrano & J.L. Rojas. 2007. Ozone reactivity and free radical scavenging behavior of phenolic secondary metabolites in lichens exposed to chronic oxidant air pollution from Mexico City. Journal of Chemical Ecology 33: 1619-1634. [ Links ]
98. Villareal, H., M. Álvarez, S. Córdoba, F. Escobar, G. Fagua, F. Gast, H. Mendoza, M. Ospina & A.M. Umaña. 2006. Manual de métodos para el desarrollo de inventarios de biodiversidad. Programa de Inventarios de Biodiversidad. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá. 236 pp. [ Links ]
99. Will-Wolf, S., S. Jovan, P. Neitlich, J.E. Peck & R. Rosentreter. 2015. Lichen-based indices to quantify responses to climate and air pollution across northeastern USA. The Bryologist 118: 59-82. [ Links ]
100. Wolf, J.H.D. 1995. Non-vascular epiphyte diversity patterns in the canopy of an upper montane rain forest (2550-3670 m), Central Cordillera, Colombia. Selbyana 16: 185-195. [ Links ]
101. Zotz, G., B. Büdel, A. Meyer, H. Zellner & O.L. Lange. 1998. In situ studies of water relations and CO2 exchange of the tropical macrolichen, Sticta tomentosa. New Phytologist 139: 525-535. [ Links ]














