Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232
Caldasia vol.38 no.1 Bogotá Jan./June 2016
https://doi.org/10.15446/caldasia.v38n1.57838
LILIANA DIODATO
ANDREA FUSTER
Instituto de Protección Vegetal, Facultad de Ciencias Forestales, Universidad Nacional de Santiago del Estero. Avda. Belgrano (s) 1912. Santiago del Estero, Argentina. CP 4200. ldiodato@unse.edu.ar, andrefusvau@yahoo.com.ar
RESUMEN
El dosel arbóreo constituye un complejo hábitat con gran diversidad de insectos. Los estudios sobre insectos del dosel están mayormente concentrados en bosques húmedos tropicales y son escasos en bosques secos subtropicales. El propósito de este trabajo fue caracterizar la entomofauna del dosel de bosques secos subtropicales, analizando su diversidad regional y localmente. Para ello se muestrearon cinco sitios localizados en la región fitogeográfica del Chaco Semiárido Argentino. Las recolecciones de insectos se realizaron durante el período estival y mediante la técnica de vareo de ramas (beating). Se recolectaron 963 insectos pertenecientes a nueve órdenes y 79 familias. La composición taxonómica y la distribución de la abundancia de familias fueron diferentes en los sitios estudiados. Las condiciones ambientales propias y los disturbios antrópicos de los sitios influyeron en la determinación de los agrupamientos taxonómicos y en la distribución de la abundancia de los insectos. Los resultados que se presentan en este trabajo constituyen los primeros datos sobre la diversidad de insectos del dosel en bosques secos subtropicales, y aportan conocimientos iniciales para futuros estudios sobre interacciones ecológicas y, en general, sobre la diversidad del dosel de estos bosques.
Palabras clave. Ensambles de insectos, abundancia, diversidad, Chaco Semiárido, Argentina.
ABSTRACT
The canopy is a complex habitat with a great diversity of insects. Most studies on canopy insects refer to tropical rain forests, and seldom to subtropical dry forests. The purpose of this study is to characterize the insect fauna in the canopy of subtropical dry forests, analyzing their diversity both regional and local. Samples were taken in five sites located in the phytogeographical district known as Semiarid Chaco, in Argentina. A total of 963 insects, belonging to 9 orders and 79 families, were collected in the summer by using the "branch-beating" technique. Differences in family abundance distribution and in taxonomic composition were among between sites, resulting in low similarity values. Environmental conditions and human disturbance in the sites might have influenced the taxonomic composition and the distribution of insect abundance. This paper provides the first data on the diversity of canopy insects in subtropical dry forests, and sets the basis for future studies regarding ecological interactions and canopy diversity in these forests.
Key words. Insect assemblages, abundance, diversity, xerophytic forest, disturbance.
Recibido: 06/02/2014
Aceptado: 22/05/2016
INTRODUCCIÓN
El dosel arbóreo, fundamental en importantes procesos ecosistémicos, integrado por las hojas, brotes, ramas finas, flores, frutos y semillas y también por las plantas trepadoras, epífitas y musgos que sostienen, originan múltiples y variados nichos ecológicos para refugio y desarrollo de una entomofauna diversa (Erwin 1983, Stork 1988, Gaston 1991, Basset et. al 2001, Barrios 2003). La implementación de técnicas para acceder al dosel permitió profundizar su conocimiento y estudiar la diversidad de organismos generada en respuesta a la heterogeneidad ambiental de este estrato, desde distintos aspectos (Nadkarni et al. 2008).
En general, los trabajos sobre insectos del dosel abarcaron estudios de composición taxonómica, patrones alimentarios, distribución, abundancia y diversidad (Stork 1988, Addis et al. 1998, Hammond 1992, Erwin 1995, Basset 2001). En América Central y Sudamérica la mayoría de estos estudios se vinculan a bosques tropicales húmedos y muy pocos a bosques secos subtropicales (Basset 2001).
En Argentina el área semiárida del Chaco Sudamericano abarca una extensión de alrededor 240.000 km2 con bosques en su mayoría xerófilos caducifolios (Neumann 1985). Las principales actividades productivas de la región, la ganadería extensiva, la agricultura y el aprovechamiento forestal, en los últimos años se intensificaron afectando los ecosistemas de bosques nativos y en consecuencia su biodiversidad florística y faunística (Naumann & Madariaga 2003, Boletta & Ravelo 2009).
Los resultados que se presentan son parte de un estudio integral tendiente a conocer la biodiversidad del Chaco Semiárido. El objetivo de este trabajo es caracterizar a nivel taxonómico superior (órdenes y familias) la composición y la diversidad del ensamble de insectos presentes en el dosel de los bosques secos subtropicales a escala global y localmente por tipos de bosques.
MATERIALES Y MÉTODOS
Sitios de estudio
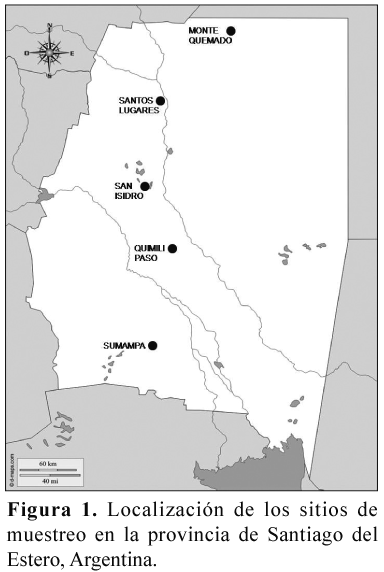
Los sitios de estudio se encuentran localizados en la provincia de Santiago del Estero, en la Región Neotropical, Chaco semiárido de Argentina (Cabrera 1976). El clima es subtropical continental semiárido, con una marcada estación seca invernal (abril a septiembre). Las lluvias son moderadas a escasas, varían entre los 500 y 700 mm anuales (Naumann 2006). La temperatura media anual oscila entre los 18° C y 25° C (Boletta & Ravelo 2009). La fisonomía general de la vegetación corresponde a bosques caducifolios xerofíticos (Cabrera 1976).
En un gradiente latitudinal de 25°50´S a 29°20´S y longitudinal de 62°42´O a 64°03´O se seleccionaron cinco bosques nativos típicos del Chaco Semiárido: (1) Bosques de "quebrachos" conformado por un estrato superior de Schinopsis lorentzii (Griseb.) Engl y Aspidosperma quebracho-blanco Schlecht., un estrato medio con predominancia de Ziziphus mistol Griseb., Celtis tala Gillies ex Planch. y Acacia praecox Griseb que corresponden a los sitios Monte Quemado (MQ) y Santos Lugares (SL); (2) Bosque secundario con cobertura vegetal defectiva-irregular debido a fuertes intervenciones antrópicas, con estrato superior de A. quebracho-blanco, y estrato medio de Acacia aroma (Hook.yArrn), Prosopis nigra (Griseb.) Hieron , P. ruscifolia Griseb. San Isidro (SI); (3) Bosque mesopotámico, con afloramiento de suelos salinos, a causa de anegamientos periódicos. La vegetación corresponde a un bosque con cobertura defectiva de S. lorentzii, A. quebracho-blanco, acompañados de Z. mistol, A. aroma y C. tala en el estrato medio: Quimilí Paso (QP); (4) Bosque serrano, estrato superior con predominancia de S. lorentzii y A. quebracho-blanco, y en el estrato medio de P. nigra, Caesalpina paraguariensis (D. Parodi) Burkarty Geoffroea decorticans (Gill.) Burk.: Sumampa (SU) (Figura 1).
Muestreo de insectos
Los muestreos se efectuaron en época estival, durante los meses de octubre a marzo de 2010. Los insectos del dosel se recolectaron, mediante la técnica de vareo de ramas con el auxilio de una red entomológica modificada con mango telescópico para acceder a la copa de los árboles hasta alturas de seis y ocho metros, denominada red de copa siguiendo la metodología propuesta por Correa-Costa et al. (1993); Diodato (1999, 2005). En cada bosque se trazaron tres líneas de 100 m de longitud, separadas entre ellas aproximadamente unos 200 m. Sobre cada línea, cada 10 m en árboles de diámetro a la altura del pecho (DAP) mayor a 15 cm se recogieron las muestras de la copa. Se muestrearon diez árboles por línea, 30 por sitio y 150 en total. La unidad de muestreo consistió de diez golpes de vareo en las ramas (beating), en cada dirección cardinal de la copa (Diodato 2005). Los insectos recolectados fueron determinados a nivel de taxón de alto rango (Orden y Familia) por medio de claves taxonómicas (Borror & De Long 1988; Ross 1971) . El material identificado se encuentra depositado en la colección entomológica del Instituto de Protección Vegetal, de la Facultad de Ciencias Forestales, Universidad Nacional de Santiago del Estero, Argentina.
Análisis de los datos
Se analizó la composición, la abundancia y la riqueza de unidades taxonómicas (Orden y Familia) del ensamble de insectos del dosel globalmente y por tipo de bosque. La riqueza se determinó por el número de familias observadas y la abundancia por el número de individuos presentes en las muestras. Se analizaron los taxones dominantes en los diferentes sitios mediante las curvas de rango-abundancia (Magurran 1988). Las diferencias significativas entre sitios de abundancia y riqueza se calcularon por la prueba de Kruskal-Wallis (Infostat ver.2011; Di Rienzo et al. 2011). Según la composición de taxones los sitios fueron agrupados mediante el análisis multivariado de correspondencia (programa PAST ver. 1.81; Hammer et al. 2001). Se obtuvieron los valores de similitud entre sitios mediante el índice de Jaccard calculado por el programa EstimateS ver. 8.2 (Colwell 2009).
RESULTADOS
Análisis global de la composición y la diversidad de los insectos del dosel
En total se recolectaron 963 individuos, pertenecientes a nueve órdenes y 79 familias de insectos. Tres órdenes comprendieron el 78 % de los insectos recolectados, correspondientes a Hemiptera (34%), Hymenoptera (25%) y Coleoptera (19%) (Figura 2A). El orden con mayor riqueza de familias fue Coleoptera seguido de Hymenoptera y Diptera y los de menor riqueza fueron Thysanoptera, Psocoptera y Neuroptera (Figura 2B).
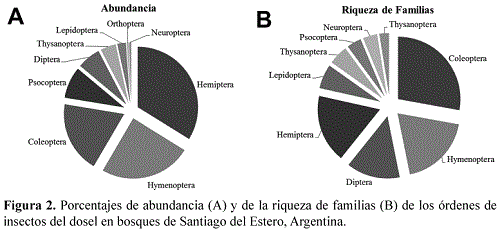
Cinco órdenes fueron constantes en todos los bosques: Coleoptera, Hymenoptera, Hemiptera y Diptera. Se registró Neuroptera únicamente en el bosque mesopotámico (QP).
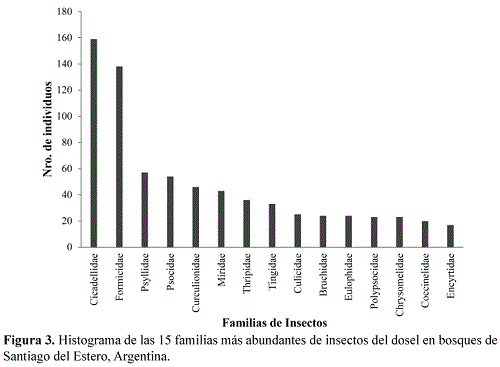
De las 79 familias registradas, Cicadellidae, Formicidae y Psyllidae fueron las más abundantes y representaron en conjunto el 37 % del total. Le siguieron en abundancia las familias Psocidae, Curculionidae, Miridae, Thripidae y Tingidae (Figura 3).
Composición y diversidad de los insectos del dosel según tipos de bosques
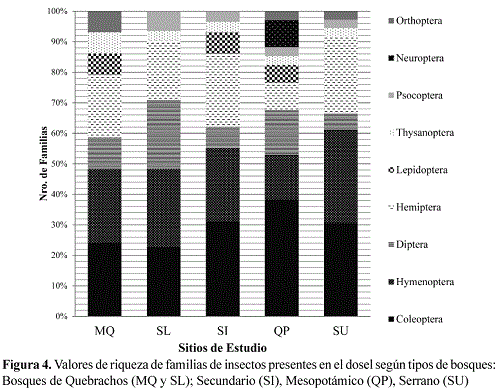
Según tipo de bosque la riqueza de órdenes osciló entre ocho y siete y la riqueza de familias entre 27 y 35. En todos los bosques Coleoptera e Hymenoptera, en coincidencia con el patrón observado a escala global, fueron los órdenes con mayor riqueza de familias (Figura 4).
El patrón de abundancia fue diferente según los tipos de bosques, siendo Hemiptera, Hymenoptera y Coleoptera los grupos dominantes (Figura 5).
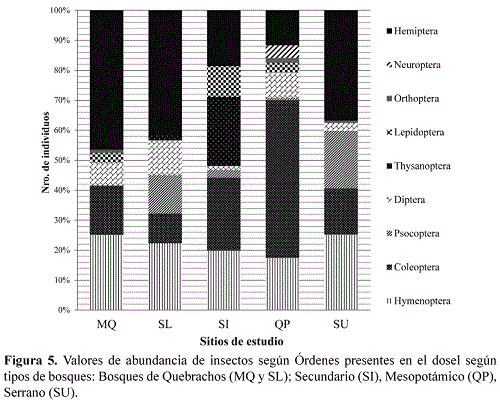
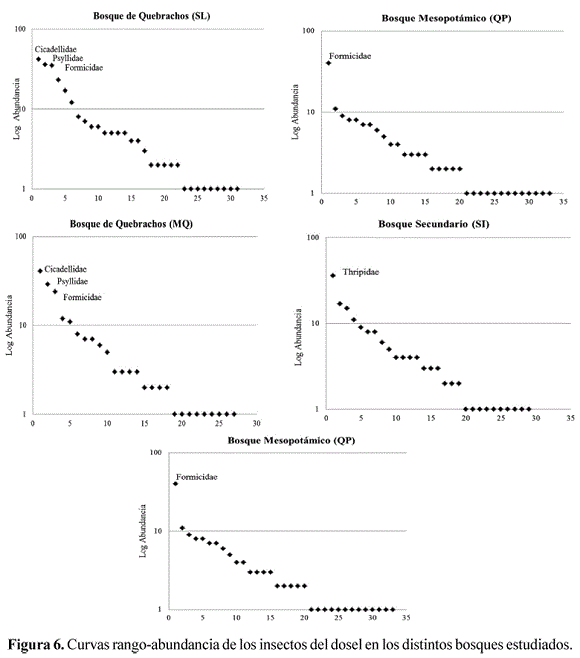
Las curvas de rango-abundancia mostraron distintas distribuciones de familias. En el bosque secundario y mesopotámico hubo dominancia de una única familia, en tanto, en los bosques de quebrachos y en el serrano la dominancia se repartió en 3 y 4 taxones, indicando una mayor equidad en la distribución de la abundancia en estos últimos bosques (Figura 6).
Las diferencias entre los valores de abundancia y riqueza de familias de insectos de los distintos bosques no fueron estadísticamente significativas (p ˃ 0.05) (Tabla 1).

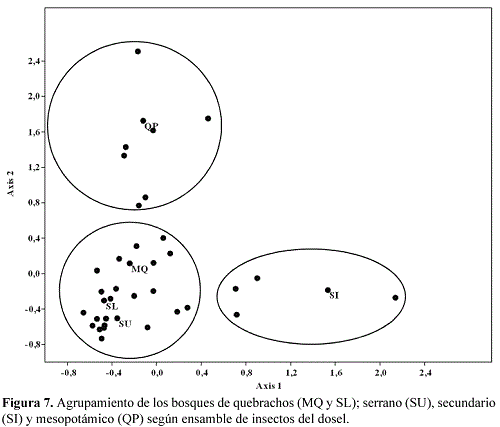
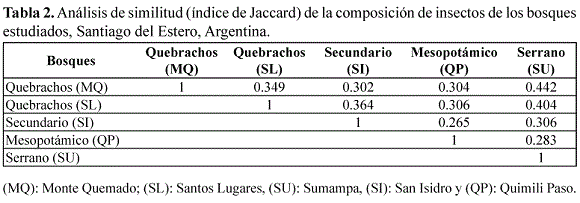
En el análisis de ordenamiento de los bosques según composición faunística, el bosque de quebrachos y el serrano son los más próximos, en tanto, el bosque secundario y el mesopotámico se diferenciaron de este agrupamiento y también entre ellos (Figura 7); resultado que coincide con lo indicado por los valores obtenidos del análisis de similitud (Tabla 2). El bosque de quebrachos y el bosque serrano comparten el mayor número de grupos taxonómicos mientras los bosques mesopotámico y secundario poseen grupos exclusivos.
DISCUSIÓN
Riqueza y abundancia de órdenes y familias de insectos del dosel de bosques secos subtropicales
La riqueza de órdenes de insectos (S=9) observada en el dosel de los bosques estudiados se aproxima a los valores registrados en otros bosques de ambientes áridos. Mientras en bosques tropicales y subtropicales húmedos se registraron entre 13 y 21 órdenes de insectos, utilizándose las técnicas de pulverización con insecticidas (fogging), trampas aéreas de intercepción de vuelo, vareo de ramas y recolecciones manuales (Marques et al. 2006, Santos et al. 2003, Gasca & Higuera 2008, Correa-Costa 1986), en bosques de ambientes áridos de Chile, aplicando la técnica de vareo del follaje, técnica similar a la utilizada en este estudio, se recolectaron insectos clasificados en 11 órdenes (Saiz et al. 2000).
La dominancia en riqueza de familias de Coleoptera e Hymenoptera registrada, también se observó en bosques tropicales y subtropicales tanto de ambientes húmedos como secos (Correa-Costa 1986, Krüger& Mac Gavin 1998, Basset 2001, Forbes et al. 2005), lo cual indicaría a este patrón de riqueza, a nivel de taxones superiores, como el prevalente en el dosel. La mayor riqueza de Coleoptera, se justifica ya que este taxón se destaca por su diversidad en diferentes ecosistemas y en el dosel de distintos tipos de bosques (Stuntz et al. 2002, Floren & Linsenmair 2003, Wagner 2003).
El patrón de abundancia del dosel de bosques del Chaco semiárido se explicaría principalmente por factores biológicos como la especialización alimenticia y disponibilidad de recursos en coincidencia con lo observado por Neves et al. 2013.
Los órdenes Hemiptera, Hymenoptera y Coleoptera, integrantes del patrón de abundancia del dosel descripto en este estudio, son taxones que también componen los patrones de abundancia en otros estudios sobre diversidad de dosel de bosques subtropicales y tropicales. Correa-Costa (1986) y Saiz et al. (2000) en bosques subtropicales húmedos y áridos respectivamente, clasificaron a Hemiptera como el taxón más abundante y Marques et al. (2006) en bosques tropicales húmedos indicaron a Hymenoptera y Coleoptera, representando el 62 % del total de especímenes recolectados. La abundancia de insectos depende de varios factores, entre otros, la distribución biogeográfica, las características propias de los bosques y de los métodos de muestreo aplicados para su estimación (Basset 2001); así como de la propia biología de los insectos. En el caso de los insectos fitófagos la especialización alimenticia está estrechamente vinculada con la estructura del dosel (Dial et al. 2006). El orden Hemiptera, integrado por insectos de régimen alimenticio fitófago succionador generalmente desarrollan numerosas colonias y son altamente dependientes de las características intrínsecas de su hospedante (Lawton 1983, Bernays & Chapman 1994, Novotny et al. 2003) como la disponibilidad de brotes terminales u órganos reproductivos accesibles (Jansen, 1975), lo cual justificaría su abundancia en el dosel de los bosques subtropicales secos, con prevalencia de los auquenorincos. La abundancia de Hymenoptera, segundo orden del patrón de abundancia observado y representado principalmente por Formicidae, podría explicarse principalmente por las característica etológicas de los insectos sociales de agruparse en grandes colonias (Hölldobler& Wilson 1990, Basset 2001) y por la disponibilidad de recursos alimenticios en las copas diferentes a los encontrados en los estratos herbáceos y arbustivos, lo cual estimula el forrajeo de hormigas tanto arborícolas como epígeas (Longino & Nadkarni 1990, Andersen & Yen 1992). En los bosques tropicales, Formicidae generalmente ocupa el primer lugar en el patrón de abundancia (Basset 2001) y esta diferencia probablemente responde a la característica de caducifolios de los bosques subtropicales secos con marcada estacionalidad en la oferta de recursos alimenticios en el estrato superior (Jafféet al. 2007) y a la mayor entrada de luz al suelo que genera mejores condiciones para las hormigas epígeas que a las arborícolas.
Las características propias de los bosques húmedos tropicales, con alta acumulación de materia orgánica y bajas tasas de descomposición (Kitching et al. 1997, Palacios-Vargas et al. 1998) propician la abundancia de Collembola e Isoptera en el dosel (Basset 2001, Santos et al. 2003); taxones que no se registraron en este estudio. Probablemente, el orden Psocoptera, representado por las familias Psocidae y Polypsocidae presentes en el dosel de los bosques subtropicales secos estudiados cumple el rol detritívoro en bosques con estas carácterísticas.
La riqueza (S=79) de familias de insectos en el dosel de bosques del Chaco Semiárido es próxima a la observada en otros tipos de bosques. En bosques subtropicales húmedos se registraron 83 familias (Correa-Costa 1986) y en bosques tropicales 112 familias (Basset et al. 2001). La distribución de las familias de los bosques estudiados coincide en general con los patrones de diversidad descriptos en bosques tropicales secos. La frecuencia de Cicadellidae y Psyllidae observada, de estrecha relación trófica con el follaje, son componentes constantes y abundantes en los ensambles de insectos del dosel (Kitching et al. 1997, Saiz et al. 2000, Basset 2001, Neves et al. 2010).
Abundancia, riqueza y composición del ensamble insectos según tipo de bosques
La abundancia y riqueza de los insectos fueron similares en los distintos tipos de bosque, sin embargo, difirieron en la composición del ensamble. El análisis de agrupamiento mostró la similitud en la composición de los taxones de los bosques de quebrachos y el serrano con dosel continuo de S. lorentzii y A. quebracho-blanco. Y diferenció el bosque mesopotámico con composición del estrato arbóreo similar a los anteriores del bosque secundario conformado solo por A. quebracho-blanco; y ambos con la característica común de cobertura defectiva. En todos los bosques, el estrato arbóreo medio fue diferente en composición y estructura. El ordenamiento de los bosques muestra que el ensamble de los insectos del dosel está estrechamente relacionado con los estratos vegetales, la composición y cobertura de los mismos. Sin embargo, la distribución de los insectos no está totalmente definida a un único estrato, es posible que exista un gradiente vertical para determinadas especies. Si bien existen especies que habitan permanentemente en la copa de los árboles, otras pueden ser temporalmente arbóreas; y esto depende de su biología. Así, algunas especies con preferencia por la copa pueden en algún momento observarse en el sotobosque, como un estrato de tránsito (Nielsen 1975).
La heterogeneidad espacial y las diferentes fisonomías vegetales de los sitios proveen variados recursos alimenticios y hábitats para la reproducción y desarrollo de diferentes especies. A su vez, las modificaciones del hábitat por distintas causas, también inciden en la composición taxonómica de un sitio debido a las estrechas interacciones planta-insecto (Collins & Thomas 1991, Kremen 1992).
Los bosques de quebrachos y el serrano con características vegetales y disponibilidad de recursos en cantidad y calidad similares compartieron el mayor número de familias; en tanto, los restantes bosques estudiados tuvieron mayor porcentaje de especies exclusivas, debido a sus marcadas diferencias en la estructura vegetal tanto naturales como antrópicas; lo que origina el recambio de especies, proceso común en estos ambientes. (Basset et al. 2003, Davies et al. 1997, Ribas et al. 2003, Yanoviak et al., 2004, 2007, Sobek et al. 2009). Además el mayor recambio de taxones en los bosques mesopotámico y secundario estaría vinculado con la simplificación de la estructura del dosel y los distintos gradientes de iluminación, la mayor superficie de áreas abiertas y la biología de los diferentes grupos (Gossner 2009).
En los bosques con dosel continuo (de quebrachos y serrano) los taxones superiores más abundantes fueron Hemiptera, Hymenoptera y Coleoptera. En cambio, en el dosel discontinuo de los bosques mesopotámico y secundario Coleoptera fue el taxón más abundante, por su plasticidad trófica.
Las familias Cicadellidae y Psyllidae fueron las más abundantes, en el dosel continuo de los bosques de quebracho y serrano; como observó Neves et al. (2010) en el dosel de bosques tropicales secos de Brasil. Probablemente la proximidad de las copas contribuye a la mejor dispersión y en consecuencia; a la mayor abundancia (Moran & Southwood 1982, Adis et al. 1984, Stork 1987). La dominancia de la familia Formicidae en el bosque mesopotámico con áreas abiertas naturales y discontinuidad en el dosel, probablemente responde a la presencia de hormigas epígeas con nidos en los claros con mayor iluminación que en el interior de los bosques y a la adaptabilidad de las mismas, que las llevaría a buscar nuevos sitios de forrajeo en las copas de los árboles. La abundancia de Thysanoptera, con la familia Thripidae, observada únicamente en el bosque secundario, coincidente con la floración de los árboles, y puede justificarse por estrecha relación que existe entre la abundancia de organismos y la disponibilidad estacional de los recursos alimenticios (Saiz et al. 2000, Basset 2001).
De acuerdo a los resultados obtenidos aplicando la técnica de vareo de ramas en la copa y la red entomológica de copa para la recolección de los especímenes, se comprobó que este método es efectivo para caracterizar la entomofauna del dosel de bosques subtropicales secos , ya que fue posible recolectar taxones en número representativo a los recolectados mediante otros métodos.
Este estudio, uno de los primeros en analizar las comunidades de insectos del dosel de los bosques del Chaco semiárido, contribuye al conocimiento de la diversidad del estrato superior de estos bosques y permitió reconocer los taxones de insectos más diversos y abundantes. Estos grupos podrían ser utilizados en el futuro como grupos focales y profundizarse en estudios específicos, generando conocimientos esenciales en análisis de cambios del uso del suelo o planes de restauración de los bosques degradados.
LITERATURA CITADA
1. Adis, J., Y. Lubin & G. Montgomery. 1984. Arthropods from the canopy of inundated and Terra firme forests near Manaus, Brazil, with critical considerations on the Pyrethrum-fogging technique. Studies On Neotropical Fauna And Environment 19: 223-236. [ Links ]
2. Andersen, A.N. & A.L. Yen. 1992. Canopy ant communities in the semi-arid mallee region of north-western Victoria. Australian Journal of Zoology 40: 205-14. [ Links ]
3. Basset, Y. 2001. Invertebrates in the canopy of tropical rain forests How much do we really know? Plant Ecology 153:87–107. [ Links ]
4. Basset, Y., H.P. Aberlenc, H. Barrios, G. Curletti, J.M. Berenger, J.P. Vesco, P. Causse, A. Haug, A.S. Hennion, L. Lesobre, F. Marques & R. Omeara. 2001. Stratification and diel activity of arthropods in a lowland rainforest in Gabon. Biological Journal of the Linnean Society 72: 585–607. [ Links ]
5. Basset, Y., V. Novotny, S. Miller & R. Kitching. 2003. Arthropods of tropical forests: spatio-temporal dynamics and resource use in the canopy. Cambridge University Press, Cambridge, 474p. [ Links ]
6. Bernays, E.A. & R.F. Chapman. 1994. Host-Plant Selection by Phytophagous Insects. Chapman & Hall, Nueva York. 312 pp. [ Links ]
7. Boletta, P.E. & A.C. Ravelo. 2009. La Deforestación y el Cambio del Uso de la Tierra en el Chaco Seco: Problemática de la Desertificación. En: A. Giannuzzo & M. Ludueña (eds.).Cambios y problemas ambientales. Perspectivas para la acción: 153 -176. Facultad de Ciencias Forestales-Universidad Nacional de Santiago del Estero. Santiago del Estero, Argentina. [ Links ]
8. Borror, D.J., DeLong. D.M., 1988. Introducao ao estudo dos insetos. Edgard Bullcher, São Paulo, 653 pp. [ Links ]
9. Cabrera, A.L. 1976. Regiones fitogeográficas argentinas. En: W.F. Kugler (ed.). Enciclopedia Argentina de Agricultura y Jardinería II, ACME, Buenos Aires. 85p. [ Links ]
10. Collins, N.M. & J.A. Thomas. 1991. The Conservation of insects and their habitats. Academic Press, Londres. 450p. [ Links ]
11. Colwell, R.K. 2009. EstimateS: statistical estimation of species richness and shared species from samples. Version 8.2. URL <purl.oclc.org/estimates> Última consulta julio 2009. [ Links ]
12. Correa-Costa, E. 1986. Artrópodes asociados a Bracatinga (Mimosa scabrella Benth). Tesis doctoral, Universidade Federal do Paraná, Paraná. Brasil. 271p. [ Links ]
13. Correa-Costa, E., C. Link & L. Diodato de Medina. 1993. Indice de diversidade para entomofauna da bracatinga (Mimosa scabrella Benth.). Diversity index for "Bracatinga" insect fauna (Mimosa scabrella Benth.). Ciencias Florestais 3 (1): 65-75 [ Links ]
14. Davies, J.G., N.E. Stork, M.J.D. Brendell& S.J. Hine. 1997. Beetle species diversity and faunal similarity in Venezuelan rainforest tree canopies. En: N.E Stork, J. Adis& R.K. Didham (eds.). Canopy Arthropods.84-103.Chapman & Hall.Londres. [ Links ]
15. Dial R.J., M.D.F. Ellwood, E.C. Turner & W.A. Foster . 2006. Arthropod abundance, canopy structure, and microclimate in a Bornean Lowland Tropical Rain Forest. Biotropica 38(5): 643–652. [ Links ]
16. Diodato, L. 1999. Estudio de las comunidades de coleópteros fitófagos (Curculionoidea) en áreas naturales y repobladas de la región central de España. Tesis doctoral. Escuela Superior de Ingenieros de Montes. Universidad Politécnica de Madrid, Madrid 287 p. [ Links ]
17. Diodato, L. 2005. Conservación de la biodiversidad de artrópodos (Insecta) en ambientes naturales del Chaco semiárido. En: A.N. Giannuzzo & M.E. Ludueña (eds.). Santiago del Estero una mirada ambiental: 207-224. Facultad de Ciencias Forestales. UNSE. Santiago del Estero. Argentina. [ Links ]
18. Di Rienzo, J.A., F. Casanove, M.G. Balzarini, L. González, M. Tablada & C.W. Robledo. InfoStat versión 2011. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. URL (http://www.infostat.com.ar) Ultima consulta diciembre 2011. [ Links ]
19. Erwin, T.L. 1983. Tropical forest canopies, the last biotic frontier. Bulletin of the Entomological Society of America 29: 14-19. [ Links ]
20. Erwin, T.L. 1995. Measuring arthropod biodiversity in the tropical forest canopy. En: M.D. Lowman & N.M. Nadkarni, (eds.). Forest Canopies: 109-127. Academic Press, San Diego. [ Links ]
21. Floren, A. & K.E. Linsenmair. 2003. How do arboreal communities of Coleoptera of a lowland rain forest react to anthropogenic disturbance? En: W.F.Laurance, O.Richard, J.Bierregard, (eds). Tropical forest remnants: ecology, management, and conservation of fragmented communities: 3-12.University of Chicago, Chicago. [ Links ]
22. Forbes, G.S., J.W. Van Zee, W. Smith & W.G. Whitford. 2005. Desert grassland canopy arthropod species richness: temporal patterns and effects of intense, short-duration livestock grazing. Journal of Arid Environments 60: 627-646. [ Links ]
23. Gasca A.H.J & D. Higuera. 2008. Artrópodos asociados al dosel de un robledal de Quercus humboldtii bonpl. (Fagaceae) de la Reserva Bosque Macanal (Bojacá, Colombia). Boletín Sociedad Entomológica Aragonesa 48: 173-185. [ Links ]
24. Gaston, K.J. 1991. The magnitude of global insect species richness. Conservation Biology 5: 283-96. [ Links ]
25. Gossner, M.M. 2009. Light intensity affects spatial distribution of Heteroptera in deciduous forests. European Journal of Entomology 106: 241–252. [ Links ]
26. Hammer, O., D.A.T. Harper & P.D. Ryan. 2001. PAST: Palaeontological Statistics software package for education and data analysis. Palaeontologia Electronica4(1): 9. [ Links ]
27. Hammond, P.M. 1992. Species inventory. En: B. Groombridge (ed.). Global Biodiversity: Status of the Earth's Living Resources: 17-39. Chapman & Hall, Londres. [ Links ]
28. Hölldobler, B. & E.O. Wilson. 1990. The ants. The Belknap Press of Harvard University Press, Cambridge, Massachusetts. 732p. [ Links ]
29. Jaffé, K., P. Horchler, M. Verhaagh, C. Gomez, R. Sievert, R. Jaffe & W. Morawetz. 2007. Comparing the ant fauna in a tropical and a temperate forest canopy. Ecotropicos 20(2): 74-81. [ Links ]
30. Jansen, D.H. 1975. Sweep Samples of Tropical Foliage Insects: Effects of Seasons, Vegetation Types, Elevation, Time of Day, and Insularity. Ecology 54 (3): 687-708. [ Links ]
31. Kitching, R.L., H. Mitchell, G. Morse & G. Thebaud. 1997. Determinants of species richness in assemblages of canopy arthropods in rainforests, En: N.E. Stork, J. Adis& R.K. Didham (eds.). Canopy Arthropods: 131-150. Chapman & Hall, Londres. [ Links ]
32. Kremen, C. 1992. Assessing the indicator properties pf species assemblages for natural areas monitoring. Ecological Applications 2: 203-217. [ Links ]
33. Krüger, O. & G.C. Mac Gavin. 1998. Insect diversity of Acacia canopies in Mkomazi game reserve, north-east Tanzania. Ecography 21: 261–268. [ Links ]
34. Lawton, J.H. 1983. Plant architecture and the diversity of phytophagous insects. Annual Review of Entomology 28: 23-39. [ Links ]
35. Longino, J. & N. Nadkarni. 1990. A comparison of ground and canopy leaf litter ants (Hymenoptera: Formicidae) in a neotropical montane forest. Psyche 97: 81-93. [ Links ]
36. Magurran, A.E. 1988. Ecological diversity and its measurement. Princeton University Press, Nueva Jersey. 179 p. [ Links ]
37. Marques, m. i., J. Adis, c, Nunes Da Cunha & G. Brizzola Dos Santos. 2002. Arthropods obtained from the canopy of vochysiadivergens (vochysiaceae), a forest dominant in the brazilianpantanal. EN: R. Lieberei, H. Bianchi, V. Boehm & C. Reisdorff (eds), Neotropicalecosystems: proceedings of the German-Brazilian workshop, Hamburg 2000. 561-563. Geesthacht: Gkss-Forschungszentrum. [ Links ]
38. Marques, M.I., J. Adis, G.B. dos Santos & L.D. Battirola. 2006.Terrestrial arthropods from tree canopies in the Pantanal of MatoGrosso, Brazil. Revista Brasileira de Entomologia 50: 257-267. [ Links ]
39. Moran, v. c. & t. r. e. Southwood. 1982. The guild composition of arthropod communities in trees. Journal of Animal Ecology 51: 289-306. [ Links ]
40. Nadkarni, N.M., A.C.S. McIntosh & J.B. Cushing. 2008. A conceptual framework to categorize perceptions and understanding of forest structure. Forest Ecology and Management 256:872–882. [ Links ]
41. Naumann, M. & M. Madariaga. 2003. Atlas Argentino. Programa de Acción Nacional de Lucha contra la Desertificación. Secretaría de Ambiente y Desarrollo Sustentable. Instituto Nacional de Tecnología Agropecuaria, Buenos Aires, Argentina. 95p. [ Links ]
42. Naumann, M. 2006. Atlas del Gran Chaco Sudamericano. Sociedad Alemana de Cooperación Técnica (GTZ). ErreGé&Asoc. Buenos Aires. 92 p. [ Links ]
43. Neumann, R. 1985. Ecosistemas de la Región subtropical seca argentina. IV Reunión de Intercambio Tecnológico en Zonas Áridas y Semiáridas. Salta, SECyT, Argentina,tomo I:31-43. [ Links ]
44. Neves F.S, L.S. Araujo, M.M. Espırito-Santo, M. Fagundes, G.W. Fernandes, G.A. Sanchez-Azofeifa & M. Quesada. 2010. Canopy Herbivory and Insect Herbivore Diversity in a Dry Forest–Savanna Transition in Brazil. Biotropica 42(1): 112–118. [ Links ]
45. Neves, F.S., C F. Sperber, R. I. Campos, J. P. Soares & S. P. Ribeiro. 2013. Contrasting effects of sampling scale on insect herbivores distribution in response to canopy structure. Revista de Biologia Tropical 61 (1): 125-137. [ Links ]
46. Nielsen, B.O. 1975. The species composition and community structure of the beech canopy fauna in Denmark. Videnskabelige Meddelelser Dansk Naturhistorisk Forening 138:137-170 [ Links ]
47. Novotny, V., Y. Basset & R. Kitching. 2003. Herbivore assemblages and their food resources. En: Y. Basset, V. Novotny, S. Miller & R. Kitching (eds.). Arthropods of tropical forests: spatio-temporal dynamics and resource use in the canopy.40-53. Cambridge University, Cambridge, Reino Unido. [ Links ]
48. Palacios-Vargas, J.G., G. Castaño-Meneses & J.A. Gómez-Anaya. 1998. Collembola from the canopy of a Mexican tropical decidous forest. Pan-Pacific Entomologist 74: 47-54. [ Links ]
49. Ribas, C. R., J. H. Schoereder, M. Pic & S. M. Soares. 2003. Tree heterogeneity, resource availability, and larger scale processes regulating arboreal ant species richness. Austral Ecology 28: 305-314. [ Links ]
50. Ross, H.A. 1971. The beetles of the United States. A ;amual for Identfication. The American Entomological Institute. Michigan, USA. 1049 p. [ Links ]
51. Saiz F,L., C. Nuñez, M. Daza, M.E. Varas & C. Vivar. 2000. Biodiversidad del complejo de artrópodos asociados al follaje de la vegetación del norte de Chile, II región. Revista Chilena de Historia Natural 73:671-692. [ Links ]
52. Santos, G.B., M.I. Marques, J. Adis & C.R. Musis. 2003. Artrópodos associados à copa de Atta leaphalerata Mart. (Arecaceae), na região do Pantanal de Poconé-MT. Revista Brasileira de Entomologia 47: 211–224. [ Links ]
53. Sobek, S., I. Steffan-Dewenter,C.h. Scherber & T. Tscharntke. 2009. Spatiotemporal changes of beetle communities across a tree diversity gradient. Diversity and Distributions 15: 660-670. [ Links ]
54. Stork, N.E. 1987. Arthropod faunal similarity of Bornean rain forest trees. Ecological Entomology12: 219-226. [ Links ]
55. Stork, N. 1988. Insect diversity: Fact, fiction, or speculation. Biological Journal of the Linnean Society 35: 321-327. [ Links ]
56. Stuntz, S., C. Ziegler, U. Simon& G. Zotz. 2002. Diversity and structure of the arthropod fauna within three canopy epiphyte species in central Panama. Journal of Tropical Ecology 18: 161–176. [ Links ]
57. Wagner T. 2003. Seasonality of canopy beteles in Uganda. En: Y. Basset, V. Novotny, S.E. Miller & R.L. Kitching (eds). Arthropods of Tropical Forests.146-158. Cambridge University. Londres. 474 p. [ Links ]
58. Yanoviak, S.P., H. Smith & N.M. Nadkarni. 2004. Arthropod diversity in vegetative vs. humic portions of epiphyte mats in a Neotropical cloud forest. Pedobiologia 48: 51-58. [ Links ]
59. Yanoviak, S.P., B.L. Fisher & A. Alonso. 2007. Arboreal ant diversity (Hymenoptera: Formicidae) in a central african forest. African Journal of Ecology 46: 60-66. [ Links ]














