INTRODUCCIÓN
Las arañas son consideradas de importancia para estudios de biodiversidad, conservación y sucesión, ya que la composición de especies y su abundancia son afectadas por los cambios producidos en la estructura del hábitat (Sjodin et al. 2008, Pinzón et al. 2013) y su microclima (Marc et al. 1999, Bell et al. 2001). Presentan facilidad para dispersarse y establecerse en nuevos hábitats (Halaj et al. 1998) por lo que son consideradas como buenos colonizadores en territorios insulares, lo que ha llevado a numerosos autores a estudiar la biogeografía y evolución de estos artrópodos en este tipo de ecosistemas (Huber & González 2001, Gillespie 2002, Cardoso et al. 2010).
La familia Theridiidae es una de las más diversas del orden Araneae y presenta una gran variabilidad morfológica, de estrategias depredadoras y comportamentales (Shear 1986, Arnedo et al. 2004). Es la cuarta familia de arañas en términos de números de especies con 2461, agrupadas en 122 géneros, de las que 74 especies pertenecientes a 22 géneros han sido citadas hasta el momento para Argentina (World Spider Catalog 2016). Algunos autores agrupan a los terídios dentro del gremio "arañas tejedoras de telas irregulares" (Cardoso et al. 2011), no obstante, algunas especies presentan hábitos cazadores solitarios y no utilizan tela para la captura de sus presas. Otros, como los Hadrotarsinae, se especializan en consumir termitas u hormigas.
La sociabilidad es rara entre las arañas, pero la mayoría de especies sociales pertenecen a la familia Theridiidae (Avilés et al. 2007). Especies del género Anelosimus son organismos modelo en el estudio del comportamiento social y su evolución, por ejemplo, Anelosimun eximius (Keyserlin, 1884) presenta agregaciones de miles de individuos que cooperan en la construcción de telas de varios metros (Agnarsson 2004). Los terídios incluyen también arañas cleptoparásitas, es decir, aquellas que ocupan lugares en telas de otras arañas para robar sus presas, como algunas especies del género Argyrodes. Existe también en esta familia canibalismo sexual en los géneros Latrodectus, Tidarren y Echinotheridion (Shear 1986).
La Isla Martín García es una Reserva Natural e Histórica, que se ubica en el sector noreste del Río de La Plata y posee gran diversidad biológica. Las selvas marginales ocupan sectores costeros de la isla, con características y composición botánica de los montes del delta. Los bosques xeromórficos ocupan sectores con menor humedad de la isla con componentes típicos de los talares del norte de la provincia de Buenos Aires. Las dunas tienen su flora particular, y escasa vegetación, con plantas bajas y achaparradas. La mayor parte de la superficie de la isla tiene formaciones boscosas que se han desarrollado sobre antiguos asentamientos humanos. De esta manera, se pueden encontrar entremezclados viejos ejemplares cultivados, plantas de especies ornamentales exóticas asilvestradas y elementos de los montes nativos (Lahitte & Hurrel 1994).
A pesar de que las arañas son comunes y de gran importancia en el equilibrio ecológico de poblaciones de invertebrados en los bosques tropicales, el conocimiento que se tiene de ellas en la región Neotropical es aún incipiente (Flórez 1999, Flórez 2000, Romo & Flores 2008). Los estudios de biodiversidad en Áreas Naturales Protegidas son imprescindibles para poder llevar a cabo políticas adecuadas de manejo y conservación. En Argentina es escaso el conocimiento que se tiene de la biodiversidad, especialmente de aquellos lugares donde existe una pérdida sistematizada de una gran cantidad de hábitats naturales. En el país se han realizado pocos trabajos referidos a la araneofauna en áreas naturales (Ávalos et al. 2007, 2009, Rubio et al. 2008, Ferretti et al. 2010, 2012, Grismado et al. 2011, Marfil et al. 2016). El presente trabajo, por lo tanto, es el primer estudio de la familia Theridiidae en diferentes ambientes de la Reserva Natural e Histórica "Isla Martín García", donde además se analizó su riqueza específica, su abundancia relativa, y se estimó su diversidad alfa y beta.
MATERIALES Y MÉTODOS
Área de estudio: La argentina Isla Martín García se encuentra ubicada a 34°11' Sur y 58°15' Oeste. Tiene forma rectangular, alargada en sentido norte-sur con 168 hectáreas de superficie (Fig. 1). El clima es templado-húmedo con temperatura media anual de 17°C, en enero la temperatura promedio es de 29°C y en julio de 8°C, y humedad promedio de 81% (Lahitte & Hurrel 1994).
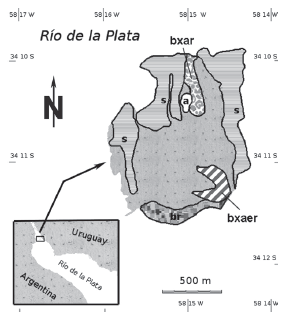
Figura 1 Localización geográfica de la Isla Martín García, Buenos Aires, Argentina. Se ubican los ambientes muestreados: selva (s), bosque ribereño (br), bosque xerófilo del aeropuerto (bxaer), bosque xerófilo del arenal (bxar), arenal (a). Tomado de: Google Earth.
Metodología de Muestreo: Durante tres años consecutivos se realizaron doce campañas, que comenzaron en marzo de 2007, cubriendo las cuatro estaciones y todos los meses del año, en los cinco ambientes característicos de la isla: selva, bosque ribereño, bosque xerófilo del aeropuerto, denominado de este modo por ubicarse sobre la margen oeste de la pista de aterrizaje, bosque xerófilo del arenal y arenal (Fig. 2). Los muestreos se llevaron a cabo mediante red de golpeo y muestreo manual siguiendo transectos o circuitos previamente establecidos a través de senderos preexistentes. Los ejemplares se preservaron en recipientes con etanol 70%, rotulados por fecha, zona y método de muestreo. Las arañas se identificaron hasta el nivel de especie/morfoespecie utilizando claves genéricas (Levi 1959, 1962, Levi & Levi 1962), mediante un análisis detallado de los genitales masculinos y femeninos; con técnicas de expansión de los palpos en machos (Levi 1965) y clarificación de los epiginos en las hembras. Se estableció el sexo y el estado de desarrollo de cada espécimen.

Figura 2 Ambientes muestreados en la Isla Martín García, Buenos Aires, Argentina. a. Bosque xerófilo arenal, b. Arenal, c. Selva, d. Bosque ribereño, e. Bosque xerófilo del aeropuerto.
Los ejemplares fueron depositados en el Laboratorio de Aracnología del Centro de Estudios Parasitológicos y de Vectores Universidad de la Plata (CEPAVE) (CONICET - UNLP), Argentina.
Para la estimación de la diversidad alfa y beta se utilizó el programa PAST (versión 3.14) (Hammer et al. 2013) y el programa EstimateS (versión 9.1.0) (Colwell 2009). Se calculó la riqueza de especies (S) y su abundancia relativa. La diversidad alfa se estimó mediante los índices de Shannon-Wienner (H') y de Equidad de Pielou (J), los estimadores ACE, ICE, Chao 1, Chao 2, y Jacknife de primer y segundo orden (Colwell y Coddington 1994, Moreno 2001). Para la medición de la diversidad beta se utilizó el coeficiente de similitud de Chao-Jaccard y además se calcularon las curvas de acumulación de especies (Moreno 2001).
RESULTADOS
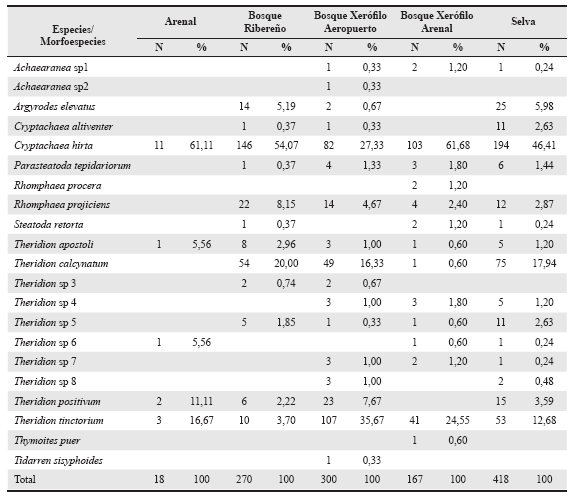
Se registraron un total de 1173 arañas, de las cuales 831 (70,84%) fueron juveniles, 240 (20,46%) hembras adultas y 102 (8,70%) machos adultos. Se diferenciaron nueve géneros y 21 morfoespecies, de las cuales trece se identificaron a nivel de especie (Tabla 1). La mayor riqueza específica la obtuvo el género Theridion, con diez entidades. Solo dos géneros Cryptachaea y Theridion se encontraron en las cinco áreas, representados por las especies Cryptachaea hirta (Taczanowski, 1873), Theridion tinctorium Keyserling, 1891 y Theridion apostoli Mello-Leitão, 1945. La especie más abundante en todos los ambientes fue C. hirta (61,68%), excepto en el bosque xerófilo del aeropuerto donde fue superada en abundancia por T. tinctorium (35,67%). Estas dos últimas especies en conjunto superaron el 57% de la abundancia relativa en todas las áreas muestreadas. Se encontraron tres especies no citadas para Argentina Cryptachaea altiventer (Keyserling, 1884), Theridion positivum (Chamberlin, 1924) y T. tinctorium.
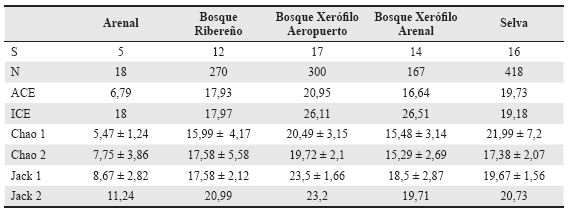
Tabla 1 Especies/morfoespecies y abundancia relativa de Theridiidae de la Isla Martín García, Buenos Aires, Argentina.
La curva de acumulación de especies mostró un 96,58% de representatividad estimada para todos los ambientes de la isla. La misma presenta planos asintóticos (Fig. 3), indicando que la cantidad de especies observadas corresponde casi por completo al número de especies esperadas y por lo tanto evidencian que el relevamiento fue eficiente. Se registraron además pocas especies representadas por un único individuo en todo el inventario (singletons) (Moreno 2001), que aparecieron en mayor número en las campañas II-V, y que correspondieron a los meses de abril, junio, agosto y octubre, es decir otoño, invierno y primavera del primer año de muestreo. Por su parte, las especies que cuentan con dos individuos en todo el inventario (doubletons) (Moreno 2001) se encontraron en mayor número en la campaña VI y VII, correspondiente a los meses de diciembre y febrero, verano, del primer y segundo año de muestreo, respectivamente. Respecto a la diversidad alfa, la selva fue el ambiente con el valor mayor (H' = 1,9, J = 0,67) (S =16), seguido por el bosque xerófilo del aeropuerto (H' = 1,86, J = 0,64) (S = 17), bosque ribereño (H' = 1,64, J = 0,63) (S = 12), el bosque xerófilo del arenal (H'= 1,47, J = 0,54) (S = 14), y finalmente el arenal (H' = 1,16, J = 0,72) (S = 5).
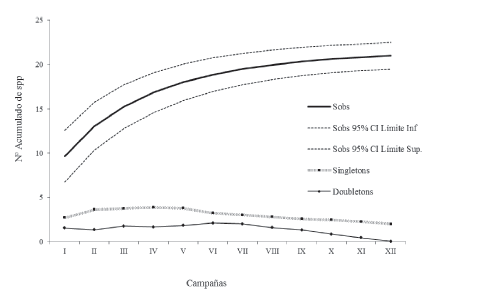
Figura 3 Curva de acumulación de especies de Theridiidae en la Isla Martín García, Buenos Aires, Argentina.
El Bosque Xerófilo del Arenal, la Selva, y el Arenal fueron los ambientes que presentaron los valores de diversidad alfa esperados más próximos a la riqueza específica registrada en cada ambiente. Para el primero oscilaron entre quince (Chao 2) y 26 (ICE) especies, para una riqueza observada total (Sobs) de catorce especies. En la Selva los estimadores Chao 2 y Chao 1 calcularon 17 y 21 especies respectivamente, donde se capturaron un total (Sobs) de 16 especies. Para el arenal la estimación de especies varió entre cinco (Chao 1) y 18 (ICE) siendo la riqueza encontrada (Sobs) de cinco especies (Tabla 2). Los valores esperados que menos se ajustaron a los observados fueron los del Bosque Ribereño los cuales se ubicaron entre quince (Chao 1) y 20 (Jacknife 2° orden) especies, para una riqueza registrada (Sobs) de doce especies.
Tabla 2 Número de individuos, número de especies e índices de diversidad beta de Theridiidae de la Isla Martín García, Buenos Aires, Argentina.
El análisis con los estimadores Chao-Jaccard (Fig. 4) mostró que la mayor similitud se presentó entre la Selva y el Bosque Xerófilo del Aeropuerto (74%) y la menor correspondió al Arenal (25%) frente a los demás sitios de muestreo. El resto de los ambientes mostraron valores de semejanza intermedios.
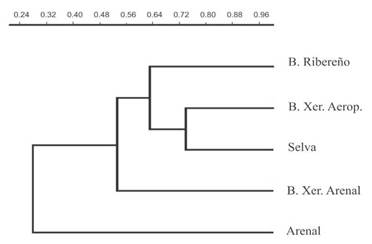
Figura 4 Dendrograma de similitud Chao-Jaccard de los ambientes estudiados en la Isla Martín García, Buenos Aires, Argentina.
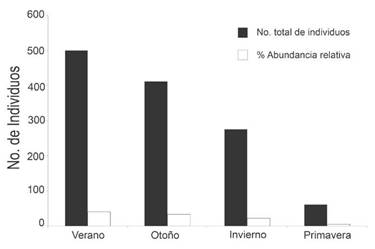
El análisis de la variación temporal mostró que el verano fue la estación más favorable, se recolectaron 500 ejemplares (40,06%) (Fig. 5), y la más diversa ya que se registraron 15 de las 21 morfoespecies encontradas. La primavera fue la época con menor abundancia relativa y diversidad, con 61 ejemplares recolectados (4,89%), que pertenecieron a nueve de las 21 morfoespecies observadas. Los resultados reflejaron un ciclo anual con aumentos del número de ejemplares adultos en los meses más cálidos, mientras que la mayor cantidad de juveniles se registró en los meses subsiguientes al aumento de adultos.
DISCUSIÓN
Desde el punto de vista taxonómico, las especies de arañas de la familia Theridiidae encontradas en la Reserva Natural e Histórica Isla Martín García representan el 17,45% del total de especies identificadas para Argentina (World Spider Catalog 2016). Estudios realizados en la región Neotropical (Nentwig 1993, Silva 1996, Silva & Coddington 1996, Flórez 1998, 1999, 2000, Álvares et al. 2004, Bonaldo et al. 2007, Cabra García 2009) y en Argentina (Corronca & Abdala 1994, Ávalos et al. 2006, 2009, Grismado et al. 2011) revelan que Theridiidae es una de las familias que siempre exhibe valores altos de diversidad y abundancia, teniendo gran representatividad en diferentes ambientes. Según Grismado et al. (2011) Theridiidae fue la segunda familia en cuanto al número de especies obtenidas (21), mientras que estuvo representada por 33 especies en la Reserva Costanera Sur (Zapata & Grismado 2015).
En tres de los cinco ambientes estudiados en la isla se presentaron valores de diversidad que siguieron la misma tendencia y fueron cercanos a los esperados. Villarreal et al. (2004) establecen que, cuando los valores del conjunto de estimadores se comportan de forma similar y cercana a los esperados, indican la obtención de un muestreo eficiente. Para todos los ambientes, los estimadores Chao 1 y Chao 2 fueron los que se ajustaron mejor a los valores de especies esperadas. Los mayores valores de abundancia obtenidos en la Selva son además coincidentes con los datos registrados en otros estudios realizados en la Isla Martín García sobre las familias Araneidae y Salticidae (Zvedeniuck 2009, Marfil et al. 2016).
La Selva es el hábitat que brinda una vasta vegetación en la isla, con amplios recursos. Fitogeográficamente, presenta tres estratos: arbóreo, en general de hasta 20 m de alto, y arbustivo y herbáceo, que proporcionan buenos sustratos para que las arañas de esta familia puedan armar sus telas, obtengan alimento y refugio para escapar de sus depredadores. Bajo este contexto, la estructura del ambiente influye en la selección de éste por las arañas, ya que existe una relación directa entre la complejidad estructural del hábitat y la diversidad de especies (Uetz 1979, Isaia et al. 2006, Ávalos et al. 2009).
Aunque el tipo de hábitat parece influir en la composición de familias, es decir, las que pertenecen al mismo gremio se ubican en ambientes similares, a nivel de especies el tipo de ambiente no parece influir en la composición de la comunidad (Whitmore et al. 2002). En efecto, en la Isla Martín García sólo seis morfoespecies se restringieron a un hábitat exclusivo. Ciertamente no solo la complejidad estructural del hábitat influye en la composición de los gremios, sino que también las variaciones estacionales pueden determinar la composición y establecer diferencias entre los miembros de los gremios de arañas (Nentwig 1993). La variación del número de individuos por campaña de muestreo y el número de individuos recolectado por estación climática, coinciden con los estudios realizados por Silva & Coddington (1996), donde el pico máximo de diversidad de arañas se alcanza a final de la estación seca. El exceso de humedad, hace menos confortable el hábitat, destruye y hace visible las telas, aumenta el esfuerzo y disminuye la captura de presas e induce a la comunidad de arañas a variar de estrategias reproductivas, y alimenticias entre otras, ejerciendo efectos decisivos sobre la diversidad y la riqueza específicas (Forero 2004).
La estructura de las comunidades y la riqueza de especies en los territorios insulares son dependientes de su tamaño y de la distancia entre estas y las poblaciones fuentes provenientes del continente (Whittaker 2000). En general, las islas son más fáciles de invadir que las zonas continentales, ya que las comunidades presentes en ellas tienen un menor número de especies, lo que facilita el proceso de invasión (Yimming et al. 2006).
En este trabajo se evidencia que la mayoría de las especies identificadas tienen amplia distribución en el continente americano, como: C. hirta, Tidarren sisyphoides (Walckenaer, 1841), Parasteatoda tepidariorum (Koch, 1841), Argyrodes elevatus Taczanowski, 1873, Rhomphaea projiciens Cambridge, 1896, Rhomphaea procera (Cambridge, 1898), Theridion calcynatum Holmberg, 1876 y T. positivum. De las cuales C. hirta, T. calcynatum y T. tinctorium fueron las más abundantes coincidentemente con datos registrados en los boques de las Reservas Naturales de Costanera Sur y Otamendi de la provincia de Buenos Aires (Grismado et al. 2011, Zapata & Grismado 2015). De esto se desprende entonces, que la isla no corresponde a un área de importancia respecto a la singularidad de especies. Solo las especies que no están citadas para Argentina: C. altiventer T. tinctorium y T. positivum podrían considerarse como posibles introducciones, ya que su distribución corresponde al sureste de Brasil y Paraguay para la primera, únicamente a Brasil la segunda y para la tercera se indica un registro más amplio en Estados Unidos y desde las Antillas a Paraguay (World Spider Catalog 2016).
Si bien la isla tiene un origen geológico que corresponde al afloramiento del macizo de Brasilia, se encuentra abastecida de manera constante por el frente de avance del Río de La Plata, proveniente de la confluencia de los ríos Paraná y Uruguay, considerados como dos corredores biológicos de importancia (Guerrero 2014). Debido al hallazgo de las especies C. altiventer y T. tinctorium, registradas hasta este momento exclusivamente en Brasil, se sugiere que podrían haber llegado a través del frente de avance del delta. Teniendo en cuenta la cantidad de individuos totales encontrados en la isla para cada una de estas especies, surge que las poblaciones han logrado establecerse, probablemente favorecidas por las condiciones ambientales. Por el contrario, Steatoda retorta González, 1987 y T. apostoli son especies con un ámbito de distribución sólo para Argentina, específicamente la provincia de Buenos Aires y Corrientes, por lo que se sugiere que habrían llegado a la isla por factores externos, como el movimiento antrópico en general, o el turismo entre otros.
En el marco de la biogeografía de islas, las comunidades naturales se forman a partir de procesos de inmigración y extinción de especies (MacArthur & Wilson 1963, 1967). Las comunidades de islas, debido a que presentan menor número de especies que el continente, son más fáciles de invadir y presentan una mayor proporción de especies exóticas que las comunidades continentales (MacArthur 1970, Yimming et al. 2006). A su vez, si se considera el tamaño de las áreas insulares, cuanto más grande es la isla mayor es el número de especies exóticas que pueden contener, tal como lo demuestran otros estudios realizados en las islas de América como Galápagos y en Hawaii (Baert 2013). Las islas tropicales tienen menos especies exóticas que las islas de otros climas (Yimming et al. 2006); es posible que lugares con climas similares tengan especies exóticas similares (Jiménez et al. 2008), lo que se incrementa debido al rol humano en la introducción de las especies. Además, las arañas constituyen especies capaces de colonizar estos ambientes particulares, ya sea por el viento (aerodispersión o ballooning) (Bell et al. 2005) o través de las corrientes de los ríos, mediante el transporte pasivo de "camalotales" (Guerrero 2014). En este contexto el presente trabajo contribuyó a dilucidar las comunidades de arañas y riqueza de especies en los ecosistemas insulares estudiados. No obstante, sería importante continuar el análisis de la araneofauna presente en otras islas de la región, considerando el rol de las especies nativas y el impacto de la urbanización como facilitadores de los procesos de inmigración.
PARTICIPACIÓN DE AUTORES
DMLL análisis de datos, AA análisis de datos y escritura del documento, CS muestreos a campo, toma de datos y análisis taxonómico, SG y JB muestreos a campo y toma de datos, LG análisis de datos y manejo de programas estadísticos, GR toma y análisis de datos, CG análisis de datos y taxonómicos, AG concepción y diseño.