INTRODUCCIÓN
La Reserva de la Biosfera Selva El Ocote (REBISO), es considerada como una de las áreas de mayor superficie de selva tropical húmeda en Mesoamérica. Protege uno de los centros de diversidad biológica más importante en México y el mundo, al encontrarse ubicada en una zona de transición de dos provincias neotropicales, la Pacifiquense y la Tehuatepequense. Este macizo forestal se encuentra donde confluyen la selva de los Uxpanapa en Veracruz y de los Chimalapas en Oaxaca. Su amplia gama de condiciones topográficas y microclimas, son la base para la existencia de varios tipos de vegetación entre los que se han reportado un total de 565 especies de árboles leñosos (CONANP 2001, Ramírez-Marcial et al. 2017). Pese a su importancia, la reserva también enfrenta graves problemas de deterioro, desde el siglo pasado la región ha presentado una compleja problemática por colonización, deforestación, ganadería, cacería, e incendios forestales naturales y provocados que desencadenan importantes procesos de erosión, de extinción de especies y de pérdida de ecosistemas (Vásquez y March 1996, CONANP 2001). La tasa de deforestación estimada en la Reserva para el periodo 1986-2000 fue de 1,05 % anual, principalmente por actividades agrícolas y ganaderas. Sin embargo, la tasa de deforestación anual para el periodo 1995-2000 fue del 2,54 % (Flamenco-Sandoval et al. 2007).
La pérdida y degradación de los ambientes naturales son la mayor amenaza para las especies silvestres, en particular para grupos que desempeñan diversas funciones ecológicas. Los escarabajos de la subfamilia Scarabaeinae (Coleoptera: Scarabaeidae) conforman un gremio bien definido en el que se aprecian características morfológicas, funcionales y de comportamiento particulares, factores que los identifican como un grupo sensible a las perturbaciones ambientales (Nichols y Gardner 2011). Viven estrechamente asociados al excremento de mamíferos y otros vertebrados ya que éste constituye su principal fuente alimenticia. Mediante la manipulación de las heces durante el proceso de alimentación, los escarabajos del estiércol intervienen en una serie de funciones que van desde la dispersión secundaria de semillas hasta el ciclo de nutrientes y la supresión de parásitos. Muchas de estas funciones ecológicas proporcionan valiosos servicios ecosistémicos, como el control biológico de plagas y la fertilización del suelo (Nichols et al. 2008, Nichols y Gómez 2013). Aunque la mayoría de estos escarabajos se alimentan de estiércol, algunas especies se alimentan de recursos alternativos como carroña, hongos, milpiés o frutas, y utilizan diferentes señales volátiles para encontrar cada recurso (Tribe y Burger 2011).
El grupo está constituido por más de 6200 especies descritas, reunidos en 11 tribus y 267 géneros, con un estimado del 30-50 % de especies aun sin describir (Tarasov y Génier 2015). Gran parte de esta fauna se encuentra distribuida en la región Neotropical con cerca de 1300 especies y alrededor de 70 géneros (Gill 2002). Chiapas es una de las regiones con mayor número de registros de Scarabaeinae en México (Morón 2003), no obstante, la mayoría de estos reportes provienen de estudios realizados en la región de La Selva Lacandona (Morón et al. 1985, Palacios-Ríos et al. 1990, Halffter et al. 1992, Navarrete y Halffter 2008, Sánchez-de-Jesús et al. 2016), mientras que los pocos registros procedentes de la REBISO se han derivado de muestreos esporádicos (Cano 1998, Blas y Gómez 2009).
El objetivo principal de este trabajo fue analizar la diversidad alfa y beta de los escarabajos copronecrófagos de la subfamilia Scarabaeinae (Coleoptera: Scarabaeidae) en dos hábitats con diferente grado y tipo de perturbación, y un área de selva mediana subperennifolia conservada, ubicados en el ejido Emilio Rabasa, en la zona de amortiguamiento de la REBISO, el cual a su vez es una de las primeras aproximaciones al conocimiento de este grupo de insectos en la Reserva de la Biosfera Selva El Ocote.
MATERIALES Y MÉTODOS
Área de estudio
El área de muestreo se ubica en los alrededores del ejido Emilio Rabasa, localizada al sur de la Zona Núcleo I de la poligonal de la REBISO, entre los 650 y 785 m de altitud en el municipio de Ocozocoautla de Espinoza (Fig. 1, CONANP 2001). En la zona se pueden observar varios tipos de vegetación como las selvas bajas y mediana subperennifolia, pastizales, vegetación secundaria y áreas deforestadas provocadas por incendios forestales. Entre las principales actividades económicas se encuentran la ganadería, los cultivos de maíz y de café (Vázquez-Pérez et al. 2009). Los sitios de muestreo elegidos para el estudio representan los principales tipos de hábitat de la zona, caracterizados por diferentes usos de suelo y tipo de vegetación (Tabla 1): 1) Selva mediana subperennifolia (SM), la altura del estrato superior fluctúa entre los 20 y 35 m y son representativas algunas especies de los géneros Manilkara, Swietenia, Brosimum, Cedrela, Bursera, Ceiba y Ficus, entre otros; 2) Policultivo tradicional de café (CC), en su mayoría este tipo de plantaciones se encuentran en áreas donde predominan las selvas medianas subperennifolia para lo cual se han eliminado el dosel inferior y algunos individuos del estrato superior para regular la sombra del cultivo, no obstante, también se encuentran cercanos a otras zonas donde se realizan diversas actividades humanas; 3) Vegetación secundaria (VS), son estados sucesionales de selva mediana subperennifolia que se caracterizan por la presencia de algunas especies de los géneros Belottia, Cecropia, Gliricidia, Bursera, Byrsonima, Guazuma y Adelia. Gran parte de estas zonas fueron provocadas por incendios forestales (CONANP 2001, Maldonado et al. 2009).
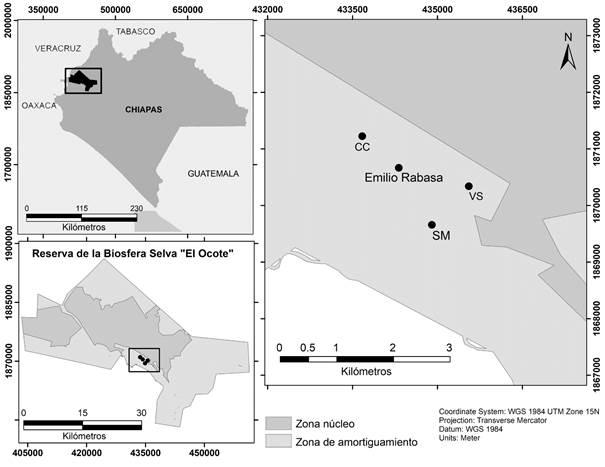
Figura 1 Localización en Chiapas de la REBISO y los tres hábitats de muestreo, ubicadas al sur de la zona núcleo I de la reserva. SM= Selva mediana, CC= Cultivo de café, VS= Vegetación secundaria
Tabla 1 Características generales de los tres hábitats de muestreo.
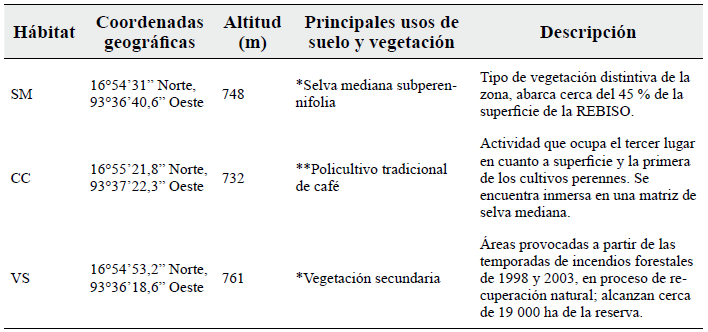
SM= Selva mediana, CC= Cultivo de café, VS= Vegetación secundaria. *según CONANP (2001). **según Moguel y Toledo (1999).
Recolección y trabajo taxonómico
Se realizaron cinco muestreos, cada uno con duración de tres días en los meses de abril, agosto, octubre y diciembre de 2011 y febrero de 2012. Las recolecciones se efectuaron mediante trampas de caída tipo CSS (Cebo-Suspendido-Superficie) modificadas (Lobo et al. 1988), utilizando de manera alternada ~30 gr de calamar en descomposición (carroña), estiércol de cerdo (omnívoro) o estiércol vacuno (herbívoro) como atrayentes, ya que el uso de estos tipos de cebo es adecuado para el muestreo de escarabajos copronecrófagos (Bustos-Gómez y Lopera 2003). Las trampas consistieron en recipientes de 1 l de capacidad enterradas a nivel de suelo. Los recipientes se llenaron con ~250 ml de etilenglicol como liquido conservador y se cubrieron con platos de plástico para proteger los cebos de la precipitación y desecación. En cada hábitat se instalaron 12 trampas por tipo de cebo de forma alternada y separadas por 10 m entre ellas, totalizando 108 trampas por muestreo. El material fue recuperado cada 24 horas y se almacenó en bolsas plásticas con etanol al 70 % para su traslado y posterior identificación.
La determinación genérica se realizó de acuerdo con los criterios de Delgado et al. (2000) y se emplearon claves y descripciones especificas según el grupo a determinar (Kohlmann y Solís 2001, Génier y Kohlmann 2003, Delgado y Kohlmann 2007, Génier 2009, Edmonds y Zidek 2010, 2012). El ordenamiento supragenérico utilizado corresponde a la propuesta de Bouchard et al. (2011). Los escarabajos capturados se encuentran depositados en las siguientes colecciones: Colecciones Entomológicas de El Colegio de la Frontera Sur, Unidad San Cristóbal (ECO-SC-E) y unidad Tapachula (ECO-TAP-E), Colección Entomológica del Instituto de Ecología A. C. (IEXA) y Colección personal Benigno Gómez (BGG).
Análisis de datos
Se evaluó la diversidad alfa (α) mediante el uso del número de especies efectivas, basadas en los tres primeros números de la serie de Hill: la diversidad de orden 0 conocida como riqueza efectiva (Q0); la diversidad de orden 1, que es el exponencial de la entropía del índice de Shannon (Q1); y la diversidad de orden 2, que es el inverso del índice de Simpson (Q2) (Jost 2006). Para evaluar el esfuerzo de muestreo se calculó la completitud de la cobertura del muestreo (Ĉm), calculada como la proporción del número de individuos totales que corresponden a las especies representadas en la muestra el cual toma valores entre 0, o mínima completitud y 100, o máxima completitud (Chao et al. 2014). Se realizaron rutinas de interpolación/extrapolación de las abundancias de cada hábitat para comparar y estimar la riqueza de especies. Estos procedimientos se realizaron utilizando el paquete iNEXT, en el software R (R Core Team c2016). Además, se estimó la riqueza de especies con el modelo Chao 1 considerando como eventos de muestreo los 15 días acumulados durante los cinco meses de recolección, utilizando el software EstimateS (Colwell c2013).
Con el fin de comparar la equitatividad de las abundancias de las especies entre los hábitats, se realizaron curvas de rango-abundancia calculando el logaritmo base 10 de la proporción de cada especie (Feinsinger 2001). Asimismo, se realizó un análisis de preferencia de hábitat mediante el índice de selección de Savage, el cual relaciona las proporciones usadas de cada recurso con su proporción en el ambiente (Atienza 1994).
La diversidad beta (β) entre los tres hábitats se obtuvo mediante el indice de Morisita-Horn basada en la diversidad efectiva de especies para multiples ensambles, como medidas de entropía entre sitios; este indice es especialmente adecuado para medir la similitud utilizando abundancias (Jost et al. 2011). La diversidad beta indica el número hipotético de comunidades tomando valores entre uno y el máximo número de comunidades que se comparan, en nuestreo caso, el máximo valor es tres; una β =1 indica una sola comunidad, mientras que valores de β >1 indica comunidades distintas (Jost et al. 2011).
Para determinar los gremios tróficos se utilizaron los criterios de Navarrete y Halffter (2008), donde cada especie se separó conforme a la proporción de sus abundancias en los diferentes cebos utilizados, considerándose especialistas (coprófagos y necrófagos) cuando al menos el 75 % de los individuos de cada especie fue capturado en trampas con estiércol o carroña y generalistas si la proporción de individuos en cualquiera de los cebos era menor a este porcentaje.
RESULTADOS
Se recolectaron 5421 individuos de 37 especies, agrupados en seis tribus y 12 géneros (Tabla 2). Onthophagini (S = 9) fue la tribu mejor representada, seguida de Deltochilini (S = 8) y Coprini (S = 7). El género Onthophagus reunió el mayor número de especies (S = 9). Las especies más abundantes fueron Uroxys microcularis Howden & Young, 1981 (1345 individuos), seguida de Canthon vazquezae (Martínez, Halffter & Halffter, 1964) (520 individuos), Deltochilum pseudoparile Paulian, 1938 (387 individuos), Copris laeviceps Harold, 1869 (321 individuos) y Phanaeus endymion Harold, 1863 (309 individuos), representando el 53,2 % de las abundancias totales. Veinticuatro especies se capturaron en todos los hábitats y solo siete fueron exclusivas: cuatro en la selva (Canthidium sp 4, Canthidium sp 5, Deltochilum scabriusculum Bates, 1887 y Eurysternus foedus Guérin-Méneville, 1830), dos en vegetación secundaria (Canthidium pseudopuncticolle Solís & Kohlmann, 2004 y Onthophagus landolti Harold, 1880) y una en el cultivo de café (Coprophanaeus gilli Arnaud, 1997) (Fig. 2). Los tres números de la serie de Hill indican que la selva (SM) es el hábitat más diverso. El cultivo de café (CC) presenta la menor riqueza (Q0) de los tres hábitats, pero una mayor diversidad (Q1) y dominancia (Q2) que el hábitat de vegetación secundaria (VS) (Tabla 3). El análisis de preferencia Savage indica una clara inclinación de la fauna de escarabajos hacia la SM (0,39), al ser este el único que sobrepasa el valor neutral de preferencia (0,34), no obstante, la VS también muestra un resultado cercano a este límite (0,33), mientras que el CC exhibe el valor más bajo (0,28).
Tabla 2 Composición y estructura de la fauna de Scarabaeinae en los tres hábitats de muestreo de la REBISO.
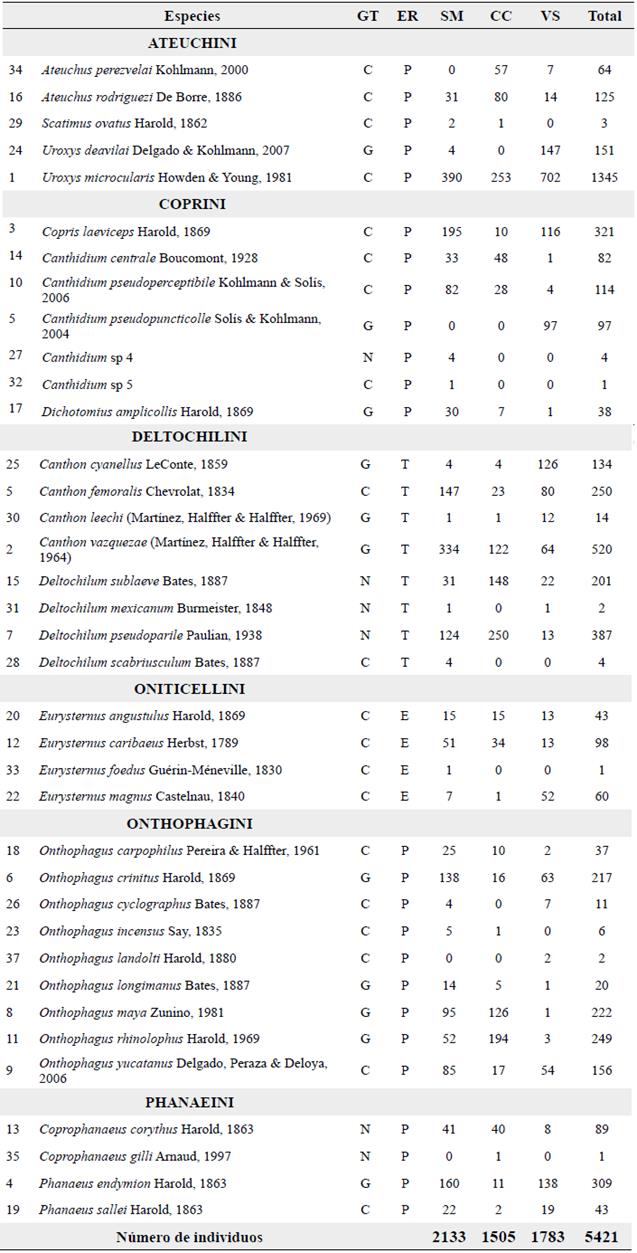
GT= Gremios tróficos, C= Coprófago, N= Necrófago, G= Generalista. ER= Estrategia de relocalización, P= Paracóprido, Telecóprido, E= Endocóprido. Los números en la primera columna son utilizados para identificar las especies en la figura 3.
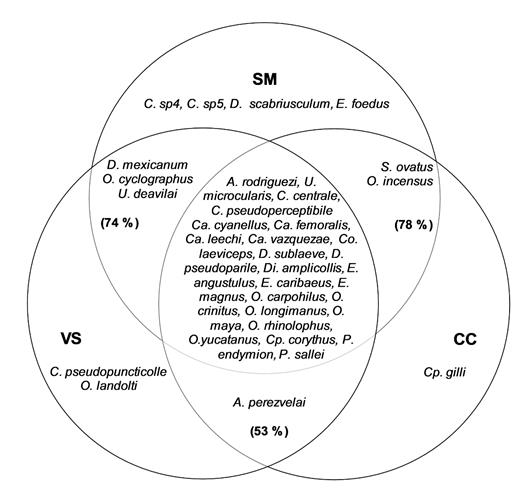
Figura 2 Diagrama de Venn que muestra la distribución de la fauna de Scarabaeinae entre los tres hábitats de la REBISO. El porcentaje entre paréntesis representa la similitud entre hábitats. SM= Selva mediana, VS= Vegetación secundaria, CC= Cultivo de café.
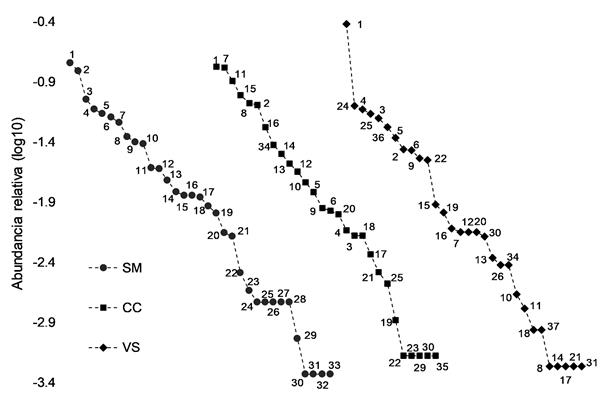
Figura 3 Curvas de rango-abundancia de la fauna de escarabajos copronecrófagos de cada hábitat de muestreo. Las especies están señaladas por los números en la tabla 2. Nótese la ubicación de U. microcularis (1). SM= Selva mediana, CC= Cultivo de café, VS= Vegetación secundaria.
La completitud de la cobertura de muestreo (Ĉm) estimada fue cercana al 100 % en los tres hábitats, por lo que se puede inferir que el muestreo fue suficientemente exhaustivo, con la SM como el sitio que se encuentra más cercano a obtener un inventario completo. Tanto el estimador de riqueza Chao1 como la extrapolación de las abundancias sugieren que el CC es el hábitat donde existen más posibilidades de capturar un mayor número de especies, estimando seis y siete especies más, respectivamente, mientras que para SM y VS estiman tres especies adicionales al inventario (Tabla 3).
Tabla 3 Estimación de la diversidad alfa mediante los tres primeros números de Hill, evaluación de la representatividad faunística y completitud del muestreo.
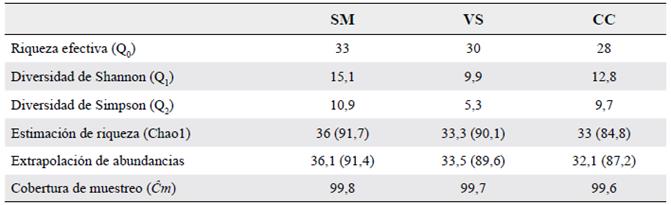
Los números entre paréntesis indican el porcentaje obtenido de acuerdo con la riqueza estimada. SM= Selva mediana, VS= Vegetación secundaria, CC= Cultivo de café.
Las curvas de rango-abundancia muestran a U. microcularis, una de las cinco especies más abundantes, como la única que persiste y se mantiene dominante en todos los hábitats (Fig. 3). Las curvas muestran un comportamiento similar en su parte media y posterior. Sin embargo, la distribución es más uniforme en SM, donde se observa un mayor número de especies dominantes y menos especies raras, presentando mayor equitatividad en la distribución de su fauna. El CC presenta un patrón similar, pero con una distribución más compacta. Por el contrario, en la VS se registró una pendiente más acentuada debido a la dominancia evidente de U. microcularis (n = 39,37 %) y una distribución más segregada del resto de las especies.
El porcentaje más alto de similitud entre las tres combinaciones posibles ocurrió entre SM-CC (78 %), seguido de SM-VS (74 %) y CC-VS (53 %), con un alto número de especies compartidas (Fig. 2). Esta alta similitud confirma el hecho de que la fauna de escarabajos de los tres hábitats probablemente sean parte de una sola comunidad ya que la diversidad beta mediante el índice de Morisita-Horn revela un valor cercano a 1 (β = 1,31).
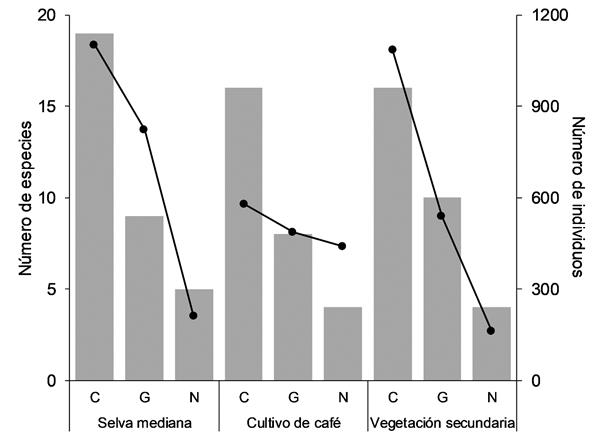
En cada uno de los tres cebos utilizados se capturaron 31 especies, pero la mayor proporción de individuos fue capturada en estiércol de cerdo (40,3 %), seguida por aquellos que prefirieron el calamar (35,7 %), siendo el estiércol vacuno el cebo con menor número de ejemplares atraídos (24 %). Sin embargo, la composición de especies y sus abundancias atraídas a los tres cebos fue diferente en cada hábitat (Fig. 4). Por su parte, la comunidad de copronecrófagos está integrada en su mayor parte por especies con hábitos alimentarios coprófagos (S = 20), seguido de las especies generalistas (S = 11) y las especies necrófagas (S = 6). En cuanto a la estructura en cada hábitat, las especies coprófagas fueron dominantes en los tres, sin embargo, están mejor representados en la SM, mientras que las generalistas se encontraron principalmente en la VS y los necrófagos en el CC (Fig. 5).
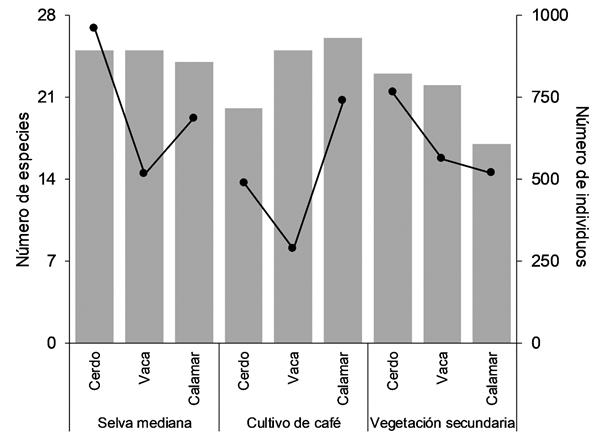
Figura 4 Número de especies (barras) y sus abundancias (líneas) capturadas en los tres atrayentes por hábitat de muestreo.
DISCUSIÓN
Diversidad alfa (α) y representatividad del inventario
Las 37 especies recolectadas representan el 31,1 % de la fauna de escarabajos copronecrófagos que se ha reportado para Chiapas (119 especies sensuDelgado y Kohlmann 2007, Génier 2009, Halffter y Halffter 2009, Edmonds y Zidek 2010, Gómez 2013, González-Alvarado y Vaz-de-Mello 2014, Lizardo et al. 2017, Sánchez-Hernández et al. 2017). Cabe destacar que constituye un porcentaje alto tomando como referencia otros trabajos realizados en la misma región, en los cuales se obtuvo una menor diversidad de especies utilizando el mismo número de trampas (Arellano et al. 2008, 2013). Esta diferencia radica en la variedad de atrayentes utilizados en este trabajo para la recolección de escarabajos copronecrófagos, ya que, incluso entre las especies coprófagas de la subfamilia, algunas utilizan solo un tipo de excremento y se les denomina especies estenófagas, mientras otras menos especializadas usan de manera indistinta cualquier tipo de excremento e inclusive, en menor medida, carroña (Halffter y Matthews 1966). Los muestreos no completaron un ciclo anual como el realizado por Navarrete y Halffter (2008), ni utilizó una gama de métodos de muestreo disponible para este grupo de insectos (Morón et al. 1985, Palacios-Ríos et al. 1990) lo cual probablemente hubiese permitido incrementar las cifras del inventario y obtener un número de especies más cercano a las sugeridas por los estimadores.
Sin embargo, los valores de eficiencia del muestreo son altos al tratarse de un grupo diverso para el cual es difícil obtener el inventario completo de especies y por lo general se considera que un inventario está razonablemente completo cuando el porcentaje de las especies observadas es mayor al 80 % de la riqueza estimada (Pineda y Verdú 2013).
Algunas especies que de acuerdo con su área de distribución pudiesen complementar el inventario son: Canthon indigaceus LeConte, 1859, C. championi Bates, 1887, Copris lugubris Boheman, 1858, Dichotomius satanas (Harold, 1867), Phanaeus pyrois Bates, 1887, Deltochilum acropyge (Bates, 1887), todas reportadas dentro de la poligonal de la REBISO, en la zona de Laguna Bélgica, al oeste del sitio de muestreo (Blas y Gómez 2009). Posiblemente la ausencia de estas especies en los muestreos responda a factores como: 1) requerimientos de hábitat: la presencia de ciertas especies como Co. lugubris y Ca. indigaceus se favorece en condiciones de alta temperatura, insolación directa y baja humedad como potreros y pastizales (Arellano et al. 2008), mientras que nuestros sitios de muestreo no presentan estas condiciones; 2) Especialización trófica: si bien D. acropyge presenta una amplia distribución en bosques tropicales húmedos, esta especie ha sido reportada como un depredador especializado en milpiés (Cano 1998); 3) segregación temporal: debido al carácter efímero del recurso y la competencia interespecífica, la variación temporal en la actividad de estos escarabajos es considerada un mecanismo de segregación ecológica (Hanski y Cambefort 1991), por lo que es recomendable realizar muestreos de por lo menos un ciclo anual.
En diversos estudios se ha encontrado una relación positiva entre un hábitat conservado o poco perturbado y su diversidad de escarabajos, indicando que los cambios en la estructura de la vegetación primaria dan lugar a una reducción de la diversidad de escarabajos (Navarrete y Halffter 2008, Díaz et al. 2010). Este patrón es concordante con los resultados del presente trabajo, ya que el hábitat de selva mediana muestra los valores más altos de abundancia, riqueza (Q0), diversidad (Q1) y dominancia (Q2) de especies respecto a lo obtenido en los otros hábitats estudiados.
Equitatividad de las comunidades
La fauna presente en la SM exhibe una estructura y composición mejor distribuida que los otros hábitats, la cual se ajusta a una de tipo logarítmica normal que caracteriza a las comunidades estables en equilibrio (Moreno 2001), sugiriendo una comunidad de escarabajos más equitativa (Melic 1993). En general se sugiere que esto es posible gracias a las condiciones microclimáticas que la heterogeneidad del paisaje permite, además de la presencia de estanques estacionales que son utilizados como abrevaderos por algunas especies de mamíferos medianos que proporcionan el recurso trófico para los escarabajos, manteniendo nichos que aseguran la supervivencia de los escarabajos. Esto ratifica la importancia de la vegetación primaria en el mantenimiento de la diversidad de especies y los servicios ecosistémicos que estos proveen (Navarrete y Halffter 2008). Pese a ser el hábitat con menor riqueza, la equitatividad del CC probablemente se deba a que este tipo de agrosistemas se desempeñan como corredores entre manchones de selva, sitios de alimentación o como refugio alternativo donde estos insectos encuentra disponibilidad de recurso, lo cual resalta su importancia como complemento de la vegetación primaria (Estrada y Coates-Estrada 2002, Arellano et al. 2005, Pineda et al. 2005). Aun cuando el patrón de distribución de las especies de abundancia media y baja es similar en los tres hábitats, la fauna de la VS se ajusta a una de tipo geométrico típica de comunidades poco competitivas (Moreno 2001). Ello se debe a la evidente dominancia de U. microcularis, cuya abundancia sobrepasa considerablemente a las demás especies, superando cinco veces a la segunda especie más abundante en el sitio.
Por otra parte, los tres hábitats presentan un esquema similar en términos de grupos funcionales. Las especies que exhiben estrategia de relocalización paracóprida, o cavadoras, representan el mayor porcentaje de riqueza y abundancia, teniendo mayor impacto en la ingeniería del suelo, no obstante, la mayoría de las especies que componen este gremio son de talla pequeña. Por su parte, las especies telecópridas, o rodadoras, están representadas por especies de talla mediana a grande, por lo que podrían tener resultados significativos en la remoción de la materia orgánica en descomposición como estiércol y carroña, y la dispersión secundaria de semillas, siendo este último, especialmente importante en zonas en proceso de recuperación. Mientras que las especies endocópridas, o residentes, están representados por pocas especies y su aporte principal reside en la supresión de parásitos intestinales (Simmons y Ridsdill-Smith 2011).
Diversidad beta (β)
La proximidad (± 2 km), es un factor que influye en el bajo recambio de especies entre los sitios, puesto que este grupo de insectos posee una amplitud de vuelo de poco más de un kilómetro y durante un tiempo de 20 a 40 minutos continuos hasta varias horas en el día (Gill 1991); permitiendo que la conectividad entre los hábitats se mantenga. Dichos factores influyen directamente en que todos los sitios de muestreo formen parte de una sola comunidad a pesar de que cada hábitat de muestreo presente condiciones diferentes, ya que entre el sitio de vegetación secundaria y los cultivos de café se encuentra un continuo de áreas perturbadas por cambios de uso del suelo como monocultivos, potreros y zonas en recuperación por incendios forestales, mientras que la selva se ubica en una zona con vegetación primaria con baja alteración (Flamenco-Sandoval et al. 2007, Maldonado et al. 2009). Dicho esto, la mayoría de las especies compartidas entre los tres hábitats (24) parecen mostrar un amplio espectro de tolerancia ambiental (especies euritípicas), principalmente las cinco más abundantes, ya que se encuentran en altas proporciones en al menos dos de los hábitats, lo que concuerda con otros estudios en los que se han capturado tanto en áreas conservadas como en zonas abiertas o de transición de manera indistinta (Arellano et al. 2008, Navarrete y Halffter 2008, Sánchez-de-Jesús et al. 2016, Díaz et al. 2010).
En este mismo sentido, las pocas diferencias en la composición de la fauna de cada sitio se deben sobre todo a la presencia de algunas especies con bajas abundancias (raras o turistas), que probablemente provienen de otros hábitats del paisaje o de paisajes colindantes en los que mantienen poblaciones abundantes, sugiriendo que estas especies muestran una gran movilidad entre los ambientes en busca de recursos (Halffter y Moreno 2005). Algunas especies como C. gilli, D. mexicanum y E. magnus que se consideran típicas de bosque mesófilo (Génier 2009, Edmonds y Zidek 2010, Cancino-López et al. 2014); O. landolti y S. ovatus generalmente abundantes en zonas abiertas como pastizales y potreros (Génier y Kohlmann 2003, Favila 2005, Basto-Estrella et al. 2012) son algunos ejemplos. Aun con estas bajas diferencias, la fauna de Scarabaeinae parece mostrar una marcada preferencia según el índice de selección de Savage al sitio conservado o selva mediana.
Gremios tróficos
Pese a capturar el mismo número de especies en los tres atrayentes, se observa una marcada diferencia entre la composición y estructura de las especies coprófagas respecto de las generalistas y las necrófagas. Este patrón es común en los bosques del Neotrópico y se adjudica a la presencia de mamíferos en el ecosistema que proveen recursos a los escarabajos de la subfamilia, representación que se sugiere es habitual en áreas con cierto grado de conservación (Halffter y Matthews 1966, Halffter et al. 2007, Navarrete y Halffter 2008). Cuando la densidad de mamíferos proveedores de estiércol desciende, la necrofagia es considerada importante en este grupo de escarabajos (Halffter y Matthews 1966), debido a la disposición de carroña, procedente principalmente de pequeños mamíferos (Bustos-Gómez y Lopera 2003). Este esquema explica la alta representatividad de los especialistas necrófagos en el CC, al considerarse un agrosistema que actúa como refugio de roedores y otros mamíferos pequeños (Mendoza Sáenz y Horváth 2013). En el caso de las especies generalistas, su mayor proporción se encuentra en la VS, donde todas las especies del gremio están representadas, lo cual coincide con lo reportado por Reyes-Novelo et al. (2007), quienes observaron que la presencia de las especies de este gremio aumenta en los sitios donde predomina la vegetación secundaria.
Si bien las especies de los tres hábitats forman parte de una sola comunidad, siendo la región, potencialmente rica en fauna de escarabajos copronecrófagos. La composición de los gremios tróficos puede revelar información valiosa sobre la presencia de vertebrados que proveen los recursos alimenticios a este grupo de escarabajos y, por consiguiente, sobre el estado de conservación de los ecosistemas (Nichols et al. 2008). Por lo tanto, es importante continuar con los estudios de este grupo de escarabajos a diferentes escalas espaciales y temporales para tener un panorama más amplio de los posibles efectos causados por diversas alteraciones de origen natural y antropogénico de la región.