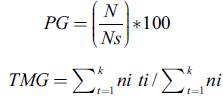INTRODUCCIÓN
La viabilidad denota el potencial que tiene una semilla para germinar (Sawma y Mohler 2002). Es un rasgo importante para evaluar la habilidad de colonización de las especies (Bremholm 1993, Pywell et al. 2003) y por ende está ligado al éxito o fracaso reproductivo de las poblaciones (Borza et al. 2007). A su vez es una medida de calidad, que cobra especial importancia en el monitoreo periódico de semillas que se encuentran bajo almacenamiento, con el fin de asegurar el éxito de un programa de conservación ex situ (Menges et al. 2004, Godefroid et al. 2010).
Mediante una revisión de los métodos utilizados para evaluar la viabilidad en estudios relacionados con bancos de semillas en campo, reclutamiento, bancos de semillas ex situ y ecología de la germinación, se encontró que de una muestra de 26 publicaciones científicas, se utilizan los siguientes métodos para su evaluación: germinación, 23,1 %; inspección directa del embrión clasificando como viable un embrión rígido y blanco, 15,4 %; prueba de Tetrazolio (TZ), 38,5 %; germinación y subsiguiente prueba de tetrazolio en las semillas no germinadas, 7,7 % y germinación e inspección del embrión subsiguiente en semillas no germinadas, 15,4 % (Anexo 1 del material suplementario).
Cada prueba tiene ventajas y desventajas; la prueba de germinación ligada a la prueba de inspección del embrión puede tomar mucho tiempo si la semilla tiene latencia y no se conocen los requerimientos para romperla (McDonald 1998, Torres y Marcos-Filho 2005), lo cual es usual en especies nativas poco estudiadas. Por otro lado, aunque la prueba de inspección del embrión se ha evaluado como equivalente a la prueba de germinación y tetrazolio (Sawma y Mohler 2002, Ooi et al. 2004, Borza et al. 2007), aún no se considera una prueba estandarizada.
La prueba de TZ es un método bioquímico basado en las reacciones de las deshidrogenasas que participan en la respiración celular de los tejidos de la semilla; cuando dichos tejidos entran en contacto con la solución, reaccionan formando un compuesto insoluble de color rosado que indica la viabilidad del tejido (Smith 1952, Moreno 1984, Gaspar-Oliveira et al. 2009). La viabilidad de las semillas se determina en función del patrón de tinción del embrión y la intensidad de la coloración (Ruiz 2009); en general, la estructura clave que debe presentar tinción es la radícula, la ausencia de tinción en ésta inmediatamente clasifica la semilla como no viable (Schmidt 2000). Por esta razón, se necesita de la pericia del analizador para la evaluación que en semillas pequeñas puede ser muy dispendiosa y la extracción del embrión casi imposible (Howarth y Stanwood 1993, Pradhan y Badola 2008). Sin embargo, muchos autores la consideran el método más exacto (Bradbeer 1988, Sawma y Mohler 2002) y es de gran utilidad en especies cuyas semillas presentan latencia y germinan con lentitud (Willan c1991, Ruiz 2009, Aslam et al. 2010).
La semilla de una especie particular puede requerir variaciones en las condiciones para tener resultados precisos (MAPA 2009, Da Silva et al. 2012). Numerosos estudios se han realizado para optimizar la prueba de TZ en especies particulares, tanto silvestres como comerciales, mediante la variación de las condiciones de evaluación (Gera et al. 1998, Purohit y Bisht 1999, Santos et al. 2007, Pinto et al. 2009, Zeng y Wang 2009, Hosomi et al. 2011, Lazarotto et al. 2011, Grzybowski et al. 2012, Kaiser et al. 2014, Lamarca y Barbedo 2014), donde se prueban acondicionamientos para facilitar la entrada del tetrazolio; corte, escarificación de la testa; tiempos y métodos de imbibición, imbibición directa o con toallas de papel; tiempos de sometimiento a la solución, entre dos y 48 horas; concentraciones de la solución, entre 0,075 y 1,0 %; y temperaturas entre 30 y 45 °C. El uso de la concentración, tiempo de tinción, la temperatura y la adecuada interpretación de la tinción en las semillas son factores cruciales para asegurar una prueba exitosa (Abbade y Takaki 2014).
Hay muy pocos estudios de viabilidad en especies nativas (Godefroid et al. 2010) y, específicamente, de especies tropicales altoandinas (Baskin y Baskin 1998), que hacen parte de los ecosistemas de bosque altoandino y páramo que prestan servicios ecosistémicos de abastecimiento hídrico, regulación, de secuestro de carbono en suelos, calidad de aire para las ciudades y además, presentan altos niveles de endemismo (Rodríguez et al. 2006).
En ecosistemas andinos de Suramérica de zonas templadas de Chile y Argentina, se referencian estudios en los cuales se evalúa la viabilidad de bancos de semillas en campo (Kalin et al. 1999, Cavieres y Arroyo 2000) o regeneración natural (Renison et al. 2004) por la prueba de TZ. En ecosistemas altoandinos de Perú se referencia un estudio de viabilidad de Puya raimondii en condiciones de laboratorio y un análisis de bancos de semillas naturales en páramo (Mora y Vargas 2007), en los cuales se utiliza la prueba de TZ. Por su parte Pico-V (2016), en un estudio en Puya loca evalúa la viabilidad por medio de la germinación. Esto evidencia la necesidad de (1) Conocer los métodos más efectivos para la evaluación correcta de rasgos reproductivos como la viabilidad de las semillas, y (2) Evaluar la viabilidad y germinación de semillas de especies altoandinas tropicales para conocer su potencial de colonización y utilizarlo como herramienta en la toma de decisiones.
En este marco, la presente investigación tuvo como objetivo comparar la prueba de germinación y tetrazolio para determinar el mejor método para la evaluación de la viabilidad en semillas de 17 especies tropicales altoandinas.
MATERIALES Y MÉTODOS
Colecta de material vegetal
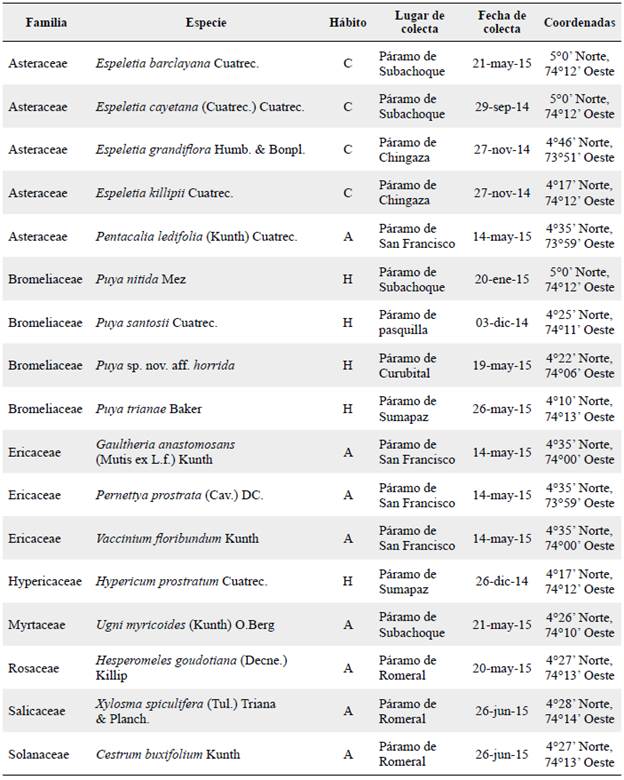
Entre 2014 y 2015 se recolectaron frutos y semillas de 17 especies de diversos bosques altoandinos y páramos cercanos a la ciudad de Bogotá D.C., Colombia (Tabla 1). Se verificó que los frutos se encontraran en madurez fisiológica a partir del color del exocarpo del fruto y de la dureza de la testa de la semilla. Se recolectó material de al menos 20 individuos por especie con condiciones fitosanitarias adecuadas. La taxonomía de cada especie fue verificada y los especímenes se ingresaron al Herbario del Jardín Botánico de Bogotá José Celestino Mutis (JBB). Los frutos y semillas se transportaron el mismo día de la colecta al Laboratorio de Conservación de Semillas del JBB y se realizó la limpieza de acuerdo al tipo de fruto. Se verificó la presencia de embrión en 100 semillas por especie por medio de inspección con un estereoscopio Motic® SMZ-168 (Hong Kong, China).
Prueba de Tetrazolio
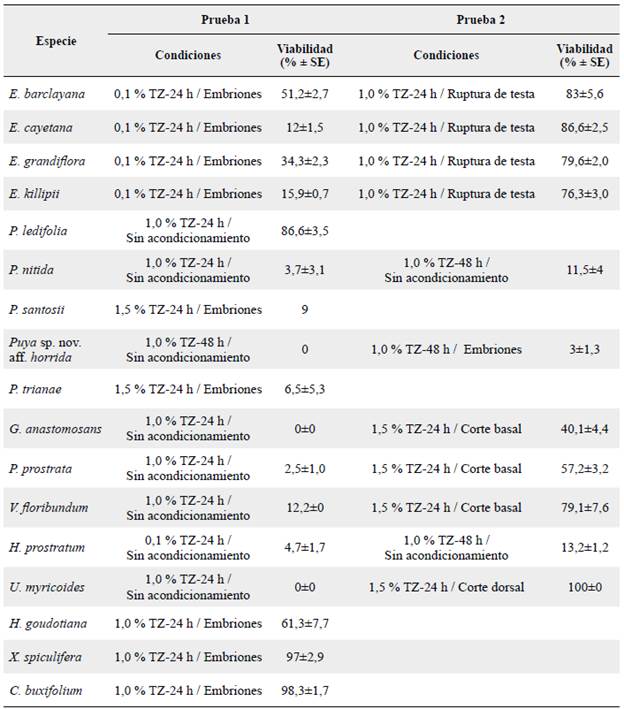
Se revisaron numerosos artículos en los cuales se aplicó la prueba de tetrazolio para identificar las condiciones más utilizadas. A partir de esto, se evaluaron primero condiciones de 30, 35 y 40 °C y de tiempos de sometimiento a la solución de tetrazolio de una, tres y 24 horas en tres especies de páramo (datos no mostrados). En estas pruebas preliminares se descartaron los tiempos de una y tres horas y la mejor temperatura fue de 40 °C por lo cual se evaluó la prueba bajo estas condiciones. Las semillas fueron embebidas en agua destilada durante 24 horas antes de aplicar la prueba que se realizó en condiciones de oscuridad; la temperatura se alcanzó con un horno de secado Binder ED 53-UL (Tuttlingen, Alemania). El ajuste del tiempo de inmersión y la concentración del TZ se realizó en dos fases; en la primera se evaluó una concentración de 0,1 % de TZ y, de acuerdo con la morfología, se realizó un acondicionamiento en la semilla para permitir la entrada de la solución. En la segunda fase, de acuerdo con los resultados en la prueba anterior, se aumentó la concentración de tetrazolio a 1,0 o 1,5 % y se varió el método de acondicionamiento. En las especies que se presentó tinción en la primera fase no se realizó la segunda fase. La tinción se consideró adecuada cuando la zona radicular y los cotiledones presentaron color rosa; se prestó especial atención a la zona radicular y, seguidamente, a los cotiledones; si el embrión presenta una tinción no homogénea puede significar un menor vigor, pero no ausencia de viabilidad (Da Silva et al. 2012). Un color rosa claro, no homogéneo en la radícula o ausencia de coloración de los embriones los clasificó como no viables. A continuación se explican los acondicionamientos utilizados y en la Tabla 2 se encuentran las características de las pruebas que fueron evaluadas en cada especie:
Tabla 2 Condiciones evaluadas para la estandarización de la prueba de viabilidad con tetrazolio. Se evaluó la concentración de tetrazolio TZ (0,1 %, 1 % y 1,5 %), el tiempo de exposición a la solución (24 y 48 h) y el acondicionamiento de la semilla previo a la prueba. SE= Error estándar.
Sin acondicionamiento (Prueba directa en semillas): se realizó la prueba directamente en las semillas sin ningún tipo de acondicionamiento.
Prueba en embriones: consistió en eliminar la testa y el endospermo, cuando estuviera presente, en la semilla para aplicar la prueba de tetrazolio directamente a los embriones.
Ruptura de la testa: se realizó un orificio en la testa con ayuda de un objeto corto punzante como pinzas de punta fina.
Corte basal: se realizó un corte con un bisturí en el extremo del funículo de la semilla.
Corte dorsal: se realizó un corte longitudinal de la semilla sin afectar el embrión.
En la mayoría de las especies se realizaron las pruebas en cuatro réplicas de 50 semillas; debido a poca disponibilidad de material vegetal en U. myricoides se utilizaron tres réplicas de 25 semillas, en H. goudotiana cuatro réplicas de 20 semillas y en C. buxifolium cuatro réplicas de 15 semillas.
Prueba de germinación
La germinación se evaluó en cajas de Petri con doble papel de filtro en condiciones controladas por medio de una cámara de germinación Thermoline (New South Wales, Australia). Las condiciones de germinación fueron 20/10 °C día/noche, con un fotoperiodo y un termoperíodo de doce horas (Pérez-Martínez et al. 2014). La humedad relativa, aunque no fue controlada, se mantuvo alrededor de 75±5 % y fue monitoreada con un Data Logger EBCHQ 94150 (China). Una semilla se consideró germinada cuando se evidenció la emergencia de la radícula de 2 mm o más de longitud. Se utilizaron cuatro réplicas de 50 semillas. La germinación fue evaluada cada tres días hasta que cesó la germinación por tres semanas consecutivas después de haber germinado la mayor parte de las semillas. Al final de los ensayos se examinó la presencia del embrión en las semillas no germinadas. El porcentaje de germinación (PG) se calculó sobre el número de semillas con embrión y el tiempo de germinación mediante el índice de tiempo medio de germinación (TMG) por medio de la ecuación (Tompsett y Pritchard 1998, Ranal y Santana 2006):
Donde N es el número de semillas germinadas y N s el número total de semillas con embrión, ni es el número de semillas germinadas en la medida iésima; ti es el tiempo en días en la medida iésima y k es el tiempo total de germinación en días.
Análisis estadístico
Se realizó la prueba de normalidad Shapiro-Wilk en cada conjunto de datos, seguida de un análisis no paramétrico de Kruskal-Wallis con una confianza del 95 % para evaluar diferencias significativas entre el porcentaje germinación y el porcentaje de semillas viables según la prueba de Tetrazolio. Para la comparación con la prueba de germinación se utilizaron los datos que arrojaron los mejores resultados en la prueba de TZ. La prueba de Tetrazolio se consideró estandarizada cuando el porcentaje de embriones teñidos fue igual o superior al porcentaje de semillas germinadas. Se utilizó el programa estadístico StatGraphics® Centurion XVI versión 16.1.11.
RESULTADOS
Prueba de Tetrazolio
La tinción obtenida en los embriones que indicó viabilidad de la semilla fue rosa oscuro, mientras que los embriones inviables registraron ausencia de coloración en la radícula y colores rosa pálidos esparcidos por los cotiledones sin un patrón homogéneo (Fig. 1).

Figura 1 Resultados de la prueba de viabilidad con Tetrazolio en una especie por familia evaluada. Para cada especie se presenta la semilla, el embrión viable y el embrión no viable. a, b, c. Puya sp. nov. aff. horrida (Bromeliaceae); d, e, f. E. grandiflora (Asteraceae); g, h, i. P. prostrata (Ericaceae); j, k, l. H. prostratum (Hypericaceae); m, n, ñ. U. myricoides (Myrtaceae); o, p, q. H. goudotiana (Rosaceae); r, s, t. X. spiculifera (Salicaceae); u, v, w. C. buxifolium (Solanaceae). Escala = 1 mm.
Las condiciones para realizar la prueba de tetrazolio presentaron similitud a nivel de género y familia. En Espeletia la consistencia quebradiza de la testa facilita realizar una ruptura ligera para permitir la entrada del TZ sin necesidad de extraer los embriones; para el género el factor que más influye en el proceso de tinción es la concentración; al utilizar tetrazolio al 1 % por 24 horas se alcanzaron viabilidades superiores a 76 % (Tabla 2). Estas mismas condiciones permitieron una tinción superior al 80 % en P. ledifolia, por otro lado, gracias a la consistencia delgada y papirácea de la testa la prueba se puede realizar directamente en las semillas sin realizar un acondicionamiento previo (Tabla 2).
En Puya la tinción fue inferior al 12 % en todas las especies, incluso al evaluar la prueba directamente en el embrión, aumentando el tiempo de exposición y la concentración del tetrazolio (Tabla 2, Fig. 2).
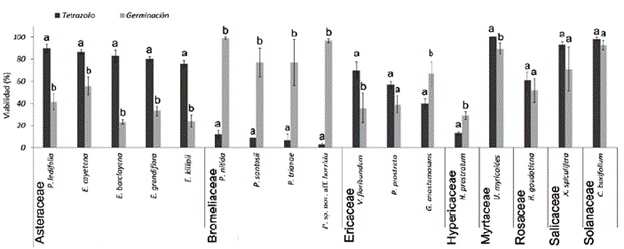
Figura 2 Viabilidad por la prueba de Tetrazolio y de germinación de 17 especies altoandinas. Letras diferentes indican que se presentaron diferencias significativas entre las pruebas de acuerdo con Kruskal-Wallis (P < 0,05). Las verticales indican el error estándar (n = 15-50).
Para las Ericáceas G. anastomosans, P. prostrata y Vfloribundum, las cuales poseen una testa delgada pero dura, es necesario realizar un corte basal en la testa que asegure la entrada de Tetrazolio, así como aumentar la concentración hasta el 1,5 % para obtener viabilidades superiores al 40 % (Tabla 2).
En H. prostratum no se pudo realizar un acondicionamiento previo en las semillas debido a su pequeño tamaño (Figs. 1j-l), y pese a los cambios utilizados en la prueba sólo se alcanzó una tinción de 13,2 %. Por su parte, U. myricoides presenta un cambio radical en los resultados en la prueba uno y dos pasando de 0 % al 100 % de tinción, donde, si bien se modificó la concentración del TZ, el factor crucial para obtener tinción es realizar un corte dorsal en la semilla ya que esta presenta una testa extremadamente dura y probablemente poco permeable (Fig. 1, Tabla 2).
Finalmente H. goudotiana, C. buxifolium y X. spiculifera presentan testas gruesas, duras y para el caso de las dos últimas especies, un abundante endospermo por lo que es necesario realizar la prueba directamente en los embriones, con una concentración del 1 % para lograr tinciones superiores al 60 % (Fig. 1, Tabla 2).
Prueba de germinación
El porcentaje de germinación varió drásticamente entre las especies, a pesar de esto se observa un comportamiento similar a nivel de familia. Asteraceae fue la familia que presentó la menor germinación donde las especies no superaron el 56 %, además reporta los valores más bajos como en E. barclayana 23 % y E. killipii 24 % (Fig. 2). En cuanto al tiempo medio de germinación este varió entre 24 y 36 días según la especie (Tabla 3).
Tabla 3 Tiempo medio de germinación (TMG) y variación del error estándar (SE) presentado en las pruebas de viabilidad por tetrazolio y germinación. * = diferencias significativas entre la prueba de germinación y tetrazolio de acuerdo con la prueba Kruskal-Wallis (P ≤ 0,05).
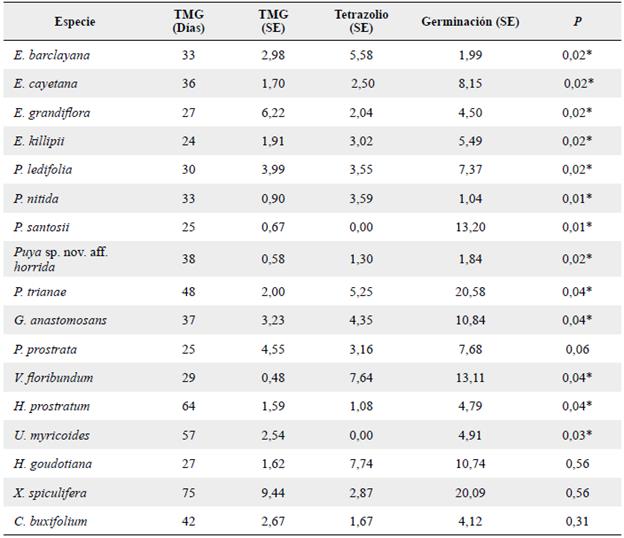
La familia Bromeliaceae presentó los mayores valores de germinación, con valores que van desde el 77 al 99 % (Fig. 2), con un tiempo medio de germinación promedio de 36 días (Tabla 3).
En Ericaceae las especies más similares fueron V. floribundum y P. prostrata con un PG promedio del 37 % y un TMG de 27 días, valores que aumentaron en G. anastomosans (Tabla 3 y Fig. 2).
En las especies restantes los mayores valores de germinación los presentaron C. buxifolium y U. myricoides, seguidas de X. spiculifera y H. goudotiana todas con valores superiores al 50 %; H. prostratum fue la especie que presentó la menor germinación (Fig. 2).
En cuanto al TMG este fue muy variable y dependiente de la especie (Tabla 3).
Comparación entre la prueba de tetrazolio y la prueba de germinación.
Para la mayoría de las especies se presenta una diferencia en los resultados de viabilidad obtenidos por las diferentes pruebas, aunque en general en la prueba de tetrazolio se presentan los valores más altos de viabilidad. En las especies de la familia Asteraceae se presentaron diferencias entre la viabilidad obtenida por tetrazolio y con germinación (P < 0,05) (Tabla 3), siendo tetrazolio la prueba en la cual se presentó una mayor viabilidad, duplicando o triplicando los resultados por germinación (Fig. 2).
En Bromeliaceae también se presentaron diferencias entre las pruebas (P < 0,05) (Tabla 3), pero en este caso la prueba de germinación registró los mejores resultados de viabilidad con diferencias entre el 7 y el 77 % entre pruebas (Fig. 2).
En las especies V. floribundum, P. prostrata y U. myricoides se obtuvo mejor viabilidad por la prueba de tetrazolio, sin embargo solo en V. floribundum y U. myricoides estas diferencias fueron significativas (P < 0,05) (Tabla 3). Para el caso de G. anastomosans e H. prostratum también se presentaron diferencias significativas (P < 0,05), pero el mayor valor de viabilidad se presentó por el método de germinación (Tabla 3, Fig. 2).
Finalmente en H. goudotiana, X. spiculifera y C. buxifolium no se presentaron diferencias entre las pruebas (P > 0,05) (Tabla 3), pero la prueba recomendada por presentar mejores valores de viabilidad es tetrazolio (Fig. 2).
En conjunto los resultados de la prueba por tetrazolio fueron más precisos ya que en general se observaron variaciones entre cero y siete de error estándar, mientras en la germinación estuvieron entre uno y 20 (Tabla 3).
DISCUSIÓN
Se logró estandarizar la prueba de tetrazolio en 11 de las 17 especies evaluadas, cuyas condiciones específicas se ilustran en la Tabla 4. En nuestro caso, las especies estandarizadas respondieron mejor a la siguiente condición de evaluación: [1-1,5 %] TZ, 40 °C y 24 horas de exposición. Dichas condiciones presentan diferencias frente a lo propuesto por Don (2009), quien recomienda una temperatura de 30 °C y 18 horas de exposición; estas condiciones son efectivas para especies cultivadas, sin embargo no fueron efectivas en las especies altoandinas evaluadas, lo cual soporta la necesidad de establecer nuevos protocolos para evaluar con precisión la viabilidad en los diferentes grupos de especies (Da Silva et al. 2012).
A pesar de que los menores valores de viabilidad por tetrazolio se presentaron en la concentración 0,1 %, no se descarta que puedan ser utilizados en otras especies altoandinas, ya que en diferentes estudios se han obtenido buenos resultados con esta concentración (De Oliveira et al. 2005, Grzybowski et al. 2012, Da Silva et al. 2012, Kaiser et al. 2014), lo cual es positivo ya que el uso de menores concentraciones de TZ conlleva a menores costos y posibilita una mejor visualización de patrones de coloración e identificación de diferentes tipos de daño (França Neto et al. 1998).
Un cuarto factor determinante es el acondicionamiento que se realice en la semilla antes de su exposición a la solución, lo cual permitirá un contacto directo entre el tetrazolio y el embrión y disminuirá el tiempo necesario para la tinción (Rao et al. 2007). Este acondicionamiento dependerá de la morfología y tamaño de la semilla; en nuestro caso se observó un agrupamiento a nivel de familia y género, lo cual sugiere que las condiciones reportadas en esta investigación pueden ser utilizadas en la evaluación de otras especies de la familia o el género (Tabla 4).
Tabla 4 Método y condiciones recomendadas para evaluar la viabilidad en 17 especies altoandinas. En la prueba de Tetrazolio se indica: la concentración del TZ, la temperatura, el tiempo de exposición y el acondicionamiento de la semilla previo a la prueba. En germinación se indica: la temperatura día/ noche, el fotoperiodo y la humedad relativa.
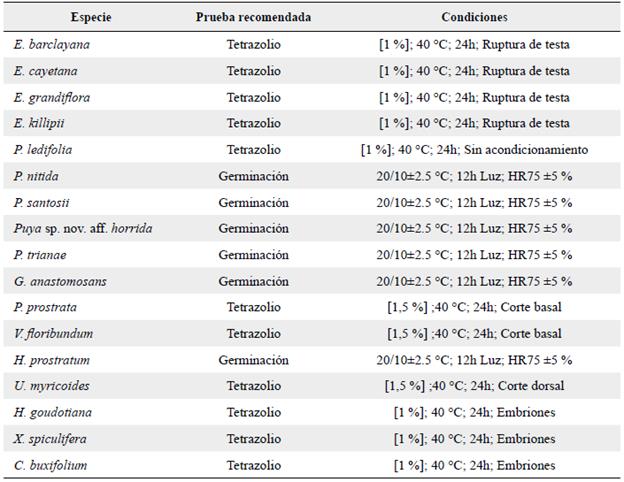
h = Horas, HR = Humedad relativa.
No obstante, es de destacar que el pequeño tamaño de las semillas obliga al analista o investigador a desarrollar habilidad en el proceso de acondicionamiento y evaluación ya que es posible que al realizar un corte o extraer directamente el embrión ocasione daños al mismo afectando la lectura de la prueba, de hecho, algunos autores señalan el tamaño de la semilla como una razón para no realizar acondicionamiento al aplicar la prueba (Tielbörger y Prasse 2009, Pradhan y Badola 2012), tal fue el caso de H. prostratum y G. anastomosans, especies para las cuales no se logró la estandarización de la prueba; se recomienda ampliar los estudios hasta identificar los mejores condiciones de la prueba ya que estas especies pertenecen a las familias Hypericaceae y Ericaceae muy bien representadas en ecosistemas altoandinos (Galindo-T et al. 2003, Sklenáf et al. 2005, Avella-M et al. 2014).
De igual manera se recomienda aumentar la concentración y tiempo de exposición en las especies del género Puya, que tras probar diferentes condiciones no presentaron la tinción esperada. En cuanto a la germinación también se observó un comportamiento similar entre géneros y familias. En el caso de los géneros Espeletia y Pentacalia se obtuvo una germinación menor al 56 % (Fig. 2), estos resultados pueden indicar que las semillas presentan algún tipo de dormancia, en este caso fisiológica, una de las más frecuentes (Baskin y Baskin 2004, 2014) y que ha sido ampliamente reportada para su orden (Baskin y Baskin 2004). Esta forma de dormancia proporciona indicaciones estacionales, asegurando que la germinación ocurra solo después de eventos ambientales específicos (Finch-Savage y Leubner-Metzger 2006). Este fenómeno indica que las semillas deben ser sometidas a tratamientos pregerminativos para lograr una buena germinación, entre ellos se sugiere la inmersión en hormonas de crecimiento o la estratificación en frio (Baskin y Baskin 2014). Por otro lado, un estudio realizado por Guariguata y Azocar (1988) en Espeletia timotensis reportó germinaciones de hasta el 80 % a temperaturas constantes inferiores a 16 °C, lo cual indica que es recomendable evaluar condiciones de siembra diferentes a las abordadas en este estudio, teniendo en cuenta que estas especies pertenecen a la familia mejor representada y abundante en las zonas de páramo (Sklenáf et al. 2005).
Por el contrario uno de los mejores resultados de germinación los presentó el género Puya, donde se reportaron PG superiores al 77 % con tiempos medios de germinación relativamente cortos (36 días), esto concuerda con lo referenciado por Vadillo et al. (2004) en P. raimondii,Franco (2014) en P. nitida y Pico-V (2016) en P. loca, quienes encontraron PG entre el 60 % y el 80 %. Esto indica que las condiciones de germinación utilizadas son adecuadas para las especies que evaluamos y posiblemente para el género (Tabla 4); sin embargo es importante resaltar que para algunas especies la germinación en condiciones de laboratorio tiende a ser mayor que en condiciones de campo (Guariguata y Azocar 1988), lo cual explica porqué Mora y Vargas (2007) registraron valores de germinación en bancos de semillas por debajo del 1 % en Puya cryptantha y P. trianae en los páramos colombianos. Estos resultados evidencian la importancia de implementar estrategias de propagación ex situ en aquellas especies que de forma in situ presenten problemas en su germinación o reclutamiento como es el caso de las del género Puya las cuales en su mayoría son endémicas y presentan alguna categoría de amenaza (Betancur c2015).
La familia Ericaceae se caracteriza por presentar frutos pequeños en bayas o cápsulas con un alto número de semillas pequeñas, lo cual, sumado a la dispersión principalmente zoocora, le permite contar con una amplia dispersión, que favorece junto a su rápida germinación la colonización de nuevos lugares (Luteyn 2002). Esta rápida germinación se evidenció en las especies evaluadas, donde los tiempos medios de germinación oscilaron entre 25 y 37 días, la especie con menor PG fue V floribundum con 36 %, mientras G. anastomosans presentó el mayor PG con 66 % (Fig. 2), los valores encontrados concuerdan con lo reportado por Pérez-Martínez et al. (2014) en su estudio de propagación en especies de páramo. En ericáceas la germinación se ve afectada por dos factores principales: la baja viabilidad de los embriones (La Rosa et al. 2017) la cual puede estar influenciada por la variación en el tamaño y los estados de maduración de las semillas dentro de un fruto (Chaparro y Becerra 1999, Kloet y Cabilio 2010, Castro et al. 2012) y la presencia de dormancia fisiológica en las semillas (Baskin y Baskin 2004, Hernández et al. 2009), lo que hace necesario aplicar tratamientos pregerminativos (Magnitskiy y Ligarreto 2007, Hernández et al. 2009).
H. prostratum fue una de las especies que presentó la menor germinación (29 %) y un TMG de 64 días (Fig. 2), este comportamiento ha sido reportado en otras especies del género (Macchia et al. 1983, Çirak et al. 2007), donde la baja capacidad germinativa está relacionada con la presencia de dormancia en las semillas y sus altos requerimientos lumínicos (Thompson y Whatley 1984), por tal motivo se recomienda incluir tratamientos pregerminativos que permitan romper la dormancia en la especie.
El resultado de la germinación en U. myricoides fue similar al encontrado por Figueroa et al. (1996) en U. molinae, donde obtuvieron una germinación de 82 %. En la especie H. goudotiana la germinación fue mucho menor a lo esperado (Pérez-Martínez et al. 2014), de acuerdo con las características que se observaron de la semillas, presentan un embrión bien desarrollado con cotiledones gruesos que pueden favorecer la germinación, sin embargo la presencia de una testa gruesa y dura presenta a su vez un impedimento para la germinación (Fig. 1), por lo cual se considera que un corte podría aumentar este porcentaje.
Finalmente en X. spiculifera y C. buxifolium se presentó una alta germinación (Fig. 2), lo que es de esperarse ya que estas especies presentan un hábito herbáceo o arbustivo, amplia distribución (Alford c2018, Canal c2018), alta tolerancia a los disturbios y tendencia a ser pioneras en los estadios sucesionales, por lo cual diferentes autores recomiendan su uso en programas de restauración (Acero-Nitola y Cortés-Pérez 2014, Cabrera y Ramírez 2014).
En conclusión los resultados permitieron comparar cuál método es el más adecuado para evaluar la viabilidad de cada una de las especies (Tabla 4), sin embargo, la elección del método dependerá del objetivo de la investigación, si solo se requiere conocer la viabilidad será suficiente utilizar la prueba de tetrazolio siempre que se conozcan las condiciones adecuadas para evaluarla, pero esta no permite conocer los requerimientos y potencial de germinación de las especies.
En conjunto estas pruebas permiten identificar condiciones fisiológicas de las semillas que no podrían ser detectadas al usarlas de manera individual, por ejemplo la detección de una germinación menor a la viabilidad reportada en tetrazolio podría sugerir la presencia de dormancia no unificada en las semillas, tal como sucedió en las familias Asteraceae y Ericaceae (Fig. 2) y sucede en diferentes familias presentes en los bosques altoandinos (Baskin y Baskin 2004) usada como una estrategia que le confiere a las especies la capacidad de distribuir la geminación en el tiempo y adaptarse a las condiciones variables del ambiente, favoreciendo la supervivencia y establecimiento de nuevas poblaciones (Snyder 2006).
MATERIAL SUPLEMENTARIO
El anexo 1 se presenta como material suplementario bajo el doi: https://dx.doi.org/10.15446/caldasia.v40n2.76108.