INTRODUCCIÓN
Los Bosques Secos Tropicales (bs-T) según Holdridge (1967), se caracterizan por tener una temperatura media anual de 17 °C, precipitación anual entre 250 y 2000 mm, y una relación entre la evapotranspiración y la precipitación (ETP/P) mayor a uno. Esta zona de vida agrupa varios tipos de formación vegetal, como bosques, sabanas y matorrales, diferenciadas por distintas características climáticas, edáficas y topográficas (Bullock et al. 1995). La estacionalidad es su atributo principal, presentándose uno o dos periodos de sequía al año, con precipitación menor a 100 mm. La estacionalidad ha modelado las características estructurales, funcionales y fenológicas de los bs-T, de las cuales la más representativa es la presencia de especies caducifolias (Murphy y Lugo 1986).
En comparación con los Bosques Húmedos Tropicales (bh-T), el bs-T se caracteriza por su estructura más simple, menores estratos de vegetación, y menor número de especies (Murphy y Lugo 1986). Sin embargo, se ha encontrado que presenta altos niveles de disimilitud florística entre unidades geográficas (Trejo y Dirzo 2002), un alto conservacionismo filogenético, y alta presencia de endemismos para cada región (De-Nova et al. 2012).
Los bs-T se presentan en suelos más fértiles y tienen un clima más moderado con respecto a los bh-T, por lo que su historia de uso ha sido mucho más larga e intensiva (Miles et al. 2006). Ésta es la razón por la cual presentan mayores tasas de fragmentación y pérdida de hábitat, posicionándolos como los ecosistemas más amenazados del mundo (Janzen 1988a, Sánchez-Azofeifa et al. 2013). No obstante, aún bajo esta categoría de conservación, siguen siendo subrepresentados en la literatura en comparación con otros ecosistemas (Sánchez-Azofeifa et al. 2005).
Los bs-T en el mundo presentan una distribución geográfica históricamente discontinua (Linares-Palomino et al. 2011) debido a procesos geológicos y climáticos (Dexter et al. 2015), y más recientemente al aprovechamiento y manejo por parte del hombre (Bullock et al. 1995). La fragmentación ha modelado el paisaje de los bs-T convirtiéndolos en extensiones boscosas de diferentes tamaños, con zonas de bordes y árboles aislados, inmersos en matrices agropecuarias.
Estos parches remanentes se encuentran casi siempre dominados por estados tempranos de la sucesión (Vargas 2015), y al igual que los bordes y árboles aislados, poseen especies con gran potencial para la restauración (Guevara y Van der Maarel 1986, Harper et al. 2005). La restauración ecológica del bs-T es una tarea necesaria, que debe enfocarse en el aumento de la conectividad entre estos elementos del paisaje, y que permita la recuperación de los servicios ecosistémicos que ofrece (Armenteras y Vargas 2015).
Dado el alto grado de endemismo y diversidad β de los bs-T (Gentry 1995, Pennington et al. 2009), es recomendable que la selección de especies para la restauración se realice a escala local. De esta manera se asegura el éxito de su propagación y adaptación a las condiciones de cada sitio, además se promueve el uso de la flora nativa. El objetivo de este trabajo fue determinar especies promisorias para la restauración, a partir de análisis florísticos realizados a los elementos del paisaje de un bs-T en los valles interandinos de Colombia.
Específicamente se buscó determinar especies promisorias para la restauración, mediante el análisis florístico del paisaje y las relaciones ecológicas que existen entre las especies que componen sus elementos. Con base en el análisis de ordenación, y rasgos como su importancia ecológica y síndrome de dispersión, se buscó identificar grupos de especies características para los distintos elementos del paisaje que puedan emplearse en estrategias de restauración propuestas para bosques tropicales.
MATERIALES Y MÉTODOS
Área de estudio
El trabajo se realizó en la Hacienda El Triunfo, reserva privada de la sociedad civil, ubicada en el municipio de Honda, Tolima, parte media de la cuenca del río Magdalena, Colombia (Fig. 1a). La precipitación es de régimen bimodal, con la primera época de lluvia entre los meses de abril y mayo y la segunda entre octubre y noviembre. La temperatura promedio anual es de 27,4 °C. El lugar de muestreo fue el potrero denominado La Flor (5°10'01,40" Norte y 74°45'08,42" Oeste). Este sitio se escogió debido a que tiene buena representación de áreas de borde y parches (Fig. 1b). Según trabajadores de la hacienda, las áreas de potrero han sido manejadas mediante actividades de roza y uso de herbicidas. Los parches incluidos en el muestreo tienen un tiempo de regeneración aproximado de 25 años, mientras los bordes son más jóvenes con apenas 10 años.
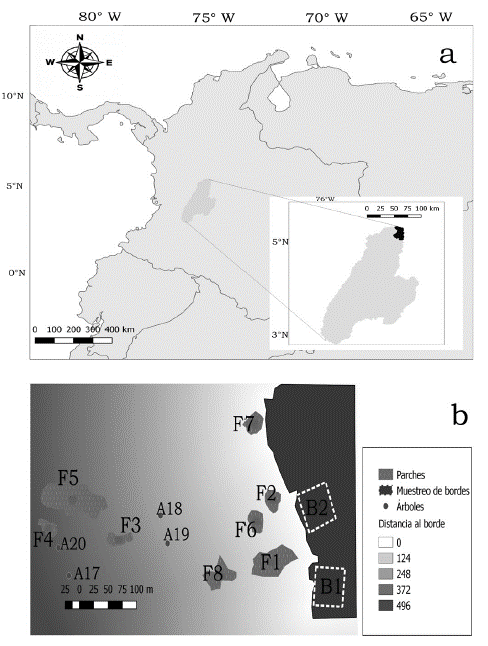
Figura 1 Ubicación geográfica y distribución espacial de los muestreos en el área de estudio a. Ubicación geográfica de la hacienda El Triunfo en el municipio de Honda; b. Diseño espacial del muestreo. Los bordes fueron clasificados como B1 (con baja pendiente) y B2 (alta pendiente). Los parches de bosque están numerados de F1 a F8. La imagen muestra los árboles aislados del A17 al A20, los demás individuos (A1 al A16) se ubicaron en otras áreas de la hacienda.
Muestreo y colección de datos
La caracterización florística y estructural se realizó en elementos de bordes y parches. En los bordes se establecieron diez transectos de 50 x 2 m, para completar 0,1 ha según la metodología de Gentry (1982). Se tomaron variables de altura, diámetro a la altura del pecho (DAP), cobertura de la copa y la abundancia de todos los individuos con un DAP mayor a 2,5 cm. Los transectos se establecieron desde el borde del bosque hacia el interior, y de manera perpendicular para evitar superposición. La mitad de éstos se trazaron en un área relativamente plana con pendiente de 17° (B1) y la otra mitad sobre zonas inclinadas con pendiente de 42° (B2) (Fig. 1b).
En los parches el muestreo fue completo y se registraron las mismas variables tomadas en bordes. En total se censaron ocho parches numerados del F1 al F8 (Fig. 1b). Para los árboles aislados tomamos la altura, diámetro y cobertura de la copa. Estos fueron organizados en dos grupos; los árboles aislados del potrero La Flor (A1) y aquellos censados en áreas más lejanas (A2), debido a que en la zona principal de muestreo no se presentó la cantidad suficiente de árboles para el censo. Las especies recolectadas por fuera de estos muestreos se catalogaron como especies de sitios abiertos o potrero (P) y especies creciendo en zonas adyacentes a bordes o parches (L). Estos agrupamientos se realizaron bajo la hipótesis de que existen diferencias de composición y estructura entre las especies de distintos elementos paisajísticos como borde, parches y sitios abiertos, porque éstas responden de manera diferencial a las condiciones ambientales de cada elemento (López de Casenave et al. 1995).
El trabajo en campo se realizó en junio del 2017, final de la primera época de lluvias, momento en el cual se recolectaron muestras botánicas de todos los individuos. Salidas posteriores se realizaron en septiembre (época seca) y octubre (época de lluvias) del 2017 para complementar el muestreo. El material botánico se determinó en el Herbario Nacional Colombiano (COL), con el apoyo de expertos asociados al Instituto de Ciencias Naturales de la Universidad Nacional de Colombia.
Análisis de los datos
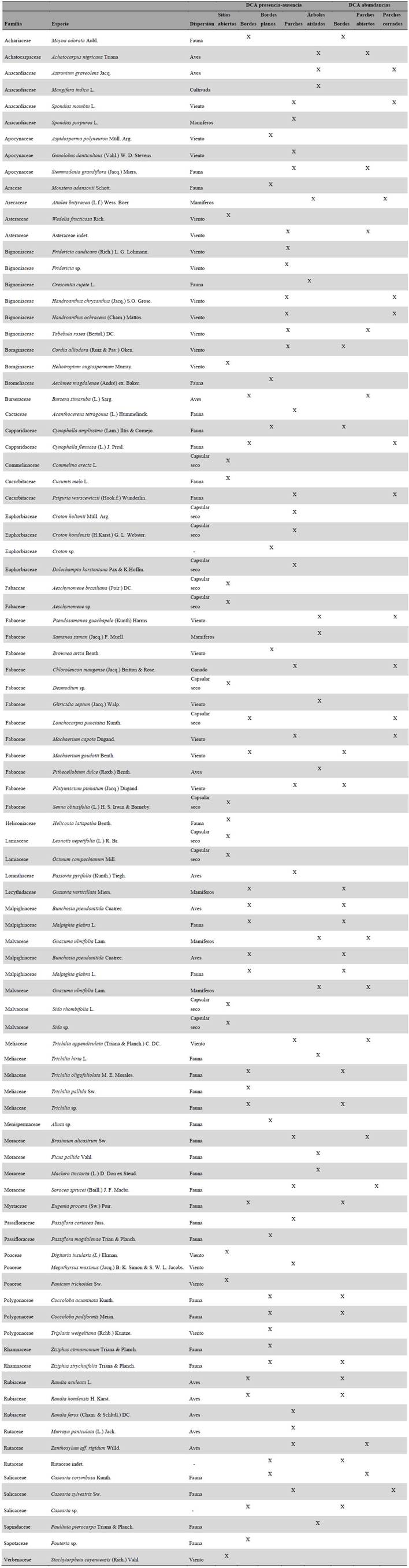
El índice de valor de importancia (I.VI.) se calculó para todas las especies con datos de abundancia. Adicionalmente se hizo un análisis de distribución de clases para las variables de altura y DAP, con el fin de establecer posibles edades de regeneración. Posteriormente éstas se compararon entre bordes y parches mediante la prueba de Wilcoxon. Además, para todas las especies recolectadas se determinó el tipo de dispersión, en anemocoria, zoocoria y dehiscencia de fruto capsular seco según Vargas (2015). Estos síndromes se analizaron para todo el conjunto de especies, y para las especies de borde y de parches por separado. Un análisis de correspondencia sin tendencia (DCA por sus siglas en inglés) se realizó para establecer grupos de especies características de cada elemento del paisaje. Éste se hizo a partir de una matriz presencia-ausencia para todas las especies. Todos los análisis se realizaron utilizando R versión 3.4.2 y RStudio versión 1.1.383, y con el paquete Vegan (Oksanen c2015).
De las agrupaciones obtenidas por el análisis de correspondencia se definieron aquellas especies que mejor representan cada elemento del paisaje, bajo la hipótesis nuevamente de que son especies que cuentan con rasgos funcionales que las hacen exitosas bajo las condiciones ecológicas de cada uno de estos. Esta selección se complementó con el I.VI. y los síndromes de dispersión, como rasgos que pueden ser importantes para la restauración.
RESULTADOS
Composición florística
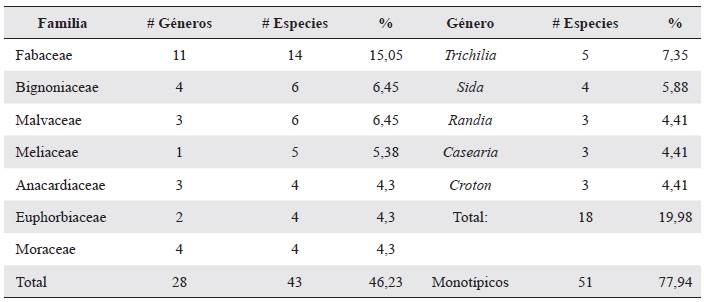
Se censaron 340 individuos de especies leñosas en bordes, parches y árboles aislados, y en total se determinaron 93 especies, 68 géneros y 37 familias (véase el Anexo en Material suplementario). De ellas, 83 se determinaron hasta especie, ocho hasta género y dos hasta familia. La familia con mayor número de especies fue Fabaceae con catorce, seguida de Bignoniaceae y Malvaceae con seis, Meliaceae con cinco, y finalmente Anacardiaceae, Euphorbiaceae y Moraceae representadas por cuatro especies cada una. Estas siete familias agrupan el 46,23 % de la riqueza. En cuanto a géneros, Trichilia tuvo el mayor número de especies con cinco, seguido de Sida con cuatro, y de Randia, Casearia y Crotón con tres cada uno. La situación más frecuente, (77,27 %) no obstante, es que los géneros estén representados por una sola especie (Tabla 1).
Estructura de la vegetación
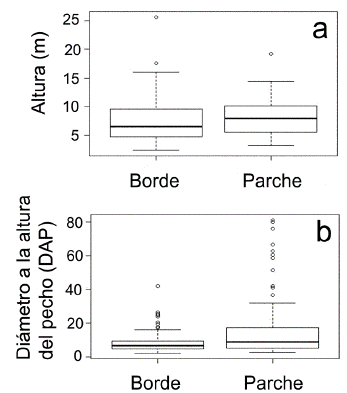
La mayoría de los individuos se ubicaron en el intervalo de altura entre los 5 y 9 metros, tanto en bordes como en parches representando el 44,7 % y 44,1 % respectivamente. Tan solo el 3,1 % de los individuos en bordes y el 1,6 % en parches superan los quince metros y sobresalen del dosel. En cuanto al DAP el 99,5 % de los individuos de borde se encuentra por debajo de los 30 cm, mientras en los parches, el 13,3 % de los árboles alcanzan diámetros superiores (Fig. 2). La prueba de Wilcoxon mostró diferencias significativas entre el DAP de bordes y parches (P = 0,0002), pero no mostró diferencias para la variable de altura (P = 0,1) (Fig. 3).
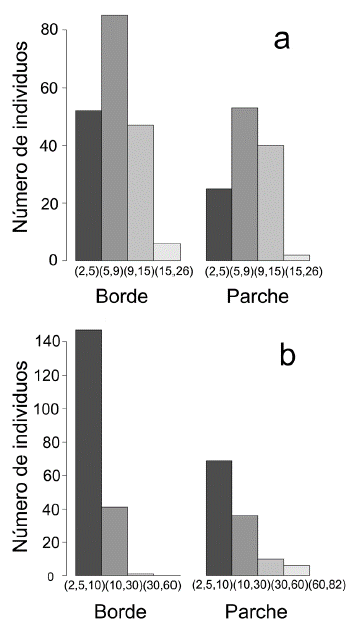
Figura 2 Análisis de distribución de clases para las variables, a. altura y b. diámetro a la altura del pecho (DAP) en bordes y parches.
Índice de valor de importancia
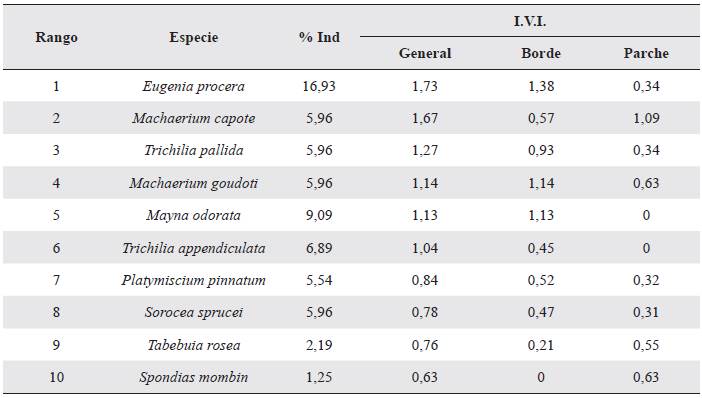
La especie con mayor número de individuos fue Eugenia procera (Sw.) Poir. que constituye el 16,9 % de los individuos censados. La siguiente especie más abundante fue Mayna odorara Aubl. con el 9,1 %. Estas dos especies están entre los tres valores más altos para I.V.I. evaluados solamente para los bordes, mientras que E. procera es la especie con mayor I.V.I. para todo el muestreo (Tabla 2).
Síndromes de dispersión
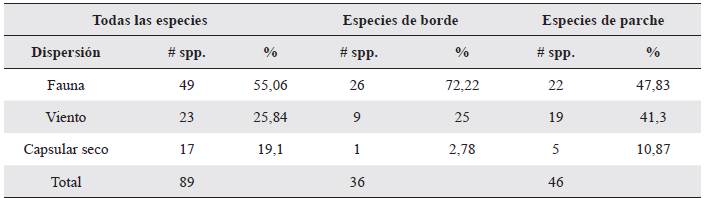
Más de la mitad de las especies (55,5 %) son dispersadas por la fauna, mientras el 25,8 % y 19,1 % son dispersadas por el viento o tienen síndrome capsular seco respectivamente. El porcentaje de zoocoria aumentó al 72,2 % en las especies de borde, mientras que en parches estuvo más equilibrado con la anemocoria, con 47,8 % y 41,3 % respectivamente (Tabla 3).
Análisis de correspondencia sin tendencia (DCA)
El 87 % de la variación es explicada por los dos primeros ejes. El análisis con base en la presencia-ausencia de las especies encontró cinco grupos bien definidos; para sitios abiertos (P, L), bordes (B1, B2), sólo bordes planos (B1), parches (F1 al F8) y árboles aislados (A1, A2) (Fig. 4).
DISCUSIÓN
Caracterización florística
Las familias con mayor riqueza fueron Fabaceae y Bignoniaceae seguidas de Malvaceae, Moraceae, Anacardiaceae y Euphorbiaceae. La dominancia de la familia Fabaceae es característica de los bs-T, lo cual ha sido encontrado en numerosos estudios florísticos tanto en Colombia (Mendoza 1999, Marulanda et al. 2003, Rodríguez et al. 2012), como en Centroamérica (Mora et al. 2012, López et al. 2015). El orden de importancia de las otras familias, por el contrario, es altamente variable entre autores, y lo mismo sucede con los géneros más diversos.
Estructura
En términos generales la mayoría de las especies leñosas censadas presentaron diámetros menores a 30 cm (Fig. 2) por lo cual pueden considerarse como individuos jóvenes (Oliveira-Filho et al. 1998). El DAP fue significativamente mayor en parches (Fig. 3), debido a la presencia de especies arbóreas de gran porte. Una hipótesis sería que estos individuos fueron primero árboles aislados que quedaron en sitios de topografía bajos, y que facilitaron el proceso de colonización de otras especies de fases tempranas (Willson y Cromer 1989). La presencia de varios árboles núcleo, en el tiempo, forma parches de vegetación abierta como lo son F1, F2, F4 y F8.
La dominancia de E. procera tanto en las comunidades de borde como de parches también ha sido encontrada por Berdugo-Lattke y Rangel (2015) en bosques secos del departamento del Cesar (Colombia). Especies de las familias Myrtaceae y Fabaceae son típicas de sitios disturbados y en regeneración (Londoño y Torres 2015). Esta resistencia por parte de algunas especies puede ser empleada en procesos de restauración, donde los disturbios limitan fuertemente la recuperación del bosque (McLaren et al. 2005).
Dispersión
Más de la mitad de las especies determinadas son dispersadas por la fauna, lo cual no es concordante con lo establecido para el bs-T, donde la anemocoria ha sido propuesta como el síndrome de dispersión predominante (López-Martínez et al. 2013), y aún más en hábitats fragmentados donde la configuración del paisaje favorece los flujos de aire y las semillas transportadas por el viento (Janzen 1988a, Gentry 1995). Sin embargo, un estudio sobre semillas de especies de varios bs-T en Colombia, también encontró mayor cantidad de semillas zoócoras, conformando el 80,35 %, seguida de las semillas anemócoras que solo representaron el 16,07 % de las especies estudiadas (Galindo-Rodríguez 2017).
La predominancia de la zoocoria en ambientes fragmentados puede representar una fuerte limitante a la regeneración natural, ya que usualmente las comunidades de animales dispersores, sobre todo mamíferos, han sido alteradas en los bs-T (Stoner y Timm 2011). Incluso cuando en el área se presenten especies cuyo crecimiento sea favorecido por las condiciones de luz de las pasturas, la ausencia de dispersores puede convertirse en el tensionante principal, y la recolonización solo se verá gradualmente desde los bordes de bosque (Klemens et al. 2011).
Con respecto a los síndromes de dispersión entre elementos del paisaje, el porcentaje de zoocoria fue mucho más alto en los bordes y menor en los parches, lo que permite pensar que los animales dispersores presentes en las áreas de bosque más grandes, no se aventuran a cruzar la matriz (Ceccon et al. 2006), lo que afecta principalmente a especies de semillas grandes (Vargas 2015) como Gustavia verticillata Miers y Pouteria sp., especies únicas de borde. Se espera que el flujo génico hacia sitios más abiertos sea limitado por lo que la restauración activa se vuelve necesaria bajo la estrategia de siembra de especies (Janzen 1988b).
Análisis de correspondencia
Las especies representativas de cada elemento del paisaje parecen estar asociadas a las condiciones microclimáticas que estos ofrecen. Por ejemplo, se observó que la topografía es uno de los factores de mayor importancia en la regeneración, que permite la colonización de especies en lugares con algún tipo de pendiente, como lo son los parches F5, F6 y F7. Éstos mostraron tener mayor cantidad de especies, estructuras más complejas, e incluso especies de sucesión avanzada. En estos sitios, dos de las principales barreras a la regeneración del bosque como son la degradación del suelo (Aide y Cavelier 1994) y la disponibilidad de semillas (Wijdeven y Kuzee 2000), pueden ser superadas, ya que la pendiente permite que el agua se acumule durante las épocas de lluvia, generando en el suelo un régimen hídrico y de nutrientes favorable durante la sequía (Oliveira-Filho et al. 1998, Cabin et al. 2002). La pendiente a su vez limita el aprovechamiento y manejo que puede darse en el área, por lo que estas zonas se recuperan primero y mantienen su cobertura boscosa. Adicional a ello, estos parches se encontraron relativamente cerca a los bordes, que probablemente funcionan como las principales fuentes de semillas (Ceccon et al. 2006).
Los árboles aislados conformaron un grupo muy bien definido (Fig. 4), debido principalmente a que son especies de sucesión avanzada no representadas dentro de los sitios de regeneración como bordes y parches. Esto tiene implicaciones importantes en la conservación de estas especies, ya que las semillas de árboles aislados como Samanea saman (Jacq.) Merr., Pseudosamanea guachapele (Kunth) Harms o Ficus pallida Vahl, no se dispersan ni se establecen en sitios nuevos sin vegetación acompañante (Sandor y Chazdon 2014) lo que pone en riesgo el mantenimiento de sus poblaciones en el largo plazo, como ya ha sido observado para Attalea butyracea (L.f.) Wess. Boer (Vargas 2012).
Implicaciones para la restauración ecológica del bs-T
La restauración de los bosques tropicales debe superar tres barreras o tensionantes principales; la ausencia de fuentes de semillas, la degradación de los suelos y la competencia con gramíneas exóticas (Holl et al. 2000, Cabin et al. 2002). En los bs-T a estos tres tensionantes se suma la disponibilidad de agua durante la época seca, que limita fuertemente la germinación y el establecimiento de las plántulas (Vieira y Scariot 2006). La realización de nuestra propuesta y la selección de especies fue fundamentada en los resultados obtenidos y complementada con literatura sobre restauración de bosques tropicales. El I.V.I y el síndrome de dispersión fueron usados como indicadores de algunos rasgos funcionales, que hacen a determinadas especies más aptas para crecer en algún elemento del paisaje. El tipo de dispersión además permitió establecer una de las principales limitantes a la regeneración y a futuros procesos de restauración. Por último, el DCA permitió establecer ensambles de especies que pueden ir introduciéndose en conjunto dentro de cada una de las fases de las estrategias.
Ampliación de bordes y parches
La ampliación de bordes y parches es una estrategia de restauración asistida, donde se aceleran los procesos de regeneración y la introducción de las especies que normalmente hacen parte de la sucesión (Bonesso y Scariot 2011). De acuerdo con los grupos arrojados por el DCA, la primera fase incluiría especies de los estratos herbáceos y arbustivos como Ocimum campechianun Mill. y Wedelia calycina Rich., para bordes, y Croton hondensis (H.Karst.) G.L. Webster y Croton holtonii Müll. Arg. para parches. Éstas permiten que las especies de la siguiente fase puedan germinar debido a su susceptibilidad a la desecación y el estrés hídrico que genera la matriz de pasturas. Al alcanzar la altura cercana al establecimiento, la cobertura de especies herbáceas se remueve, con tal de evitar competencia por la luz (Ceccon et al. 2002).
Lo más recomendable sería luego introducir especies dominantes según el I.V.I. como E. procera, M. odorata, Machaerium goudoti Benth, para bordes, y Machaerium capote Dugand, Spondias mombin L., y Trichilia pallida Sw., para los parches. Luego se introducen especies con menor I.V.I. como Pouteria sp., y Randia aculeata L., en bordes y Stemmadenia grandiflora (Jacq.) Miers, Cynophalla amplissima (Lam.) Iltis & Cornejo y B. simaruba en los parches.
La alta tasa de crecimiento de las pioneras intermedias permite recuperar la estructura en relativamente pocos años (Kennard 2002), lo que hace posible posteriormente, introducir especies de crecimiento lento o de sucesión tardía (Álvarez-Yépiz et al. 2008). Entre ellas se puede incluir Aspidosperma polyneuron Müll. Arg. y Trichilia oligofoliata M.E.Morales, especies con importante valor de conservación (IUCN c2017), o Ceiba petandra (L.) Gaertn. y Pseudobombax septenatum (Jacq.) Dugand, especies que Aguilar et al. (2016) registraron para bosques maduros en la misma localidad. La ampliación de los bordes y parches debe realizarse sobre sitios planos para introducir especies aisladas como S. saman, y también realizar procesos de enriquecimiento (Griscom et al. 2009) con especies como Monstera adansonii Schott., Passiflora coriacea Juss., Fridericia spp., entre otras.
Nucleación
La estrategia de nucleación consiste en sembrar especies leñosas en arreglos irregulares, con el objetivo de atraer dispersores, aumentar la regeneración y conectar varios núcleos (Carbin y Holl 2012). Los árboles aislados tienen la capacidad de atraer animales que aumentan la deposición de semillas bajo sus copas, además de funcionar como especies facilitadoras aminorando las condiciones extremas de la matriz (Guevara y Van der Maarel 1986). Los árboles aislados presentes en el área de estudio, así como los parches de estructura abierta, son elementos que pueden fácilmente convertirse en núcleos de regeneración, ya que especies como Platymiscium pinnatum (Jacq.) Dugand, Pithecellobium dulce (Roxb.) Benth. y P. guachapele, son reconocidas por su capacidad de fijar nitrógeno y mejorar los ciclos de nutrientes en el suelo (Martínez-Garza et al. 2016). Otros árboles aislados de la familia Moraceae como F. pallida, Maclura tinctoria (L.) Steud. y Sorocea sprucei (Baill.) J.F. Macbr. además, ofrecen recursos alimenticios para la fauna (Mora et al. 2012).
Para bosques secos de Costa Rica, Janzen (1988a) observó el potencial de algunas de las especies aquí mencionadas para la estrategia de nucleación, que con el tiempo forman islas de árboles (parches abiertos) y sirven como puntos de paso a los dispersores voladores. Este potencial debe ser favorecido por la cercanía a fragmentos de bosque que sean fuente de semillas y la exclusión del pastoreo, para así aumentar la probabilidad de que las semillas alcancen estos sitios y las plántulas se establezcan (Sandor y Chazdon 2014).
Inicio de la sucesión en sitios abiertos
Cuando los sitios se encuentran muy lejos de las fuentes de semillas, la restauración se vuelve un proceso difícil y en ocasiones muy costoso (Ceccon 2013). Algunas especies como las del género Sida, pueden crecer en potreros abiertos y lejos de los parches, mientras que especies del género Croton crecen en sitios abiertos, pero siempre cerca de parches o bordes. Ambos géneros componen típicamente rastrojos en matrices ganaderas (Vargas 2015) y están adaptadas a condiciones muy secas (Figueroa y Galeano 2007), además de no ser apetecibles para el ganado. Por esta razón se convierten rápidamente en entramados de maleza y representan una etapa muy temprana de la sucesión, que permite luego el establecimiento de otras especies, como S. mombin, Spondias purpurea L. y Astronium graveolens Jacq. (observación en campo) que parecen ser las únicas especies arbóreas capaces de resistir las condiciones adversas de la matriz.
CONCLUSIONES
En este trabajo se presentó una metodología novedosa para la selección de especies promisorias en la restauración. Si bien los análisis de ordenación son ampliamente usados en estudios florísticos, para este trabajo permitieron realizar algunas inferencias sobre la dinámica y el potencial de regeneración que se presenta en los bosques fragmentados, y cómo pueden éstos aprovecharse en la implementación de estrategias de restauración. Usualmente, la selección de especies es un proceso más empírico y de observación del restaurador en campo, en lugar de un análisis teórico de los criterios para elegir unas especies sobre otras. Sin descartar el importante valor que tienen las actividades prácticas en la restauración, estudios científicos como este pueden reforzar las bases teóricas que permitan mejores decisiones por parte de los actores en estas iniciativas.
Reconocemos que, debido al tipo de muestreo, la aplicabilidad de los resultados se limita al área de estudio o áreas cercanas con condiciones muy similares. La restauración además requiere una revisión profunda de los rasgos funcionales de las especies e incluso de si éstas pueden representar a futuro un recurso sostenible para las comunidades. Aun así, encontramos que áreas muy fragmentadas como el sitio de estudio, guardan una alta calidad del hábitat y un importante potencial, reduciendo los costos de la restauración, factor que representa un limitante muy importante para este proceso en Colombia.