INTRODUCCIÓN
El Bosque Seco Tropical (bs-T) es considerado como uno de los ecosistemas terrestres más amenazados a nivel mundial debido a las elevadas tasas de deforestación y fragmentación, especialmente para la conversión a tierras agrícolas y pastizales (Miles et al. 2006, Quesada et al. 2009, Dirzo et al. 2011, Dryflor et al. 2016). Este ecosistema presenta por tanto importantes retos para su conservación, debido a su rareza, baja representatividad en áreas protegidas y vulnerabilidad en escenarios de cambio climático (García-Millán et al. 2014). Sin embargo, es uno de los ecosistemas menos estudiados, especialmente en comparación con otros ecosistemas tropicales (Portillo-Quintero y Sánchez-Azofeifa 2010) y es poco el conocimiento acerca de su dinámica y composición, primordialmente en el caso de la fauna (Nassar et al. 2014).
En Colombia actualmente persiste menos del 8 % de la distribución original del bs-T que en su mayoría corresponde a relictos de bosque en estados sucesionales tempranos (Pizano y García 2014) y tan sólo el 5 % está representado en el sistema nacional de áreas protegidas (SINAP) (Etter et al. 2018). Este ecosistema también ha sido poco estudiado en el país, aunque recientemente se ha incrementado el número de investigaciones en aves en diferentes regiones (Naranjo 1992, Andrade y Mejía 1998, Rojas y Piragua 2000, Ayerbe-Quiñonez y López-O 2011, Collazos-González y Echeverry-Galvis 2017, Avendaño et al. 2018). Para el valle del río Magdalena los estudios se han centrado en su zona alta y media (Losada-Prado et al. 2005, Losada-Prado y Molina-Martínez 2011, Gómez y Robinson 2014). Mientras la zona sur no cuenta con información actualizada, encontrándose únicamente inventarios aislados (Gómez y Robinson 2014).
En cuanto a la sucesión secundaria, ésta se entiende como un cambio direccional y gradual en la composición, estructura y función de las comunidades en respuesta a un disturbio a gran escala (> 1 ha) (Chazdon 2008). Para el caso de los bs-T casi la totalidad de disturbios son de origen antrópico lo que resulta en un mosaico de bosque en diferentes estados sucesionales (Vieira y Scariot 2006, González-M et al. 2018). La mayoría de estudios sobre el tema en el Neotrópico no han tenido en cuenta otros factores ecológicos como la complejidad de hábitat y cambios en la función que provee la fauna asociada (Almazán-Núñez et al. 2015, Sayer et al. 2017). En este sentido, la ecología funcional permite evaluar la función de las diferentes especies dentro del ecosistema para ayudar a determinar su respuesta a los cambios en su ambiente y predecir las consecuencias de la pérdida de la biodiversidad a mediano y largo plazo (Tilman et al. 1997, Cadotte et al. 2011, Luck et al. 2012).
Para evaluar la diversidad funcional se utilizan características fisiológicas, morfométricas o de historia de vida asociadas a las funciones ecológicas y el desempeño de las especies, ellas son conocidas como rasgos funcionales (Díaz y Cabido 2001), los cuales pueden tomar diferentes valores dependiendo de las variaciones espaciales, temporales o ambientales a lo largo de un gradiente (Violle et al. 2007).
En definitiva, resulta necesario evaluar la relación que presenta la diversidad funcional con los diferentes estados sucesionales de la vegetación, ya que no se conoce la capacidad de recuperación de las comunidades y su papel en los procesos de sucesión secundaria, los cuales son mediados por las funciones que brindan al ecosistema (Sekercioglu 2006, 2012, Gómez y Robinson 2014). En el presente trabajo se analizan los patrones de diversidad taxonómica (DT) y funcional (DF) de la avifauna del bs-T del sur del Huila, departamento de Colombia, en diferentes estados de sucesión vegetal. Se espera que la diversidad taxonómica y funcional sea mayor en estados sucesionales más avanzados y presente una relación directa con la complejidad estructural del hábitat a escala de comunidad, observándose variaciones diferenciables de acuerdo con los grupos funcionales categóricos escogidos (sensu Sekercioglu 2006).
MATERIALES Y MÉTODOS
Área de estudio
El estudio se realizó en el sur del departamento del Huila, Colombia, en el área de compensación ambiental y restauración ecológica de la Central Hidroeléctrica el Quimbo, que comprende 11 079 hectáreas ubicadas entre los municipios de El Agrado, Gigante, Garzón y Paicol (Fig.1). El área se sitúa entre los 720 y 1400 m de altitud, presenta una temperatura media anual de 25 o C y dos temporadas de lluvias en el año, una en los meses de octubre-noviembre y la otra en marzo-abril y una temporada seca muy marcada entre junio y agosto. Las precipitaciones anuales oscilan entre los 800 y 1400 mm (IDEAM, estación 21045010 Betulia) y el ecosistema corresponde a la zona de vida de bosque seco tropical (bs-T) (Holdridge 1967), inmerso en un mosaico de coberturas vegetales en diferentes estadios de sucesión secundaria (García et al. 2014).
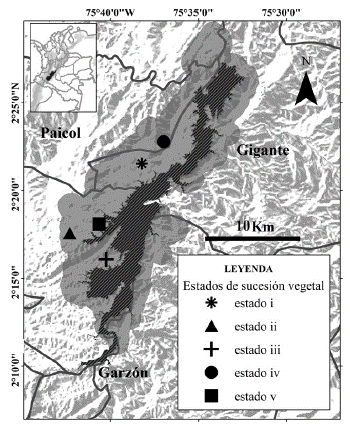
Figura 1 Localización de los sitios de muestreo para la caracterización de avifauna y sus hábitats en los bs-T del sur del valle del Magdalena, Huila, Colombia, Central Hidroeléctrica el Quimbo: embalse (en achurado negro) y área de compensación ambiental y restauración ecológica (gris oscuro). Los estados sucesionales se indican con números romanos del i al v.
Definición de estados sucesionales
Para determinar los estados sucesionales en el área de estudio se empleó el enfoque de cronosecuencia, este método utiliza sitios con diferentes edades de sucesión para examinar cambios en la composición, estructura y función (Chazdon 2008). Aunque este método es el más usado para estudiar la sucesión secundaria y se recomienda su aplicación en el bs-T (Quesada et al. 2009, García-Millán et al. 2014), se le critica porque concibe la sucesión secundaria como un proceso altamente determinístico y lineal, que no incorpora elementos estocásticos e idiosincráticos (Norden et al. 2015). Para abordar estas críticas se consideraron para el estudio localidades con tipos de topografía y suelos similares. Además, la historia de uso del suelo (pastoreo y ganadería) y edades de abandono de actividades productivas (postdisturbio) fueron evaluadas con entrevistas con los pobladores locales. Este enfoque ha sido replicado recientemente en otros bs-T, permitiendo observar cambios estructurales y fisionómicos asociados al estado sucesional (González-M et al. 2018). A continuación, se presenta una descripción breve de los estados sucesionales caracterizados:
i. ) Estados sucesionales tempranos dominados por pastos (58 ha): es el estado sucesional más disturbado, compuesto por matriz de pastos exóticos y nativos en diferentes estados iniciales de sucesión de menos de dos años debido a la ganadería. Sin elementos arbustivos y arbóreos, con baja diversidad y estructura, dominado por gramíneas de las especies Brachiaria decumbens Stapf, Rhynchospora nervosa Vahl, y Andropogon bicornis L, entre otras.
ii. ) Estados sucesionales tempranos dominados por herbazales abiertos (60 ha): presenta abundantes gramíneas y herbáceas como Digitaria cf. horizontalis Will, Hyparrhenia rufa Nees y A. bicornis y en menor medida cactáceas de bajo porte. Con elementos arbustivos de bajo porte tales como Acacia farnesiana (L.) Willd. , Croton glabellus L y Guazuma ulmifolia Lam, debido a un mayor tiempo de abandono (tres a cinco años).
iii. ) Estados sucesionales intermedios de herbazales cerrados (20,4 ha): se considera más avanzado debido a un mayor tiempo de abandono, entre cinco y ocho años, y menor intensidad de uso del suelo. La composición de especies es similar a los estados anteriores, con parches de gramíneas de menor extensión y elementos arbustivos dispersos de G. ulmifolia, A. farnesiana, Chloroleucon mangense Jacq., Machaerium capote Dugand y Pseudosamanea guachapele (Kunth) Harms.
iv. ) Estados sucesionales intermedios de arbustales (33,9 ha): Presenta un tiempo de sucesión mayor, entre diez y veinte años, con mayor estructura vertical y menor cobertura herbácea, con elementos arbustivos y algunos arbóreos propios de formaciones secas como Casearia corymbosa Kunth, G. ulmifolia, M. capote, Croton hibiscifolius Kunth ex Spreng, Guapira pubescens Kunth. Aunque aún persisten especies asociadas a zonas con alta perturbación y estados sucesionales tempranos (e.g. A. farnesiana), son estados importantes para acelerar la sucesión debido a la presencia de especies vegetales dispersadas por animales y de rápido crecimiento que facilitan el reclutamiento de otras especies leñosas (Quesada et al. 2009).
v. ) Estados sucesionales tardíos de bosques (30,5 ha): es el estado sucesional más avanzado que se encuentra en el área. Presenta mayores valores de riqueza, diversidad y una estructura vertical y horizontal más compleja. Con presencia de palmas como Attalea butyracea (Mutis ex L.f.) Wess.Boer y árboles típicos de bosque seco como Anacardium excelsus (Bertero ex Kunth), Spondias mombin L., M. capote, Maclura tinctoria y Bursera simaruba (L.) Sarg además de un sotobosque consolidado. Al igual que en muchas localidades del alto Magdalena, los bs-T del área presentan menores valores de riqueza y área basal y no hay muchas especies de maderas finas como Nectandra turbacensis (Kunth) Nees y Prunus integrifolia (C. Presl) Walp, las cuales fueron extraídas y aprovechadas hace más de 70 años.
Caracterización de la avifauna
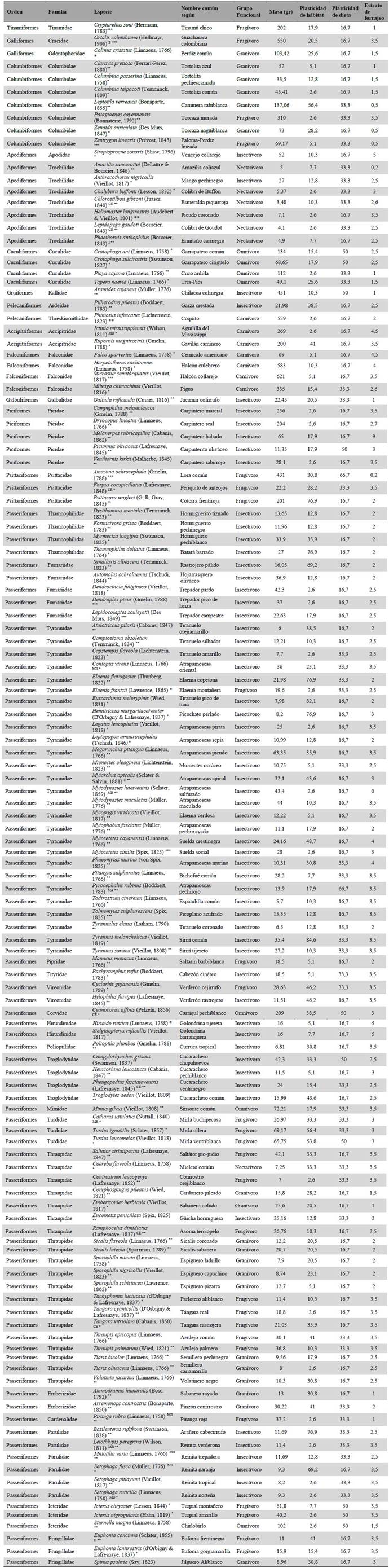
Se establecieron un total de 39 puntos de conteo de radio fijo, ocho para cada estado sucesional evaluado, excepto para el estado iii en el que se establecieron siete puntos debido a particularidades topográficas y una menor área disponible. Los puntos se establecieron de 30m de radio con una distancia mínima de separación de 150 m donde se registraron las aves escuchadas y observadas durante 5 minutos por punto (Ralph et al. 1996). Se utilizaron binoculares 8x42 y una grabadora digital (Sony ICD-PX720) para registros auditivos. Para la identificación visual se usó la guía especializada de Restall et al. (2007). Para los registros auditivos se compararon las grabaciones con la biblioteca sonora en línea Xenocanto (c2018). Estos puntos fueron visitados en cuatro salidas de campo trimestrales entre julio de 2015 y marzo de 2016. En cada salida se dispuso de dos días para el conteo en cada estado sucesional, realizándose dos repeticiones por día, una durante las primeras horas de la mañana (05:20-6:00) hasta las 10:00, y otra en la tarde entre las 16:00 y las 18:00. El número máximo de individuos de una especie registrado en todas las repeticiones de un punto de conteo se tomó como la estimación de los individuos en este punto en particular (Gómez y Robinson 2014). La clasificación de especies, familias y ordenes siguió la propuesta de Remsen et al. c2018. Para los endemismos se siguió a Chaparro-Herrera et al. (2013) y para las categorías de especies migratorias a Naranjo et al. (2012).
Caracterización del hábitat
En enero de 2016 se cuantificaron variables estructurales del hábitat mediante transectos de vegetación de 100 x 5 m ubicados en cada punto de observación empleado para la caracterización de la avifauna. Los transectos se dividieron en cuatro secciones de 20 m (0-20 m, 20-40 m, 40-60 m y 80-100 m), donde se registró el diámetro a la altura del pecho (DAP) y la abundancia y riqueza de plantas leñosas con un DAP > 5cm, área basal, altura estimada de la vegetación, porcentaje de la cobertura herbácea y porcentaje de cobertura de dosel, estas últimas dos variables fueron estimadas con la aplicación móvil Canopeo (Patrignani y Ochsner 2015).
Todas las variables recolectadas en los transectos de vegetación (n=6) fueron transformadas a logaritmo (x +1) y estandarizadas a una media cero y desviación estándar uno. Se realizó un análisis de componentes principales (ACP) donde el primer componente principal (CP1) fue redimensionado a una escala entre cero y uno, el cual se utilizó como una medida de la complejidad de hábitat (CH), donde los valores cercanos a uno indican una mayor complejidad. La CH resume bien los cambios en estructura y riqueza del hábitat de la sucesión secundaria (Raman et al. 1998), y se ha documentado su relación directa con la diversidad de la avifauna en comunidades tropicales (Robinson y Terborg 1997, Díaz et al. 2005, Matlock y Edwards 2006, Meynard y Quinn 2008, Almazán-Núñez et al. 2015, Casas et al. 2016).
Análisis de datos
Se estimó la abundancia y riqueza con el estimador de riqueza propuesto por Chao y Jost (2012), que permite evaluar la completitud del muestreo basado en las especies con una y dos muestras, relacionadas con el número total de individuos. Para comparar la diversidad alfa y evaluar la representatividad de muestreo entre los diferentes estados sucesionales, se utilizaron curvas de rarefacción basadas en el número de individuos y la interpolación/ extrapolación de los números de Hill q0, q1 y q2 (número efectivo de especies) (Chao et al. 2014). Cuando q = 0la diversidad de especies (qD) es equivalente a la riqueza específica y no es sensible a la abundancia. Cuando q = 1, corresponde al valor exponencial del índice de Shannon que representa a las especies comunes en el muestreo. Cuando q = 2, equivale al inverso del índice de Simpson el cual representa a las especies dominantes y que contribuyen proporcionalmente más a la diversidad (Chao et al. 2014).
También se evaluaron los patrones de composición y recambio comunitario de las aves con un escalamiento métrico no dimensional (NMDS por sus siglas en inglés) a partir de una matriz de similitud de abundancia de Bray-Curtis, se exploró si la composición variaba entre los estados de sucesión y si estaba relacionada con la complejidad de hábitat. Las variaciones observadas en el NMDS se confirmaron a posteriori con un análisis de similitud (ANOSIM) de una vía (Clarke y Ainsworth 1993). Para cuantificar la diversidad funcional (DF), se seleccionaron los siguientes rasgos funcionales: masa corporal (g), plasticidad de dieta, plasticidad de hábitat y estrato de forrajeo, estos rasgos están relacionados con las funciones ecosistémicas de las especies, responden a cambios ambientales, son fáciles de medir o se encuentran disponibles en información secundaria (Luck et al. 2012) . La masa es un rasgo relacionado con la tasa metabólica y la contribución de las especies a diferentes funciones en los ecosistemas (López-O et al. 2015). La plasticidad de dieta, plasticidad de hábitat y estrato de forrajeo son rasgos de historia de vida que influencian aspectos relacionados con el comportamiento de forrajeo y flujo de materia y energía en los ecosistemas (Luck et al. 2013). La masa corporal fue obtenida de Dunning (2008), y tanto la plasticidad de dieta como el estrato de forrajeo fueron tomados de Wilman et al. (2014). Estos rasgos categóricos fueron transformados a una escala continua (Luck et al. 2012, 2013) . La plasticidad de dieta se calculó sumando la frecuencia de consumo de los principales ítems alimentarios como frutos, insectos, vertebrados y néctar, dividida entre el número total de ítems consumidos. Para calcular el estrato de forrajeo se utilizó el porcentaje de preferencia de las aves en cada categoría de forrajeo sobre el total de estratos disponibles. La plasticidad de hábitat se calculó igual que la de dieta, sumando la frecuencia de ocurrencia de cada especie en todos los estados sucesionales (Luck et al. 2013). A partir de estos rasgos se calculó la riqueza funcional (FRic) que evalúa la dispersión de las especies en el espacio del rasgo (Violle et al. 2007, Mouchet et al. 2010), y se utilizaron las abundancias de las especies como el valor de ponderación para todo el ensamblaje.
Adicionalmente, las métricas de DF fueron calculadas a escala de grupo funcional. Un grupo funcional es un conjunto de organismos con atributos funcionales similares, que presentan respuestas o efectos similares a factores o procesos de los ecosistemas. Para el estudio se tomaron grupos funcionales categóricos basados en la dieta que son equivalentes a las principales funciones ecosistémicas (Blondel 2003, Sekercioglu et al. 2004, Sekercioglu 2006, 2012) definiéndose seis grupos funcionales a priori: Grupos relacionados con dispersión de semillas y reclutamiento: 1) frugívoros y 2) granívoros; grupos relacionados con control de poblaciones de vertebrados o invertebrados: 3) insectívoros, 4) carnívoros y 5) omnívoros; y grupos relacionados con la polinización: 6) nectarívoros.
Se exploró la relación entre la CH y la diversidad taxonómica (DT) y con la diversidad funcional (DF) mediante correlaciones de Pearson. Para la DT se correlacionaron los valores de los números de Hill y el primer eje del NMDS (recambio y composición), mientras que para la DF se correlacionó con el índice FRic tanto para todo el ensamblaje como para los grupos funcionales. Todos los análisis estadísticos fueron realizados en el lenguaje estadístico R (R Core Team c2018), utilizando los paquetes iNEXT (Hsieh et al. 2016) y Vegan (Oksanen et al. c2018) para la DT y el paquete FD para calcular FRic (Laliberté et al. c2018).
RESULTADOS
Se registraron 127 especies de aves pertenecientes a trece órdenes y 34 familias. Tyrannidae (atrapamoscas) fue la familia más rica con 27 especies, seguida de las tángaras y afines (Thraupidae) con 19 especies; otras familias como Trochilidae (colibríes) y Columbidae (palomas y torcazas) presentaron siete especies cada una, y para las reinitas (Parulidae) se registraron seis especies (Material suplementario - Anexo 1). Entre las especies registradas, se encontraron once migratorias transfronterizas, diez provenientes de Norteamérica (MB) y una del sur de Sudamérica (MA) (Naranjo et al. 2012). Además, se registraron tres especies endémicas (E), que corresponden a la Guacharaca colombiana (Ortalis columbiana Hellmayr, 1906), la Eufonía frentinegra (Euphonia concinna Sclater, 1855) y el Atrapamoscas apical (Myiarchus apicalis Sclater & Salvin, 1881), siete especies casi endémicas (CE) y una especie de interés (I) (Chaparro-Herrera et al. 2013) (Material suplementario - Anexo 1).
Complejidad de hábitat en los diferentes estados sucesionales
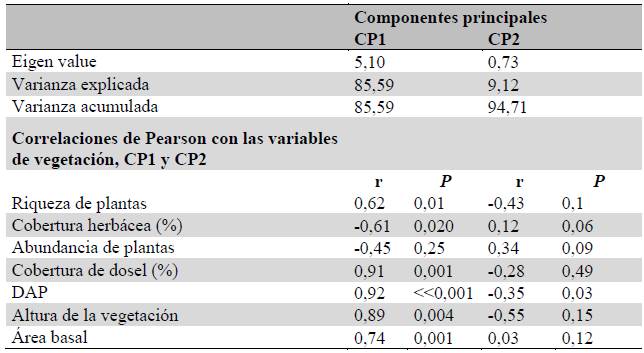
El primer componente principal (CP1) agrupó el 85,59 % de la variación en la complejidad estructural (CH) de las variables de vegetación caracterizadas.
Éste se correlacionó positivamente con la riqueza de plantas leñosas (r = 0,62, P = 0,01), cobertura de dosel (r = 0,91, P = 0,001), DAP (r = 0,92, P «0,001), altura de la vegetación (r = 0,89, P = 0,004) y área basal (r = 0,74, P = 0,001), y negativamente con la cobertura herbácea (r = -0,61, P = 0,02) (Material suplementario - Anexo 2). Observándose un gradiente marcado en donde estados sucesionales más tempranos presentan un menor valor de CH, con un incremento en los estados intermedios y alta superposición de la complejidad estructural entre los estados ii y iii (Fig. 2 y Material suplementario - Anexo 2) .
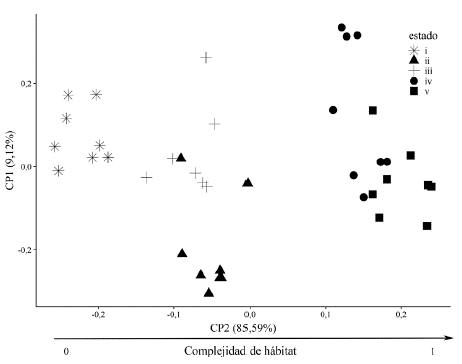
Figura 2 Análisis de componentes principales (ACP) de la complejidad estructural del hábitat (CH) en los diferentes estados sucesionales evaluados; se aprecia el gradiente de complejidad de hábitat de izquierda a derecha a partir el componente principal 1 (CP1) que explica el 85,59 % de la variabilidad.
Patrones de diversidad taxonómica en los diferentes estados sucesionales
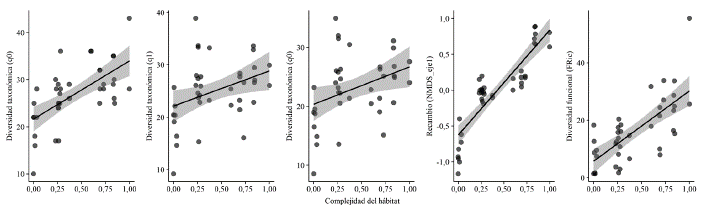
La curva de rarefacción de especies basada en abundancia se acercó a la asíntota para todos los estados de sucesión con una representatividad de muestreo superior al 80 % (estado i 91 %, ii 84 %, iii 80 %, iv 85 %, v 84 %) (Fig. 3). Respecto a la diversidad taxonómica, se observa que aumenta progresivamente para todos los números de Hill (q0, q1, q2), alcanzando valores máximos en el estado v, con excepción del estado ii correspondiente a herbazales abiertos (Fig. 3). El NMDS con distancia Bray-Curtis produjo una solución con un estrés de 0,19, indicando una buena representación de los datos para evaluar diferencias en la composición y recambio de la avifauna (Fig. 4 y Material suplementario - Anexo 3). De esta manera, se observan grupos diferenciados según la CH y el estado sucesional, con mayor solapamiento de la composición de las comunidades entre los estados intermedios (ii, iii y iv), mientras que los estados sucesionales más tempranos (i) y tardíos (v) fueron disímiles en cuanto a su composición. Al evaluar estas tendencias por medio de un ANOSIM, se confirma que hay un efecto de la complejidad de hábitat y el estado sucesional en la composición de las comunidades de aves (R = 0,70, P < 0,01).
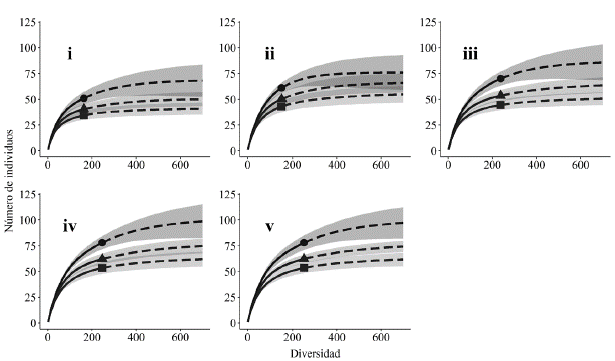
Figura 3 Curvas de rarefacción basadas en el número de individuos para cada estado de sucesión evaluado en el bosque seco tropical (bs-T) del sur del valle del Magdalena. La parte punteada de cada curva representa la extrapolación (diversidad esperada) con el estimador Chao1 y la parte continua la interpolación (diversidad observada). Círculos representan el número de Hill del orden q0, los triángulos del orden q1 y los cuadrados del orden q2. Las áreas sombreadas representan intervalos al 95 % basados en remuestreos de bootstrap. Los estados sucesionales se indican con números romanos i a v.
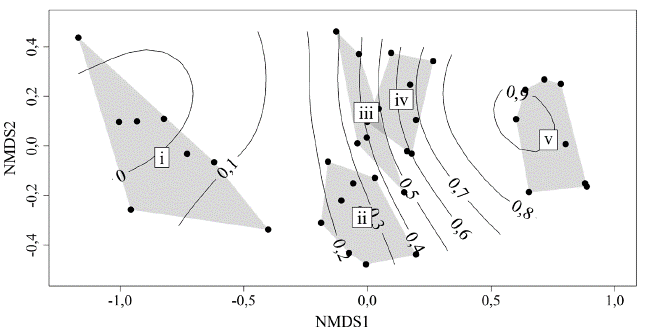
Figura 4 Análisis de escalamiento métrico (NMDS) basado en distancia de similitud de Bray-Curtis, los ejes representan distancias arbitrarias con el fin de evaluar el solapamiento y diferencias de las comunidades de aves. Cada punto corresponde a sitios de muestreo en cada estado de sucesión y las curvas son una superficie ajustada representando la complejidad de hábitat que aumenta de izquierda a derecha (0 a 1). Los estados sucesionales están rodeados por un polígono mínimo convexo y se indican con números romanos i a v.
Relación entre la complejidad de hábitat (CH) y la diversidad taxonómica (DT) y funcional (DF)
Se observó una correlación positiva con el número de Hill de orden q0 (riqueza específica) (R = 0,68, P << 0,01) y los patrones recambio de especies (eje 1 del NMDS) (r = 0,86, P << 0,01) (Fig. 5). Para la DF se observó el mismo patrón con una correlación positiva de FRic con CH (r = 0,70, P << 0,01) (Fig. 5). A nivel de grupos funcionales, se encontró una correlación positiva entre la DT (q0) y CH para frugívoros (r = 0,84, P << 0,01), insectívoros (r = 0,60, P << 0,01), nectarívoros (r = 0,5, P = 0,02) y omnívoros/carnívoros (r = 0,61, P < 0,05). Los granívoros presentaron una correlación negativa (r = -0,71, P < 0,05) disminuyendo significativamente su número de especies a mayor valor de CH. Mientras en el caso de la DF y CH, se observó una correlación positiva únicamente en frugívoros (r = 0,56, P << 0,01) y en menor medida en insectívoros (r = 0,34, P = 0,03).
DISCUSIÓN
En el bosque seco tropical situado en el área sur del valle del Magdalena se registraron un total de 127 especies de aves, estudios en otros bs-T en el centro y norte del valle del Magdalena, registraron hasta 297 especies en 37 localidades del Tolima (Losada-Prado y Molina-Martínez 2011), y 145 especies en seis localidades de Cundinamarca, Tolima y norte del Huila (Gómez y Robinson 2014). Para otras regiones en Colombia con remanentes de bs-T se reportan entre 91 y 212 especies (Ayerbe-Quiñonez y López-O 2011, Collazos-González y Echeverry-Galvis 2017).
Respecto a la complejidad de hábitat (CH), se observó un gradiente que corresponde a los estados sucesionales evaluados (Raman et al. 1998). Se observó que las variables de riqueza de plantas leñosas, área basal, estructura vertical y cobertura del dosel conllevan al aumento de la CH y están típicamente relacionadas con una mayor edad de sucesión (Guariguata y Ostertag 2001, Quesada et al. 2009, González-M et al. 2018). Esta complejidad florística y estructural se relaciona con los patrones de DT y DF, ya que puede existir una mayor disponibilidad de microhábitats y recursos tróficos para las especies de aves, las cuales pueden explotar un mayor número de nichos y en consecuencia diversificarse en estos hábitats más complejos (Robinson y Terborg 1997, Raman et al. 1998, Blake y Loiselle 2001). Los estados sucesionales con mayor CH y edad, aumentan gradualmente tanto en número de especies como en diversidad, en consecuencia, pueden albergar comunidades más disímiles en relación con estados sucesionales más tempranos. Esto permite suponer que la riqueza y diversidad dependen del recambio de especies en el tiempo, observándose una acumulación gradual de especies y variaciones en la composición de las comunidades (Blake y Loiselle 2001). Este aumento en la riqueza, diversidad y recambio de especies en estados sucesionales más avanzados ha sido ampliamente documentado en bosques tropicales (Robinson y Terborgh 1997, Raman et al. 1998, Maldonado-Coelho y Marini 2000, Díaz et al. 2005). El presente estudio es uno de los primeros que evidencia este fenómeno para bs-T, lo cual sucede además en localidades relativamente cercanas entre sí (de 2 a 7 km), por lo cual el estado sucesional podría considerarse como uno de los determinantes principales para el recambio de especies a escala local (Raman et al. 1998). En este orden de ideas, se reportan asociaciones fuertes entre los recambios de comunidades de aves y variables de vegetación como estructura y composición, en bosques tropicales (Jankowski et al. 2013), que favorecen un aumento de la CH en estados sucesionales más complejos (Raman et al. 1998). Sin embargo, existe poca información acerca de las relaciones con la DF y el hábitat medido en una escala continua (Sitters et al. 2016).
En el presente estudio se observó una relación entre la DF y la CH, lo que puede indicar que existe un mayor número de funciones en estados de sucesión más avanzados (Luck et al. 2013, Bregman et al. 2016), pues en teoría, a mayor DF aumenta también la diversidad de los rasgos funcionales, presentándose una mayor partición de los recursos disponibles y observándose un volumen mayor en el espacio funcional (Cadotte et al. 2011, Luck et al. 2013 ). Esto conlleva a una sobredispersión de rasgos, vinculada con una mayor resiliencia y redundancia funcional (Oliver et al. 2015), por lo que las comunidades de aves de estados sucesionales tardíos podrían absorber, amortiguar y resistir más fácilmente los cambios que ocurren después de un disturbio (Bregman et al. 2016).
Por otra parte, la contribución relativa de las especies a los servicios o funciones en el ecosistema puede asociarse a la variación de los rasgos funcionales y cambios en la abundancia (Violle et al. 2007). En el presente estudio, se observaron variaciones en la distribución de los rasgos funcionales dependiendo del estado sucesional, así por ejemplo, muchas de las especies registradas presentan menor masa y variabilidad en su estratificación vertical y mayor plasticidad de hábitat y dieta en estadios sucesionales intermedios como el ii y iii, dominados por herbazales y arbustales con valores intermedios de CH. Mientras que en estados avanzados de sucesión, los valores en la plasticidad de hábitat y dieta disminuyen, presentándose una mayor variabilidad de tamaño corporal y estratificación vertical, lo cual podría estar reflejando una mayor especialización en este tipo de hábitats donde encontramos especies propias de bosque (Gray et al. 2007).
Para los grupos funcionales encontramos correlaciones positivas entre la DT y CH en diferentes estados sucesionales, especialmente con los frugívoros e insectívoros, los cuales en el presente estudio se asociaron a estados sucesionales intermedios y tardíos con valores medios y altos de complejidad (Pearman 2002, Almazán-Núñez et al. 2015). En el Neotrópico, varios estudios reportan que la diversidad de frugívoros e insectívoros se relaciona con la complejidad de hábitat (Sekercioglu 2012, Bregman et al. 2016, Casas et al. 2016), lo cual se reporta también para bosque seco, en relación con estados sucesionales (Nassar et al. 2014, Latta et al. 2018). Por lo general el ensamblaje de especies consumidoras de frutos está dominado por generalistas, cuya flexibilidad les permite habitar todo el año en este tipo de ecosistemas (Gillespie y Walter 2001, Losada-Prado y Molina-Martinez 2011, Gómez y Robinson 2014, Almazán-Nuñez et al. 2015). En el presente estudio se observó que los frugívoros están constituidos principalmente por especies de tángaras pequeñas a medianas, y no se registran frugívoros especializados y de mayor masa corporal como por ejemplo miembros de la familia Ramphastidae (Tucanes) y Cracidae de los géneros Penelope y Crax, que probablemente se extinguieron de los bs-T del valle del Magdalena (Gómez y Robinson 2014). Estos frugívoros obligados además dependen en su mayoría de árboles de gran porte, adecuada cobertura de dosel y disponibilidad de frutos (Arriaga-Weiss et al. 2008), y por lo general disminuyen en hábitats disturbados y fragmentados (Sekercioglu et al. 2002, Sekercioglu 2012, Bregman et al. 2016).
En el caso de insectívoros, carnívoros y omnívoros, estos se asocian principalmente con características estructurales de la vegetación ligadas a requerimientos específicos para búsqueda de presas (Raman et al. 1998, Pearman 2002). La importancia de estos grupos se debe principalmente a su rol como depredadores y en muchos casos a que también actúan como dispersores secundarios de semillas (Wilman et al. 2014). No obstante, se encuentran pocos estudios sobre estos grupos en bosques secos (Maldonado-Coelho y Marini 2000, Nassar et al. 2014). La disminución de la diversidad de estos grupos funcionales en estados sucesionales tempranos de menor
CH, podría indicar que la remoción de algunas características estructurales de sus hábitats tales como la disminución de troncos y árboles caídos, árboles con cavidades para refugio y anidación, así como de especies vegetales de mayor porte, pueden influir tanto en la composición como en la abundancia relativa de estas especies (Raman et al. 1998, Castaño-Villa et al. 2014).
Los nectarívoros por su parte presentaron una asociación menos marcada con la CH, relacionada probablemente con su baja presencia y menor riqueza de plantas leñosas, la mayoría de ellas anemófilas, en estados iniciales de sucesión. La importancia de este grupo funcional está vinculada a la polinización, no obstante, hay pocos estudios que evalúen este grupo funcional en bs-T debido a su baja representatividad en este ecosistema (Gómez y Robinson 2014). Si bien estudios reportan una mayor abundancia de nectarívoros en paisajes fragmentados (Sekercioglu 2012, Sayer et al. 2017), en el presente estudio los estados sucesionales más avanzados y con mayor CH parecen mantener procesos de polinización más estables. De otra parte, para los granívoros la correlación negativa con la CH se reporta para agroecosistemas con diferentes intensidades de uso y fragmentos de bosque en el Neotrópico (Sekercioglu 2006,2012). En el caso de bs-T se consideran al igual que en el presente estudio la mayoría estas especies como de amplia tolerancia, indicando su preferencia de hábitat por áreas abiertas y bordes de bosque (Losada-Prado y Molina-Martinez 2011).
Con respecto a la DF, sólo los frugívoros e insectívoros presentan una correlación positiva con la CH, lo cual se reporta también en ecosistemas tropicales con diferentes intensidades de uso (Bregman et al. 2016). Dentro de los rasgos funcionales de efecto, entendidos como los rasgos que contribuyen al funcionamiento del ecosistema, la plasticidad de dieta es considerada como uno de los más importantes (Newbold et al. 2014), por lo cual el papel de los frugívoros e insectívoros es fundamental en el ecosistema pues contribuyen respectivamente a la dispersión de semillas y control de invertebrados, procesos que se consideran como factores limitantes para la sucesión en ambientes disturbados (Nassar et al. 2014, Bregman et al. 2016). En estados sucesionales tempranos, las especies generalistas juegan un papel importante en la dispersión y control de herbivoría contribuyendo a la recuperación de los ecosistemas (Almazán-Núñez et al. 2015). En el presente estudio, la mayoría de las especies registradas se consideran generalistas lo cual es común en bosques secos debido a la estacionalidad en los recursos que presenta este ecosistema (Losada-Prado y Molina-Martinez 2011, Gómez y Robinson 2014).
En conclusión, la Diversidad Taxonómica y la Diversidad Funcional de la avifauna en remanentes de bosque seco tropical (bs-T) en diferentes estados de sucesión en el sur del Valle del Magdalena, aumentaron en los estados sucesionales avanzados con mayor Complejidad de Hábitat. Esto se observó a nivel de comunidad y en varios grupos funcionales, por lo que el estado sucesional y la Complejidad de Hábitat pueden estar jugando un papel clave en la estructuración de las comunidades de avifauna en el bs-T.