INTRODUCCIÓN
La actividad de los anuros se encuentra en estrecha relación con las condiciones climáticas (Duellman y Trueb 1986). En las regiones de clima templado, con estacionalidad térmica y pluviométrica, la mayoría de las especies se reproducen en la estación cálida y lluviosa (Huang et al. 2004, Sánchez et al. 2007, López et al. 2011). Sin embargo, existen algunos anuros que pueden reproducirse en meses fríos o incluso algunos que muestran una actividad gonadal ininterrumpida y son capaces de reproducirse todo el año (Cei 1948, 1949, Maneyro et al. 2008).
Acorde con la duración del periodo reproductivo, los anfibios pueden ser clasificados como reproductores continuos, si el periodo se extiende a lo largo de todo el año, con hembras grávidas durante la mayor parte del año; reproductores prolongados, cuando la reproducción dura varios meses, sin hembras grávidas en los meses de bajas temperaturas -otoño e invierno-, entre mayo y agosto para el hemisferio sur; o reproductores explosivos cuando la reproducción ocurre durante unos pocos días (Crump 1974, Wells 1977).
El esfuerzo reproductivo puede definirse como la proporción de recursos invertidos por un organismo en la generación de descendencia en relación con los recursos utilizados para mantenimiento y crecimiento durante un periodo determinado (Prado y Haddad 2005). Diferentes autores han registrado una relación positiva entre el tamaño corporal de las hembras y el esfuerzo reproductivo (Castellano et al. 2004, Camargo et al. 2005). La actividad reproductiva demanda una importante cantidad de energía que proviene tanto del consumo de presas durante la temporada de reproducción, como de la energía almacenada en forma de lípidos durante el resto del año (Wells 2001, Solé y Pelz 2007, Antoniazzi et al. 2013). En anfibios, la energía es almacenada en órganos especiales denominados cuerpos grasos (Duellman y Trueb 1986), y es utilizada durante el periodo reproductivo para el crecimiento/maduración de ovarios (Martori et al. 2005); por lo tanto, cabe esperar una relación inversa entre el desarrollo gonadal y el tamaño de los cuerpos grasos.
Boana pulchella (Duméril & Bibron, 1841) y Boana punctata (Schneider, 1799) son dos especies que, aunque se encuentran ampliamente distribuidas en el neotrópico, han sido poco estudiadas desde el aspecto reproductivo (Crump 1974, Basso 1990, Sánchez et al. 2007, 2013, Antoniazzi et al. 2014, Brunetti et al. 2014). Comparten aproximadamente 54 450 km2 de sus respectivas áreas de distribución, principalmente a lo largo del valle de inundación del río Paraná (Fig. 1). Sin embargo, la distribución de B. pulchella (1 268 900 km2) es mucho menor que la de B. punctata (10 826 700 km2) (Kwet et al. c2004, La Marca et al. c2016). La distribución de B. punctata comprende principalmente regiones de clima tropical (cuencas de los ríos Amazonas y Orinoco y parte de la región del Gran Chaco sudamericano), alcanzando climas templados en Argentina gracias a su penetración hacia el sur a lo largo del río Paraná (La Marca et al. c2016). En tanto, la distribución de B. pulchella es más austral, abarcando climas subtropicales al norte, al sureste de Brasil, noreste de Argentina y norte de Uruguay, pero distribuyéndose principalmente en climas templados del sur de Uruguay y la región pampeana Argentina, hasta el sur de la Provincia de Buenos Aires (Kwet et al. c2004). Esta diferencia en la mayor parte del área de distribución de ámbas especies permite suponer el desarrollo de distintas estrategias reproductivas, seleccionadas en ambientes tropicales para B. puncatata y en ambientes templados para B. pulchella.
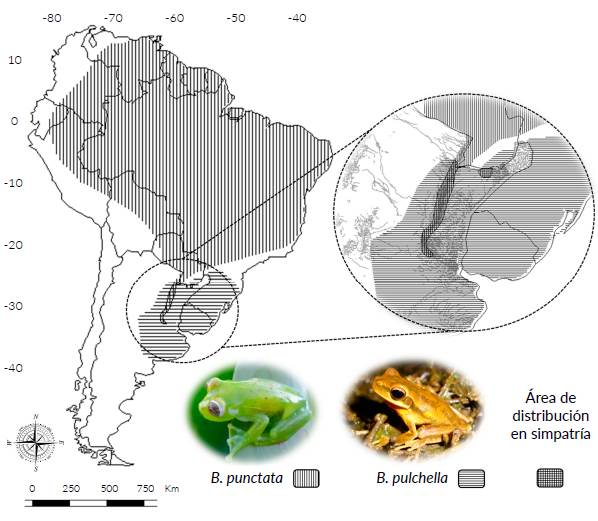
Figura 1 Distribución de Boana pulchella (foto: Antoniazzi C.E.) y de B. punctata (foto: López J.A.).
Los trabajos más recientes han aportado información sobre la distribución espacio-temporal del evento reproductivo de ambas especies (Peltzer y Lajmanovich 2007, Sánchez et al. 2007, 2013), y sobre territorialidad y la selección de pareja en B. pulchella (Brunetti et al. 2014), aunque en ningún estudio se ha explorado la relación entre el desarrollo gonadal y el tamaño de los cuerpos grasos de estas especies. Los trabajos de Crump (1974), Basso (1990) y Antoniazzi et al. (2014) son los únicos estudios que aportan información sobre la inversión reproductiva para poblaciones parapátricas de estas dos especies. La pequeña porción de sus amplias áreas de distribución que Boana pulchella y B. punctata comparten a lo largo del valle de inundación del río Paraná en Argentina (Kwet et al. c2004, La Marca et al. c2016), brinda un contexto adecuado para el estudio comparativo de la biología reproductiva de estas dos especies en condiciones de simpatría, eliminando la presión selectiva ambiental como fuente de las posibles diferencias entre ambas especies en su biología reproductiva, y permitiendo evaluar similitudes y diferencias respecto a las poblaciones parapátricas y que prosperan en condiciones ambientales y climáticas diferentes. De este modo, el objetivo del presente estudio fue la descripción y comparación de las estrategias reproductivas de B. pulchella y B. punctata en poblaciones simpátricas de humedales templados ubicadas en la planicie de inundación del río Paraná Medio, Argentina.
MATERIALES Y MÉTODOS
Ejemplares analizados y área de estudio
Se utilizaron 223 especímenes adultos de B. pulchella, 192 machos y 31 hembras, y 174 especímenes adultos de B. punctata, 84 machos y 90 hembras, de la colección del Grupo de estudio de Anfibios (GA-INALI, Anexo 1 del Material suplementario), del Laboratorio de Biodiversidad y Conservación de Tetrápodos del Instituto Nacional de Limnología (CONICET-UNL), Santa Fe, Argentina. Se seleccionaron los ejemplares correspondientes a los meses de septiembre de 2004 a agosto de 2005 (Anexo 1 del Material complementario). Los ejemplares fueron capturados en seis cuerpos de agua (31°40'Sur - 60°40'Oeste) permanentes de la planicie aluvial del río Paraná Medio en las cercanías de la ciudad de Santa Fe, Provincia de Santa Fe, Argentina, realizando seis salidas a campo mensuales, una por ambiente, durante los doce meses abarcados (Antoniazzi et al. 2013, López et al. 2015). La planicie aluvial del río Paraná Medio constituye un sistema complejo de islas con bosques fluviales, humedales, ríos secundarios, arroyos y lagunas, que cubre unos 20 000 km2 del noreste de Argentina (Drago et al. 2003). La región presenta un clima templado, subhúmedo-húmedo, mesotermal. Los meses más cálidos son de noviembre a marzo, con una temperatura media anual de 18,4 °C. La precipitación anual promedio es de 1000 mm y se produce principalmente entre octubre y abril (Rojas y Saluso 1987).
Metodología de laboratorio
Se midió la longitud hocico-cloaca (LHC) de cada ejemplar con un calibre digital (0,01 mm) y se registró su masa corporal (M) en una balanza digital (0,00001 g). El sexo de cada individuo adulto se determinó mediante el examen de sus gónadas.
Para las comparaciones intra e interespecificas se determinó el periodo de actividad reproductiva de las hembras a partir del grado de desarrollo de las gónadas, siendo consideradas grávidas aquellas que tenían óvulos maduros, es decir, aquellos con presencia de un polo animal y otro vegetal diferenciados (Camargo et al. 2005). Como variables reproductivas de las hembras se determinaron la masa ovárica (MO) considerando el ovario completo, el diámetro de los óvulos (DO), obtenido del promedio del diámetro de 30 óvulos maduros separados al azar en cada hembra grávida y el complemento ovárico (CO) o número total de óvulos maduros de cada hembra grávida, parámetro que representa la fecundidad de esa hembra o su potencial reproductivo. Para calcular el número de óvulos totales se midió la masa de una alícuota del ovario, en la que se contaron los óvulos, y posteriormente se extrapoló ese valor a la masa total del órgano (Martori et al. 2005).
Para probar si existen diferencias en el esfuerzo reproductivo (ER) entre las hembras de B. pulchella y B. puntacta se calculó la proporción de la masa de las gónadas maduras respecto a la masa del cuerpo o masa neta de cada ejemplar. Para ello se empleó el criterio de Perotti (1997), donde ER = MO / (MNC - MO) * 100; siendo MO la masa ovárica y MNC la masa neta de cada hembra grávida sin las gónadas. Para relacionar la fecundidad y el tamaño de los óvulos con respecto al tamaño del cuerpo se empleó el factor de tamaño ovárico (Basso 1990, Perotti 1997): FTO = CO*DO/LHC; donde CO es el promedio del complemento ovárico de las hembras grávidas, DO es el promedio del diámetro de los óvulos maduros del total de hembras y LHC es el promedio de la longitud hocico-cloaca de las hembras grávidas. El promedio del diámetro de los óvulos maduros se obtuvo a partir del total de óvulos maduros medidos para cada especie por época reproductiva. Siguiendo el criterio de Martori et al. (2005), se definieron tres categorías de desarrollo ovárico a partir de la cantidad de vitelo presente en los óvulos: 1) masa indiferenciada: los óvulos no han comenzado a acumular vitelo en su citoplasma y, en el análisis macroscópico, aparecen translúcidos; 2) óvulos inmaduros: se ha iniciado la acumulación de vitelo; el citoplasma se ha tornado opaco y de aspecto lechoso, pero son pequeños; 3) óvulos maduros: aumenta la intensidad del color (claramente amarillo o negro) y el tamaño, distinguiéndose claramente los polos animal y vegetal, indicando que los óvulos han completado su crecimiento y desarrollo. En los machos se estimó el volumen de cada testículo (VT) mediante la fórmula del esferoide (Martori et al. 2005): VT = 4/3*n*L/2*(A/2)2; donde L es el diámetro mayor y A el diámetro menor. Se midió la masa de los dos cuerpos grasos (MCG) de ejemplares de ambos sexos en una balanza digital (0,00001 g) (Vitt y Ohmart 1975).
Tratamiento de los datos
Para evaluar dimorfismo sexual se realizaron pruebas t con el LHC y la M. Para evaluar las diferencias entre meses en los parámetros reproductivos y el desarrollo de cuerpos grasos (la ausencia de cuerpos grasos se consideró como cero: 0 g) de cada especie se utilizaron ANOVAs (post-hoc de Tukey), y ANCOVAs en aquellas comparaciones que incluían machos de B. puncata, ya que se encontraron diferencias entre meses en su M (variación entre meses en M de de machos B. punctata, ANOVA, F4 79 = 5,92; P < 0,01; y de todos los ejemplares de B. puncata, ANOVA, F4 169 = 4,37; P < 0,01). La masa de los ejempleres y su LHC estuvieron fuertemente correlacionadas en ambas especies (B. pulchella: R2 = 0,86, P < 0,001; B. puntata: R2 = 0,90; P < 0,001), por lo que para los ANCOVAs se eligió la M como covariable. Cuando los datos no cumplieron con los supuestos estadísticos necesarios de homoscedasticidad y normalidad para el análisis, se procedió a la transformación logarítmica base 10 de los mismos para mejorar el ajuste de los residuos. En los casos en que la transformación no mejoró el ajuste de los residuos, se utilizaron las pruebas no paramétricas Kruskal-Wallis con post-hoc de Dunn. Para evaluar la relación entre las variables reproductivas y el esfuerzo reproductivo, se realizaron correlaciones de Pearson y Spearman según el cumplimiento de los supuestos estadísticos.
Para comparar las variables reproductivas de las hembras (MO, CO, DO y EF) y machos (VT) entre especies se utilizaron ANCOVAs (utilizando la M como covariable, ya que la M varió significativamente entre especies en hembras, ANOVA, 70 = 206,8; P < 0,001; y en machos, ANOVA, F1, 274 = 301,6; P < 0,001).
Para comparar el desarrollo de los cuerpos grasos entre especies se realizó un ANCOVA con masa de los mismos y considerando su ausencia como masa igual a cero (0 g), utilizando meses como covariable. Para este análisis, se consideraron solo los meses en que co-ocurrieron ambas especies (marzo a mayo; N = 181).
Para analizar si existe una relación entre el desarrollo gonadal (masa ovárica y volumen testicular) y el tamaño de los cuerpos grasos, se realizaron correlaciones de Spearman. Además, se realizaron ANCOVAs para comparar el grado de desarrollo de cuerpos garsos entre machos y hembras de cada especie, utilizando meses y M como cofactores.
Estos análisis fueron implementados mediante los paquetes Car, Dunn test y Hmisc (Fox y Weisberg 2011, Harrell y Dupont 2015, Dinno 2016) del programa R (R Core Team 2018).
RESULTADOS
El tamaño de las hembras de B. pulchella fué significativamente mayor que el de los machos (LHC, t221 = 31,89; P < 0,001; N = 223; M: t221 = 97,29; P < 0,001; N = 223), en tanto en B. punctata el tamaño de los machos fue significativamente mayor que el de las hembras (LHC, t = 16,86; P < 0,001; N = 174; M: t172 = 20,83; P < 0,001; N = 174) (Tabla 1). En B. pulchella el 81 % de las hembras recolectadas presentaron óvulos maduros (N = 25; MO = 1,03 ± 0,59 g) mientras que las restantes (19 %) presentaron óvulos inmaduros (N = 6; MO = 0,09 ± 0,06 g). En B. punctata, el 52 % de las hembras recolectadas presentaron óvulos maduros (N = 47; MO = 0,19 ± 0,12 g), mientras que las restantes (48 %) presentaron óvulos inmaduros (N = 43; MO = 0,04 ± 0,02 g). En ninguna de las dos especies se registraron hembras con masa indiferenciada en sus ovarios. Las hembras de B. pulchella presentaron óvulos maduros en siete de los nueve meses en los que se capturaron ejemplares (Fig. 2). Las hembras de B. punctata fueron capturadas durante cinco meses, desde mediados de verano hasta fines de otoño, registrándose óvulos maduros a lo largo de todo ese periodo (Fig. 2).
Tabla 1 Variables de tamaño, cuerpos grasos y reproductivas, discriminados por sexo de los ejemplares de Boana pulchella y B. punctata.
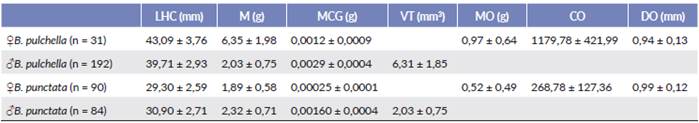
Media aritmética ± desviación estándar de las variables largo hocico-cloaca (LHC), masa (M), masa cuerpos grasos (MCG), volumen testicular (VT), masa ovárica (MO), complemento ovárico (CO), diámetro de los óvulos maduros (DO).
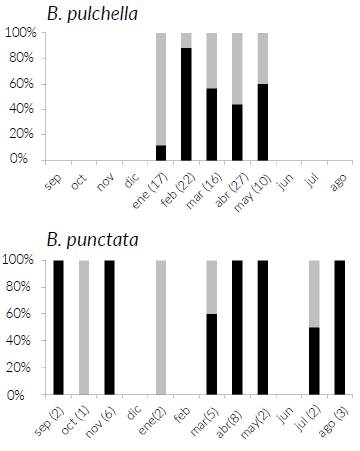
Figura 2 Porcentaje de hembras con óvulos maduros (negro) e inmaduros (gris) por mes para Boana pulchella y B. punctata. Entre paréntesis se indica el número de hembras analizado para cada especie en los meses con capturas.
Se encontraron diferencias en el esfuerzo reproductivo de las hembras grávidas de las dos especies, con una mayor inversión en B. pulchella (ANCOVA, F16,96 = 70 ־; P = 0,01; N = 72; ER = 20,48 ± 12,9 y 10,06 ± 4,45, respectivamente). El FTO fue mayor en B. pulchella que en B. punctata (25,73 y 8,99 respectivamente). En ambas especies se encontró una correlación positiva entre el tamaño de las hembras (M) y las variables reproductivas consideradas (Tabla 2). A su vez, se encontró una correlación positiva entre la masa ovárica (MO) y el número y diámetro de óvulos (DO); pero no hubo una relación significativa entre la cantidad de óvulos y su tamaño (Tabla 2). La masa ovári-ca varió entre meses tanto en B. pulchella y B. punctata (ANOVA, F4 85 = 3,47; P < 0,01; Tukey, feb-ene = P < 0,01; N = 90) (Fig. 3).
Tabla 2 Coeficiente de correlación rho (Spearman) y r (Pearson) entre as variables reproductivas de las hembras grávidas de Boana pulchella y B. punctata.
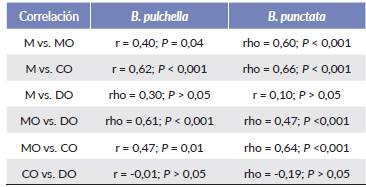
Masa de los ejemplares (M), masa ovárica (MO), complemento ovárico (CO), diámetro de los óvulos maduros (DO), B. punctata (n = 47) y B. pulchella (n = 25)
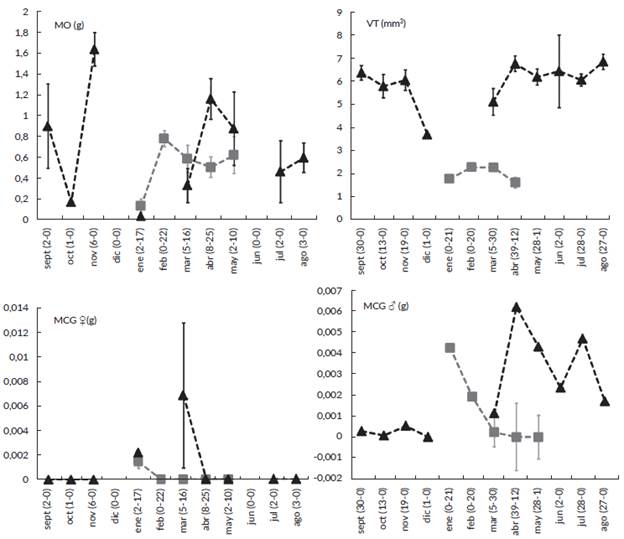
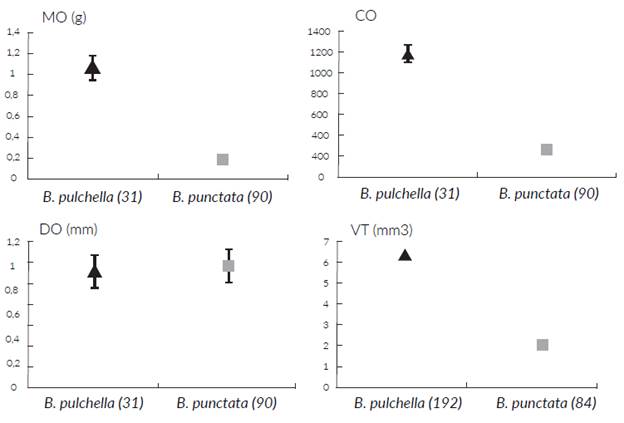
Figura 3 Variación estacional de la masa ovárica (MO), volumen testicular (VT) para Boana pulchella (triángulo negro) y B. punctata (cuadrado gris) y masa de los cuerpos grasos para hembras (MCG $) y machos (MCG S) de ambas especies. Los valores corresponden a media y la barra es el error estándar. Entre paréntesis se brinda el número de ejemplares (B. pulchella-B. punctata) para cada mes.
El volumen testicular (VT) de los machos de B. pulchella no varió significativamente entre meses (ANOVA, F9 182 = 1,20; P > 0,05; N = 192). Sin embargo, sí se encontraron diferencias entre meses en el VT de B. punctata (ANCO-VA, F7 75 = 5,86; P < 0,001; Tukey, feb-abr y mar-abr = P < 0,01, mar-ene = P < 0,05; N = 84) (Fig. 3).
De los 223 ejemplares de B. pulchella, el 64 % presentó cuerpos grasos (CG) con algún grado de desarrollo. No se encontraron diferencias en la masa de los cuerpos grasos entre machos y hembras de B. pulchella (ANCOVA, F1 = 2,51; P > 0,05; N = 223; Tabla 1). La masa media de los CG de machos y hembras juntos fue de 0,0027± 0,0003 g (N = 223). Se encontraron diferencias en la masa de los cuerpos grasos entre meses (Kruskal Wallis, H10 = 48,64; P < 0,01; Dunn, nov-abr, nov-jul, oct-jul y sep-jul = P < 0,01; N = 223). La masa de los CG de hembras no varió entre meses (Fig. 3), pero sí se encontró una diferencia estadística en los machos (Kruskal Wallis, H9 = 55,86; P < 0,01; Dunn, nov-abr, nov-jul, oct-abr, oct-jul, sep-abr y sep-jul, P < 0,01; N = 192) (Fig. 3).
Solo el 32 % de los 174 ejemplares de B. punctata presentó CG. La masa media de los CG en esta especie fue de 0, 0009 ± 0, 0002 g. Se encontraron diferencias en la masa de los cuerpos grasos entre machos y hembras (ANCOVA, F1, 172 = 13,41; P < 0,001; N = 174; Tabla 1). Se encontraron diferencias en la masa de los cuerpos grasos entre meses (ANCOVA, F9, 163 = 17,36; P < 0,01; Tukey, ene-abr, feb-ene, mar-ene y may-ene, P < 0,01; N = 174) (Fig. 3). Se encontraron diferencias entre meses en la masa de los CG en hembras (Kruskal Wallis, H4 = 51,22; P < 0,01; Dunn, ene-abr, feb-ene, mar-ene y may-ene, P < 0,01; N = 90) y en machos (ANCOVA: F7 74 = 8,44; P < 0,01; Tukey: ene-abr, mar-ene, P < 0,01; N = 83). En mayo solo se capturó un ejemplar macho sin CG distinguibles.
En las hembras de ambas especies se encontró una correlación negativa entre la masa de los cuerpos grasos y la masa ovárica (B. pulchella: rho = -0,38; P = 0,001; B. punctata: rho = -0,50; P = 0,004). Sin embargo, en los machos no se contró una correlación entre la masa de los cuerpos graso y el volumen testicular (B. pulchella: rho = -0,12; P > 0,05; B. punctata: rho = -0,10; P > 0,05).
Las especies difirieron en su masa ovárica (ANCOVA, F1> 69 = 112,19; P < 0,001; R2 = 0,67; N total = 72; N B. pul-chella = 25; N B. punctata = 47), complemento ovárico (ANCOVA, F1, 69 = 303.41; P < 0,001; R2 = 0,83; N total = 72; N B. pulchella = 25; N B. punctata = 47), y en su volúmen testicular (ANCOVA, F1> 274 = 918,47; P < 0,001; N = 276; transformación logarímica base 10), siendo estas variables proporcionalmente mayores en B. pulchella. No hubo diferencias en el diámetro de los óvulos (ANCOVA, F1, 69 = 2,37; P > 0,05; N = 72) (Fig. 4). Además, se encontró una diferencia en el grado de desarrollo de los cuerpos grasos entre las dos especies en los meses que se encontraron ejemplares de ambas (ANCOVA, 177 = 30,04; P < 0,001; N = 181; B. pulchella: 0,0004 ± 0,00008 g; B. punctata: 0,000007 ± 0,000003 g) (Fig. 3).
DISCUSIÓN
El dimorfismo sexual fue uno de los pocos puntos en común encontrados en la biología reproductiva de B. pulchella y B. punctata, registrándose diferencias significativas de tamaño entre ambos sexos. Este aspecto se encuentra ampliamente entre los anfibios anuros y no es distintivo del género Boana (Duellman y Trueb 1986, Rodrigues et al. 2003, Quiroga et al. 2004, Martori et al. 2005), y si bien lo más frecuente es que las hembras sean de mayor tamaño, existen excepciones (López et al. 2017), como aquí registrada para B. punctata. Otro aspecto en común, aunque tampoco exclusivo de Boana (Crump 1974, Perotti 1997), fue que las hembras más grandes de ambas especies realizaron una inversión proporcionalmente mayor para la reproducción, confirmada por la correlación positiva entre el tamaño de las hembras y las variables reproductivas consideradas, coincidiendo con lo expuesto por otros autores (Castellano et al. 2004, Camargo et al. 2005). Existiría un cambio en el compromiso evolutivo de inversión en crecimiento versus inversión en reproducción a lo largo de la ontogenia, donde las hembras más jóvenes deben invertir mayor proporción de energía en crecer, mientras que las hembras más viejas, de mayor tamaño, inverten más energía en aumentar la fecundidad (Duellman y Trueb 1986, Tejedo 1992).
En cuanto a las diferencias encontradas, las hembras de B. pulchella realizaron una mayor inversión reproductiva que las de B. punctata. Por otro lado, no se evidenció una segregación temporal en la estación reproductiva, ya que las hembras de B. punctata presentaron mayor actividad vitelogenética desde enero a mayo, coincidiendo con un periodo en el que B. pulchella también mostró actividad vitelogenética, y con la época de mayor actividad reproductiva del ensamble local de especies (Sánchez et al. 2013). Sin embargo, la extensión del periodo reproductivo de B. pulchella, y su posibilidad de reproducirse durante la temporada de bajas temperaturas, llevan a que esta especie segregue parcialmente su periodo reproductivo respecto a B. punctata.
Los machos de B. pulchella presentaron un tamaño testicular constante a lo largo del año, lo que muestra su potencialidad para una reproducción continua. En los meses estivales de enero y febrero, donde no se registra actividad reproductiva de B. pulchella (Sánchez et al. 2013), los testículos podrían encontrase igualmente activos y potencialmente preparados para la reproducción, como se ha informado para otros anuros en regiones templadas (Martori et al. 2005, Quiroga y Sanabria 2012). En tanto, los machos de B. punctata presentaron un crecimiento de los testículos en los meses estivales, pero ellos decrecieron a comienzo del otoño. Esta variación en el tamaño testicular, que indica la temporada de producción de espermatozoides, ha sido registrada para otras especies de anfibios neotropicales (Prado y Haddad 2003, Martori et al. 2005, Maragno y Cechin 2009). En los machos de ninguna de las dos especies se encontró correlación entre el volumen testicular y el desarrollo de los cuerpos grasos, a diferencia de lo ocurrido con los ovarios y los cuerpos grasos de las hembras.
Se ha sugerido que los anuros que viven en zonas templadas exhiben variaciones estacionales de los cuerpos grasos en relación con el período reproductivo y también con su utilización como reservas para la hibernación (Tsiora y Kyriako-poulou-Sklavounou 2002, Martori et al. 2005, Pereira y Maneyro 2012, Antoniazzi et al. 2013). Al estudiar las hembras de Pelophylax epeiroticus (Schneider, Sofianidou, and Kyriakopoulou-Sklavounou, 1984), Tsiora y Kyriakopoulou-Sklavounou (2002) encontraron una relación negativa entre el desarrollo gonadal de hembras y el desarrollo de los cuerpos graso. En las dos especies de Boana aquí analizadas también se encontró una correlacion inversa entre el desarrollo de los cuerpos grasos y el desarrollo gonadal en las hembras. Nuestros resultados, juntos con los antecedentes mencionados en la literatura para especies de otros géneros y familias (Tsiora y Kyriakopoulou-Sklavounou 2002, Martori et al. 2005, Pereira y Maneyro 2012), refuerzan la hipótesis que las hembras de anuros utilizan las reservas lipídicas de los cuerpos grasos para madurar sus gónadas para la temporada de reproducción.
En machos de ambas especies el mayor desarrollo de los cuerpos grasos coincide con sus respectivas estaciones reproductivas (Sánchez et al. 2013). Además, ambas especies se alimentan durante sus estaciones reproductivas, ya sea en verano en B. punctata (López et al. 2002, 2009), o en otoño-invierno en B. pulchella (Solé y Pelz 2007, Antoniazzi et al. 2013). Puesto que los machos se encuentran involucrados en diferentes actividades energéticamente demandantes durante la temporada reproductiva, como establecer y defender sitios de canto y vocalización, entre otros (Pough et al. 1992, Wells 2001, Brunetti et al. 2014), la energía almacenada en los cuerpos grasos de los machos podría ser utilizada para solventar parte del gasto energético requerido durante la actividad reproductiva (Basso 1990, Solé y Pelz 2007, Both et al. 2008), complementando la energía de la alimentación durante la misma estación reproductiva (López et al. 2002, 2009, Solé y Pelz 2007, Antoniazzi et al. 2013).
Considerando que los machos de B. pulchella emiten la vocalización reproductiva durante todo el año (Peltzer y Lajmanovich 2007) y que nuestros resultados mostraron que las gónadas se encuentran también desarrolladas a lo largo de todo el año, puede suponerse para esta especie una potencialidad de reproducción continua (Crump 1974, Wells 1977). En cuanto a B. punctata, considerando que la presencia de machos vocalizando ocurre principalmente entre octubre y marzo (Peltzer y Lajmanovich 2007), y que las gónadas y los cuerpos grasos presentaron un desarrollo estacional, puede suponerse un periodo reproductivo extendido durante todo el verano y hasta principios del otoño, propio de una especie que puede clasificarse como de reproducción prolongada (Crump 1974, Wells 1977).
La población de B. pulchella estudiada presentó una mayor inversión reproductiva que una población de esta especie que habita a mayores latitudes (Basso 1990, Reserva natural integral Punta Lara, 34°47'S - 57°59'O, Provincia de Buenos Aires, Argentina; FTO = 20,17; n = 14). En tanto, las hembras de B. punctata mostraron una menor inversión reproductiva en relación con poblaciones de esta especie que habitan a menores latitudes y en un clima tropical (Crump 1974, Santa Cecilia, 00°05'N, 76°59', Ecuador; FTO = 36,4; n =15). Se destaca que para ambas especies hay mayor inversión reproductiva para las hembras de las poblaciones ubicadas a menor latitud (Crump 1974, Basso 1990, Antoniazzi et al. 2014). Esto podría deberse a un clima más tropical donde existe un mayor acceso a recursos durante todo el año, permitiendo extender el período de la reproducción. Factores climáticos como las precipitaciones y la temperatura, afectan directamente la disponibilidad de alimento, e indirectamente el número y tamaño de los óvulos, mediante la reducción de las reservas lipídicas necesarias para la maduración de las gametas femeninas (Tsiora y Kyriakopoulou-Sklavounou 2002). Aunque deberían analizarse un mayor número de poblaciones a lo largo de un amplio gradiente latitudinal para corroborar si esta observación responde a un patrón consistente, sí puede mencionarse que otras variables reproductivas de anfibios, varían latitudinalmente en función del clima, observándose a mayores latitudes un acortamiento del período reproductivo, la extensión de períodos larvales, el aumento del tamaño de las larvas y de los adultos, una mayor edad a la primer reproducción, un menor número de puestas por año y producción de huevos y posturas más grandes (Morrison y Hero 2003, Lowe et al. 2016). Sin embargo, estas generalizaciones deben considerarse con cautela, debido a la pequeña cantidad de estudios que las respaldan en relación al gran número de especies de anfibios existentes y su gran diversidad de estrategias reproductivas (Crump 1974, 2015).
Mas allá de las poblaciones simpátricas de B. pulchella y B. punctata a lo largo del valle aluvial del río Paraná en sus tramos medio y superior, estas dos especies son parapátricas en un amplio ámbito de sus respectivas distribuciones (Fig. 1): B. pulchella cohabita con B. punctata en solo el 4,2 % de su distribución, lo que representa para B. punctata solo el 0,5 % de su área de distribución. Boana punctata es una especie predominantemente tropical, mientras que B. pulchella se distribuye principalmente en regiones templadas. Además, los parámetros reproductivos informados para poblaciones parapátricas de estas especies muestran una diferenciación en la inversión reproductiva (Crump 1974, Basso 1990), coincidiendo con nuestros resultados. Así, las diferencias encontradas en las poblaciones simpátricas aquí estudiadas, podrían relacionarse con el desarrollo de diferentes estrategias reproductivas entre latitudes tropicales y templadas.