INTRODUCCIÓN
La tortuga verde (Chelonia mydas Linnaeus, 1758) se reproduce y alimenta en varias zonas a lo largo de la línea costera de Venezuela (Rodríguez et al. 2015). De las áreas de alimentación confirmadas para C. mydas el Golfo de Venezuela constituye una de las más importantes de la nación y el Caribe, principalmente por la presencia de praderas de fanerógamas y parches de arrecifes coralinos que proporcionan una gran fuente de alimento para estos animales (Barrios-Garrido y Montiel-Villalobos 2016).
Los principales factores causantes del declive de las poblaciones de tortugas marinas a nivel global son la captura intencional, pesca incidental, cambio climático, modificación y degradación del hábitat (Wallace et al. 2011, IUCN c2015). Entre las amenazas naturales a la supervivencia de estos reptiles se incluyen las causadas por enfermedades, siendo de mayor relevancia las de origen viral como la Fibropapilomatosis y las parasitosis sistémicas causadas por protozoarios y tremátodos vasculares. Estas enfermedades pueden causar alta morbilidad y mortalidad en poblaciones naturales (Jacobson et al. 2006, Flint et al. 2009, Gordon y Johnson c2010, Jones et al. 2016). En el Golfo de Venezuela muchos de estos factores se encuentran presentes, afectando la viabilidad de las poblaciones de tortugas marinas en el área, y en especial de C. mydas por ser esta la especie de mayor frecuencia en la zona (Guada y Solé 2000).
Dentro de las patologías reportadas para C. mydas se encuentran las parasitosis sistémicas (Aguirre et al. 2002, 2006, Greiner 2013), entre ellas las causadas por pro-tozoarios del género Caryospora. Este grupo de proto-zoarios cuenta con más de 30 especies de coccidias de ciclo homoxeno o heteroxeno facultativo que afectan a reptiles y aves depredadoras (Duszynki y Morrow 2014).
Hasta ahora, la única especie registrada de este género que afecta a tortugas marinas es Caryospora cheloniaeLeibovitz et al., 1978 (Rebell et al. 1974). La coccidiosis causada por esta especie es una enfermedad emergente de importancia, que ha sido reportada en tortugas Caguama (Caretta caretta Linnaeus, 1758), pero principalmente en ejemplares de tortuga Verde (Chelonia mydas) (Manire y Montgomery 2014). Esta coccidiosis produce un cuadro clínico complejo, donde se afectan diferentes órganos mayormente el tracto gastrointestinal y el sistema nervioso central (Rebell et al. 1974, Leivobitz et al. 1978, Gordon 2005, Flint et al. 2009, Gordon y Johnson c2010, Manire y Montgomery 2014).
Investigaciones previas sugieren que la presencia de este parásito tiende a ser subestimada debido a lo complejo de su identificación y procesamiento de muestras para identificación (Jacobson et al. 2006, Flint et al. 2009). En los últimos años se han presentado varios casos en la zona del Golfo de Venezuela que según hallazgos clínicos y de laboratorio son compatibles con Caryospora cheloniae, este parásito no había sido reportado previamente en el área, por lo que el presente trabajo tiene como objetivo describir los primeros casos que evidencian la presencia de coccideos intestinales morfológicamente semejantes a Caryospora cheloniae en individuos juveniles de tortuga verde provenientes de pesca artesanal en el Golfo de Venezuela (Caribe sur).
MATERIALES Y MÉTODOS
Área de Estudio
El Sistema de Maracaibo está localizado en la región noroccidental de Venezuela. Esta región presenta una extensión de 12 1823 km2 y está compuesta por cuatro cuerpos de agua íntimamente conectados: Lago de Maracaibo, Estrecho de Maracaibo, Bahía el Tablazo y el Golfo de Venezuela. Este último se encuentra en la porción norte y exterior de dicho sistema (Fig. 1) (Febres y Masciangioli 2000).
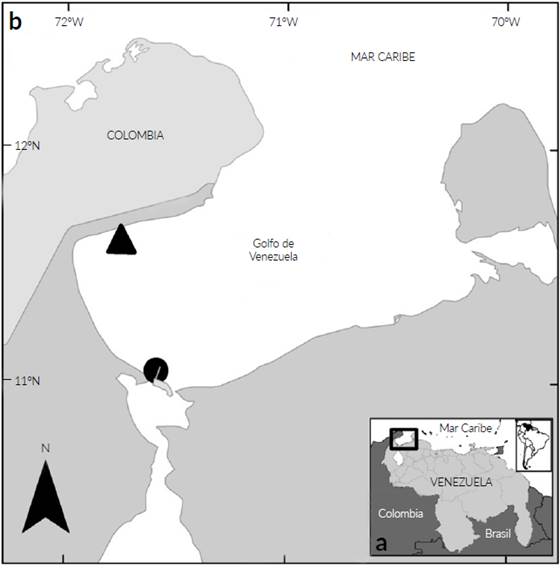
Figura 1 Área de estudio. a. Mapa referencial del país donde se realizó el estudio; b. Ubicación relativa de los poblados donde fueron capturados los individuos estudiados mediante artes de pesca artesanales. (▲) Kazuzain, Municipio Guajira, (•) Bajo San Bernardo, Municipio Insular Padilla, Estado Zulia (ST.ORG c2002).
El Golfo de Venezuela (Fig. 1) presenta una gran diversidad de hábitats que permiten el desarrollo y crecimiento de un número considerable de organismos (Febres y Masciangioli 2000). Además, presenta una zona de surgen-cia que proporciona importantes cantidades de nutrientes los cuales son utilizados por diversos organismos (Rueda-Roa y Muller-Karger 2013).
Animales de estudio
Los ejemplares estudiados se capturaron en dos localidades específicas del Golfo de Venezuela, en el poblado pesquero de Kazuzain (11°37'57" Norte y 71°50'36" Oeste) y en el Bajo San Bernardo (11°00'01" Norte y 71°36'16" Oeste) (Fig. 1).
Para facilitar la identificación de cada individuo y de sus muestras subsecuentes se utilizó la siguiente codificación: Los tres individuos juveniles de tortuga verde (Chelonia mydas) procedentes de la localidad de Kazuzain fueron rotulados como K001, K002, K003, y SB001 el ejemplar proveniente de la localidad de Bajo San Bernardo (Tabla 1). Todos los ejemplares fueron capturados por pesca artesanal y posteriormente rescatados mediante el programa Red de Aviso Oportuno - Zulia (RAO-Zulia), a cargo de la ONG "Grupo de Trabajo en Tortugas Marinas del Golfo de Venezuela (GTTM-GV)" (Barrios-Garrido y Montiel-Villalobos 2016).
Tabla 1 Datos obtenidos de los ejemplares estudiados. Código, Localidad y fecha de captura. Valores morfométricos, peso, y estudios patológicos ,realizados en los individuos de tortuga verde (Chelonia mydas) capturados en el Golfo de Venezuela.
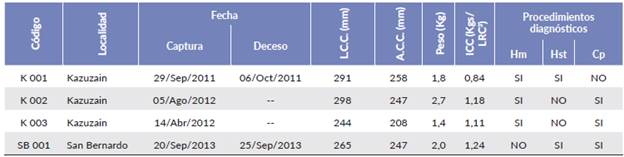
L.C.C = Largo curvo del caparazón, A.C.C= Ancho curvo del caparazón, ICC = Índice de condición corporal, Hm = hematología, Hst = Histopatología, Cp = coprología. Los individuos K002 y K003 fueron liberados luego de 10-15 días en cautiverio.
Los individuos se midieron y pesaron utilizando el método propuesto por Bolten (1999). Empleando ambos datos, se estimó el Índice de Condición Corporal (ICC) utilizado por Limpus (2009) con la fórmula
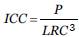 ; donde P es el peso en kilogramos, y LRC es el largo recto de caparazón (milímetros). Este índice permite categorizar a los ejemplares en función del valor obtenido, las categorías aplicadas son: Muy Bien - MB para ICC ≥ 1,20; Bien - BI para ICC entre 1,19 y 1,10, Promedio - PR para ICC entre 1,09 y 1; y la condición Pobre - PO para ICC ≤ 1. Para el cálculo del ICC, inicialmente se transformó el valor de Largo Curvo de Caparazón (LCC) en Largo Recto de Caparazón (LRC) aplicando la fórmula propuesta por Lagueux (1998), donde LRC = (-1,358) +1,002 χ (Lee).
; donde P es el peso en kilogramos, y LRC es el largo recto de caparazón (milímetros). Este índice permite categorizar a los ejemplares en función del valor obtenido, las categorías aplicadas son: Muy Bien - MB para ICC ≥ 1,20; Bien - BI para ICC entre 1,19 y 1,10, Promedio - PR para ICC entre 1,09 y 1; y la condición Pobre - PO para ICC ≤ 1. Para el cálculo del ICC, inicialmente se transformó el valor de Largo Curvo de Caparazón (LCC) en Largo Recto de Caparazón (LRC) aplicando la fórmula propuesta por Lagueux (1998), donde LRC = (-1,358) +1,002 χ (Lee).
Todas las evaluaciones clínicas, incluyendo examen físico, actividad natatoria, comportamiento dentro y fuera del agua, e ingesta de comida, fueron realizadas en la ciudad de Maracaibo siguiendo el protocolo de evaluación clínica completa propuesto por Casal et al. (2009). Las tortugas se mantuvieron en tanques de plástico redondos con capacidad de 300 Litros. Debido a la poca disponibilidad para acceder a grandes cantidades de sal industrial o artesanal, los ejemplares se mantuvieron en agua dulce por períodos no mayores a los 15 días.
Se suministraron soluciones cristaloides isotónicas por vía intracelómica a dosis de mantenimiento 10 ml/kg cada 24 horas durante cinco días a los ejemplares que presentaron signos de deshidratación (Mader 2005), de igual manera durante este período se realizaron diferentes pruebas diagnósticas.
Recolección y procesamiento de muestras
Se extrajo sangre a los ejemplares K001, K002 y K003 y se les realizó hematología completa (Owen y Ruiz 1980, NMFSSFSC 2008) en el laboratorio de la Policlínica Veterinaria de La Universidad del Zulia. Sólo a K002 se le realizó un frotis de capa blanca con la finalidad de evaluar la presencia de zoitos en leucocitos (Rose c2005). El cuarto animal (SB001) murió antes tomar muestra de sangre.
Se recolectaron heces de los ejemplares K002, K003 y SB001 del tanque para estudio. Se realizaron exámenes directo y de flotación (Dryden et al. 2005, Innis et al. 2010), las heces de SB001 se usaron con el fin de obtener la espo-rulación del parásito, empleando la metodología descrita por Gordon et al. (1993). En una placa de Petri se sembró un estimado de 2-3 gramos de heces refrigeradas con 20 mL de la solución salina preparada. En otra placa con 20 mL de la solución se sembraron heces tomadas del intestino post necropsia. Las fotografías microscópicas se realizaron con un microscopio Olympus CX41. La medición de los parásitos se utilizó una escala micrométrica, y el software ImageJ (Collins 2007).
Finalmente, los ejemplares K002 y K003 fueron liberados, posteriores a su mejoría clínica y por no contar con instalaciones adecuadas para su manejo en cautividad. Mientras que K001 y SB001 murieron durante la primera semana de cautividad.
Estudios anatómico-patológicos
De los ejemplares K001 y SB001 se realizaron estudios anatómico-patológicos post-mortem correspondientes siguiendo la metodología propuesta por Wyneken (2001) y Phelan y Eckert (2006). Se recolectaron muestras de tejido estomacal, intestino delgado y grueso, músculo, bazo, encéfalo, riñón, esófago, páncreas, pulmón y corazón (aprox. 2 cm3), seguidamente fueron fijados en formalina al 10 %, para luego trasladarlas al laboratorio para análisis histopatológico. La variabilidad en la toma de muestras y exámenes realizados a cada animal se debió a la falta de insumos necesarios al momento de la recolección y procesamiento de muestras o tejidos.
RESULTADOS
Todos los ejemplares juveniles de tortuga verde Chelonia mydas presentaron hallazgos coprológicos, hematológicos o histopatológicos que evidencian la presencia de organismos compatibles con Caryosporasp. (Apicomplexa: Eimeriorina) (Tabla 1). Constituyendo estos los primeros reportes de coccidiosis en tortugas marinas en Venezuela, y la zona sur del Mar Caribe.
Hallazgos clínicos
Dos de los individuos (K001 y K002) presentaron signos nerviosos marcados, como cabeza ladeada, movimientos involuntarios de aletas y cabeza, movimientos natatorios circulares, además de hiperestesia, temblores, fasciculaciones y depresión. Uno de estos ejemplares también presentó problemas de flotabilidad y postura anormal de descanso. El ejemplar SB001 solo presentó depresión, des-hidratación leve y luego muerte súbita. K003 no presentó ningún tipo de sintomatología, solo algunas escoriaciones en las aletas, la observación de ooquistes en este animal fue un hallazgo incidental, durante los exámenes de rutina, previos a su liberación. En general, tres de los cuatro animales estudiados presentaron buena o muy buena condición corporal, basándonos en los valores de Índice de Condición Corporal (ICC). Solo K001 presentó un valor de ICC categorizado como Pobre (ICCK001= 0,84) (Tabla 1).
Hallazgos del estudio coprológico
Los individuos K002, K003 y SB001 mostraron formas parasitarias morfológicamente semejantes a ooquistes no esporulados de Caryospora cheloniae en moderada cantidad, tanto en el examen directo como en el de flotación (Fig. 2a). Dichos ooquistes presentaron forma elipsoidal alargada, en algunos casos curva, paredes suaves y el espacio interior ocupado por un material granulado de color verdoso. El tamaño promedio de los ooquistes fue de 35,50 micrómetros de largo, SD = 6,43 (mínimo = 26,45 micrómetros; máximo = 49,80 micrómetros) y 15,53 micrómetros de ancho, SD = 1,48 (mínimo = 12,47; máximo = 17,81).
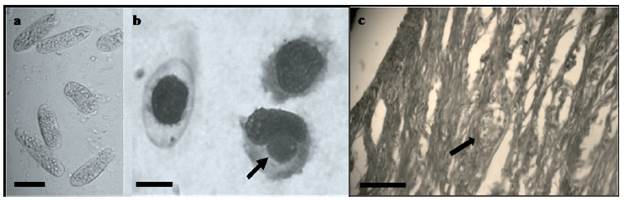
Figura 2 Vistas histológicas de coccidios encontrados en ejemplares de juveniles de Chelonia mydas en el Golfo de Venezuela. a. Ooquistes no espo-rulados en muestras de heces; b. Zoitos (flechas) en monocitos y linfocitos, muestras de sangre del ejemplar K002. Tinción "Dip Quick Stain"; c. tejido intestinal del individuo K001. Las flechas indican la presencia de diferentes estadios de estructuras semejantes a Caryospora sp. Escalas en a = 40 μ, en b y c = 60 μ. Fotos: M. C. Alvarado.
Hallazgos hematológicos
De manera general, la morfología y valores de los eritrocitos y leucocitos observados en la tortuga K001 se encontraron entre los intervalos de referencia (Tabla 2). K002 presentó linfocitos reactivos escasos, eosinofilia e hipoproteinemia. Además, en este individuo se encontraron con relativa frecuencia estructuras similares a zoitos de Caryospora sp. en linfocitos y monocitos circulantes en frotis de capa blanca (Fig. 2b). El ejemplar K003 a pesar de ser un animal asintomático, presentó anemia, leucopenia e hipo-proteinemia hallazgos que podrían presentarse en casos de anorexia prolongada, enfermedades infecto-contagiosas, intoxicación, inmunosupresión, entre otros.
Tabla 2 Valores hematológicos de los ejemplares de tortuga verde (Chelonia mydas) con ooquistes coccidiales en el Golfo de Venezuela.
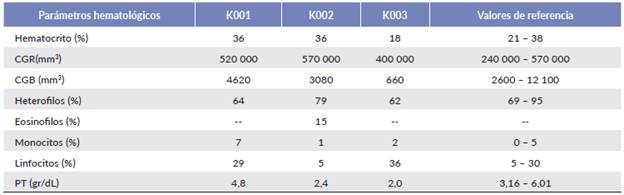
CGR = Conteo de glóbulos rojos (mm3), CGB = Conteo de glóbulos blancos (mm3), PT = Proteínas totales (gramos/deciLitros - gr/dL). Valores hematológicos normales referenciales de la especie Cheloniamydas tomados de Montilla et al. (2006)
Hallazgos histopatológicos
A nivel macroscópico el hallazgo más resaltante fue el engrosamiento y congestión de las paredes del intestino en K001 (Fig. 3). En este ejemplar a nivel microscópico se presentaron indicios de miocardiopatía degenerativa multifocal severa, hepatopatía hemorrágica tóxica y enteritis necrótica moderada en intestino anterior y posterior, caracterizada por la presencia de vellosidades atrofiadas o fusionadas, erosión del epitelio, necrosis e infiltración linfocitaria. El cerebro no pudo ser evaluado en este ejemplar.
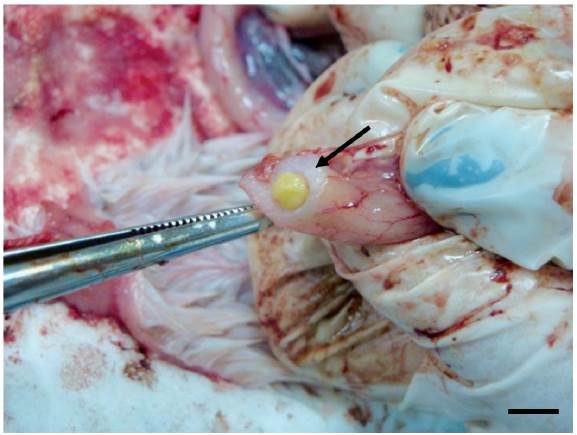
Figura 3 Secciones de intestino delgado del ejemplar K001. Flecha indica engrosamiento de las paredes intestinales. Escala = 1 cm. Foto: B. Conde.
En el individuo SB001 todos los órganos evaluados se encontraron normales, incluyendo cerebro, solo el intestino presentó una enteritis linfocítica multifocal leve. En ambos ejemplares a nivel intestinal, se observaron numerosos cuerpos cilíndricos, elipsoidales u ovoides y en ocasiones redondeados, de pared delgada, bien definida y un cuerpo central nucleado rodeado por un halo o corona ópticamente vacía, no coloreada. Estos cuerpos se observaron libres en el lumen intestinal o invadiendo la región inferior del corion de la mucosa y la región superficial de la muscular propia. La morfología de estos cuerpos fue compatible con estadios parasitarios de agentes coccidiales, semejantes a Caryospora cheloniae (Fig. 2c).
DISCUSIÓN
Se registran por vez primera en el Golfo de Venezuela casos clínicos asociados a la presencia de coccidiosis intestinal en juveniles de tortuga verde. Las descripciones morfológicas, sintomáticas y clínicas presentadas por los cuatro animales estudiados coinciden con las características reportadas para Caryospora cheloniae por Rebell et al. (1974), Leibovitz et al. (1978), Gordon et al. (1993), Gordon (2005), Rose (c2005), Gordon y Johnson (c2010), Pelton et al. (2013), Grillo et al. (2014) y Manire y Montgomery (2014). Desde la publicación del primer reporte de este organismo en 1974, el diagnóstico de Caryospora cheloniae se ha basado principalmente en la observación de ooquistes en heces, detección de estadios coccidiales en tejidos, y en las características morfológicas distintivas de los ooquistes esporulados en forma de estrella de ocho puntas (Gordon et al. 1993, Gordon y Johnson c2010).
Recientemente se han comenzado a realizar trabajos a nivel molecular con el objetivo de lograr una identificación precisa del agente (Pelton et al. 2013, Chapman et al. 2016). Según estudios de secuenciación y análisis filogenéticos realizados en Queensland (Australia), hasta el presente se han hallado dos genotipos en las tortugas afectadas por coccidiosis intestinal, lo que sugiere la presencia de dos especies, una cercana a la familia Lankesterellidae y otra a la Eimeriidae (Chapman et al. 2016). En Estados Unidos, Pelton et al. (2013) mediante secuenciamiento de ADN usando reacción PCR estudiaron que el agente coccidial afectando a las tortugas pertenecía a la familia Eimeriidae. Estos dos estudios son los únicos que refieren el uso de técnicas moleculares para el diagnóstico de Caryospora y son definidos por sus propios autores como trabajos exploratorios.
En este reporte la identificación del parasito se realizó con base en las características morfológicas de los ooquistes no esporulados debido a que no fue posible lograr el proceso de esporulación por un inadecuado manejo de las muestras. El uso de técnicas coprológicas como único método diagnóstico puede conllevar a errores de identificación, especialmente cuando se requiere diferenciar ooquistes de especies similares (Chapman et al. 2016), por lo que es prioritario para futuros trabajos utilizar técnicas moleculares para la correcta identificación del organismo.
En el presente estudio los casos de coccidiosis se presentaron en diferentes años y épocas. Esto último es similar a lo registrado por Greiner (2013), Pelton et al. (2013) y Manire y Montgomery (2014) para Florida; mientras en Australia, la enfermedad se presenta en forma de epizootias, de manera cíclica, y está generalmente relacionada con los meses posteriores al invierno austral (Tabla 3), entre los meses de agosto-noviembre (Flint et al. 2009).
Tabla 3 Origen, ubicación geográfica, grupo etario y forma de presentación de la enfermedad en ejemplares de tortuga verde (Chelonia mydas) con estructuras coccidiales en el Golfo de Venezuela y anteriores investigaciones realizadas en América y Australia.
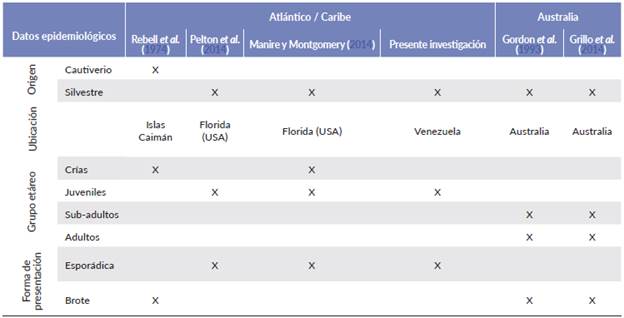
Los individuos donde se evidenció la presencia de ooquistes morfológicamente compatibles con Caryospora cheloniae fueron juveniles (LCC: media = 27,45 cm, DE = 2,479; intervalo = 24,4-29,1) lo que coincide con el comportamiento de la enfermedad en el Océano Atlántico (Rebell et al. 1974, Pelton et al. 2013, Manire y Montgomery 2014). Por otro lado, en Australia, Caryospora se ha observado por lo general en tortugas con medidas de LCC que superan los 70,0 cm lo que corresponde a ejemplares sub-adultos y adultos (Gordon et al. 1993, Flint et al. 2009, Grillo et al. 2014, Chapman et al. 2016) (Tabla 3).
Hasta la fecha solo se habían determinado como causas de muerte o enfermedad en las especies de tortugas presentes en la zona de estudio, patologías como fibropapilomatosis, obstrucciones gastrointestinales y traumatismos (Montiel-Villalobos et al. 2008, Espinoza-Rodríguez y Barrios-Garrido 2012). La observación de lesiones en intestino y organismos semejantes a coccidias en el estudio histopatológico de una tortuga juvenil (K001) condujo a la primera sospecha de la presencia de Caryosporacheloniae en el área (Duszynki y Morrow 2014). A partir de allí se comenzaron a realizar estudios clínicos y de laboratorio en otros especímenes con sintomatología similar que llevaron posteriormente a la realización de la presente investigación.
Así mismo, se observaron diferentes manifestaciones clínicas en las tortugas con el parásito, dentro de las más importantes estuvieron las afectaciones sistémicas de carácter nervioso, leves afectaciones del tracto gastrointestinal, y buena condición corporal al momento del diagnóstico. Este cuadro clínico coincide con lo reportado durante las epizootias ocurridas en Australia (Gordon et al. 1993, Gordon 2005, Rose c2005, Gordon y Johnson c2010, Grillo et al. 2014, Chapman et al. 2016), y se diferencia del brote reportado por Rebell et al. (1974), en el cual la letargia, emaciación y afectación intestinal fueron las manifestaciones clínicas típicas, en ausencia de signos nerviosos. Uno de los animales de estudio mostró problemas de flotabilidad, este hallazgo concuerda con lo encontrado por Pelton et al. (2013), en dos juveniles de tortuga verde afectadas por Caryospora cheloniae en Carolina del Sur, en EE. UU.
En dos de las tortugas estudiadas (SB001 y K003) la observación de ooquistes en las heces fue un hallazgo incidental durante los exámenes de rutina realizados a todos los animales rescatados por la Organización No Gubernamental GTTM-GV, estos ejemplares no presentaron signos asociados a Caryospora. Aunque SB001 murió pocos días después de ser rescatada, las causas de su muerte no pudieron ser atribuidas a la presencia del parásito, estos hallazgos sugieren que las tortugas presentaban la enfermedad de forma subclínica. Otros autores coinciden en la observación de ooquistes en animales asintomáticos como Gordon (2005) en Australia y Greiner (2013) en Florida; este último en un estudio coprológico realizado en animales muertos por otras causas registró que el 22 % de ellos tenían ooquistes de Caryospora en el tracto gastrointestinal, sin lesiones en intestino u otros órganos, sugiriendo un estado subclínico de la enfermedad (Gordon 2005).
Con respecto a la evaluación hematológica, la mayoría de los valores encontrados estuvieron dentro del intervalo fisiológico considerado normal para la especie (Bolten y Bjorndal 1992, Aguirre et al. 1995, Montilla Fuenmayor et al. 2006); sólo uno de los animales (SB001) presentó anemia e hipoproteinemia, hallazgos que podrían ser asociados a carencias nutricionales, debilidad o enfermedades crónicas (Stahl 2006); mencionado animal murió pocos días después por causas indeterminadas.
De las dos tortugas clínicamente enfermas, sólo K002 pudo ser evaluada hematológicamente. Este ejemplar (K002) presentó hipoproteinemia y ligera eosinofilia, estos hallazgos se asocian a parasitosis; sin embargo, el hallazgo más relevante fue la observación de zoitos de Caryospora cheloniae. La presentación de zoitos en leucocitos circulantes solo ha sido evidenciada anteriormente por Rose (c2005) como un signo de coccidiosis sistémica y fue usado como un indicador de pronóstico desfavorable en las tortugas afectadas, esto debido a que frecuentemente los animales con signos neurológicos y zoitos circulantes presentaron en la necropsia lesiones inflamatorias severas en el sistema nervioso central (Rose obs. pers.).
Aunque no hay evidencia histológica que confirme que las alteraciones neurológicas en ambos ejemplares se deben a Caryospora, los hallazgos coprológicos y hematológicos, el cuadro clínico característico y la ausencia de cualquier otra causa conocida que pudiera conllevar a esta manifestación clínica, sugieren que ocurren a consecuencia de la infección por Caryospora.
En este estudio las lesiones presentes en el tejido asociadas a la presencia de organismos coccidiales, semejantes a Caryospora cheloniae, estuvieron circunscritas al intestino. Casos similares fueron evidenciados por Rebell et al. (1974) durante la epidemia que tuvo lugar en las Islas Caimán. En los dos ejemplares a los que se les realizó histopatología (K001 y SB001) se observaron cuerpos elipsoidales en varias secciones de intestino que sugieren a presencia de macrogametos y trofozoitos inmaduros de estadios coccidiales, compatibles con Caryospora, y acompañados a su vez de atrofia de vellosidades, enteritis necrótica e infiltración linfocitaria multifocal.
En ningún otro órgano se evidenció al parásito, aunque es necesario recalcar que el cerebro de los animales que presentaron sintomatología nerviosa no pudo ser evaluado. Estos resultados difieren de lo reportado en las epizootias ocurridas en Australia, donde varios autores señalan la presencia Caryospora asociada o no a inflamación granulomatosa en órganos tales como, intestino, cerebro, tiroides, riñón, glándula adrenal, vejiga, estómago y pulmón (Gordon et al. 1993, Gordon 2005, Rose c2005, Flint et al. 2009, Gordon y Johnson c2010, Grillo et al. 2014, Chapman et al. 2016).
Este trabajo brinda nuevos aportes para conocer la enfermedad, se registra una nueva localidad, así como un nuevo grupo etario, individuos juveniles, afectado por coccidios intestinales de forma sistémica, con cuadros clínicos semejantes a los estudiados anteriormente en otras localidades. Además, se evidencia por segunda vez zoitos en leucocitos circulantes.















