INTRODUCCIÓN
Los páramos se caracterizan por sus altos niveles de diversidad y endemismo de especies (Balslev y Luteyn 1992, Luteyn 1999), aproximadamente cubren el 6 % de la superficie (1 250 000 hectáreas) del Ecuador y se caracterizan por sus bajas temperaturas, alta incidencia de neblina, irradiación solar y aridez fisiológica, con lo que se crea un ambiente de estrés para la biodiversidad de flora y fauna (Mena-Vásconez et al. 2001). Estos ecosistemas desempeñan un papel clave en la regulación hidrológica, además constituyen la fuente de agua para consumo humano, riego y generación de energía hidroeléctrica (Mena-Vásconez et al. 2001, Buytaert et al. 2006). En la actualidad son uno de los ecosistemas más amenazados, debido a malas prácticas agrícolas, quemas, minería y mal uso del recurso hídrico y cambio climático que han provocado un deterioro de su funcionalidad (Hofstede 2001, Hofstede et al. 2003, Beltrán et al. 2009).
En estos ecosistemas los briófitos son muy diversos, con más de 800 especies reportadas (e.g, Gradstein 1998, 1999, in prep., Churchill y Griffin 1999, Churchill c2019). Estos organismos por sus características fisiológicas relacionadas con la pérdida y captación de agua (organismos poiquilohídricos) son muy sensibles a las alteraciones en el ambiente (Gradstein et al. 2001), por lo que se han utilizado como indicadores de conversión de bosques, cambios ambientales y calentamiento global (Gignac 2001, Nöske et al. 2008, Benítez et al. 2015). De manera general los briófitos se encuentran directamente condicionados por factores macroclimáticos, por ejemplo, altitud y precipitación (Sun et al. 2013, González et al. 2017), estructura del bosque y microclima (Mandl et al. 2010); adicionalmente, variables topográficas como pendiente, orientación y de suelo como pH, humedad, materia orgánica también son factores limitantes para estos organismos (Eldridge y Tozer 1997, Benavides et al. 2006, Mandl et al. 2009, Castillo-Monroy et al. 2016).
A pesar de ello, la mayor parte de estudios a nivel de Ecuador se han enfocado en analizar la relación de la diversidad de plantas vasculares y los factores ambientales y topográficos en estos ecosistemas (Ramsay y Oxley 1996, Sklenár y Ramsay 2001, Sklenár y Balslev 2005, Anthelme y Dangles 2012, Matson y Bart 2014). En cuanto a briófitos terrícolas y su relación con factores ambientales y topográficos, los estudios realizados hasta el momento son muy limitados y se han restringido a bosques de neblina montanos (Mandl et al. 2009), y solo un estudio en los páramos de Ecuador señala que los gradientes altitudinales implican cambios macroclimáticos que pueden afectar la diversidad de líquenes y briófitos (González et al. 2017). Por ello, nuestro estudio es un aporte importante para determinar cambios en la composición de briófitos terrícolas en tres cimas (CIA a 3270 m, CIB a 3320 m y CIC a 3400 m de altitud), relacionados con la precipitación y topografía en el páramo de Cajanuma del Parque Nacional Podocarpus. Específicamente buscamos responder a las siguientes preguntas: 1. ¿Existen diferencias en la composición de briófitos terrícolas en las tres localidades evaluadas? y 2. ¿Cuáles factores ambientales y topográficos influyen en la composición de briófitos terrícolas en dichas localidades?
MATERIALES Y MÉTODOS
Área de Estudio
La investigación se llevó a cabo en tres cimas del páramo del Parque Nacional Podocarpus de la cordillera oriental de los Andes (PNP). La temperatura oscila diariamente entre 3 °C y 10 °C y con precipitaciones mínimas entre 2000 y 4000 mm, y con máximas de entre 5000 y 6000 mm. Las tres cimas ocupan una superficie aproximada de 6136,4 m2 y forman parte del proyecto de investigación: "Monitoreo a largo plazo del impacto del cambio climático en la biodiversidad de los ecosistemas de páramo del Parque Nacional Podocarpus (MICCAMBIO)" (Aguirre et al. 2015, Fig. 1).

Figura 1 Área de estudio nostrando cada una de las ־ cimas (CIA = cima A, CIB =cima B, CIC = cima C)
En cuanto a flora vascular, la cima A (CIA, 3270 m), registró 58 especies, 28 familias y 765 individuos, las especies con mayor índice de valor de importancia corresponde a Puya nitida Mez, Hypericum lancioides Cuatrecv Tillandsia aequatorialis L.B. Sm., Calamagrostis macrophylla (Pilg.) Pilg., Themistoclesia epiphytica A.C. Sm. y Senecio tephrosioides Turcz. Para la cima B (CIB, 3320 m) se registraron 51 especies, 25 familias y 1085 individuos, las especies más notables son Tillandsia aequatorialis, Disterigma empetrifolium (Kunth) Drude, Escallonia myrtilloides L. f., Cortaderia jubata (Lemoine) Stapf, Disterigma pentandrum S.F. Blake y Calamagrostis macrophylla. La cima C (CIC, 3400 m) presentó 59 especies con 29 familias y 1126 individuos, y las especies con mayor índice de valor de importancia fueron Escallonia myrtilloides, Neurolepis nana L.G. Clark, Cortaderia bifida Pilg., Chusquea neurophylla L.G. Clark, Rubus laegaardii Romol. y Tillandsia aequatorialis (Eguiguren et al. 2015).
Diseño de muestreo y recolección de datos
Se establecieron dos parcelas en cada punto cardinal de las cimas, dando un total de ocho parcelas por cada cima (P1 a P8). El muestreo fue realizado en las parcelas esquineras de cada punto cardinal de las tres cimas donde se registró la presencia y cobertura de briófitos. Para el muestreo se utilizó el método de la malla de 1 χ 1 m. La malla tiene un tamaño de 10 x 10 cm que corresponde al 1 % de la parcela total de muestreo, la malla se dividió en 100 celdillas que representan el 0,10 % de cobertura en relación a la superficie total de la parcela (Urgiles-Gómez et al. 2015). Las muestras fueron almacenadas en sobres de papel para su posterior identificación a cargo de especialistas tanto de la Pontificia Universidad Católica del Ecuador (PUCE) como de los autores de esta investigación. Para la identificación se utilizaron claves generales (Gradstein et al. 2001) y claves específicas de briófitos (Gradstein 2016, Gradstein y Benitez 2016). La metodología utilizada forma parte del protocolo de muestreo global GLORIA para flora vascular en ecosistemas alpinos y páramos (Pauli et al. 2004, 2015, Erschbamer et al. 2010, Cuesta et al. 2017, Vanneste et al. 2017). Además, se ha implementado en estudios de briófitos (Vittoz et al. 2010).
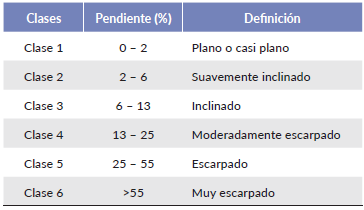
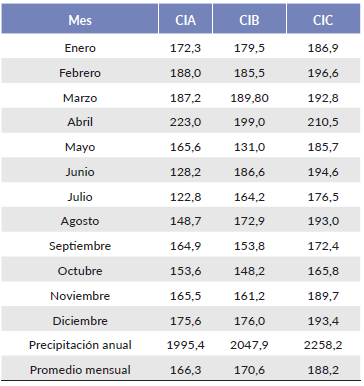
Los datos de temperatura y de precipitación fueron tomados de los 12 meses del año 2011. Los datos de precipitación se obtuvieron de pluviógrafos instalados en el punto cumbre de cada una de las tres cimas durante un año, con sensores HOBO (Onset Stowaway Tidbit) que registran datos de precipitación en intervalos de cinco minutos diarios (Tabla 1). La temperatura se registró por sensores (Onset Stowaway Tidbit) instalados en cada punto cardinal de las cimas (en total 12 sensores) con intervalos de una hora. La pendiente se midió utilizando un clinómetro en cada una de las direcciones cardinales de las cimas de la zona piloto y luego para su interpretación se utilizó una escala de clasificación en porcentaje (Tabla 2).
Tabla 1 Promedios mensual y anual de precipitación en cada una de las cimas en el año 2011. CIA = cima A, CIB = cima B, CIC = cima C.
Análisis de datos
La riqueza total en cada cima se comparó mediante curvas de acumulación de especies y el estimador de riqueza no paramétrico Chao 2, con el programa Estimates 9.1.0 (Colwell c2013). Se realizó un análisis de escalamiento multidimensional no métrico (NMDS) con los valores de cobertura de las especies a nivel de parcela con la finalidad de visualizar el grado de similitud de composición de especies entre las tres cimas, como medida de similitud se utilizó la distancia de Bray-Curtis (Anderson y Legendre 1999).
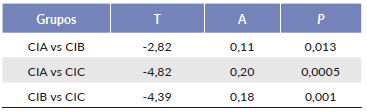
Para estudiar cambios en la composición de las comunidades en las diferentes cimas y su relación con los factores microclimáticos y topográficos se realizó un análisis de la varianza multivariado con base en permutaciones (PER-MANOVA, Anderson et al. 2008). Para probar las diferencias en la comunidad de briófitos entre las cimas, una matriz de 24 parcelas χ 28 especies fue sometida a una prueba no paramétrica de procedimiento de permutación de respuesta múltiple (MRPP). MRPP es un método utilizado para hacer comparaciones estadísticas a priori entre dos o más grupos. El estadístico A representa el grado de homogeneidad dentro de grupo en comparación a lo esperado por azar y la prueba T permite conocer si hay diferencias entre los grupos. Se utilizó la distancia Bray-Curtis para el MRPP con 1000 permutaciones (McCune et al. 2002).
Adicionalmente se realizó un análisis de especies indicadoras (AEI) de las comunidades de briófitos para cada cima. Este análisis está basado en la frecuencia y abundancia relativa de las especies (Dufrêne y Legendre 1997). El valor AEI igual a 100 significa que la especie fue registrada en todas las parcelas y 0 un patrón contrario. Los valores AEI fueron probados con el procedimiento de 1000 permutaciones de Monte Carlo, considerándose significativas las especies con un P < 0,05. Todos los análisis se realizaron con el programa R version 3.1.2 (R Core Development Team c2014) y el paquete estadístico vegan (Oksanen et al. 2013).
RESULTADOS
Se registró un total de 28 especies de briófitos clasificados dentro de 21 familias y 24 géneros, de los cuales 20 especies fueron hepáticas y ocho especies musgos. La CIC presentó un mayor número de especies (16), seguido de la CIA con quince especies y la CIB con catorce especies. Un patrón similar señaló la curva de acumulación (Fig. 2) y el estimador de riqueza Chao 2 con valores similares de riqueza estimada para las tres cimas con 16 ± 2,51 para la CIA, 14 ± 0,44 para CIB y 16 ± 0,06 para CIC. Ocho especies fueron exclusivas de la CIC, seguido de las CIA y CIB con cuatro especies cada una (Tabla 3).
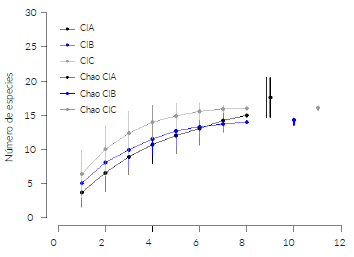
Figura 2 Curvas de acumulación y estimador de riqueza Chao 2 para cada una de las cimas (CIA = cima A, CIB = cima B, CIC = cima C).
Tabla 3 Especies de briófitos presentes en cada cima y valor de indicación según el análisis de especies indicadoras (AEI). CIA = cima A, CIB = cima B, CIC = cima C, P = nivel de significancia.
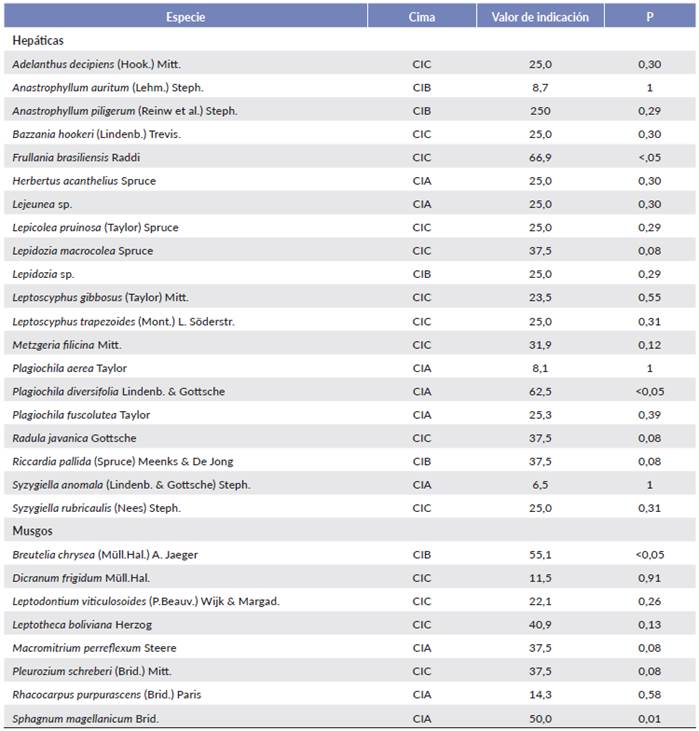
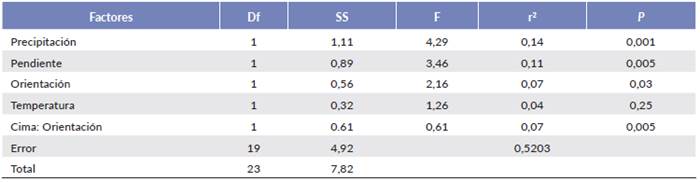
El NMDS señaló una separación entre las tres cimas con un estrés medio de 0,12 (Fig. 3). Las especies Bazzania hookeri (Lindenb.) Trevis., Lepidozia macrocolea Spruce, Lepicolea pruinosa (Taylor) Spruce, Leptoscyphus trapezoides (Mont.) L.Sõderstr., Pleurozium scherberi (Brid.) Mitt., Riccardia pallida (Spruce) Meenks & De Jong y Sphagnum magellanicum Brid., fueron asociadas con una mayor precipitación (CIC). Esto fue consistente con lo encontrado en el análisis multivariante (PERMANOVA) que señaló que las comunidades de briófitos variaron significativamente en relación con la precipitación y topografía (orientación y pendiente) que explicaron mayores cambios en las comunidades de briófitos, así como también la interacción entre cima y orientación (Tabla 4).
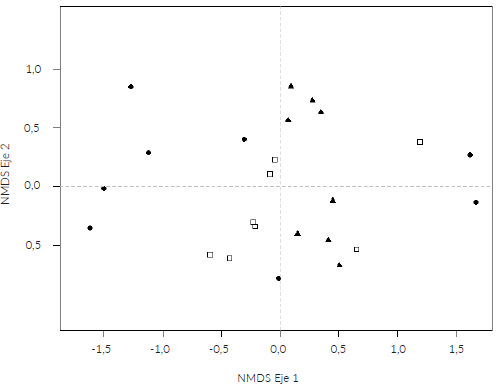
Figura 3 Análisis de escalamiento multidimensional no métrico (NMDS) de la composición de especies en las tres cimas. Cima A = círculos negros, cima B = cuadros blancos y cima C = triángulos negros.
Tabla 4 Resultados del PERMANOVA de la composición de especies a nivel de cuadrante y los factores ambientales y topográficos. Df = Grados de ibertad; SS = suma de cuadrados; F = estadísticos F; P = nivel de significación; r2 = coeficiente de variación.
El MRPP mostró diferencias significativas en la composición de especies entre las tres cimas (A = 0,20, P < 0,001). Adicionalmente, la comparación entre pares señaló diferencias significativas (Tabla 5). El análisis de especies indicadoras (AEI) señaló que Plagiochila diversifolia Lindenb. & Gottsche presentó un alto valor de indicación para la CIA, así mismo, Breutelia chrysea (Müll. Hal.) A. Jaeger y Sphagnum magellanicum para la CIB (Tabla 3).
DISCUSIÓN
Nuestros resultados indicaron que variables ambientales como la humedad y topográficas como la pendiente y orientación, condicionaron la composición de las comunidades de briófitos terrícolas en tres cimas del Páramo del Parque Nacional Podocarpus. Estos hallazgos concuerdan con algunos estudios donde documentan el efecto de estas variables sobre la diversidad de comunidades de briófitos terrícolas (Mandl et al. 2009, Sun et al. 2013, González et al. 2017).
Dentro de los briófitos, las hepáticas presentaron una mayor riqueza de especies (20) al compararlas con los musgos, con ocho especies. Este patrón concuerda con otros estudios (Mandl et al. 2009, González et al. 2017). Sin embargo, Cataño-D et al. (2014) registro un total de 54 especies en las turberas de Colombia con un mayor número de musgos (30 especies) al comprarlos con 24 especies de hepáticas. En este contexto, varios trabajos han documentado que las hepáticas están mejor representadas que los musgos en ambientes terrestres, debido a que están adaptadas a condiciones de mayor humedad (Gradstein et al. 2001, Mandl et al. 2009), los cuales están de acuerdo con los resultados de este estudio, debido a que las hepáticas, con 20 especies, están mejor representadas que los musgos con únicamente ocho especies. Así mismo en la cima C, con los valores más altos de precipitación, se registró la mayor riqueza total de hepáticas en comparación con las demás cimas.
La composición de especies de briófitos terrícolas estuvo limitada por la precipitación y la pendiente que dieron cuenta del mayor porcentaje de variabilidad en las comunidades con el 14 % y 11 % de varianza explicada. Similar a nuestras observaciones, otros estudios han documentado cambios en la composición de las comunidades de briófitos terrícolas en función de la precipitación y las variables topográficas como la pendiente (Mandl et al. 2009, Sun et al. 2013, González et al. 2017). Las CIB y CIC estuvieron caracterizados por géneros de hepáticas con altos requerimientos de humedad (Bazzania, Lepicolea, Plagiochila, Radula y Riccardia). Estas cimas presentaron los valores más altos de precipitación mensual y anual en comparación con la CIA donde estos géneros estuvieron menos representados. Siguiendo este patrón, Sun et al. (2013) documenta que la precipitación es un factor limitante en la composición de las comunidades de briófitos terrícolas, y que está relacionada con sus requerimientos altos de humedad (Cogoni et al. 2011).
Adicionalmente, la pendiente fue otro factor limitante de las comunidades de briófitos terrícolas. Garcia-Pichel y Belnap (2001) mencionan que la pendiente está correlacionada con la estabilidad del sustrato, radiación, temperatura y humedad del suelo. Bajo esta premisa, cambios topográficos en ambientes terrícolas relacionados con la micro-topografía, geología, características de suelo y cobertura de la vegetación, son factores limitantes para estos organismos (Mandl et al. 2009). En nuestro caso, la heterogeneidad del hábitat a pequeña escala, en factores como precipitación y pendiente, condicionan la composición de las comunidades de briófitos terrícolas, debido a que están relacionadas con cambios en la humedad, temperatura e irradiación. A pesar de ello, otros factores ambientales como altitud (Bruun et al. 2006, Ah-Peng et al. 2007) y edáficos como el pH, textura, humedad, materia orgánica, nitrógeno total y amonio presentes en el suelo se han identificado como factores limitantes de estas comunidades (Eldridge y Tozer 1997, Castillo-Monroy et al. 2016, Sun et al. 2017). Esta investigación constituyó un aporte importante en comprender la relación entre las comunidades de briófitos terrícolas y los factores ambientales (precipitación) y topográficos (pendiente) en las tres cimas del páramo del Parque Podocarpus.