INTRODUCCIÓN
Las sabanas representan aproximadamente el 20 % de la superficie continental del planeta; de las cuales el 45 % están en Suramérica con una extensión cercana a las 269 millones de hectáreas (Rippstein et al. 2001a). En Colombia existen 18 millones de ha de sabanas y el 94,4 % de ellas están en la Orinoquia (Rippstein et al. 2001a). De las sabanas colombianas orinocences, 4 320 000 ha son sabanas inundables localizadas principalmente en los departamentos de Arauca y Casanare (Etter 1997) en el Anfibioma Arauca-Casanare (Romero et al. 2004). El régimen anual de pluviosidad de la región genera dos períodos contrastantes, uno de sequía y otro de lluvias propiciando la inundación periódica y confiriéndole a las sabanas inundables una dinámica ecológica basada en el recurso hídrico (Rangel-Ch y Minorta-Cely 2014).
Las sabanas inundables son importantes desde el punto de vista económico por proveer forrajes para sustentar la ganadería extensiva, la cual ha sido tradicionalmente la mayor actividad productiva de la Orinoquia colombiana a pesar de sus bajos indiciadores de rentabilidad (Peñuela y Fernández 2010). Más recientemente, la expansión de la frontera agrícola con cultivos de arroz y palma africana, la explotación petrolífera y el consecuente incremento de asentamientos humanos han posicionado a la Orinoquia en primer plano como una región para la generación de ingresos económicos para el Estado colombiano (Rippstein et al. 2001a, Peñuela y Fernández 2010). Sin embargo, ese potencial económico podría acelerar la transformación y pérdida de hábitats que en general han sido precariamente documentados (Etter 1997, Camacho y Fandiño 2008, Giraldo-Cañas 2013). Esos factores en conjunto implican graves riesgos para la persistencia de la biodiversidad con probabilidades estimadas de deterioro irreversibles del 53 % y con tendencia al aumento (Bello et al. 2014, Portocarrero-Aya et al. 2014).
Acciones concretas internacionales que llaman a la cautela son la declaración de las sabanas de la cuenca del Orinoco como una de las ultimas áreas silvestres o regiones vírgenes del planeta (Rivas et al. 2002) y ser reconocidas por la World Wildlife Foundation como estratégicas para la humanidad (Correa et al. 2005) y un hotspot de biodiversidad (Rodríguez et al. 2009, Lasso et al. 2011). Paradójicamente, entre las unidades de conservación en Colombia las sabanas de la Orinoquia no se encuentran bien representadas, sólo con el Parque Nacional Natural (PNN) El Tuparro y los PNN Sierra de la Macarena y Tinigua (Chaves y Santamaría 2006, Vásquez-V y Serrano 2009), y más recientemente el Cinaruco, la nueva área protegida declarada Distrito Nacional de Manejo Integrado y algunas reservas privadas. Adicionalmente, la Orinoquia es una de las regiones de Colombia con más vacíos de datos biológicos y ecológicos (Bello et al. 2014) debido a múltiples causas como el orden público (Arbeláez-Cortés 2013), las precarias vías de acceso a potenciales sitios de estudio, la ausencia de instituciones locales académico-científicas capaces de realizar investigación sostenida y sistemática (Agudelo y Pérez-Buitrago 2015) y su aparente "simpleza" paisajística y estructural por la predominancia de sabanas. La ausencia de información acerca de la diversidad y la ecología de las sabanas de la Orinoquia hace necesario generar conocimiento que contribuya a entender su funcionamiento con el fin de propiciar su persistencia en el tiempo, su integridad funcional y su conservación.
El objetivo de este estudio fue documentar la dinámica ecológica de la composición florística asociada al régimen climático estacional de precipitación anual en las sabanas inundables del anfibioma de Arauca - Casanare.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se realizó en la Sede Orinoquia de la Universidad Nacional de Colombia (Hacienda El Cairo: 7°0'59" Norte, 70°44'40" Oeste) localizada a 9 km del municipio de Arauca (Arauca, Colombia). El campus universitario tiene una extensión de 50 ha de las cuales más del 75 % corresponden a sabana inundable. La altitud es de 127 m en terraza alta aluvial de río andinense del anfibioma Arauca - Casanare (Romero et al. 2004). La zona tiene una temperatura promedio anual de 25,9 °C (Minorta-Cely y Rangel-Ch 2014) y un régimen pluvial unimodal con un periodo de lluvias de siete meses entre abril y octubre en el que cae el 84,3 % del total de la precipitación anual y un periodo seco de cinco meses entre noviembre y marzo (Minorta-Cely y Rangel-Ch 2014). La precipitación promedio anual es de 1840 mm y mensual de 153 mm; durante el periodo de lluvias puede haber un nivel de inundación superior a los 10 cm (Minorta-Cely y Rangel-Ch 2014).
En el área de estudio se distinguen dos formaciones en la sabana inundable con diferencias en la microtopografía del terreno. Áreas de esteros (36,4 % del área total) en sitios arcillosos con depresiones y encharcamiento permanente por acumulación de aguas de escorrentía superficial durante el periodo de lluvias y bajos (63,6 %) en áreas menos encharcadas de suelo limoso (Sarmiento y Monasterio 1969).
Toma de datos
Para cuantificar la riqueza de especies y sus abundancias se emplearon dos métodos: a) el método de línea de intercepción (Canfield 1941) que consiste en registrar todas las intercepciones o proyecciones de las plantas como ramas, tallos, hojas y flores que hacen contacto directo con una cinta métrica que define el transecto; y b) el método de cuadrantes de 1 m2 divididos en 25 sub-cuadrantes de 20 x 20 cm (Mora 2000). Los dos métodos son complementarios en el sentido que los cuadrantes permiten cuantificar la cobertura y detectar taxones o individuos muy bajos o rasantes que no se detecta con el método de líneas de intercepción, además, son apropiados para estudiar vegetación densa dominada por arbustos y gramíneas (Mostacedo y Fredericksen 2000, Kercher et al. 2003).
Se establecieron once líneas de intercepción de 30 m cada una y once cuadrantes de 1 m2 en áreas de sabana inundable con bajos y esteros ocupados por cobertura vegetal nativa propia de estos ambientes. Tanto las líneas como los cuadrantes fueron delimitados con estacas para garantizar la ubicación exacta en muestreos consecutivos. Los cuadrantes se establecieron en puntos con preponderancia de vegetación herbácea. Se determinó como unidad de muestreo parejas de un cuadrante y una línea de intercepción ubicados espacialmente cerca. Siete de las unidades muestrales fueron ubicadas en la formación de bajo y cuatro en estero. Los seis monitoreos de vegetación se realizaron bimensualmente entre marzo de 2014 y marzo de 2015 para evaluar el recambio en la composición de especies relacionado con la estacionalidad de la zona. Los datos climáticos durante todo el estudio se obtuvieron mediante una estación meteorológica automatizada Vantage Pro2 (Davis Instruments Inc.) localizada en el sitio.
Caracterización florística. Se realizó la determinación preliminar en campo de las morfoespecies y posteriormente se determinaron taxonómicamente mediante claves, la comparación con ejemplares del Herbario Orinocense Colombiano (HORI) e imágenes de alta resolución de especímenes pertenecientes a otros herbarios (Herbario Amazónico Colombiano COAH, Herbario Nacional Colombiano COL, Herbario del New York Botanical Garden NYBG, entre otros). Se utilizó el sistema de clasificación para los órdenes y familias de plantas con flores The Angiosperm Phylogeny Group APG IV 2016 (Stevens c2017). En las especies con determinaciones taxonómicas tentativas el epíteto específico va precedido con un cf. después de su determinación. Se estableció una colección de referencia que reposa en el Herbario Orinocence (HORI) de la Sede Orinoquia de la Universidad Nacional de Colombia.
Caracterización estructural. Para estimar la representatividad del muestreo se calculó el estimador no paramétrico Jackniffe 1 el cual provee alta precisión para estimaciones de riqueza de especies en pastizales (Chazdon et al. 1998, González-Oreja et al. 2010). Se calculó el Índice de Valor de Importancia (IVI) (Curtis y McIntosh 1951) que indica la importancia ecológica relativa de cada especie en la comunidad y que corresponde a la sumatoria de los valores relativos de densidad, frecuencia y dominancia como indicadores de la abundancia, distribución y cobertura respectivamente (De Martino y Marín 1999, Soler et al. 2012). La densidad se calculó como el número de individuos por especie dividido entre el número de individuos totales. La frecuencia se determinó como el cociente entre el número de líneas o cuadrantes en los que aparece una especie y el total (once) de unidades muestrales (De Martino y Marín 1999). La dominancia para los cuadrantes se determinó usando el número de sub-cuadrantes ocupados por cada especie dividido entre el total de las cuadrantes; y para las líneas de intercepción se cuantificó como el cociente entre la suma de las interceptaciones en la línea de cada especie y el total obtenido para todas las especies. Para el censo de las gramíneas y ciperáceas las macollas distinguibles fueron consideradas como individuos independientes.
El IVI se calculó para cada especie en cada evento de mues-treo tabulando los datos por separado para cuadrantes y líneas para evaluar el recambio de especies a lo largo del tiempo. Para ilustrar la dinámica estacional, para algunas especies con variación amplia en el IVI a lo largo del año se realizaron gráficas por hábito de crecimiento (arbusto, hierba y gramíneas). Para visualizar la equitatividad se generaron curvas separadas de rango - abundancia (Smith y Smith 2007) para los periodos de lluvia y sequía y también para las especies en las comunidades de estero y bajo.
RESULTADOS
Se registraron 110 especies pertenecientes a 82 géneros y 42 familias. Tres especies pertenecen a los Pteridofitos, 107 angiospermas (una basal, 64 eudicotiledóneas y 42 monocotiledóneas) (Tabla 1). Las familias con mayor número de especies y géneros fueron Poaceae con (13 especies/13 géneros), Cyperaceae (15/5), Fabaceae (8/6) y Malvaceae (6/5) que correspondieron al 38,2 % de las especies encontradas. 22 de las familias registradas son monoespecíficas y monogenéricas. De acuerdo con el estimador Jacknife 1 el número esperado de especies fue 112 indicando que los muestreos fueron efectivos en documentar el 98,2 % de la riqueza de especies del área. El número promedio de especies en los seis muestreos fue de 49 (DS = 14, ámbito = 35 - 65) (Fig. 1). La mayor riqueza de especies se registró en el muestreo realizado en julio durante el periodo de lluvias con 65 especies, seguido por septiembre con 62, mientras que marzo y enero, en el periodo de sequía hubo valores mínimos de riqueza con 35 especies cada uno (Fig. 2a). Se registraron 53 especies exclusivas de los meses de lluvia y catorce especies de los meses de sequía. Las 43 especies restantes fueron detectadas durante todo el año (Tabla 1).
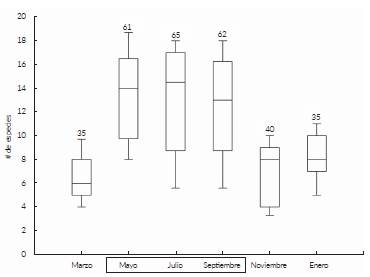
Figura 1 Variación en el número de especies de plantas vasculares por unidades de muestreo (i.e. un cuadrante y una línea) en las sabanas estacional-mente inundables de Arauca entre marzo de 2014 a marzo de 2015. Los números indican la cantidad total de especies registradas en cada periodo. El recuadro en el eje x representa el periodo de lluvias.
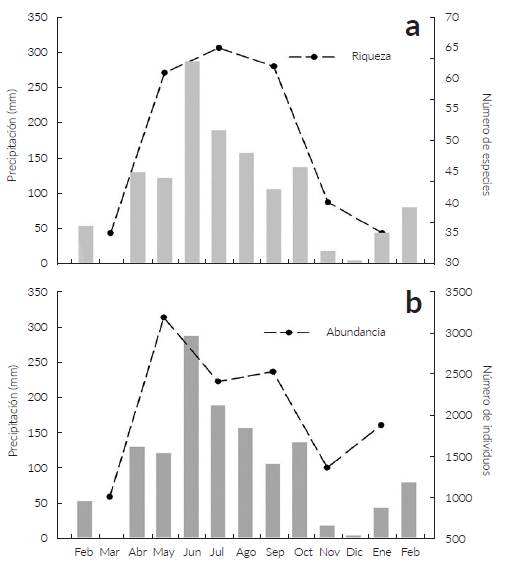
Figura 2 Relación entre la precipitación (barras) y la 'riqueza a y las abundancias b de especies vegetales 'registradas en muestreos bimensuales en la sabana Inundable del municipio de Arauca.
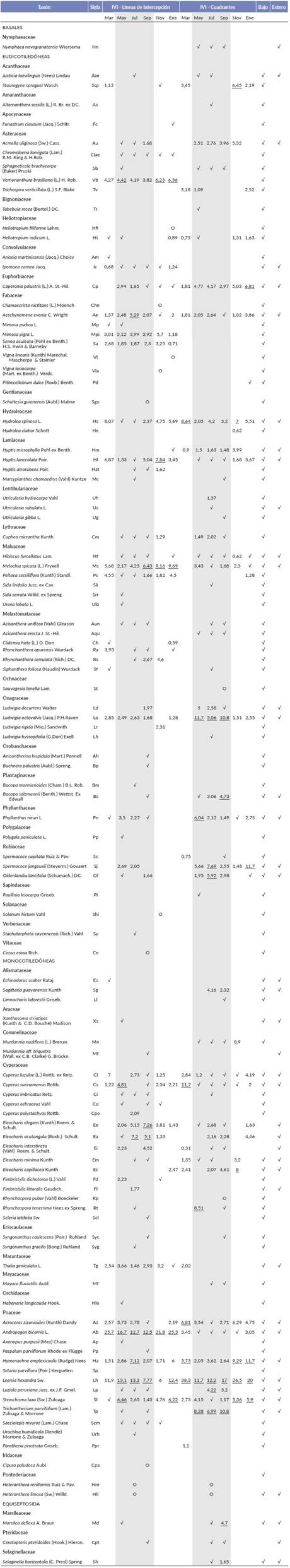
Tabla 1 Lista de especies registradas en la sabana inundable del municipio de Arauca haciendo distinción entre las dos técnicas de muestreo, líneas de intercepción y cuadrantes. Se relacionan numéricamente los Indices de Valor de Importancia (IVI) de las 20 especies con mayor valor en este parámetro en cada uno de los seis muestreos. Los cinco valores más altos de IVI aparecen subrayados y las especies con valores más bajos se representan con el símbolo ( ). Las columnas sombreadas corresponden al periodo de lluvias. El símbolo (O) indica las especies que fueron observadas de forma casual en el área de estudio, pero que no fueron detectadas con las técnicas de muestreo. En las columnas de la extrema derecha se indica la ocurrencia de las especies en el "bajo" o "estero".
). Las columnas sombreadas corresponden al periodo de lluvias. El símbolo (O) indica las especies que fueron observadas de forma casual en el área de estudio, pero que no fueron detectadas con las técnicas de muestreo. En las columnas de la extrema derecha se indica la ocurrencia de las especies en el "bajo" o "estero".
De los 12 403 registros realizados, las especies más abundantes fueron gramíneas como Leersia hexandra Sw. (24,1 %) y Trichanthecium parvifolium (Lam.) Zuloaga y Morrone (7,0 %); los arbustos Hydrolea spinosa L. (3,4 %) y Melochia spicata (L.) Fryxell (1,8 %) y las herbáceas Ludwigia octovalvis (Jacq.) P.H. Raven (5,5 %) y Spermacoce jangouxii (Steyerm.) Govaerts (5,2 %). Otras especies herbáceas comunes fueron Steinchisma laxa (Sw.) Zuloaga, Paspalum cf. parviflorum Rhode ex Flüggé, Eleocharis capillacea Kunth, Eleocharis elegans (Kunth) Roem. y Schult., Eleocharis interstincta (Vahl) Roem. y Schult., Cyperus luzulae (L.) Rottb. ex Retz. y Rhynchospora tenerrima Nees ex Spreng.
Se detectó una relación positiva entre la abundancia y la precipitación en los meses de muestreo (correlación de Spearman: rho = 0,83, P = 0,04, n = 6). Las mayores abundancias se registraron durante los muestreos de los meses de lluvias (abril-octubre) con 8136 (65,6 %) individuos. El muestreo de mayo (segundo mes de la época de lluvias) tuvo el valor máximo con 3193 (25,7 %) individuos, seguido por julio con 2416 (19,5 %) registros. La menor abundancia fue registrada en marzo (último mes de sequía) con 1009 (8,1 %) individuos (Fig. 2b).
La curva de rango-abundancia que compara la comunidad en el periodo de lluvias con el seco (Fig. 3a) evidencia una diversidad de plantas diferente, aunque en ambas comunidades L. hexandra fue la especie dominante. Además, la mayor horizontalidad en la representación de la comunidad en el periodo de lluvias denota una mayor equitatividad indicando que la composición de la comunidad es más homogénea con menos especies dominantes.
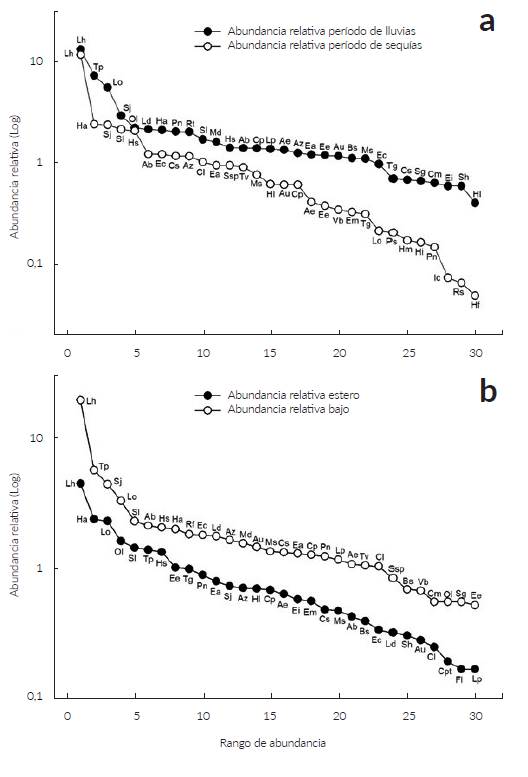
Figura 3 Curvas de rango-abundancia de las 30 especies con mayores IVI de la comunidad de plantas presentes en las sabanas estacionalmente inundables de Arauca en el periodo de lluvias y el de sequía a, y en el bajo y el estero b. Para las abreviaturas de las especies ver Tabla 1.
Respecto a la importancia ecológica de las especies los valores de IVIs por muestreo se exponen en Tabla 1 haciendo distinción entre los métodos de transectos y cuadrantes. En el periodo seco los mayores IVI fueron para las gramíneas L. hexandra, Andropogon bicornis L. e Hymenachne amplexicaulis (Rudge) Nees. En el periodo de lluvias, con un número mayor de especies presentes en la comunidad, las especies más abundantes y frecuentes registradas evidenciaron una disminución en el IVI respecto al periodo seco.
Algunos ejemplos de las especies de hierbas, gramíneas y arbustos con mayores variaciones en IVI y haciendo distinción por método de muestreo se muestran en la Fig. 4. Hierbas como Eleocharis cf. acutangula (Roxb.) Schult., E. interstincta, E. elegans y Phyllanthus niruri L. presentaron un aumento en el IVI en el periodo de lluvias, sin embargo, pocas especies como C. luzulae e Hyptis lanceo-lata Poir. tienen mayores IVI durante la sequía (Fig. 4a, 4b y 4e). Estas variaciones también se detectaron en especies de gramíneas como T. parvifolium la cual aumento el IVI en el periodo de lluvias. En contraste, gramíneas como A. bicornis, H. amplexicaulis, Acroceras zizanioides (Kunth) Dandy y S. laxum redujeron el IVI durante los meses de lluvia respecto a los IVIs el periodo seco (Fig. 4c y 4f). Los arbustos presentaron un patrón de aumento de IVI en el periodo seco y valores menores durante el periodo de lluvias como en el caso de H. spinosa yM. spicata (Fig. 4d).
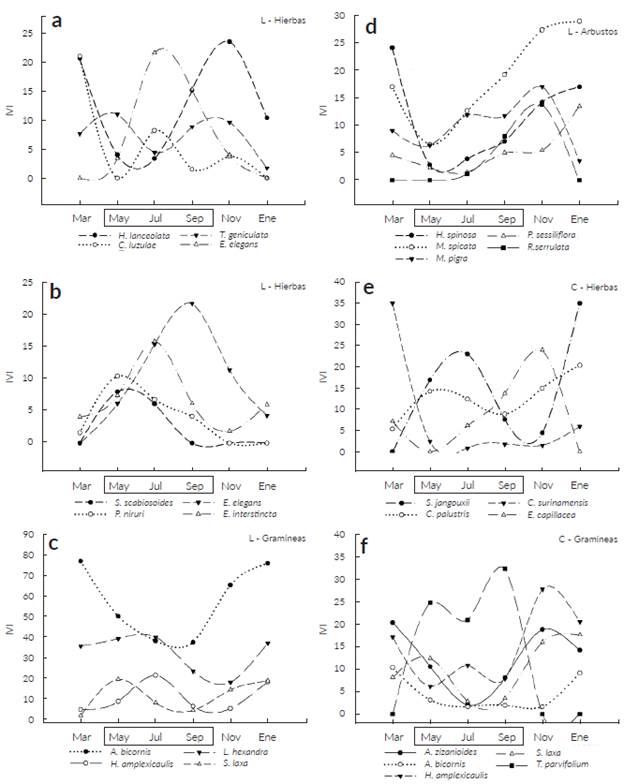
Figura 4 Especies de plantas presentes en las sabanas estacionalmente inundables de Arauca con fluctuaciones amplias en el Indice de Valor de Importancia (IVI) relacionadas con el ciclo estacional en muestreos realizados entre marzo de 2014 a marzo de 2015. a-d corresponden a especies registradas usando la metodología de líneas de intercepción (L), e-f corresponden a especies registradas con la metodología de cuadrantes (C). Se hace distinción de las especies por el hábito de crecimiento. El recuadro en el eje "x" representa los meses de lluvias.
En relación con la riqueza en el bajo y el estero se registraron 104 y 43 especies respectivamente. Las dos formaciones compartieron 37 especies mientras que 67 fueron exclusivas para el bajo y seis para el estero (Tabla 1). La mayor abundancia se registró en las siete unidades mues-traies del bajo donde se censaron 8797 (70,9 %) individuos respecto a las cuatro unidades muéstrales del estero que tuvo 3606 (29,1 %). La figura de rango abundancia del bajo y el estero sugiere que en ambos sitios la equitatividad es similar, siendo L. hexandra la especie dominante en ambas localidades (Fig. 3b). En el bajo las especies más abundantes fueron T. parvifolium, L. octovalvis, S. jangouxii y S. laxa; mientras que en el estero fueron H. amplexicaulis, L. octovalvis y O. lancifolia ( Fig. 3 y Fig. 5 respectivamente).
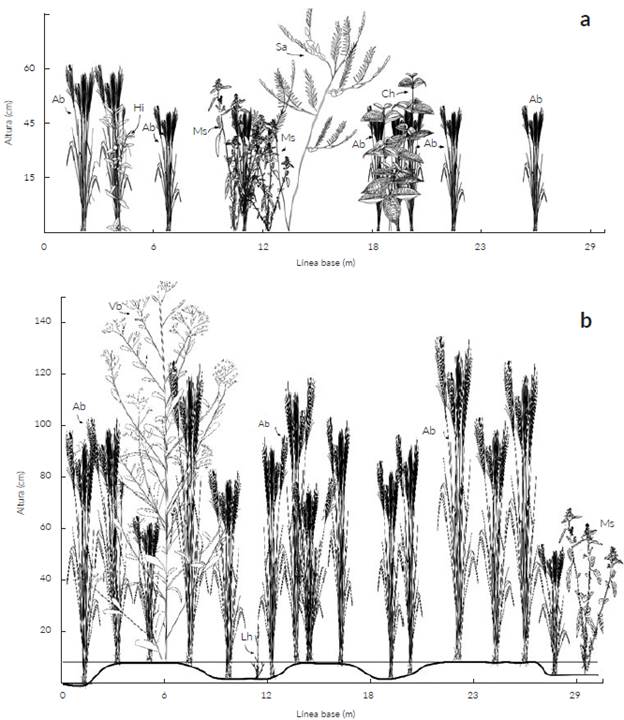
Figura 5 Perfiles fisionómicos mostrando la composición de plantas vasculares presentes en las sabanas estacionalmente inundables de Arauca. Vegetación para zona de bajo evaluada a través de línea de intercepción: a. periodo de sequía; b. periodo de lluvia. Ab = Andropogon bicornis, Ch = Clidemia hirta, Lh = Leersia hexandra, Ms = Melochia spicata, Sa = Senna aculeata, Vb = Vernonanthura brasiliana.
DISCUSIÓN
Las familias más abundantes en este estudio fueron Poaceae, Fabaceae y Cyperaceae y en la composición florística predominaron especies como L. hexandra, A. bicornis, S. laxa y Setaria parviflora (Poir.) Kerguélen similar a lo descrito por Blydenstein (1967) en sabanas inundables en los llanos de Colombia, Sarmiento et al. (1971) y San José et al. (1998) en los estados de Barinas y Apure en Venezuela, Rippstein et al. (2001b) en las sabanas del Carimagua (Meta), Díaz y Delascio-Chitty (2007) en Ciudad Bolívar en Venezuela, y Díaz-P (2009) en el bajo río Orinoco y Pinzón C. et al. (2017) en sabanas inundables del departamento de Arauca. L. hexandra es una de las especies que muestra mayor dominancia lo que refleja su alto nivel de adaptación a la variación estacional y los microrelieves que ocurren en el área. Esta especie ha sido considerada una de las gramíneas más frecuentes en sabanas del Estado de Apure (Ramia 1967).
Las 110 especies registradas superan las de otros estudios exceptuando a Rippstein et al. (2001b) quienes reportaron 183 especies en altillanuras del Carimagua (Meta) y Pinzón C. et al. (2017) que documentaron 363 especies en pastizales de la sabana inundable de los municipios de Arauca, Arauquita, Cravo Norte y Puerto Rondón (Arauca). En contraste, Baruch (2005) en Venezuela registró entre 53 y 85 especies en la Guayana y sabanas oligotróficas arenosas. Wilson et al. (2012) sugirió que las sabanas evaluadas a escalas espaciales entre 1 m2 y 49 m2 son los ecosistemas más diversos del planeta en riqueza de especies vegetales con valores entre 89 y 131 especies respectivamente. La riqueza de 110 especies en este estudio refleja una alta diversidad a pesar de la pequeña escala espacial considerada y corresponde a una diversidad intermedia respecto a lo reportado por Wilson et al. (2012). Dicha riqueza podría estar relacionada con el recambio de especies debido a la estacionalidad climática a lo largo del año y adicionalmente a que se estudiaron dos formaciones (estero y bajo) con variaciones microtopográficas (Figs. 5 y 6). En el estero, la microtopografía, el sustrato arcilloso que facilita la retención de agua y la mayor profundidad del horizonte orgánico permiten que haya disponibilidad de recursos para el crecimiento de las plantas gran parte del año (San José et al. 1998, Baruch 2005).
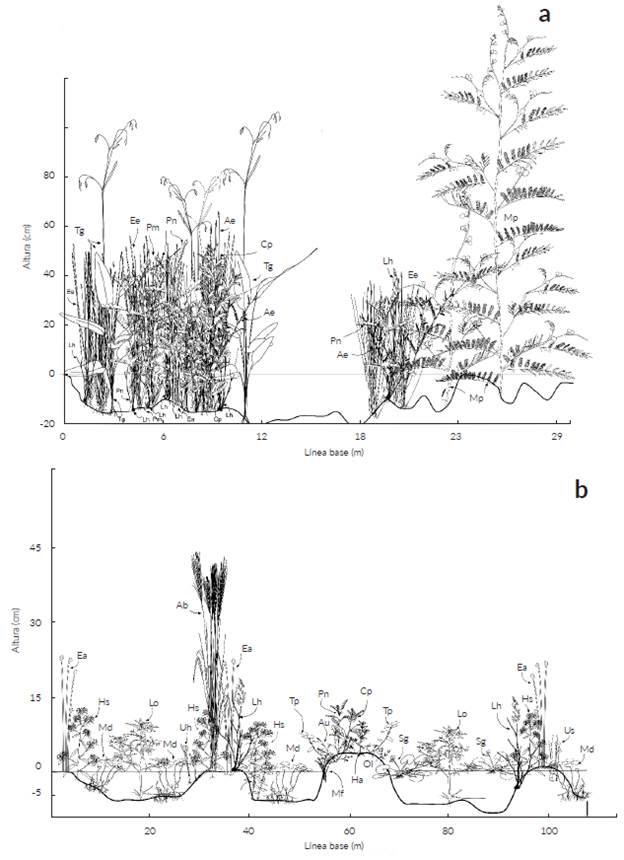
Figura 6 Perfiles fisionómicos mostrando la composición de plantas vasculares presentes en las sabanas estacionalmente inundables de Arauca. a. Vegetación para zona de estero durante época de lluvias evaluada a través de línea de intercepción; b. Vegetación para zona de estero durante época de lluvias evaluada a través de cuadrante. Ae = Aeschynomene evenia, Au = Acmella uliginosa, Ab = A. bicornis, Bs = Bacopa salzmannii, Cp = Caperonia palustris, Ea = Eleocharis cf. acutangula, Ee = E. cf. elegans, Hs = Hydrolea spinosa, Ha = Hyptis atrorubens, Lh = L. hexandra, Lo = Ludwigia octovalvis, Md = Marsilea deflexa, Mf = Mayaca fluviatilis, Mp = Mimosa pigra, Ol = Oldenlandia lancifolia, Pm = Phyllanthus microphyllus, Pn = P. niruri, Sg = Sagittaria guayanensis, Tg = Thalia geniculata, Tp = Trichanthecium parvifolium, Uh = Utricularia cf. hydrocarpa, Us = U. cf. subulata.
Para el régimen unimodal de lluvias de la Orinoquia se reconocen cuatro fases o ecofases del hidroperíodo: sequía, entrada de aguas, aguas altas, y bajada de aguas (Rial 2000). Sugerimos que la llegada de las lluvias en abril podría ser considerada como un "disturbio" que afecta anualmente a la comunidad vegetal dado que en el periodo de sequía solo ocurren especies especialistas capaces de tolerar la escasez del recurso hídrico. Las primeras lluvias en abril promueven la proliferación de especies que requieren una moderada disponibilidad de agua pero permite aun la existencia de especies propias del periodo seco. Posteriormente en julio, y con mayores niveles de inundación pueden ocurrir algunas especies propias de la sequía, especies tolerantes a niveles bajos de inundación y otras adaptadas a la inundación permanente. Este patrón que se evidencia en las mayores riqueza de especies en mayo y julio (Fig. 2a) se ajusta a la Hipótesis de Disturbio Intermedio (IDH) (Connell 1978) que predice que a frecuencias o intensidades intermedias de disturbio la diversidad es máxima (Fig. 2a).
Un mecanismo propuesto para este patrón incluye la reducción en la exclusión competitiva (Connell 1978, Premauer y Vargas 2004). En la comunidad vegetal estudiada las especies especialistas y adaptadas a sobrevivir durante la sequía excluyen a las demás especies, pero la llegada de las lluvias en abril (i.e. disturbio) propicia que el recurso hídrico deje de ser un limitante y nuevas especies reaparecen en la comunidad alcanzado el pico de riqueza durante la mitad de la época de lluvias en julio. Este ciclo anual se repite con la fase de disminución o bajada de aguas y posteriormente la llegada de la sequía. Otro mecanismo no excluyente alterno a la IDH plantea que en estadios tempranos posteriores a un disturbio se ocupan nichos que se mantenían desocupados antes de que el disturbio ocurriera (Roxburgh et al. 2004). En el área de estudio, y particularmente durante la sequía extrema, se observan en la microtopografia áreas amplias de terreno bajas de suelo sin vegetación y es en las zonas altas (i.e. terrazas) donde predominantemente persiste la vegetación en esta época del año. Con la llegada de las épocas de lluvias los espacios previamente desnudos son ocupados aumentando la cobertura vegetal y la riqueza con especies capaces de prosperar en condiciones de inundación.
Así, similar con lo descrito por Rial (2004) en estudios realizados en los Llanos del Estado de Apure, el ciclo anual de inundación y sequía y sus efectos, principalmente en el nivel del agua, promueve un rearreglo de la comunidad vegetal debido a la muerte de algunas especies y la reaparición de otras. Ese recambio de especies y rearreglo de la comunidad se observa en la variación en los IVIs de algunas especies de hierbas, gramíneas y arbustos (Fig. 4). La tendencia para las hierbas con la llegada de las lluvias es un aumento de IVI que persiste hasta septiembre. En general, entre mayo y septiembre (periodo de lluvias), la proliferación de múltiples especies de hierbas hace que las gramíneas reduzcan sus valores de IVI. Posteriormente cuando bajan las aguas, las gramíneas empiezan a aumentar sus valores de IVI y al llegar la sequía (noviembre) los arbustos y gramíneas presentan valores altos en el IVI que persisten durante la época seca dado que muchas especies de hierbas desaparecen, o se hacen muy poco frecuentes.
La variación en la composición florística por el régimen estacional también se evidenció en la mayor equitatividad de la comunidad en el periodo de lluvias debido a una mayor riqueza y abundancia de especies que hace que la comunidad sea más homogénea respecto al periodo de sequía. Esto se observa en las diferencias de cobertura en las dos temporadas; mientras que en el periodo de lluvias existe cobertura casi continua de vegetación, en los meses de sequía son frecuentes zonas de suelo desnudo y solo en zonas altas de la microtopografía se concentran hierbas y gramíneas. Esto concuerda con estudios previos que plantean que las condiciones de sequía reducen el número y la diversidad de especies presentes generando dominancia de especies tolerantes a la sequía (De Martino y Marín 1999, Rial 2000, House et al. 2003).
La equitatividad y la riqueza de especies de la comunidad de estero fue menor respecto a la del bajo, debido posiblemente a la mayor profundidad de la columna de agua en estero en época de lluvias que impide el establecimiento de especies poco adaptadas a condiciones de inundación, mientras que taxones como E. elegans, Thalia geniculata L. y H. amplexicaulis tolerantes a la inundación son frecuentes.
En conclusión, se documenta que la sabana inundable exhibe una alta riqueza de especies y una alta tasa de recambio de especies a lo largo del año asociado al régimen de lluvias de la región. Además de evidenciar esos atributos, se ratifica lo que ha sido detectado en otros estudios que resaltan las altas riquezas de especies que pueden ser encontradas en ecosistemas de sabana (Furley 1999, Wilson et al. 2012). Desde el punto de la conservación, y si se tiene en cuenta que en la Orinoquia existen más de 30 tipos de sabanas (Romero et al. 2004) es posible que existan muchas especies por documentar y aspectos ecológicos por comprender. Así, es importante el desarrollo de estudios adicionales en las sabanas de la cuenca del Orinoco que permitan generar estrategias de uso sustentable y planes de conservación que garanticen la persistencia en el tiempo y la integridad funcional de estos ecosistemas. Esto es imperativo debido a que por su aparente sencillez estructural y topográfica las sabanas son muy susceptibles a ser impactados por la expansión de la frontera agropecuaria y, en el caso de Colombia, para la explotación de recursos mineros y petrolíferos. Por último, una de las implicaciones de este estudio en métodos de muestreo de diversidad vegetal en sabanas es que los mismos deben ser ejecutados en el periodo de lluvias o la transición lluvias-sequia. Esto es importante en estudios de impacto ambiental, desarrollados como requisito para cambiar o modificar el uso del suelo, debido a que muestreos realizados en la época seca subestimarán la riqueza de especies y podrían propiciar decisiones erradas que acarrearían la pérdida de biodiversidad en ecosistemas de sabana en la Orinoquia.















