INTRODUCCIÓN
Los cangrejos del género Callinectes son conocidos en México como jaibas, se distribuyen ampliamente en el Golfo de México y la zona costera americana del océano Atlántico. Se han registrado desde los estados de Maine y Massachusetts en los Estados Unidos hasta las costas de Uruguay, incluyendo los archipiélagos de las Bermudas y las Antillas (Williams 2007); estos crustáceos son un recurso pesquero de alto valor económico, sobre todo en las pesquerías estuarinas de pequeña escala; en los estados costeros de Tamaulipas y Veracruz, México, se captura el 90 % de la biomasa, en particular de las especies Callinectes sapidus Rathbun, 1896 y Callinectes rathbunae Contreras, 1930 que sostienen la pesquería en ambos estados (SAGARPA c2013).
Las jaibas son capaces de colonizar diferentes hábitats acuáticos, tanto marinos, estuarinos y dulceacuícolas, tienen una fase estuarino dependiente durante su ciclo de vida, ya que después en condiciones marinas ocurre el desove, la eclosión y el crecimiento de las primeras fases larvales, luego los individuos en fase megalopa arriban a los estuarios transportados por las mareas y las jaibas jóvenes se distribuyen hacia sus hábitats críticos aprovechando las zonas de alimentación y refugio de los estuarios, para luego regresar al mar en etapa adulta (Gelpi et al. 2009).
Hasta ahora se han descrito parcialmente los procesos ecológicos de los estadios jóvenes de las jaibas en estuarios de boca abierta permanentemente al mar principalmente con información generada con artes de captura utilizadas en la pesca artesanal, esto contrasta con la escasa información generada de estuarios ciegos del Golfo de México, por lo que en esta contribución se describe la estructura por tallas, el crecimiento relativo y la proporción de sexos de los estadios juveniles de C. sapidus del estuario ciego Laguna El Llano, en el estado mexicano de Veracruz.
MATERIALES Y MÉTODOS
Área de estudio
El estuario Laguna El Llano (ELEL) se localiza entre 19°38' Norte a 19°40' Norte, y 96°23' Oeste a 96°24' Oeste, en el municipio de Actopan, Veracruz (Fig. 1). Es un cuerpo de agua de 226 ha, la profundidad en los márgenes internos es menor a 1 m, pero en el canal central alcanza un intervalo estacional de profundidad de 2 a 4 m.
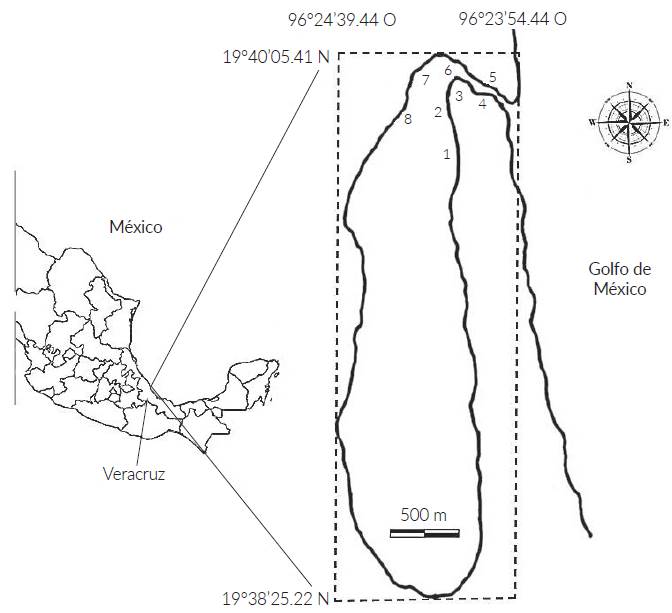
Figura 1 Ubicación del estuario Laguna El Llano (ELEL) municipio de Actopan, Veracruz, México. Los números dentro del estuario indican los ocho sitios de muestreo (SM1 - SM8) en los que se hicieron recolecciones desde mayo de 2013 a mayo de 2014.
El clima de la zona es cálido sub-húmedo con lluvias en verano (Aw2) (García 2004); la precipitación media anual alcanza 1286 mm, la temperatura media anual es de 24 °C; en esta región se presenta una temporada cálida que transcurre entre abril y junio, la temporada de lluvias que sucede entre julio y octubre, y una temporada fría del año o de "nortes" que sucede entre diciembre y marzo, cuando la temperatura ambiental disminuye a sus mínimos y prevalecen corrientes de vientos fríos boreales (Morán-Silva et al. 2005); ELEL es peculiar respecto a otros estuarios de esta región del Golfo de México, su geomorfología muestra un canal alargado que hace conexión con el mar mediante una boca estuarina como en otros estuarios, pero de noviembre a enero se forma una berma arenosa que lo aísla del océano.
Como otros estuarios ciegos, ELEL no se puede clasificar de acuerdo con definiciones tradicionales, por lo que aquí se usa la definición de Potter et al. (2010), que alude al cierre temporal de la boca estuarina y a la posibilidad que durante este evento se presenten condiciones de hipersalinidad.
Toma de datos
Los registros hidrológicos y las recolecciones de los organismos fueron realizados de mayo de 2013 a mayo de 2014; las capturas se realizaron en ocho sitios de muestreo (SM): Cuatro se ubicaron cercanos a riberas de mangle rojo Rhizophora mangle L. y de mangle negro Avicennia germinans L. caracterizadas por fondos lodosos y cercanos a arrecifes de ostión Crassostrea virginica, (Gmelin, 1791) (SM1-SM4); las otras cuatro se ubicaron en sedimentos arenosos (SM5-SM8) cercanas a la boca estuarina (Fig. 1); en mayo de 2013, los SM7 y SM8 se ubicaron sobre la barra arenosa que selló la boca estuarina.
El muestreo se restringió a profundidades menores de 1,2 m, no pudo extenderse hacia el canal central debido a la variación estacional de la profundidad de la columna de agua y a la profundidad (> 1 m) del horizonte limo-arcilloso del sustrato.
Los sitios de muestreo se ubicaron geográficamente con un GPS Garmin 10X GPS, en cada uno se registró el oxígeno disuelto (mg/L) y la temperatura del agua (°C) con un oxímetro Oakton DO 300 series con precisión de 0,1°C, la salinidad (UPS) con un refractómetro Vista A366ATC con precisión de 0,1 UPS, la turbidez con un turbidímetro La Motte 2020 (UNT) con precisión de 0,1 UNT, pH con un pHmetro Oakton pH 110 Meter con precisión de 0,1 unidad de pH, y la profundidad (cm) fue registrada con una sonda Echotest II Plastimo con precisión de 0,1 cm. Las categorías de salinidad se definieron con base a la propuesta del Sistema de Venecia (Ito 1959).
Las jaibas fueron recolectadas con una red tipo chinchorro de 25 m de longitud, por 2 m de alto y luz de malla de 1,5 cm, reforzada en el centro con una red para peces pequeños de 6 m de longitud, 2 m de alto y luz de malla de 0,65 cm; en cada SM se procuró una superficie de arrastre efectiva de 300 m2. Todos los especímenes se colocaron en hielo y se fijaron en etanol al 70 %, en el laboratorio se lavaron, se fijaron con formalina al 5 % y se almacenaron en etanol al 70 %.
Los organismos capturados presentaron una morfología similar a la de los organismos adultos lo que permitió identificarlos claramente con las claves de Williams (1984) y Carpenter (2002). Con la clasificación de estadios de maduración gonádica Costa y Negreiros-Fransozo (1998) adaptada a C. sapidus se reconocieron las etapas de desarrollo gonádico. A cada ejemplar se le midió el ancho de caparazón (AC) con un vernier a una precisión de 0,01 mm considerando la distancia entre el origen de las espinas laterales, también fueron pesadas (P) con una balanza electrónica Cole-Parmer Simmetry con precisión de 0,001 g.
Análisis estadístico
Los registros de las variables hidrológicas se promediaron mensualmente y se correlacionaron con los valores mensuales de abundancia y biomasa de las jaibas, usando el coeficiente de correlación de Pearson. Se estableció la estructura por tallas separando a los organismos en intervalos de 10 mm AC, las tallas se definieron usando el método de análisis de frecuencias de Pope et al. (2010).
El crecimiento relativo de las jaibas se evaluó con base en la relación biométrica AC vs. P, donde AC fue la variable independiente, esta relación biométrica se ajustó usando una función potencial (Y = aXb), donde a es la ordenada al origen (coeficiente de crecimiento inicial o factor de condición) y b es la pendiente (coeficiente de crecimiento o también llamado coeficiente de alometría), el valor de b aportó información valiosa sobre el crecimiento de las jaibas jóvenes, es isométrico cuando b = 3, es alométrico positivo cuando b > 3 y es alométrico negativo cuando b < 3 (Sokal y Rohlf 1995).
Los valores de AC y P se transformaron a logaritmos y el resultado de la relación lineal se ajustó con una regresión de mínimos cuadrados usando P como variable dependiente (Ricker 1975), el grado de asociación entre las variables se estableció mediante el coeficiente de determinación (r2). Se calcularon las relaciones AC-P para toda la muestra de jaibas y por cada sexo por separado.
Para probar la hipótesis de crecimiento isométrico se usó una prueba de t student Ho: b = 3 contra H1: b # 3 con n-1 grados de libertad y un nivel de significancia de P = 0,05. De la misma manera, para determinar si ocurrieron diferencias entre los valores de b de machos y hembras se probó Ho: bmachos - bhembras = 0, lo que indica diferencias entre las pendientes, contra H1: bmachos - bhembras # 0, que indica diferencias en el valor de b entre los grupos; además se usó una prueba de ANCOVA para comparar las diferencias entre las relaciones biométricas de AC vs P entre sexos.
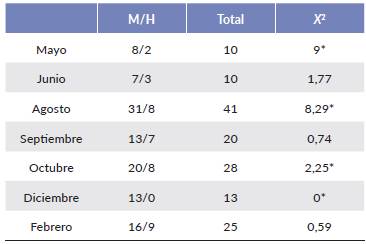
La proporción sexual se estimó mensualmente y se comparó estadísticamente con una prueba de chi-cuadrada. La prueba de Kruskal-Wallis se usó para comparar si las composiciones de la estructura por tallas mensual fueron similares. Todos los procedimientos estadísticos se calcularon con el programa PAST (Hammer et al. 2001) con un nivel de significancia de P = 0,05.
RESULTADOS
Con base en la tendencia mensual de los parámetros hidrológicos (Tabla 1), se identificaron cuatro etapas: la primera caracteriza el final de la temporada de boca estua-rina cerrada en mayo 2013, el aislamiento provocado por la presencia de la barra arenosa más la ausencia flujos de agua dulce y el inicio de la temporada cálida explican el aumento de la salinidad hasta 76 UPS, las aguas estuvieron bien oxigenadas y la turbidez se mantuvo en niveles bajos y el pH fue ligeramente alcalino.
Tabla 1 Valores promedio por muestreo (± desviación estándar), de las variables hidrológicas en el estuario Laguna El Llano, Veracruz, México, entre mayo de 2013 y mayo de 2014.
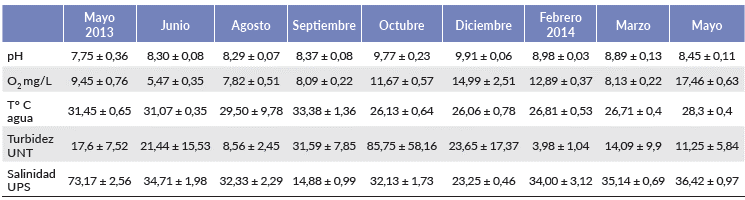
Para julio 2013 la boca estuarina se desintegró, entonces la salinidad del agua alcanzó un nivel euhalino con predominio de condiciones acuáticas marinas, la temperatura del agua aumentó por encima de 30 °C, con aguas bien oxigenadas y niveles bajos de turbidez, estas condiciones se mantuvieron en el estuario hasta agosto.
En septiembre, durante la temporada de lluvias, la salinidad se diluyó a nivel mesohalino (14 UPS), provocado por la intensidad de las lluvias y la ocurrencia de meteoros atmosféricos intensos (una tormenta tropical y un huracán), en este lapso se manifestaron las condiciones más estuarinas y también se registraron los mayores niveles de turbidez.
A partir de octubre se recuperó la dominancia marina, este mes marcó el final de la temporada de lluvias y el inicio de la temporada de nortes con episodios de vientos intensos entre diciembre de 2013 y enero de 2014, en ocasiones mayores a 120 km/h, acompañados de lluvias, la salinidad disminuyó a 21 UPS y la temperatura del agua descendió a un mínimo de 22 °C. La suma de estos eventos atmosféricos impidió que la boca estuarina se sellara, manteniéndose abierta parcialmente lo que permitió el intercambio mareal y que la salinidad fuese euhalina de enero a mayo; en este período se registraron los valores de turbidez y de oxígeno disuelto más altos.
En condiciones de boca estuarina cerrada se capturaron diez jaibas con coloraciones anaranjadas a rojizas, con movilidad lenta, al parecer poco saludables. En la playa y el agua se observaron numerosos organismos muertos; en los siguientes muestreos, se recolectaron 267 jaibas, todas con apariencia normal sin anomalías visibles; en febrero de 2014 se recolectó la mayor abundancia y biomasa; la biomasa total fue de 2085,8 g.
En SM 1-4 con vegetación de manglar y fondos lodosos se recolectó el 91,3 % de la abundancia total y 93,2 % de la biomasa total en contraste con SM 5-8, cercanas a la boca de comunicación que presentaban aguas claras, fondos arenosos y sin vegetación de manglar (Figs. 2 y 3).
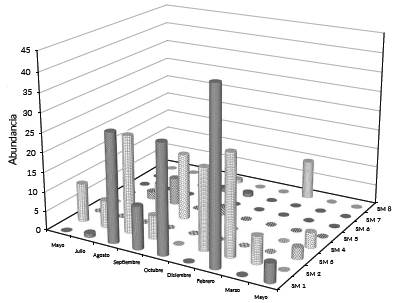
Figura 2 Abundancia por sitio de muestreo de las jaibas juveniles de Callinectes sapidus en estuario Laguna El Llano (ELEL) entre mayo de 2013 a mayo de 2014.
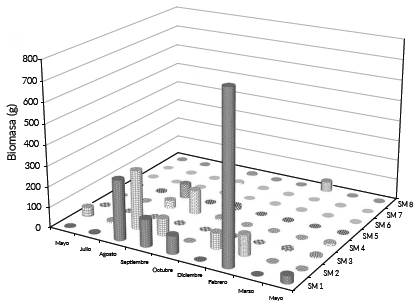
Figura 3 Biomasa por mes y por sitio de muestreo de las jaibas juveniles de Callinectes sapidus en estuario Laguna El Llano (ELEL) entre mayo de 2013 a mayo de 2014.
Las medidas de AC de los machos se registraron en un intervalo de 12 a 92 mm, en las hembras el intervalo fue de 9,0-92,08 mm; respecto al P de los machos, el intervalo fue de 0,3-156,2 g y el de las hembras de 0,7-152,6 g; se definieron cinco clases de talla, las más abundantes fueron las de 11-20 mm y 41-60 mm AC, estas dos clases sumaron el 76,44 % de la abundancia y fueron más numerosas en los meses de agosto de 2013 y febrero de 2014, solo estuvieron ausentes en diciembre de 2013 y mayo de 2014 (Fig. 4); en marzo de 2014 se colectó un único individuo en proceso de muda. Se observó una diferencia entre las composiciones de tallas mensuales (KW, H = 15,53 P < 0,05). La abundancia de C. sapidus no se correlacionó con las variaciones de las variables hidrológicas (P > 0,05).
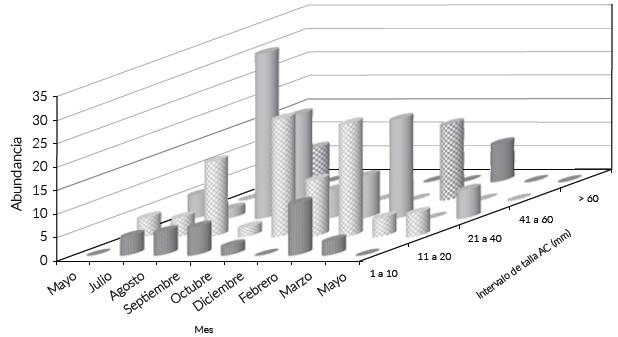
Fig. 4 Abundancia por clases de talla AC (mm), por muestreo de las jaibas jóvenes en el estuario Laguna El Llano (ELEL).
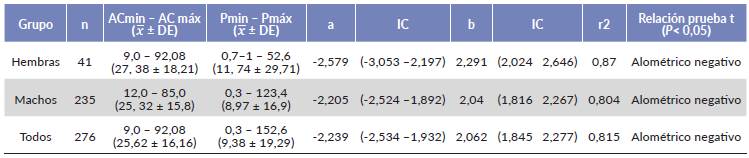
En la Tabla 2 se presentan los parámetros de los modelos de crecimiento relativo calculados para todos los individuos, de machos y hembras por separado de las jaibas jóvenes de ELEL; en los tres casos se obtuvieron coeficientes b que tendieron a la alometría negativa (t, P < 0,05), no existieron diferencias en el incremento de peso entre machos y hembras (ANCOVA, F = 0,1591, P > 0,05).
Tabla 2 Parámetros de la relación AC-P por sexo y para la muestra completa de jaibas juveniles Callinectes sapidus en el estuario Laguna El Llano. DE = desviación estándar, IC = intervalos de confianza, n = tamaño de la muestra.
La diferenciación del telson de las jaibas jóvenes se apreció en individuos mayores de 20 mm AC, la mayoría de los organismos de ambos géneros presentaron etapas de desarrollo gonádico rudimentario, solo se colectaron tres hembras y siete machos en etapas de desarrollo gonádico avanzado, estos individuos correspondieron a tallas mayores de 60 mm AC; en general la proporción sexual favoreció a los machos hasta un valor de 6:1, solo en los meses de junio y septiembre de 2013 se registró una proporción sexual 1:1 (Tabla 3).
DISCUSIÓN
En términos generales se reconoce que la función de los estuarios del Golfo de México está determinada por los procesos meteorológicos (Toledo 2005), pero Laguna El Llano como un estuario temporalmente sellado, demuestra que la dinámica de apertura/cierre de la boca de comunicación estuarina es otro factor ambiental clave en los cambios físico-químicos del agua y en las respuestas ambientales de los componentes estuarinos bentónicos (Whitfield et al. 2012).
En Laguna El Llano se identificaron cuatro fases hidrológicas: en la primera se presenta una boca estuarina cerrada e hipersalinidad mayor a 70 UPS, aguas claras, cálidas y bien oxigenadas, ésta concluyó en mayo de 2013; en la segunda fase se reinició la comunicación entre el estuario y el mar, entre julio y agosto predominaron condiciones marinas, las aguas estuvieron bien oxigenadas y la turbidez fue baja; esta tendencia se interrumpió en la tercera fase, que correspondió a la temporada de lluvias de septiembre y octubre, en ésta la salinidad descendió hasta 14 UPS, se presentaron aguas turbias y la menor concentración de oxígeno disuelto. Al inicio de la cuarta fase, hacia el fin de año, no se cerró la boca estuarina, se recuperaron las condiciones marinas y se registraron concentraciones poco usuales de oxígeno disuelto, sobre todo en los meses de "nortes" que se prolongaron hasta abril de 2014; la coincidencia de la realización de los muestreos bajo estas condiciones (vientos con velocidad de 50 a 70 km/h), indica una posible repercusión de los fenómenos meteorológicos en las propiedades del agua en plazos de tiempo cortos. Snow y Taljaard (2007) señalaron que, al ser someros, los estuarios ciegos están sometidos a una mezcla constante de sus aguas provocada por el viento que homogeniza la columna de agua y la sobresatura rápidamente de oxígeno. Por las variaciones hidrológicas registradas entre 2013 y 2014, la laguna El Llano se puede definir como un estuario parcialmente sellado, ya que a diferencia de otros años la boca estuarina permaneció abierta en la temporada de nortes.
El escenario hidrológico de boca estuarina cerrada en mayo de 2013, con aguas hipersalinas y temperaturas mayores a 30 °C, puede estar relacionado con la apariencia débil y la mortalidad masiva de jaibas observada en ese mes, Sharmila y Ravichandran (2012) han reportado que esta combinación de factores ambientales provoca que las tasas metabólicas de las jaibas disminuyan a un nivel que las hace más susceptibles a enfermedades generadas por bacterias y virus en periodos menores de 60 días; Brill et al. (2015) mencionan que la prevalencia de la infección del dinoflagelado parásito Hematodinium perezi Chatton y Poisson, 1931 aumentó en jaibas colectadas en condiciones de hipersalinidad en la costa norteamericana de Virginia.
Debido a la mortalidad masiva que se observó en mayo de 2013, cuando el estuario estaba sellado, se asume que el reclutamiento de las jaibas jóvenes hacia el estuario se rei-nició con la apertura de la boca de comunicación estuarina.
Los resultados estadísticos demuestran que ninguna de las variables hidrológicas se correlacionó con la abundancia de las jaibas jóvenes en ELEL, aunque se ha reportado que una temperatura del agua menor a 13 °C afecta el crecimiento y la sobrevivencia de estos crustáceos (Rugolo et al. 1998), en este caso cuando la boca estuarina estuvo abierta, la temperatura mínima en ELEL fue de 18 °C. Las variaciones de la salinidad parecieron no afectar la colonización de las jaibas, puesto que se registró su presencia en un intervalo de 14 a 36 UPS con un posible límite letal en condición de hipersalinidad dentro del estuario. C. sapidus se convierte en un fuerte osmoregulador desde que las larvas se asientan en el estuario e inician la etapa juvenil, lo que les permite ocupar los diferentes hábitats estuarinos con diferentes niveles de salinidad (Henry et al. 2012), esta notable capacidad fisiológica explica por qué en ELEL la ocurrencia y abundancia de las jaibas juveniles no se relacionó a la fluctuación de las variables hidrológicas registradas entre julio de 2013 y mayo de 2014, durante el período de boca estuarina abierta.
La abundancia mensual de las jaibas jóvenes en ELEL no mostró alguna tendencia, los números de organismos más altos ocurrieron en agosto y octubre de 2013 y febrero de 2014, se ha determinado que las abundancias más altas de jaibas juveniles para diferentes regiones del Golfo de México y la costa del Atlántico de los Estados Unidos, ocurren anualmente entre julio y noviembre (Rabalais et al. 1995, Rugolo et al. 1998, Spitzer et al. 2003, Ralph et al. 2013).
Las jaibas jóvenes fueron notoriamente más abundantes en los SM ubicados en aguas de mayor turbidez cercanas a los manglares y sobre sedimento lodoso respecto a los sitios de aguas claras y fondos arenosos más cercanos a la boca de comunicación, Ralph et al. (2013) encontraron la misma tendencia en la bahía de Chesapeake; Moksnes y Heck (2006) afirman que una vez que concluye el asentamiento de las formas larvales, las jaibas jóvenes logran mayor movilidad y seleccionan su hábitat cuando están en tallas menores a 20 mm de AC, ocupando hábitats estructuralmente complejos, con vegetación acuática sumergida como lechos de pastos y pantanos, que pueden concentrar hasta un 90 % de la abundancia (Pardieck et al. 1999, Spitzer et al. 2003); Zimmerman et al. (2000) mencionan que estetipode hábitatsson lossitiosde crianza principales de C. sapidus porque ofrecen mayor protección contra depredadores, comparados con sitios desprovistos de vegetación.
Pero en ELEL la ausencia de vegetación acuática sumergida combinada con períodos de condiciones marinas prolongadas favoreció el uso de hábitats con aguas turbias, sedimentos lodosos y cercanos al manglar, esto también ha sido reportado por autores como Zimmerman y Minello (1984), Zimmerman et al. (2000) y Shervette et al. (2011) para otras localidades del Golfo de México.
Los organismos de las tallas entre 11-40 mm AC fueron los más abundantes a lo largo del estudio, principalmente entre los meses de agosto de 2013 y febrero de 2014. Los registros frecuentes de individuos menores a 10 mm AC en las muestras también permiten inferir la ocurrencia de un reclutamiento continuo de jaibas jóvenes al estuario; este hecho se ha relacionado con la abundancia de larvas me-galopas en la plataforma continental, Perry et al. (1998) reportaron que en estuarios de Mississippi, después de capturas masivas de megalopas de C. sapidus entre agosto y septiembre, sucedieron capturas numerosas de cangrejos en talla de 10-19,9 mm AC en septiembre y octubre; por otro lado, la baja abundancia de jaibas colectadas de más de 60 mm AC (diez organismos), parece un hecho común en la estructura por tallas de las jaibas en los estuarios.
Perry et al. (1998) encontraron una disminución sustancial entre la abundancia de las tallas de 10 a 30 mm de AC al examinar la relación de la abundancia entre los primeros y últimos estadios juveniles de C. sapidus en Mississippi, pero la abundancia de las tallas más grandes no presentó diferencias significativas; esta tendencia se comprobó en experimentos en condiciones de cultivo en la bahía de Chesapeake, los que indicaron que la sobrevivencia de las jaibas jóvenes es una función de la talla de los organismos y el hábitat (Hines 2007). La sobrevivencia de los juveniles es mayor en hábitats con vegetación sumergida que en sitios desprovistos (Pile et al. 1996), en contraste los individuos de tallas mayores a 50 mm AC presentan abundancias similares en ambos hábitats (Lipcius et al. 2005).
De manera general, es necesario considerar dos factores que se relacionan con estas diferencias: primero, que las jaibas son consumidas localmente aún en tallas pequeñas, los cangrejos son usados como un recurso alimenticio de subsistencia, lo que causa una extracción selectiva de las jaibas por parte de los pescadores en ELEL. El segundo factor, es la depredación por aves y peces; se encontraron larvas megalopas y jaibas jóvenes de tallas pequeñas en los contenidos alimenticios de especies de peces como Centro-pomus ensiferus Poey, 1860, Lutjanus griseus (Linnaeus, 1758), Lutjanus synagris (Linnaeus, 1758), Eucinostomus melanopterus (Bleeker, 1863) y Gobiomorus dormitor Lacepède, 1800, en los meses de mayor abundancia de jaibas jóvenes en ELEL. También se observó canibalismo por las jaibas de tallas mayores (Chávez-L datos no publ.), este hecho también se ha reportado en jaibas de Mississippi (Guillory y Prejean 2001).
Mosknes et al. (1997) indicaron que la sobrevivencia de los estadios juveniles de jaibas en los estuarios es el resultado de la combinación de una selección apropiada del hábitat como defensa contra depredadores, esta selección ocurre en el cuarto estadio de crecimiento y después de la cópula (Barutot et al. 2001), cuando las hembras se desplazan a la plataforma marina para el desove, en tanto los machos se dirigen a zonas de menor salinidad (Aguilar et al. 2005). Este argumento contribuye a explicar la diferencia que se observó en las proporciones sexuales que fueron dominadas por los machos jóvenes en ELEL, tal como se ha reportado en el sistema lagunar de Alvarado (Loran et al. 1993), para la laguna de Celestún, Yucatán (Rosas-Correa y Jesús-Navarrete 2008) y para la bahía de Chetumal en Quintana Roo (Celis-Sánchez et al. 2014), esta similitud llama la atención debido a que en este estudio la información que se presenta se refiere a organismos en etapa juvenil, mientras que la información de los reportes citados proceden de capturas comerciales de individuos de tallas mayores a 130 mm, en donde no se descarta el efecto de las artes de pesca empleadas y las diferencias ambientales de los hábitats de las jaibas adultas en relación al sexo.
En las relaciones AC-P no hubo diferencia entre machos y hembras; para ambos sexos el crecimiento fue de tipo alométrico negativo, esta similitud parece que se pierde cuando las jaibas son adultas, Olmi y Bishop (1983) reportaron que los machos adultos tienden a ser más pesados que las hembras adultas, excepto cuando estas se encuentran en etapa ovígera y se desplazan de los estuarios a la plataforma continental a desovar (Epifanio 1995).
En este trabajo se describe que después de un periodo de boca estuarina cerrada, ocurrió el reclutamiento de jaibas jóvenes a ELEL procedentes de la plataforma marina, aportando información sobre individuos de tallas menores a 100 mm AC raramente obtenidos mediante actividades pesqueras. Se destaca que en la fase cerrada del estuario el agua alcanzó un nivel de hipersalinidad que superó 70 UPS que pudo causar una mortalidad masiva de las jaibas en mayo de 2013 y posterior a este episodio, la apertura de la boca estuarina permitió el arribo y la colonización de las jaibas jóvenes, principalmente en las áreas bordeadas por vegetación de manglar y sedimentos de textura fina respecto a las zonas desprovistas de vegetación. El crecimiento de las jaibas jóvenes la tendencia que se presento fue alométrico negativo sin considerar el sexo; los machos predominaron en comparación con las hembras en el periodo de estudio, de acuerdo con los resultados de este trabajo estas evidencias reafirman la función ecológica de este estuario como zona de crianza y protección para los estadios juveniles de C. sapidus.